Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Floem Elek Elements Elektrik Sinyallerini Edinme ve Ölçüm Elektrik Penetrasyon Grafik (EPG) Yeni Bir Uygulama
Bu Makalede
Özet
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
Özet
Hücrelerin Elektrofizyolojik özellikleri genellikle kendi ana ortamlarda onları dissociating sonra, in vitro incelenmiştir. Bununla birlikte, bir organizmada uzak hücreler arasındaki elektrik iletim çalışma, in vivo olarak ana ortam içinde gömülü hücrelerin artifakt kayıtları gerektirir. Bir bitki Yaralanmamış alanlara yaralı elektrik sinyallerinin iletimi çoktandır botanikçiler ilgi kırılmak olmuştur. Floem, bitki boyunca yayılır bitki damar oturma bölümü, bitkilerde, elektrik iletimi açısından önemli bir doku olarak öne sürülmüştür. Uygun elektrofizyolojik yöntemler eksikliği in vivo floem hücrelerinin elektriksel özelliklerinin incelenmesi için birçok zorluklar teşkil etmektedir. Burada elektrik penetrasyon gra entegre yaşayan yaprak bitleri, ya da diğer floem besleme hemipteran böcekleri kullanan elek elemanlarının hücre içi elektrofizyoloji (SE), için yeni bir yaklaşım sunmakph (EPG) devresi. Bu yöntemin çok yönlülük, sağlamlık ve doğruluk mümkün kaydetmek ve model bitki Arabidopsis thaliana 1 santral venlerin SE ayrıntılı olarak yara kaynaklı elektrik sinyalleri incelemek için yaptı. Burada EPG-elektrotlar kolayca marjinal damarlarında SE hücre içi elektrofizyolojik kayıtlar için uygulanabilir, yanı sıra çok sayıda dış uyaranlara elektrik sinyallerinin ile yanıt SE kapasitesini incelemek için olduğunu göstermektedir. SE hücre içi elektrofizyoloji uygulanan EPG yaklaşım, bitki / böcek kombinasyonları çok sayıda, bitki türlerinin geniş bir çeşitliliği için uygulanan ve bir çok araştırma amaçları için olabilir.
Giriş
uzun mesafeli elektrik sinyallerini üretme yeteneği dış uyaranlara verimli yanıtlar sağlayan çok hücreli organizmaların avantajlı bir özelliktir. Bu özellik bitki ve hayvan bağımsız gelişti ve böylece yakınsak evrim olgusunu temsil etti. Yoğun araştırma konusu elektrik sinyalleri bu tür hayvanlarda uyarıcı indüklenmiş elektrik sinyallerinin sinir iletiminin ve kas kasılması, molekül olarak, iletim mekanizması ve fonksiyonu olarak hayvanlarda önemli fonksiyonları ile birlikte olduğunu olan göz önüne alındığında. Bunun aksine, bitkilerde uyarıcı indüklenmiş elektrik sinyal çok az araştırma konusu olmuştur. Bitkiler hiçbir sinir veya kas olmasına rağmen, bitkiler çevresel faktörlere verdikleri yanıtlara önemli bir rol oynar bu uyarıcı kaynaklı elektrik sinyalleri varsaymak için yeterli delil var gibi görünüyor.
floem, bitki damar yaşayan bileşeni, önemli bir alt olarak ileri sürülmüştüruyarıcı indüklenmiş elektrik sinyallerinin iletimi için bağlamında sadece, uyarılan / uyarılmamış / hasarsız alanlara 2 hasar. floem ana hücreler elek elemanları (SE), nispeten basit, uzun hücrelerdir. SE uçları bitki yayılmış sürekli bir düşük direnç, elek tüp sistemi oluşturan diğer SE bağlanır. Bu çok özel hücrelerinin elektriksel özellikleri üzerinde çok az çalışma Bununla birlikte, var. Bu önceki çalışmalarda, araştırmacılar ile SES erişilen ya cam mikro elektrotlar stylectomy (kesme) sonra yaprak biti 3 veya birleştirildi cam elektrotlar ile bitki eklenen stilelerin 4. Cam Mikroelektronlar çapı en az 1 um ince bir ucu içine ısı ile bir ucunda çekilmiş, ve daha sonra bir KCl çözeltisiyle doldurulmuştur cam kılcal yapılır. KCl dolu cam elektrot içine yerleştirilen Ag / AgCl veya platin tel, sonra amplifikatör girişine bağlı ve bir Referent olduğunuElektrot devreyi tamamlayan, ilgi konusu bir hücreyi çevreleyen banyosuna yerleştirilir. Bu kurulum dışı referent elektrot ve hücre içi ölçüm elektrotu, yani hücrenin 5 membran potansiyeli arasındaki potansiyel farkı kaydeder. Bu yöntem ile, Umrath yosun Nitella 6,7 kullanarak, bir bitki hücresi ile ilgili ilk hücre içi kayıt yaptı. Nitella nispeten basit bir büyük hücreler ile organizma ve hücre içi elektrofizyolojik deneyler bu nedenle elverişlidir. Buna karşılık, çok hücreli, üç boyutlu karasal bitkilerin küçük hücrelerine içi cam elektrotlar ekleme, teknik açıdan zor olan bir çok yetenekli bir araştırmacı, hem de sofistike görselleştirme, mikromanipülasyon ve titreşim önleyici ekipman gerektirir. Cam elektrotlar gibi kök epidermal hücreler 8 olarak bitkilerde yüzeysel hücre, kayıt için uygun olmasına rağmen, hücre içi recordinhücrelerden gs derinden sonuçları kafa karıştırıcı gibi SE, çok büyük olasılıkla hasara neden kaynaklı tepkiler olarak tesisin dokusunda, gömülü. 1989 yılında, Fromm ve Eschrich, alternatif bir yöntem kullanılması bildirdi cam elektrotlar stylectomy 4 sonra yaprak biti stilet bağlanmış edildiği 'yaprak biti yöntemi' olarak adlandırılan. Cam elektrotlar gibi esnek stilelerin doku ya da hücre hasarına neden yok çünkü yaprak biti yöntemi, minimal invaziv olduğunu. Afit stilelerin bitki penetrasyonu için doğanın harika buluş, ve yaprak bitleri ölçüde SES bulmakta insanlardan daha yetenekli. Ne yazık ki, bu yaprak biti yöntemi de teknik uzmanlık ve ekipman açısından son derece zorlu olduğunu. Stylectomy zamanında, kararlı bir şekilde bir SE yerleştirilen bir stile ile - Buna ek olarak, bu teknik uygular Her bir deney başarısı besleme modunda olmak yaprak biti ile tamamen bağlıdır. Retrospektif Düşünme, kimse bu tekniğin başarı oran i olabilirdi görebilirsinizdeney kurulumu stylectomy uygulanırken biti stile SE olup olmadığını tanımlayan izin veren bir araç ekleyerek mproved.
1964 yılında, McLean ve Kinsey gerçek zamanlı 9,10 yaprak biti beslenme davranışının çalışması için bir 'elektronik izleme sistemi' nitelendirdi. Bu sistemde, yaprak biti ve stile-nüfuz bitki bir elektrik devresi içine entegre edilmiştir. Daha sonra, 1978 yılında, Tjallingii, sistemin değiştirilmiş bir sürümü geliştirdi 'Elektrik Penetrasyon Grafik' (EPG) sistemi 11,12 çağırdı. Orijinal elektronik izleme sistemi direnci kaynaklı potansiyellerine duyarlı Oysa sadece EPG sistemi ile, elektromotor kuvveti (emk) potansiyelleri, yani bitki ya da böcek oluşturulan kaynaklanan potansiyelleri ek olarak kaydedilmiş olabilir kökenli böcek direnç (R). Bu, önemli bir gelişmeyi temsil hem sinyal bileşenleri, emf ve Ar çünkü,yaprak bitleri bitki penetrasyonu sırasında olaylarla ilgili biyolojik ilgili bilgi sağlar. Ne R-bileşenlere EPG pre-amplifikatör duyarlı hale bitki / yaprak biti direnç ortalamasına yakın 1 GΩ, onun nispeten düşük giriş direncidir. Küçük bir ofset voltajı (Şekil 1, V) yaklaşık 100 mV daha sonra bir tarafında bitki ve böcek arasında bölünmüştür bitki, ve diğer taraftan da giriş direnci uygulanır. gerilimleri ve bunların değişiklikleri böcek ve giriş direnci arasındaki bir noktaya (Şekil 1A, B) ölçülür. Emk bileşenler böcek neden olduğu bitki stile ucunda potansiyelleri ve potansiyellerinin belirli bir fraksiyonu iken Bu nedenle, R bileşenler, ofset gerilimi bitki yaprak biti direnci modülasyonu temsil etmektedir. Bitki potansiyelleri - burada en uygun - yaprak biti stilet tarafından delinmiş bitki hücrelerinin özellikle zar potansiyelleri vardır. Böcek potansiyeller ağırlıklı olduğu görülmektedirİki stile kanallar içinde sıvı hareketlerinin neden olduğu akış potansiyelleri, yani gıda ve tükürük kanalları; hiçbir iç sinir veya kas potansiyelleri EPG kaydedilir. Uygulamada, bir elektrot ucu olarak stile ucu çalışır. Tüm bitki hücreleri olumsuz hücrenin pozitif dış akrabası içinde tahsil edilir. elektrik akımı (yani, sulu çözelti içinde yüklü iyonların hareketi) dış ve tersi içeriden akan çok nedeniyle hücre zarının yüksek direnç ile sınırlıdır. Normal olarak dinlenme potansiyeli sabit tutulur. Negatif iyon taşımak veya pozitif iyonları hücre zarından hareket Ancak, zar potansiyeli, bu depolarize ', yani azalır. Depolarizasyon hücre uyarma durumunda ortaya çıkar. Membran zarar ve iyonlar ve dışarı sızıntı olduğunda zarında spesifik iyon kanalları açılır veya zaman iyonlar sonra veya taşınmak. Tüm hücreler t iyon kanalları ve pompa varo hücrenin içinde çeşitli iyonların orijinal konsantrasyonunu restore ederek dinlenme seviyesine zar potansiyelini getirmek membran plazma. dinlenme potansiyeli ve değişiklikler emf bileşenleridir ve bu nedenle, EPG tekniği onları ölçmek için uygundur.
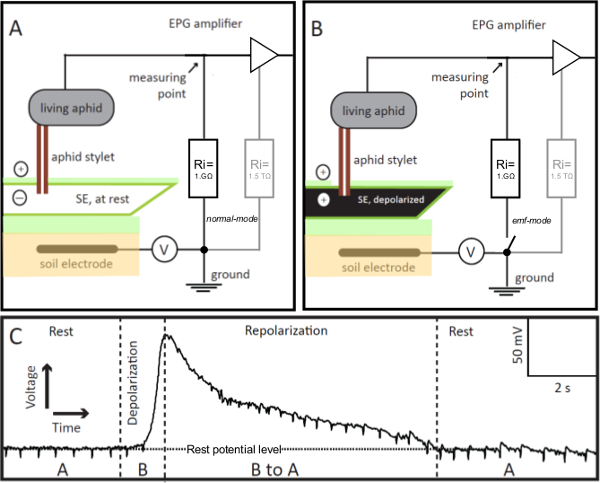
1. EPG-elektrotlar Şekil. EPG-elektrot olan keski istikrarlı besleme modunda bir elek elemanı (SE) sokulur Elektrik Penetrasyon Grafik (EPG) devre, entegre bir yaşam yaprak biti olduğunu. Stile-kazığa SE geri kalanı (Panel A) ise, EPG tarafından kaydedilen devrede, gerilim, istikrarlı ve dinlenme potansiyeli düzeyde (Panel C, Rest) yer almaktadır. SE heyecanlı ise, gerilim kademeli bir artış (panel C, Depolarizasyon) olarak EPG görüntülenmiştir onun zar depolarize (panel B). SE iyonik denge yani, repolar, dinlenmek için döner gibiizes, EPG tarafından kaydedilen gerilim giderek kalan potansiyel düzeyine (Panel C, repolarizasyon) azalır. Panel C, "A" ve "B", sırasıyla Panel A ve B, gösterilen senaryolar bakın. V = Ayarlanabilir ofset gerilim kaynağı. Ri = Giriş direnci. 1 GΩ dış direnç paralel olarak, amplifikatör (gri, paneller A ve B) yüksek 1.5 TΩ direnci (opamp olarak) bir iç vardır. Anahtarın uzaktan kumanda ile EPG pre-amp son derece hassas voltaj değerlerini elde edilmesine izin verir, modu emf normal değiştirilebilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Bir sonraki bölümde, biz de odaklanmış-böcek ve bitki odaklı çalışmalar için geçerlidir EPG deneyler için temel protokol ile okuyucuya sunmak.
Protokol
1. Yaprak biti Yetiştirme
Not: EPG kayıtları için bitki ve yaprak biti türlerinin seçimi Araştırma amacına bağlıdır. Arabidopsis thaliana çalışmaları için, yaprak biti Brevicoryne brassicae uygundur.
- Arka B. Brassica oleracea bir serada brassicae yaprak bitleri. Diğer bitkiler kirletmesini önlemek amacıyla, kafeslerde yaprak biti yetiştirme için kullanılan bitkiler tutun. Yaprak bitleri ile deneysel bitkilerin kirlenmesini önlemek amacıyla, yaprak biti yetiştirme tesisleri ve ayrı odalarda (bizim durumumuzda B. oleracea ve A. thaliana'da) deneysel bitkileri tutun.
- Önemli bitki hasara neden ya da aşırı nüfus ulaşmadan, her 2 haftada yaklaşık taze bitkiler yaprak bitlerini aktarın. Yeni bir koloni başlatmak için yeni bir yetiştirme tesisi için 10-20 yetişkin yaprak bitlerini aktarın.
- İstenmeyen yaprak biti türleri, diğer böcek otobur, yaprak biti parazitoit ve fung ile kontaminasyon düzenli bitkiler yetiştirme MonitörBen yaprak biti koloninin sağlığını etkileyebilir.
- EPG kayıt için nihai tüy dökme sonra bir hafta yetişkin, kanatsız yaprak bitlerini toplayabilirsiniz.
- Genellikle yanlışlıkla diğer bitkiler kirletebilir kayıt sırasında üretilmiştir bazı yavru olduğu gibi deneyler sonrasında, büyüme odasına kullanılmadı deneysel bitkiler dönün.
EPG kayıt için 2. Böcek Kablolama
- Pirinç konektörü pimleri (çivi Ø 1,2 mm), ince bakır tel (Ø 0.2 mm), çok ince altın tel (Ø yaklaşık 20 mikron), su bazlı tutkal gümüş, basit, küçük lehim cıvata ile elde böcek elektrotlar yapmak için lehim sıvısı ve reçine özlü lehim teli, 10X büyütme, küçük makas veya neşter, iki ince forseps ve strafor levha veya kutusu ile stereomikroskopta. Not: vorteks karıştırıcı yararlı olabilir. Not: elektrotlar yapmak için adım adım protokolü, Şekil 2'de belirtilmiştir.
- Yaprak biti içinkullanım ve tutkal sürme elde: küçük ve yumuşak sulu boya devetüyü fırça (boyut 2 ya da daha az) ve bu tür böcek koleksiyonlarının için kullanılanlar gibi böcek pimleri, ince bir dikiş iğnesi ya da kürdan da iyi çalışabilmesine karşın,. Adım 4 EPG Kaydı başlatmak için nasıl gösterir.
- Adım 1.
Not: 1 ve 2 aşağıda böcek elektrotlar eksi yaprak biti nasıl hazırlanacağını gösteriyor adımları. Adım 3 elektrot bir yaprak biti nasıl bağlanacağını göstermektedir. Yaprak biti vakum sabitleme kabloları içinde önerilen, ancak her zaman yavaş hareket türleri (örneğin, B. brassicae) için gerekli değildir.- Lehim cıvata açın ve ucu (Şekil 2A) bazı lehim teli eritmek. Bazı lehim sıvısı (Şekil 2B) ile pirinç konektörü piminin başını ıslatın ve eritilmiş lehim metali (Şekil 2C) içine daldırın.
- İnce bakır tel 1-2 cm uzunluğunda parçasının bir ucunda erimiş lehim metal bir kılıf uygulanır (Şekil2D). Ardından sıcak cıvata (Şekil 2E) karşı birlikte pim ve bakır tel getirmek ve serin ve (Şekil 2F) katılaşmaya uzağa birlikte taşıyabilirsiniz.
- Adım 2.
- Pürüzsüz bir emülsiyon gösterilene kadar iyice birkaç dakika süreyle gümüş yapıştırıcı ile flakon sallamak (veya vorteks). Kes (makas veya neşter) stereomikroskop (Şekil 2G) nesne plaka üzerinde altın tel (uzunluğu yaklaşık 1.5 cm) bir kaç parça.
- (Bölüm 2.3 yapılan) lehim bakır tel ile bir pirinç pimini çekin ve (Şekil 2H) açtıktan sonra şişenin kapağı içinde toplanan olacak küçük gümüş tutkal hazneye bakır tel serbest ucunu batırın. Not: Sadece küçük damlacık gereklidir.
- Stereomikroskop nesnesi plakası üzerine tutkal bulaşmasını önlemek için bir ucunu kaldırırken, altın tel parçasına bakır tel tutkal daldırma ucunu taşır. Coppe üst üste deneyinİki tel örtüşme boyunca tutkal dağıtılması birkaç mm (Şekil 2I), r ve altın tel.
- Tutkal birleşik telleri tutmak için yeterli kurutulmuş kadar bekleyin. Kuruduktan sonra tutkal temas edin ve birleştirilmiş tellerin bazı kısımları yapıştırıcı içermeyen parçalar gösterirseniz Küçük bir iğne veya bakır tel, diğer parça ile bazı taze tutkal ekleyin.
- Böcek elektrot hazır olduktan sonra, strafor bir parça takılı Örneğin saklayın.
Not: altın tel uzunluğu yaprak bitinin hareket özgürlüğünü belirler: o (en az 5 mm) çok kısa ise, yaprak biti kısıtlı hissedebilirsiniz, ve normal davranacaktır olmaz; o (> 2 cm) çok uzunsa, yaprak biti serbestçe hareket edecektir. Yaprak bitleri izin verilirse, yaprakların adaxial tarafına geçmek eğilimindedir. Altın tel yaprağı dokunursa, sinyal kısa devre olacaktır.
- Adım 3.
- Yaprak biti, bir vakum kullanılarak, hafif emme vasıtasıyla yerine tutulabilir; bu durumda, t gerekmektedirO stereomicroscope altında cihazı emme. Alanın ortasında emme açıklığı yerleştirin.
- İyice pürüzsüz bir emülsiyon oluşana kadar, birkaç dakika (veya vorteks) için gümüş yapıştırıcı ile şişe sallayın. Küçük bir fırça ile bir yaprak biti toplayın.
- Karın arka, emme cihazının açın ve emiş ağzının (Şekil 2J) üzerinde yaprak biti monte deneyci döndü. İnce fırça ile, (lahana yaprak bitleri bol) karın herhangi bir yüzey kiri çıkarın.
- Tutkal flakon açın ve gümüş tutkal çok küçük bir damlacık (Şekil 2K) ile bir iğne ıslak. Yaprak biti karnında (Şekil 2L-M) sırtına gümüş tutkal damlacık uygulayın. Kuvvetlice tekrar tutkal şişesini sallayın ve ilk üstünde gümüş tutkal ikinci bir damlacık ekleyin birkaç dakika boyunca tamamen kuru bu damlacık edelim. Not: Gümüş yapışkan bir elektrik iletken olsa da, önemli bir neden olmazböceğin manikür zarar.
- Tutkal şişesini kapattıktan sonra, ıslak damlacık içine altın telin serbest ucunu takın ve tutkal tamamen (Şekil 2N) kurumasına izin verirken hala tel tutun. Bacaklar veya anten üzerine tutkal bulaşmasını önlemek ve bu olmamış bir yaprak biti atın.
- Emme tespit cihazı kapatın ve dikkatlice böcek (Şekil 2O) kaldırın. Gerekirse, emme cihazından yaprak bitinin kaldırma yardımcı olmak için iyi bir fırça kullanılır.
Not: Kablolama B. onlar kendi karın ıslak tutkal bir damla uyguladıktan sonra kaldırdı olmayacak şekilde yeterli kavrama ile yaprak biti sağlayan pürüzlü yüzey hangi hassas laboratuvar doku parçası, üzerinde kablolu edilebilir brassicae, bir vakum gerektirmez. Tutkal Kuruduktan sonra biri ince bir fırça yardımıyla doku yaprak biti kaldırabilir. - Strafor içine kablolu böcek ile pirinç pimini takın ve gerekirse, devamDiğer tüm böcekler kablolama EPG kayıt oturumu için kullanılacak.
Not: yaprak bitleri kablo için Bu protokoller bizim için iyi çalışır. Kullanıcı yaprakbitleri kablo için onun / onu kendi yöntemini bulabilirsiniz.
- Adım 4.
- Bir iletken olmayan destek Faraday kafesi (Şekil 2P) bitkileri koyun: Petri kapları ya da cam veya plastik bir tabak kullanın.
- Her pot toprağa bir bitki elektrot yerleştirin. EPG ön amplifikatör (Şekil 2Q) giriş konektörüne takın kablolu böceğin pirinç pimini takın. Not: Toprak elektrodu, diğer elektrofizyolojik teknikler kullanılan toprak elektrot ile uyuşmuyor. Bu ayarlama ve elektrot polarizasyon gerilimleri telafi etmek için gerekli olan ofset gerilimi vardır.
- 100 Hz sabit örnekleme frekansı ile kazanım yazılım Stile + arayüzü üzerinde, bir dosya adı girin kayıt süresi belirtin ve deney detaylarını belirtmek için metin yazmak (tedavi, bitki / böcek ö Yorum hatlar 2 ve 3, CT türleri, vb.)
- Bitkinin uygun bir iniş alanı üzerine böcekler indirin ve satın alma yazılımı (Stylet +) arabirimi Başlat düğmesine tıklayarak kayıt oturumu başlatın.
Not 1: 8 kanal maksimum kurmak bir EPG aynı anda kullanılabilir. Bir EPG-elektrot veya bitki başına birkaç EPG-elektrotlar kullanılabilir.
Not 2: Bu çalışmanın odak yaprak biti davranışı olduğunda, ilk bitki penetrasyon faaliyetlerini eksik önlemek için yaprak bitlerinin bitki erişimi önce Kayda başlamak. - Uyaranlara SE elektrofizyolojik yanıtları incelemek için, yaprak biti yaprak biti sürekli floem yenmesi aşamasında olduğundan emin olmak için, floem faza girmiştir sonra en az 10 dakika bekleyin ve sinyal temel kararlı olduğunu söyledi. Ancak o zaman, herhangi bir bitki stimülasyon denemeyi başlatın.
tp_upload / 52826 / 52826fig2.jpg "/>
Şekil 2. Elektrik penetrasyon grafiğinde (EPG) kayıtları için yaprak bitleri ve diğer hemipteran böcekler EPG-elektrotlar yapma. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Paneller AI, gerekli adımlar EPG-elektrotlar eksi yaprak biti hazırlamak. İlk olarak, bir lehim cıvata (A) 'ucuna lehimleme metal bir parça eriyik. Ardından, lehim sıvısı (B) bir damla içine pirinç piminin başını daldırma ve lehim ucu cıvata (C) erimiş metal ile temasa geçin. Hemen bu aşamadan sonra, pirinç pimi (EF) arasında baş tutkal amacıyla, lehim cıvatasının ucuna bakır telden ucuyla temas. Bisturi ya da bıçak ile, altın tel (G) 'in bir parça keser. Daldırmagümüş kurur önce serbest gümüş tutkal (H) üzerine (pirinç pin diğer ucunda katıldı) bakır tel sonu ve çabucak (I) altın tel katılın. altın tel mükemmel bir iletkendir ve polarize edilebilir. Gerçekte, çoğu durumda bir polarizasyon tespit edilemeyecek kadar küçük olduğu, ve bu durumda, bu ofset voltajı (V) ile telafi edilebilir.
Paneller JO, elektrot bir yaprak biti (ya da diğer hemipteran böcek) bağlamak için gereken adımlar. İlk olarak, dikkatli bir şekilde ince bir sulu boya fırçası ile bir yaprak biti kaldırın ve vakum emme cihazı (J) açılması üzerine yerleştirin. Vakum pompası açın ve emme uygulamak için bir kağıt parçası ile hava valfi deliği kapsamaktadır. Gümüş yapıştırıcı (K) içine böcek piminin ucu batırın ve bir stereomikroskop (LM) kapsamında, yaprak biti karın üstünde küçük bir tutkal damlacık koydu. IçindeGümüş yapıştırıcı sahip olana kadar bir sonraki ~ 20 sn, yaprak biti kurudukça gümüş tutkal damlacık önce gümüş tutkal ıslak damlacık içine böcek elektrot altın telin ucunu yerleştirin ve 1-3 dakika boyunca yerde saklayın Tamamen hava ile kurutulmuştur (N). Bu noktada, emme cihazından, emme cihazının hava valfi deliğini kaplayan ve dikkatle yaprak biti kaldırmak kağıt parçası kaldırarak emmeyi devre dışı bırakın: kablolama sonra yaprak biti kaldırma genellikle ince bir fırça ile bazı yardım gerektirir (O).
Panel P, tüm EPG genel bir bakış Faraday kafesi içinde kurmak gösterir ve Panel Q EPG için bitki yaprak biti kombinasyonunun bir özetini göstermektedir. Bu sürecin daha ayrıntılı bir açıklama için yukarıdaki bölüm 2'ye bakın.
A: Küçük harfler tek EPG-elektrotlar yapmak gerekiyor öğeleri atıfta etiketlerdir lehim cıvatasını b: lehim metali erimiş;c: lehim sıvısı, d: pirinç konektörü pimi (çivi), e: bakır tel f: Ø 18μm altın tel g: emme cihazı h: biti; i: su bazlı yapıştırıcı gümüş, j: Faraday kafesi; k: Bitki elektrot l: EPG öncesi amplifikatör giriş konektörü (BNC).
Sonuçlar
Bir önceki çalışmada, tırtıl saldırı 1 sırasında midvein arasında SE üretilen elektrik sinyallerini karakterize amacıyla EPG-elektrot tekniği uygulanmaktadır. bu tekniklerin uygulanması için gerekli tespit dolayısıyla müsait, SE-yoğun ve göreceli olarak sağlamdır, çünkü midvein, geleneksel cam elektrotlar, hem de cam stile elektrotlar için tercih edilen bir ekleme edilir. Burada, biz yaprakları marjinal damarlarında olanlar özellikle SES erişmek için daha zor gelen elektrofizy...
Tartışmalar
Bu makalede, Elektrik Penetrasyon Grafik (EPG) kayıtları yapmak için ayrıntılı bir protokol sağlar. EPG tekniği de dünya çapında 100-200 aktif kullanıcı ile kurulur ve örneğin farklı konularda birçok çalışma için uygulamaya konulmuştur: a) yaprak bitleri ve diğer stile taşıyan böcekler 13'e kadar ev sahibi bitki direnci; b) Bitki virüs ve patojen iletim mekanizmaları 14; eylem c) insektisit modu, (toksisite ve davranış değişiklikleri) 15; d) EPGs bile ...
Açıklamalar
WFT launched EPG Systems as a retirement activity, and is affiliated with it financially.
Teşekkürler
VSR IIF Marie Curie Grant tarafından desteklenmiştir (EARTH IN YARA, kısaltması için: Yara Arabidopsis thaliana elektrik sinyallerini kaynaklı).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG Systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is 10X | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100 Hz (softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
Referanslar
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır