É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um novo aplicativo do Electrical Penetration Graph (EPG) para aquisição e medição de sinais elétricos em Floema Sieve Elements
Neste Artigo
Resumo
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
Resumo
Propriedades electrofisiológicas de células são frequentemente estudado in vitro, depois dissociando-os dos seus ambientes nativos. No entanto, o estudo de transmissão eléctrico entre células distantes de um organismo requer in vivo, gravações livre de artefactos de células embebidas dentro do seu ambiente nativo. A transmissão de sinais elétricos a partir de feridos para áreas sem ferimentos em uma planta tem, desde há muito despertou o interesse de botânicos. O floema, a parte viva da vasculatura planta que se espalha por toda a planta, tem sido postulada como uma das principais tecido em transmissão eléctrica em plantas. A falta de métodos eletrofisiológicos adequados coloca muitos desafios para o estudo das propriedades elétricas das células do floema in vivo. Aqui nós apresentamos uma nova abordagem para eletrofisiologia intracelular de elementos crivados (SEs) que usa pulgões vivos ou outros insetos hemípteros floema-alimentação, integrado no gra penetração elétricaph (EPG) circuito. A versatilidade, robustez e precisão deste método, foi possível gravar e estudar em detalhe os sinais elétricos induzidos por feridas em SEs das veias centrais da planta modelo Arabidopsis thaliana 1. Aqui mostramos que GPE-eléctrodos pode ser facilmente implementado para registos electrofisiolicos intracelulares de SE em veias marginais, bem como estudar a capacidade das SE para responder com sinais eléctricos de vários estímulos externos. A abordagem EPG aplicado a electrofisiologia intracelular das SE pode ser implementada de uma grande variedade de espécies de plantas, em um grande número de combinações de plantas / insectos, e para muitos pesquisa pretende.
Introdução
A capacidade para produzir sinais eléctricos de longa distância é uma característica vantajosa de organismos multi-celulares que permite respostas eficientes a estímulos externos. Esta característica tem evoluído independentemente em plantas e animais, e representa, portanto, um processo de evolução convergente. Dado que os sinais eléctricos são acoplados com funções importantes em animais, tais como a transmissão neuronal e a contracção muscular, a base molecular, o mecanismo de transmissão, e a função de sinais eléctricos induzidos por estímulos em animais são sujeitos de pesquisa intensiva. Em contraste, induzida por estímulo sinalização elétrica em plantas tem recebido pouca atenção da investigação. Embora as plantas não têm nervos ou músculos, parece haver provas suficientes para assumir que os sinais elétricos induzida por estímulo em plantas desempenham um papel fundamental nas suas respostas aos factores ambientais.
O floema, o componente vivo da vasculatura planta, tem sido postulada como uma das principais substrate para a transmissão de sinais eléctricos induzidos por estímulos, a partir estimulada / danificado para áreas não estimuladas intactas / 2. As principais células do floema são os elementos de peneira (SES), células alongadas, relativamente simples. As extremidades das SEs estão ligados a outro SEs, formando um contínuo, de baixa resistência, sistema de tubo de peneira que se espalha por toda a planta. Há, no entanto, muito poucos estudos sobre as propriedades elétricas dessas células altamente especializadas. Nesses estudos anteriores, os pesquisadores acessada SEs com qualquer vidro micro-eletrodos 3 estiletes ou com eletrodos de vidro que foram acoplados a plantar-inseridos de pulgões, após stylectomy (corte) 4. Microeléctrodos de vidro são feitas a partir de capilares de vidro que são puxados numa extremidade com calor para uma ponta fina de menos do que 1 um de diâmetro, e depois encheram-se com uma solução de KCl. Um fio de Ag / AgCl ou platina, inserido no eléctrodo de vidro de KCl cheio é então ligado à entrada do amplificador, e um referenteeléctrodo for inserido no banho em torno da célula de interesse, completando o circuito. Esta configuração regista a diferença de potencial entre o eléctrodo de referência extracelular e intracelular do eléctrodo de medição, ou seja, o potencial da membrana da célula 5. Com este método, Umrath feita a primeira gravação intracelular a partir de uma célula de planta, utilizando as algas Nitella 6,7. Nitella é um organismo relativamente simples com células grandes, e portanto passíveis de experiências electrofisiologia intracelulares. Em contraste, a inserção de eléctrodos de vidro intracelular para as pequenas células de plantas terrestres, tridimensionais multi-celulares é tecnicamente exigente, requer um investigador altamente especializado, bem como a visualização sofisticado, micromanipulação, e material anti-vibração. Apesar de eletrodos de vidro são adequados para gravar a partir de células superficiais em plantas, tais como células epidérmicas raiz 8, recordin intracelulargs de células profundamente enraizado no tecido da planta, tais como SEs, muito prováveis respostas induzidas por causar danos, confundindo os resultados. Em 1989, Fromm e Eschrich relataram a utilização de um método alternativo, designado por "método pulgão ', em que eléctrodos de vidro são acoplados a estiletes afídeos após stylectomy 4. O método pulgão é minimamente invasivo, por estiletes flexíveis não causar danos no tecido ou célula como eléctrodos de vidro fazer. Estiletes afídeos são grande invenção da natureza para a penetração planta, e pulgões são consideravelmente mais qualificados do que os seres humanos em encontrar SEs. Infelizmente, este método pulgão também é altamente exigente em termos de competências e de equipamento técnico. Além disso, o sucesso de cada experiência que implementa esta técnica depende inteiramente do pulgão estar no modo de alimentação - com o estilete estavelmente inserida num SE, no momento da stylectomy. Pensando em retrospectiva, pode-se ver que as chances de sucesso dessa técnica poderia ter sido improved adicionando à configuração experimental um instrumento que permite identificar se o estilete é pulgão na SE quando se aplica stylectomy.
Em 1964, McLean e Kinsey descrito um 'sistema de controlo electrónico "para o estudo do comportamento de alimentação de afídeos em tempo real 9,10. Neste sistema, o pulgão da planta e penetrou-estilete foram integrados num circuito eléctrico. Mais tarde, em 1978, Tjallingii concebeu uma versão modificada do sistema, chamado sistema de 'Electrical Penetration Graph "(EPG) 11,12. Considerando que o sistema original de monitoramento eletrônico foi sensível aos potenciais originou-resistência, apenas com o sistema EPG, a força eletromotriz (fem) originou potenciais, ou seja, gerada na planta ou no inseto, pode ser gravadas, além de potenciais decorrentes da a resistência (R) no insecto. Isto representa uma melhoria importante, porque tanto o sinal componentes, emf e R,fornecer informação biológica relevante sobre os acontecimentos durante a penetração planta por pulgões. O que torna o pré-amplificador EPG sensíveis aos R componentes é a sua relativamente baixa resistência de entrada de 1 GÊ, que é próximo da média da resistência de plantas / pulgão. Uma pequena tensão de deslocamento (Figura 1, V) de cerca de 100 mV é aplicada à planta, o qual, em seguida, é dividido entre plantas e de insectos, de um lado, e a resistência de entrada do outro. As tensões e as alterações são medidas num ponto (Figura 1A, B) entre o insecto e a resistência de entrada. Portanto, o R-componentes representam modulações de resistência de plantas pulgão da tensão de offset, enquanto os EMF-componentes são uma certa fração do potencial da planta na ponta do estilete e potenciais causados no inseto. Os potenciais de plantas - mais relevantes aqui - são potenciais principalmente membrana das células vegetais perfurados por estiletes afídeos. Os potenciais de insectos parecem ser principalmentepotenciais de streaming causadas por movimentos fluidos dentro dos dois canais estilete, ou seja, a comida e os canais salivares; há potenciais nervosas ou musculares internos são registrados no EPG. Na prática, as funções de ponta de estilete como uma ponta do eletrodo. Todas as células vegetais são carregadas negativamente para dentro em relação ao exterior da célula positiva. A corrente eléctrica (isto é, o movimento de iões carregados em solução aquosa) que flui a partir do interior para o exterior e vice-versa é muito limitada devido à alta resistência da membrana celular. Normalmente, o potencial de repouso é mantida constante. No entanto, quando os iões negativos mover para fora ou iões positivos mover-se através da membrana celular, o potencial de membrana é reduzido, isto é, 'despolariza'. A despolarização ocorre no caso de excitação celular. Íons, em seguida, entrar ou sair quando os canais iónicos específicos na membrana são abertos ou quando a membrana está danificado e íons vazar dentro e para fora. Todas as células têm canais iônicos e bombas em tele membrana plasmática que trazem o potencial de membrana para o seu nível de repouso, restaurando a concentração original de vários iões dentro da célula. O potencial de repouso e as suas modificações são componentes emf, e, por conseguinte, a técnica do EPG é adequado para medi-los.
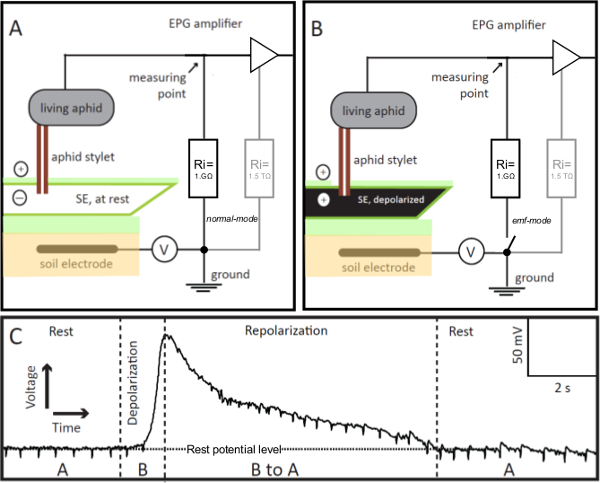
Figura 1. EPG-eletrodos. O GPE-eléctrodo é um pulgão de estar integrados no circuito eléctrico de penetração Gráfico (EPG), cuja estilete é inserido um elemento de crivo (SE) no modo de alimentação estável. Se o empalado-SE estilete está em repouso (painel A), a tensão no circuito, gravado por EPG, é estável e, ao nível de potencial de repouso (painel C, de lazer). Se o SE é animado, seus despolariza membranas (painel B), que é visualizada no EPG como um aumento gradual na voltagem (painel C, despolarização). À medida que o equilíbrio iónico no SE retorna ao descanso, ou seja, repolarizes, a tensão registrada por EPG diminui gradualmente ao resto nível potencial (Painel C, Repolarização). No painel C, "A" e "B" referem-se aos diferentes cenários apresentados nos painéis A e B, respectivamente. V = fonte de tensão compensado ajustável. Ri = resistor de entrada. Em paralelo com a resistência externa 1 GÊ, o amplificador tem uma interna (no amplificador operacional) de alta resistência de 1,5 TΩ (painéis A e B, a cinzento). Por controle remoto da chave do pré-amp EPG pode ser alterado de normal a EMF-mode, que permite a obtenção de valores de alta precisão de tensão. Por favor clique aqui para ver uma versão maior desta figura.
Na próxima seção, nós fornecemos o leitor com um protocolo básico para a realização de experimentos EPG que é válido para ambos os estudos de insetos com foco e focou-planta.
Protocolo
1. Aphid Empinar
Nota: A escolha de espécies de plantas e de afídeos para gravações EPG depende do objetivo da pesquisa. Para estudos sobre a Arabidopsis thaliana, o pulgão Brevicoryne brassicae é apropriado.
- Traseira B. pulgões brassicae em uma estufa em Brassica oleracea. Manter as plantas utilizadas para a criação pulgão em gaiolas, a fim de evitar a contaminação de outras plantas. Manter plantas de criação de pulgões e plantas experimentais (no nosso caso B. oleracea e A. thaliana) em salas separadas, a fim de evitar a contaminação de plantas experimentais com pulgões.
- Transferir pulgões para plantas frescas sobre a cada 2 semanas, antes de causar danos às plantas significativa, ou chegar a superpopulação. Transferir 10-20 pulgões adultos a uma planta criação fresco para iniciar uma nova colônia.
- Monitorar criação plantas regularmente para contaminação por espécies de afídeos indesejados, outros insetos herbívoros, parasitóides de afídeos e fungi que podem afetar a saúde da colônia pulgão.
- Recolha adultos, pulgões sem asas até uma semana após a sua última muda para a gravação EPG.
- Após os experimentos, as plantas experimentais regresso que não foram utilizados para a câmara de crescimento, como muitas vezes eles têm alguns descendentes que foi produzido durante a gravação, o que poderia inadvertidamente contaminar outras plantas.
2. Insect Fiação para gravação EPG
- Para fazer eletrodos de insetos, obtenha pinos do conector de bronze (pregos, Ø 1,2 milímetros), fio de cobre fino (0,2 milímetros Ø), fio de ouro muito fina (Ø cerca de 20 mm), cola de prata à base de água, um parafuso de solda pequeno simples com fluido de solda e fio de solda com núcleo de resina, microscópio estereoscópico com ampliação de 10X, uma tesoura pequena ou bisturi, dois pinça fina, e uma folha de isopor ou caixa. Nota: Um misturador de vórtice pode ser útil. Nota: O protocolo passo-a-passo para fazer eléctrodos é indicado na Figura 2.
- Para pulgãomanuseamento e de aplicação de cola, obtém-se: um pequeno pincel macio e camelhair aguarela (tamanho 2 ou menor) e os pinos de insectos, tais como aqueles usados para conjuntos de insectos, embora uma agulha de costura ou palito fino pode funcionar tão bem. Passo 4 mostra como para iniciar a gravação EPG.
- Passo 1.
Nota: Os passos 1 e 2 abaixo mostram como preparar eletrodos de insetos menos o pulgão. Passo 3 mostra como ligar um afídeo ao eletrodo. Aspirador de fixação do pulgão é recomendado durante a fiação, mas nem sempre necessária para as espécies que se deslocam lenta (por exemplo, B. brassicae).- Ligue o parafuso de solda e derreter algum fio de solda na sua ponta (Figura 2A). Umedeça a cabeça do pino conector de bronze com um pouco de fluido de solda (Figura 2B) e mergulhe-o de solda de metal derretido (Figura 2C).
- Aplicar um revestimento de solda fundida de metal sobre uma extremidade de uma peça de 1-2 cm de comprimento do fio de cobre fina (figura2D). Em seguida, leve o fio do pino e cobre juntos contra o parafuso quente (Figura 2E) e movê-los juntos longe para esfriar e solidificar (Figura 2F).
- Passo 2.
- Completamente agitar (ou vortex) o frasco com cola de prata por vários minutos até que uma emulsão suave é mostrado. Cut (tesoura ou bisturi) alguns pedaços de fio de ouro (de cerca de 1,5 cm de comprimento) sobre o objeto placa do microscópio estereoscópico (Figura 2G).
- Com um pino de bronze com fio de cobre soldada (feito na seção 2.3) e mergulhar a extremidade livre do fio de cobre para o pequeno reservatório de cola de prata que se reuniram no interior da tampa do frasco após abri-lo (Figura 2H). Nota: Apenas uma pequena gota é necessário.
- Mover o fim-mergulhadas cola do fio de cobre para o pedaço de fio de ouro, ao levantar uma extremidade para evitar manchar a cola sobre a placa estereomicroscópio objecto. Tente se sobrepõem copper e um fio de ouro para alguns mm (Figura 2I), distribuindo a cola ao longo da sobreposição dos dois fios.
- Espere até que a cola tenha sido seco o suficiente para manter os fios unida. Verifique o contato cola após a secagem e adicione um pouco de cola fresca com um pequeno alfinete ou outro pedaço de fio de cobre, se algumas partes dos fios aderiram mostrar peças livre de cola.
- Após o eletrodo inseto está pronto, armazená-lo, por exemplo inserido em um pedaço de isopor.
Nota: O comprimento do fio de ouro irá determinar a liberdade de movimento do pulgão: se for muito curto (menos do que 5 mm), o pulgão pode sentir-se constrangido e não irá comportar-se normalmente; se for muito longo (> 2 cm), o pulgão vai mover-se livremente. Pulgões tendem a mover-se para o lado adaxial das folhas, se permitido. Se o fio de ouro toca a folha, o sinal será curto-circuito.
- Passo 3.
- O pulgão pode ser mantido no lugar por meio de sucção de luz, utilizando um vácuo; neste caso, instale tele sucção dispositivo, ao microscópio estereoscópico. Coloque a abertura de aspiração, no centro do campo.
- Agite bem o frasco com cola de prata por vários minutos (ou até que um vortex) emulsão lisa é formado. Recolha um afídeo com a pequena escova.
- Ligar o dispositivo de aspiração e montar o pulgão na abertura de sucção (Figura 2J), com a parte de trás do abdómen virou-se para o experimentador. Com o pincel fino, remova toda a cera da superfície do abdômen (abundante em pulgões de couve).
- Abra o frasco de cola e molhar um pino com uma pequena gota de cola de prata (Figura 2K). Aplique a gota de cola de prata na parte traseira do abdômen do pulgão (Figura 2L-M). Que esta gotícula completamente seco durante vários minutos, agitar vigorosamente o frasco cola novamente e adicionar um segundo gota de cola de prata na parte superior da primeira. Nota: Embora a cola de prata é um condutor eléctrico, que não causa significativadanos à cutícula do inseto.
- Depois de fechar o frasco de cola, inserir a extremidade livre do fio de ouro na gotícula molhado e ainda manter o fio, permitindo a cola secar completamente (Figura 2N). Evitar manchas cola sobre pernas ou antenas e descartar um afídeo se isso aconteceu.
- Desligue o dispositivo de fixação de sucção e cuidadosamente levante o inseto (Figura 2O). Se necessário, utilizar um pincel fino para auxiliar na supressão do pulgão do dispositivo de sucção.
Nota: Fiação B. O brassicae não requerem um vácuo, uma vez que pode ser ligado em um pedaço de tecido de um laboratório de precisão, a superfície áspera do que fornece o pulgão com aderência suficiente de modo que não será levantada depois de aplicar uma gota de cola húmida ao seu abdómen. Após secagem da cola pode-se levantar o pulgão do tecido com a ajuda de um pincel fino. - Insira o pino de bronze com o inseto com fio para o isopor e, se necessário, continuarcablagem de todos os outros insectos a ser usado para a sessão de gravação EPG.
Nota: Estes protocolos para a instalação elétrica pulgões funcionar bem para nós. O usuário pode encontrar a sua / seu próprio método para fiação pulgões.
- Passo 4.
- Coloque plantas na gaiola de Faraday (Figura 2P) sobre um suporte não condutor: utilizar placas de Petri ou uma placa de vidro ou de plástico.
- Insira um eletrodo planta no solo de cada vaso. Insira o pino de bronze do inseto com fio ao conector de entrada do pré-amplificador EPG (Figura 2T). Nota: o eléctrodo de terra, não corresponde ao eléctrodo de terra utilizado em outras técnicas electrofisiológicas. Ele tem a tensão de deslocamento necessário para ajustar e compensar as tensões eletrodo de polarização.
- Na interface do software de aquisição Stylet +, com freqüência de amostragem fixa de 100 Hz, digite um nome de arquivo, especifique o tempo de gravação, e escrever um texto para especificar os detalhes da experiência (tratamento, planta / inse ct espécies, etc.) em Linhas de comentário 2 e 3.
- Abaixe os insetos para uma área de pouso adequado da planta e começar a sessão de gravação clicando no botão Iniciar do software de aquisição (Stylet +) interface.
Nota 1: um máximo de 8 canais podem ser utilizados simultaneamente num EPG configurado. Um EPG-eléctrodo ou vários EPG-eléctrodos por planta pode ser usado.
Nota 2: quando o foco do estudo é o comportamento do pulgão, iniciar a gravação antes do acesso planta dos afídeos para evitar perder as primeiras atividades de penetração planta. - Para estudar as respostas electrofisiológicos das SE a estímulos, esperar, pelo menos, 10 minutos após o pulgão tenha entrado em fase floema, a fim de assegurar que o pulgão está numa fase ingestão floema sustentada, e que a linha de base do sinal é estável. Só então, iniciar um experimento estimulação da planta.
tp_upload / 52826 / 52826fig2.jpg "/>
Figura 2. Fazendo EPG-eletrodos com pulgões ou outros insetos hemípteros para gravações gráfico penetração elétrica (EPG). Por favor clique aqui para ver uma versão maior desta figura.
Painéis AI, etapas necessárias para preparar EPG-eletrodos menos o pulgão. Em primeiro lugar, derreter uma peça de metal de solda na extremidade de um parafuso de solda (A). Em seguida, mergulhe a cabeça do alfinete de bronze em uma gota de fluido de solda (B), e entre em contato com o metal derretido na ponta do parafuso de solda (C). Imediatamente após este passo, em contacto com a extremidade de um fio de cobre para a ponta do parafuso de solda, de modo a que a cola da cabeça do pino de latão (EF). Com um bisturi ou uma lâmina, cortar um pedaço do fio de ouro (L). Mergulhoa extremidade livre do fio de cobre (juntou-se na outra extremidade ao pino de latão) sobre a cola de prata (H), e juntar-se rapidamente o fio de ouro a ele (I) antes da prata seca-se. O fio de ouro é um excelente condutor, e pode ser polarizada. Na realidade, na maioria dos casos, a polarização é muito pequeno para ser detectado, e se assim for, isto pode ser compensado com a tensão de deslocamento (V).
Painéis de JO, passos necessários para ligar um pulgão (ou outro inseto hemíptero) para o eletrodo. Primeiro, levante cuidadosamente um afídeo com um pincel fino aquarela e colocá-lo na abertura do dispositivo de sucção a vácuo (J). Ligar a bomba de vácuo e cobrir o buraco da válvula de ar com um pedaço de papel para aplicar sucção. Mergulhe a ponta do pino de inseto na cola de prata (K), e colocar uma pequena gota de cola na parte superior do abdômen do pulgão, sob microscópio estereoscópico (LM). Dentro dopróxima ~ 20 seg, antes da gota de cola de prata sobre a seca de afídeos, inserir a extremidade do fio de ouro do eléctrodo de insectos para a gotícula de cola húmida de prata, e mantê-lo no lugar para 1-3 min, até que a cola tem de prata completamente (N) secou-se ao ar. Neste ponto, desactivar sucção através da remoção da folha de papel que cobre o orifício da válvula de ar do dispositivo de sucção e cuidadosamente remover o pulgão, a partir do dispositivo de sucção: levantando o pulgão após a ligação, muitas vezes requer alguma ajuda de um pincel fino (O).
Painel P mostra uma visão geral de todo o EPG criada dentro da gaiola de Faraday, e Painel Q mostra uma visão geral da combinação planta-pulgão para EPG. Consulte a seção 2 acima para uma explicação mais detalhada deste processo.
Pequenas letras são rótulos referentes aos itens que se deve fazer EPG-eletrodos: um: parafuso de solda; b: derretido do metal de solda;c: fluido de solda; d: bronze conector de pino (unha); e: fio de cobre; f: Fio Ø 18μm ouro; g: dispositivo de sucção; h: pulgão; i: cola de prata à base de água; j: gaiola de Faraday; k: eletrodo planta; l: conector de entrada (BNC) do pré-amplificador EPG.
Resultados
Em um estudo anterior, implementamos a técnica EPG-eletrodo com o objetivo de caracterizar os sinais elétricos produzidos em SEs do midvein durante o ataque da lagarta 1. A nervura central é um local de inserção preferencial para eléctrodos de vidro convencionais, bem como dos eléctrodos de vidro e de estilete, porque é SE-denso, e relativamente robustos, portanto, susceptível de fixação necessários para a implementação destas técnicas. Aqui, nós tiramos proveito da versatilidade do eletrodo E...
Discussão
Este artigo fornece um protocolo detalhado para a tomada elétrica Penetração Gráfico (OPG) gravações. A técnica EPG está bem estabelecida, com 100-200 de usuários ativos em todo o mundo, e tem sido implementada para muitos estudos sobre diferentes temas, por exemplo: a) resistência de plantas para pulgões e outros insetos portadores de estilete 13; b) de vírus de plantas e patógenos mecanismos de transmissão 14; c) Modo de inseticida de ação, (toxicidade e mudanças de comportamento...
Divulgações
WFT launched EPG Systems as a retirement activity, and is affiliated with it financially.
Agradecimentos
VSR foi apoiada por uma IIF Marie Curie Grant (FERIDAS NA TERRA, sigla para: Ferida induzida sinais elétricos em Arabidopsis thaliana).
Materiais
| Name | Company | Catalog Number | Comments |
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG Systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is 10X | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100 Hz (softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
Referências
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados