Method Article
Número de unidad de motor electrofisiológico Estimación (MUNE) Medición de Potencial Compuesto muscular Acción (CMAP) en los músculos del ratón las patas traseras
En este artículo
Resumen
Presentamos protocolos que permiten a los refinados en el seguimiento in vivo de la función de la unidad de motor en el ratón. Técnicas para medir el potencial de acción muscular compuesto (CMAP) y el número de la estimación de la unidad de motor (MUNE) en los músculos de las extremidades traseras ratón inervados por el nervio ciático se describen.
Resumen
Compound muscle action potential (CMAP) and motor unit number estimation (MUNE) are electrophysiological techniques that can be used to monitor the functional status of a motor unit pool in vivo. These measures can provide insight into the normal development and degeneration of the neuromuscular system. These measures have clear translational potential because they are routinely applied in diagnostic and clinical human studies. We present electrophysiological techniques similar to those employed in humans to allow recordings of mouse sciatic nerve function. The CMAP response represents the electrophysiological output from a muscle or group of muscles following supramaximal stimulation of a peripheral nerve. MUNE is an electrophysiological technique that is based on modifications of the CMAP response. MUNE is a calculated value that represents the estimated number of motor neurons or axons (motor control input) supplying the muscle or group of muscles being tested. We present methods for recording CMAP responses from the proximal leg muscles using surface recording electrodes following the stimulation of the sciatic nerve in mice. An incremental MUNE technique is described using submaximal stimuli to determine the average single motor unit potential (SMUP) size. MUNE is calculated by dividing the CMAP amplitude (peak-to-peak) by the SMUP amplitude (peak-to-peak). These electrophysiological techniques allow repeated measures in both neonatal and adult mice in such a manner that facilitates rapid analysis and data collection while reducing the number of animals required for experimental testing. Furthermore, these measures are similar to those recorded in human studies allowing more direct comparisons.
Introducción
Motor número de unidad de estimación (MUNE) fue descrito originalmente por McComas et al. 1 más de tres décadas. La técnica original era una modificación de la técnica de grabación de potencial de acción muscular compuesto (CMAP) que emplea un aumento gradual de la estimulación para obtener incrementos submáximos. Estos incrementos se suman y promedian para determinar un tamaño estimado de un potencial de una sola unidad de motor (SMUP). Este tamaño se dividió en la respuesta CMAP para estimar el número de unidades motoras que inervan el músculo se está probando. Después de la descripción original, numerosas variaciones utilizando tanto las respuestas electrofisiológicas y de la fuerza incremental de las mediciones (mecánicas) se han utilizado en ambos estudios en humanos y modelos animales 2. La técnica de MUNE fue modificada por Shefner y sus colegas para investigar modelos de ratón de la esclerosis lateral amiotrófica (ELA) 3, 4.
En la descripción actual, detallamos simplifmodificaciones del IED de las técnicas de MUNE que son rápidas de realizar. Es importante destacar que, CMAP y MUNE permiten medidas fiables tanto en ratones recién nacidos y adultos 5-8. Individuos experimentados pueden realizar estas medidas en 10-20 minutos por animal y medidas repetidas son factibles que permite la adquisición de datos longitudinales 5. En los estudios actuales, empleamos un sistema de electrodiagnóstico clínica. En nuestra experiencia, los sistemas de electrodiagnóstico clínicos están optimizados para la captura rápida y eficiente de los datos electrofisiológicos in vivo, plataformas electrofisiológicas estándar, sin embargo, se pueden adaptar fácilmente para esta aplicación.
Protocolo
Este protocolo fue aprobado por y se adhiere a las pautas de cuidado de los animales y de ética del Centro Médico de la Universidad de Wexner de Ohio State.
1. Preparación del animal y Anestesia
- Use guantes durante la manipulación de los ratones.
- Anestesiar ratones con isoflurano inhalado y colocar en la posición prona. Inducir la anestesia utilizando 3-5% isoflurano y 1 L por minuto O2 caudal. Después de la inducción de la anestesia, mantener la anestesia a 2-3% y 1 L por minuto O 2 velocidad de flujo.
- Ajuste O 2 y el porcentaje de flujo para la anestesia isoflurano adecuados según estado de la enfermedad, la edad y la tasa de respiración del animal. Los animales más pequeños o más débiles pueden requerir menos isoflurano para la anestesia adecuada (es decir, 1,5 2,5% isoflurano).
- Confirme anestesia adecuada mediante la aplicación de luz de presión de la almohadilla plantar las extremidades posteriores con un objeto, como pinzas para demostrar la falta de respuesta de retirada.;
- Mantener la temperatura a 37 ° C temperatura de la superficie con una placa de calentamiento termostática como variación en la temperatura puede afectar tamaño y la duración CMAP.
- Aplique un ungüento a base de petróleo veterinario para los ojos para evitar la sequedad. Controlar el nivel de la anestesia observación de la tasa de respiración y la evaluación de las respuestas de abstinencia siguientes presión aplicada a la almohadilla de la pata a través de fórceps.
- Retire el cabello del miembro posterior a estudiar el uso de máquinas de cortar. Después de eliminación del pelo de la extremidad posterior (s) a ser estudiado, se extienden ligeramente las extremidades posteriores en la rodilla, secuestrar en las caderas y colocar sobre la superficie de trabajo usando cinta adhesiva (como se muestra en la Figura 1).
- Después de las grabaciones y la interrupción de la anestesia CMAP y MUNE, no dejar animales sin vigilancia hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal. No vuelva animal a la compañía de otros animales hasta que se recupere totalmente.
2. Rrabación Configuración y Equipos
- Coloque los electrodos para las grabaciones CMAP y MUNE como se muestra en la Figura 1.
- Utilice dos electrodos anulares finas para los electrodos de registro.
- Coloque la activa (E1) electrodo de anillo en la piel que recubre la porción proximal del músculo gastrocnemio de la extremidad posterior, en la articulación de la rodilla, y el electrodo (E2) anillo de referencia en la piel sobre la parte intermedia-metatarsiano del pie.
- Con el fin de reducir la impedancia, capa de la piel subyacente a los electrodos de anillo con el gel para saturar suficientemente pelo residual y maximizar el contacto electrodo-piel. Evite la aplicación excesiva de gel para electrodos ya que esto puede causar un puente eléctrico entre los electrodos y podría impedir la grabación exacta.
- Para la estimulación del nervio ciático en la extremidad posterior proximal, utilice dos aislados 28 G agujas monopolares como el cátodo y el ánodo. Insertar el cátodo en la región de la extremidad posterior proximal e inserte el anode más proximalmente en el tejido subcutáneo que recubre el sacro.
- Evite insertar los electrodos de estimulación excesivamente cerca del nervio ciático o demasiado profundas que sería directamente la lesión del nervio ciático u otra estructura. Figura 1 ilustra la colocación de electrodos.
- Para el electrodo de masa, colocar un electrodo de superficie disponible en la extremidad posterior contralateral o la cola.
3. Adquisición de Datos
- CMAP ciático
- Obtener respuestas CMAP ciático al estimular el nervio ciático con pulsos de onda cuadrada de 0,1 ms de duración y la intensidad que van 1-10 mA.
- Adquirir respuestas CMAP con el aumento de la intensidad del estímulo hasta que la amplitud de la respuesta ya no aumenta. Entonces, con el fin de garantizar la estimulación supramáxima, aumentar la estimulación a ~ 120% de la intensidad del estímulo utilizado para obtener una respuesta máxima y obtener una respuesta adicional. Si no hay es aumentar aún más in el tamaño CMAP, registrar esta respuesta como la CMAP máxima.
- Registros de línea de base a pico y pico a pico amplitudes CMAP en mV (Figura 2).
- Promedio Potential Unidad Motor (SMUP) Tamaño y MUNE Cálculo
- Determinar el tamaño medio de la potencial unidad de un solo motor (SMUP) con una técnica de estimulación incremental 1. Para obtener respuestas incrementales, ofrecer estimulación submáxima de duración 0,1 ms a una frecuencia de 1 Hz, mientras que el aumento de la intensidad de 0,03 mA pasos para obtener los mínimos respuestas de todo o nada. Obtener la respuesta inicial con la intensidad del estímulo entre 0,21 mA y 0,70 mA.
- Si la respuesta inicial no se produce con la intensidad del estímulo entre 0,21 mA y 0,70 mA, ajuste la posición del cátodo estimulante más cerca o más lejos de la posición del nervio ciático en el muslo proximal para aumentar o disminuir la intensidad del estímulo requerido, respectivamente.
- Si la i inicialrespuesta ncremental se obtiene con una intensidad del estímulo entre 0,21 mA y 0,70 mA y cumple los criterios indicados a continuación (3.2.2), almacenar y registrar incrementos adicionales a medida que aumenta la intensidad de estímulo de ajuste en pasos de 0,03 mA para obtener un total de 9 incrementos adicionales que cumplir con los criterios establecidos.
- Durante las mediciones de las respuestas incrementales, asegúrese de que cada incremento cumpla con los siguientes criterios.
- Asegúrese de que el pico negativo inicial de las respuestas incrementales está alineado temporalmente en el pico negativo de la respuesta CMAP máxima se muestra como la parte sombreada de la ilustración CMAP en la figura 2.
- Asegúrese de que cada respuesta incremental es estable y sin fraccionamiento, establecido mediante la observación de tres respuestas duplicadas. Distinguir respuestas visualmente incrementales, en tiempo real (superpuesta sobre los incrementos registrados previamente).
Nota: Cada incremento debe ser visualmente distintay más grande en comparación con la respuesta anterior (Figura 3). Análisis en tiempo real permite el reconocimiento de mayor amplitud las respuestas (incrementales) en comparación con las respuestas anteriores, y los pequeños cambios atribuibles al ruido de fondo puede ser tenida en cuenta. Una vista superpuesta de 10 incrementos se muestra en la Figura 4 (B y D) para ilustrar adicionalmente este punto. - Después de confirmar visualmente cada incremento, asegúrese de que la diferencia de amplitud medida (confirmado respuesta de amplitud de la respuesta antes = diferencia de amplitud) es al menos 25 mV.
- Si el incremento es menor que 25 mV, desechar y volver a medir la respuesta. Después de grabar 10 respuestas incrementales, evaluar los incrementos para asegurar que la amplitud de cada respuesta incrementales individuo no es mayor que un tercio de la suma de todos los incrementos de diez (es decir, la amplitud total de la respuesta final). Si no se cumple esta condición, vuelva a medir las respuestas incrementales.
- La media de los 10 valores incrementales para dar una estimación del potencial de unidad motora individual (SMUP) amplitud media (Figura 3). Nota: La figura 3 detalla la base del cálculo de la media SMUP, pero la amplitud media SMUP puede ser simplemente calculado dividiendo toda la amplitud de la respuesta gradual final por el número total de incrementos (es decir, 10).
Ejemplo de cálculos individuales SMUP (ilustrado en la Figura 3):
SMUP 1 = amplitud de pico a pico de la subasta 1
SMUP 1 = 0.050 mV
SMUP 2 (amplitud pico a pico de incremento 2) = - (amplitud de pico a pico de la subasta 1)
SMUP 2 = 0.150 mV-0.050 mV = 0,100 mV- Calcula cada incremento posterior (hasta un total de 10), y hacer un promedio de los diez incrementos.
- Calcular MUNE dividiendo la amplitud máxima CMAP (pico a pico) por la amplitud media SMUP (pico a pico). (MUNE = CMAP / SMUP promedio). En algunos sistemas electrofisiológicos, los incrementos SMUP se miden en mV mientras que CMAP se proporciona típicamente en mV. Cuando sea necesario, convertir CMAP y SMUP resultados a otras unidades similares antes de cálculo MUNE.
- Determinar el tamaño medio de la potencial unidad de un solo motor (SMUP) con una técnica de estimulación incremental 1. Para obtener respuestas incrementales, ofrecer estimulación submáxima de duración 0,1 ms a una frecuencia de 1 Hz, mientras que el aumento de la intensidad de 0,03 mA pasos para obtener los mínimos respuestas de todo o nada. Obtener la respuesta inicial con la intensidad del estímulo entre 0,21 mA y 0,70 mA.
Resultados
Las técnicas de CMAP y MUNE describen en este informe permitir el registro de la función neuromuscular de los músculos de las extremidades ciático inervado trasera que utilizan la colocación de electrodos mínimamente invasiva (Figura 1). Tamaño supramáxima CMAP, que representa la producción total de un grupo muscular, se puede describir utilizando los parámetros de amplitud y el área (Figura 2), sin embargo, en los métodos actuales, se utiliza para cuantificar la amplitud de CMAP y los tamaños SMUP. Dado que las medidas de respuesta CMAP agrupaban despolarización de las fibras musculares dentro de un músculo, la patología en cualquier lugar de la neurona motora a la fibra muscular puede resultar en reducción en el tamaño CMAP. Por lo tanto, CMAP da una excelente medida de la situación funcional totales. Como era de esperar, el tamaño CMAP se incrementará durante el desarrollo 5. Debido a los cambios compensatorios que pueden ocurrir después de la denervación (es decir surgimiento colateral), el tamaño CMAP puede mantenerse a pesar de los procesos de neur motoren o pérdida axonal motor. Por lo tanto, se requiere la técnica de MUNE para determinar la neurona motora o la entrada de axón al músculo o grupo de músculos que se está probando. Grabación de incrementos individuales (Figura 3) permite la estimación de la producción media de las unidades motoras individuales (tamaño SMUP) para dar una información más detallada sobre el estado funcional de las unidades motoras.
CMAP y MUNE pueden utilizarse para medir la función neuromuscular en varios modelos de ratón de enfermedad neuromuscular. En la Figura 4, los resultados en un ratón de control de adultos y un ratón adulto de 11 semanas después del aplastamiento del nervio ciático se contrastan. Después del aplastamiento del nervio ciático, MUNE se reduce drásticamente a 50 unidades motoras funcionales estimados en comparación con los resultados normales de 278 unidades motoras funcionales en el ratón de control. En contraste, la amplitud de CMAP en el animal triturado (39,6 mV línea de base a pico, 74,9 mV pico a pico) muestra sólo la reducción leve en comparación con el control (49,0 mV para la línea de base--peak, 84,2 mV pico a pico) debido al surgimiento de garantía.
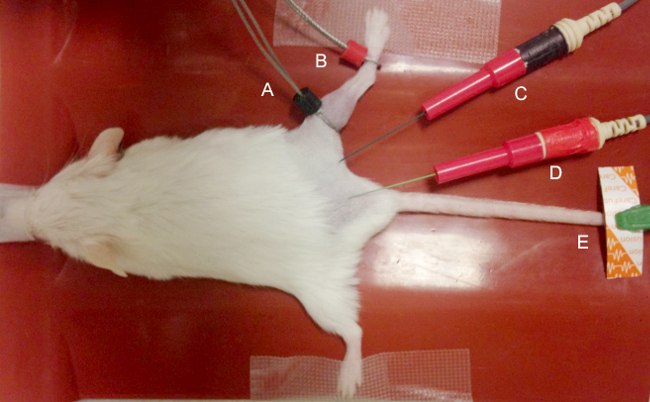
Figura 1. Colocación de los electrodos. El negro (E1) electrodo "activo" (A) y rojo (E2) electrodo de registro "de referencia" (B) se coloca sobre el gastrocnemio en la porción proximal del gemelo en la rodilla. El cátodo estimulante (negro) (C) y el ánodo (rojo) (D) se insertan proximal por vía subcutánea a los electrodos de registro para generar respuestas distales. Un electrodo de disco desechable (D) se coloca en la extremidad posterior, la cola o el sacro como motivo para reducir al mínimo el artefacto. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Compuesto potencial de acción muscular. En la foto, una ilustración de una respuesta CMAP representante. (A) La amplitud de la línea de base a pico se mide desde la línea de base isoeléctrica al pico negativo inicial (voltaje negativo se representa por encima de la línea de base). ( B) La amplitud de pico a pico se mide desde pico de voltaje negativo al voltaje de pico positivo. El área sombreada indica el área del pico negativo. Por favor haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Respuestas incrementales. Dos respuestas incrementales representativos se muestran superpuestas y en isolación. Para MUNE amplitudes de cálculo de cada incremento se miden pico a pico. Incremento # 1 es el primer todo-o-nada respuesta registran y representa un potencial de unidad motora (SMUP). Cada incremento posterior (# 2-10) representa un aumento quantal superpuesta sobre la respuesta anterior. Por lo tanto para obtener las amplitudes SMUP para incrementos de 2-10, la amplitud de la respuesta anterior se restará de la amplitud del incremento obtenido. Por favor haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Ejemplo ciático CMAP y MUNE. (A) potencial de acción muscular compuesto ciático (CMAP) en un adulto (6 meses de edad) de ratón de control con amplitud de línea de base a pico de 49.0 mV y pico-a-amplitud de pico de 84,2 mV. Sensibilidad de la pantalla = 10 mV por división y la duración pantalla de 10 ms. (B) Diez correspondientes respuestas incrementales (en el ratón control) con una amplitud total de 3.028 mV se dividen por 10 para determinar el tamaño promedio SMUP (0,3028 mV). La sensibilidad de la pantalla = 0,5 mV y velocidad de barrido de 1 ms por división. Calculado MUNE = 278 (MUNE = CMAP / SMUP promedio (84,2 mV / 0.3028 mV)) (C) ciático CMAP 11 semanas siguientes aplastamiento del nervio ciático en un ratón adulto (6 meses de edad) que muestran ligeramente reducida amplitud de línea de base a pico ( 39,6 mV) y la amplitud de pico a pico (74,9 mV). La sensibilidad de la pantalla = 10 mV por división y velocidad de barrido de 1 ms por división. (D) Diez correspondientes respuestas incrementales (en el ratón con aplastamiento del nervio) con amplitud total de pico a pico de 14.923 mV dividido por 10 para obtener una SMUP promedio tamaño de 1,4923 mV. La sensibilidad de la pantalla = 2 mV por división y una velocidad de barrido de 1 ms por división. Calculado MUNE = 50 (MUNE = CMAP/ SMUP promedio (74,9 mV / 1.4923 mV)). (** Tenga en cuenta la diferente sensibilidad para las respuestas incrementales del ratón enamorado ciático). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
MUNE y CMAP son medidas clínicamente relevantes con frecuencia utilizados en estudios de investigación y en el seguimiento de pacientes con trastornos neuromusculares tales como ALS y la atrofia muscular espinal (SMA) 9, 10. Por ejemplo, en SMA, CMAP y MUNE se correlacionan bien con la edad, la gravedad y clínica medidas de la función 10-14. Ambas medidas son mínimamente invasiva y permiten la evaluación de la función longitudinalmente en el mismo individuo. Es importante destacar que estas medidas no pueden medir la activación o reclutamiento de la unidad de motor por las neuronas motoras corticales, pero proporcionar una evaluación clínicamente relevantes de la integridad de la neurona motora y su contraparte funcional, la unidad de motor.
Los modelos animales de enfermedad neuromuscular son esenciales para una comprensión de los mecanismos patogénicos de la enfermedad humana y para el desarrollo preclínico de agentes terapéuticos potencialmente eficaces. La capacidad de traducir las medidas de resultado y biomarcadores que pueden serutilizado en todas estas especies pueden facilitar y acelerar la traducción de los resultados preclínicos prometedores a los ensayos clínicos en humanos. Varios grupos han utilizado previamente ambas mediciones electrofisiológicas y de fuerza (mecánicos) para estimar la función de la unidad de motor en modelos de ratón 2-4, 15-22. Debido a la relativa complejidad de las medidas, hemos refinado estas técnicas en un formato visual para permitir el uso y la aplicación más extendida en ratones. El formato de vídeo de demostración e instrucción, permite pasos clave del procedimiento a destacar y peligros potenciales que deben abordarse. La aplicación de estas técnicas a las pruebas preclínicas de potenciales terapias en enfermedades de las neuronas motoras puede mejorar la traducción de terapias putativos de los ratones a la enfermedad humana.
Hay varios pasos críticos en el proceso de adquisición de las respuestas CMAP y MUNE. Colocación de los electrodos de grabación adecuado y consistente y suficiente contacto del electrodo con la ciervalas extremidades son críticos para la medición reproducible de amplitud y para disminuir el ruido de fondo. Por lo tanto, el contacto cercano entre las traseras de la piel de las extremidades y los electrodos debe ser confirmado de forma coherente. Hemos encontrado que los electrodos de superficie ofrecen grabaciones más consistentes CMAP y MUNE que los electrodos de aguja. Debido a los tejidos subcutáneos muy delgados, pequeños movimientos de superficie de grabación de la aguja puede dar lugar a una amplia variación en amplitudes CMAP. Además, el carácter más invasivo de electrodos de aguja no es óptimo para ratones recién nacidos o estudios longitudinales debido a la interrupción potencial muscular y lesiones. Una desventaja potencial de los electrodos de superficie, grabaciones no selectivos se refiere a la posibilidad de resolución fenotipo disminuida si un músculo en particular es más o menos involucrados en comparación con otro, y esto ha sido reportado en un modelo de ratón ALS 21.
Adquirir el tamaño medio SMUP es técnicamente más difícil en comparación con la CMAP. Debido a los respons más pequeñostamaño de correo (en el rango de mV en lugar de mV) el ruido de fondo puede ser más problemático. El ruido de fondo puede reducirse mediante el ajuste del electrodo de tierra, cátodo, ánodo, y el control de otro equipo eléctrico cerca de la configuración experimental. Una jaula de Faraday, normalmente utilizado para aplicaciones de electrofisiología intracelulares, no es necesario. Determinación visual de las respuestas individuales SMUP es la habilidad más difícil de adquirir y requiere práctica para obtener resultados consistentes con repetibilidad adecuada. Es importante asegurarse de que los SMUPs que están siendo registrados inician dentro de la duración de la respuesta CMAP máxima. Hemos definido los criterios para la aceptación de las respuestas incrementales individuales para hacer este proceso más sencillo de realizar y para aumentar la fiabilidad intra e inter-evaluador.
Una desventaja potencial de la técnica incremental de MUNE incluye la posibilidad de sobreestimar el número de unidades motoras funcionales debido a la alternancia de motor unidades. Hemos utilizado una técnica similar a Shefner et al. en que cada respuesta debe ser reproducible visto un total de 3 veces para reducir el impacto de este fenómeno 3.
En nuestra experiencia, los sistemas de electrodiagnóstico clínicos están optimizados para los estudios descritos en este documento debido a la mejora de la ergonomía de la interfaz del sistema-examinador electrodiagnóstico permitiendo facilidad de control. El sistema de dos canales utilizados en nuestro laboratorio está equipado con dos canales no conmutada amplificador utilizando un amplificador con 24 bits convertidor analógico a digital y una tasa de muestreo de 48 kHz por canal. Ganancia de hardware se puede ajustar desde 10nV a 100 mV / división. El filtro de baja frecuencia tiene un rango de 0,2 Hz-5 kHz, y la configuración del filtro de alta frecuencia va desde 30 Hz-10 kHz. Un estimulador de corriente constante se utiliza (intensidad: 0-100 mA; duración: 0,02-1 ms). La mayoría de los sistemas clínicos tienen características similares apropiados y se pueden ajustar para registrar adecuadamente las respuestas CMAP y MUNE. LAdicionalmente, plataformas electrofisiológicas estándar se pueden montar para registrar adecuadamente CMAP y MUNE, pero la interfaz puede ser necesario ajustar la facilidad de ajuste de la estimulación y la rápida identificación de las respuestas CMAP y SMUP.
Hemos utilizado anteriormente las técnicas de la CMAP y MUNE descrito aquí para permitir una evaluación rápida y reproducible del ciático músculo inervado de la extremidad posterior en ratones durante el periodo postnatal temprano a la edad adulta 5. Estas técnicas permiten la evaluación en modelos de ratón, cuando las pruebas de comportamiento para el funcionamiento del motor no es posible o es menos fiable. La aplicación de esta técnica a ratones recién nacidos facilita el estudio del desarrollo de unidades motoras y tiene el potencial de ampliar nuestra comprensión de la inervación de las neuronas motoras y la poda. Por ejemplo, hemos demostrado que el número de unidades motoras funcionales grabadas con MUNE se incrementará durante la poda de polyneuronal a la inervación mononeuronal durante las dos primeras semanass de la vida en ratones recién nacidos 5. La capacidad para poner a prueba los ratones durante largos períodos de tiempo con esta técnica se presta al estudio de la respuesta de la unidad de motor a la lesión del nervio periférico, trastornos neuromusculares hereditarias y el envejecimiento.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
WDA is supported by grant funding from NIH-NICHD (5K12HD001097-17) and Cure SMA. SJK is supported by grant funding from NINDS (K08NS067282 and U01NS079163).
Materiales
| Name | Company | Catalog Number | Comments |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Synergy T2 EMG system | Natus Neurology | Model no longer available | portable electrodiagnostic system |
| monopolar needles 28 G | Teca | 017K121 | cathode and anode stimulating electrodes |
| Alpine Biomed Digital Ring Electrode with twisted wires and 1.5 mm TP connectors. | Alpine Biomed | 9013S0312 | recording electrodes |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Spectra 360 Electrode Gel | Parker Laboratories | 9013G5012 | applied to reduce skin impedance |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| EMG needle cable | Teca | 902-RLC-TP | to connect monopolar electrodes to electrodiagnostic stimulator |
| Disposable 2" x 2" Electrode or similar trimmed as needed | Carefusion | 019-415000 | ground electrode |
| Small Heating Plate with built-in RTD sensor, 15 x10 cm | World Precision Instruments | 61830 | warming plate used with animal temperature controller to transmit heat to animal |
| Silicone pad for use with ATC2000 | World Precision Instruments | 503573 | conductive removable pad to cover warming plate for easy cleaning |
| Animal temperature controller | World Precision Instruments | ATC2000 | low noise animal heating system for maintaining animal temperature |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Referencias
- McComas, A. J., Fawcett, P. R., Campbell, M. J., Sica, R. E. Electrophysiological estimation of the number of motor units within a human muscle. Journal of neurology, neurosurgery, and psychiatry. 34 (2), 121-123 (1971).
- Shefner, J. M. Motor unit number estimation in human neurological diseases and animal models. Clinical Neurophysiology. 112 (6), 955-964 (2001).
- Shefner, J. M., Cudkowicz, M. E., Brown, R. H. Comparison of incremental with multipoint MUNE methods in transgenic ALS mice. Muscle & Nerve. 25 (1), 39-42 (2002).
- Shefner, J. M., Cudkowicz, M., Brown, R. H. Motor unit number estimation predicts disease onset and survival in a transgenic mouse model of amyotrophic lateral sclerosis. Muscle Nerve. 34 (5), 603-607 (2006).
- Arnold, W. D., et al. Electrophysiological Biomarkers in Spinal Muscular Atrophy: Preclinical Proof of Concept. Annals of clinical and translational neurology. 1 (1), 34-44 (2014).
- Li, J., et al. A comparison of three electrophysiological methods for the assessment of disease status in a mild spinal muscular atrophy mouse model. PloS one. 9 (10), e111428(2014).
- Srivastava, A. K., et al. Mutant HSPB1 overexpression in neurons is sufficient to cause age-related motor neuronopathy in mice. Neurobiology of disease. 47 (2), 163-173 (2012).
- Yalvac, M., Arnold, E., D, W., Hussain, S. R., et al. VIP-expressing dendritic cells protect against spontaneous autoimmune peripheral polyneuropathy. Molecular therapy: the journal of the American Society of Gene Therapy. 22 (7), 1353-1363 (2014).
- Gooch, C. L., et al. Motor unit number estimation: A technology and literature review. Muscle Nerve. 50 (6), 884-893 (2014).
- Arnold, W. D., Kassar, D., Kissel, J. T. Spinal muscular atrophy: diagnosis and management in a new therapeutic era. Muscle Nerve. , (2014).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function). Annals of Neurology. 57 (5), 704-712 (2005).
- Finkel, R. S. Electrophysiological and motor function scale association in a pre-symptomatic infant with spinal muscular atrophy type I. Neuromuscular Disorders. 23 (2), 112-115 (2013).
- Kaufmann, P., et al. Prospective cohort study of spinal muscular atrophy types 2 and 3. Neurology. 79 (18), 1889-1897 (2012).
- Arnold, W. D., Burghes, A. H. Spinal muscular atrophy: The development and implementation of potential treatments. Annals of Neurology. 74 (3), 348-362 (2013).
- Li, J., Sung, M., Rutkove, S. B. Electrophysiologic biomarkers for assessing disease progression and the effect of riluzole in SOD1 G93A ALS mice. PloS one. 8 (6), e65976-65 (2013).
- Ngo, S. T., et al. The relationship between Bayesian motor unit number estimation and histological measurements of motor neurons in wild-type and SOD1 (G93A) mice. Clin Neurophysiol. 123 (10), 2080-2091 (2012).
- Shefner, J. M. Recent MUNE studies in animal models of motor neuron disease. Supplements to Clinical neurophysiology. 60, 203-208 (2009).
- Souayah, N., Potian, J. G., Garcia, C. C., et al. Motor unit number estimate as a predictor of motor dysfunction in an animal model of type 1 diabetes. American journal of physiology Endocrinology and metabolism. 297 (3), E602-E608 (2009).
- Zhou, C., et al. A method comparison in monitoring disease progression of G93A mouse model of ALS. Amyotrophic lateral sclerosis: official publication of the World Federation of Neurology Research Group on Motor Neuron Diseases. 8 (6), 366-3672 (2007).
- Feng, X. H., Yuan, W., Peng, Y., Ss Liu, M., Cui, L. Y. Therapeutic effects of dl-3-n-butylphthalide in a transgenic mouse model of amyotrophic lateral sclerosis. Chinese medical journal. 125 (10), 1760-1766 (2012).
- Mancuso, R., Santos-Nogueira, E., Osta, R., Navarro, X. Electrophysiological analysis of a murine model of motoneuron disease. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology. 122 (8), 1660-1670 (2011).
- Lee, Y. i, Mikesh, M., Smith, I., Rimer, M., Thompson, W. Muscles in a mouse model of spinal muscular atrophy show profound defects in neuromuscular development even in the absence of failure in neuromuscular transmission or loss of motor neurons. Developmental biology. 356 (2), 432-444 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados