Method Article
Nombre électrophysiologique Motor Unit Estimation (MUNE) Mesure composé Muscle Potentiel d'action (CMAP) dans les muscles de souris membres postérieurs
Dans cet article
Résumé
Nous présentons raffinés protocoles qui permettent à la surveillance in vivo de la fonction de l'unité de moteur dans la souris. Techniques pour mesurer le potentiel d'action composé de muscle (CMAP) et le numéro de bloc moteur estimation (MUNE) dans les muscles des membres postérieurs de la souris innervés par le nerf sciatique sont décrits.
Résumé
Compound muscle action potential (CMAP) and motor unit number estimation (MUNE) are electrophysiological techniques that can be used to monitor the functional status of a motor unit pool in vivo. These measures can provide insight into the normal development and degeneration of the neuromuscular system. These measures have clear translational potential because they are routinely applied in diagnostic and clinical human studies. We present electrophysiological techniques similar to those employed in humans to allow recordings of mouse sciatic nerve function. The CMAP response represents the electrophysiological output from a muscle or group of muscles following supramaximal stimulation of a peripheral nerve. MUNE is an electrophysiological technique that is based on modifications of the CMAP response. MUNE is a calculated value that represents the estimated number of motor neurons or axons (motor control input) supplying the muscle or group of muscles being tested. We present methods for recording CMAP responses from the proximal leg muscles using surface recording electrodes following the stimulation of the sciatic nerve in mice. An incremental MUNE technique is described using submaximal stimuli to determine the average single motor unit potential (SMUP) size. MUNE is calculated by dividing the CMAP amplitude (peak-to-peak) by the SMUP amplitude (peak-to-peak). These electrophysiological techniques allow repeated measures in both neonatal and adult mice in such a manner that facilitates rapid analysis and data collection while reducing the number of animals required for experimental testing. Furthermore, these measures are similar to those recorded in human studies allowing more direct comparisons.
Introduction
Moteur numéro d'unité estimation (MUNE) a été initialement décrit par McComas et al. Il ya 1 plus de trois décennies. La technique originale est une modification du potentiel d'action musculaire composé (CMAP) Technique d'enregistrement qui utilise une augmentation progressive de la stimulation afin d'obtenir des incréments sous-maximales. Ces augmentations ont été additionnées et moyennées pour déterminer une taille d'environ un potentiel de l'unité de moteur unique (SMUP). Cette taille a été divisée en réponse CMAP pour estimer le nombre d'unités motrices innervant le muscle testé. Après la description originale, de nombreuses variations à l'aide de deux réponses électrophysiologiques et vigueur progressive des mesures (mécaniques) ont été utilisés dans les deux études humaines et des modèles animaux 2. La technique MUNE a été modifié par Shefner et ses collègues d'enquêter sur des modèles murins de la sclérose latérale amyotrophique (SLA) 3, 4.
Dans la description actuelle, nous détaillons simplifIED modifications des techniques MUNE qui sont rapides à effectuer. Surtout, le CMAP et MUNE permettent des mesures fiables dans les deux souris néonatales et adultes 5-8. Individus expérimentés peuvent effectuer ces mesures en 10-20 min par animal, et des mesures répétées sont réalisables qui permet l'acquisition de données longitudinales 5. Dans les études actuelles, nous employons un système électrodiagnostique clinique. Dans notre expérience, les systèmes électrodiagnostiques cliniques sont optimisés pour la capture rapide et efficace des données électrophysiologiques in vivo, les plates-formes électrophysiologiques néanmoins standard peuvent être facilement adaptés pour cette application.
Protocole
Ce protocole a été approuvé par et adhère aux soins des animaux et de l'éthique des lignes directrices de l'Université Wexner Medical Center Ohio State.
1. Préparation des animaux et anesthésie
- Porter des gants lors de la manipulation des souris.
- Anesthésier la souris avec l'isoflurane inhalé et le placer dans la position couchée. Induire une anesthésie en utilisant 3-5% d'isoflurane et de 1 L par débit O 2 minutes. Après l'induction de l'anesthésie, maintenir l'anesthésie à 2-3% et 1 L par débit O 2 minutes.
- Régler O 2 flux et le pourcentage de l'isoflurane pour l'anesthésie adéquates selon l'état de la maladie, l'âge et le taux de respiration de l'animal. Animaux plus petits ou plus faibles peuvent nécessiter moins isoflurane pour une anesthésie adéquate (ie 1,5 2,5% de l'isoflurane).
- Confirmez anesthésie adéquate en appliquant une pression du coussinet plantaire de la patte arrière la lumière avec un objet tel qu'une pince pour démontrer un manque de réponse de retrait.;
- Maintenir la température à 37 ° C la température de surface avec une plaque chauffante thermostatique variation de température peut affecter la taille et la durée CMAP.
- Appliquer une pommade à base de pétrole vétérinaire pour les yeux pour prévenir la sécheresse. Surveiller le niveau de l'anesthésie en observant le taux de respiration et de l'évaluation des réponses de sevrage suivants pression appliquée sur le patin de pied par forceps.
- Enlever les poils de la patte arrière à étudier l'aide de tondeuses. Après l'enlèvement de cheveux de la patte arrière (s) d'être étudié, prolonger légèrement les membres postérieurs au niveau du genou, enlever sur les hanches, apposer sur la surface de travail avec du ruban adhésif (comme le montre la figure 1).
- Après les enregistrements et l'arrêt de l'anesthésie CMAP et MUNE, ne pas laisser l'animal sans surveillance tant qu'il a repris conscience suffisante pour maintenir décubitus sternal. Ne pas retourner animal à la compagnie d'autres animaux jusqu'à guérison complète.
2. Rent installation et de l'équipement
- Placer les électrodes pour les enregistrements MUNE CMAP et comme illustré sur la figure 1.
- Utilisez deux électrodes annulaires fines pour les électrodes d'enregistrement.
- Placez l'actif (E1) électrode en anneau sur la peau recouvrant la partie proximale du muscle jumeau de la patte postérieure, à l'articulation du genou, et l'électrode de référence (E2) de l'anneau sur la peau sur la partie mi-métatarsien du pied.
- Afin de réduire l'impédance, manteau de la peau sous-jacente aux électrodes annulaires avec du gel pour saturer les cheveux suffisamment résiduelle et maximiser le contact électrode-peau. Éviter l'application excessive de gel de l'électrode car cela pourrait provoquer un pont électrique entre les électrodes et pourrait empêcher l'enregistrement précis.
- Pour la stimulation du nerf sciatique à la patte arrière proximale, utilisez deux isolé 28 g aiguilles monopolaires que la cathode et l'anode. Insérez la cathode dans la région de la patte arrière proximale et insérez le anode plus proximale dans le tissu sous-cutané recouvrant le sacrum.
- Evitez d'insérer les électrodes de stimulation trop proches du nerf sciatique ou trop profondes qu'il serait directement blessure du nerf sciatique ou une autre structure. La figure 1 illustre le placement des électrodes.
- Pour l'électrode de masse, placer une électrode de surface disponible sur le membre postérieur controlatéral ou la queue.
3. Acquisition de données
- CMAP sciatique
- Obtenir des réponses sciatiques CMAP en stimulant le nerf sciatique avec des impulsions rectangulaires de 0,1 ms durée et l'intensité allant de 1-10 mA.
- Acquérir réponses CMAP avec l'augmentation de l'intensité du stimulus jusqu'à ce que l'amplitude de la réponse plus augmente. Ensuite, afin d'assurer une stimulation supramaximale, augmenter la stimulation à ~ 120% de l'intensité de stimulation utilisé pour obtenir une réponse maximale et obtenir une réponse supplémentaire. Si il n'y a pas encore augmenter in la taille CMAP, enregistrer cette réponse que le CMAP maximale.
- Enregistrez référence à pic et pic-à-crête amplitudes CMAP en mV (figure 2).
- Moyenne simple Potentiel Motor Unit (SMUP) Taille et MUNE Calcul
- Déterminer le potentiel unique de l'unité de moteur (SMUP) de taille moyenne avec une technique de stimulation incrémentale 1. Pour obtenir des réponses supplémentaires, offrir une stimulation sous-maximal d'une durée de 0,1 ms à une fréquence de 1 Hz tout en augmentant l'intensité de 0,03 mA étapes pour obtenir les minimes tout ou rien réponses. Obtenir la réponse initiale avec l'intensité du stimulus entre 0,21 et 0,70 mA mA.
- Si la réponse initiale ne se produit pas avec l'intensité du stimulus entre 0,21 mA et 0,70 mA, ajuster la position de la cathode stimulant soit plus près ou plus loin de la position du nerf sciatique dans la cuisse proximale pour diminuer ou augmenter l'intensité du stimulus nécessaire, respectivement.
- Si l'i initialeréponse évolution graduelle est obtenu avec une intensité du stimulus entre 0,21 mA et 0,70 mA et remplit les critères mentionnés ci-dessous (3.2.2), de stocker et enregistrer incréments supplémentaires avec l'augmentation de l'intensité de relance de réglage par pas de 0,03 mA pour obtenir un total de 9 incréments supplémentaires répondre aux critères établis.
- Pendant les mesures des réponses supplémentaires, veiller à ce que chaque incrément répond aux critères suivants.
- Assurez-vous que le pic initiale négative des réponses supplémentaires est aligné temporellement dans le pic négatif de la réponse de la CMAP maximale présentée comme la partie ombrée de l'illustration CMAP à la figure 2.
- Assurez-vous que chaque réponse incrémentale est stable et sans fractionnement, établi en observant trois réponses en double. Distinguer les réponses visuellement supplémentaires en temps réel (en surimpression sur les augmentations enregistrées précédemment).
Remarque: Chaque incrément devrait être visuellement distincteet plus large par rapport à la réponse précédente (figure 3). Analyse en temps réel permet la reconnaissance de plus grande amplitude des réponses (différentiels) par rapport à des réponses antérieures, et de petits changements imputables au bruit de fond peut être négligée. Une vue superposée de 10 incréments est montré dans la figure 4 (B et D) pour illustrer davantage ce point. - Après avoir confirmé visuellement chaque incrément, veiller à ce que la différence amplitude mesurée (confirmé réponse amplitude de la réponse avant = différence d'amplitude) est d'au moins 25 mV.
- Si l'augmentation est inférieure à 25 mV, le jeter et re-mesurer la réponse. Après l'enregistrement de 10 réponses supplémentaires, évaluer les incréments de sorte que l'amplitude de chaque réponse individuelle supplémentaire ne dépasse pas un tiers de la somme de tous les incréments de dix (par exemple l'amplitude totale de la réponse finale). Si cette condition est pas remplie, re-mesurer les réponses supplémentaires.
- La moyenne des 10 valeurs incrémentielles de donner une estimation de l'amplitude moyenne unique potentiel de bloc moteur (SMUP) (Figure 3). Remarque: La figure 3 détaille le mode de calcul de moyenne SMUP, mais l'amplitude de SMUP moyenne peut être simplement obtenu en divisant l'ensemble de la réponse amplitude incrémentielle finale par le nombre total d'incréments (par exemple, 10).
Exemples de calcul de SMUP individuelles (représentées sur la figure 3):
SMUP une amplitude de 1 incrément = crête-à-crête
SMUP 1 = 0,050 mV
SMUP 2 (amplitude crête-à-crête de l'accroissement 2) = - (amplitude crête-à-crête de l'accroissement 1)
SMUP 2 = 0,150 mV 0,050 mV = 0,100 mV- Calculer chaque incrément ultérieur (jusqu'à un total de 10), et faire une moyenne des dix incréments.
- Calculer MUNE en divisant l'amplitude maximale CMAP (crête-à-crête) par l'amplitude moyenne de SMUP (crête à crête). (MUNE = CMAP / SMUP moyenne). Dans certains systèmes électrophysiologiques, les incréments de SMUP sont mesurés en mV alors CMAP est généralement fournie en mV. Lorsque cela est nécessaire, convertir les résultats CMAP et SMUP à des unités similaires avant le calcul MUNE.
- Déterminer le potentiel unique de l'unité de moteur (SMUP) de taille moyenne avec une technique de stimulation incrémentale 1. Pour obtenir des réponses supplémentaires, offrir une stimulation sous-maximal d'une durée de 0,1 ms à une fréquence de 1 Hz tout en augmentant l'intensité de 0,03 mA étapes pour obtenir les minimes tout ou rien réponses. Obtenir la réponse initiale avec l'intensité du stimulus entre 0,21 et 0,70 mA mA.
Résultats
Les techniques de CMAP et MUNE décrits dans le présent rapport permettre l'enregistrement de la fonction neuromusculaire des muscles innervés sciatiques des pattes postérieures en utilisant le placement des électrodes minimalement invasive (Figure 1). Supramaximale CMAP taille, qui représente le rendement total à partir d'un groupe de muscles, peut être décrit à l'aide des paramètres d'amplitude et de zone (figure 2), cependant, dans les procédés actuels, on utilise l'amplitude de quantifier la CMAP et les tailles de SMUP. Etant donné que les mesures d'intervention CMAP sommées dépolarisation des fibres musculaires dans un muscle, de la pathologie à partir de n'importe où le neurone moteur de la fibre musculaire peut entraîner une réduction de la taille CMAP. Par conséquent, le CMAP donne une excellente mesure de l'état fonctionnel totale. Comme prévu, la taille CMAP va augmenter au cours du développement 5. En raison de changements compensatoires qui peuvent survenir dénervation suivante (c.-à-garantie de germination), la taille CMAP peut être maintenue malgré processus de moteur neurou perte axonale moteur. Par conséquent, la technique de MUNE est nécessaire pour déterminer le neurone moteur ou d'entrée de l'axone au muscle ou groupe de muscles en cours de test. Enregistrement des différents incréments (Figure 3) permet une estimation de la production moyenne de simples unités motrices (taille de SMUP) de donner des informations plus détaillées sur l'état fonctionnel des unités motrices.
CMAP et MUNE peuvent être utilisés pour mesurer la fonction neuromusculaire dans différents modèles murins de la maladie neuromusculaire. Dans la figure 4, les conclusions d'une souris de contrôle des adultes et une souris adulte 11 semaines après écrasement du nerf sciatique sont contrastées. Après l'écrasement du nerf sciatique, MUNE est sévèrement réduite à 50 unités motrices fonctionnelles estimées par rapport aux résultats normaux de 278 unités motrices fonctionnelles chez la souris de contrôle. En revanche, l'amplitude CMAP chez l'animal broyé (39,6 mV ligne de base à crête, 74,9 mV crête à crête) montre seulement une légère réduction par rapport au témoin (49,0 mV à base-peak, 84,2 mV crête à crête) en raison de garanties germination.
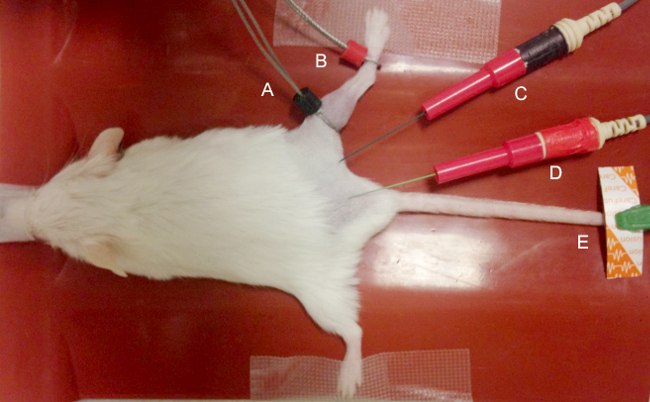
Figure 1. placement des électrodes. Le noir (E1) électrode «active» (A) et rouge (E2) électrode d'enregistrement "de référence" (B) sont placés sur les jumeaux à la partie proximale de la jumeau au niveau du genou. La cathode de stimulation (noir) (C) et l'anode (rouge) (D) sont insérés par voie sous- cutanée proximale aux électrodes d'enregistrement afin de générer des réponses distales. Une électrode de disque jetable (D) est placé sur la patte arrière, la queue ou sacrum comme un motif pour minimiser artefact. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Composé Muscle potentiel d'action. Sur la photo est une illustration d'une réponse de la CMAP représentant. (A) L'amplitude de base-à-crête est mesurée à partir de la ligne de base isoélectrique au pic initiale négative (tension négative est représentée au-dessus de la ligne de base). ( B) L'amplitude crête-à-crête est mesurée à partir de la tension négative de crête à la tension de crête positive. La zone en gris dénote la zone pic négatif. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 3. réponses incrémentaux. Deux réponses supplémentaires représentatifs sont présentés superposées et à Isolation. Pour le calcul des amplitudes de MUNE chaque incrément sont mesurées crête-à-crête. Incrément N ° 1 est le premier tout-ou-rien réponse enregistrés et représente un potentiel de l'unité de moteur unique (SMUP). Chaque augmentation subséquente (# 2-10) représente une augmentation quantique superposé sur la réponse avant. Par conséquent, pour obtenir les amplitudes SMUP pour incréments 2-10, l'amplitude de la réponse avant est soustraite de l'amplitude de l'augmentation obtenue. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 4. Exemple sciatique CMAP et MUNE. (A) de potentiel composé sciatique d'action musculaire (CMAP) chez un adulte (6 mois) de la souris de contrôle avec une amplitude de base-à-crête de 49,0 mV et à crêteamplitude de crête de 84,2 mV. La sensibilité de l'écran = 10 mV par division et la durée de l'écran 10 ms. (B) Dix réponses supplémentaires correspondants (à la souris de contrôle) avec une amplitude totale de 3.028 mV sont divisés par 10 pour déterminer la taille de SMUP moyenne (0,3028 mV). La sensibilité de l'écran = 0,5 mV et la vitesse de balayage de 1 ms par division. Calculé MUNE = 278 (MUNE = CMAP / SMUP moyenne (84,2 mV / 0,3028 mV)) (C) sciatique CMAP 11 semaines suivantes sciatique écrasement du nerf dans une souris adulte (6 mois) montrant légèrement réduit l'amplitude de base-à-crête ( 39,6 mV) et l'amplitude pic-à-pic (74,9 mV). La sensibilité de l'écran = 10 mV par division et la vitesse de balayage de 1 ms par division. (D) Dix réponses supplémentaires (à la souris avec écrasement du nerf) avec amplitude totale de pic à pic de 14,923 mV divisé par 10 correspondant à obtenir une SMUP moyenne taille de 1,4923 mV. La sensibilité de l'écran = 2 mV par division et une vitesse de balayage de 1 ms par division. Calculé MUNE = 50 (MUNE = CMAP/ SMUP moyenne (74,9 mV / 1,4923 mV)). (** Notez la sensibilité différente pour les réponses supplémentaires de la souris à l'écrasement sciatique). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
MUNE et CMAP sont des mesures cliniquement pertinentes fréquemment utilisés dans les études de recherche et dans le suivi des patients atteints de maladies neuromusculaires comme la SLA et l'atrophie musculaire spinale (SMA) 9, 10. Par exemple, dans SMA, CMAP et MUNE sont bien corrélés avec l'âge, la gravité et clinique mesures de la fonction 10-14. Ces deux mesures sont minimalement invasive et permettent évaluation de la fonction longitudinalement dans le même individu. Fait important, ces mesures ne peuvent pas mesurer l'activation ou le recrutement de l'unité de moteur par les motoneurones corticaux, mais ils fournissent une évaluation cliniquement pertinente de l'intégrité du neurone moteur et son équivalent fonctionnel, l'unité de moteur.
Les modèles animaux de maladie neuromusculaire sont essentiels à la compréhension des mécanismes pathogènes de la maladie humaine et le développement préclinique des agents thérapeutiques potentiellement efficaces. La capacité à traduire les mesures des résultats et des biomarqueurs qui peuvent êtreutilisé à travers les espèces peuvent faciliter et accélérer l'application des résultats précliniques prometteurs à des essais cliniques humains. Plusieurs groupes ont déjà utilisé les deux mesures électrophysiologiques et de force (mécaniques) pour estimer la fonction de bloc moteur dans des modèles de souris 2-4, 15-22. En raison de la relative complexité des mesures, nous avons affiné ces techniques dans un format visuel pour permettre une utilisation plus répandue et la mise en œuvre chez la souris. Le format de la vidéo de démonstration et de l'instruction, permet étapes clés de la procédure à être mis en évidence et les pièges potentiels qui seront abordés. L'application de ces techniques à des essais précliniques de thérapies potentielles dans les maladies du motoneurone peut améliorer la traduction des thérapies putatives de souris à la maladie humaine.
Il ya plusieurs étapes critiques dans le processus d'acquisition des réponses CMAP et MUNE. Le placement des électrodes d'enregistrement appropriée et cohérente et le contact de l'électrode suffisant avec la bichemembres sont essentiels pour la mesure reproductible de l'amplitude et de diminuer le bruit de fond. Par conséquent, un contact étroit entre la peau derrière des membres et des électrodes doit être constamment confirmée. Nous avons trouvé que des électrodes de surface et offrent CMAP MUNE enregistrements plus cohérente que les électrodes à aiguilles. En raison de tissus sous-cutanés très minces, de petits mouvements de surface d'enregistrement de l'aiguille peuvent conduire à grande variation dans amplitudes CMAP. En outre, la nature plus envahissante des électrodes aiguilles est pas optimale pour les souris néonatales ou des études longitudinales en raison de la perturbation de potentiel musculaire et des blessures. Un inconvénient potentiel de l'électrode, des enregistrements de surface non sélectifs concerne la possibilité de résolution réduite si le phénotype de muscle particulier est plus ou moins impliqués par rapport à un autre, ce qui a été rapporté dans un modèle de souris ALS 21.
L'acquisition de la taille moyenne des SMUP est techniquement plus difficile par rapport à la CMAP. En raison des petites responstaille de e (dans la gamme de mV plutôt que mV) bruit de fond peut être plus problématique. Le bruit de fond peut être réduite en ajustant l'électrode de masse, la cathode, l'anode, et de vérifier un autre équipement électrique à proximité de l'installation expérimentale. Une cage de Faraday, typiquement utilisé pour des applications d'électrophysiologie intracellulaire, est pas nécessaire. Détermination visuelle des réponses individuelles de SMUP est la compétence la plus difficile à acquérir et prend la pratique pour des résultats cohérents avec une bonne reproductibilité. Il est important de veiller à ce que les SMUPs qui sont enregistrées à l'intérieur initier la durée de la réponse maximale du CMAP. Nous avons défini des critères d'acceptation des réponses individuelles supplémentaires pour rendre ce processus plus simple à réaliser et à augmenter la fiabilité intra- et inter-évaluateur.
Un inconvénient potentiel de la technique MUNE incrémentale inclut la possibilité de surestimer le nombre d'unités motrices fonctionnelles dues à l'alternance de motounités de r. Nous avons utilisé une technique similaire à Shefner et al. en ce que chaque réponse doit être considérée de manière reproductible un total de 3 fois de réduire l'impact de ce phénomène 3.
Dans notre expérience, les systèmes électrodiagnostiques cliniques sont optimisés pour les études décrites ici grâce à l'amélioration ergonomie des interfaces du système examinateur-électrodiagnostique permettant la facilité de contrôle. Le système à deux canaux utilisé dans notre laboratoire est équipé de deux canaux d'amplification non-commuté en utilisant un amplificateur à 24 bits convertisseur analogique-numérique et un taux de 48 kHz par voie d'échantillonnage. Gain de matériel peut être ajustée de 10nV à 100 mV / division. Le filtre basse fréquence a une portée de 0,2 Hz à 5 kHz, et les paramètres de filtre haute fréquence varie de 30 Hz-10 kHz. Un stimulateur à courant constant est utilisé (intensité: 0-100 mA; durée: 0,02-1 ms). La plupart des systèmes cliniques ont des caractéristiques similaires appropriés et peuvent être ajustés pour enregistrer correctement les réponses CMAP et MUNE. UNn outre, les plates-formes électrophysiologiques standard peuvent être assemblés pour enregistrer adéquatement CMAP et MUNE, mais l'interface peut être nécessaire d'ajuster pour la facilité d'ajustement de la stimulation et l'identification rapide des réponses CMAP et SMUP.
Nous avons déjà utilisé les techniques de CMAP et MUNE décrit ici pour permettre une évaluation rapide et reproductible de la sciatique musculaire innervée de la patte postérieure chez la souris pendant la période postnatale précoce à l'âge adulte 5. Ces techniques permettent d'évaluer des modèles de souris lors des tests de comportement pour la fonction motrice est pas possible ou est moins fiable. L'application de cette technique à des souris néonatale facilite l'étude du développement moteur de l'unité et a le potentiel d'élargir notre compréhension de neurone moteur innervation et l'élagage. Par exemple, nous avons montré que le nombre d'unités motrices fonctionnelles enregistrées avec MUNE va augmenter lors de la taille de polyneuronale innervation mononeuronal pendant les deux premières semainess de la vie chez la souris néonatale 5. La capacité à tester souris sur de longues périodes de temps avec cette technique se prête bien à l'étude de la réponse de l'unité de moteur à une lésion du nerf périphérique, des troubles neuromusculaires héréditaires et le vieillissement.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
WDA is supported by grant funding from NIH-NICHD (5K12HD001097-17) and Cure SMA. SJK is supported by grant funding from NINDS (K08NS067282 and U01NS079163).
matériels
| Name | Company | Catalog Number | Comments |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Synergy T2 EMG system | Natus Neurology | Model no longer available | portable electrodiagnostic system |
| monopolar needles 28 G | Teca | 017K121 | cathode and anode stimulating electrodes |
| Alpine Biomed Digital Ring Electrode with twisted wires and 1.5 mm TP connectors. | Alpine Biomed | 9013S0312 | recording electrodes |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Spectra 360 Electrode Gel | Parker Laboratories | 9013G5012 | applied to reduce skin impedance |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| EMG needle cable | Teca | 902-RLC-TP | to connect monopolar electrodes to electrodiagnostic stimulator |
| Disposable 2" x 2" Electrode or similar trimmed as needed | Carefusion | 019-415000 | ground electrode |
| Small Heating Plate with built-in RTD sensor, 15 x10 cm | World Precision Instruments | 61830 | warming plate used with animal temperature controller to transmit heat to animal |
| Silicone pad for use with ATC2000 | World Precision Instruments | 503573 | conductive removable pad to cover warming plate for easy cleaning |
| Animal temperature controller | World Precision Instruments | ATC2000 | low noise animal heating system for maintaining animal temperature |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Références
- McComas, A. J., Fawcett, P. R., Campbell, M. J., Sica, R. E. Electrophysiological estimation of the number of motor units within a human muscle. Journal of neurology, neurosurgery, and psychiatry. 34 (2), 121-123 (1971).
- Shefner, J. M. Motor unit number estimation in human neurological diseases and animal models. Clinical Neurophysiology. 112 (6), 955-964 (2001).
- Shefner, J. M., Cudkowicz, M. E., Brown, R. H. Comparison of incremental with multipoint MUNE methods in transgenic ALS mice. Muscle & Nerve. 25 (1), 39-42 (2002).
- Shefner, J. M., Cudkowicz, M., Brown, R. H. Motor unit number estimation predicts disease onset and survival in a transgenic mouse model of amyotrophic lateral sclerosis. Muscle Nerve. 34 (5), 603-607 (2006).
- Arnold, W. D., et al. Electrophysiological Biomarkers in Spinal Muscular Atrophy: Preclinical Proof of Concept. Annals of clinical and translational neurology. 1 (1), 34-44 (2014).
- Li, J., et al. A comparison of three electrophysiological methods for the assessment of disease status in a mild spinal muscular atrophy mouse model. PloS one. 9 (10), e111428(2014).
- Srivastava, A. K., et al. Mutant HSPB1 overexpression in neurons is sufficient to cause age-related motor neuronopathy in mice. Neurobiology of disease. 47 (2), 163-173 (2012).
- Yalvac, M., Arnold, E., D, W., Hussain, S. R., et al. VIP-expressing dendritic cells protect against spontaneous autoimmune peripheral polyneuropathy. Molecular therapy: the journal of the American Society of Gene Therapy. 22 (7), 1353-1363 (2014).
- Gooch, C. L., et al. Motor unit number estimation: A technology and literature review. Muscle Nerve. 50 (6), 884-893 (2014).
- Arnold, W. D., Kassar, D., Kissel, J. T. Spinal muscular atrophy: diagnosis and management in a new therapeutic era. Muscle Nerve. , (2014).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function). Annals of Neurology. 57 (5), 704-712 (2005).
- Finkel, R. S. Electrophysiological and motor function scale association in a pre-symptomatic infant with spinal muscular atrophy type I. Neuromuscular Disorders. 23 (2), 112-115 (2013).
- Kaufmann, P., et al. Prospective cohort study of spinal muscular atrophy types 2 and 3. Neurology. 79 (18), 1889-1897 (2012).
- Arnold, W. D., Burghes, A. H. Spinal muscular atrophy: The development and implementation of potential treatments. Annals of Neurology. 74 (3), 348-362 (2013).
- Li, J., Sung, M., Rutkove, S. B. Electrophysiologic biomarkers for assessing disease progression and the effect of riluzole in SOD1 G93A ALS mice. PloS one. 8 (6), e65976-65 (2013).
- Ngo, S. T., et al. The relationship between Bayesian motor unit number estimation and histological measurements of motor neurons in wild-type and SOD1 (G93A) mice. Clin Neurophysiol. 123 (10), 2080-2091 (2012).
- Shefner, J. M. Recent MUNE studies in animal models of motor neuron disease. Supplements to Clinical neurophysiology. 60, 203-208 (2009).
- Souayah, N., Potian, J. G., Garcia, C. C., et al. Motor unit number estimate as a predictor of motor dysfunction in an animal model of type 1 diabetes. American journal of physiology Endocrinology and metabolism. 297 (3), E602-E608 (2009).
- Zhou, C., et al. A method comparison in monitoring disease progression of G93A mouse model of ALS. Amyotrophic lateral sclerosis: official publication of the World Federation of Neurology Research Group on Motor Neuron Diseases. 8 (6), 366-3672 (2007).
- Feng, X. H., Yuan, W., Peng, Y., Ss Liu, M., Cui, L. Y. Therapeutic effects of dl-3-n-butylphthalide in a transgenic mouse model of amyotrophic lateral sclerosis. Chinese medical journal. 125 (10), 1760-1766 (2012).
- Mancuso, R., Santos-Nogueira, E., Osta, R., Navarro, X. Electrophysiological analysis of a murine model of motoneuron disease. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology. 122 (8), 1660-1670 (2011).
- Lee, Y. i, Mikesh, M., Smith, I., Rimer, M., Thompson, W. Muscles in a mouse model of spinal muscular atrophy show profound defects in neuromuscular development even in the absence of failure in neuromuscular transmission or loss of motor neurons. Developmental biology. 356 (2), 432-444 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon