Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microfluidic genipina Deposición Técnica de Cultura extendido de micropatterned vasculares musculares Thin Films
En este artículo
Resumen
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Resumen
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Introducción
Las enfermedades vasculares, tales como vasoespasmo cerebral 1,2, hipertensión 3, 4 y la aterosclerosis, se desarrollan lentamente, son típicamente de naturaleza crónica, e implican disfuncional fuerza generación por las células del músculo liso vascular (CMLV). Nuestro objetivo es estudiar estos lento que progresan disfunciones vasculares utilizando métodos in vitro con un mayor control de las condiciones experimentales que en modelos in vivo. Hemos desarrollado previamente películas finas musculares vasculares (vMTFs) para la medición de la contractilidad funcional de in vitro diseñados tejidos cardiovasculares 5, pero este método se ha limitado a relativamente estudios a corto plazo. A continuación, presentamos una técnica de modificación del sustrato que se expande nuestra técnica anterior vMTF para mediciones a largo plazo.
Mientras que el endotelio es también crítico en la función vascular en general, laminillas arterial ingeniería proporcionan un sistema modelo útil para evaluar los cambios en vascularcontractilidad durante la progresión de la enfermedad. Para diseñar un modelo de tejido de la enfermedad vascular funcional, tanto la estructura y la función de la lámina arterial, la unidad contráctil básico de la embarcación, se debe recapitula con alta fidelidad. Laminillas arterial son láminas concéntricas, circunferencialmente alineados de CMLV contráctiles separadas por láminas de elastina 6. La impresión por microcontacto de (ECM), las proteínas de la matriz extracelular sobre sustratos de polidimetilsiloxano (PDMS) se ha utilizado anteriormente para proporcionar señales de orientación para la organización del tejido para imitar alineado tejido cardiovascular 5,7-10. Sin embargo, los tejidos modelados utilizando impresión por microcontacto puede perder la integridad después de 3-4 días de cultivo, lo que limita su aplicabilidad en estudios crónicos. Este protocolo proporciona una solución a este problema mediante la sustitución de las técnicas de impresión por microcontacto anteriores con una nueva técnica de deposición de microfluidos.
Genchi et al. PDMS sustratos modificados con genipina y found prolongada viabilidad de miocitos hasta un mes en la cultura 11. Aquí, se utiliza un enfoque similar para extender la cultura de las células del músculo liso vascular estampadas en PDMS. Genipina, un derivado hidrolítica natural de la fruta gardenia, es un candidato deseable para la modificación de sustrato debido a su toxicidad relativamente baja en comparación con agentes de reticulación similares y su creciente uso como un biomaterial en los campos de la reparación de tejidos y la modificación 12,13 ECM 14, 15. En este protocolo, la fibronectina se utiliza como una señal de orientación celular, como en métodos de impresión por microcontacto anteriores; sin embargo, genipina se deposita sobre PDMS sustratos antes de patrón fibronectina. Por lo tanto, como las células degradan la matriz de estampado, ECM recién sintetizado a partir de CMLV adjuntos se puede unir al sustrato PDMS genipina-revestido.
Este protocolo utiliza un dispositivo de suministro de microfluidos para el de dos pasos genipina y ECM deposición. El diseño de la microfluidos imita dispositivo microcopatrones de impresión ntact utilizados para laminillas arterial ingeniería en estudios previos 16. Por lo tanto, esperamos que este protocolo para dar imita laminillas arterial que recapitular con éxito el alineado altamente en la estructura y la función contráctil vivo de laminillas arterial. También evaluamos la contractilidad del tejido que confirmar que genipina es un compuesto de modificación sustrato adecuado para largo plazo en modelos de enfermedades vasculares in vitro.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Nota: El objetivo de este protocolo es para construir y utilizar una película vascular musculares delgados (vMTF) con la estructura mostrada en la Figura 1 para evaluar la contractilidad durante el cultivo prolongado de células de músculo liso vascular (CMLV) sobre sustratos de PDMS. Para prolongar la viabilidad CMLV, utilizamos la genipina compuesto reticulante. Los sustratos para estos vMTFs están diseñados para analizar la contractilidad del tejido desarrollado por Grosberg et al. 8 Otros métodos vMTF 5 también pueden utilizarse, con cambios sutiles en el protocolo de fabricación sustrato presentado.
Fabricación 1. Sustrato
- Limpieza Coverslip
- Coloque 25 mm cubreobjetos de vidrio de diámetro en un rack tinción cubreobjetos. Coloque la parrilla en un gran vaso de precipitados o recipiente (por ejemplo, un vacío 100 -. 1000 l pipeta contenedor punta).
- Añadir etanol al 70% al recipiente para sumergir totalmente los cubreobjetos. Sonicar durante al menos 30 min.
- Retire el bastidor cubreobjetos de la solución de etanol. Permitir los cubreobjetos se sequen al aire en la horca el rack en una campana de cultivo estéril (para evitar la acumulación de partículas en cubreobjetos) de 1- 2 horas.
Nota: Los cubreobjetos deben estar completamente seco antes de los siguientes pasos.
- Poli (N-iso-propilacrilamida) Aislamiento (PIPAAm) Gaza el Coverslip
- El uso de cinta adhesiva, cinta de los lados de un cubreobjetos limpio, dejando una tira expuesta centrado en el cubreobjetos (Figura 1A). Modificar el ancho de esta franja expuesta basada en la aplicación y / o el diseño de microfluidos.
- Marque los bordes de las tiras de cinta sobre el cubreobjetos utilizando un marcador de laboratorio para su posterior consulta (Figura 1).
- Corte alrededor del perímetro del cubreobjetos para liberar de la antena (Figura 1A, línea roja punteada).
- El poli (N-iso-propilacrilamida) (PIPAAm) Recubrimiento
- Usando una balanza analítica, pesar 1 g de PIPolvo PAAm. No utilice sin polimerizar N-iso-propilacrilamida, que es un carcinógeno.
- Transferir el PIPAAm a un tubo de centrífuga de 50 ml. Añadir 10 ml de 1-butanol dentro de una campana química para producir un 10% w solución / v. PRECAUCIÓN: El punto de inflamación de 1-butanol es de 37 o C. Almacenar la solución resultante en un armario inflamable y evitar el calentamiento.
- Permitir que el PIPAAm se disuelva durante 10 min. Si el polvo es aún visible, mezclar la solución con un vórtice mezclador hasta que todas polvo se disuelva.
Nota: Los siguientes pasos requieren el uso de un revestidor de giro. Para cada cubreobjetos: - Coloque el cubreobjetos grabada en el mandril recubridora de rotación con pinzas.
- Transferir 150 l de solución de PIPAAm en el cubreobjetos mediante la colocación de las gotitas a lo largo del vaso expuesto en el centro del cubreobjetos. Asegurar una cobertura completa de la zona expuesta.
- Escudo de Spin PIPAAm utilizando la siguiente receta:
- Rampa 10 seg a 3.000 rpm. Medita durante 5 segundos.
- Rampa de 10 segundos a 6,000 rpm. Medita durante 60 segundos.
- Rampa 10 seg a 3.000 rpm. Medita durante 5 segundos.
- Coloque el cubreobjetos en una placa de Petri cubierto con la PIPAAm hacia arriba. Deje que se seque al aire durante al menos 15 min.
- Retire cuidadosamente la cinta adhesiva de todos los cubreobjetos, dejando el cubreobjetos completa expuesta con una fina capa de recubrimiento PIPAAm en una franja central.
- PDMS Recubrimiento
- Mezclar y desgasificar 15 g de PDMS en una proporción de 10: reticulante: base 1. Añadir 7 - 8 gotas de sonicadas 0,2 micras microperlas fluorescentes antes de la mezcla. Cubra la taza de PDMS con papel de aluminio cuando no esté en uso para evitar que el polvo y otras partículas contaminen el PDMS.
Nota: Los siguientes pasos requieren el uso de un revestidor de giro. Para cada cubreobjetos: - Coloque un cubreobjetos recubiertos de PIPAAm en el mandril recubridora de rotación con pinzas.
- Transferencia de PDMS en el cubreobjetos, que cubre al menos un tercio de la zona cubreobjetos.
- Escudo de la vuelta utilizando la siguiente recipe:
- Rampa 5 segundos a 500 rpm. Medita 5 seg.
- Rampa 5 seg a 1.000 rpm. Medita 5 seg.
- Rampa 10 seg a 3.000 rpm. Medita 10 seg.
- Rampa 10 segundos a 4.000 rpm. Medita 60 seg.
- Rampa 10 segundos a 2.000 rpm. Medita 15 seg.
- Rampa 10 seg a 1.000 rpm. Medita 10 seg.
- Rampa 5 segundos a 500 rpm. Medita 5 seg.
- Coloque el cubreobjetos en una placa de Petri cubierto con el PDMS hacia arriba. Registre el momento en que el cubreobjetos era spin revestido. No pierda de vista el tiempo asociado a cada cubreobjetos durante todo el experimento para su uso posterior en la determinación del espesor del sustrato PDMS.
- Coloque la placa de Petri que contiene los cubreobjetos en un horno de 90 ° C durante al menos 1,5 horas para asegurar el curado PDMS adecuada. Si un horno no está disponible, deje que los cubreobjetos curan por lo menos durante 48 horas a temperatura ambiente.
- Quitar los cubreobjetos del horno y guardarlos en un cajón oscuro hasta que esté listo para su uso.
- Ponga a un lado todos los cubreobjetos cuarto fo medición posterior de grosor del sustrato, como una función del tiempo de recubrimiento por rotación, con un perfilómetro.
- Mezclar y desgasificar 15 g de PDMS en una proporción de 10: reticulante: base 1. Añadir 7 - 8 gotas de sonicadas 0,2 micras microperlas fluorescentes antes de la mezcla. Cubra la taza de PDMS con papel de aluminio cuando no esté en uso para evitar que el polvo y otras partículas contaminen el PDMS.
2. Patrones de microfluidos para Ingeniería tejidos
- La fabricación de dispositivos de microfluidos
- Diseño de Tejidos fotomáscara Microfluidic
- Utilice cualquier programa de diseño asistido por ordenador apropiado para diseñar patrones de microfluidos. Para laminillas arterial compuesto de células musculares humanas arteria cordón umbilical liso vascular, use un patrón alternante de 10 micras canales con 10 micras paredes.
- Utilice canal binario de ramificación si es posible 17, pero otros diseños de ramificación pueden ser utilizados. Disminuir el ancho y la longitud de los canales para cada iteración de ramificación hasta lograr el patrón de tejido deseado espaciamiento (paredes y canales, Figura 1B).
- Diseñar el dispositivo para tener una sola entrada para la colocación de solución de tratamiento de superficie y una única salida para la aplicación de vacío.
- Fabricate una fotomáscara con el diseño de microfluidos (s), como se ha descrito previamente 18.
- Fotolitográfica Wafer Fabrication
Nota: Realice la fotolitografía en una sala limpia adecuado o instalación similar. Para hacer las obleas de silicio con las pautas de fabricación litográfica suave de los dispositivos de microfluidos de tejido (~ 20 a 25 micras altura del canal) usando fotolitografía:- Limpiar una oblea de silicio en acetona, metanol y alcohol isopropílico durante 1 min cada uno. Secar la oblea con una pistola de nitrógeno.
- Precocción la oblea en una placa caliente durante 5 minutos a 115 ° C para eliminar el exceso de humedad.
- Escudo de la vuelta de la oblea con SU-8 3025 fotoprotector usando la siguiente receta para dar cuenta con 20 a 25 micras de altura:
- Rampa 5 segundos a 500 rpm. Medita 5 seg.
- Rampa 15 seg a 4.000 rpm. Medita 15 seg.
- Hornear suave de la oblea en una placa caliente a 95 ° C durante 15 minutos.
- Cargar una fotomáscara, y exponer tque la oblea por 16 segundos usando un programa de contactos de vacío en un alineador de máscara de contacto.
- Duro hornear la oblea en una placa caliente a 95 ° C durante 4 min.
- Desarrollar la oblea durante 6 minutos en desarrollador. A continuación, lavar la oblea dos veces para 2 seg en el revelador fresco y enjuagar la oblea con alcohol isopropílico.
- Silanate el modelado oblea O / N mediante la colocación de 2 - 3 gotas de tridecafluoro-triclorosilano en un plato vacío en un desecador de vacío. Prop la oblea utilizando placas de Petri de modo que tanto la parte inferior y la parte superior de la oblea están expuestos.
PRECAUCIÓN: Tridecafluro-triclorosilano es un líquido inflamable y corrosivo. Equipo de protección personal adecuado y de escape local es necesaria para su uso.
- Tissue la fabricación de dispositivos de microfluidos
- Coloque un lado característica oblea modelado silanada en una placa de Petri.
- Mezclar y desgasificar 100 g de PDMS con una proporción de 10: reticulante: base 1. Vierta el PDMS en el plato, completamente y de manera uniforme que cubre la oblea.
- Coloque el plato en un desecador de vacío hasta que todas las burbujas de aire se retiran de los PDMS sin curar, aproximadamente 30 min. Curar las PDMS en el plato a 90 ° C durante al menos 1,5 h. El tiempo y la temperatura pueden ser ajustados según lo dictado por las directrices de fabricación para obtener una cura completa.
- Una vez que el PDMS se ha curado, cortar el PDMS alrededor de la oblea con una hoja de afeitar y libere cuidadosamente la oblea PDMS-cubiertas de la antena. Retire el exceso de PDMS debajo de la oblea y pele lentamente PDMS lejos de la parte superior de la oblea.
- Coloque el lado característica disco PDMS en un plato limpio y almacenar la oblea de la luz después de su uso.
- Cortar el exceso de PDMS de alrededor de los patrones usando una cuchilla de afeitar. Dispositivos cortado en formas rectangulares (Figura 1C) para facilitar la peladura del dispositivo de sustratos en pasos posteriores. Cortes precisos no son necesarios, siempre y cuando existe un amplio espacio para la entrada, salida, y el área patrón de tejido (Figura 1C).
- Poncheorificios de entrada y de salida (Figura 1C) usando un punzón de biopsia de 1 mm quirúrgica.
- Diseño de Tejidos fotomáscara Microfluidic
- Deposición de dispositivos de microfluidos
Nota: En este protocolo, la entrega de microfluidos se utiliza para depositar genipina modelado, el agente de reticulación clave para el cultivo de tejido a largo plazo, así como la fibronectina. Pasos previos a la esterilización de penicilina / estreptomicina (2.2.3) no tienen que llevarse a cabo en condiciones estériles, pero limitando la colección contaminación y el polvo se anima todo el protocolo. Todos los pasos que se producen después de la esterilización cubreobjetos con penicilina / estreptomicina (2.2.3) deben utilizar una técnica estéril. Nota: Esta parte del protocolo se debe iniciar un día antes de la siembra de células.- Sustrato y Microfluidic Dispositivo Preparación
- Sonicar los dispositivos de microfluidos en etanol al 70% durante al menos 30 min.
- Secar los dispositivos de microfluidos sonicadas usando aire comprimido o nitrógeno, y colocarlos en un plato de Petri wiº canal presenta boca arriba para evitar el desgaste innecesario de las características.
- Coloque hasta 10 cubreobjetos sustrato vMTF en un limpiador UVO (cubierta retira en el plato lo está funcionalizado la superficie) durante 8 minutos.
- Quitar los cubreobjetos tratados con UVO, y colocar la función de dispositivos de microfluidos lado hacia abajo en cada deslizamiento de una en una (orientación debe ser similar a la Figura 1C). Presione con firmeza en los dispositivos para asegurar un cierre hermético a los cubreobjetos PDMS-revestidos.
- La deposición de genipina y fibronectina
- Preparar una solución genipina 5 mg / ml mediante la adición de 1 ml de ddH 2 O estéril a un recipiente de 5 mg de liofilizado genipina. Mezclar la solución con un vórtice-mezclador. Ponga a un lado a temperatura ambiente durante al menos 30 minutos.
Nota: El polvo es difícil de solubilizar a TA, la mezcla de manera repetitiva durante al menos un minuto es a menudo necesario. - Rápidamente, colocar una gota de etanol al 70% en la entrada de cada dispositivo para el cebado dispositivo. Nota: El ethanol debe absorber a través de los dispositivos.
- Después de 5 - 10 min, aspirar cuidadosamente el exceso de etanol en la entrada, inmediatamente reemplazándolo con 1X tampón fosfato salino (PBS) en la entrada. Desde este punto en adelante, asegúrese de no permitir la entrada a convertirse completamente seco para evitar la introducción de aire en el dispositivo.
- Coloque una punta del aspirador de vacío a la salida de cada dispositivo. Dibuje 1X PBS a través de dispositivos para enjuagar etanol de distancia. Deja una pequeña cantidad de 1X PBS a la entrada. Nota: si la entrada aparece casi seco, agregar más 1X PBS.
- Aspirar el exceso de 1X PBS de manera que sólo una pequeña cantidad permanece en la entrada antes de la aplicación de la solución de genipina.
- Coloque 60 l de la solución genipina 5 mg / ml en cada entrada (Figura 1D). Dibuje la solución genipina través de los dispositivos mediante la colocación de una punta del aspirador de vacío en la salida (Figura 1D). Asegúrese de no extraer toda la solución a través, dejando una pequeña cantidad de solución en la entrada.
- Place gotas (aproximadamente del tamaño de moneda de diez centavos) de 1X PBS a tanto la entrada y la salida para mantener la humectación durante la incubación. Mueva el plato que contiene los dispositivos a un horno o incubadora humidificado (ambiente estéril no es necesario) establecidos a 37 ° C, y se incuba durante 4 horas. El plato no necesita ser cubierto.
- Durante la incubación, resuspender fibronectina a una concentración de 50 mg / ml en estéril ddH 2 O en hielo durante al menos 30 min antes de la aplicación a un dispositivo de microfluidos.
- Después de la incubación de genipina, aspirar toda 1X PBS restante en las salidas del dispositivo. Continúe aplicando un aspirador de vacío a cada punto de venta de dispositivos, tirando a través del 1X PBS restante en la entrada.
- Coloque 100 l de solución de fibronectina 50 mg / ml en cada entrada, añadiendo a una cantidad mínima de 1X PBS restante en la entrada (Figura 1D).
- Dibuje la solución de fibronectina a través de los dispositivos que usan una punta del aspirador de vacío en la salida ( Figura 1D). Asegúrese de no extraer toda la solución a través. Nota: caída de fibronectina se verá diferente que el 1X PBS y genipina debido a diferencias en la tensión superficial.
- Mueva el plato descubierto que contiene los dispositivos a un horno o incubadora a 37 ° C, y se incuba durante 24 horas. Nota: El paso fibronectina no requiere humectación de la entrada y la salida con 1X PBS. La piscina restante de fibronectina en la entrada se seque. Con ello se espera.
- Preparar una solución genipina 5 mg / ml mediante la adición de 1 ml de ddH 2 O estéril a un recipiente de 5 mg de liofilizado genipina. Mezclar la solución con un vórtice-mezclador. Ponga a un lado a temperatura ambiente durante al menos 30 minutos.
- Esterilización y preparación para la siembra de células
- Preparar una solución de penicilina / estreptomicina para la esterilización de cubreobjetos vMTF estampadas. Añadir 5 ml de penicilina / estreptomicina (10.000 unidades / ml; 10.000 g / ml) a 500 ml de 1X PBS estéril.
- Coloque el plato que contiene los dispositivos en una campana de bioseguridad estéril.
- Retire con cuidado los dispositivos de los cubreobjetos lentamente pelando el dispositivo en una esquina, mientras que la ligera agarrando el cubreobjetos en la mano opuesta.Nota: Este paso requiere de práctica para reducir el daño cubreobjetos en el proceso de eliminación. Una alternativa es usar una jeringa para inyectar 1X PBS en la entrada y / o salida para ayudar en la liberación del dispositivo.
- Coloque el cubreobjetos en placas de seis pocillos estériles. Añadir al menos 5 ml de solución de penicilina / estreptomicina a cada pocillo. Colocar las cápsulas en un incubador estéril a 37 ° C durante al menos 30 min.
- Después de la esterilización, aspirar la solución de penicilina / estreptomicina y sembrar los cubreobjetos con arteria umbilical humana cultivadas cells19 músculo liso vascular (Figura 1D). La concentración de la siembra de CMLV es ~ 80.000 células por cm2. Para reducir el número de células necesarias para cada muestra, utilizar un reductor para disminuir el área de la siembra. Un ejemplo de un reductor es la parte superior de corte de un tubo cónico de 15 ml unido a la cubreobjetos con grasa de vacío estéril antes de la siembra.
- Incubar los cubreobjetos cabezas de serie en un incubador estéril a 37 ° C y 5% de CO 2 y permitir que las células sembradas para sujetar y forman alineados imita laminillas arteriales O / N (Figura 2A-B).
- VMTF Tejido a largo plazo Cultura
- Un día después de la siembra, retire el medio celular y reductores. Enjuague los tejidos con 1X PBS. Añadir 4 ml de medio celular libre de suero para inducir un fenotipo contráctil en el CMLV 20.
- Repita el enjuague 1X PBS y adición de medio libre de suero fresco cada dos días si lo deseas para el cultivo a largo plazo.
- Sustrato y Microfluidic Dispositivo Preparación
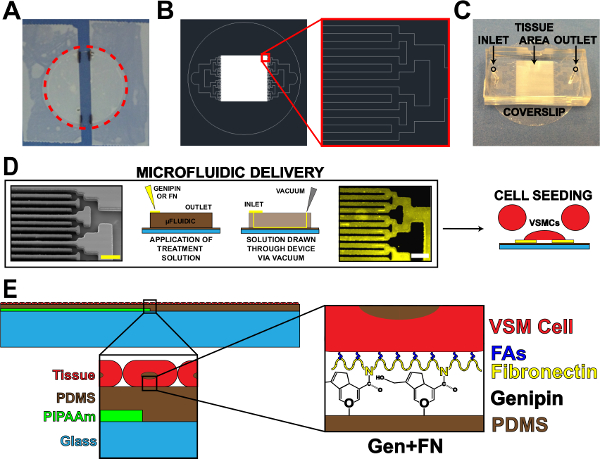
Figura 1. Dispositivo de microfluidos Proteína de entrega. (A) sujetada con cinta adhesiva de cubreobjetos para el revestimiento PIPAAm. Red círculo de puntos: Camino de corte para liberar cubreobjetos (B) Representante AutoCAD dibujo de tejido patrón de máscara de microfluidos.. Recuadro: Detalle de ramificación binaria para AlternCIONES 10 micras x 10 micras patrón de tejido. (C) La colocación del dispositivo de microfluidos en un sustrato cubreobjetos con entrada y salida indicada. (D) Esquema del patrón de proteínas de microfluidos y entrega. Imagen de microscopio electrónico de barrido de canales de microfluidos (barra de escala:: 50 micras) de izquierda a derecha; Esquemática detallada de método para la deposición de proteínas; La inmunohistoquímica de fibronectina manchado (barra de escala: 50 m); La siembra de células con células de músculo liso vascular. (E) Esquema de tejido fabricado. 1 st inserción: Detalle de la construcción en capas. 2º inserción: Detalle de modificación genipina de sustrato PDMS después de la deposición de microfluidos. © IOP Publishing. Reproducción y / o modificado con autorización. Todos los derechos reservados. 19 Por favor haga clic aquí para ver una versión más grande de esta figura.
3. Análisis de Tejidos Función con vMTF contractilidad Ensayo
Nota: El ensayo de la contractilidad MTF que aquí se presenta es el modelo de la técnica desarrollada en Grosberg et al 8.
- Experimento vMTF contractilidad
- Colocar una muestra de tejido en un plato de 100 mm. Añadir solution8 de 1X estéril Tyrode a pH 7,4 se calentó a 37 ° C para cubrir la muestra.
- Use una hoja de afeitar para hacer varios cortes paralelos perpendiculares al borde PIPAAm. Haga cortes de una manera que produce cortes de tejido más amplios que serán el vMTFs (con un ancho de ~ 2 mm) alternando con tiras finas (Figura 3A, cortes laterales). Para hacer cortes limpios, coloque una hoja de afeitar en contacto con la muestra y firmemente arrastrar a un lado.
- Girar el plato 90 ° y hacer dos cortes rectos, paralelos en el centro del tejido, paralela a la tira de PIPAAm (Figura 3A, cortes de los extremos). Retire y deseche la tira suelta de tejido entre éstos cortes y las tiras delgadas entre en vMTFs (corte en el paso anterior) para evitar que las películas adyacentes de hacer contacto.
- Permita que la muestra para descansar a temperatura ambiente durante 10 minutos, o hasta que todo el PIPAAm se haya disuelto. Nota: Si PIPAAm permanece en futuros pasos, la muestra puede ser devuelto al plato de corte para disolver PIPAAm residual. Un raspado suave de la parte inferior de vMTF puede ayudar en la eliminación de PIPAAm, según sea necesario.
- Coloque un pequeño punto de la grasa de vacío en una limpia de 35 mm placa de Petri. Añadir 5 ml de solución nueva, estéril 1X de Tyrode a 37 ° C. Transferir el cubreobjetos con películas cortadas de la placa de 100 mm a la placa de 35 mm, y pulse en grasa de vacío para evitar el movimiento del cubreobjetos.
- Coloque el plato en una plataforma de control de temperatura en el escenario estereoscópico.
- Captura de lapso de tiempo de transmisión y las imágenes de luz fluorescente a intervalos deseados (por ejemplo., 30 seg) a lo largo del ensayo de tratamiento.
- En serie tratar vMTFs con 50 nM de endotelina-1 durante 20 min (contracción inducida) y 100 M HA-1077 para 30 min (relajación de los tejidos). Añadir soluciones concentradas de cada tratamiento para el plato experimental que contiene 5 ml de solución de Tyrode 1X estéril en los puntos de tiempo especificados, obteniéndose la concentración de tratamiento deseada en el volumen 5 ml. Hacer adiciones de tratamiento durante el intervalo entre adquisiciones imagen de lapso de tiempo para evitar la captura de la pipeta en las imágenes.
- Análisis contractilidad vMTF
- El uso de cubreobjetos que se contabilicen en 1.4.8, medir el espesor de sustrato PDMS con un profilometer21. Crear un espesor vs. curva de tiempo de giro para cada conjunto de cubreobjetos. Utilice esta curva para estimar el espesor vMTF para cada cubreobjetos utilizado en un experimento de la contractilidad.
- Medir las longitudes de proyección vMTF para cada punto de tiempo durante el experimento, y calcular los radios de curvatura asociada (Figura 3B) utilizando métodos previamente reportados 8.
- Calcula el estrés vMTF en cada po tiempoint utilizando métodos anteriores vMTF 5.
Nota: Utilice el espesor vMTF estimado calculado a partir de 3.2.1. Mida el espesor CMLV utilizando confocal de imágenes, como se informó anteriormente 9. Obtener el módulo de Young de PDMS hojas de datos de empresa.
Access restricted. Please log in or start a trial to view this content.
Resultados
El objetivo principal de este trabajo fue extender la viabilidad de CMLV micropatterned sobre sustratos PDMS hidrofóbicas. Esto se logró mediante la incorporación de un sistema de entrega de microfluidos para depositar genipina modelado y fibronectina en PDMS (Figura 1). La deposición de proteínas ECM utilizando la entrega de microfluidos dio de alta transferencia de la fidelidad de la pauta canal con PDMS desnudas entre líneas de genipina y fibronectina (Figura 1D). Las células ...
Access restricted. Please log in or start a trial to view this content.
Discusión
A continuación, presentamos un protocolo que se basa en la tecnología vMTF desarrollado previamente, lo que permite tiempos de experimentación extendidos más típica de las vías de enfermedades vasculares crónicas 1,23,24. Para lograr esto, micropatrón genipina, que ha sido previamente demostrado para proporcionar funcionalización a largo plazo de sustratos PDMS 11, utilizando una técnica de deposición de microfluidos para producir laminillas arterial Engineered con la mejora de la viabil...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
Referencias
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados