A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טכניקת microfluidic Genipin הפקדת לתרבות מורחבת של כלי דם micropatterned השרירים Thin Films
In This Article
Summary
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Abstract
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Introduction
מחלות כלי דם, כגון vasospasm המוחית 1,2, יתר לחץ דם 3, וטרשת עורקת 4, לפתח לאט, הן בדרך כלל כרוניים בטבע, וכרוכים בכוח-דור מתפקד על ידי תאי שריר חלק של כלי דם (VSMCs). אנו שואפים ללמוד בתפקוד אלה איטיים מתקדמים של כלי הדם באמצעות בשיטות מבחנה עם שליטה עדינה יותר של תנאי ניסוי מאשר בin vivo מודלים. סרטים שפותחנו בעבר בכלי דם שרירי דק (vMTFs) למדידת התכווצות פונקציונלית של רקמות מהונדסות במבחנה לב וכלי דם 5, אך שיטה זו הוגבלה למחקרים יחסית לטווח קצר. כאן, אנו מציגים טכניקת שינוי מצע שמתרחבת טכניקת vMTF הקודמת שלנו למדידות לטווח ארוך.
בעוד האנדותל הוא גם קריטי בתפקוד כלי דם כללי, lamellae עורקים מהונדסים לספק מערכת מודל שימושית להערכת שינויים בכלי דםהתכווצות במהלך התקדמות מחלה. להנדס מודל פונקציונלי של כלי דם ברקמת מחלה, גם את המבנה ותפקוד של lamella העורקים, יחידת ההתכווצות הבסיסית של כלי השיט, יש סכמה עם איכות גבוהה. lamellae עורקים הם גיליונות קונצנטריים, circumferentially מיושר של VSMCs ההתכווצות מופרדת על ידי גיליונות של אלסטין 6. הדפסת microcontact של חלבוני מטריצה תאית (ECM) על גבי מצעי polydimethylsiloxane (PDMS) כבר השתמשה בעבר כדי לספק רמזי הדרכה לארגון רקמה לחקות מיושרים רקמת לב וכלי דם 5,7-10. עם זאת, רקמות דוגמת באמצעות הדפסת microcontact יכול לאבד יושרה לאחר 3-4 ימים בתרבות, הגבלת תחולתם בלימודים כרוניים. פרוטוקול זה מספק פתרון לבעיה זו על ידי החלפת טכניקות הדפסת microcontact קודמות עם טכניקה בתצהיר microfluidic חדשה.
Genchi et al. מצעי PDMS שונה עם genipin וFound ממושך כדאיות של myocytes עד חודש בתרבות 11. כאן, אנו משתמשים בגישה דומה להארכת תרבות של תאי שריר בדוגמת כלי דם חלקים על PDMS. Genipin, נגזר hydrolytic טבעית של הפירות גרדניה, הוא מועמד רצוי לשינוי מצע בשל רעילותה הנמוכה יחסית בהשוואה לסוכני crosslinking דומים והשימוש הגובר שלה כביולוגי בתחומי תיקון רקמות 12,13 ושינוי ECM 14, 15. בפרוטוקול זה, פיברונקטין הוא מנוצל כרמז הדרכת תא, כמו בשיטות הדפסת microcontact קודמות; עם זאת, genipin מופקד על גבי מצעים לפני דפוסי פיברונקטין PDMS. לפיכך, כתאים לבזות את המטריצה בדוגמת, ECM מסונתז חדש מVSMCs המצורף יכול להיקשר למצע PDMS המצופה genipin.
פרוטוקול זה משתמש בהתקן משלוח microfluidic לgenipin שני שלבים ותצהיר ECM. העיצוב של microco מחקה מכשיר microfluidicדפוסי הדפסת ntact משמשים לlamellae עורקים מהונדסים במחקרים קודמים 16. לפיכך, אנו מצפים פרוטוקול זה להניב מחקה lamellae עורקים שבהצלחה לשחזר מזדהים ביותר במבנה ותפקוד vivo התכווצות של lamellae עורקים. אנו גם מעריכים התכווצות רקמות כדי לאשר genipin שהיא תרכובת שינוי המצע מתאימה לטווח ארוך בדגמי מחלת כלי דם במבחנה.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: המטרה של פרוטוקול זה היא לבנות ולנצל סרט של כלי דם שרירי דק (vMTF) עם המבנה מוצג באיור 1 להעריך התכווצות במהלך התרבות המורחבת של תאי שריר חלק של כלי דם (VSMCs) על מצעי PDMS. כדי להאריך את כדאיות VSMC, אנו מנצלים את genipin מתחם crosslinker. מצעים לvMTFs אלה נועדו לנתח התכווצות רקמות כפי שפותח על ידי Grosberg et al. 8 שיטות אחרות vMTF גם 5 עשויים לשמש, עם שינויים קלים בפרוטוקול ייצור מצע שהוצג.
ייצור 1. תשתית
- ניקוי coverslip
- הנח coverslips זכוכית קוטר 25 מ"מ למדף צביעת coverslip. הנח את המדף לתוך כוס או מיכל גדול (למשל, ריק 100 -. מיכל 1,000 pipet μl קצה).
- להוסיף 70% אתנול למכל לטבול באופן מלא את coverslips. Sonicate לפחות 30 דקות.
- הסר את מדף coverslip מפתרון אתנול. לאפשר coverslips לייבוש באוויר בתליית המדף בברדס תרבות סטרילי (כדי למנוע הצטברות חלקיקים על coverslips) ל1- 2 שעות.
הערה: coverslips חייב להיות יבש לחלוטין לפני השלבים הבאים.
- פולי (N-ISO-propylacrylamide) בידוד (PIPAAm) הרצועה על Coverslip
- שימוש בנייר דבק, קלטת מהצדדים של coverslip ניקה, והשאיר רצועה נחשפה במרכז על coverslip (איור 1 א). לשנות את רוחב רצועה חשוף זה מבוסס על יישום ו / או עיצוב microfluidic.
- סמן את הקצוות של רצועות קלטת על coverslip באמצעות סמן מעבדה לעיון מאוחר יותר (איור 1 א).
- חותך סביב ההיקף של coverslip לשחרר מהצלחת (איור 1 א, קו אדום מקווקו).
- פולי (N-ISO-propylacrylamide) לציפוי (PIPAAm)
- באמצעות איזון אנליטיים, שוקל 1 גרם של PIאבקת PAAm. אל תשתמש בN-ISO-propylacrylamide unpolymerized, שהוא מסרטן.
- העבר את PIPAAm לצינור צנטריפוגות 50 מיליליטר. להוסיף 10 מיליליטר של 1-butanol בתוך ברדס כימי להניב 10% w / v פתרון. זהירות: נקודת 1-butanol הבזק היא 37 מעלות צלסיוס אחסן את הפתרון שהתקבל בקבינט דליק ולהימנע מחימום.
- לאפשר PIPAAm לפזר במשך 10 דקות. אם האבקה עדיין גלויה, לערבב את הפתרון בעזרת מערבולת-מיקסר עד שכל האבקה נמס.
הערה: השלבים הבאים דורשים שימוש בcoater ספין. לכל coverslip: - מניחים את coverslip הדביק על צ'אק coater הספין עם מלקחיים.
- העבר את 150 μl של פתרון PIPAAm על coverslip על ידי הצבת טיפות לאורך הזכוכית החשופה במרכז coverslip. להבטיח כיסוי של השטח נחשף מלא.
- מעיל ספין PIPAAm באמצעות המתכון הבא:
- רמפה 10 שניות ל -3,000 סל"ד. להתעכב במשך 5 שניות.
- רמפה 10 שניות ל6,000 סל"ד. להתעכב במשך 60 שניות.
- רמפה 10 שניות ל -3,000 סל"ד. להתעכב במשך 5 שניות.
- מניחים את coverslip לתוך צלחת פטרי מכוסה PIPAAm פונה כלפי מעלה. לאפשר לאוויר יבש לפחות 15 דקות.
- מוציא בזהירות את נייר דבק מכל coverslips, עוזב את coverslip המלא נחשף בשכבה דקה של ציפוי PIPAAm ברצועת מרכז.
- PDMS ציפוי
- לערבב ודגת 15 גרם של PDMS ב- 10: יחס crosslinker: הבסיס 1. להוסיף 7-8 טיפות של 0.2 מיקרומטר microbeads פלורסנט sonicated לפני הערבוב. מכסה את הכוס של PDMS עם רדיד אלומיניום כאשר אינו בשימוש כדי למנוע אבק וחלקיקים אחרים מזיהום PDMS.
הערה: השלבים הבאים דורשים שימוש בcoater ספין. לכל coverslip: - מניחים coverslip מצופה PIPAAm על צ'אק coater הספין עם מלקחיים.
- העבר את PDMS על coverslip, מכסה לפחות שליש משטח coverslip.
- מעיל ספין באמצעות RECIP הבאדואר:
- רמפה 5 שניות ל -500 סל"ד. להתעכב 5 שניות.
- רמפה 5 שניות ל1,000 סל"ד. להתעכב 5 שניות.
- רמפה 10 שניות ל -3,000 סל"ד. תשכון 10 שניות.
- רמפה 10 שניות ל4,000 סל"ד. תשכון 60 שניות.
- רמפה 10 שניות ל2,000 סל"ד. תשכון 15 שניות.
- רמפה 10 שניות ל1,000 סל"ד. תשכון 10 שניות.
- רמפה 5 שניות ל -500 סל"ד. להתעכב 5 שניות.
- מניחים את coverslip לתוך צלחת פטרי מכוסה PDMS פונה כלפי מעלה. רשום את הזמן שבו היה coverslip ספין-מצופה. לעקוב אחר הזמן משויך לכל coverslip לאורך הניסוי לשימוש מאוחר יותר בקביעת עובי מצע PDMS.
- מניחים את צלחת פטרי המכילה את coverslips בתנור C ° 90 לפחות 1.5 שעות כדי להבטיח ריפוי PDMS נכון. אם תנור אינו זמין, בוא coverslips לרפא לפחות 48 שעות בRT.
- הסר את coverslips מהתנור ולאחסן אותם במגירה חשוכה עד מוכן לשימוש.
- מניח בצד כל רביעי ו coverslipאו מדידה עוקבת של עובי מצע, כפונקציה של זמן ציפוי ספין, עם profilometer.
- לערבב ודגת 15 גרם של PDMS ב- 10: יחס crosslinker: הבסיס 1. להוסיף 7-8 טיפות של 0.2 מיקרומטר microbeads פלורסנט sonicated לפני הערבוב. מכסה את הכוס של PDMS עם רדיד אלומיניום כאשר אינו בשימוש כדי למנוע אבק וחלקיקים אחרים מזיהום PDMS.
2. דפוסים Microfluidic לרקמות הנדסה
- ייצור של המכשירים microfluidic
- עיצוב של Photomask Microfluidic רקמות
- השתמש בכל תכנית תכנון בעזרת מחשב מתאים לעצב דפוסי microfluidic. לlamellae עורקים מורכבים מתאים אנושי עורק טבורי כלי דם שריר חלק, השתמש דפוס לסירוגין של 10 מיקרומטר ערוצים עם 10 מיקרומטר קירות.
- השתמש ערוץ בינארי הסתעפות אם 17 אפשריים, אך ניתן להשתמש בי עיצובי הסתעפות אחרים. להקטין את הרוחב ואורך של ערוצים לכל איטרציה הסתעפות עד להשגת דפוס הרקמה הרצויה מרווח (קירות וערוצים, איור 1).
- לעצב את המכשיר יש כניסה אחת להשמת פתרון טיפול פני השטח ושקע בודד ליישום של ואקום.
- Fabricate photomask מכיל עיצוב microfluidic (ים), כפי שתואר בעבר 18.
- ייצור photolithographic ופל
הערה: בצע photolithography בחדר נקי מתאים או מתקן דומה. כדי להפוך פרוסות סיליקון עם דפוסים לייצור ליתוגרפי רך של מכשירי רקמת microfluidic (~ 20 - 25 גובה ערוץ מיקרומטר) photolithography באמצעות:- נקה פרוסות סיליקון באצטון, מתנול, ואלכוהול איזופרופיל דקות 1 כל אחד. ייבש את הרקיק עם אקדח חנקן.
- Prebake הרקיק על פלטה חשמלית במשך 5 דקות ב 115 מעלות צלזיוס כדי להסיר לחות עודפת.
- מעיל ספין הרקיק עם photoresist SU-8 3025 באמצעות המתכון הבא להניב כולל 20 - 25 מיקרומטר בגובה:
- רמפה 5 שניות ל -500 סל"ד. להתעכב 5 שניות.
- רמפה 15 שניות ל4,000 סל"ד. תשכון 15 שניות.
- לאפות רך הרקיק על פלטה חשמלית על 95 מעלות צלזיוס במשך 15 דקות.
- לטעון photomask, ולחשוף tהוא ופל במשך 16 שניות באמצעות תכנית קשר ואקום על aligner מסכת קשר.
- קשה לאפות את הרקיק על פלטה חשמלית על 95 מעלות צלזיוס למשך 4 דקות.
- לפתח את הרקיק במשך 6 דקות במפתח. לאחר מכן, לשטוף את הרקיק פעמיים עבור 2 שניות במפתח טרי ולשטוף את הרקיק עם אלכוהול איזופרופיל.
- Silanate O / N רקיק בדוגמת ידי הצבת 2 - 3 טיפות של tridecafluoro-trichlorosilane בצלחת ריקה בתוך ייבוש ואקום. לחזק את הרקיק באמצעות צלחות פטרי, כך ששניהם התחתון והעליון של פרוסות סיליקון נחשפים.
זהירות: Tridecafluro-trichlorosilane הוא נוזל דליק ומאכל. ציוד מגן אישי מתאים ופליטה מקומית הוא הכרחי לשימוש.
- ייצור המכשיר microfluidic רקמה
- הנח silanated, תכונה בצד רקיק בדוגמת בצלחת פטרי.
- לערבב ודגה של PDMS 100 גרם עם 10: יחס crosslinker: הבסיס 1. יוצקים את PDMS לתוך הצלחת, לחלוטין ובאופן שווה מכסה את הרקיק.
- מניחים את הצלחת בייבוש ואקום עד שכל בועות האוויר יוסרו מן PDMS דפוקה, כ 30 דקות. לרפא את PDMS בצלחת על 90 מעלות צלזיוס לפחות 1.5 שעות. זמן וטמפרטורה יכולים להיות מותאמת כפי שהוכתבו על ידי הנחיות ייצור כדי להשיג ריפוי מלא.
- ברגע PDMS ריפא, לחתוך את PDMS סביב הרקיק בסכין גילוח ולשחרר את הרקיק מכוסה PDMS מהצלחת בזהירות. הסר PDMS העודף מתחת רקיק ולאט לקלף PDMS מרחק מהחלק העליון של פרוסות סיליקון.
- מניחים את התכונה בצד PDMS דיסק בצלחת נקייה ולאחסן את הרקיק מאור לאחר שימוש.
- לחתוך את PDMS העודף מרחבי הדפוסים באמצעות סכין גילוח. מכשירים חתוכים לצורות מלבניות (איור 1 ג) כדי להקל על קילוף של מכשיר ממצעים בצעדים מאוחר יותר. קיצוצים מדויקים אינם הכרחיים, כל עוד שטח נרחב קיים לכניסה, יציאה, ואזור דפוס רקמה (איור 1 ג).
- אגרוףחורי כניסה ויציאה (איור 1 ג) באמצעות אגרוף ביופסיה כירורגית 1 מ"מ.
- עיצוב של Photomask Microfluidic רקמות
- הפקדת מכשיר microfluidic
הערה: בפרוטוקול זה, מסירת microfluidic משמשת להפקיד genipin בדוגמת, סוכן crosslinking מפתח עבור culturing רקמות לטווח ארוך, כמו גם פיברונקטין. צעדים לפני עיקור פניצילין / סטרפטומיצין (2.2.3) לא צריכים להתקיים בתנאים סטריליים, אבל אוסף זיהום ואבק הגבלה מעודד לאורך כל הפרוטוקול. כל הצעדים שהתרחשו לאחר עיקור coverslip עם פניצילין / סטרפטומיצין (2.2.3) צריכים לנצל את הטכניקה סטרילית. הערה: חלק זה של הפרוטוקול יש להתחיל יום אחד לפני זריעת תאים.- הכנת מצע וMicrofluidic התקן
- Sonicate מכשירי microfluidic באתנול 70% לפחות 30 דקות.
- ייבש את מכשירי microfluidic sonicated באמצעות אוויר או חנקן דחוס, ומניח אותם בצלחת פטרי wiערוץ ה כולל כלפי מעלה כדי למנוע בלאי מיותר על התכונות.
- הנח עד 10 coverslips מצע vMTF בשואב UVO (כיסוי הוסר על צלחת כך את פני השטח הוא פונקציונליות) במשך 8 דקות.
- הסר את coverslips טופל UVO, ולמקם את התכונה בצד מכשירי microfluidic למטה על כל תלוש אחד בכל פעם (נטייה צריכה להיות דומה לתרשים 1C). לחץ כלפי מטה בחוזקה על המכשירים כדי להבטיח חותם חזק לcoverslips מצופה PDMS.
- בתצהיר של Genipin ופיברונקטין
- הכן פתרון genipin 5 מ"ג / מיליליטר על ידי הוספת 1 מיליליטר של DDH סטרילי 2 O למכל 5 מ"ג של genipin lyophilized. מערבבים את הפתרון בעזרת מערבולת-מיקסר. מניח בצד בRT לפחות 30 דקות.
הערה: האבקה קשה solubilize ב RT, ערבוב כל כך חוזר על עצמו לפחות דקה לעתים קרובות יש צורך. - במהירות, במקום ירידה של 70% אתנול בכניסה של כל התקן להתקן תחול. הערה: ETHanol צריך פתיל באמצעות המכשירים.
- אחרי 5 - 10 דקות, בזהירות לשאוב אתנול העודף בכניסה, והחלפתו באופן מיידי עם מי מלח 1X פוספט (PBS) בכניסה. מכאן ולהבא, להיות בטוח שלא לאפשר כניסה ללהיות יבשה לחלוטין, כדי למנוע כניסה של אוויר למכשיר.
- הנח קצה aspirator ואקום ביציאה של כל מכשיר. לצייר 1X PBS באמצעות מכשירים לשטוף אתנול משם. להשאיר כמות קטנה של 1X PBS בכניסה. הערה: אם הכניסה מופיעה כמעט יבשה, להוסיף עוד 1X PBS.
- לשאוב עודף 1X PBS, כך שרק כמות קטנה נשארה בכניסה לפני היישום של פתרון genipin.
- מניחים 60 μl של 5 מ"ג פתרון genipin מיליליטר / בכל כניסה (1D איור). צייר את פתרון genipin באמצעות המכשירים על ידי הצבת קצה aspirator ואקום ביציאה (1D איור). הקפד שלא למשוך את כל הפתרון דרך, משאיר כמות קטנה של פתרון בכניסה.
- מקום טיפות (כ אגורה בגודל) של 1X PBS בשתי הכניסה והיציאה כדי לשמור על ההרטבה במהלך דגירה. הזז את הצלחת המכילה מכשירים לתנור או חממת humidified (סביבת סטרילית אין צורך) נקבעו ל -37 מעלות צלזיוס, ודגירה של 4 שעות. המנה לא צריכה להיות מכוסה.
- במהלך דגירה, resuspend פיברונקטין לריכוז של 50 מיקרוגרם / מיליליטר בסטרילי DDH 2 O על קרח במשך לפחות 30 דקות לפני היישום למכשיר microfluidic.
- לאחר הדגירה של genipin, לשאוב את כל 1X PBS שנותר בשקעי המכשיר. תמשיך לחול aspirator ואקום בכל שקע מכשיר, מושך באמצעות 1X PBS שנותר בכניסה.
- מקום 50 מיקרוגרם / מיליליטר פתרון פיברונקטין 100 μl בכל כניסה, הוספה לכמות מינימאלית של 1X PBS שנותר בכניסה (1D איור).
- צייר את פתרון פיברונקטין באמצעות המכשירים באמצעות קצה aspirator ואקום ביציאה ( 1D איור). הקפד שלא למשוך את כל הפתרון דרך. הערה: ירידת פיברונקטין תיראה שונה מPBS 1X וgenipin בשל הבדלים במתח פנים.
- הזז את הצלחת נחשפה המכילה מכשירים לתנור או חממה מוגדרת 37 ° C, ודגירה של 24 שעות. הערה: צעד פיברונקטין אינו דורש הרטבה של הכניסה ויציאה עם 1X PBS. הבריכה הנותרת של פיברונקטין בכניסה תתייבש. זה צפוי.
- הכן פתרון genipin 5 מ"ג / מיליליטר על ידי הוספת 1 מיליליטר של DDH סטרילי 2 O למכל 5 מ"ג של genipin lyophilized. מערבבים את הפתרון בעזרת מערבולת-מיקסר. מניח בצד בRT לפחות 30 דקות.
- עיקור והכנה לזריעת תאים
- הכן פתרון של פניצילין / סטרפטומיצין לעיקור של coverslips vMTF בדוגמת. הוסף 5 מיליליטר של פניצילין / סטרפטומיצין (10,000 יחידות / מיליליטר; 10,000 מיקרוגרם / מיליליטר) ל -500 מיליליטר של סטרילית 1X PBS.
- מניחים את הצלחת המכילה את המכשירים במכסת מנוע בטיחות ביולוגית סטרילי.
- מוציא בזהירות את המכשירים מcoverslips על ידי קילוף לאט את המכשיר בפינה, בעוד אחיזת coverslip ביד נגדית באורח קל.הערה: צעד זה דורש תרגול כדי להפחית את נזק coverslip בתהליך ההסרה. אלטרנטיבה היא באמצעות מזרק כדי להזריק 1X PBS בכניסה ו / או יציאה כדי לסייע בשחרור מכשיר.
- מניחים את coverslips במנות שש היטב סטרילי. להוסיף לפחות 5 מיליליטר של תמיסת פניצילין / סטרפטומיצין היטב כל אחד. מניחים את הכלים בחממה סטרילית על 37 מעלות צלזיוס במשך לפחות 30 דקות.
- לאחר עיקור, לשאוב את פתרון פניצילין / סטרפטומיצין, וזרע coverslips עם השרירים cells19 התרבותי אנושי עורק טבור כלי הדם חלק (1D איור). ריכוז הזריעה לVSMCs הוא ~ 80,000 תאים לכל 2 סנטימטר. כדי להפחית את מספר התאים הדרושים לכל דגימה, להשתמש מפחית כדי להקטין את שטח הזריעה. דוגמא אחת היא כמפחית העליון החתך של צינור חרוטי 15 מיליליטר מצורף coverslip עם גריז ואקום סטרילי לפני הזריעה.
- דגירה coverslips זרע בחממה סטרילית על 37 מעלות צלזיוס, 5% CO 2 ולאפשר לתאי זרע לצרף ויוצרים מחקה lamellae עורקים מיושרים O / N (איור 2 א-ב).
- תרבות רקמות vMTF לטווח ארוך
- יום אחד לאחר הזריעה, להסיר את המדיום הסלולרי מוריד. יש לשטוף את הרקמות עם 1X PBS. הוסף 4 מיליליטר של מדיום סלולארי סרום ללא לגרום לפנוטיפ התכווצות בVSMCs 20.
- חזור על שטיפת 1X PBS ותוספת של מדיום סרום ללא טרי בכל יום אחר כרצוי לתרבות לטווח ארוך.
- הכנת מצע וMicrofluidic התקן
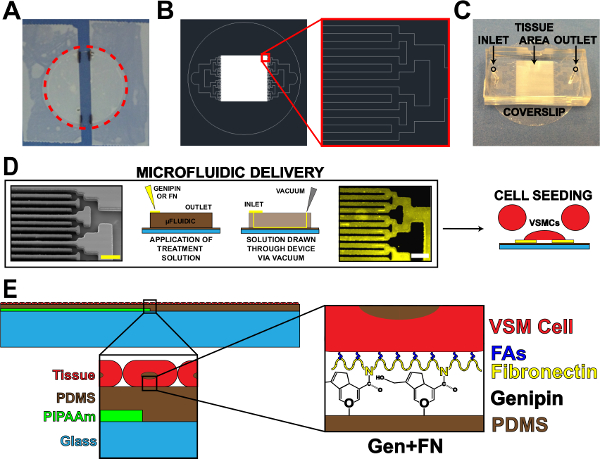
איור 1. התקן משלוח חלבון microfluidic. () קלטת מcoverslip לציפוי PIPAAm. העיגול אדום מנוקד: חיתוך דרך לשחרר coverslip (ב) ציור הנציג AutoCAD של דפוס מסכת microfluidic רקמה.. הבלעה: פרט של הסתעפות בינארי לalternating 10 מיקרומטר x 10 מיקרומטר דפוס רקמה. (ג) מיקום של מכשיר microfluidic על מצע coverslip עם כניסה ויציאה שצוין. (ד) סכמטי של דפוסי חלבון microfluidic ומשלוח. תמונת מיקרוסקופ אלקטרונים הסורק של ערוצי microfluidic (סרגל קנה מידה: 50 מיקרומטר) משמאל לימין; סכמטי מפורט של שיטה לתצהיר חלבון; פיברונקטין אימונוהיסטוכימיה המוכתם (סרגל קנה מידה: 50 מיקרומטר); תא זריעה עם תאי שריר חלק בכלי דם. סכמטי (ה) של רקמה מפוברקת. 1 הבלעה st: פירוט של מבנה שכבתי. 2 nd הבלעה: פירוט של שינוי genipin של מצע PDMS לאחר תצהיר microfluidic. © IOP הוצאה לאור. לשכפל ו / או שונה ברשות. כל הזכויות שמורות. 19 אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ניתוח פונקציה 3. רקמות עם vMTF ההתכווצות Assay
הערה: assay התכווצות MTF שהוצג כאן הוא מודל לאחר הטכניקה שפותחה בet al Grosberg 8.
- ניסוי vMTF התכווצות
- מניחים דגימת רקמה בצלחת 100 מ"מ. להוסיף solution8 של סטרילי 1X Tyrode ב- pH 7.4 חימם עד 37 מעלות צלזיוס כדי לכסות את המדגם.
- השתמש בסכין גילוח לעשות כמה חתכים מקבילים בניצב לקצה PIPAAm. לבצע חתכים באופן שמניב סעיפי רקמות רחבים יותר שיהיה vMTFs (עם רוחב ~ 2 מ"מ) לסירוגין עם רצועות דקות (איור 3 א, קיצוצים בצד). לבצע קיצוצים נקיים, מקום סכין גילוח במגע עם המדגם ותקיפות לגרור לצד.
- סובב את הצלחת 90 ° ולעשות שני חתכים ישרים, מקבילים באמצע הרקמה, במקביל לרצועת PIPAAm (איור 3 א, קיצוצי הסוף). הסר ולהיפטר מהרצועה הרופפת של רקמה בין הקיצוץ אלהים והרצועות דקות בין vMTFs (חתך בשלב הקודם) כדי למנוע מסרטים סמוכים יצירת קשר.
- לאפשר המדגם לנוח על RT במשך 10 דקות, או עד שכל PIPAAm נמס. הערה: אם PIPAAm נשאר בצעדים עתידיים, מדגם ניתן להחזיר לצלחת החיתוך לפזר PIPAAm שייר. גירוד עדין של החלק התחתון של vMTF יכול לסייע בהסרת PIPAAm, בהתאם לצורך.
- הנח נקודה קטנה של שומן ואקום בצלחת פטרי 35 מ"מ נקייה. הוסף 5 מיליליטר של התמיסה של טרי, 1X Tyrode סטרילי על 37 מעלות צלזיוס. העבר את coverslip עם סרטים לחתוך מצלחת 100 מ"מ לצלחת 35 מ"מ, ולחץ על גריז ואקום כדי למנוע תנועה של coverslip.
- מניחים את הצלחת בפלטפורמת טמפרטורה מבוקרת על הבמה סטראו.
- זמן לשגות לכידה משודרת ותמונות אור ניאון במרווחים רצויים (למשל., 30 שניות) לאורך assay טיפול.
- סדרתי לטפל vMTFs 50 ננומטר אנדותלין -1 בבמשך 20 דקות (התכווצות מושרה) ו 100 מיקרומטר HA-1077 למשך 30 דקות (הרפיה רקמות). להוסיף פתרונות מרוכזים של כל טיפול לצלחת הניסוי המכילה 5 מיליליטר של הפתרון של סטרילי 1X Tyrode בנקודות זמן שצוינו, מניב ריכוז הטיפול הרצוי בנפח 5 מיליליטר. הפוך תוספות טיפול במרווח בין רכישות הזמן לשגות תמונה כדי למנוע לכידת פיפטה בתמונות.
- vMTF התכווצות ניתוח
- שימוש coverslips להפריש ב1.4.8, למדוד את עובי מצע PDMS עם profilometer21. צור עובי לעומת עקומת זמן ספין עבור כל קבוצה של coverslips. השתמש עקום זה להעריך את עובי vMTF לכל coverslip משמש בניסוי התכווצות.
- מדוד את אורכי הקרנת vMTF עבור כל נקודת זמן במהלך הניסוי, ולחשב את רדיוס עקמומיות קשור (איור 3) תוך שימוש בשיטות שדווחו בעבר 8.
- חישוב מתח vMTF בכל PO זמןint באמצעות שיטות vMTF קודמות 5.
הערה: השתמש בעובי vMTF המוערך מחושב מ3.2.1. למדוד את עובי VSMC באמצעות תמונות confocal, כפי שדווח בעבר 9. להשיג מודולוס של PDMS הצעיר מגיליונות נתוני חברה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
המטרה העיקרית של עבודה זו הייתה להאריך את הכדאיות של VSMCs micropatterned על מצעי PDMS הידרופובי. הדבר זה הושג על ידי שילוב מערכת מסירת microfluidic להפקיד genipin בדוגמת ופיברונקטין על PDMS (איור 1). בתצהיר של חלבוני ECM באמצעות משלוח microfluidic הניב העברת נאמנות גבוהה של דפוס הערוץ עם PD...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן, אנו מציגים פרוטוקול שבונה על טכנולוגיה שפותחה בעבר vMTF, מאפשרים פעמים ניסוי מורחבות טיפוסיות יותר של מסלולי מחלת כלי דם כרוניים 1,23,24. כדי להשיג זאת, אנו micropattern genipin, אשר בעבר הוכח לספק functionalization לטווח הארוך של מצעי PDMS 11, תוך שימוש בטכניקה בתצהיר microfluidic ל?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
References
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved