Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Micropatterned Vasküler Musküler İnce Filmlerin Genişletilmiş Kültür mikroakışkan Genipin Biriktirme Tekniği
Bu Makalede
Özet
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Özet
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Giriş
Serebral vazospazm 1,2, hipertansiyon 3 ve ateroskleroz 4 gibi vasküler hastalıklar, yavaş gelişen doğada tipik olarak kronik ve vasküler düz kas hücreleri (VSMC'Ier) ile işlevsel kuvvet kuşak içerir. Biz in vivo modellere göre deneysel koşullar ince kontrolü ile in vitro yöntemleri kullanarak bu yavaş ilerleyen damar işlev bozuklukları incelemek hedefliyoruz. In vitro fonksiyonel kontraktilite ölçmek için biz daha önce geliştirilen damar kas ince filmler (vMTFs) kardiyovasküler dokuları 5 mühendislik, ancak bu yöntem nispeten kısa vadeli çalışmalar sınırlı kalmıştır. Burada, biz uzun vadeli ölçümler için önceki vMTF tekniği genişleyen bir alt tabaka değişiklik tekniğini sunuyoruz.
Endotel genel vasküler işlev kritik olsa da, işlenmiş arter lameller vasküler değişiklikleri değerlendirmek için yararlı bir model sistemi sağlamakhastalığın ilerlemesi sırasında kontraktilite. Fonksiyonel vasküler hastalık doku modeli, yapısı ve arteriyel lamel işlevini hem mühendis, geminin temel kasılma birimi, yüksek sadakat ile değinmeyecek gerekir. Arter lameller 6 elastin tabakaları ile ayrılmış kontraktil VSMC'Ierin eş, çevresel olarak hizalanmış levhalar vardır. Polidimetilsiloksan (PDMS) yüzeylerde hücre dışı matris (ECM) proteinleri microcontact baskı önceden kardiyovasküler doku 5,7-10 hizalanmış taklit eden doku organizasyonu için rehberlik ipuçları sağlamak için kullanılır olmuştur. Ancak, dokular kronik çalışmalarda uygulanabilirliğini sınırlayan, kültürde 3-4 gün sonra bütünlüğünü kaybedebilir microcontact baskı kullanarak desenli. Bu protokol, yeni bir mikroakışkan biriktirme tekniği ile önceki microcontact baskı teknikleri değiştirerek bu soruna bir çözüm sağlar.
Genipin ve f Genchi ve ark., Modifiye edilmiş PDMS substratlaround kültürde 11 bir ay miyositlerin canlılığı kadar uzamış. Burada, biz PDMS üzerinde desenli damar düz kas hücrelerinin kültürünü genişletmek için benzer bir yaklaşım kullanın. Genipin, gardenya meyve doğal hidrolitik türevi, içindeki çapraz bağlama maddeleri ve doku onarımı 12,13 ile ECM modifikasyon 14 alanlarında biyomalzeme olarak artan kullanımı ile karşılaştırıldığında nedeniyle nispeten düşük toksisiteye alt-tabaka modifikasyonu için arzu edilen bir aday 15. Bu protokol, fibronektin, önceki microcontact baskı yöntemlerde olduğu gibi, bir cep yönlendirme işaret olarak kullanılmaktadır; Bununla birlikte, genipin fibronektin desen önce PDMS substratlar üzerine tatbik edilir. Hücreler desenli matrisi bozan Dolayısıyla, ekli VSMC'Ierin gelen yeni sentezlenmiş ECM genipin kaplı PDMS substrata bağlanabilir.
Bu protokol, iki aşamalı genipin ECM tevdi edilmesi için mikro-akışkan aktarım cihazını kullanmaktadır. Mikroakışkan cihaz taklit microco tasarımıDaha önceki çalışmalarda 16 tasarlanmış arteriyel ince tabakalar için kullanılan ntact baskı kalıpları. Böylece, bu protokol başarıyla in vivo yapısı ve arteriyel lamellerin kasılma fonksiyonunda yüksek hizalanmış özetlemek arteriyel lamel taklit verim bekliyoruz. Biz de bu genipin in vitro damar hastalığı modellerinde uzun vadede uygun bir substrat değişiklik bileşik onaylamak için doku kasılma değerlendirir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Not: Bu protokolün amacı oluşturabilir ve PDMS substratlar üzerinde, vasküler düz kas hücreleri (VSMC'Ier) uzatılmış kültür sırasında kasılma değerlendirmek için, Şekil 1 'de gösterilen yapıya sahip bir vasküler kas ince film (vMTF) kullanılmasıdır. VSMC canlılığını uzatmak için, çapraz bağlayıcı bileşik genipin kullanmaktadır. Grosberg ve ark., 8 Diğer vMTF yöntemleri 5 sunulmuştur alt-tabaka imalat protokolü ince değişikliklerle, kullanılabilir tarafından geliştirilen bu vMTFs için substrat doku kasılmasını analiz etmek için tasarlanmıştır.
1. Yüzey Fabrikasyon
- Lamel Temizlik
- Bir lamel boyama rafa 25 mm çaplı cam lamelleri yerleştirin. Büyük bir beher veya kabın içine yerleştirin raf (örneğin, boş bir 100 -. 1000 ul pipetlemeyin ucu konteyner).
- Tam lamelleri sokmak için kaba% 70 etanol ekleyin. En az 30 dakika boyunca, onları sonikasyon.
- Etanol çözeltisinden lamel raf çıkarın. 1- 2 saat süreyle (lamelleri partikül birikimini önlemek için) bir steril kültür kaputu raf asarak kuru hava lamelleri bırakın.
Not: lamelleri önce aşağıdaki adımlara tamamen kuru olmalıdır.
- Lamel Poli (N-izo-propylacrylamide) (PIPAAm) Şerit İzolasyon
- Lamel (Şekil 1A) merkezli bir açık şeridi bırakarak, temizlenmiş bir lamel kenarlarında kapalı yapışkan bant, bant kullanarak. Uygulama ve / veya mikroakışkan tasarıma dayanan bu açık şerit genişliğini değiştirin.
- Mark, daha sonra referans (Şekil 1A) bir laboratuar kalemle lamel bandı şeritlerinin kenarları.
- Çanak (Şekil 1A, noktalı kırmızı çizgi) çıkartmak için lamel çevresinde kesin.
- Poli (N-izo-propylacrylamide) (PIPAAm) Kaplama
- Bir analitik terazi kullanılarak PI 1 g ağırlığındaPAAm toz. Kanserojen polimerleşmemiş N-iso-propylacrylamide kullanmayın.
- 50 ml'lik bir santrifüj tüpüne PIPAAm aktarın. % 10 ağırlık / hacim solüsyonu elde etmek için kimyasal bir kaput içinde 1-bütanol 10 ml ilave edilir. DİKKAT: 1-bütanol parlama noktası 37 o C olup Yanıcı kabinede nihai çözeltinin saklayın ve ısıtma kaçının.
- PIPAAm 10 dakika boyunca çözünmeye bırakılır. Toz hala görünür ise, tüm toz eriyene kadar bir vorteks-mikser kullanılarak çözüm karıştırın.
Not: Aşağıdaki adımlar bir eğirme kaplayıcı kullanılmasını gerektirir. Her lamel için: - Forseps ile spin lak aynası üzerinde bantlanmış lamel yerleştirin.
- Lamel merkezinde açık cam boyunca damlacıkları koyarak lamel üzerine PIPAAm çözeltisi 150 ul aktarın. Maruz kalan alanın bütünüyle örtülmesinin sağlanması.
- Spin kat PIPAAm aşağıdaki tarifi kullanarak:
- 3,000 rpm 10 sn Rampa. 5 saniye boyunca yaşamak.
- Rampa 10 sn 6,000 rpm. 60 saniye boyunca yaşamak.
- 3,000 rpm 10 sn Rampa. 5 saniye boyunca yaşamak.
- Yukarı bakacak PIPAAm ile kaplı Petri kabı içine lamel yerleştirin. En az 15 dakika boyunca havada kurumaya bırakın.
- Dikkatle bir merkez şerit PIPAAm kaplama ince bir tabaka ile maruz tam lamel bırakarak, tüm lamelleri gelen yapışkan bandı çıkarın.
- PDMS Kaplama
- Mix ve 10 PDMS 15 gr degas: 1 baz: çapraz bağlayıcı oranı. Karışmadan önceki sonicated 0.2 mikron floresan mikro 8 damla - 7 ekleyin. PDMS karışmasını toz ve diğer parçacıkları önlemek için kullanılmadığı zaman alüminyum folyo ile PDMS fincan örtün.
Not: Aşağıdaki adımlar bir eğirme kaplayıcı kullanılmasını gerektirir. Her lamel için: - Forseps ile spin lak ayna üzerinde PIPAAm kaplı lamel yerleştirin.
- Lamel alanının en az üçte birini kapsayan bir örtücü camın üzerine PDMS aktarın.
- Aşağıdaki recip kullanarak Spin cekete:
- 500 rpm 5 sn Rampa. 5 sn yaşamak.
- 1000 rpm 5 sn Rampa. 5 sn yaşamak.
- 3,000 rpm 10 sn Rampa. 10 sn yaşamak.
- 4,000 rpm 10 sn Rampa. 60 sn yaşamak.
- 2,000 rpm 10 sn Rampa. 15 sn yaşamak.
- 1000 rpm 10 sn Rampa. 10 sn yaşamak.
- 500 rpm 5 sn Rampa. 5 sn yaşamak.
- PDMS yukarı bakacak şekilde bir kapalı Petri kabı içine lamel yerleştirin. Lamel spin-kaplı olan zamanını kaydedin. PDMS substrat kalınlığını belirlemede daha sonra kullanılmak üzere deney boyunca her lamel ile ilişkili zaman takip edin.
- Uygun PDMS yapışma için, en az 1.5 saat için 90 ° C bir fırında lamelleri içeren Petri tabağına yerleştirin. Bir fırın mevcut değilse, lamelleri oda sıcaklığında en az 48 saat süre ile tedavi sağlar.
- Fırından lamelleri çıkarın ve kullanmaya hazır olana kadar karanlık bir çekmecede saklayabilirsiniz.
- Her dördüncü lamel f kenaraya da bir profilometre ile döndürerek kaplama, zamanın bir fonksiyonu olarak alt-tabaka kalınlığı, daha sonra ölçümü.
- Mix ve 10 PDMS 15 gr degas: 1 baz: çapraz bağlayıcı oranı. Karışmadan önceki sonicated 0.2 mikron floresan mikro 8 damla - 7 ekleyin. PDMS karışmasını toz ve diğer parçacıkları önlemek için kullanılmadığı zaman alüminyum folyo ile PDMS fincan örtün.
Mühendislik Dokular 2. mikroakışkan Desenlendirme
- Mikroakışkan Cihazlar İmalatı
- Doku mikroakışkan photomask Tasarımı
- Mikroakışkan desen tasarımı uygun herhangi bir bilgisayar destekli tasarım programı kullanın. Insan göbek kordonu damar vasküler düz kas hücreleri oluşan arter ince tabakalar için, 10 um duvarlar 10 um kanalların bir alternatif modeli kullanırlar.
- Olası 17 halinde dallanma ikili kanal kullanarak, ancak diğer dallanma tasarımları kullanılabilecektir. (Duvarlar ve kanallar, Şekil 1B) aralığı istenen doku deseni elde kadar her dallanma yineleme için kanalların genişliğini ve uzunluğunu düşürün.
- Yüzey işleme solüsyonu yerleştirilmesi ve vakum uygulanması için, tek bir çıkış için tek bir giriş için cihaz tasarımı.
- FabDaha önce tarif edildiği gibi 18, mikro-akışkan bir tasarım (ler) ihtiva eden bir ışık-maskesi ricate.
- Fotolitografik Gofret İmalatı
Not: Uygun bir temiz oda veya benzeri tesiste fotolitografi gerçekleştirin. Doku mikroakışkan cihazlar (~ 20-25 mikron kanal yükseklik) yumuşak litografi üretim için desenleri ile silikon gofret yapmak için kullanan fotolitografi:- 1 dakika her biri için, aseton, metanol, ve isopropil alkol içinde bir silikon gofret temizleyin. Bir azot tabancası ile gofret kurulayın.
- Fazla nemi çıkarmak için 115 ° C'de 5 dakika boyunca sıcak bir plaka üzerinde gofret Prebake.
- : Yüksekliği 25 mm - Spin kat verim için aşağıdaki tarifi kullanarak SU-8 3025 fotorezist ile gofret 20 özellikleri
- 500 rpm 5 sn Rampa. 5 sn yaşamak.
- 4,000 rpm 15 saniye Rampa. 15 sn yaşamak.
- Yumuşak fırında 15 dakika boyunca 95 ° C'de bir sıcak plaka üzerinde ince bisküvi.
- T photomask yükleyin ve maruzo bir kişi maske hizalama üzerinde bir vakum kontak programını kullanarak 16 saniye boyunca gofret.
- Sabit 4 dakika boyunca 95 ° C'de bir sıcak plaka üzerinde gofret fırında.
- Geliştirici 6 dakika gofret geliştirin. Daha sonra, taze, geliştirici 2 saniye boyunca iki kez gofret yıkayın ve izopropil alkol ile gofret yıkayın.
- Bir vakum desikatörde içinde boş bir tabak tridekaflor-trichlorosilane 3 damla - 2 yerleştirerek desenli gofret O / N Silanate. Gofret alt ve üst hem de maruz böylece Petri yemekleri kullanarak gofret Prop.
DİKKAT: Tridecafluro-trichlorosilane yanıcı ve aşındırıcı bir sıvıdır. Uygun kişisel koruyucu ekipman ve yerel egzoz kullanımı için gereklidir.
- Doku mikroakışkan Aygıt Fabrikasyon
- Petri kabı içinde silanlanmış, desenli gofret özelliği tarafı yukarı bakacak şekilde yerleştirin.
- Mix ve 10 ile PDMS 100 gr degas: 1 baz: çapraz bağlayıcı oranı. Tamamen ve eşit gofret kapsayan, çanak içine PDMS dökün.
- Tüm hava kabarcıkları, vulkanize edilmemiş PDMS yaklaşık 30 dakika kaldırılana kadar bir vakum desikatörde çanak yerleştirin. En az 1.5 saat boyunca 90 ° C 'de çanak PDMS Cure. Tam bir tedavi elde etmek için üretim kurallarına emrettiği gibi Zaman ve sıcaklık ayarlanabilir.
- PDMS tedavi edildikten sonra, bir jilet ile gofret etrafında PDMS kesip dikkatlice çanak PDMS kaplı gofret bırakın. Gofret altında aşırı PDMS çıkarın ve yavaşça gofretin üst uzak PDMS soyun.
- Temiz bir tabak PDMS diski özelliği tarafı yukarı bakacak şekilde yerleştirin ve kullanımdan sonra ışıktan uzak gofret saklayın.
- Bir jilet kullanarak desen etrafında aşırı PDMS kesip. Dikdörtgen şeklinde (Şekil 1C) içine Kesme aygıtları, sonraki adımlarda substratların cihazın soyulması kolaylaştırmak içindir. Hassas kesimler sürece geniş bir alanı girişi, prize ve doku desen alanı (Şekil 1C) için mevcut olduğu, gerekli değildir.
- Punch1 mm'lik bir cerrahi biyopsi zımbası ile giriş ve çıkış delikleri (Şekil 1C).
- Doku mikroakışkan photomask Tasarımı
- Mikroakışkan Cihaz Biriktirme
Not: Bu protokol, mikroakışkan dağıtım desenli genipin, uzun vadeli bir doku kültür için önemli çapraz bağlama maddesi, aynı zamanda fibronektin yatırmak için kullanılır. Penisilin / streptomisin sterilizasyon (2.2.3) öncesinde Adımlar steril koşullarda gerçekleşmesi gerekmez, ancak sınırlayıcı kirlilik ve toz toplama protokolü boyunca teşvik edilmektedir. Penisilin / streptomisin (2.2.3) ile lamel sterilizasyon sonrasında meydana gelen tüm adımlar steril tekniği kullanmak gerekir. Not: protokolün bu bölümü öncesinde hücre tohumlama bir gün başlatılması gerekir.- Yüzey ve mikroakışkan Cihaz Hazırlama
- En az 30 dakika boyunca% 70 etanol içinde mikroakışkan cihazlar sonikasyon.
- Basınçlı hava ya da azot kullanılarak sonike mikroakışkan cihazlar kurutulur ve bir Petri tabağı wi koyuninci kanal özellikleri Gereksiz aşınmaları önlemek için yüz-up bulunmaktadır.
- 8 dakika boyunca bir UVO temizleyici (yüzey Fonksiyonlu böylece kapak çanak kaldırıldı) 10 vMTF substrat lamelleri kadar yerleştirin.
- UVO ile tedavi lamelleri çıkarın ve bir anda her kayma biri üzerine aşağı Mikroakışkan cihazlar özelliği tarafı yerleştirin (oryantasyon 1C Şekil benzer olmalıdır). Sıkıca cihazlarda Basın PDMS kaplı lamelleri sıkı bir mühür sağlamak.
- Genipin ve Fibronektin birikmesi
- Liyofilize genipin 5 mg kabın steril GKD 2 O, 1 ml ilave edilerek 5 mg / ml genipin çözeltisi hazırlayın. Bir vorteks mikser kullanılarak çözelti karıştırın. En az 30 dakika boyunca oda sıcaklığında bir kenara.
Not: toz, en azından bir dakika, oda sıcaklığında çok tekrarlanan karıştırma çözündürülmesi zordur çoğu zaman gereklidir. - Hızlı, cihaz prime işlemi için her bir cihazın girişinde,% 70 etanol içinde bir damla yerleştirin. Not: ETHAnole cihazları ile fitil gerekir.
- 5 sonra - 10 dakika, dikkatli bir şekilde, hemen girişinde 1X fosfat tamponlu salin (PBS) ile değiştirilmesi, girişteki aşırı etanol aspire. Bu noktadan itibaren, giriş cihazına hava giriş önlemek için tamamen kuru olmasına izin değil emin olun.
- Her cihazın çıkışında bir vakum aspiratör ucu yerleştirin. Etanol uzak durulama cihazlar aracılığıyla 1X PBS çizin. Girişinde 1X PBS küçük bir miktar boş. Not: giriş neredeyse kuru görünüyorsa, daha 1X PBS ekleyin.
- Sadece küçük bir miktar genipin çözeltinin uygulanmasından önce girişinde kalır, böylece aşırı 1X PBS aspire.
- Her bir giriş (Şekil 1D), 5 mg / ml genipin çözeltisi 60 ul koyun. Prize (Şekil 1D) bir vakum aspiratör ucu yerleştirerek cihazlar aracılığıyla genipin çözüm çizin. Giriş çözeltinin küçük bir miktar bırakarak boyunca çözelti her çekmek için emin olun.
- Yer (yaklaşık on sent büyüklüğünde) 1X PBS girişi ve inkübasyon sırasında ıslatma korumak için çıkışında hem de düşer. 37 ° C'ye ayarlanmış bir nemlendirilmiş fırın veya inkübatör cihazları (steril bir ortam gerekli değildir) ihtiva eden çanak taşımak ve 4 saat süre ile inkübe edilir. Kap, kaplanmıştır gerek yoktur.
- İnkübasyon sırasında, önce mikro sıvısal tertibat uygulama için en az 30 dakika boyunca buz üzerinde steril GKD 2 O 50 ug / ml 'lik bir konsantrasyona kadar fibronektin yeniden süspanse edin.
- Genipin inkübasyonundan sonra, cihaz çıkışları kalan tüm 1X PBS aspire. Girişinde kalan 1X PBS üzerinden çekerek, her cihaz çıkışında bir vakum aspiratör uygulamak için devam edin.
- Giriş kalan 1X PBS içinde çok az miktarda (Şekil 1D) ekleyerek, her giriş 50 ug / ml fibronektin çözeltisi 100 ul koyun.
- (Çıkışında bir vakum aspiratör ucu kullanarak cihazlar aracılığıyla fibronektin çözüm çizin Şekil 1D). Yoluyla çözümün tüm çekemez emin olun. Not: Fibronektin düşmesi, yüzey gerilimi farklılıklar 1X PBS ve genipin farklı bakacağız.
- 37 ° C'ye ayarlanmış bir fırın ya da kuluçka cihazları ihtiva eden ortaya çanak getirin ve 24 saat daha inkübe edilir. Not: fibronektin adımı 1X PBS ile giriş ve çıkış ıslanmasını gerektirmez. girişinde fibronektin kalan havuz kurur. Bu beklenmektedir.
- Liyofilize genipin 5 mg kabın steril GKD 2 O, 1 ml ilave edilerek 5 mg / ml genipin çözeltisi hazırlayın. Bir vorteks mikser kullanılarak çözelti karıştırın. En az 30 dakika boyunca oda sıcaklığında bir kenara.
- Hücre Yayımlamak için Sterilizasyon ve Hazırlama
- Desenli vMTF lamelleri sterilizasyonu için penisilin / streptomisin bir çözüm hazırlayın. Steril 1X PBS 500 ml penisilin / streptomisin ve 5 ml (10.000 mg / ml 10,000 ünite / ml) ilave et.
- Steril bir biyogüvenlik kaput cihazları içeren çanak yerleştirin.
- Dikkatle hafifçe ters elinde lamel doyumsuz yavaşça, bir köşede cihazı soyulması ile lamelleri cihazları kaldırın.Not: Bu adım çıkarma işleminde lamel hasarı azaltmak için pratik gerektirir. Alternatif bir cihazı serbest yardım etmek için giriş ve / veya çıkışında 1X PBS enjekte etmek için bir şırınga kullanılarak edilir.
- Steril altı oyuklu tabaklarda lamelleri yerleştirin. Her bir oyuğa, penisilin / streptomisin çözeltisinin en az 5 ml ilave edilir. En az 30 dakika boyunca 37 ° C'de steril inkübatör yemekler yerleştirin.
- Sterilizasyon sonrasında, penisilin / streptomisin solüsyonu aspire ve kültürlenmiş insan umbilikal damar vasküler düz kas cells19 (Şekil 1D) ile lamelleri tohum. VSMC'Ierin için tohumlama konsantrasyonu ~ cm2 başına 80.000 hücreleri. Her bir örnek için gerekli olan hücrelerin sayısını azaltmak için, tohum alanı azaltmak için, bir redüktör kullanın. Bir redüktör bir örneği önce tohumlama steril vakum gres ile lamel bağlı bir 15 ml konik tüp kesme üst olduğunu.
- 37 ° C ve% 5 CO2 ile steril bir inkübatör tohumlanmış lamelleri inkübe ve numaralı seribaşı hücreleri hizalanmış arteriyel lamel taklit takmak ve oluşturmak için izin O / N (Şekil 2A-B).
- Uzun süreli vMTF Doku Kültürü
- Bir gün tohumlama sonra, hücre orta ve redüktör çıkarın. 1X PBS ile dokuları durulayın. VSMC'Ierin 20 bir kasılma fenotipi uyarmak için, serumsuz hücre ortamının 4 ml ekleyin.
- Uzun süreli kültürü için arzu edildiği gibi her gün 1X PBS durulama ve taze serumsuz ortam ilave tekrarlayın.
- Yüzey ve mikroakışkan Cihaz Hazırlama
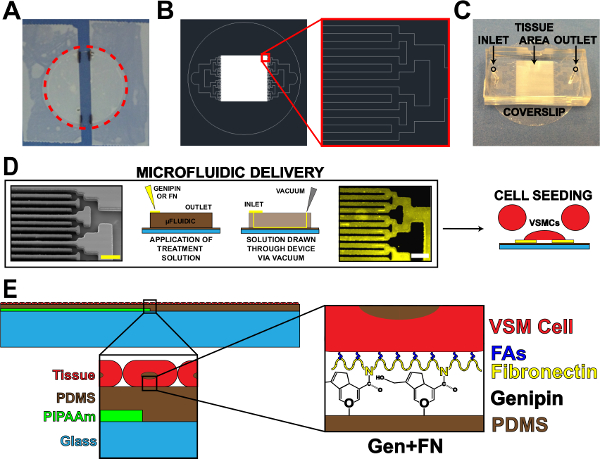
1. Mikroakışkan Protein Teslim Cihazı Şekil. (A) PIPAAm kaplama lamel kapalı Taped. Kırmızı noktalı daire: lamel serbest yolunu kesme (B) Doku mikroakışkan maske desen Temsilcisi AutoCAD çizim.. Ankastre: İkili dallanma Detay ALTERN içingiriş ve çıkış bir lamel alt-tabaka üzerinde mikro sıvısal tertibat 10 mm x 10 mm doku örneği. (C), bir başlatma Sıralama gösterdi. mikroakışkan proteini desen ve teslimat (D) şematik. Soldan sağa: microfluidic kanalların taramalı elektron mikroskobu görüntüsü (ölçek çubuğu: 50 mikron); Protein birikimi yönteminin detaylı şematik; İmmünohistokimya lekeli fibronektin (ölçek çubuğu: 50 mikron); Vasküler düz kas hücreleri ile hücre tohumlama. Imal doku (E) şematik. 1. içerlek: katmanlı yapının Detay. 2. inset: mikroakışkan birikimi sonra PDMS substrat genipin modifikasyonu Detay. © GİB Yayıncılık. Çoğaltılabilir ve / veya izni ile değiştirilmiş. Tüm hakları saklıdır. 19 Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
VMTF Kasılma Testi ile 3. Doku Fonksiyon Analizi
Not: Burada sunulan MTF kontraktilitesinin tahlil Grosberg ark geliştirilen teknikle sonra modellenmiştir 8.
- vMTF Kasılma Deneme
- 100 mm tabak içinde bir doku numunesi yerleştirin. PH 7.4'te steril 1X Tyrode solution8 ekleme örneği kapsayacak şekilde 37 ° C'ye kadar ısıtıldı.
- PIPAAm kenarına dik birçok paralel kesim yapmak için bir jilet kullanın. Ince şeritler (Şekil 3A, yan keser) ile dönüşümlü vMTFs (genişlik ~ 2 mm) olacak geniş doku bölümleri veren bir şekilde keser olun. Temiz kesim yapmak için, numune ile temas halinde bir jilet yerleştirin ve yan sürükleyin sıkıca.
- Çanak 90 ° döndürün ve doku ortasında iki düz, paralel kesim yapmak, PIPAAm şerit (Şekil 3A, uç kesimler) paralel. Çıkarın ve bu kesim arasındaki doku gevşek şerit eldens ve vMTFs arasındaki (önceki adımda kesme) ince şeritler temas bitişik filmler önlemek için.
- Numune, 10 dakika boyunca oda sıcaklığında dinlenmeye bırakın veya tüm kadar PIPAAm çözününceye. Not: PIPAAm gelecek adımda kalırsa, numune kalan PIPAAm çözmek için kesim çanak iade edilebilir. Gerektiğinde vMTF alt tarafının bir yumuşak kazıma, PIPAAm uzaklaştırılmasında yardımcı olabilir.
- Temiz bir 35 mm Petri kabındaki vakum gres küçük bir nokta koyun. 37 ° C sıcaklıkta, taze, steril 1X Tyrode çözeltisi 5 ml. Lamel hareket etmesini önlemek için vakum yağ üzerine 100 mm 35 mm çanak çanak ve basından kesim filmleri ile lamel aktarın.
- Stereomikroskop aşamasında sıcaklık kontrollü bir platform çanak yerleştirin.
- Yakalama time-lapse iletilir ve istenilen aralıklarla floresan ışık görüntüleri (örn., 30 sn) tedavi deneyi boyunca.
- Seri olarak (20 dakika boyunca 50 nM endotelin-1 ile tedavi vMTFskaynaklı daralma) ve 30 dakika (doku dinlenmek için 100 uM HA-1077). 5 ml hacim içinde, istenen tedavi konsantrasyonu elde belirtilen zaman noktalarında steril 1X Tyrode çözeltisi 5 ml ihtiva eden deney kabına her işlemin konsantre çözümler ekleyin. Görüntülerde pipet yakalama önlemek için time-lapse görüntü satın almalar arasındaki aralığı boyunca tedavi eklemeler yapın.
- vMTF Kasılma Analizi
- 1.4.8 kenara koyun lamelleri kullanarak, bir profilometer21 PDMS substrat kalınlığını ölçmek. Lamelleri her set için sıkma zaman eğrisi kalınlığı oluşturun. Bir kontraktilite deneyde kullanılan her lamel için vMTF kalınlığını tahmin etmek için bu eğriyi kullanın.
- Deney boyunca her bir zaman noktası için vMTF projeksiyon uzunlukları ölçmek ve daha önce bildirilen yöntem kullanılarak 8 eğrilik yarıçaplarına bağlı (Şekil 3B) hesaplar.
- Her zaman po at vMTF stres hesaplayınönceki vMTF yöntemlerini kullanarak 5 int.
Not: 3.2.1 hesaplanan tahmini vMTF kalınlığı kullanın. Daha önce 9 bildirdiği gibi, konfokal görüntüleri kullanarak VSMC kalınlığını ölçün. Şirket veri sayfaları PDMS Young modülüne edinin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu çalışmanın temel amacı, hidrofobik PDMS yüzeylerde micropatterned VSMC'lerin canlılığı uzatmak oldu. Bu desenli genipin ve PDMS ile fibronektin (Şekil 1) biriktirilmesi için bir mikro-akışkan dağıtım sistemi eklenerek gerçekleştirilmiştir. Mikroakışkan teslim kullanarak ECM proteinleri Biriktirme genipin ve fibronektin (Şekil 1D) satırları arasında çıplak PDMS kanal desen yüksek sadakat transferi vermiştir. Önceki microcontact baskı yöntemleri
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada, kronik damar hastalığı yolların 1,23,24 uzun deney kat daha tipik izin önce geliştirilen vMTF teknolojisi üzerine inşa bir protokol mevcut. Bunu gerçekleştirmek için, daha önce MTF kontraktilitesi deneylerinde kullanılmak üzere geliştirilmiş bir vasküler doku canlılığı ile mühendislik arter lameller üretmek üzere bir mikro-akışkan yerleştirme tekniği kullanılarak, PDMS alt tabakalar 11 uzun süreli işlevselleştirilmesini sağlamak için gösterilmiştir genipi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
Referanslar
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır