È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Microfluidic genipina Deposizione Tecnica per la cultura estesa di micropatterned vascolari muscolari Thin Films
In questo articolo
Riepilogo
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Abstract
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Introduzione
Malattie vascolari, come il vasospasmo cerebrale 1,2, ipertensione 3, 4 e aterosclerosi, si sviluppano lentamente, sono tipicamente di natura cronica, e coinvolgere disfunzionale forza-generazione da parte delle cellule muscolari lisce vascolari (VSMC). Il nostro obiettivo è di studiare queste disfunzioni vascolari lenta progressione che utilizzano metodi in vitro con un controllo più preciso delle condizioni sperimentali rispetto ai modelli in vivo. Film Abbiamo già sviluppato vascolari muscolari sottili (vMTFs) per la misurazione della contrattilità funzionale in vitro progettati tessuti cardiovascolari 5, ma questo metodo è stata limitata a relativamente studi a breve termine. Qui vi presentiamo una tecnica modifica substrato che espande la nostra precedente tecnica vMTF per misure a lungo termine.
Mentre l'endotelio è fondamentale anche in funzione vascolare generale, lamelle arteriosa progettato fornire un sistema modello utile per valutare i cambiamenti in vascolarecontrattilità durante la progressione della malattia. Per progettare un modello di tessuto malattia vascolare funzionale, sia la struttura e la funzione della lamella arteriosa, l'unità contrattile base del recipiente, deve essere riassunta con alta fedeltà. Arteriosa lamelle sono concentrici, fogli circonferenzialmente allineati di VSMC contrattili separati da fogli di elastina 6. Stampa microcontact di matrice extracellulare (ECM) proteine su polidimetilsilossano (PDMS) substrati è stata precedentemente utilizzata per fornire spunti di orientamento per l'organizzazione dei tessuti di imitare allineato tessuto cardiovascolare 5,7-10. Tuttavia, i tessuti modellati utilizzando la stampa microcontact può perdere integrità dopo 3-4 giorni di cultura, limitando la loro applicabilità in studi cronici. Questo protocollo fornisce una soluzione a questo problema, sostituendo tecniche di stampa microcontact precedenti con una nuova tecnica di deposizione microfluidica.
Modificati PDMS substrati con genipina e f Genchi et al.ound prolungata sopravvivenza dei miociti fino a un mese di cultura 11. Qui, usiamo un approccio simile per estendere la cultura delle cellule muscolari lisce vascolari modellate su PDMS. Genipina, un derivato idrolitica naturale della frutta gardenia, è un candidato desiderabile per la modifica del substrato a causa della sua tossicità relativamente bassa rispetto ad agenti reticolanti simili e il suo uso crescente come biomateriale nel campo della riparazione tissutale 12,13 e ECM modifica 14, 15. In questo protocollo, la fibronectina è utilizzata come spunto di orientamento delle cellule, come in metodi di stampa microcontact precedenti; tuttavia, genipina viene depositata su PDMS substrati prima della fibronectina patterning. Così, come le cellule si degradano la matrice fantasia, ECM di nuova sintesi di VSMC collegati può legarsi al substrato PDMS genipina rivestite.
Questo protocollo utilizza un dispositivo di somministrazione microfluidica per due fasi genipina e ECM deposizione. Il design della microfluidica imita dispositivo microcomodelli di stampa ntact utilizzati per lamelle arteriosa progettato in studi precedenti 16. Quindi, ci aspettiamo che questo protocollo di cedere imita lamelle arteriosa che ricapitolano successo altamente allineato per struttura vivo e la funzione contrattile del lamelle arteriosa. Si valutano anche contrattilità tessuto per confermare che genipina è un composto modifica substrato adatto a lungo termine in vitro modelli di malattia vascolare.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Nota: L'obiettivo di questo protocollo è quello di costruire e utilizzare un film vascolare muscolare sottile (vMTF) con la struttura mostrata in Figura 1 per valutare la contrattilità durante la coltura prolungata delle cellule muscolari lisce vascolari (VSMC) su PDMS substrati. Per prolungare la vitalità VSMC, utilizziamo il genipina composto reticolante. I substrati per questi vMTFs sono progettati per analizzare contrattilità tessuto sviluppato da Grosberg et al. 8 Metodi Altro vMTF 5 possono essere utilizzati anche con piccole modifiche al protocollo substrato fabbricazione presentato.
1. Supporto Fabrication
- Pulizia Coverslip
- Mettere 25 millimetri di diametro vetrini in un rack vetrino di colorazione. Inserire la griglia in un grande bicchiere o un contenitore (ad esempio, un 100 vuoto -. 1,000 microlitri pipetta contenitore punta).
- Aggiungere 70% di etanolo al contenitore per immergere completamente i coprioggetti. Li con ultrasuoni per almeno 30 minuti.
- Rimuovere il rack vetrino dalla soluzione di etanolo. Lasciare i coprioggetti di aria secca per impiccagione il rack in una cappa di coltura sterile (per prevenire l'accumulo di particelle su vetrini) per 1- 2 ore.
Nota: i vetrini devono essere completamente asciutti prima i seguenti passaggi.
- Poli (N-iso-propylacrylamide) Isolamento (PIPAAm) Strip su Coverslip
- Utilizzando nastro adesivo, il nastro dai lati di un coprioggetto pulito, lasciando una striscia esposta centrata sul vetrino (Figura 1A). Modificare la larghezza di questa striscia esposta in base all'applicazione e / o progettazione microfluidica.
- Mark i bordi delle strisce di nastro sul vetrino con un pennarello laboratorio per riferimento futuro (Figura 1A).
- Tagliare lungo il perimetro del vetrino per rilasciare dal piatto (Figura 1A, tratteggiata linea rossa).
- Poli (N-iso-propylacrylamide) (PIPAAm) Rivestimento
- Utilizzando una bilancia analitica, pesare 1 g di PIPolvere PAAM. Non utilizzare polimerizzato N-iso-propylacrylamide, che è un agente cancerogeno.
- Trasferire il PIPAAm di una provetta da centrifuga da 50 ml. Aggiungere 10 ml di 1-butanolo all'interno di una cappa chimica per produrre un 10% w / v soluzione. ATTENZIONE: Il punto di infiammabilità di 1-butanolo è di 37 ° C. Conservare la soluzione risultante in un armadio infiammabile ed evitare il riscaldamento.
- Lasciare che il PIPAAm di sciogliere per 10 minuti. Se la polvere è ancora visibile, mescolare la soluzione con un vortice mixer fino a quando tutti si dissolve in polvere.
Nota: Le seguenti operazioni richiedono l'uso di un dispositivo a induzione di rotazione. Per ogni coprioggetto: - Posizionare il vetrino registrato sul mandrino di spin coater con una pinza.
- Trasferire 150 ml di soluzione PIPAAm sul vetrino coprioggetti posizionando goccioline lungo il vetro esposta al centro del vetrino. Assicurare una copertura completa della superficie esposta.
- Cappotto Spin PIPAAm utilizzando la seguente ricetta:
- Rampa 10 sec a 3.000 giri al minuto. Pausa per 5 sec.
- Rampa 10 sec a 6,000 rpm. Pausa per 60 sec.
- Rampa 10 sec a 3.000 giri al minuto. Pausa per 5 sec.
- Mettere il vetrino in una capsula di Petri coperto con la PIPAAm rivolto verso l'alto. Lasciare asciugare per almeno 15 minuti.
- Rimuovere delicatamente il nastro adesivo da tutte le lamelle, lasciando l'intero vetrino esposta con un sottile strato di rivestimento PIPAAm in una striscia centrale.
- PDMS Coating
- Mescolare e degassare 15 g di PDMS in un rapporto di 10: crosslinker: 1 base. Aggiungere 7 - 8 gocce di sonicati 0,2 micron microsfere fluorescenti prima della miscelazione. Coprire la tazza di PDMS con un foglio di alluminio quando non in uso per evitare che polvere e altre particelle di contaminare il PDMS.
Nota: Le seguenti operazioni richiedono l'uso di un dispositivo a induzione di rotazione. Per ogni coprioggetto: - Mettere un copri PIPAAm rivestito sul mandrino di spin coater con una pinza.
- Trasferire PDMS sul vetrino, che copre almeno un terzo della superficie vetrino.
- Cappotto Spin utilizzando il seguente recipe:
- Rampa 5 sec a 500 giri al minuto. Dwell 5 sec.
- Rampa 5 sec a 1.000 giri al minuto. Dwell 5 sec.
- Rampa 10 sec a 3.000 giri al minuto. Dwell 10 sec.
- Rampa 10 sec a 4.000 giri. Dwell 60 sec.
- Rampa 10 sec a 2.000 giri al minuto. Dwell 15 sec.
- Rampa 10 sec a 1.000 giri al minuto. Dwell 10 sec.
- Rampa 5 sec a 500 giri al minuto. Dwell 5 sec.
- Mettere il vetrino in una capsula di Petri coperto con il PDMS rivolto verso l'alto. Registrare il tempo in cui il vetrino era spin-rivestito. Tenere traccia del tempo associato a ciascun coprioggetto tutto l'esperimento per un uso successivo nel determinare lo spessore del substrato PDMS.
- Porre la capsula di Petri contenente i coprioggetti in un forno a 90 ° C per almeno 1,5 ore per garantire la corretta stagionatura PDMS. Se un forno non è disponibile, lasciare che i vetrini cura per almeno 48 ore a temperatura ambiente.
- Togliere i coprioggetti dal forno e riporli in un cassetto buio fino al momento dell'uso.
- Mettere da parte ogni quarto vetrino fo successiva misura di spessore del substrato, in funzione del tempo spin coating, con un profilometro.
- Mescolare e degassare 15 g di PDMS in un rapporto di 10: crosslinker: 1 base. Aggiungere 7 - 8 gocce di sonicati 0,2 micron microsfere fluorescenti prima della miscelazione. Coprire la tazza di PDMS con un foglio di alluminio quando non in uso per evitare che polvere e altre particelle di contaminare il PDMS.
2. Patterning Microfluidic per Ingegneria tessuti
- Fabbricazione di dispositivi microfluidici
- Progettazione di Tissue Photomask Microfluidic
- Utilizzare qualsiasi programma appropriato progettazione assistita da computer per la progettazione di modelli di microfluidica. Per lamelle arteriosa composto da cellule muscolari lisce vascolari arteriose cordone ombelicale umano, utilizzare uno schema alternato di 10 micron canali con 10 micron pareti.
- Utilizzare canale binario ramificazione se possibile 17, ma altri disegni di ramificazione possono essere utilizzati. Diminuire la larghezza e la lunghezza di canali per ogni iterazione ramificazione fino al raggiungimento del modello tessuto desiderata spaziatura (pareti e canali, Figura 1B).
- Progettare il dispositivo di avere un unico ingresso per il trattamento superficiale posizionamento soluzione e una singola presa per l'applicazione del vuoto.
- Fabricate una fotomaschera con il motivo microfluidica (s), come descritto in precedenza 18.
- Fotolitografia Wafer Fabrication
Nota: Eseguire fotolitografia in una camera sterile adatto o struttura similare. Per rendere wafer di silicio con modelli per il morbido fabbricazione litografica di dispositivi microfluidici tessuti (~ 20 - 25 altezza del canale micron) con fotolitografia:- Pulire un wafer di silicio in acetone, metanolo e alcool isopropilico per 1 min ciascuna. Essiccare il wafer con una pistola di azoto.
- Precottura il wafer su una piastra calda per 5 minuti a 115 ° C per rimuovere l'umidità in eccesso.
- Cappotto Spin il wafer con SU-8 3025 photoresist utilizzando la seguente ricetta per produrre presenta 20 - 25 micron di altezza:
- Rampa 5 sec a 500 giri al minuto. Dwell 5 sec.
- Rampa 15 sec a 4.000 giri. Dwell 15 sec.
- Morbida bake il wafer su una piastra riscaldante a 95 ° C per 15 min.
- Caricare un fotomaschera, ed esporre tegli wafer per 16 secondi utilizzando un programma di contatto a vuoto su un assetto maschera contatti.
- Duro cuocere il wafer su una piastra riscaldante a 95 ° C per 4 min.
- Sviluppare il wafer per 6 minuti in sviluppatore. Poi, lavare il wafer due volte per 2 secondi in sviluppatore fresco e sciacquare il wafer con alcool isopropilico.
- Silanate la fantasia wafer O / N mettendo 2-3 gocce di tridecafluoro-triclorosilano in un piatto vuoto all'interno di un essiccatore a vuoto. Prop wafer utilizzando piastre di Petri in modo che sia la parte inferiore e superiore del wafer sono esposti.
ATTENZIONE: Tridecafluro-triclorosilano è un liquido infiammabile e corrosivo. Dispositivi di protezione individuale adeguata e scarico locale è necessario per l'uso.
- Tissue Fabrication dispositivo a microfluidi
- Posizionare un silanata, fantasia wafer funzione rivolta verso l'alto in una capsula di Petri.
- Mescolare e degassare 100 g di PDMS con un rapporto di 10: crosslinker: 1 base. Versare il PDMS nel piatto, completamente e in modo uniforme che copre il wafer.
- Porre la capsula in un essiccatore a vuoto fino a che tutte le bolle d'aria vengono rimosse dai PDMS polimerizzato, di circa 30 min. Curare le PDMS nel piatto a 90 ° C per almeno 1,5 ore. Il tempo e la temperatura può essere regolata come dettato dalle linee guida produzione per ottenere una guarigione completa.
- Una volta che il PDMS è indurito, tagliare le PDMS intorno wafer con una lama di rasoio e rilasciare accuratamente wafer PDMS-coperti dal piatto. Rimuovere PDMS in eccesso sotto wafer e sbucciare lentamente PDM distanza dalla parte superiore del wafer.
- Posizionare il disco PDMS funzione rivolta verso l'alto in un piatto pulito e conservare il wafer al riparo dalla luce dopo l'uso.
- Tagliare il PDMS in eccesso intorno ai modelli con una lama di rasoio. Dispositivi tagliati in forma rettangolare (Figura 1C) per facilitare peeling di dispositivo da substrati in fasi successive. Tagli precisi non sono necessari, finché esiste ampio spazio per l'ingresso, di uscita, e l'area del modello di tessuto (Figura 1C).
- Pugnoingresso e di uscita fori (Figura 1C) utilizzando un 1 millimetro biopsia chirurgica pugno.
- Progettazione di Tissue Photomask Microfluidic
- Microfluidic Deposizione dispositivo
Nota: In questo protocollo, consegna microfluidica è utilizzato per depositare genipina fantasia, l'agente reticolante chiave per la coltura tissutale a lungo termine, e fibronectina. I passaggi precedenti alla penicillina / streptomicina sterilizzazione (2.2.3) non devono avvenire in condizioni di sterilità, ma limitando la contaminazione e la polvere raccolta è incoraggiato in tutto il protocollo. Tutti i passaggi che si verificano dopo la sterilizzazione vetrino con penicillina / streptomicina (2.2.3) dovrebbero utilizzare una tecnica sterile. Nota: Questa porzione del protocollo deve essere iniziata il giorno prima della semina cellulare.- Substrato e Microfluidic dispositivo Preparazione
- Sonicare i dispositivi microfluidici in etanolo al 70% per almeno 30 minuti.
- Asciugare i dispositivi microfluidici sonicati utilizzando aria compressa o azoto, e metterli in un piatto Petri wi° canale è dotato di faccia-up per prevenire usura su di caratteristiche.
- Posizionare un massimo di 10 vMTF vetrini substrato in un detergente UVO (copertura rimossa sul piatto in modo che la superficie è funzionalizzato) per 8 minuti.
- Togliere i coprioggetti UVO-trattati, e posizionare il dispositivi microfluidici funzione rivolto verso il basso su ogni slittamento, uno alla volta (orientamento dovrebbe essere simile alla figura 1C). Premere con decisione sui dispositivi per garantire una tenuta ermetica per i coprioggetti PDMS-rivestite.
- Deposizione di genipina e fibronectina
- Preparare una / soluzione genipina ml 5 mg aggiungendo 1 ml di DDH sterili 2 O ad un contenitore 5 mg di genipina liofilizzato. Mescolare la soluzione con un vortice-mixer. Mettere da parte a temperatura ambiente per almeno 30 minuti.
Nota: La polvere è difficile da solubilizzare a RT, miscelazione in modo ripetitivo per almeno un minuto è spesso necessario. - Rapidamente, una goccia di etanolo al 70% in ingresso di ciascun dispositivo per il dispositivo di innesco. Nota: l'ETHAnol dovrebbe stoppino attraverso i dispositivi.
- Dopo 5 - 10 min, aspirare accuratamente l'etanolo in eccesso in ingresso, immediatamente sostituendolo con 1X tampone fosfato salino (PBS) in entrata. Da questo punto in avanti, assicurarsi di non permettere l'ingresso di diventare perfettamente asciutta per evitare l'introduzione di aria al dispositivo.
- Inserire una punta aspiratore all'uscita di ciascun dispositivo. Disegna 1X PBS attraverso i dispositivi per lavare via l'etanolo. Lasciare una piccola quantità di 1X PBS in ingresso. Nota: Se ingresso appare quasi asciutta, aggiungere più PBS 1X.
- Aspirare eccesso 1X PBS in modo che solo una piccola quantità rimane in ingresso, prima dell'applicazione della soluzione genipina.
- Mettere 60 ml di soluzione genipina 5 mg / ml a ciascun ingresso (Figura 1D). Aspirare la soluzione genipina attraverso i dispositivi posizionando una punta aspiratore in uscita (Figura 1D). Assicurarsi non attirare tutta la soluzione attraverso, lasciando una piccola quantità di soluzione in ingresso.
- Luogo gocce (circa monetina piccola) di 1X PBS sia all'entrata ed all'uscita di mantenere bagnatura durante l'incubazione. Spostare il piatto contenente dispositivi ad un forno o in un incubatore umidificato (ambiente sterile non è necessario) impostati a 37 ° C, e incubare per 4 ore. Il piatto non deve essere coperto.
- Durante l'incubazione, risospendere fibronectina ad una concentrazione di 50 ug / ml in sterile DDH 2 O in ghiaccio per almeno 30 minuti prima dell'applicazione al dispositivo microfluidico.
- Dopo l'incubazione di genipina, aspirare tutti i restanti 1X PBS presso i punti vendita del dispositivo. Continuare ad applicare un aspiratore ad ogni uscita dispositivo, tirando attraverso il restante 1X PBS in ingresso.
- Mettere 100 ml di 50 mg / ml soluzione fibronectina ad ogni ingresso, aggiungendo una quantità minima di residuo 1X PBS in ingresso (Figura 1D).
- Disegnare la soluzione fibronectina attraverso i dispositivi utilizzando una punta aspiratore in uscita ( Figura 1D). Essere sicuri di non ritirare tutta la soluzione attraverso. Nota: goccia fibronectina avrà un aspetto diverso rispetto al PBS 1X e genipina causa di differenze nella tensione superficiale.
- Spostare il piatto scoperto contenente i dispositivi per un forno o incubatore a 37 ° C, e incubare per 24 ore. Nota: Il passo fibronectina non richiede bagnatura di ingresso ed uscita con 1X PBS. La piscina restante della fibronectina all'ingresso si asciuga. Questo è previsto.
- Preparare una / soluzione genipina ml 5 mg aggiungendo 1 ml di DDH sterili 2 O ad un contenitore 5 mg di genipina liofilizzato. Mescolare la soluzione con un vortice-mixer. Mettere da parte a temperatura ambiente per almeno 30 minuti.
- Sterilizzazione e preparazione per la semina delle cellule
- Preparare una soluzione della penicillina / streptomicina per la sterilizzazione di lamelle fantasia vMTF. Aggiungere 5 ml di penicillina / streptomicina (10.000 unità / ml; 10.000 mg / ml) a 500 ml di sterile PBS 1X.
- Porre la capsula contenente i dispositivi in una cappa di biosicurezza sterile.
- Rimuovere con attenzione i dispositivi dai coprioggetto lentamente peeling il dispositivo in un angolo, mentre leggermente afferrando il vetrino in mano opposta.Nota: Questo passaggio richiede pratica per ridurre i danni vetrino nel processo di rimozione. Un'alternativa sta usando una siringa per iniettare 1X PBS in ingresso e / o di uscita per facilitare il rilascio del dispositivo.
- Mettere i coprioggetti in piatti a sei pozzetti sterili. Aggiungere almeno 5 ml di soluzione di penicillina / streptomicina in ciascun pozzetto. Porre le capsule in un incubatore sterile a 37 ° C per almeno 30 min.
- Dopo la sterilizzazione, aspirare la soluzione di penicillina / streptomicina, e seminare il coprioggetto con colta umano arteria ombelicale vascolare cells19 muscolatura liscia (Figura 1D). La concentrazione di semina per VSMCs è ~ 80.000 cellule per cm 2. Per ridurre il numero di cellule necessarie per ogni campione, utilizzare un riduttore per ridurre l'area di semina. Un esempio di un riduttore è il top taglio di un tubo da 15 ml attaccato al coprioggetto con grasso per vuoto sterile prima della semina.
- Incubare i coprioggetti seminate in un incubatore sterile a 37 ° C e 5% CO 2 e consentire le cellule seminate per fissare e formare allineati arteriosi imita lamelle O / N (Figura 2A-B).
- A lungo termine Cultura vMTF Tissue
- Un giorno, dopo la semina, rimuovere il supporto cellulare e riduttori. Sciacquare i tessuti con PBS 1X. Aggiungere 4 ml di terreno cellulare privo di siero per indurre un fenotipo contrattile nel VSMCs 20.
- Ripetere il risciacquo 1X PBS e l'aggiunta di mezzo privo di siero fresco ogni altro giorno desiderato per coltura a lungo termine.
- Substrato e Microfluidic dispositivo Preparazione
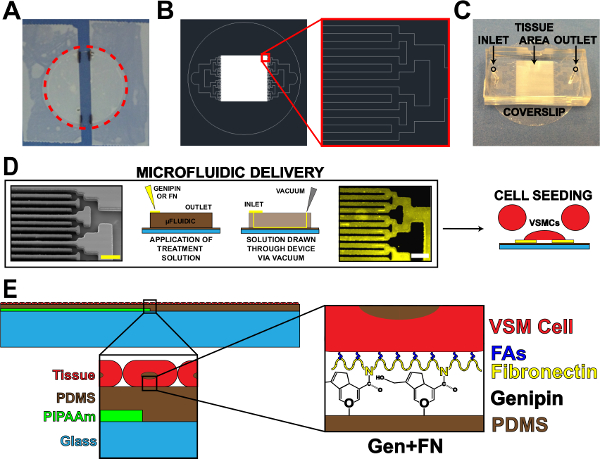
Figura 1. Microfluidic Dispositivo di proteine di consegna. (A) nastrate off vetrino per il rivestimento PIPAAm. Red cerchio punteggiato: percorso di taglio per liberare coprioggetto (B) disegno AutoCAD Rappresentante del tessuto microfluidica modello di maschera.. Inserto: Particolare di ramificazione binario a AlternDELL'INDICE DI 10 micron x 10 micron modello di tessuto. (C) Collocamento di dispositivo a microfluidi su un substrato vetrino con ingresso e uscita indicata. (D) Schema di microfluidica proteine patterning e la consegna. Immagine microscopio elettronico a scansione dei canali microfluidica (barra della scala:: 50 micron) da sinistra a destra; Schematico dettagliata del metodo di deposizione di proteine; Immunoistochimica fibronectina macchiato (barra della scala: 50 micron); Semina delle cellule con le cellule muscolari lisce vascolari. (E) Schema di tessuto fabbricato. 1 ° inserto: Particolare di costruzione a strati. 2 ° inserto: Particolare di genipina modifica di substrato PDMS dopo la deposizione microfluidica. © IOP Publishing. Riprodotto e / o modificati con il permesso. Tutti i diritti riservati. 19 , cliccate qui per vedere una versione più grande di questa figura.
3. Tessuto Funzione Analisi con vMTF contrattilità Assay
Nota: Il test MTF contrattilità qui presentata è modellato dopo la tecnica sviluppata in Grosberg et al 8.
- vMTF contrattilità Experiment
- Collocare un campione di tessuto in un piatto a 100 mm. Aggiungere solution8 di sterile 1X Tyrode a pH 7,4 riscaldato a 37 ° C per coprire il campione.
- Utilizzare una lama di rasoio per fare diversi tagli paralleli perpendicolari al bordo PIPAAm. Effettuare tagli in modo che produce sezioni di tessuto più ampio che sarà il vMTFs (con larghezza ~ 2 mm) alternate a strisce sottili (Figura 3A, tagli laterali). Per effettuare tagli puliti, posizionare una lama di rasoio in contatto con il campione e saldamente trascinarli sul lato.
- Ruotare il piatto 90 ° e fare due tagli paralleli rettilinei nel mezzo del tessuto, parallelamente alla striscia di PIPAAm (Figura 3A, tagli finali). Rimuovere e smaltire la striscia sciolto di tessuto tra queste taglios e le strisce sottili tra vMTFs (taglio nel passaggio precedente) per impedire il film adiacenti da fare contatto.
- Lasciare il campione riposare a temperatura ambiente per 10 min, o fino a quando tutto il PIPAAm è dissolta. Nota: se PIPAAm rimane in passi successivi, campione può essere restituito al piatto di taglio di sciogliere PIPAAm residua. Un raschiatura dolce della parte inferiore di vMTF può aiutare nella rimozione PIPAAm, come necessario.
- Mettere un piccolo punto di grasso per vuoto in un ambiente pulito 35 millimetri piastra di Petri. Aggiungere 5 ml di soluzione fresca, sterile 1X Tyrode a 37 ° C. Trasferire il vetrino con i film di taglio del piatto 100 millimetri al piatto 35 mm, e premere sul grasso per vuoto per impedire il movimento del vetrino.
- Porre la capsula in una piattaforma a temperatura controllata sul palco stereomicroscopio.
- Capture time-lapse trasmessa e immagini fluorescenti a intervalli desiderati (ad es., 30 sec) durante test trattamento.
- Di serie trattare vMTFs con 50 nm endotelina-1 per 20 min (contrazione indotta) e 100 mM HA-1077 per 30 min (rilassamento dei tessuti). Aggiungere soluzioni concentrate di ogni trattamento al piatto sperimentale contenente 5 ml di soluzione sterile di 1X Tyrode in momenti specifici, ottiene il trattamento concentrazione desiderata nel volume 5 ml. Fai aggiunte di trattamento durante l'intervallo tra le acquisizioni di immagini time-lapse per evitare la cattura pipetta in immagini.
- vMTF contrattilità Analisi
- Utilizzando coprioggetto accantonati 1.4.8, misurare lo spessore del substrato PDMS con un profilometer21. Creare uno spessore rispetto curva del tempo di rotazione per ogni set di lamelle. Utilizzare questa curva per stimare lo spessore vMTF per ogni coprioggetto utilizzato in un esperimento contrattilità.
- Misurare le lunghezze di proiezione vMTF per ogni punto di tempo durante l'esperimento, e calcolare i raggi di curvatura associata (figura 3B) con metodi precedentemente riportati 8.
- Calcola lo stress vMTF in ogni momento point con precedenti metodi vMTF 5.
Nota: utilizzare lo spessore vMTF stima calcolata da 3.2.1. Misurare spessore VSMC utilizzando immagini confocale, come riportato in precedenza 9. Ottenere modulo di PDMS Young da schede tecniche dell'azienda.
Access restricted. Please log in or start a trial to view this content.
Risultati
L'obiettivo principale di questo lavoro è stato quello di estendere la validità di VSMCs micropatterned su PDMS idrofobiche substrati. Ciò è stato realizzato incorporando un sistema di consegna microfluidico depositare genipina modellata e fibronectina su PDMS (Figura 1). Deposizione di proteine ECM utilizzando l'invio microfluidica prodotto alto trasferimento fedeltà del modello di canale con PDMS nude tra le linee di genipina e fibronectina (Figura 1D). Le cellule a...
Access restricted. Please log in or start a trial to view this content.
Discussione
Qui, vi presentiamo un protocollo che si basa sulla tecnologia vMTF precedentemente sviluppato, consentendo tempi prolungati esperimento più tipico dei percorsi croniche malattie vascolari 1,23,24. Per realizzare ciò, si micropattern genipina, che è stato precedentemente dimostrato di fornire funzionalizzazione a lungo termine di substrati PDMS 11, utilizzando una tecnica di deposizione microfluidi cedere lamelle arteriosa progettato con migliorata viabilità tessuto vascolare per esperimenti co...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
Riferimenti
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon