Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микрожидкостных генипин осаждения Техника для расширенной культуры Micropatterned сосудистых мышечной тонких пленок
В этой статье
Резюме
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
Аннотация
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
Введение
Сосудистые заболевания, такие как церебральный вазоспазм 1,2, гипертонии 3 и 4, атеросклероза развиваются медленно, как правило, хронический характер, и привлечь неблагополучных силы поколения сосудистыми гладкомышечных клеток (VSMCs). Мы стремимся, чтобы изучить эти медленно прогрессирующее-сосудистых дисфункций, используя в пробирке методами с более точного управления экспериментальных условиях, чем в естественных условиях модели в. Ранее мы уже разработаны сосудистые мышечные тонкие пленки (vMTFs) для измерения функциональной сократительной в пробирке инженерии тканей сердечно-сосудистых 5, но этот способ был ограничен относительно краткосрочные исследования. Здесь мы представляем технику модификации субстрата, который расширяет наш предыдущий метод vMTF для долгосрочных измерений.
В то время как эндотелий также имеет важное значение в общей сосудистой функции, разработаны артериальной ламели обеспечивают полезную модель системы оценки изменения в сосудистойсократимость во прогрессирования заболевания. Чтобы сконструировать функциональную модель сосудистых заболеваний тканей, как структуру и функцию артериальной ламели, основной единицей сократительного сосуда, должна быть воспроизводятся с высокой точностью. Артериальная ламели представляют собой концентрические окружности, выровненный листы сократительных VSMCs разделенных листов эластина 6. Микроконтактной печати внеклеточного матрикса (ЕСМ) белки на полидиметилсилоксановых (PDMS) подложках ранее использовались, чтобы обеспечить сигналы наведения для тканевой организации, чтобы имитировать выровнены сердечно-сосудистой ткани 5,7-10. Тем не менее, ткани с рисунком, используя микроконтактной печати может потерять целостность после 3-4 дней в культуре, что ограничивает их применимость в длительных исследованиях. Этот протокол обеспечивает решение этой проблемы путем замены предыдущих методов микроконтактная печати с новой техникой микрофлюидного осаждения.
Генчи др. Модифицированные PDMS субстраты с генипин и Fкруглый продлен жизнеспособность миоцитов до одного месяца в культуре 11. Здесь мы используем аналогичный подход, чтобы расширить культуру рисунком гладкомышечных клеток сосудов ПДМС. Генипин, естественно гидролитической производное гардении фруктов, является желательным кандидатом для модификации подложки из-за его относительно низкой токсичности по сравнению с аналогичными сшивающих агентов и его более широкое использование в качестве биоматериала в области восстановления тканей 12,13 и модификации ECM 14, 15. В этом протоколе, фибронектин используется в качестве ячейки наведения команде, как и в предыдущих методов микроконтактная печати; Однако, генипин осаждается на подложках PDMS до фибронектина паттерна. Таким образом, как клетки деградируют в узорной матрицу, вновь синтезированный ЕСМ из прилагаемых VSMCs может связываться с генипин покрытием PDMS подложки.
Этот протокол использует микрожидкостных доставки устройство для двухступенчатой генипин и осаждения ECM. Дизайн микрожидкостных имитирует устройство microcontact модели печатные, используемые для инженерных артериальной ламелей в предыдущих исследованиях 16. Таким образом, мы ожидаем, что этот протокол для получения артериальной ламели имитирует, что успешно воспроизводят высоко выровнены в структуре естественных и сократительной функции артериальной ламелей. Мы также оценить сократительную ткань, чтобы подтвердить, что это генипин подходит модификация субстрата соединение для долгосрочного в пробирке моделей сосудистых заболеваний.
Access restricted. Please log in or start a trial to view this content.
протокол
Примечание: Цель данного протокола состоит в построении и использовать сосудистую мышечную тонкую пленку (vMTF) со структурой, показанной на рисунке 1, чтобы оценить сократимость течение длительного культуре сосудистых гладкомышечных клеток (VSMCs) ПДМС субстратов. Чтобы продлить жизнеспособность VSMC, мы используем сшивающий соединение генипин. Подложки для этих vMTFs предназначены для анализа тканей сократимость, разработанной Гросберг др. 8 Другие методы vMTF 5 также могут быть использованы, с тонкими изменениями в представленной протокола изготовления подложки.
1. Изготовление основания
- Покровное очистки
- Поместите диаметром 25 мм покровные стекла в окрашивания покровное стойки. Поместите стойку в большой стакан или контейнер (например, пустой 100 -. 1000 мкл пипетки наконечник контейнера).
- Добавить 70% этанола в контейнер, чтобы полностью погрузить покровные. Разрушать ультразвуком их в течение по крайней мере 30 мин.
- Удалить покровное стойки из раствора этанола. Разрешить покровные высохнуть на воздухе через повешение стойку в стерильной капот культуры (чтобы предотвратить накопление частиц на покровные) для 1- 2 часа.
Примечание: Покровные стекла должны быть абсолютно сухими до следующих шагов.
- Поли (N-изо-пропилакриламид) (PIPAAm) Газа Изоляция на покровное
- Использование клейкой ленты, ленты по бокам от очищаемой покровного, оставляя открытую полосу по центру на покровное (рис 1А). Изменить ширину полосы этом открытом, основанной на применении и / или микрофлюидного дизайна.
- Марк края ленты полоски на покровное с использованием лабораторного маркера для последующего использования (рис 1А).
- Сокращение по периметру покровное, чтобы освободить от чашки (фиг.1А, пунктирная красная линия).
- Поли (N-изо-пропилакриламид) (PIPAAm) Покрытие
- Использование аналитических весов, весят 1 г PIPAAm порошок. Не следует использовать Неполимеризованные N-изо-пропилакриламид, который является канцерогеном.
- Передача PIPAAm к 50 мл центрифужную пробирку. Добавьте 10 мл 1-бутанола в химической капотом с получением 10% вес / об раствора. ВНИМАНИЕ: Температура вспышки 1-бутанола составляет 37 ° С. Храните полученный раствор в горючей шкафу и избежать нагрева.
- Разрешить PIPAAm распустить в течение 10 мин. Если порошок до сих пор видны, смешайте решение не используя вихревой смеситель-пока все порошок, хорошо растворимый.
Примечание: Следующие шаги требуют использования спинового нанесения покрытий. Для каждого покровное: - Поместите покровное приклеенный на спин нанесения покрытий патрон с щипцами.
- Передача 150 мкл раствора PIPAAm на покровное путем размещения капель вдоль открытого стекла в центре покровного стекла. Убедитесь, полный охват области воздействия.
- Спин пальто PIPAAm с помощью следующей рецепт:
- Рампа 10 сек до 3000 оборотов в минуту. Остановимся на 5 сек.
- Рампа 10 сек до 6,000 мин. Остановимся на 60 сек.
- Рампа 10 сек до 3000 оборотов в минуту. Остановимся на 5 сек.
- Поместите покровное в крытой чашке Петри с PIPAAm вверх. Дайте высохнуть в течение по крайней мере 15 мин.
- Осторожно снимите клейкую ленту из всех покровные, оставляя полную открытую покровное с тонким слоем покрытия PIPAAm в центральной полосе.
- PDMS покрытие
- Смешайте и дегазации 15 г PDMS в соотношении 10: сшивающего: 1 база. Добавить 7 - 8 капель ультразвуком 0,2 мкм флуоресцентные микрошарики перед смешиванием. Накройте чашку PDMS с алюминиевой фольгой, когда он не используется для предотвращения попадания пыли и других частиц из загрязняя PDMS.
Примечание: Следующие шаги требуют использования спинового нанесения покрытий. Для каждого покровное: - Поместите покровное PIPAAm покрытием на спин нанесения покрытий патрон с щипцами.
- Перевести PDMS на покровное, охватывающий, по меньшей мере одна треть площади покровного.
- Спин пальто, используя следующую Recipе:
- Ramp 5 сек до 500 оборотов в минуту. Остановимся 5 сек.
- Ramp 5 сек до 1000 оборотов в минуту. Остановимся 5 сек.
- Рампа 10 сек до 3000 оборотов в минуту. Остановимся 10 сек.
- Рампа 10 сек до 4000 оборотов в минуту. Остановимся 60 сек.
- Рампа 10 сек до 2000 оборотов в минуту. Остановимся 15 сек.
- Рампа 10 сек до 1000 оборотов в минуту. Остановимся 10 сек.
- Ramp 5 сек до 500 оборотов в минуту. Остановимся 5 сек.
- Поместите покровное в крытой чашке Петри с PDMS вверх. Запишите время, когда покровное был спин-покрытием. Следите за время, связанное с каждым покровным в течение всего эксперимента для последующего использования при определении толщины подложки PDMS.
- Поместите чашку Петри, содержащую покровные в 90 ° C сушильном шкафу в течение по меньшей мере 1,5 ч, чтобы обеспечить надлежащее отверждение PDMS. Если печь не доступен, пусть покровные вылечить в течение по крайней мере 48 часов при комнатной температуре.
- Удалить покровные из духовки и не храните их в темном ящике, пока готов к использованию.
- Отложите каждый четвертый покровное еили выше измерение толщины подложки, как функция времени нанесения покрытия, с профилометра.
- Смешайте и дегазации 15 г PDMS в соотношении 10: сшивающего: 1 база. Добавить 7 - 8 капель ультразвуком 0,2 мкм флуоресцентные микрошарики перед смешиванием. Накройте чашку PDMS с алюминиевой фольгой, когда он не используется для предотвращения попадания пыли и других частиц из загрязняя PDMS.
2. Микрожидкостных рисунок для инженерных тканей
- Изготовление микрофлюидных устройств
- Дизайн тканей микрофлюидных Photomask
- Используйте любой соответствующую программу автоматизированного проектирования для разработки микрожидкостных узоры. Для артериальной пластин, состоящей из артерии пуповины гладкомышечных клеток сосудов человека, используют переменный образец 10 мкм каналов с 10 мкм стен.
- Используйте двоичный канал разветвления, если это возможно 17, но могут быть использованы другие конструкции ветвления. Уменьшите ширину и длину каналов для каждого разветвления итерации до достижения желаемого ткани шаблон оформления (стены и каналы, рис 1б).
- Конструкция устройства имеют один вход для обработки поверхности размещения раствора и одной выходной для применения вакуума.
- Потрясающийricate фотомаски содержащий микрожидкостных дизайн (ы), как описано ранее 18.
- Фотолитография подложек
Примечание: Выполнение фотолитографии в подходящем помещения или аналогичный объект. Для того, чтобы кремниевых пластин с узорами для мягкой литографических изготовления тканей микрофлюидных устройств (~ 20 - 25 мкм высота канала) с использованием фотолитографии:- Очистить кремниевой пластины в ацетон, метанол и изопропиловый спирт в течение 1 мин каждый. Высушите пластины с пистолетом азота.
- Предварительного обжига пластины на горячей плите в течение 5 мин при 115 ° С для удаления избытка влаги.
- Спин пальто пластина с SU-8 3025 фоторезиста с помощью следующей рецепт, чтобы получить располагает 20 - 25 мкм в высоту:
- Ramp 5 сек до 500 оборотов в минуту. Остановимся 5 сек.
- Рампа 15 сек до 4000 оборотов в минуту. Остановимся 15 сек.
- Мягкие выпекать пластины на горячей плите при 95 ° С в течение 15 мин.
- Загрузите фотошаблона, и подвергать тон полупроводниковой пластине в течение 16 с использованием вакуумного контактную программу на контакт Aligner маски.
- Жесткий выпекать пластины на горячей плите при 95 ° С в течение 4 мин.
- Разработка пластины для 6 мин в разработчика. Затем промыть пластины в два раза в течение 2 сек в пресной разработчика и промыть пластины с изопропилового спирта.
- Silanate узорный пластины O / N путем размещения 2 - 3 капли tridecafluoro-трихлорсилана в пустую чашку в вакуумном эксикаторе. Поддерживают пластины с использованием чашек Петри так, чтобы и в нижней и верхней части пластины подвергаются.
ВНИМАНИЕ: Tridecafluro-трихлорсилана воспламеняется и коррозионную жидкость. Правильное индивидуальной защиты и местной вытяжной необходимо для использования.
- Ткань Изготовление Микрожидкостных Устройство
- Поставьте силанизировать, узорной пластины особенность стороной вверх в чашке Петри.
- Смешайте и дегазации 100 г PDMS с соотношении 10: сшивающего: 1 база. Вылейте PDMS в блюдо, полностью и равномерно покрывая пластины.
- Поместите блюдо в вакуумном эксикаторе, пока все пузырьки воздуха не будут удалены из неотвержденных PDMS, около 30 мин. Вылечить PDMS в чашке при 90 ° С в течение по меньшей мере 1,5 ч. Время и температуру можно отрегулировать, как диктуется принципов производства для получения полного излечения.
- После отверждения PDMS, вырезать PDMS около пластины с лезвием и тщательно освободить PDMS покрытые пластины из тарелки. Удалить лишние PDMS под пластины и медленно корка PDMS от верхней пластины.
- Поместите PDMS диск особенность стороной вверх в чистую чашку и хранить пластины от света после использования.
- Срежьте лишние PDMS от вокруг шаблоны, используя лезвие бритвы. Cut устройства в прямоугольных форм (рис 1в), чтобы облегчить шелушение устройства из субстратов в последующих шагах. Точные разрезы не нужны, если достаточно пространство существует для впускного, розетки, и рисунок ткани области (рис 1в).
- Панчвпускные и выпускные отверстия (рис 1в) с использованием 1 мм хирургической биопсии удар.
- Дизайн тканей микрофлюидных Photomask
- Микрожидкостных Нанесение Устройство
Примечание: В этом протоколе, Микрожидкостных доставки используется для нанесения рисунком генипин, ключевой сшивающий агент для долгосрочного культивирования тканей, а также фибронектин. Шаги до пенициллина / стрептомицина стерилизации (2.2.3) не нужно проходить в стерильных условиях, но ограничения загрязнения и пыли коллекция призвал на протяжении протокола. Все шаги, происходящие после покровного стерилизации пенициллина / стрептомицина (2.2.3) следует использовать стерильную технику. Примечание: Эта часть протокола должна быть запущена один день до посева клеток.- Основания и Микрожидкостных Устройство Подготовка
- Разрушать ультразвуком микрожидкостных устройства в 70% этаноле в течение не менее 30 мин.
- Высушите ультразвуком микрожидкостных устройства с помощью сжатого воздуха или азота, и поместите их в блюдо Wi-Петрий канал имеет лицевой стороной вверх, чтобы предотвратить излишний износ от особенностей.
- Поместите до 10 vMTF подложки покровные в уборщицей УВО (крышка снята на блюдо так, поверхность функционализируют) в течение 8 мин.
- Снимите УВО обработанных покровные, и поместите микрофлюидных устройства имеют стороной вниз на каждой скольжения по одному за раз (ориентация должна быть похожа на рис 1С). Плотно прижмите устройств, чтобы обеспечить плотное прилегание к PDMS-покрытием покровные.
- Отложение генипин и фибронектина
- Подготовка 5 мг / мл раствора генипин добавлением 1 мл стерильной DDH 2 O в 5 мг лиофилизированного контейнера генипин. Смешайте раствор с помощью вихревого смесителя-. Отложите при комнатной температуре в течение по крайней мере 30 мин.
Примечание: порошок трудно растворить при комнатной температуре, так повторяющиеся перемешивание в течение по крайней мере одну минуту часто необходимо. - Быстро, поместить каплю 70% -ного этанола на входе каждого устройства для заправки устройства. Примечание: ETHAnol должны фитиль через устройства.
- После 5 - 10 мин, тщательно аспирата избыток этанола на входе, сразу же заменив его 1X фосфатным буферным раствором (PBS) на входе. С этого момента, обязательно, чтобы не допустить на входе, чтобы стать полностью сухим, чтобы избежать введения воздуха в устройстве.
- Поместите наконечник Вакуумный аспиратор на выходе из каждого устройства. Нарисуйте 1X PBS через устройства для полоскания этанола прочь. Оставьте небольшое количество 1X PBS на входе. Примечание: Если на входе появляется почти сухой, добавьте больше 1X PBS.
- Аспирируйте избыток 1X PBS, так что только небольшое количество остается на входе перед нанесением раствора генипин.
- Поместите 60 мкл 5 мг / мл раствора генипин на каждом входе (рис 1D). Нарисуйте генипин решение через устройств путем размещения аспиратор наконечник вакуумного на выходе (рис 1D). Будьте уверены, чтобы не привлечь все решения через, оставив небольшое количество раствора на входе.
- Место капли (приблизительно центов размера) от 1X PBS как на входе и на выходе, чтобы поддерживать смачивание в процессе инкубации. Перемещение блюдо, содержащее устройства для влажной духовке или инкубатора (стерильной среде не надо), установленные до 37 ° С, и инкубируют в течение 4 ч. Тарелки не должны быть покрыты.
- Во время инкубации, ресуспендируют фибронектин в концентрации 50 мкг / мл в стерильной DDH 2 O на льду в течение по крайней мере 30 минут до нанесения на микрожидком устройства.
- После инкубации генипин, аспирация все оставшиеся 1X PBS на выходах устройств. Продолжать применять вакуумный аспиратор на каждом выходе устройства, потянув в течение оставшегося 1X PBS на входе.
- Поместите 100 мкл 50 мкг / мл раствора фибронектина на каждом входе, добавляя к минимальным количеством оставшегося 1X PBS на входе (рис 1D).
- Нарисуйте фибронектина решение через устройств, использующих наконечник вакуумного аспиратора на выходе ( Рисунок 1D). Будьте уверены, чтобы не привлечь все решения через. Примечание: Фибронектин падение будет выглядеть несколько иначе, чем 1X PBS и генипин из-за различий в поверхностного натяжения.
- Перемещение непокрытой тарелку, содержащую устройства в печи или инкубатор до 37 ° С, и инкубируют в течение 24 ч. Примечание: шаг фибронектин не требует смачивания входе и выходе с 1X PBS. Остальные бассейн фибронектина на входе будет высыхать. Ожидается, что это.
- Подготовка 5 мг / мл раствора генипин добавлением 1 мл стерильной DDH 2 O в 5 мг лиофилизированного контейнера генипин. Смешайте раствор с помощью вихревого смесителя-. Отложите при комнатной температуре в течение по крайней мере 30 мин.
- Стерилизация и подготовка для сотового Раздают
- Приготовьте раствор пенициллина / стрептомицина для стерилизации узорные vMTF покровные. Добавляют 5 мл пенициллина / стрептомицина (10000 единиц / мл; 10,000 мкг / мл) к 500 мл стерильного 1X PBS.
- Поместите блюдо, содержащее устройств в стерильных капот биобезопасности.
- Осторожно удалите устройства от покровных медленно пилинг устройство на углу, в то время как слегка захватывая покровное в противоположную руку.Примечание: Этот шаг требует практики, чтобы уменьшить ущерб покровное в процессе удаления. Альтернативой является использование шприца, чтобы ввести 1X PBS на входе и / или выходе, чтобы помочь в освобождении устройства.
- Поместите покровные в стерильные чашки шесть скважин. Добавить по крайней мере, 5 мл пенициллина / стрептомицина раствора в каждую лунку. Поместите посуду в стерильном инкубаторе при 37 ° С в течение не менее 30 мин.
- После стерилизации, аспирации раствор пенициллина / стрептомицина, и семян покровные с культивированных человеческих пупочной артерии гладкие мышцы сосудов cells19 (рис 1D). Концентрация посева для VSMCs составляет ~ 80000 клеток на см 2. Чтобы уменьшить количество клеток, необходимых для каждого образца, использовать редуктор для уменьшения площади посева. Одним из примеров является редуктором разрез верхней части 15 мл коническую пробирку, прикрепленной к покровным стерильной вакуумной смазки перед посевом.
- Инкубируйте семенами покровные в стерильном инкубаторе при температуре 37 ° С и 5% CO 2 и позволяют семенами клеткам прикрепляться и образовывать выровненные артериальных ламели имитирует O / N (2А-Б).
- Долгосрочный vMTF культуры ткани
- Однажды после посева, удалить среду клеток и редукторов. Промыть тканей с 1X PBS. Добавить 4 мл бессывороточной среды клеток, чтобы индуцировать фенотип сократительную в VSMCs 20.
- Повторите промывание PBS 1X и добавлением свежего бессывороточной среде каждый день, как требуется для долгосрочного культуры.
- Основания и Микрожидкостных Устройство Подготовка
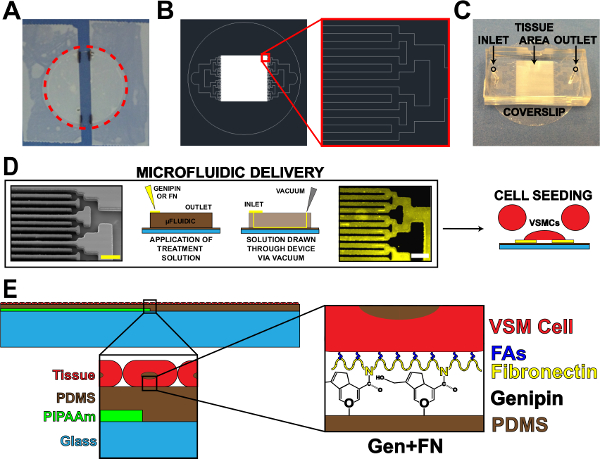
Рисунок 1. микрофлюидных устройство Белок доставки. () Замаскированы покровное для PIPAAm покрытия. Красный пунктирный круг: резка путь, чтобы освободить покровное (Б) представитель AutoCAD рисунок ткани микрофлюидного шаблон маски.. Врезка: Деталь двоичной ветвления в Alternтем создания 10 мкм х 10 мкм образец ткани. (С) размещение микрожидком устройства на покровное подложки с входом и выходом указано. (D) Схема микрожидком паттерна белка и доставки. Слева-направо: сканирующий электронный микроскоп изображение микроканалов (масштаб бар: 50 мкм); Подробную схему способа для осаждения белка; Иммуногистохимия окрашенных фибронектин (масштаб бар: 50 мкм); Сотовый посева с сосудистыми гладкие мышечные клетки. (Е) Схема сфабрикованному ткани. 1-й вставка: Деталь слоистой конструкции. 2-й вставка: Деталь модификации генипин из PDMS подложки после осаждения микрофлюидного. © Издательский ВГД. Воспроизводится и / или изменения с разрешения. Все права защищены. 19 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
3. Ткань Анализ Функция с vMTF сократимость анализе
Примечание: MTF сократимость анализ, представленный здесь, по образцу методике, разработанной в Гросберга др 8.
- vMTF Сократимость Эксперимент
- Поместите образец ткани в 100 мм блюдо. Добавить раствора8 стерильного 1X Тирода при рН 7,4 нагревают до 37 ° С, чтобы покрыть образец.
- Используйте лезвие, чтобы сделать несколько параллельных разрезов, перпендикулярных к краю PIPAAm. Сделайте сокращения образом, что дает более широкие слои ткани, которые будут vMTFs (с шириной ~ 2 мм), чередующихся с тонкими полосками (рис 3А, боковые порезы). Для того, чтобы чистые сокращения, поместите лезвие бритвы в контакте с образцом и твердо перетащить в сторону.
- Поверните блюдо на 90 ° и сделать две прямые, параллельные разрезы в середине ткани, параллельно полосе PIPAAm (рис 3А, конечные сокращений). Снимите и выбросьте рыхлой полосой ткани между этими разрезас и тонкие полоски между vMTFs (вырезать в предыдущем шаге), чтобы предотвратить смежные фильмы от контакта.
- Разрешить образец отдохнуть при комнатной температуре в течение 10 мин, или пока все PIPAAm не растворится. Примечание: Если PIPAAm остается в будущих шагов, образец может быть возвращен к режущей тарелки для растворения остаточного PIPAAm. Нежный скрип нижней vMTF может помочь в удалении PIPAAm, по мере необходимости.
- Нанесите небольшое пятнышко вакуумной смазки в чистом 35 мм чашки Петри. Добавьте 5 мл раствора свежего, стерильного 1X Тирода при 37 ° С. Передача покровное с вырезом фильмов из 100-мм блюдо 35 мм блюдо и нажмите на вакуумной смазкой, чтобы предотвратить движение покровного стекла.
- Поместите блюдо в платформе контролируемой температурой на этапе стереомикроскопа.
- Захват покадровой передается и люминесцентные изображения в требуемые интервалы (например,., 30 сек) на протяжении всего лечения анализе.
- Серийно лечения vMTFs с 50 нМ эндотелина-1 в течение 20 мин (индуцированной сжатие) и 100 мкМ HA-1077 в течение 30 мин (тканевой релаксации). Добавить концентрированные растворы каждой обработки в экспериментальной чашке, содержащей 5 мл стерильного раствора 1X Тирода в определенные моменты времени, получая целевой концентрации лечения в объеме 5 мл. Сделайте дополнения лечения в течение интервала между приобретений покадровой изображения, чтобы избежать захвата пипетки на изображениях.
- vMTF Сократимость анализ
- Использование покровные отведенных в 1.4.8, измерьте PDMS толщину подложки с profilometer21. Создать толщину против кривой времени спин для каждого набора покровные. Используйте эту кривую, чтобы оценить толщину vMTF для каждого покровного используется в эксперименте сократимости.
- Мера длины проекции vMTF для каждой временной точке в ходе эксперимента, и вычислить соответствующий радиус кривизны (Фиг.3В), используя ранее сообщалось о способах 8.
- Рассчитать vMTF стресс в каждый момент времени роInt, используя предыдущие методы vMTF 5.
Примечание: Используйте расчетная толщина vMTF рассчитывается из 3.2.1. Измерьте толщину VSMC с помощью конфокальной изображения, как сообщалось ранее 9. Получить модуль Юнга PDMS от паспортах компания.
Access restricted. Please log in or start a trial to view this content.
Результаты
Основная цель данной работы было продлить жизнеспособность micropatterned VSMCs на гидрофобных субстратов PDMS. Это было достигнуто путем включения микрожидкостных систему доставки, чтобы внести рисунком генипин и фибронектин на PDMS (рис 1). Отложение ECM белков с использованием микрожидк...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Здесь мы приводим протокол, который строит на ранее разработанной технологии vMTF, позволяя расширенные раз эксперимент более характерно хронических сосудистых заболеваний путей 1,23,24. Чтобы достичь этого, мы micropattern генипин, который ранее было показано, чтобы обеспечить долговрем?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
Ссылки
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены