Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El uso del ensayo de Ramsay medir la secreción de fluidos y de iones Flux tarifas en el
En este artículo
Resumen
Este protocolo describe el uso del ensayo de Ramsay para medir las tasas de secreción de fluidos aislados de Malpighi (renal) túbulos de Drosophila melanogaster. Además, el uso de electrodos de ión específico para medir las concentraciones de sodio y potasio en el líquido secretado, lo que permite el cálculo del flujo de iones transepitelial, se describe.
Resumen
La modulación de transporte de iones epiteliales renales permite a los organismos para mantener la homeostasis iónica y osmótica en la cara de la variación de las condiciones externas. La Drosophila melanogaster Malpighi (renal) túbulo ofrece una oportunidad sin precedentes para estudiar los mecanismos moleculares de transporte iónico epitelial, debido a los poderosos genética de este organismo y la accesibilidad de sus túbulos renales al estudio fisiológico. Aquí se describe el uso del ensayo de Ramsay para medir las tasas de secreción de líquido de los túbulos renales aislados de moscas, con el uso de electrodos de iones específicos para medir las concentraciones de sodio y potasio en el líquido secretado. Este ensayo permite el estudio de fluido transepitelial de iones y los flujos de ~ 20 túbulos a la vez, sin la necesidad de transferir el fluido secretado a un aparato separado para medir las concentraciones de iones. Genéticamente túbulos distintas se pueden analizar para evaluar el papel de genes específicos en procesos de transporte. Además, el bsolución salina athing puede ser modificado para examinar los efectos de sus características químicas o fármacos u hormonas añadidas. En resumen, esta técnica permite la caracterización molecular de los mecanismos básicos de transporte epitelial de iones en el túbulo Drosophila, así como la regulación de estos mecanismos de transporte.
Introducción
Transporte iónico epitelial renal subyace ionosfera del organismo y la osmorregulación. La Drosophila melanogaster Malpighi (renal) túbulo ofrece una oportunidad sin precedentes para estudiar los mecanismos moleculares de transporte iónico epitelial. Esto es debido a la combinación de las poderosas genética de Drosophila, emparejado con la accesibilidad de sus túbulos renales a estudio fisiológico. El ensayo de Ramsay, el nombre del investigador que fue pionero en la técnica 1, mide las tasas de secreción de líquido de los túbulos de Malpighi aislados, y se constituyó en Drosophila en 1994 por Dow y colegas 2. Esto allanó el camino para más estudios utilizando Drosophila herramientas genéticas, tales como el sistema GAL4-UAS 3,4, para definir las vías de señalización de células específicas que regulan la secreción de fluidos. Un ejemplo incluye la señalización del calcio en respuesta a una hormona peptídica 5, entre muchos otros 6,7.
ve_content "> Una combinación de técnicas genéticas y estudio fisiológico clásica ha demostrado que la generación de la orina en el se produce la marcha a través de la secreción de un cloruro de potasio rica en líquido de la principal segmento del túbulo. Esto ocurre a través de la secreción transepitelial paralelo de cationes, principalmente K + Na +, sino también, a través de la célula principal, y Cl -. a través de la secreción de las células estrelladas 8-12 La capacidad de medir por separado transepiteliales flujos de K + y Na + permite una caracterización más detallada de los mecanismos de transporte que la medición de la secreción de fluidos solo. Por ejemplo, en los túbulos de Drosophila no estimuladas, el Na + / K + -ATPasa ouabaína no tiene ningún efecto sobre la secreción de fluido 2, incluso cuando su captación en las células principales se inhibe por el transportador de aniones orgánicos inhibidor de taurocolato 13. Sin embargo, Linton y O'Donnell mostró que ouabaína despolarizael potencial de membrana basolateral, y aumenta Na + flujo 9. Como se muestra en los resultados representativos, replicamos estos hallazgos, y demostramos que K + flujo es concomitante disminución de 14; el aumento del flujo de Na + y la disminución de K + flujo tener efectos opuestos sobre la secreción de fluidos, lo que resulta en ningún cambio neto en la secreción. Por lo tanto, hay dos resoluciones a la "paradoja ouabaína", es decir, la observación inicial de que ouabaína no tiene ningún efecto sobre la secreción de fluido en el túbulo Drosophila:. Primero, en los túbulos estimulados, el efecto de ouabaína sobre la secreción de fluido no es evidente debido a la su absorción por el transportador de aniones orgánicos 13; y en segundo lugar, en los túbulos no estimuladas, ouabaina ha oponerse efectos sobre transepitelial Na + y K + flujo, lo que resulta en ningún cambio neto en la secreción de fluidos (ver resultados representativos y ref. 9). Por lo tanto, la función principal de la Na + / K + -ATPase en los túbulos no estimuladas es disminuir la concentración intracelular de Na + para generar un gradiente de concentración favorable para Na + -junto procesos de transporte a través de la membrana basolateral. En efecto, mediante la medición por separado de Na + y K + fundentes, hemos demostrado que los túbulos que carece del cotransportador sodio-potasio-2-cloruro de mosca (NKCC) han disminuido K transepitelial + fundente, sin mayor descenso después de la adición ouabaina, y ningún cambio en transepitelial Na + Flujo 14. Estos resultados apoyan nuestra conclusión de que Na + entrar en la célula a través de la NKCC se recicla a través de la Na + / K + -ATPasa. En otro ejemplo, Ianowski et al. Observaron que la reducción de baño de K + concentración de 10 mM a 6 mM disminuyó transepitelial K + y el aumento de flujo transepitelial Na + en los túbulos flujo de Rhodnius prolixus, sin cambio neto en la secreción de fluidos 15. Efectos diferenciales sobre Na + y K + flujo flujo a través de los túbulos de larvas se han observado también en los túbulos de Drosophila en respuesta a diferentes dietas de sal 16 y en dos especies de mosquitos en respuesta a la cría de salinidad 17.El mayor reto en la medición del flujo de iones transepitelial en la preparación de ensayo Ramsay es la determinación de las concentraciones de iones dentro del fluido secretado. Este reto se ha cumplido con soluciones diferentes, incluyendo photometery llama 18, el uso de iones radiactivos 19, y el electrón sonda de longitud de onda de la espectroscopía dispersiva 20. Estas técnicas requieren la transferencia de la gota de líquido secretado a un instrumento para la medición de concentraciones de iones. Dado que el volumen de líquido secretado por el túbulo Drosophila no estimulada es pequeño, típicamente ~ 0,5 nl / min, esto plantea un reto técnico y también introduce error si algo del fluido es secretadaperdido en la transferencia. En contraste, el uso de electrodos de ión específico permite la medición de la actividad de iones (a partir del cual se puede calcular la concentración de iones) in situ. El protocolo actual fue adaptado de la utilizada por Maddrell y sus colegas para medir transepitelial K + flujo a través de los túbulos Rhodnius usando valinomicina como el K + ionóforo 21, y también describe el uso de un -butylcalix 4- terc [4] areno-ácido tetraacético Na base de éster de tetraetilo + específico de electrodo específico de iones caracterizado por Messerli et. al., 22. Ion-electrodos específicos también se han utilizado para medir las concentraciones de iones en el fluido secretado por los túbulos de Malpighi en el ensayo de Ramsay en adulto y larval 9,23 16 Drosophila melanogaster, la Nueva Zelanda Alpine Weta (Hemideina maori) 24 y 17 en los mosquitos.
Aquí se describe en detalle el uso del Ramsay comodecir para medir las tasas de secreción de fluidos en los túbulos de Malpighi de Drosophila melanogaster, así como el uso de electrodos de ión específico para determinar las concentraciones de K + y Na + en el fluido secretado y por lo tanto el cálculo de los flujos de iones transepitelial. Una visión general del ensayo se proporciona en la Figura 1.

Figura 1. Esquema del Malpighi túbulos y el ensayo de Ramsay con uso de iones específicos electrodos para medir concentraciones de iones. Esta figura ilustra la configuración para el ensayo de Ramsay. (A) Cada mosca tiene cuatro túbulos, un par de túbulos anterior y un par de túbulos posteriores, que flotan en la cavidad abdominal rodeado de hemolinfa. En cada par, los dos túbulos se unen en el uréter, que luego se vacía la orina en la unión del intestino medio y hindgut. Los túbulos son ciego terminado. La orina se genera por el segmento principal de fluido que secretan (mostrado en rojo), y fluye hacia el uréter y hacia fuera en el intestino. Después de la disección, el par túbulo se disocia desde el intestino por transección el uréter. (B) El par de túbulos se transfiere a continuación en una gota de solución salina de baño dentro de un pocillo de la placa de ensayo. Uno de los dos túbulos, que se refiere aquí como el "túbulo ancla," se envuelve alrededor de un pasador de metal y es inerte. El otro es el túbulo túbulo secretor. El segmento inicial (que no secretar fluido) y el segmento principal de los túbulos secretores se mantienen dentro de la gota de solución salina de baño. Iones y movimiento de agua de la solución salina de baño y en el lumen de los túbulos del segmento principal, y luego se mueven hacia el uréter, como ocurriría en vivo. El segmento inferior (azul) está fuera de la solución salina de baño y por lo tanto inerte. Desde el uréter se corta, el fluido secretado emerge como una gotita desde el extremo cortado del uréter. Tél secretada gotita de fluido aumenta con el tiempo como la secreción continúa, y su diámetro se mide utilizando un micrómetro ocular. Una capa de aceite mineral evita la evaporación del fluido secretado. Los iones de referencia y electrodos específicos miden la concentración de iones del líquido secretado. Por favor haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Preparación de los platos, de calibración y ensayo de disección
Nota: En este paso, se preparan tres placas de Petri de plástico forrados con elastómero de silicona: uno para la disección, uno para realizar el ensayo Ramsay ("plato de ensayo"), y uno para realizar la calibración. Estos platos se reutilizan de experimento a experimento, y por lo tanto este paso sólo necesita ser repetida si se rompe un plato. Una imagen de la placa de ensayo se muestra en la Figura 2.
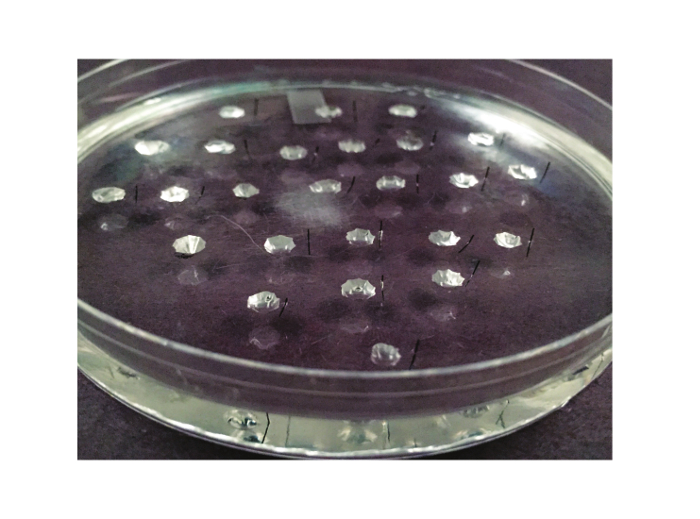
Figura 2. El plato de ensayo. El plato utilizado para el ensayo de Ramsay se muestra aquí. Se trata de una placa de Petri de 10 cm que se alinea con elastómero de silicona. Entre 20 y 25 pozos están talladas en el elastómero. Un pasador metálico Minutien, reducido a la mitad, se coloca a la derecha de cada bien (o hacia la izquierda, si el experimentador es zurdo).TPS: //www.jove.com/files/ftp_upload/53144/53144fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- Usando guantes, vierta ~ 80 g de base de elastómero de silicona en un vaso de vidrio. Añadir décima peso (8 g) de curación de elastómero de silicona. Agitar con una varilla de metal. Colocar en un agitador orbital con una cima plana a una velocidad suave, por ejemplo 100 rpm, durante varias horas hasta que se hayan eliminado todas las burbujas.
- Vierta el elastómero de silicona en placas de Petri de plástico limpia: 100 platos mm x 15 mm para los platos de disección y de ensayo, y 35 x 10 mm para el plato de calibración. El espesor de la capa de elastómero debe ser ~ 6 - 7 mm para las placas de 100 mm, y ~ 5 mm para el plato de 35 mm.
- Colocar las cápsulas en el banquillo a temperatura ambiente (TA) para curar (se endurecen), ~ 24 a 48 h.
- Una vez que el plato de ensayo se ha curado, preparar un lote pequeño de elastómero de silicona como en el paso 1.1, por ejemplo., 10 g de silicona con base de elastómero de 1 g cura. Agitar en órbitaagitador que en el paso 1.1 hasta que las burbujas de aire ya no están presentes. Este elastómero será utilizado en el paso 1.5.4 y no debe ser deja endurecer antes de ese paso.
- Con un bisturí quirúrgico y precauciones cortopunzantes estándar, hacer pozos en uno de los 100 mm con recubrimiento de elastómero de silicona placas de Petri. Este será el plato de ensayo.
- Hacer pozos ~ 1 cm de distancia y con un diámetro de ~ 3 - 4 mm. 25 pozos pueden caber fácilmente en una placa de ensayo de 100 mm. Wells debe ser de al menos 6 mm retirados de las paredes de la cápsula. La Figura 2 ilustra la separación de los pozos. Cada pocillo contendrá un túbulo fluido que secretan durante el experimento. Por lo tanto, un plato que contiene 25 pozos permitirá 25 túbulos a analizar.
- Use un marcador permanente para marcar la posición de los pozos si es necesario.
- Hacer las paredes del pozo tan suave como sea posible colocando el bisturí en el elastómero, y luego usando la mano contraria para girar el plato de 360 °.
- Luego, utilizando sha estándar rps precauciones, sumergir una aguja 30 G en el elastómero no endurecido de la etapa 1.4 y colocar una pequeña gota en la parte inferior de cada pocillo. Esto suaviza la parte inferior del pozo. Deje curar (se endurecen) x 24-48 h.
- Preparar los pasadores Minutien.
- Coloque 0.15 mm anodizado negro pines Minutien en una fila en un trozo de cinta de etiquetado de laboratorio estándar de 1 pulgada. Eje largo Los pasadores 'debe ser ortogonal al eje largo de la cinta. Cortar la cinta a lo largo de su longitud con el fin de cortar cada pasador en dos mitades aproximadamente iguales (Figura 3). Utilice una media pines para cada pozo.

Figura 3. Cortar los Minutien Pins. Los pines se alinean en un pedazo de cinta de etiquetado en paralelo. A continuación, las tijeras se utilizan para cortar los pasadores en medio.ge.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- Inserte cada media-pin en el elastómero de silicona de aproximadamente 1 mm a la derecha de cada bien (si es diestro, si zurdo, inserte el pasador a la izquierda de cada pocillo). Esto se hace más fácilmente cuando la visualización de los pozos a baja potencia bajo un estereomicroscopio de disección y es ayudada por el uso de un fórceps romos. La Figura 2 ilustra el posicionamiento de los pasadores.
2. Preparación de Bellas Glass Varillas
Nota: En este paso, se prepara una varilla de vidrio que se utiliza para transferir los túbulos de la placa de disección en la gota de baño. La varilla de vidrio se reutiliza de experimento a experimento, por lo que este paso se realiza sólo una vez menos que se necesite se rompe la varilla y una nueva.
- Obtener láminas de 3 mm (1/8 de pulgada) de espesor de vidrio negro manchado de una tienda de hobby y copa adecuada-cutting equipo, tal como un cortador de vidrio y alicates. Utilice el equipo de seguridad adecuado (guantes gruesos, gafas).
- Cortar el vidrio en tiras ~ 6 mm de ancho x 10 cm de largo
- Sostenga una tira de cristal en cada mano. Suavizar el extremo corto de cada tira sobre la llama de un mechero Bunsen, usando las precauciones de seguridad apropiadas. A continuación, empuje los extremos de las dos tiras juntas y tire de separación, en un movimiento suave para crear una varilla de vidrio fino con un mango.
3. Fisiología de instalación
Nota: En este paso, el microscopio, el circuito de electrómetro y eléctrica está configurado. Aparte de periódico re-cloruración (paso 3.2) de los alambres de plata y re-calibración del electrómetro (paso 3.8), esta etapa se realiza sólo una vez. La Figura 4 ilustra la configuración.

Figura 4. Fisiología de configuración. La configuración de la fisiología se representa aquí. (A) Descripción general de la instalación. El microscopio estereoscópico se coloca dentro de la jaula de Faraday con los micromanipuladores en ambos lados. Una luz de fibra óptica se rosca a través de un agujero en el lado de la jaula de Faraday. El electrómetro se coloca fuera de la jaula de Faraday. (B) al cloruro de recubrir los alambres de plata, el alambre se sumerge en lejía. (C) Primer plano de la configuración. El titular de microelectrodos recta, que se muestra en esta imagen de la izquierda, se coloca sobre la sonda del electrómetro. El electrodo de iones específicos a continuación, se enrosca sobre el alambre de plata en el porta electrodo. A la derecha, el electrodo de referencia se coloca sobre el alambre de plata del titular de microelectrodos 45 °. El circuito debe entonces estar conectado a tierra de manera apropiada. El plato de ensayo se muestra ya que se posicionará al realizar mediciones. Por favorhaga clic aquí para ver una versión más grande de esta figura.
- Coloque el stereomicrosope con micrómetro ocular dentro de la jaula de Faraday. Planta para el interior de la jaula de Faraday, que luego es conectado a tierra a la tierra del chasis del electrómetro. Coloque los micromanipuladores a cada lado del microscopio (Figura 4A).
- Cloruro de dos alambres de plata por inmersión en lejía durante al menos 1 hora. Extender durante la noche (O / N) si es necesario (Figura 4B). Repita este paso cada vez que los alambres de plata necesitan ser re-clorado, por ejemplo, si son de color gris en la apariencia en lugar de negro.
- Pase un clorado de alambre de plata en cada uno de los titulares de microelectrodos.
- Establecer el circuito eléctrico con conexión a tierra adecuada. Por ejemplo, coloque la, titular de microelectrodos recta ventilado, que celebrará el electrodo específico de iones (ISE), en la sonda electrómetro, que se fija en el micromanipulador (Figura 4C).
- Asegure el, 45 ° titular de microelectrodos ventilado, que celebrará el electrodo de referencia, en el otro micromanipulador (Figura 4C). Luego de tierra a la tierra del circuito del electrómetro.
- Conecte a tierra el "AB out" salida BNC del electrómetro a la tierra del chasis del electrómetro.
- Coloque la fuente de luz de fibra óptica fuera de la jaula de Faraday, con el tubo de cuello de cisne roscado a través de un agujero en la jaula de Faraday (Figura 4A).
- Configurar y calibrar el electrómetro de acuerdo a las instrucciones del fabricante. Volver a calibrar el electrómetro de forma regular (cada 1 - 2 semanas). Una vez terminado, y entre las medidas, deje el electrómetro en modo "standby" con el conmutador de posición ajustado en "IN", establece de entrada al metro "A" y el rango ajustado en "200 mV."
4. Preparar las soluciones de disección y Baño
- Preparar Drosophila salina que se detallan en la Tabla 1. Para su uso en experimentos, vierta ~ 40 ml en un tubo cónico de 50 ml y se mantienen a temperatura ambiente. Descartar si hay evidencia de crecimiento bacteriano o fúngico.
- Para preparar el medio de baño estándar (SBM), mezclar Drosophila salina 1: 1 con medio de Schneider, y pasar a través de un filtro de jeringa de 0,22 micras. Preparar en pequeñas alícuotas (~ 10 - 15 ml), se almacenan a 4 ° C y descartar si hay evidencia de crecimiento bacteriano o fúngico. Los componentes de medio de Schneider se enumeran en la Tabla 2.
5. Hacer que el electrodo de Ion-específica: silanizante Pipetas
Nota: En este paso, diclorodimetilsilano se utiliza para la ligera "silanizar" el electrodo de iones específicos. Esto añade una capa hidrófoba en el interior del electrodo que le permite retener el ionóforo hidrófobo. Silanización excesiva se evita para evitar la absorción de aceite mineral al hacer measurements en gotas bajo de aceite. Electrodos silanizadas son buenas para varias semanas. Por lo tanto, este paso se lleva a cabo cada pocas semanas.
- Llama a pulir los extremos de 5 - 6 tubos unfilamented capilares de vidrio de borosilicato (diámetro exterior de 1,2 mm, diámetro interior de 0,69 mm, longitud 10 cm) sobre una llama baja, utilizando las precauciones de seguridad apropiadas.
- Colocar los tubos capilares en el fondo de un vaso de precipitados de vidrio de 1 L.
- En una campana y el uso de equipo de protección personal adecuado, verter el ácido nítrico al 70% (PRECAUCIÓN: inflamable y corrosivo, vea la hoja de datos de seguridad para el almacenamiento seguro y las instrucciones de manejo) en los tubos capilares y remojo durante 5 min.
- Verter el ácido nítrico de nuevo en una botella de vidrio. Re-uso para el lavado ácido nítrico posterior.
- Añadir ~ 200 ml de H 2 O desionizada al vaso de precipitados. Residuos vacío en una botella de vidrio dedicada para los residuos de ácido nítrico. Repita con otros 200 ml de H2O desionizada Siga las pautas institucionales para ªe eliminación segura de los residuos de ácido.
- Haga tres lavados adicionales con grandes volúmenes de agua desionizada. Vacíe en el fregadero.
- En la capilla, colocar tubos capilares en un plato caliente con cerámica set top de 200 ° C y secar durante un mínimo de 20 minutos, de manera óptima 1 hr. También se puede dejar por períodos más largos de tiempo.
- En un extractor de pipeta (Figura 5A), tire de pipetas a un diámetro de la punta de ~ 1 - 2 micras.
- Coloque pipetas tirados de nuevo en placa caliente, con cuidado de no romper consejos, por lo menos durante 10 minutos, de forma óptima de 30 minutos, pero se puede dejar por más tiempo.
- Añadir 20 l de diclorodimetilsilano (PRECAUCIÓN: inflamable, corrosivo, toxicidad aguda, ver la hoja de datos de seguridad para el almacenamiento seguro y las instrucciones de manejo) en un 15 cm placa de Petri de vidrio e invertir plato sobre las pipetas en la placa caliente (Figura 5B). Deja en su lugar por lo menos durante 20 minutos, de manera óptima 2 hr. La misma placa de Petri se puede volver a utilizar en experimentos posteriores.
- Determinar el amou nt de diclorodimetilsilano añadió por ensayo y error. Después de ionóforo se añade (etapa 8.4), asegurarse de que la interfaz entre el ionóforo y la solución de relleno es plano (Figura 5C). Si la interfaz es cóncava, esto indica un exceso de silanización, y menos de silano debe ser utilizado. Si la interfaz es convexa, esto indica bajo-silanización, y más de silano debe ser utilizado.
Nota: El diclorodimetilsilano tiende a ir "off" con el tiempo, es decir, silanización menos eficaz se logra con el mismo volumen de silano.. En este punto, ya sea nueva silano se puede pedir, o la cantidad ajustada para lograr silanización equivalente.
- Determinar el amou nt de diclorodimetilsilano añadió por ensayo y error. Después de ionóforo se añade (etapa 8.4), asegurarse de que la interfaz entre el ionóforo y la solución de relleno es plano (Figura 5C). Si la interfaz es cóncava, esto indica un exceso de silanización, y menos de silano debe ser utilizado. Si la interfaz es convexa, esto indica bajo-silanización, y más de silano debe ser utilizado.
- Apague plato caliente y dejar enfriar. Retire placa de Petri de vidrio y pipetas para transferir frasco de almacenamiento que contiene gel de sílice, que mantiene la desecación. Maneje pipetas con cuidado (fórceps votos) para evitar romper la punta.
5 "src =" / files / ftp_upload / 53144 / 53144fig5.jpg "/>
Figura 5. Pipetas silanización. (A) Ejemplo de extractor pipeta. (B) Imagen de las pipetas tirados en el plato caliente. El plato de vidrio que contiene una gota de diclorodimetilsilano se ha invertido en los pipetas tirados. (C) esquemático que ilustra la interfaz entre el cóctel ionóforo y la solución de relleno. Una interfaz plana indica silanización óptima. Por favor haga clic aquí para ver una versión más grande de esta figura.
6. Preparar el dispositivo de succión negativa
Nota: En este paso, se prepara un sencillo dispositivo de succión negativa (Figura 6) que se utiliza para llenar el electrodo específico de iones. Este paso se realiza sólo una vez.
- Conecte una jeringa de 3 ml de una llave de paso de 3 vías con cierre luer. Ael extremo opuesto de la llave de paso, que contiene el collar giratorio y guardia, tornillo en un conector luer hembra de bloqueo con el extremo de púas. Luego, conecte el tubo de silicona, 16.1 pulgadas de diámetro interior con 1/8 de pulgada de diámetro exterior, hasta el final de púas del conector. A continuación, inserte un tubo de plástico con 1/32 de pulgada de diámetro interior y de 3/32 de pulgada de diámetro exterior
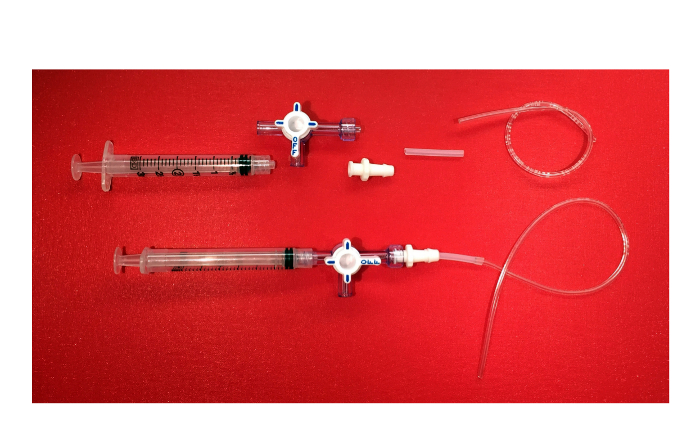
Figura 6. El dispositivo de succión negativa. Imagen de los componentes del dispositivo de succión negativa (3 ml con jeringa luer lock, 3-way llave de paso con el collar de rotación y guardia, conector luer hembra de bloqueo con el extremo de púas, tubo de silicona, un tubo de plástico) y el producto final. Por favor haga clic aquí para ver una versión más grande de esta figura.
7. Las moscas cobrar por disección < / p>
- Utilice técnicas de cría de moscas estándar 25 para establecer cruces de moscas y modificar según sea necesario. Por ejemplo, utilice la temperatura (por ejemplo, 28 ° C) se incrementó en experimentos donde se desea una mayor actividad GAL4.
Nota: Es importante que las moscas no se crían en condiciones excesivamente concurridos; los números de progenitores masculinos y femeninos deben disminuirse en este caso. Si se utilizan diferentes genotipos, el número de hombres y mujeres que los padres deben ser ajustados para obtener el número aproximadamente similar de la progenie. - Recoger las moscas para la disección (paso 11), utilizando técnicas de cría de moscas estándar de 25 dentro de 1 - 2 días después de la eclosión. Túbulos de las moscas hembras son más fácilmente disecados, pero túbulos de las moscas macho también se pueden utilizar si es necesario o deseado. Lugar vuela en un vial que contiene alimentos mosca. Colocar los viales a la temperatura deseada durante 3 - 5 días antes de la disección.
8. Llenar el electrodo de iones específicos (ISE)
e_content "> Nota:.. En este paso, el ISE se rellena con una solución salina y luego ionóforo se introduce en la punta El ISE se puede volver a utilizar desde día a día, siempre y cuando está funcionando bien Por lo tanto, este paso es realizado cada pocos días según sea necesario.- Para hacer un electrodo específico de K +, rellenar una pipeta silanizado con 0,5 M KCl usando una jeringa de 1 ml y microfilamentos (re-uso de microfilamentos de experimento a experimento). Asegúrese de que la solución de relleno llena hasta la punta de la pipeta - hay aire en la punta. Si no está seguro, visualizar con un microscopio compuesto. Desalojar burbujas de aire accionando suavemente la pipeta.
- Para un electrodo específico de Na +, rellenar con NaCl 150 mM.
- Inserte el extremo posterior de la ISE en el tubo de plástico del dispositivo de succión negativa preparada en el paso 6. En el capó, coloque el ISE en un plástico de 3,5 cm plato de petri invertida con un trozo de plastilina para asegurar en su lugar.
- Generar p negativoRESIÓN usando el dispositivo de succión. Tirar hacia atrás de la jeringa con el "off" del mango llave de paso que apunta hacia el puerto lateral. La cantidad de retrocediendo variará, pero está normalmente en el intervalo de 0,6 - 0,7 ml. A continuación, gire la manija llave de paso por lo que el "off" está apuntando hacia el tubo.
- En el capó y el uso de equipo de protección personal adecuado, mojar un 1 - l punta 10 pipeta en la solución ionóforo (PRECAUCIÓN: tóxico Ver Hoja de Datos de Seguridad de Materiales para el almacenamiento seguro y las instrucciones de manejo.). Expulsar una pequeña gota mediante la colocación de un dedo enguantado sobre la abertura más grande de la punta de la pipeta. A continuación, toque la gota de ionóforo a la punta de la ISE, sin tocar la punta ISE con la punta de la pipeta para evitar romper la punta ISE.
- Utilice el ionóforo de potasio que figuran en la Tabla de Materiales "tal cual". Para preparar el ionóforo de sodio, hacer una solución de (en% w / w) 10% 4-terc--butylcalix [4] tetraetılico ácido areno tetraacético, 890,75% de éter octil nitrofenilo, y 0,25% tetrafenil borato de sodio (PRECAUCIÓN:. Tóxico Ver Hoja de Datos de Seguridad de Materiales para el almacenamiento seguro y las instrucciones de manejo). Guarde en un frasco de vidrio envuelto en papel de aluminio para proteger de la luz.
- Examine el ISE bajo magnificación 40X utilizando un microscopio compuesto para determinar si el ionóforo se "recoge" en la punta ISE y si la interfaz solución ionóforo / relleno es plana (véase el paso 5.10.1 y la Figura 5C).
- Si ningún ionóforo fue recibido arriba, aumentar la cantidad de presión negativa generada por el dispositivo de succión. Si esto no tiene éxito, el electrodo puede haber sido inadecuadamente silanizada. Repita el paso 5 utilizando una mayor cantidad de diclorodimetilsilano.
- Coloque el ISE, la punta hacia abajo, en la pared de un vaso parcialmente lleno con 150 mM KCl. Asegurar el ISE mediante la colocación de la arcilla de modelado sobre el lado del vaso de precipitados. La punta está dentro del mM KCl 150. Siga usando el ov ISEer múltiples días, siempre y cuando está funcionando bien (véase el paso 10.6).
- Para un Na + ISE, almacenar el electrodo en NaCl 150 mM.
9. Prepare el electrodo de referencia
Nota: Los pasos 9.1 a 9.3 se puede realizar con antelación. Los pasos 9,4 - 9.6 se llevan a cabo cada día experimental.
- Llama a pulir los extremos de 10 tubos filamented capilares de vidrio de borosilicato (diámetro exterior de 1,2 mm, diámetro interior de 0,69 mm, longitud 10 cm) sobre un fuego lento, utilizando medidas de seguridad.
- En un extractor de pipeta, pipetas tire a un diámetro de la punta de ~ 1 - 2 micras.
- Pipetas Almacene en un frasco de almacenamiento pipeta hasta su uso. Pipetas se pueden almacenar indefinidamente.
- En el día del experimento, utilizando un microfilamentos y la jeringa, llenar la punta y el vástago de la pipeta con acetato de sodio 1 M. Garantizar que no haya burbujas de aire y que la solución va a la punta. Flick suavemente la pipeta si las burbujas de aire están presentes.
- El uso de un segundomicrofilamentos y la jeringa, relleno la pipeta con 3 M KCl. Una vez más, asegúrese de burbujas de aire no están presentes.
- Almacenar el electrodo de referencia en un vaso de precipitados que contiene 150 mM KCl (véase el paso 8.6).
10. Calibración de ISE
Nota: Este paso se realiza tres veces al día experimento: temprano en el día para asegurarse de que el ISE está trabajando, y luego, antes y después de las mediciones de los 20 - 25 gotas de fluidos secretados (Tabla 3).
- Para la calibración del ISE de potasio, coloque dos 0,6 l gotas de cada uno de los siguientes cuatro concentraciones de KCl en el elastómero de silicona recubierto de 3,5 cm plato de petri (preparado en el paso 1): 15 mm, 75 mm, 150 mm y 200 mm. La capa cuidadosamente 2 ml de aceite mineral sobre las gotas.
- Para sodio ISE, use gotas de calibración de 15 mM y NaCl 150 mM.
- Coloque el plato de calibración en el escenario del microscopio estereoscópico en la jaula de Faraday e iluminar.
- Threanuncio el electrodo ISE y referencia sobre los alambres de plata y fijarlo en los titulares de microelectrodos.
- Utilizando los micromanipuladores, avanzar en el ISE y electrodos de referencia en la gota 15 mM KCl.
- Cambie el electrómetro a "operar" de modo. Permitir la lectura a un acuerdo.
- Lectura de registro en el cuaderno. Repita con el 75 mM, 150 mM y 200 mM cae. Calcula la pendiente para determinar si ISE está funcionando bien (ver paso 13.1 y en la Tabla 3). Si no es así, prepare un nuevo ISE.
Nota: Las señales de que un ISE no funciona así: el fracaso para obtener una lectura; lento para equilibrar (varios segundos o más); lectura inestable; pendiente <49 mV / cambio decil en K + o Na + concentración. - Entre la primera calibración del día y las mediciones realizadas en el paso 12, es decir, durante la ejecución de la etapa 11 (disecciones del túbulo), almacenar el ISE y electrodos de referencia en 150 mM KCl (como se describe en el paso 8.6).
11. Túbulo Disección
Nota: Este paso se realiza en el día experimento.
- Alícuota de una pequeña cantidad (~ 500 - 600 l) de medio de baño estándar (SBM), preparado en la etapa 4.2, para su uso en el día de experimento y se deja calentar a RT. Esto se debe hacer por lo menos 30 min antes de disecciones, pero también se puede hacer antes. También, tener al menos 20 ml de solución salina RT Drosophila (paso 4.1) disponible antes de iniciar disecciones.
- Inmediatamente antes de comenzar disecciones: ver el plato de ensayo a un aumento de 10x bajo un estereomicroscopio y añadir una cantidad suficiente SBM a casi llenar cada pocillo en la placa de ensayo, típicamente entre 10 y 30 l. Si las drogas o el péptido se van a añadir a SBM mediados de experimento, anote el volumen exacto de SBM a cada pocillo. Evitar el exceso de llenado del pozo ya que esto puede conducir a la túbulo flotando durante el experimento.
- Capa con cuidado ~ 12 - 13 ml de aceite mineral en la parte superior para que los pozos de unrecuperado. Esto evitará la evaporación de las gotas de líquido secretado durante el experimento.
- Lugar vuela a ser diseccionado en CO 2 pad.
- Hacerse con una marcha a través de su pierna o ala con unas pinzas y colocar en su parte posterior (ventral hacia arriba) en el plato de disección con recubrimiento de elastómero de silicona preparada en el paso 1. Impale el tórax con un alfiler Minutien para asegurar la marcha en su lugar.
- Añadir una gota de solución salina RT Drosophila (paso 4.1) para sumergir a la marcha en solución salina.
- Opcional: Clip de alas y patas. En la práctica, esto no suele ser necesario.
- Utilice las pinzas mano no dominante a "mantener" el abdomen de la mosca en la unión toraco abdominal. Usa los fórceps mano dominante para pelar la cutícula abdominal de distancia, a partir de la unión torácico-abdominal y se mueve hacia el extremo de la cola de la mosca. El intestino, con túbulos de Malpighi adjuntos, se debe exponer con esta maniobra.
- Sin tocar los túbulos, diseccionar libre el intestino medio /intestino grueso y los túbulos unidos. Sostenga el intestino en la pinza de la mano no dominante y utilizar una aguja de 30 G para cortar el uréter desde el intestino, separando los túbulos de la tripa y libre de la fly.It es esencial que no hay lágrimas ni las rentas pueden introducir en el túbulo, que no sea en el uréter.
Nota: El par anterior de los túbulos es más fácilmente diseccionada, sin embargo los túbulos posteriores se pueden usar también. - El uso de la varilla de vidrio fino (paso 2), levante el par túbulo y transferir en un pozo de la placa de ensayo.
- Inmediatamente después de que ambos túbulo ha sido trasladado al pozo, levante el extremo de uno de los túbulos con la varilla de vidrio, retirarse de la caída de baño hasta que el extremo del corte del uréter está a medio camino entre el pasador y la caída de baño, y envoltura el extremo del túbulo alrededor del pasador usando la varilla de vidrio. Al final de esta maniobra, uno túbulo permanece en la gota de solución salina de baño y se secretan fluido desde el extremo del corte del uréter, como se ilustra en la Figura 1 . El otro túbulo, denominado el "túbulo ancla" en la Figura 1, se envuelve alrededor de la clavija. Se ancla el túbulo secretor en su lugar, está rodeado por el aceite, y no secreta fluido.
- Inmediatamente después de la etapa 11,11, anote el bien (por ejemplo, A, B, C), la información túbulo la identificación (por ejemplo., El genotipo o condición), y el tiempo (éste es el tiempo de inicio cuando el fluido comenzará a ser secretada por el túbulo en la gota de solución salina de baño).
- Continúe con la siguiente disección. Una vez que el experimentador es experto en esta técnica, que por lo general dura 3 - 4 minutos para diseccionar un par de túbulos, transferirlos a la salina de baño, y envuelva el túbulo ancla alrededor de la clavija. Por lo tanto, 20 - 25 túbulos se pueden configurar en el ensayo de Ramsay dentro de 1,5 hr. La hora de inicio de cada túbulo será por lo tanto de aproximadamente 3 - 4 min después de la hora de inicio del túbulo anterior.
12. Toma de mediciones
Nota: Este paso se realiza en el día experimento.
- Calibrar el ISE (paso 10), aproximadamente 20 minutos antes de la primera medición. Esto da tiempo para hacer un nuevo ISE si es necesario.
Nota: En el momento deseado, por ejemplo después de 2 hr de la secreción, la caída de líquido secretado de cada túbulo está listo para la medición. - Registre el momento de la medición. Medir el diámetro de la gota de líquido secretado usando el micrómetro ocular y grabar. Tenga en cuenta la ampliación, por ejemplo, 50X.
- Avanzar en el ISE y electrodo de referencia en la gota de líquido. Cambie el electrómetro a "operar". Permita que la lectura se estabilice. Registre el valor.
- Repita el procedimiento para la próxima caída.
- Al final del experimento, repetir las mediciones de calibración (paso 10).
13. Cálculos
Nota: Este paso se puede realizar ya sea al final del día experimento, o en un momento posterior.
- Calcule la mediapendiente / cambio decil en la concentración de potasio. Ver Tabla 3 para un ejemplo.
Nota: Para sodio, los valores serán por la diferencia entre el 15 mM y 150 mM NaCl mediciones. - Determinar el valor medio de las dos mediciones (antes y después) de KCl 200 mM (o NaCl 150 mM).
- Calcular el volumen de cada gotita. V = πd 3/6, donde D es el diámetro de la gotita medida con el micrómetro ocular en el paso 12.2.
- Calcular la tasa de secreción = V / hora (nL / min / túbulo), donde V es el volumen de la gotita determinado en la etapa 13.3, y el tiempo es la longitud de tiempo que el fluido segregado túbulo (= momento de la medición - momento del uréter tirando fuera de la gotita de baño).
- Calcular la concentración de iones utilizando la fórmula [K] = 10e (? V / S) * 200 o [Na] = 10e (? V / S) * 150, donde? V = la diferencia (en mV) entre el potencial medido del fluido secretado gota, y el potencial de la caída de calibración 200 mM (fo potasio; Gota 150 mM para el sodio). S = la pendiente determinada en el paso 13.1.
- Calcular flujo de iones = [ion] x tasa de secreción de líquido. Para túbulos de Drosophila, este será pmol / min / túbulo.
14. Limpiar
Nota: Este paso se lleva a cabo al final del día experimento.
- Limpieza a fondo de los pozos es esencial para asegurar que los cristales de sal residuales no permanecen en los pozos, la alteración de la concentración de iones y la osmolaridad en futuros experimentos.
- Deje que el aceite mineral se escurra.
- Lavar los pocillos de la placa de ensayo. Una punta de pipeta 200 l se puede utilizar para raspar suavemente de cristal de sal residual. El uso de un tubo de plástico conectado al grifo, apriete el tubo para crear un chorro de alta presión de agua caliente para enjuagar a fondo cada pocillo.
- Deje secar O / N. Alternativamente, un secador de pelo se puede utilizar para secar los pocillos.
- Enjuague con fórceps desionizada H 2 O yremojo en etanol durante 15 min a varias horas.
- Escurrir el aceite fuera del plato de calibración y lavar con agua caliente. Use jabón, así como siempre que se enjuaga a fondo apagado. Realizar el último enjuague con agua destilada H2O
- Microfilamentos Enjuague y jeringas con H2O destilada
Resultados
Las Figuras 7 y 8 demuestran que el uso del ensayo de Ramsay con electrodos de ión específico para medir las concentraciones de K + y Na + puede distinguir genéticamente y farmacológicamente distintas K + y los flujos de Na +, la información que no se captura mediante la medición de las tasas de secreción de líquido solo. Figura 7 muestra que la disminución de la secreción de fluidos en los túbulos de las moscas que llevan una mutac...
Discusión
El uso del ensayo Ramsay, junto con electrodos de ión específico, permite la medición de tasas de secreción de fluidos y los flujos de iones en el aislado de insectos de Malpighi (renales) túbulos. Veinte o más túbulos se pueden ensayar a la vez, lo que permite un mayor rendimiento en comparación con el ensayo de individuo en túbulos in vitro microperfused. Además, los electrodos de ión específico permiten la determinación de las concentraciones de iones dentro del fluido secretado in ...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materiales
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Referencias
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados