Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Nutzung der Ramsay Assay zu Flüssigkeitssekretion und Ionenfluss Preise in der Maßnahme
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verwendung des Ramsay Assay Flüssigkeitssekretion Raten von isolierten Malpighischen (Nieren) Tubuli aus Drosophila melanogaster zu messen. Darüber hinaus ist die Verwendung von ionenspezifischen Elektroden, die Natrium- und Kaliumkonzentrationen in der sekretierten Flüssigkeit zu messen, mit Berechnung der transepithelialen Ionenfluss, wird beschrieben.
Zusammenfassung
Modulation Nierenepithelzellen Ionentransport erlaubt Organismen ionische und osmotische Homöostase angesichts der unterschiedlichen äußeren Bedingungen aufrechtzuerhalten. Die Drosophila melanogaster Malpighischen (Nieren) Tubulus bietet eine einmalige Gelegenheit, um die molekularen Mechanismen der epithelialen Ionentransport zu untersuchen, aufgrund der leistungsfähigen Genetik dieses Organismus und der Zugänglichkeit ihrer Nierentubuli auf physiologische Studie. Hier beschreiben wir die Verwendung des Ramsay Assayfluid Sekretionsraten von isolierten fly Nierentubuli zu messen, mit der Verwendung von ionenspezifischen Elektroden, die Natrium- und Kaliumkonzentrationen in der sekretierten Flüssigkeit zu messen. Dieser Assay ermöglicht Studium der transepithelialen Flüssigkeit und Ionenflüsse von ~ 20 Tubuli zu einer Zeit, ohne die Notwendigkeit, das sezernierte Fluid zu einer separaten Vorrichtung zu übertragen, um die Ionenkonzentration zu messen. Genetisch unterschiedlichen Tubuli können analysiert werden, um die Rolle spezifischer Gene, die in Transportprozessen zu beurteilen. Zusätzlich wird die bathing Salzlösung kann geändert werden, um die Wirkungen der chemischen Eigenschaften oder Arzneimittel oder Hormone zugesetzt untersuchen. Zusammenfassend ermöglicht diese Technik die molekulare Charakterisierung der Grundmechanismen von epithelialen Ionentransport in Drosophila Tubulus sowie Regelung dieser Transportmechanismen.
Einleitung
Nierenepithelzellen Ionentransport zugrunde organismal iono- und Osmoregulation. Die Drosophila melanogaster Malpighischen (Nieren) Tubulus bietet eine einmalige Gelegenheit, um die molekularen Mechanismen der epithelialen Ionentransport zu studieren. Dies ist aufgrund der Kombination der leistungsfähigen Genetik von Drosophila, gepaart mit der Zugänglichkeit der Nierentubuli auf physiologische Studie. Die Ramsay Assay, nach dem Forscher, der die Technik 1 Pionier benannt, misst Flüssigkeitssekretion Raten von isolierten Malpighischen, und wurde in Drosophila 1994 von Dow und Kollegen 2 etabliert. Dies ebnete den Weg für weitere Studien unter Verwendung von Drosophila genetische Werkzeuge, wie beispielsweise die GAL4-UAS-System 3,4, um zellspezifische Signalwege regulieren Flüssigkeitssekretion definieren. Ein Beispiel beinhaltet Calcium-Signal in Reaktion auf ein Peptidhormon, 5, unter vielen anderen 6,7.
ve_content "> eine Kombination von genetischen Techniken und klassischen physiologischen Studie hat gezeigt, dass Urin-Generation gezeigt, in die Fliege durch die Sekretion eines Kaliumchlorid-reiche Flüssigkeit aus dem Hauptsegment der Röhrchen erfolgt. erfolgt dies durch die parallele transepithelialen Sekretion von Kationen, in erster Linie K +, sondern auch Na +, durch die Hauptzelle und Cl -. Sekrets durch die Sternzellen 8-12 Die Fähigkeit, transepithelialen K + und Na + Flüsse getrennt zu messen ermöglicht eine genauere Charakterisierung von Transportmechanismen als die Messung Flüssigkeitssekretion allein, z. B. in unstimulierten Drosophila Tubuli, die Na + / K + -ATPase-Inhibitors Ouabain hat keine Auswirkung auf Flüssigkeitssekretion 2, auch wenn ihre Aufnahme in den Hauptzellen wird durch den organischen Anionentransporter Inhibitor Taurocholat 13 gesperrt. Jedoch Linton und O'Donnell zeigte, dass Ouabain depolarisiertder basolateralen Membranpotential und erhöht Na + Fluss 9. Wie in den Repräsentative Ergebnisse gezeigt, repliziert haben wir die Ergebnisse und zeigte, daß K + Flußmittel gleichzeitig um 14; die erhöhte Na + Fluss und verminderte K + Fluss haben entgegengesetzte Auswirkungen auf Flüssigkeitssekretion, was zu keiner Nettoänderung der Sekretion. So gibt es zwei Entschließungen zum "Ouabain Paradox", das heißt, die anfängliche Beobachtung, dass keine Auswirkung auf Flüssigkeitssekretion im Drosophila-Röhrchen Ouabain:. Zunächst in stimulierten Tubuli, ist nicht ersichtlich, die Wirkung von Ouabain auf Flüssigkeitssekretion aufgrund seine Aufnahme durch den organischen Anionentransporter 13; und zweitens, in unstimulierten Tubuli, Ouabain hat gegenläufige Effekte auf transepithelialen Na + und K + Fluss, was zu keiner Nettoänderung der Flüssigkeitssekretion (siehe Repräsentative Ergebnisse und ref. 9). Die primäre Rolle der Na + / K + -ATPase in unstimulierten Tubuli ist es, intrazellulären Na + -Konzentration zu senken, um eine günstige Konzentrationsgradienten zu erzeugen für die Na + -gekoppelten Transportprozesse in der basolateralen Membran. Tat kann durch separates Messen Na + und K + Flüsse zeigten wir, dass Tubuli fehlt die Fliege Natrium-Kalium-2-Chlorid-Cotransporter (NKCC) haben transepithelialen K + Flusses vermindert, wobei keine weitere Abnahme nach Ouabain hinaus und keine Veränderung des transepithelialen Na + Fluss 14. Diese Ergebnisse unterstützten unsere Schlussfolgerung, dass Na + in die Zelle durch die NKCC wird durch die Na + / K + -ATPase recycelt. In einem anderen Beispiel Ianowski et al. Beobachtet, dass die Senkung Bad K + -Konzentration von 10 mM bis 6 mM verringert transepithelialen K + Flußmittel und erhöht den transepithelialen Na + Flusses in Tubuli aus Rhodnius prolixus, ohne Nettoänderung in Flüssigkeitssekretion 15. Unterschiedliche Auswirkungen auf Na + und K + Flussflusses über Larven Tubuli wurden auch in Drosophila Tubuli als Reaktion auf variierende Salzdiäten 16 und in zwei Mückenarten in Reaktion auf die Aufzucht Salinität 17 beobachtet worden.Die größte Herausforderung bei der Messung des transepithelialen Ionenfluß im Ramsay Probenaufbereitung ist die Bestimmung von Ionenkonzentrationen in der sekretierten Flüssigkeit. Diese Herausforderung hat mit unterschiedlichen Lösungen, einschließlich flamm photometery 18, Verwendung von radioaktiven Ionen 19 und Elektronensonde Wellenlänge Spektroskopie 20 erfüllt sind. Diese Techniken erfordern Übertragung des sekretierten Fluidtropfen auf ein Instrument zur Messung von Ionenkonzentrationen. Da das Volumen der Flüssigkeit durch den unstimulierten Drosophila Tubulus sekretiert ist klein, typischerweise ~ 0,5 nl / min, stellt dies eine technische Herausforderung dar und führt auch Fehler, wenn einige der sekretierten Flüssigkeitverlor bei der Übertragung. Im Gegensatz dazu die Verwendung von ionenspezifischen Elektroden ermöglicht die Messung der Ionenaktivität (von dem Ionenkonzentration berechnet werden kann) in situ. Das aktuelle Protokoll wurde von dem von Maddrellschem und Kollegen zur transepithelialen K + Flusses über die Rhodnius Tubulus Messung mit Valinomycin als Ionophor K + 21 angepasst, und beschreibt auch die Verwendung eines 4-tert-Butylcalix [4] aren-tetraessigsäure Tetraethylester basierten Na + -spezifische ionenspezifischen Elektrode, gekennzeichnet durch Messerli et. al. 22. Ionenspezifischen Elektroden wurden ebenfalls verwendet, um die Ionenkonzentrationen in Flüssigkeit durch Malpighischen im Ramsay Assay bei Erwachsenen 9,23 und 16 Larven Drosophila melanogaster sezerniert zu messen, der Neuseeland-Alpine Weta (Hemideina maori) 24 und in Moskitos 17.
Hier beschreiben wir im Detail die Verwendung des so Ramsaysage Flüssigkeitssekretion Raten in Malpighischen von Drosophila melanogaster, sowie die Verwendung von ionenspezifischen Elektroden, die Konzentrationen von K + und Na + innerhalb von sekretierten Flüssigkeit zu bestimmen und somit die Berechnung der transepithelialen Ionenflüsse zu messen. Eine Übersicht des Tests ist in Figur 1 vorgesehen.

Abbildung 1. Schematische Darstellung des Vasa Malpighi und der Ramsay-Assay unter Verwendung von ionenspezifischen Elektroden, die an Ionenkonzentrationen zu messen. Diese Abbildung zeigt das Setup für die Ramsay Assay. (A) Jede Fliege hat vier Röhrchen, ein Paar von vorderen Tubuli und ein Paar von hinteren Tubuli, die schwimmen in der Bauchhöhle von Hämolymphe umgeben. In jedem Paar, verbinden die beiden Röhrchen in den Harnleiter, die dann leert den Urin an der Kreuzung des Mitteldarms und hindgut. Die Röhrchen sind blind digen. Urin wird durch die (in rot dargestellt) Flüssigkeit absondernden Hauptsegment erzeugt und strömt in Richtung des Harnleiters und hinaus in den Darm. Nach der Präparation wird die Tubuli Paar aus dem Darm durch Durchtrennung des Harnleiters dissoziiert. (B) Das Paar von Röhrchen wird dann in einen Tröpfchenbadesalzlösung innerhalb einer Vertiefung des Assays Schale überführt. Eines der beiden Röhrchen, hier als die "Anker Tubulus" ist um einen Metallstift gewickelt und ist inert. Die andere Röhrchen ist die sezernierenden Röhrchen. Das Anfangssegment (die nicht Flüssigkeit sezerniert) und Hauptsegment der sezernierenden Röhrchen bleiben innerhalb des Tröpfchens des Badens Kochsalzlösung. Ionen und Wasser Umzug von der Badekochsalzlösung und in die Tubuluslumen des Hauptsegments und dann in Richtung des Harnleiters zu bewegen, wie es in vivo auftreten. Das untere Segment (blau) ist außerhalb der Badesalzlösung und daher inert. Da der Harnleiter geschnitten wird, tritt der sekretierten Flüssigkeit als ein Tröpfchen von dem geschnittenen Ende des Ureters. Ter sezerniert Fluidtröpfchen vergrößert Laufe der Zeit als Sekret setzt, und sein Durchmesser wird unter Verwendung eines okularen Mikrometers gemessen. Eine Schicht von Mineralöl verhindert die Verdunstung des sekretierten Flüssigkeit. Die Referenz- und ionenspezifische Elektroden messen die Ionenkonzentration der Flüssigkeit ausgeschieden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protokoll
1. Vorbereiten der Sezierung, Kalibrierung und Test Geschirr
Hinweis: In diesem Schritt werden drei Kunststoff-Petrischalen mit Silikon-Elastomer ausgekleidet zubereitet: eine für die Präparation, eine für die Durchführung der Ramsay-Test ("Test Gericht"), und eine für die Kalibrierung. Diese Gerichte werden aus dem Experiment wiederverwendet, zu experimentieren, und so dieser Schritt muss nur dann, wenn ein Gericht Pausen wiederholt werden. Ein Bild des Assays Schale wird in Abbildung 2 dargestellt.
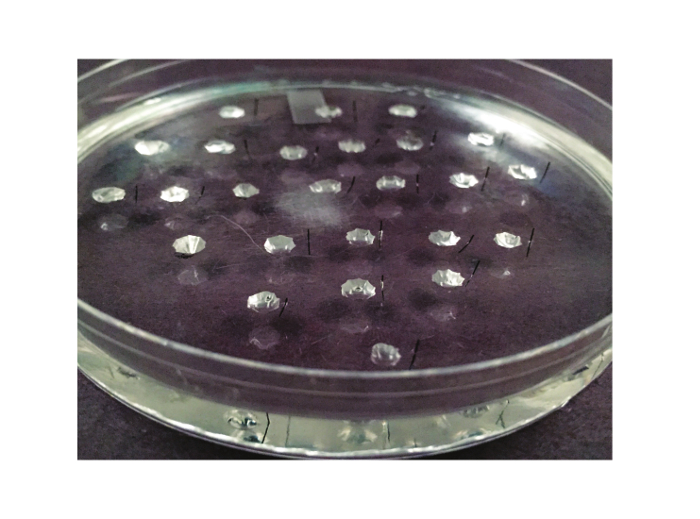
Abbildung 2. Der Assay Dish. Die für den Test verwendet Ramsay Gericht hier gezeigt. Es ist eine 10 cm-Petrischale, die mit Silikon-Elastomer ausgekleidet ist. Zwischen 20 und 25 Vertiefungen aus dem Elastomer geschnitzt. Ein Minutien Metallstift, halbieren, wird auf der rechten Seite eines jeden gut aufgestellt (oder nach links, wenn der Experimentator ist Linkshänder).tps: //www.jove.com/files/ftp_upload/53144/53144fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Mit Handschuhen, gießen ~ 80 g Siliconelastomerbasis in ein Becherglas. In 1/10 Gewicht (8 g) Silikonelastomer Heilung. Rühren Sie mit einem Metall-Rührer. Legen Sie auf einem Orbitalschüttler mit einer flachen Oberseite mit einer sanften Drehzahl, beispielsweise 100 Umdrehungen pro Minute, für mehrere Stunden, bis alle Luftblasen entfernt wurden.
- Pour das Silikonelastomer in saubere Petrischalen aus Kunststoff: 100 mm x 15 mm-Schalen für die Präparation und Assay Gerichte und 35 x 10 mm für die Kalibrierung Schale. 7 mm für die 100 mm-Schalen, und ~ 5 mm für die 35 mm-Schale - die Dicke der Elastomerschicht sollte ~ 6 ist.
- Die Schalen werden auf der Bank bei Raumtemperatur (RT) zu heilen (verhärten), ~ 24 - 48 Std.
- Wenn mit der Testschale ausgehärtet ist, bereiten ein kleiner Stapel von Siliconelastomer wie in Stufe 1.1, z. B. 10 g Silikonelastomerbasis mit 1 g Heilung. Schütteln Sie auf OrbitalSchüttler, wie in Schritt 1.1, bis Luftblasen nicht mehr vorhanden sind. Dieses Elastomer wird in Schritt 1.5.4 verwendet werden und sollten nicht erlaubt, vor diesem Schritt zu härten.
- Mit Hilfe eines chirurgischen Skalpells und Standard-Kleie Vorsichtsmaßnahmen, stellen Brunnen in einem der 100 mm Silikonelastomer beschichteten Petrischalen. Dies wird das Assaygericht.
- Bilden Vertiefungen ~ 1 cm voneinander entfernt und mit einem Durchmesser von ca. 3 - 4 mm. 25 Brunnen kann leicht in einem 100 mm-Assay Gericht passen. Wells sollte mindestens 6 mm von den Wänden der Schale entfernt werden. Figur 2 zeigt den Abstand der Vertiefungen. Jede Vertiefung wird eine Fluid-sezer Röhrchen während des Experiments enthalten. Somit wird eine Schale mit 25 Vertiefungen ermöglichen Tubuli 25 analysiert werden.
- Verwenden Sie eine dauerhafte Markierung, um die Position der Bohrlöcher markieren, wenn nötig.
- Stellen Sie die Wände des Bohrlochs so glatt wie möglich, indem das Skalpell im Elastomer, und dann mit der anderen Hand in die Schale um 360 ° drehbar.
- Dann, mit Standard-sha rps Vorsichtsmaßnahmen, tauchen Sie ein 30 G Nadel in den nicht gehärteten Elastomer aus Schritt 1.4 und legen Sie einen kleinen Tropfen auf dem Boden jeder Vertiefung. Dies glättet den Boden des Bohrlochs. Aushärten lassen (verhärten) x 24 - 48 Std.
- Die Minutien Stifte herzustellen.
- Zeigen 0,15 mm schwarz eloxiert Minutien Stifte in einer Reihe auf einem Stück von 1 Zoll Standard-Laboretikettenband. Die Stifte "lange Achse sollte orthogonal zur Bandlängsachse ist. Schneiden das Band entlang seiner Länge, um jeden Stift in zwei ungefähr gleiche Hälften (Figur 3) zu durchtrennen. Verwenden Sie eine Halbstift für jede Vertiefung.

Abbildung 3. Schneiden der Minutien Pins. Die Stifte sind bis auf ein Stück Etikettenband parallel gefüttert. Dann werden Schere verwendet werden, um in der Mitte der Stifte schneiden.ge.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Legen Sie jede Hälfte-Stift in das Silikon-Elastomer etwa 1 mm auf der rechten Seite jeder Vertiefung (wenn Rechtshänder, wenn Linkshänder, setzen Sie den Stift auf der linken Seite jeder Vertiefung). Dies geschieht am einfachsten, wenn die Visualisierung der Vertiefungen bei niedriger Leistung unter einem Präpariermikroskop Stereomikroskop und durch die Verwendung einer stumpfen Pinzette unterstützt. 2 zeigt die Positionierung der Stifte.
2. Vorbereitung Feine Glasstäbe
Anmerkung: In diesem Schritt wird ein Glasstab hergestellt werden, die verwendet werden, um die Tubuli des Präpariermikroskop Schüssel in der Badeabfall übertragen wird. Der Glasstab aus dem Experiment wiederverwendet, zu experimentieren, so dass dieser Schritt wird nur einmal, sofern die Stange bricht, und ein neues erforderlich ist durchgeführt.
- Erhalten Blätter 3 mm (1/8 Zoll) dick schwarz gebeizt Glas von einem Fachhändler und entsprechende GlasAnti-Cut-Geräte, wie zB ein Glasschneider und Zangen. Verwenden Sie geeignete Schutzausrüstung (dicke Handschuhe, Schutzbrille).
- Schneiden Sie das Glas in Streifen ~ 6 mm breit x 10 cm lang
- Halten Sie einen Glasstreifen in jeder Hand. Erweichen Sie das kurze Ende jedes Streifens über der Flamme eines Bunsenbrenners, mit entsprechenden Sicherheitsvorkehrungen. Dann schieben Sie die Enden der beiden Streifen zusammen und auseinander ziehen in einer glatten Bewegung, um eine feine Glasstab mit einem Handgriff zu schaffen.
3. Physiologie Setup-
Hinweis: In diesem Schritt wird das Mikroskop, Elektrometer und elektrischen Schaltkreis eingerichtet ist. Ausgenommen periodische Wieder chloriding (Schritt 3.2) der Silberdrähte und Neukalibrierung des Elektrometers (Schritt 3.8), wird dieser Schritt nur einmal durchgeführt. 4 zeigt die Konfiguration.

Abbildung 4. Physiologie-Setup. Die Physiologie Setup ist hier abgebildet. (A) Übersicht des Aufbaus. Das Stereomikroskop ist innerhalb des Faraday-Käfigs mit den Mikromanipulatoren an jeder Seite angeordnet. Ein faseroptisches Licht durch ein Loch in der Seite des Faradayschen Käfigs eingeschraubt. Das Elektrometer außerhalb des Faraday-Käfigs angeordnet. (B) Zur Beschichtung Chlorid der Silberdrähte wird der Draht in die Bleichmittel eingetaucht. (C) Close-up des Setup. Die gerade Mikroelektrodenhalter, in diesem Bild auf der linken Seite dargestellt ist, wird auf die Sonde des Elektrofädelt. Die ionenspezifische Elektrode wird dann über den Silberdraht in den Elektrodenhalter eingefädelt werden. Auf der rechten Seite wird die Referenzelektrode über der Silberdraht der 45º Mikroelektrodenhalter geschraubt. Die Schaltung muß dann entsprechend geerdet werden. Der Assay Schale gezeigt, wie sie bei der Durchführung von Messungen positioniert werden. BitteKlicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Legen Sie die stereomicrosope mit Okularmikrometer innerhalb des Faraday-Käfigs. Boden zum Inneren des Faradayschen Käfigs, die dann an Masse des Elektro geerdet. Setzen Mikromanipulatoren zu beiden Seiten des Mikroskops (4A).
- Chlorid zwei Silberdrähten in Bleichmittel für mindestens 1 Stunde eingetaucht. Erstrecken sich über Nacht (O / N), falls erforderlich (Figur 4B). Wiederholen Sie diesen Schritt, wenn die Silberdrähte erneut chloriert werden, zum Beispiel wenn sie grau in Erscheinung statt schwarz sind brauchen.
- Thema einem chlorierten Silberdraht in jede der Mikroelektrodenhalter.
- Stellen Sie den elektrischen Schaltkreis mit entsprechender Erdung. Beispielsweise stellen die entlüftet wird, geraden Mikroelektrodenhalter, der die ionenspezifische Elektrode (ISE) auf der Elektrometersonde, die auf den Mikromanipulator (4C) befestigt ist, halten wird.
- Sichern Sie die belüftete, 45 ° Mikroelektrodenhalter, der die Referenzelektrode halten wird, auf die andere Mikromanipulator (4C). Dann gemahlen, mit Schaltungsmasse am Elektro.
- Erden Sie die "AB out" Ausgang BNC des Elektrometers an Masse des Elektrometers.
- Legen Sie die Faseroptik-Lichtquelle außerhalb des Faradayschen Käfigs, mit dem Schwanenhals-Rohr durch ein Loch in den Faraday-Käfig (4A) eingefädelt.
- Einrichten und kalibrieren das Elektrometer nach den Anweisungen des Herstellers. Re-Kalibrierung des Elektrometer in regelmäßigen Abständen (alle 1-2 Wochen). Wenn Sie fertig sind, und zwischen den Messungen, lassen Sie das Elektrometer in "Stand-by" -Modus mit der Position Toggle auf "IN", Zählereingang auf "A" und den Bereich auf "200 mV."
4. Bereiten Sie Seziersaal und Bad-Lösungen
- Bereiten Sie Drosophila Kochsalzlösung so detailliert in Tabelle 1. Für den Einsatz in Experimenten, gießen ~ 40 ml in einen 50 ml konischen Röhrchen bringen und RT. Verwerfen, wenn es Beweise für Bakterien- oder Pilzwachstum.
- Standard Badmedium (SBM) vorzubereiten, mischen Drosophila Kochsalzlösung 1: 1 mit Schneider-Medium, und durch ein 0,22 um Spritzenfilter. Bereiten Sie in kleinen Aliquoten (~ 10-15 ml), bei 4 ° C und entsorgen, wenn es Hinweise auf bakterielle oder Pilzwachstum. Die Komponenten des Schneiders Mediums sind in Tabelle 2 aufgeführt.
5. Herstellung des ionenspezifischen Elektrode: Silanisierung Pipetten
Anmerkung: In diesem Schritt wird Dichlordimethylsilan verwendet, um leicht "silanisiert" die ionenspezifischen Elektrode. Dadurch wird eine hydrophobe Schicht auf der Innenseite der Elektrode, daß sie die hydrophoben Ionophor behalten kann. Übermäßige Silanisierung vermieden wird, um die Aufnahme von Mineralöl zu verhindern, wenn Sie messungen in Tropfen unter Öl. Silanisiert Elektroden sind für mehrere Wochen. Daher wird dieser Schritt alle paar Wochen durchgeführt.
- Flammpolitur die Enden 5-6 unfilamented Borosilikatglas Kapillaren (Außendurchmesser 1,2 mm, Innendurchmesser 0,69 mm, Länge 10 cm) auf kleiner Flamme, mit geeigneten Sicherheitsvorkehrungen.
- Platzieren der Kapillarrohre in den Boden eines 1 l-Becherglas.
- In einer Kapuze und mit geeigneter persönlicher Schutzausrüstung, gießen Sie 70% Salpetersäure (ACHTUNG: brennbare und ätzende siehe Sicherheitsdatenblatt zur sicheren Lagerung und Handhabung) in den Kapillaren und genießen für 5 min.
- Gießen Sie die Salpetersäure wieder in einer Glasflasche. Wiederverwendung für die anschließende Salpetersäure Waschen.
- Hinzufügen ~ 200 ml entionisiertem H 2 O in das Becherglas. Leere Abfälle in einem speziellen Glasflasche für Salpetersäure Abfälle. Wiederholen Sie mit zusätzlichen 200 ml entionisiertem H 2 O Folgen Sie den Richtlinien des Instituts für the sicheren Entsorgung von Abfallsäure.
- Haben drei weitere Waschungen mit großen Mengen von entionisiertem Wasser. Leeren Sie in die Spüle.
- In der Haube, legen Kapillaren auf einer Heizplatte mit Keramik Top Set zu 200 ° C und trocken für mindestens 20 min, optimal 1 Std. Es kann auch für längere Zeiträume verbleiben.
- 2 & mgr; m - auf einer Pipette Abzieher (5A), Pipetten mit einem Spitzendurchmesser von ca. 1 zu ziehen.
- Zeigen gezogen Pipetten wieder auf Kochplatte, kümmert sich nicht um Tipps zu brechen, für mindestens 10 min, optimal 30 Minuten, kann aber länger bleiben.
- In 20 ul Dichlordimethylsilan (ACHTUNG: Entzündlich, ätzend, akute Toxizität, siehe Sicherheitsdatenblatt zur sicheren Lagerung und Handhabung) in eine 15 cm Petrischale aus Glas und invertieren Teller über den Pipetten auf der heißen Platte (5B). Verlassen Sie an Ort und Stelle für mindestens 20 min, optimal 2 h. Die gleiche Petrischale in Folgeexperimenten wieder verwendet werden kann.
- Bestimmen Sie die amou nt Dichlordimethylsilan gegeben durch Versuch und Irrtum. Nach dem Ionophor aufgenommen (Schritt 8.4), dass die Schnittstelle zwischen dem Ionophor und Verfüllung Lösung ist flach (5C). Wenn die Schnittstelle konkav, zeigt dies an Über Silanisierung und weniger Silan verwendet werden. Wenn die Schnittstelle ist konvex, so zeigt dies unter Silanisierung und Silan verwendet werden.
Anmerkung: Die Dichlordimethylsilan neigt zu "Aus" über die Zeit zu gehen, dh, weniger wirksam Silanisierung mit dem gleichen Volumen an Silan erreicht.. An diesem Punkt kann entweder neue Silan bezogen werden, oder die Höhe eingestellt werden, um äquivalent Silanisierung erzielen.
- Bestimmen Sie die amou nt Dichlordimethylsilan gegeben durch Versuch und Irrtum. Nach dem Ionophor aufgenommen (Schritt 8.4), dass die Schnittstelle zwischen dem Ionophor und Verfüllung Lösung ist flach (5C). Wenn die Schnittstelle konkav, zeigt dies an Über Silanisierung und weniger Silan verwendet werden. Wenn die Schnittstelle ist konvex, so zeigt dies unter Silanisierung und Silan verwendet werden.
- Schalten Sie heißen Platte und abkühlen lassen. Entfernen Glas-Petrischale und Transferpipetten zum Vorratsgefäß enthalten, Kieselgel, das Austrocknung hält. Griff sorgfältig Pipetten (Pinzette hilfreich) zu brechen Spitze zu verhindern.
5 "src =" / files / ftp_upload / 53.144 / 53144fig5.jpg "/>
Abbildung 5. Silanisierung Pipetten. (A) Beispiel für Pipettenzieher. (B) Bild von den gezogen Pipetten auf der heißen Platte. Die Glasschale mit einem Rückgang von Dichlordimethylsilan hat sich in den gezogen Pipetten invertiert wurde. (C) Schematische Darstellung der Schnittstelle zwischen dem Ionophor Cocktail und der Hinterfüllung Lösung. Eine flache Schnittstelle zeigt optimale Silanisierung. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
6. Vorbereitung der Negative Absaugvorrichtung
Anmerkung: In diesem Schritt wird ein einfach negativ Saugvorrichtung hergestellt (Figur 6), mit dem die ionenspezifische Elektrode füllen wird. Dieser Schritt wird nur einmal durchgeführt.
- Bringen Sie ein 3-ml-Spritze mit einem 3-Wege-Hahn mit Luer-Lock. Beimdas gegenüberliegende Ende des Absperrventils, mit dem sich drehenden Kragen und Wache, Schraube in einem weiblichen Luer-Verbindungssperr mit Stacheldraht Ende. Dann befestigen Silikonschlauch 1/16 Zoll Innendurchmesser 1/8 Zoll Außendurchmesser, um die mit Widerhaken versehene Ende des Verbinders. Legen Sie dann Kunststoffschlauch mit 1/32 inch Innendurchmesser und 3/32 Inch Außendurchmesser
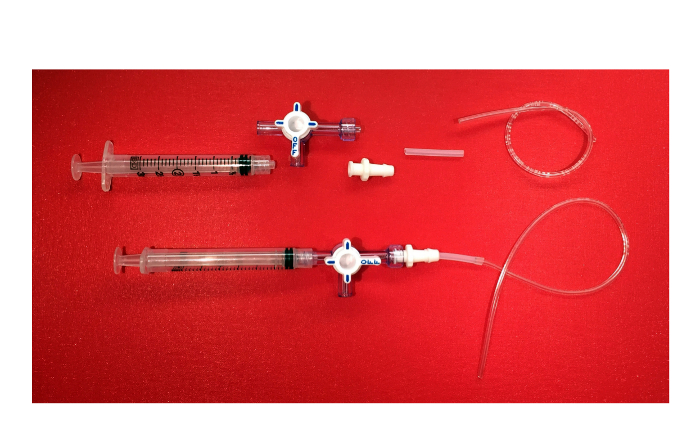
Abbildung 6. Das Negative Absaugvorrichtung. Bild von den Komponenten der negativen Absaugeinrichtung (3 ml Spritze mit Luer-Lock, 3-Wege-Hahn mit drehenden Kragen und Wache, weiblichen Luer-Verriegelungsverbinder mit Stacheldraht Ende, Silikonschläuche, Kunststoffschlauch) und das Endprodukt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
7. Collect Flies für Dissection < / p>
- Verwenden Sie Standard-fly Haltung Techniken 25 einzurichten fly Kreuze und zu ändern, wie gebraucht. Beispielsweise verwenden in Experimenten, bei denen erhöhte GAL4 Aktivität erwünscht erhöhte Temperatur (zB 28 ° C).
Hinweis: Es ist wichtig, dass die Fliegen sind nicht in überfüllten Bedingungen aufgezogen wurden; die Anzahlen von männlichen und weiblichen Elternteile sollten in diesem Fall verringert werden. Wenn verschiedene Genotypen verwendet werden, sollte die Anzahl von männlichen und weiblichen Elternteile angepasst werden, um etwa gleiche Anzahl von Nachkommen zu erhalten. - Sammeln Fliegen für die Präparation (Schritt 11) unter Verwendung von Standardtechniken fly Haltung 25 in 1 - 2 Tagen nach dem Schlüpfen. Tubuli aus weiblichen Fliegen leichter zerlegt, aber Tubuli aus männlichen Fliegen können, falls notwendig oder erwünscht, verwendet werden. Platz fliegt in ein Fläschchen mit Fliegen Essen. Platzieren Fläschchen bei der gewünschten Temperatur für 3 - 5 Tage vor der Sektion.
8. Füllen des ionenspezifischen Elektroden (ISE)
e_content "> Hinweis:.. In diesem Schritt wird die ISE mit einer Salzlösung aufgefüllt und dann Ionophor in die Spitze eingeführt Die ISE kann von Tag zu Tag, so lange wiederverwendet werden, da es gut funktioniert, ist daher dieser Schritt alle paar Tage durchgeführt, je nach Bedarf.- Um einen K + -spezifischen Elektroden zu machen, Hinterfüllung eine silanisierte Pipette mit 0,5 M KCl mit einer 1-ml-Spritze und Mikrofilament (Wiederverwendung Mikrofilamente von Experiment zu Experiment). Stellen Sie sicher, dass die Hinterfüllung Lösung füllt an die Spitze der Pipette - ohne Luft in Spitze. Wenn unsicher, visualisieren unter einem zusammengesetzten Mikroskop. Entfernen Luftblasen durch vorsichtiges Schwenken der Pipette.
- Für einen Na + -spezifische Elektrode, Hinterfüllung mit 150 mM NaCl.
- Setzen Sie die hintere Ende der ISE in den Kunststoffschlauch des negativen Absaugvorrichtung in Schritt 6 In der Haube vorbereitet, legen Sie die ISE auf einen umgedrehten Kunststoff 3,5 cm Petrischale mit einem Stück Knete, um an Ort und Stelle zu sichern.
- Generieren negativen pruck mit der Saugvorrichtung. Zeichnen Sie wieder auf die Spritze mit dem "off" der Hahn Handgriff in Richtung des Seitenöffnung. Die Menge an Zurückziehen wird variieren, liegt aber üblicherweise im Bereich von 0,6 bis 0,7 ml. Dann drehen Sie den Wasserhahn Griff, so dass die "off" in Richtung auf den Schlauch zeigt.
- In der Haube und mit geeigneter persönlicher Schutzausrüstung, tauchen Sie ein 1 - 10 ul Pipettenspitze in den Ionophor-Lösung (ACHTUNG: giftige Siehe Materialdatensicherheitsblatt zur sicheren Lagerung und Handhabung.). Vertreibt einen kleinen Tropfen, indem Sie einen behandschuhten Finger über die größere Öffnung der Pipettenspitze. Berühren Sie dann die Tropfen Ionophor auf die Spitze des ISE, ohne Berührung der ISE Spitze mit der Pipettenspitze zu vermeiden brechen die ISE Spitze.
- Verwenden Sie die Kalium-Ionophor in der Tabelle aufgeführten Materialien "wie sie ist." Um die Natrium-Ionophor vorzubereiten, stellen eine Lösung von (in% w / w) 10% 4-tert-Butylcalix [4] aren-tetraessigsäure tetraethylester, 890,75% Nitrophenyloctylether und 0,25% Natriumtetraphenylborat (ACHTUNG:. Giftige Siehe Materialdatensicherheitsblatt zur sicheren Lagerung und Handhabung). Shop in einem Glasfläschchen in Folie verpackt den Inhalt vor Licht zu schützen.
- Untersuchen Sie die ISE unter 40-facher Vergrößerung unter Verwendung eines zusammengesetzten Mikroskop zu bestimmen, ob das Ionophor in die ISE Spitze und ob das Ionophor / Hinterfüllung Lösung Schnittstelle ist flach (siehe Schritt 5.10.1 und 5C) "aufgenommen".
- Wenn kein Ionophor aufgenommen wurde, die Menge an Unterdruck durch die Saugeinrichtung erzeugt wird. Wenn dies nicht erfolgreich ist, kann die Elektrode unzulängliche silanisiert sein. Schritt 5 unter Verwendung einer größeren Menge von Dichlordimethylsilan.
- Legen Sie die ISE, Spitze nach unten, auf die Wand eines Bechers teilweise mit 150 mM KCl gefüllt. Sichern Sie die ISE indem Modelliermasse auf die Seite des Bechers. Die Spitze liegt innerhalb des 150 mM KCl. Fahren Sie mit dem ISE ov verwendener mehrere Tage, so lange es gut funktioniert (siehe Schritt 10.6).
- Für einen Na + ISE, speichern Sie die Elektrode in 150 mM NaCl.
9. Bereiten Sie die Referenzelektrode
Hinweis: Die Schritte 9,1-9,3 können im Voraus durchgeführt werden. Schritte 9,4-9,6 jeweils experimentellen Tag durchgeführt.
- Flammpolitur die Enden 10 filamentierten Borosilikatglas Kapillaren (Außendurchmesser 1,2 mm, Innendurchmesser 0,69 mm, Länge 10 cm) auf kleiner Flamme, mit Sicherheitsvorkehrungen.
- 2 & mgr; m - auf einer Pipette Abzieher, Pipetten zu einem Spitzendurchmesser von ca. 1 zu ziehen.
- Shop Pipetten in einer Pipette Vorratsglas bis zur Verwendung. Pipetten können unbegrenzt lagerfähig.
- Am Tag des Experiments unter Verwendung eines Mikrofilament und Spritze, füllen die Spitze und der Schaft der Pipette mit 1 M Natriumacetat. Stellen Sie sicher, es gibt keine Luftblasen und diese Lösung geht an der Spitze. Flick vorsichtig die Pipette, wenn Luftblasen vorhanden sind.
- Verwendung eines zweitenMikrofilament und Spritze, verfüllen die Pipette mit 3 M KCl. Wiederum gewährleisten Luftblasen vorhanden sind.
- Bewahren Sie die Referenz-Elektrode in ein Becherglas mit 150 mM KCl (siehe Schritt 8.6).
10. Kalibrierung der ISE
Hinweis: Dieser Schritt wird dreimal auf das Experiment Tag durchgeführt: früh am Tag, um sicherzustellen, dass die ISE arbeitet, und dann vor und nach Messungen der 20-25 sekretiertes Flüssigkeitstropfen (Tabelle 3).
- Zur Kalibrierung des Kalium ISE, legen zwei 0,6 & mgr; l Tropfen jeder der folgenden vier Konzentrationen von KCl auf die siliconelastomerbeschichteten 3.5 cm Petrischale (hergestellt in Schritt 1): 15 mM, 75 mM, 150 mM und 200 mM. Sorgfältig Schicht 2 ml Mineralöl über den Tropfen.
- Für Natrium-ISE, verwenden Sie Kalibrierungs Tropfen 15 mM und 150 mM NaCl.
- Legen Sie die Kalibrierungs Gericht auf die Bühne des Stereomikroskops in der Faraday-Käfig und zu beleuchten.
- ThreAnzeige der ISE und der Referenzelektrode über die Silberdrähte und ziehen in die Mikroelektrodenhalter.
- Mit Hilfe der Mikromanipulatoren, vorab die ISE und Bezugselektrode in das 15 mM KCl Abfall.
- Schalten Sie das Elektrometer zu "arbeiten" -Modus. Ermöglichen das Lesen zu begleichen.
- Nehmen Lesung im Notebook. Wiederholen der 75 mM, Tropfen 150 mM und 200 mM. Berechnen Steigung zu bestimmen, ob ISE gut funktioniert (siehe Schritt 13.1 und Tabelle 3). Wenn nicht, erstellen Sie eine neue ISE.
Hinweis: Anzeichen, dass ein ISE arbeitet nicht gut: Versäumnis, einen Messwert zu erhalten; langsam (mehrere Sekunden oder länger) ins Gleichgewicht; instabilen Messwert; Steigung <49 mV / Dezil Änderung der K + oder Na + -Konzentration. - Zwischen der ersten Kalibrierung des Tages und die Messungen in Schritt 12 durchgeführt, also während der Durchführung von Schritt 11 (Tubulus Dissektionen), speichern die ISE und Referenzelektroden in 150 mM KCl (wie in Schritt 8.6 beschrieben).
11. Tubulus Dissection
Anmerkung: Dieser Schritt basiert auf dem Versuch Tag durchgeführt.
- Aliquot eine kleine Menge (~ 500 bis 600 & mgr; l) der Norm Badmedium (SBM), die in Schritt 4.2 hergestellt, für die Verwendung am Tag des Experiments genommen und auf Raumtemperatur erwärmen. Dieser sollte mindestens 30 Minuten vor der Dissektion durchgeführt werden, kann aber auch früher erfolgen. Außerdem müssen mindestens 20 ml RT Drosophila Kochsalzlösung (Schritt 4.1) zur Verfügung vor Beginn Dissektionen.
- Unmittelbar vor Beginn der Dissektionen: sehen Sie das Testschale bei 10-facher Vergrößerung unter einem Stereomikroskop und fügen Sie genug SBM fast füllen jedes Loch in dem Test Schale, in der Regel zwischen 10 und 30 & mgr; l. Wenn Medikamente oder Peptid gehen, um aufgenommen zu Mitte Experiment SBM werden, notieren Sie sich den genauen Volumen von SBM in jede Vertiefung gegeben. Vermeiden Sie Überfüllung der auch dies kann zu dem Röhrchen während des Experiments floating Weg führen.
- Sorgfältig Schicht ~ 12-13 ml Mineralöl auf die Oberseite, so daß die Vertiefungen eineRe abgedeckt. Dies wird Verdampfen des sekretierten Flüssigkeitstropfen während des Experiments zu verhindern.
- Platz fliegt auf CO 2 Pad seziert werden.
- Pick-up eine Fliege über seinem Bein oder Flügel mit einer Pinzette und auf seiner Rückseite (Bauchseite nach oben) auf dem Silikonelastomer-beschichtet Sezieren Gericht in Schritt 1 vorbereitet Impale den Brustkorb mit einem Minutien Stift, um die Fliege zu befestigen.
- Fügen Sie einen Tropfen RT Drosophila Kochsalzlösung (Schritt 4.1), um Tauchen Sie das Haar in Kochsalzlösung.
- Optional: Clip off Flügel und Beine. In der Praxis ist dies meist nicht erforderlich.
- Mithilfe der nicht-dominanten Hand Pinzette auf "hold" Leib der Fliege am thorakoabdominale Kreuzung. Mithilfe der dominanten Hand Pinzette, um die Bauchschuppenschicht ablöst, beginnend an der thorakoabdominale Übergang und Bewegung in Richtung des hinteren Endes der Fliege. Der Darm, mit angeschlossenem Malpighischen, sollte mit diesem Manöver ausgesetzt werden.
- Ohne Berührung der Tubuli, sezieren gratis das Mitteldarm /Enddarm und die angeschlossenen Tubuli. Halten Sie den Bauch in den nicht-dominanten Hand Pinzette und verwenden Sie eine 30 G Nadel, um den Harnleiter aus dem Darm zu trennen, Ablösen der Tubuli aus dem Darm und frei von der fly.It ist wichtig, dass keine Risse oder Mieten in die Röhrchen eingebracht werden, außer an den Harnleiter.
Hinweis: Das vordere Paar der Tubuli wird am einfachsten präpariert, jedoch die hinteren Tubuli können ebenso verwendet werden. - Unter Verwendung der feinen Glasstab (Schritt 2), nehmen Sie den Röhrchenpaar und übertragen in eine Mulde des Assays Gericht.
- Unmittelbar nach dem Tubulus Paar in das Loch eingebracht worden ist, greifen Sie zum Ende von einem der Röhrchen mit dem Glasstab, ziehen sich aus der Bade Tropfen, bis das abgeschnittene Ende des Harnleiters liegt auf halbem Weg zwischen dem Stift und der Badeabfall und Wrap- das Ende des Röhrchens um den Stift mit dem Glasstab. Am Ende dieses Manövers bleibt eine Tubulus in der Badesalzabfall und wird vom Schnittende des Harnleiters Flüssigkeit absondern, wie in 1 veranschau . Das andere Röhrchen, die in 1 markiert die "Anker Tubulus", um den Stift gewickelt. Es verankert die sezernierenden Röhrchen im Ort, wird von Öl umgeben ist und nicht Flüssigkeit absondern.
- Unmittelbar nach dem Schritt 11.11, schreiben Sie den gut (zB A, B, C), Tubulus identifizierende Informationen (z. B. Genotyp oder Zustand) und die Zeit (das ist die Startzeit, wenn Fluid beginnt, durch die Tubuli sezerniert werden im Tröpfchen des Badens Kochsalzlösung).
- Fahren Sie mit der nächsten Dissektion. Sobald der Experimentator mit ihren Kompetenzen in dieser Technik, dauert es in der Regel 3-4 min, um ein Paar Tubuli zu sezieren, übergeben sie an der Badekochsalzlösung, und wickeln Sie den Anker Röhrchen um den Stift. Daher 20-25 Tubuli können in der Ramsay-Test innerhalb von 1,5 Stunden eingestellt werden. 4 min nach der Startzeit des vorherigen Tubulus - der Startzeit jedes Röhrchens wird somit über 3 liegen.
12 Messungen vornehmen
Hinweis: Dieser Schritt wird auf das Experiment Tag durchgeführt.
- Kalibrieren der ISE (Schritt 10) etwa 20 Minuten vor der ersten Messung. Dies ermöglicht es Zeit, eine neue ISE zu machen, wenn nötig.
Anmerkung: Bei der gewünschten Zeit, beispielsweise nach 2 h Sekretion ist das sekretierte Flüssigkeitstropfen jedes Röhrchen zur Messung bereit. - Aufzeichnung der Zeit der Messung. Messung des Durchmessers des sezernierten Flüssigkeitstropfens mit dem okularen Mikrometer und Aufzeichnung. Beachten Sie die Vergrößerung, zB 50X.
- Schieben Sie den ISE und der Referenzelektrode in die Flüssigkeit Drop. Schalten Sie das Elektrometer zu "arbeiten". Lassen Sie den Messwert stabilisiert. Notieren Sie den Wert.
- Wiederholen Sie für den nächsten Tropfen.
- Am Ende des Experiments, wiederholen Sie die Kalibrierungsmessungen (Schritt 10).
13. Berechnungen
Anmerkung: Dieser Schritt kann am Ende des Versuchs Tag durchgeführt, entweder werden oder zu einem späteren Zeitpunkt.
- Berechnen Sie den MittelwertSteigung / Dezil Änderung der Kaliumkonzentration. Tabelle 3 zeigt ein Beispiel.
Anmerkung: Für Natrium, werden die Werte für die Differenz zwischen 15 mM und 150 mM NaCl Messungen sein. - Den Mittelwert der beiden Messungen (vor und nach) 200 mM KCl (oder 150 mM NaCl).
- Berechnen Sie das Volumen jedes Tröpfchens. V = & pgr; d 3/6, wobei d der Durchmesser des Tröpfchens mit dem Okularmikrometer in Schritt 12.2 gemessen.
- Berechnen die Sekretionsrate = V / Zeit (nL / min / Röhrchen), wobei V das Volumen der in Schritt 13.3 bestimmt Tröpfchen, und die Zeit ist die Länge der Zeit der Tubulus sekretierten Flüssigkeit (= Messzeit - Zeit des Ziehens Harnleiter von Bade Tröpfchen).
- Berechnung der Ionenkonzentration unter Verwendung der Formel [K] = 10e (& Dgr; v / S) * 200 oder [Na] = 10e (& Dgr; v / S) * 150, wobei & Delta; v = die Differenz (in mV) zwischen dem Potential, gemessen von der sekretierten Flüssigkeit Abfall und das Potential des 200 mM Kalibrierungsabfall (foder Kalium; 150 mM Abfall für Natrium). S = die in Schritt 13.1 bestimmt Hang.
- Berechnen Ionenfluss = [ion] x Flüssigkeitssekretion Rate. Drosophila Tubuli, wird diese pmol / min / Röhrchen sein.
14. Reinigung Up
Anmerkung: Dieser Schritt wird am Ende des Versuchs Tag durchgeführt.
- Gründliches Reinigen der Wells ist wichtig, um sicherzustellen, daß restliche Salzkristalle nicht in den Vertiefungen verbleiben, zur Änderung der Ionenkonzentration und Osmolarität in zukünftigen Experimenten.
- Lassen Sie den Mineralöl abfließen.
- Spülen Sie die Vertiefungen der Assay Gericht. Ein 200 ul Pipettenspitze verwendet werden, um sanft abzukratzen Restsalzkristall werden. Verwendung Kunststoffschlauch an den Wasserhahn angeschlossen, drücken Sie den Schlauch, um ein Hochdruckstrahl von heißem Wasser zu schaffen, um gründlich spülen jede Vertiefung geben.
- Lassen Sie die O / N trocknen. Alternativ kann auch ein Fön zu trocknen die Brunnen verwendet werden.
- Spülen Sie Zange mit deionisiertem H 2 O undgenießen in Ethanol für 15 Minuten bis zu mehreren Stunden.
- Lassen Sie das Öl aus der Kalibrierung Schüssel und mit heißem Wasser gewaschen. Verwenden Sie Seife sowie solange sie gründlich abgespült. Durchführen des letzten Spülgang mit destilliertem H 2 O.
- Flush Mikrofilamente und Spritzen mit destilliertem H 2 O.
Ergebnisse
Die 7 und 8 zeigen, dass die Verwendung des Ramsay Assay mit ionenspezifischen Elektroden gegenüber K + und Na + -Konzentration zu messen, kann die genetische und pharmakologisch verschieden K + und Na + Flüsse, Informationen, die nicht durch die Messflüssigkeit Sekretionsraten allein erfasst wird unterscheiden. Fig 7 zeigt, dass Fluid-Sekretion in Tubuli von Fliegen, die eine homozygote Nullmutation in der NKCC verringert wird durch eine A...
Diskussion
Die Verwendung des Ramsay Assay zusammen mit ionenspezifischen Elektroden, ermöglicht die Messung der Fluid Sekretionsraten und Ionenströme in isolierten Insekten Malpighian (Niereninsuffizienz) Tubuli. Zwanzig oder mehr Tubuli kann zu einem Zeitpunkt untersucht werden, was einen höheren Durchsatz im Vergleich zu dem Assay in vitro einzelne microperfused Tubuli. Zusätzlich ionenspezifischen Elektroden erlauben die Bestimmung von Ionenkonzentrationen in der sekretierten Flüssigkeit in situ, die Beg...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materialien
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Referenzen
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten