A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש של assay רמזי כדי למדוד את הפרשת נוזלים ויון שטף מחירים ב
In This Article
Summary
פרוטוקול זה מתאר את השימוש של assay רמזי למדידת שיעורי הפרשת נוזל מצינוריות Malpighian (כליות) מבודדות מmelanogaster תסיסנית. בנוסף, השימוש באלקטרודות יון ספציפי למדידת ריכוזי נתרן ואשלגן בנוזל המופרש, המאפשר חישוב של שטף יון transepithelial, מתואר.
Abstract
אפנון של תחבורת יון אפיתל כליות מאפשר אורגניזמים לשמור על הומאוסטזיס יוני והאוסמוטי בפרצוף של משתנה תנאים חיצוניים. אבובית דרוזופילה melanogaster Malpighian (כליות) מציעה הזדמנות שאין כמותו כדי לחקור את המנגנונים המולקולריים של תחבורת יון אפיתל, בשל הגנטיקה החזקה של האורגניזם הזה ואת הנגישות של tubules הכליות שלה למחקר פיסיולוגי. כאן, אנו מתארים את השימוש של assay רמזי למדידת שיעורי הפרשת נוזל מtubules הכליות לטוס מבודד, עם השימוש באלקטרודות יון ספציפי למדידת ריכוזי נתרן ואשלגן בנוזל המופרש. assay זה מאפשר לימוד והנתיבים נוזל transepithelial ויון של ~ 20 tubules בזמן, ללא הצורך להעביר את הנוזל המופרש למנגנון נפרד למדידת ריכוזי יון. מבחינה גנטית ניתן לנתח tubules השונה כדי להעריך את התפקיד של גנים ספציפיים בתהליכי הובלה. בנוסף, במלוח athing יכול להיות שונה כדי לבחון את ההשפעות של מאפייניו הכימיים, או תרופות או הורמונים הוסיפו. לסיכום, טכניקה זו מאפשרת האפיון המולקולרי של מנגנונים בסיסיים של תחבורת אפיתל יון באבובית דרוזופילה, כמו גם הסדרת מנגנוני תחבורה אלה.
Introduction
תחבורת יון אפיתל כליות בבסיס iono- האורגניזם וויסות האוסמוטי. אבובית דרוזופילה melanogaster Malpighian (כליות) מציעה הזדמנות שאין כמותו כדי לחקור את המנגנונים המולקולריים של תחבורת יון אפיתל. זאת בשל השילוב של הגנטיקה החזקה של דרוזופילה, יחד עם הנגישות של tubules הכליות שלה למחקר פיסיולוגי. Assay ראמזי, על שמו של החוקר שהיה חלוץ טכניקת 1, מודד שיעורי הפרשת נוזל מצינוריות Malpighian מבודדות, והוקם בשנת 1994 על ידי תסיסנית דאו ועמיתים 2. זה סלל את הדרך למחקרים נוספים באמצעות תסיסנית כלים גנטיים, כגון מערכת GAL4-כטב"מ 3,4, להגדיר מסלולי איתות תא ספציפי המסדירים את הפרשת נוזלים. דוגמא כוללת איתות סידן בתגובה להורמון פפטיד 5, בקרב רבים אחרים 6,7.
ve_content "> שילוב של טכניקות גנטיות ומחקר פיסיולוגי קלאסי הוכיח כי דור שתן בזבוב מתרחש באמצעות ההפרשה של נוזל כלוריד-עשיר אשלגן מהמגזר העיקרי של אבובית. זו מתרחשת באמצעות הפרשת transepithelial המקבילה של קטיונים, בעיקר K + אלא גם Na +, דרך התא העיקרי, וCl -. ההפרשה דרך תא stellate 8-12 היכולת למדוד בנפרד והנתיבים transepithelial K + וNa + מאפשרת אפיון מפורט יותר של מנגנוני תחבורה מאשר המדידה של הפרשת נוזל יש לבד. לדוגמא, בtubules תסיסנית unstimulated, + Na / K + -ATPase מעכב ouabain אין כל השפעה על הפרשת נוזל 2, גם כאשר ספיגתו לתוך תאים עיקריים היא מעוכבת על ידי taurocholate מעכב טרנספורטר אניון האורגני 13. עם זאת, לינטון ו אודונל הראה כי ouabain depolarizesפוטנציאל הממברנה basolateral, ומגביר Na + שטף 9. כפי שניתן לראות בנציגי התוצאות, אנו משוכפלים ממצאים אלה, והראו כי K + שטף הוא במקביל ירד 14; שטף Na + המוגבר וירידת K + שטף יש השפעות מנוגדות על הפרשת נוזל, וכתוצאה מכך אין שינוי נטו בהפרשה. לפיכך, יש שתי החלטות ל" פרדוקס ouabain, "כלומר, ההתבוננות הראשונית שouabain אין כל השפעה על הפרשת נוזלים באבובית תסיסנית:. ראשונה, בtubules המגורה, ההשפעה של ouabain על הפרשת נוזל אינה נראית לעין עקב הספיגה שלה על ידי טרנספורטר אניון האורגני 13; ושנייה, בtubules unstimulated, ouabain יש השפעות מנוגדות על transepithelial Na + K + ושטף, וכתוצאה מכך אין שינוי נטו בהפרשת נוזל (ראה תוצאות ונ"צ נציג. 9). לכן, התפקיד העיקרי של + Na / K + -ATPASE בtubules unstimulated הוא להוריד תאיים ריכוז Na + ליצור שיפוע ריכוז נוח לNa + -coupled תהליכי הובלה על פני קרום basolateral. ואכן, על ידי מדידה בנפרד Na + K + ונתיבים, שהוכחנו כי tubules חסר cotransporter נתרן, אשלגן-2-כלוריד זבוב (NKCC) ירד K + שטף transepithelial, ללא ירידה נוספת לאחר תוספת ouabain, ולא חלו שינוי בtransepithelial Na + שטף 14. ממצאים אלה נתמכים מסקנתנו כי Na + כניסה לתא דרך NKCC ממוחזרת דרך Na + / K + -ATPase. בדוגמא אחרת, Ianowski נצפה et al. כי הורדת K אמבטיה + ריכוז מ -10 מ"מ ועד 6 מ"מ ירד K transepithelial + שטף וtransepithelial המוגבר שטף Na + בצינוריות מprolixus Rhodnius, ללא שינוי נטו בהפרשת נוזל 15. אפקטי ההפרש בשטף Na + K + ושטף על פני tubules זחל גם נצפו בtubules דרוזופילה בתגובה לדיאטות מלח שונה 16 ובשני מיני יתושים בתגובה לגידול מליחות 17.האתגר הגדול ביותר במדידת שטף יון transepithelial בהכנת assay רמזי הוא קביעת ריכוזי יון בתוך הנוזל המופרש. אתגר זה כבר נפגש עם פתרונות שונים, כולל photometery להבה 18, שימוש ביונים רדיואקטיביים 19, וגל אלקטרון הבדיקה ספקטרוסקופיה נפיצה 20. טכניקות אלה דורשות העברה של ירידת הנוזל המופרשת למכשיר למדידת ריכוזי יון. מאז את נפח הנוזל המופרש על ידי אבובית תסיסנית unstimulated הוא קטן, בדרך כלל ~ 0.5 NL / דקה, זה מציב אתגר טכני וגם מציגה שגיאה אם חלק מהנוזל המופרש הואאיבד על העברה. לעומת זאת, השימוש באלקטרודות יון ספציפי מאפשרת המדידה של פעילות יון (שממנו ניתן לחשב ריכוז יון) באתרו. הפרוטוקול הנוכחי הותאם מזה בשימוש על ידי Maddrell ועמיתים למדידת K transepithelial + שטף על פני אבובית Rhodnius באמצעות valinomycin כK + ionophore 21, ומתאר גם את השימוש ב-butylcalix 4 טרט [4] חומצת arene-tetraacetic Na מבוסס אסתר tetraethyl + אלקטרודה יון ספציפי -specific המאופיינת Messerli et. אל. 22. אלקטרודות יון ספציפיות יש גם שימשו למדידת ריכוזי יון בנוזל המופרש על ידי צינוריות Malpighian בassay רמזי ב9,23 מבוגרים ו -16 זחל תסיסנית melanogaster, ניו זילנד Alpine Weta (Hemideina מאורי) 24 וביתושים 17.
כאן, אנו מתארים בפירוט את השימוש ברמזים כאומר למדוד שיעורי הפרשת נוזל בtubules Malpighian מדרוזופילה melanogaster, כמו גם שימוש באלקטרודות יון ספציפי כדי לקבוע את הריכוזים של K + וNa + בתוך הנוזל המופרש ולכן החישוב של נתיבי יון transepithelial. סקירה של assay מסופקת באיור 1.

איור 1. סכמטי של קשיות Malpighian וAssay רמזי עם שימוש ביון ספציפי אלקטרודות למדידת ריכוזי יון. נתון זה ממחיש את ההתקנה לassay רמזי. (א) לכל זבוב ארבעה tubules, זוג הצינוריות קדמית וזוג הצינוריות אחורית, לצוף שבחלל הבטן המוקף hemolymph. בכל זוג, שתי הצינוריות להצטרף בשופכן, אשר לאחר מכן מרוקן את השתן בצומת של midgut וhindguלא. Tubules הם הסתיים עיוור. שתן נוצר על ידי המגזר העיקרי מפרישי הנוזל (באדום), וזורם לכיוון השופכן והחוצה אל הבטן. לאחר נתיחה, זוג אבובית הוא ניתק מהבטן על ידי חוצה את השופכן. (ב) זוג הצינוריות מועבר לאחר מכן לטיפה של ים מלוח בתוך היטב של צלחת assay. אחד משתי הצינוריות, המכונה כאן "אבובית העוגן," עטוף סביב סיכת מתכת והוא אינרטי. אבובית האחרות היא אבובית הסתרתו. הקטע הראשוני (שאינו מפריש נוזל) והקטע העיקרי של אבובית מפרישות להישאר בתוך הטיפה של ים מלוח. יונים ומהלך מים מתמיסת מלח הים ולתוך לום אבובית של המגזר העיקרי, ולאחר מכן לנוע לכיוון השופכן, כפי שהיו קורים בvivo. הקטע התחתון (הכחולה) הוא מחוץ למלוח רחצה ולכן אדיש. מאז שופכן הוא לחתוך, הנוזל המופרש מתגלה כטיפה מסוף החתך של השופכן. Tהוא מופרש טיפת נוזל מגדילה לאורך הזמן כהפרשה ממשיכה, וקוטרה נמדד באמצעות מיקרומטר עיני. שכבה של שמן מינרלים מונעת אידוי של הנוזל המופרש. אלקטרודות ספציפיות ההתייחסות והיון למדוד את ריכוז היון של הנוזל המופרש. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
1. Dissection, הכלים כיול וAssay הכנה
הערה: בשלב זה, שלוש צלחות פטרי פלסטיק מרופדות בסיליקון אלסטומר מוכנים: אחד לנתיחה, אחד לביצוע assay רמזי ("צלחת assay"), ואחד לביצוע כיול. מנות אלה מחדש בשימוש מניסוי לניסוי, ובכך צעד זה רק צריך להיות חוזר ונשנה אם הפסקות מנה. תמונה של המנה assay מוצגת באיור 2.
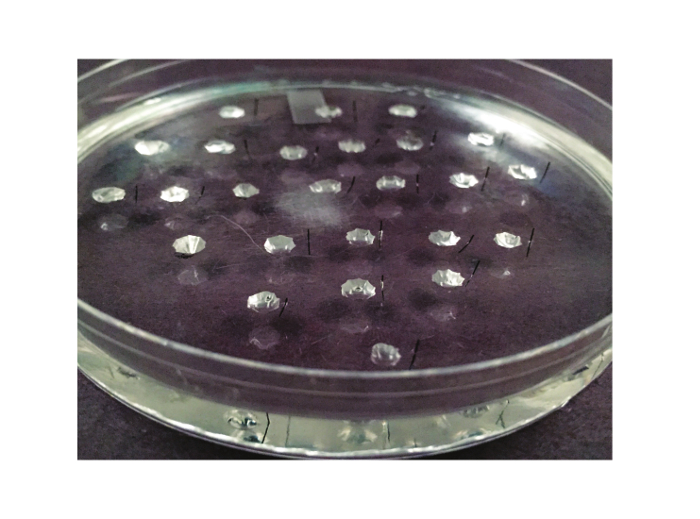
איור 2. צלחת Assay. הצלחת המשמשת לassay רמזי מוצג כאן. זה צלחת פטרי 10 סנטימטרים שמצופית אלסטומר סיליקון. בין 20 ל -25 בארות שנחצבו של אלסטומר. סיכת מתכת Minutien, לחתוך בחצי, ממוקמת בצד הימין של כל אחד גם (או לשמאל, אם הנסיין הוא שמאלי).תב"ע: "target =" _ //www.jove.com/files/ftp_upload/53144/53144fig2large.jpg blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- , שימוש בכפפות לשפוך ~ בסיס אלסטומר סיליקון 80 גרם לתוך כוס זכוכית. להוסיף 1/10 משקל (8 גרם) תרופת אלסטומר סיליקון. מערבבים עם בוחש מתכת. מניחים על שייקר מסלולית עם ראש שטוח במהירות עדינה, למשל 100 סל"ד, במשך כמה שעות עד שכל הבועות הוסרו.
- יוצקים את אלסטומר סיליקון לתוך צלחות פטרי פלסטיק נקי: 100 מנות מ"מ x 15 מ"מ לכלים לנתיחה וassay, ו -35 x 10 מ"מ לצלחת הכיול. עובי שכבת אלסטומר צריך להיות ~ 6 - 7 מ"מ למאכלי מ"מ 100, ו~ 5 מ"מ לצלחת 35 מ"מ.
- מניחים את הכלים על הספסל בטמפרטורת חדר (RT) כדי לרפא (להקשיח), ~ 24 - 48 שעות.
- לאחר צלחת assay ריפאה, להכין אצווה קטן יותר של אלסטומר סיליקון כמו בשלב 1.1, למשל., בסיס סיליקון אלסטומר 10 גרם עם תרופת 1 גרם. נער על מסלולשייקר כמו בשלב 1.1 עד בועות אוויר הם כבר לא נוכחים. אלסטומר זה ישמש בשלב 1.5.4 ולא צריך להיות מותר להקשיח לפני הצעד ש.
- באמצעות אזמל כירורגי ואמצעי זהירות חדים סטנדרטית, להפוך את בארות באחד מצלחות פטרי מצופה סיליקון אלסטומר 100 מ"מ. זה יהיה צלחת assay.
- הפוך בארות ~ 1 סנטימטר זה מזה ובקוטר של ~ 3 - 4 מ"מ. 25 בארות יכולות להתאים בקלות בצלחת assay 100 מ"מ. ולס צריך להיות לפחות 6 מ"מ הוסר מהקירות של המנה. איור 2 מדגים את המרווח של הבארות. כל טוב יכיל אבובית מפרישי נוזל אחד במהלך הניסוי. כך, מנה מכילה 25 בארות תאפשר 25 tubules להיות מנותח.
- השתמש בסמן קבוע כדי לסמן את המיקום של הבארות במידת הצורך.
- הפוך את הקירות והחלקים ככל האפשר על ידי הצבת האזמל באלסטומר, ולאחר מכן באמצעות היד הנגדית כדי לסובב את הצלחת של 360 מעלות.
- לאחר מכן, באמצעות sha הסטנדרטי RPS אמצעי זהירות, לטבול מחט G 30 לאלסטומר אינו קשוח מהשלב 1.4 ולמקם את טיפה קטנה בחלק התחתון של כל טוב. זה מחליק את תחתית הבאר. (להקשיח) אפשר לרפא x 24 - 48 שעות.
- הכן את סיכות Minutien.
- הנח 0.15 מ"מ סיכות Minutien anodized השחור ברציפות על פיסת קלטת תיוג מעבדה סטנדרטית 1 אינץ '. ציר הזמן 'הפינים צריך להיות מאונך לציר הארוך של הקלטת. חותך את הקלטת לאורכה כדי לנתק את כל פינים לשני חצאים שווים בערך (איור 3). להשתמש במחצית פינים אחד לכל אחד.

איור 3. חיתוך סיכות Minutien. הסיכות הם נעמדו על פיסת קלטת תיוג במקביל. לאחר מכן, מספריים משמשים לחתוך את הפינים במחצית."Target =" _ ge.jpg blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- הכנס כל מחצית פינים לאלסטומר סיליקון 1 מ"מ כ לזכותו של כל טוב (אם ימני, אם שמאלי, הכנס את הסיכה בצד השמאל של כל טוב). הדבר נעשה בקלות כאשר לדמיין את הבארות בצריכת חשמל נמוכה תחת סטראו לנתח ונעזר על ידי שימוש במלקחיים בוטים. איור 2 ממחיש את המיקום של הסיכות.
2. הכנת פיין זכוכית רפפות
הערה: בשלב זה, מוט זכוכית מוכן שישמש להעברת tubules מהצלחת לנתח לירידת הרחצה. מוט הזכוכית מחדש בשימוש מניסוי לניסוי, כך שלב זה מתבצע רק פעם אחת, אלא אם כן יש צורך בהפסקות מוט ואחד חדש.
- להשיג גיליונות של 3 מ"מ (1/8 אינץ ') זכוכית שחורה מוכתמת עבה מחנות תחביב וזכוכית מתאימהחותך ציוד, כגון חותך זכוכית וצבת. להשתמש בציוד בטיחות מתאים (כפפות עבות, משקפי מגן).
- חותך את הזכוכית לרצועות ארוכות ~ 6 מ"מ רחב x 10 סנטימטרים
- החזק רצועת זכוכית בכל יד. לרכך את הקצה הקצר של כל רצועה מעל הלהבה של מבער בונזן, באמצעות אמצעי בטיחות מתאים. לאחר מכן, דחף את הקצוות של שתי רצועות יחד ולפרק בתנועה חלקה כדי ליצור מוט זכוכית דק עם ידית.
3. התקנת פיזיולוגיה
הערה: בשלב זה, מיקרוסקופ, מעגל אלקטרומטר וחשמל מוגדר. מלבד מחדש chloriding התקופתי (שלב 3.2) של חוטי הכסף והכיול מחדש של אלקטרומטר (שלב 3.8), שלב זה מתבצע רק פעם אחת. תרשים 4 מתאר את ההתקנה.

איור 4. התקנת פיזיולוגיה. התקנת הפיסיולוגיה היא בתמונה כאן. סקירה כללית (א) להתקנה. סטראו ממוקם בתוך כלוב פאראדיי עם micromanipulators משני הצדדים. אור סיבים אופטי הוא מושחל דרך חור בצד השני של כלוב פאראדיי. אלקטרומטר ממוקם מחוץ לכלוב פאראדיי. (ב) לכלוריד מעיל חוטי הכסף, החוט הוא שקוע לתוך אקונומיקה. תקריב של ההתקנה (C). בעל microelectrode ישר, שמוצג בתמונה הזאת בצד השמאל, הוא מושחל על הבדיקה של אלקטרומטר. אלקטרודה היון ספציפי לאחר מכן ניתן תהיה מושחלת על חוט הכסף לבעל אלקטרודה. מימין, את האלקטרודה ההתייחסות היא מושחלת על חוט הכסף של בעל microelectrode 45 °. המעגל חייב להיות מעוגן כראוי אז. צלחת assay מוצגת כפי שימוקם בעת ביצוע מדידות. אנאלחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- מניחים את stereomicrosope עם מיקרומטר העיני בתוך כלוב פאראדיי. קרקע לפנים של כלוב פאראדיי, אשר לאחר מכן מעוגן לקרקע המארז של אלקטרומטר. מניחים את micromanipulators משני צדי מיקרוסקופ (איור 4 א).
- כלוריד שני חוטי כסף על ידי טבילה באקונומיקה במשך שעה לפחות 1. להאריך לילה (O / N) במידת צורך (איור 4). חזור על פעולה זו בכל פעם שחוטי הכסף צריכים להיות מחדש chlorided, לדוגמא, אם הם אפורים במראה ולא שחורים.
- נושא אחד chlorided חוט כסף לכל אחד מבעלי microelectrode.
- להקים את המעגל החשמלי עם הארקה מתאימה. לדוגמא, יניח פרק, בעל microelectrode ישר, אשר יקיים את האלקטרודה היון-ספציפי (ISE), בבדיקת אלקטרומטר, המובטחת על micromanipulator (איור 4C).
- Secure פרק, בעל microelectrode 45 °, שיחזיק את האלקטרודה ההתייחסות, על micromanipulator האחר (איור 4C). אז קרקע לאדמה במעגל על אלקטרומטר.
- קרקע הפלט "א.ב. החוצה" BNC של אלקטרומטר על קרקע המארז של אלקטרומטר.
- הנח את מקור אור סיבים האופטי מחוץ לכלוב פאראדיי, עם צינור מתכווננת מושחל דרך חור לתוך כלוב פאראדיי (איור 4 א).
- הקים ולכייל את אלקטרומטר לפי הוראות היצרן. לכייל מחדש את אלקטרומטר על בסיס קבוע (כל 1-2 שבועות). ברגע שהושלם, ובין מדידות, לעזוב את אלקטרומטר במצב "המתנה" עם רכיסה העמדה מוגדרת "IN", להגדיר קלט מטר ל" "ומגוון מוגדר" 200 mV. "
4. מכינים את פתרונות הביתור והאמבט
- הכן דרוזופילה מלוחה כמפורט בטבלה 1. לשימוש בניסויים, לשפוך ~ 40 מיליליטר לתוך צינור חרוטי 50 מ"ל ולשמור על RT. בטל אם יש ראיות של התפתחות חיידקים או פטרייתי.
- להכין מדיום רחצה סטנדרטי (SBM), לערבב מלוח תסיסנית 1: 1 עם המדיום של שניידר, ועובר דרך מסנן מזרק 0.22 מיקרומטר. הכן aliquots הקטן (~ 10 - 15 מיליליטר), חנות ב 4 ° C וזורקים אם יש ראיות של התפתחות חיידקים או פטרייתי. הרכיבים של המדיום של שניידר מפורטים בטבלה 2.
5. ביצוע אלקטרודה יון הספציפית: Silanizing pipets
הערה: בשלב זה, dichlorodimethylsilane משמש לקל "silanize" האלקטרודה היון ספציפי. זה מוסיף מעיל הידרופובי לחלק הפנימי של האלקטרודה שמאפשרת לו לשמר את ionophore הידרופובי. silanization מוגזם הוא נמנע כדי למנוע ספיגה של שמן מינרלים בעת ביצוע מ 'easurements בטיפות תחת שמן. אלקטרודות silanized טובות במשך כמה שבועות. לכן, בשלב זה מתבצע אחת לכמה שבועות.
- להבה-פולני הקצוות של 5 - 6 צינורות unfilamented נימי הזכוכית בורוסיליקט (מ"מ קוטר 1.2 חיצוני, מ"מ קוטר 0.69 פנימי, אורך 10 סנטימטרים) מעל להבה נמוכה, תוך שימוש באמצעי בטיחות מתאים.
- מניחים את צינורות נימים בתחתית כוס זכוכית 1 ליטר.
- , במכסת מנוע ושימוש בציוד מגן אישי מתאים לשפוך 70% חומצה חנקתית (זהירות: דליקה ומאכלת, ראה גיליון נתוני בטיחות לאחסון בטוח והוראות טיפול) על צינורות הנימים ומשרים למשך 5 דקות.
- יוצקים את החומצה חנקתית בחזרה לבקבוק זכוכית. שימוש מחדש לשטיפת חומצה חנקתית שלאחר מכן.
- להוסיף ~ 200 מיליליטר של H 2 O deionized לכוס. פסולת ריקה לתוך בקבוק זכוכית ייעודי לפסולת חומצה חנקתית. חזור עם 200 מיליליטר נוסף של H 2 O. deionized פעל לפי הנחיות מוסדיות להסילוק בטוח של פסולת אלקטרוני חומצה.
- האם שלושה שוטף נוסף עם כמויות גדולות של מים ללא יונים. רוקן לתוך כיור.
- בשכונה, מקום צינורות נימים על צלחת חמה עם סט הקרמיקה עליון 200 ° C ויבש למינימום של 20 דקות, בצורה אופטימלית שעה 1. זה יכול להיות גם יצא לתקופות זמן ארוכות יותר.
- על חולץ pipet (איור 5 א '), למשוך pipets לקוטר קצה ~ 1 - 2 מיקרומטר.
- הנח pipets משוך לאחור על פלטה חשמלית, נזהר שלא לשבור את הטיפים, לפחות 10 דקות, בצורה אופטימלית 30 דקות אבל אפשר להשאיר למשך זמן ארוך יותר.
- הוסף 20 μl של dichlorodimethylsilane (זהירות: רעילות דליק, מאכל, חריפה, ראה גיליון נתוני בטיחות לאחסון בטוח והוראות טיפול) לצלחת פטרי מזכוכית 15 סנטימטר ולהפוך צלחת מעל pipets על הצלחת החמה (איור 5). השאר במקום לפחות 20 דקות, בצורה אופטימלית שעה 2. אותו צלחת פטרי יכולה להיות שימוש בניסויים הבאים.
- לקבוע amou NT של dichlorodimethylsilane הוסיף על ידי ניסוי וטעייה. לאחר ionophore מתווסף (שלב 8.4), לוודא שהממשק בין ionophore ופתרון המילוי הוא שטוח (איור 5 ג). אם הממשק הוא קעור, זה מצביע על-silanization, ויש להשתמש פחות silane. אם הממשק הוא קמור, זה מצביע על תת-silanization, ויש להשתמש יותר silane.
הערה: dichlorodimethylsilane נוטה ללכת "את" לאורך זמן, כלומר, silanization פחות יעיל מושגת עם הנפח זהה של silane.. בשלב זה, ניתן להזמין גם silane החדש, או הסכום מותאם להשגת silanization שווה ערך.
- לקבוע amou NT של dichlorodimethylsilane הוסיף על ידי ניסוי וטעייה. לאחר ionophore מתווסף (שלב 8.4), לוודא שהממשק בין ionophore ופתרון המילוי הוא שטוח (איור 5 ג). אם הממשק הוא קעור, זה מצביע על-silanization, ויש להשתמש פחות silane. אם הממשק הוא קמור, זה מצביע על תת-silanization, ויש להשתמש יותר silane.
- כבה את הפלטה ולהתקרר. הסר צלחת פטרי זכוכית ולהעביר pipets לצנצנת אחסון המכיל ג'ל סיליקה, אשר שומר על התייבשות. ידית pipets בזהירות (מלקחיים מועילים) כדי למנוע שבירת קצה.
5 "src =" / קבצים / ftp_upload / 53,144 / 53144fig5.jpg "/>
5. pipets איור Silanizing. (א) דוגמא של חולץ pipet. תמונה (ב) לpipets משך על הצלחת החמה. צלחת הזכוכית המכילה טיפת dichlorodimethylsilane כבר הפוכה מעל pipets משך. (ג) סכמטי הממחיש את הממשק בין קוקטייל ionophore ופתרון המילוי. ממשק שטוח מציין silanization האופטימלי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
6. הכנת התקן היניקה שלילית
הערה: בשלב זה, מכשיר יניקה שלילי פשוט מוכן (איור 6) שישמש כדי למלא את האלקטרודה היון ספציפי. שלב זה מתבצע רק פעם אחת.
- צרף מזרק 3 מיליליטר לברזלי 3 דרך עם מנעול luer. בְּהקצה השני של ברזלים, המכיל את הצווארון ושומר מסתובב, בורג במחבר luer הנעילה נקבה עם סוף התיל. לאחר מכן, לצרף צינורות סיליקון, קוטר פנימי 1/16 אינץ 'עם קוטר חיצוני 1/8 אינץ', ועד סוף התיל של המחבר. לאחר מכן, הכנס צינורות פלסטיק עם קוטר פנימי 1/32 אינץ 'וקוטר חיצוני 3/32 אינץ'
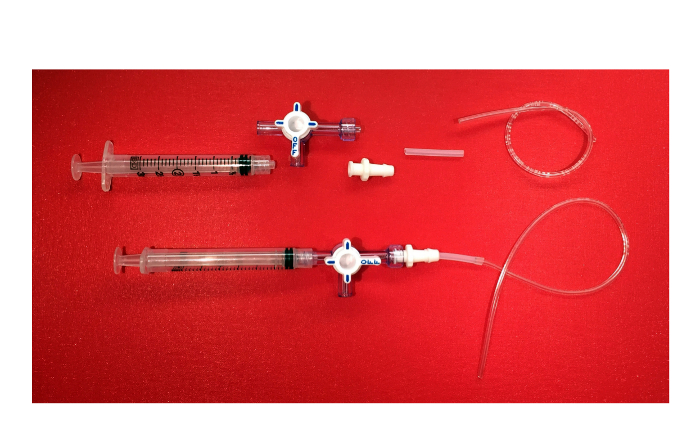
איור 6. מכשיר שאיבה שלילי. תמונה של הרכיבים של מכשיר היניקה השלילי (3 מיליליטר מזרק עם מנעול luer, ברזלים 3-בדרך עם צווארון מסתובב ושומר, מחבר luer נקבת נעילה עם סוף התיל, צינורות סיליקון, צינורות פלסטיק) ו המוצר הסופי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
7. זבובים אסוף לנתיחה < / P>
- להשתמש בטכניקות גידול זבוב סטנדרטיים 25 להקים צלבי זבוב ולשנות במידת הצורך. לדוגמא, שימוש מוגבר טמפרטורה (כגון 28 מעלות צלזיוס) בניסויים שבם פעילות מוגברת GAL4 היא רצויה.
הערה: חשוב שהזבובים לא גדלו בתנאים צפופים יתר על המידה; המספרים של הורי זכר ונקבה צריכים להיות ירידה במקרה זה. אם גנוטיפים שונים משמשים, מספרי הורי זכר ונקבה צריכים להיות מותאמים להשגת מספר כ דומה של צאצאים. - לאסוף זבובים לנתיחה (שלב 11) תוך שימוש בטכניקות גידול זבוב סטנדרטי 25 בתוך 1 - 2 ימי eclosion. קשיות מזבובים נשיים יותר בקלות גזור, אלא גם tubules מזבובי זכרים יכול לשמש במידת צורך או רצוי. מקום עף לתוך בקבוקון המכיל מזון זבוב. מניחים צלוחיות בטמפרטורה הרצויה במשך 3 - 5 ימים לפני לנתיחה.
8. מילוי אלקטרודה יון-הספציפית (ISE)
e_content "> הערה:.. בשלב זה, ISE הוא backfilled עם תמיסת מלח ולאחר מכן ionophore הוא הציג לתוך הקצה ISE יכול להיות שימוש חוזר מיום ליום, כל עוד זה עובד היטב לכן, בשלב זה הוא ביצע כל כמה ימים לפי צורך.- כדי להפוך אלקטרודה -specific K +, לגבות pipet silanized עם 0.5 M KCl באמצעות מזרק 1 מיליליטר וmicrofilament (סיבים מיקרוסקופים שימוש חוזר מניסוי לניסוי). ודא כי פתרון המילוי ממלא את קצה קצו של pipet - אין אוויר בקצה. אם לא בטוח, לדמיין תחת מיקרוסקופ מתחם. לסלק בועות אוויר בעדינות על ידי מצליף את pipet.
- לאלקטרודה -specific Na +, לגבות עם 150 מ"מ NaCl.
- הכנס את הקצה האחורי של ISE לתוך צינורות הפלסטיק של מכשיר היניקה השלילי מוכן בשלב 6. במכסת המנוע, למקם את ISE על צלחת הפוכה פלסטיק 3.5 סנטימטר פטרי עם חתיכת פלסטלינה כדי לאבטח במקום.
- צור עמ 'השליליressure באמצעות מכשיר היניקה. לצייר את בוכנה עם "את" של ידית ברזלים מצביעה לכיוון הנמל בצד. הסכום של הציור בחזרה ישתנה אבל היא בדרך כלל בטווח של 0.6-0.7 מיליליטר. לאחר מכן הפעל את ידית ברזלים כך "את" הוא מצביע לכיוון הצינור.
- בשכונה ושימוש בציוד מגן אישי מתאים, לטבול 1 - קצה pipet μl 10 לפתרון ionophore (זהירות: רעילה ראה גיליון בטיחות חומר לאחסון בטוח והוראות טיפול.). לגרש טיפה קטנה על ידי הצבת אצבע עטויה בכפפה על הפתיחה הגדולה יותר של קצה pipet. לאחר מכן, לגעת בירידה של ionophore לקצה של ISE, בלי לגעת בקצה ISE עם קצה pipet כדי למנוע שבירת קצה ISE.
- השתמש בionophore אשלגן מופיע בלוח חומרים "כמות שהוא". כדי להכין את ionophore נתרן, להפוך את פתרון של (ב% w / w) 10% -butylcalix [4] tetraethylester חומצת arene-tetraacetic 4 טרט, 89.75% אתר octyl nitrophenyl, ושל 0.25% borate tetraphenyl נתרן (זהירות:. רעיל ראו גיליון בטיחות חומר לאחסון בטוח והוראות טיפול). חנות בבקבוקון זכוכית העטופה בנייר כסף כדי להגן מפני אור.
- בדוק את ISE תחת 40X הגדלה באמצעות מיקרוסקופ מתחם כדי לקבוע אם ionophore היה "לקח את" לתוך קצה ISE והאם ממשק פתרון ionophore / מילוי הוא שטוח (ראה שלב 5.10.1 ואיור 5 ג).
- אם לא ionophore נלקח למעלה, להגדיל את כמות הלחץ שלילי שנוצר על ידי מכשיר היניקה. אם זה לא מצליח, את האלקטרודה ייתכן שsilanized כהלכה. חזור על שלב 5 תוך שימוש בכמות גדולה יותר של dichlorodimethylsilane.
- מניחים את ISE, להטות כלפי מטה, על הקיר של כוס מלאה באופן חלקי עם 150 מ"מ KCl. Secure ISE על ידי הצבת פלסטלינה על הצד של הכוס. טיפ נמצא בתוך 150 מ"מ KCl. תמשיך להשתמש בOV ISEאה ימים מרובים, כל עוד זה עובד היטב (ראו שלב 10.6).
- לNa + ISE, לאחסן את האלקטרודה ב150 מ"מ NaCl.
9. מכין את האלקטרודה ההתייחסות
הערה: שלבי 9.1-9.3 יכולים להתבצע מראש. צעדים 9.4-9.6 מבוצעים בכל יום ניסיוני.
- להבה-פולני הקצוות של 10 צינורות filamented נימי הזכוכית בורוסיליקט (מ"מ קוטר 1.2 חיצוני, מ"מ קוטר 0.69 פנימי, אורך 10 סנטימטרים) מעל להבה נמוכה, תוך שימוש באמצעי בטיחות.
- על חולץ pipet, למשוך pipets לקוטר קצה ~ 1 - 2 מיקרומטר.
- pipets חנות בצנצנת אחסון pipet עד לשימוש. ניתן לאחסן pipets ללא הגבלת זמן.
- ביום של הניסוי, באמצעות microfilament ומזרק, למלא את הקצה ושוק של pipet עם נתרן אצטט 1 M. ודא שאין בועות אוויר ופתרון שהולך עד לקצה. בעדינות קפיצית pipet אם בועות אוויר נוכחים.
- שימוש שניmicrofilament ומזרק, לגבות pipet עם 3 M KCl. שוב, להבטיח בועות אוויר אינן נוכחים.
- אחסן את האלקטרודה ההתייחסות בכוס המכילה 150 מ"מ KCl (ראה שלב 8.6).
10. כיול של ISE
הערה: שלב זה מתבצע שלוש פעמים ביום הניסוי: בתחילת היום כדי לוודא ISE עובד, ולאחר מכן לפני ואחרי מדידות של 20 - 25 טיפות המופרשים נוזל (לוח 3).
- לכיול של אשלגן ISE, הנח שני 0.6 μl טיפות כל אחד מארבעה הריכוזים של KCl הבאים על 3.5 פטרי צלחת סיליקון המצופה אלסטומר סנטימטר (מוכנה בשלב 1): 15 מ"מ, 75 מ"מ, 150 מ"מ ו -200 מ"מ. שכבה בזהירות 2 מיליליטר של שמן מינרלים על הטיפות.
- לנתרן ISE, להשתמש בטיפי כיול של 15 מ"מ ו- 150 מ"מ NaCl.
- מניחים את צלחת הכיול על הבמה של סטראו בכלוב פאראדיי ולהאיר.
- Thre מודעת האלקטרודה ISE והתייחסות על חוטי הכסף ולהדק למחזיקי microelectrode.
- שימוש micromanipulators, לקדם את ISE ואלקטרודות התייחסות לירידה של 15 מ"מ KCl.
- לעבור אלקטרומטר ל" פועל "מצב. לאפשר קריאה להתיישב.
- שיא קריאה במחברת. חזור עם 75 מ"מ, 150 מ"מ ו -200 מ"מ טיפות. חישוב שיפוע כדי לקבוע אם ISE עובד היטב (ראה שלב 13.1 וטבלה 3). אם לא, להכין ISE חדש.
הערה: סימנים שISE לא עובד טוב: כישלון כדי לקבל קריאה; איטי לאזן (כמה שניות או יותר); קריאה לא יציבה; מדרון <49 שינוי / עשירון mV בריכוז K + או Na +. - בין הכיול הראשון של היום והמדידות שבוצעו בשלב 12, כלומר בזמן ההופעה של צעד 11 (ניתוחי אבובית), לאחסן ISE ואלקטרודות התייחסות ב150 מ"מ KCl (כמתואר בשלב 8.6).
> 11. אבובית Dissection
הערה: שלב זה מתבצע ביום הניסוי.
- Aliquot את כמות קטנה (~ 500-600 μl) של מדיום רחצה הסטנדרטי (SBM), מוכנה בשלב 4.2, לשימוש ביום של ניסוי ולאפשר כדי לחמם לRT. זה צריך להיעשות לפחות 30 דקות לפני ניתוחים, אבל יכול להיעשות גם קודם לכן. כמו כן, יש להם לפחות 20 מיליליטר של תמיסת מלח RT דרוזופילה (שלב 4.1) זמין לפני תחילת ניתוחים.
- מייד לפני תחילת ניתוחים: להציג את צלחת assay בהגדלה 10x תחת סטראו ולהוסיף מספיק SBM כמעט למלא היטב כל בצלחת assay, בדרך כלל בין 10 ל -30 μl. אם תרופות או הפפטיד הולכים להתווסף לSBM אמצע ניסוי-, רשום היקף SBM המדויק הוסיף לכל אחד. הימנע גם זה יכול להוביל לאבובית צף משם במהלך הניסוי מילוי מעל.
- שכבה בזהירות ~ 12 - 13 מיליליטר של שמן מינרלים על גבי כך שהבארותמחדש מכוסה. זה ימנע אידוי של טיפות נוזל המופרשים במהלך הניסוי.
- מקום הזבובים להיות גזור בCO 2 כרית.
- להרים זבוב באמצעות הרגל או הזרוע שלה עם מלקחיים ומניחים על הגב שלה (צד הגחון למעלה) על הצלחת לנתח מצופה סיליקון אלסטומר מוכן בשלב 1. לדקור בית החזה עם סיכת Minutien כדי לאבטח את הזבוב במקום.
- הוסף טיפה של תמיסת מלח RT דרוזופילה (שלב 4.1) לטבול את הזבוב במלח.
- אופציונאלי: קליפ את כנפיים ורגליים. בפועל, זה בדרך כלל לא נחוץ.
- השתמש במלקחי היד הלא הדומיננטיים "להחזיק" הבטן של הזבוב בצומת thoraco-בטן. השתמש במלקחי היד הדומיננטיים לקלף ציפורן בטן משם, מתחיל בצומת thoraco-הבטן ומרגשת לקראת סוף הזנב של הזבוב. הבטן, עם צינוריות Malpighian מצורפים, צריכה להיות חשופה עם תמרון זה.
- בלי לגעת בצינוריות, לנתח בחינם midgut /המעי האחורי וtubules המצורף. החזק את הבטן במלקחי היד הלא הדומיננטיים ולהשתמש במחט 30 G לנתק השופכן מהבטן, ניתוק הצינוריות מהבטן והחופשית מfly.It חיונית שאין דמעות או דמי שכירות יוכנסו לאבובית, אחר מאשר בשופכן.
הערה: הצמד הקדמי של tubules הוא גזור בקלות, עם זאת tubules האחורי עשוי לשמש גם כן. - באמצעות מוט הזכוכית הדק (שלב 2), להרים את זוג אבובית ולהעביר לתוך באר של צלחת assay.
- מייד לאחר זוג אבובית הועבר לתוך הבאר, להרים את קצו של אחד מהצינוריות עם מוט הזכוכית, לסגת מירידת הרחצה עד לסוף החתך של השופכן הוא באמצע הדרך בין הסיכה וירידת הרחצה, ולעטוף סוף אבובית סביב הסיכה באמצעות מוט הזכוכית. בסופו של תמרון זה, אבובית אחד נשארת בירידת רחצה מלוחה ולהפריש נוזל מקצה החתך של השופכן, כפי שמודגם באיור 1 strong>. אבובית האחרות, שכותרתו "אבובית העוגן" באיור 1, עוטפת את הסיכה. זה מעגן את אבובית מפריש במקום, מוקפת בשמן, ולא להפריש נוזל.
- מייד לאחר צעד 11.11, לרשום גם (לדוגמא, A, B, C), מידע אבובית זיהוי (למשל., גנוטיפ או מצב), והזמן (זה הזמן להתחיל כאשר הנוזל יתחיל להיות מופרש על ידי אבובית בטיפה של ים מלוח).
- להמשיך בנתיחה הבאה. ברגע שהנסיין הוא מיומן בטכניקה זו, זה בדרך כלל לוקח 3-4 דקות כדי לנתח זוג הצינוריות, להעביר אותם לתמיסת מלח הים, ולעטוף את אבובית העוגן סביב הפין. לכן, 20 - ניתן להגדיר 25 tubules בassay רמזי בתוך 1.5 שעות. שעת ההתחלה של כל אבובית לכן תהיה על 3 - 4 דקות לאחר שעת ההתחלה של אבובית הקודמת.
12. מדידות ביצוע
> הערה: שלב זה מתבצע ביום הניסוי.
- כייל את ISE (שלב 10) כ 20 דקות לפני המדידה הראשונה. זה מאפשר זמן לעשות ISE חדש במידת הצורך.
הערה: בזמן הרצוי, לדוגמא לאחר 2 שעות של הפרשה, ירידת הנוזל המופרשת מכל אבובית מוכנה למדידה. - רשום את הזמן של מדידה. מדוד את הקוטר של טיפת הנוזל המופרשת באמצעות מיקרומטר והשיא העיני. שים לב להגדלה, למשל, 50X.
- לקדם את ISE ואלקטרודה התייחסות לירידת הנוזל. לעבור אלקטרומטר ל" לפעול. "אפשר לקרוא לייצוב. רשום את הערך.
- חזור לירידה הבאה.
- בסוף הניסוי, לחזור על מדידות כיול (שלב 10).
13. חישובים
הערה: ניתן לבצע צעד זה גם בסופו של יום הניסוי, או במועד מאוחר יותר.
- לחשב את הממוצעמדרון / שינוי עשירון בריכוז אשלגן. ראה טבלה 3 לדוגמא.
הערה: נתרן, הערכים יהיו על ההפרש בין מ"מ 15 ו -150 מדידות מ"מ NaCl. - לקבוע את הערך הממוצע של שתי מדידות (לפני ואחרי) של 200 מ"מ KCl (או 150 מ"מ NaCl).
- לחשב את עוצמת הקול של כל טיפה. V = πd 3/6, כאשר D היא בקוטר של אגל נמדד עם מיקרומטר העיני בצעד 12.2.
- לחשב את שיעור ההפרשה = V / שעה (NL / דקות / אבובית), שבו V הוא הנפח של רביב קבע בשלב 13.3, וזמן הוא משך זמן הנוזל המופרש אבובית (= זמן של מדידה - זמן של השופכן מושך מתוך ים טיפה).
- חשב את ריכוז היון באמצעות הנוסחא [K] = 10E (Δv / S) * 200 או [Na] = 10E (Δv / S) * 150, שבו Δv = ההבדל (בmV) בין הפוטנציאל הנמדד של הנוזל המופרש ירידה, ואת הפוטנציאל של ירידת כיול 200 מ"מ (ואו אשלגן; 150 מ"מ לירידת נתרן). S = המדרון שנקבע בשלב 13.1.
- חישוב שטף יון = [יון] x שיעור הפרשת נוזל. לtubules דרוזופילה, זה יהיה pmol / דקות / אבובית.
14. ניקוי
הערה: שלב זה מתבצע בסופו של יום הניסוי.
- ניקיון יסודי של הבארות הוא חיוני כדי להבטיח כי גבישי מלח שייר לא נשארים בבארות, לשנות את ריכוז היון וosmolarity בניסויים עתידיים.
- לאפשר שמן מינרלים כדי לנקז.
- יש לשטוף את הבארות של המנה assay. טיפ pipet 200 μl יכול לשמש כדי לגרד בעדינות גביש מלח שייר. באמצעות צינורות פלסטיק מחוברים לברז, לסחוט את צינורות כדי ליצור סילון בלחץ גבוה של מים חמים כדי לשטוף ביסודיות כל טוב.
- לאפשר לו להתייבש O / N. לחלופין, מכת מייבש יכול לשמש כדי לייבש את הבארות.
- לשטוף את המלקחיים עם H 2 O וללא יוניםלטבול באתנול במשך 15 דקות לכמה שעות.
- מסננים את שמן של צלחת כיול ולשטוף עם מים חמים. להשתמש בסבון, כמו גם כל עוד הוא לשטוף אותם היטב. לבצע שטיפה הסופית עם H 2 O. מזוקק
- סיבים מיקרוסקופים סומק ומזרקים עם H מזוקק 2 O.
תוצאות
איורים 7 ו -8 להפגין כי שימוש בassay רמזי עם אלקטרודות יון ספציפי למדידת ריכוזי K + וNa + יכול להבחין K גנטי ופרמקולוגית נפרד + והנתיבים Na +, מידע שאינו נתפס על ידי מדידת שיעורי הפרשת נוזל לבד. איור 7 מראה כי ירידה בהפרשת נוזלים בצינורי...
Discussion
השימוש של assay ראמזי, יחד עם אלקטרודות יון ספציפי, מאפשר המדידה של שיעורי הפרשת נוזל והנתיבים יון בMalpighian tubules חרקים מבודדים (כליות). ניתן assayed עשרים או יותר tubules בזמן, המאפשר תפוקה גבוהה יותר בהשוואה לassay של פרט בtubules המבחנה microperfused. בנוסף, אלקטרודות יון ספציפי תאפשר ק...
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved