É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A utilização do Ramsay ensaio para medir secreção de fluidos e Ion Flux Preços no
Neste Artigo
Resumo
Este protocolo descreve a utilização do ensaio de Ramsay para medir as taxas de secreção de fluidos de Malpighi (túbulos renais) isolado a partir de Drosophila melanogaster. Além disso, a utilização de eléctrodos específicos de iões para medir as concentrações de sódio e potássio no líquido segregado, que permite o cálculo do fluxo de iões transepitelial, é descrito.
Resumo
Modulação de transporte iónico epitelial renal permite que os organismos para manter a homeostase iónica e osmótica na face da variação das condições externas. A Drosophila melanogaster Malpighian (renal) túbulo oferece uma oportunidade única para estudar os mecanismos moleculares de transporte de íons epitelial, devido à genética poderosas deste organismo e da acessibilidade dos seus túbulos renais para estudo fisiológico. Aqui, nós descrevemos o uso do ensaio de Ramsay para medir as taxas de secreção de fluidos a partir de isolado de moscas túbulos renais, com a utilização de eléctrodos específicos de iões para medir as concentrações de sódio e potássio em que o fluido segregado. Este ensaio permite o estudo de fluidos e de iões transepitelial fluxos de ~ 20 túbulos de cada vez, sem a necessidade de transferir o fluido segregado a um aparelho separado para medir as concentrações de iões. Túbulos geneticamente distintas podem ser analisados para avaliar o papel de genes específicos em processos de transporte. Além disso, o bathing salina pode ser modificado para analisar os efeitos das suas características químicas, ou drogas ou hormonas acrescentados. Em resumo, esta técnica permite a caracterização molecular dos mecanismos básicos de transporte epitelial de iões no túbulo Drosophila, bem como a regulação destes mecanismos de transporte.
Introdução
Transporte de íons epitelial renal subjacente iono- organismal e osmoregulation. A Drosophila melanogaster Malpighian (renal) túbulo oferece uma oportunidade única para estudar os mecanismos moleculares de transporte de íons epitelial. Isto é devido à combinação dos poderosas da genética de Drosophila, emparelhado com a acessibilidade dos seus túbulos renais para estudo fisiológico. O ensaio de Ramsay, em homenagem ao pesquisador que foi pioneiro na técnica 1, mede as taxas de secreção de fluidos de túbulos de Malpighi isolados, e foi criada em Drosophila em 1994 pela Dow e colegas 2. Isso pavimentou o caminho para novos estudos utilizando Drosophila ferramentas genéticas, tais como o sistema GAL4-UAS 3,4, para definir específico de células vias de sinalização que regulam a secreção de fluidos. Um exemplo inclui a sinalização de cálcio, em resposta a uma hormona peptídica, 5, 6,7, entre muitos outros.
ve_content "> uma combinação de técnicas genéticas e estudo fisiológico clássica demonstrou que a geração de urina na mosca ocorre através da secreção de um líquido rico em cloreto de potássio a partir do segmento principal do túbulo. Isto ocorre através da secreção transepitelial paralelo de catiões, principalmente K + Na +, mas também, através da célula principal, e Cl -. através da secreção de células estreladas 8-12 A capacidade de medir separadamente transepiteliais K + e Na + fluxos permite uma caracterização mais detalhada dos mecanismos de transporte do que a medição da secreção de fluido sozinho. Por exemplo, nos túbulos de Drosophila não estimuladas, a Na + / K + -ATPase ouabaína não tem efeito sobre a secreção de fluido 2, mesmo quando a sua absorção em células principais é inibida pelo inibidor de transportador aniónico taurocolato orgânica 13. No entanto, e Linton O'Donnell mostrou que a ouabaína despolarizao potencial da membrana basolateral, e aumenta o fluxo de Na + 9. Como mostrado nos resultados representativos, nós replicado estes achados, e mostrou que K + fluxo é concomitantemente diminuiu 14; o aumento do fluxo de Na + e diminuição do K + fluxo têm efeitos opostos sobre a secreção de fluido, resultando em nenhuma alteração na secreção de líquido. Assim, existem duas resoluções para o "paradoxo ouabaína," ou seja, a observação inicial de que a ouabaína não tem efeito sobre a secreção de fluido no túbulo Drosophila:. Em primeiro lugar, nos túbulos estimulada, o efeito de ouabaína na secreção de fluido não é aparente devido à sua absorção pelo transportador de aniões orgânicos 13; e, segundo, nos túbulos não estimuladas, ouabaína tem efeitos sobre transepithelial Na + e K + fluxo opostas, resultando em nenhuma alteração líquida na secreção de fluidos (ver resultados representativos e ref. 9). Portanto, o principal papel do Na + / K + -ATPase nos túbulos não estimuladas é o de diminuir a concentração intracelular de Na + para gerar um gradiente de concentração de Na + para o favorável -coupled processos de transporte através da membrana basolateral. Com efeito, medindo em separado de Na + e K + fluxos, nós demonstramos que túbulos que falta o co-transportador de mosca de sódio-potássio-2-cloreto de (CCAN) diminuíram K transepitelial + fluxo, sem diminuição adicional após a adição de ouabaína, e nenhuma alteração em transepitelial Na + fluxo 14. Estes resultados suportada nossa conclusão de que o Na + que entra na célula através da CCAN é reciclado através do Na + / K + -ATPase. Em outro exemplo, Ianowski et al., Observaram que a redução da concentração do banho de K + de 10 mM a 6 mM de K + diminuiu transepitelial fluxo transepitelial e aumentou o fluxo de Na + nos túbulos de Rhodnius prolixus, sem alteração líquida no fluido de secreção 15. Efeitos diferenciais de fluxo de Na + e K + fluxo através dos túbulos de larvas também têm sido observadas em túbulos de Drosophila em resposta a diferentes dietas de sal 16 e em duas espécies de mosquitos em resposta à criação de salinidade 17.O maior desafio na medição de fluxo de iões transepitelial na preparação de ensaio Ramsay é a determinação das concentrações de iões dentro do fluido segregado. Este desafio foi cumprido com soluções diferentes, incluindo photometery chama 18, o uso de íons radioativos 19, e eletrônica sonda comprimento de onda espectroscopia por dispersão de 20. Estas técnicas exigem transferência da gota líquido secretado a um instrumento para a medição de concentrações de íons. Uma vez que o volume de fluido que é segregado pelo túbulo Drosophila não estimulado é pequena, tipicamente ~ 0,5 nl / min, isto representa um desafio técnico e também introduz erro se algum do fluido é segregadaperdeu por ocasião da transferência. Em contraste, a utilização de eléctrodos específicos de iões permite a medição da actividade de iões (a partir do qual a concentração de iões pode ser calculado) in situ. O protocolo corrente foi adaptada da utilizada por Maddrell e colegas para medir transepitelial K + fluxo através do túbulo Rhodnius usando valinomicina como o K + ionóforo 21, e também descreve a utilização de um -butylcalix 4- terc [4] areno-ácido tetraacético tetraetil éster à base de Na + eléctrodo específico de iões espec�ico caracterizado por Messerli et. al. 22. Eletrodos íon-específicas também têm sido usados para medir concentrações de íons no líquido secretado por túbulos de Malpighi no ensaio Ramsay em 9,23 adulto e 16 larval Drosophila melanogaster, a Nova Zelândia Alpine Weta (Hemideina maori) 24 e 17 em mosquitos.
Aqui, descrevemos em detalhes o uso do Ramsay comodizer para medir as taxas de secreção de fluidos em túbulos de Malpighi de Drosophila melanogaster, bem como o uso de eletrodos de íon-específico para determinar as concentrações de K + e Na + dentro do fluido secretado e, portanto, o cálculo dos fluxos de iões transepithelial. Uma visão geral do ensaio é fornecida na Figura 1.

Figura 1. Esquema do Malpighian Palhinha eo Ramsay Ensaio com uso de íon-específicas eletrodos para medir concentrações de iões. Esta figura ilustra a configuração para o ensaio Ramsay. (A) Cada mosca tem quatro túbulos, um par de túbulos anterior e um par de túbulos posteriores, que flutuam na cavidade abdominal cercado por hemolinfa. Em cada par, as duas túbulos juntar-se no ureter, que, em seguida, esvazia-se a urina na junção do intestino médio e hindgut. Os túbulos são cegos-ended. A urina é gerado pelo segmento principal secretor de fluido (representado em vermelho), e flui para fora do ureter e no intestino. Após dissecção, a par dos túbulos é dissociada do intestino, ao seccionar o ureter. (B) A par dos túbulos é então transferida para uma gota de solução salina de banho dentro de uma cavidade do prato de ensaio. Um dos dois túbulos, referido aqui como o "túbulo âncora", é enrolado em torno de um pino de metal e é inerte. A outra é o túbulo túbulo secretora. O segmento inicial (que não secretam fluido) e segmento principal do túbulo segregam permanecer dentro da gotícula de solução salina de banho. Íons e movimento de água da salina de banho e para o lúmen do túbulo do segmento principal, em seguida, avançar em direção ao ureter, como ocorreria in vivo. O segmento inferior (azul) está fora da salina de banho e, portanto, inertes. Uma vez que o ureter é cortado, o fluido segregado surge como uma gota a partir da extremidade de corte do ureter. Tele secretada gota de fluido aumenta ao longo do tempo como a secreção continua, e o seu diâmetro é medido usando um micrómetro ocular. Uma camada de óleo mineral evita a evaporação do fluido que é segregado. Os eletrodos de referência específicas e de iões de medir a concentração de íons do fluido secretado. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
1. Preparar a dissecção, calibração e de ensaio Pratos
Nota: Neste passo, os três pratos de Petri de plástico revestidas com o elastómero de silicone são preparados: um para dissecção, uma para realizar o ensaio de Ramsay ("ensaio de prato"), e uma para realizar a calibração. Estes pratos são re-utilizado de experiência para experiência, e, assim, este passo apenas necessita de ser repetida, se um prato quebras. Uma imagem do prato de ensaio é mostrada na Figura 2.
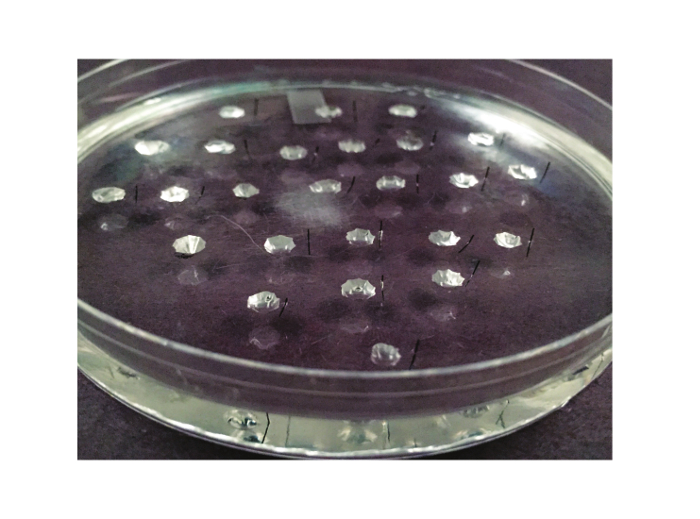
Figura 2. O prato de ensaio. A antena utilizada para o ensaio de Ramsay é mostrada aqui. É uma placa de petri de 10 cm, que é revestida com elastómero de silicone. Entre 20 e 25 poços são esculpidos fora do elastômero. Um pino de metal Minutien, corte ao meio, é colocado à direita de cada poço (ou para a esquerda, se o experimentador é canhoto).TPS: "target =" _ blank //www.jove.com/files/ftp_upload/53144/53144fig2large.jpg "> Clique aqui para ver uma versão maior desta figura.
- Usando luvas, despeje ~ 80 g base de silicone elastômero em um copo de vidro. Adicionar 10/01 peso (8 g) cura elastômero de silicone. Mexa com um agitador de metal. Colocar num agitador orbital com um topo plano a uma velocidade suave, por exemplo, 100 rpm, durante várias horas até que todas as bolhas de ter sido removido.
- Despeje o elastômero de silicone em placas de Petri de plástico limpo: 100 mm x 15 mm para a dissecção e ensaio de pratos, e 35 x 10 mm para o prato de calibração. A espessura da camada de elastómero deve ser ~ 6 - 7 mm para os pratos de 100 mm, e ~ 5 mm para 35 mm a prato.
- Coloque os pratos na bancada à temperatura ambiente (RT) para curar (endurecer), ~ 24-48 h.
- Uma vez que o prato de ensaio tenha curado, preparar um lote menor de elastómero de silicone tal como no passo 1.1, por exemplo., 10 g de silicone de base de elastómero com 1 g de cura. Agitar no orbitalshaker como no passo 1.1 até que as bolhas de ar não estão mais presentes. Este elastómero vai ser utilizado no passo 1.5.4 e não deve ser deixada endurecer antes da referida etapa.
- Usando um bisturi cirúrgico e precauções cortantes standard, fazer poços em um dos 100 mm placas de petri silicone elastômero-revestidos. Este será o prato de ensaio.
- Adicione poços ~ 1 cm de distância e com um diâmetro de ~ 3 - 4 mm. 25 poços pode facilmente caber em um ensaio de 100 milímetros prato. Wells deve ser de pelo menos 6 mm afastada das paredes da cápsula. A Figura 2 ilustra o espaçamento dos poços. Cada poço contém uma túbulo secretoras de fluido durante a experiência. Deste modo, um prato de 25 poços contendo 25 túbulos permitirá a ser analisado.
- Usar um marcador permanente para marcar a posição dos poços, se necessário.
- Faça as paredes do poço o mais suave possível, colocando o bisturi no elastômero, e em seguida, usando a outra mão para girar o prato 360 °.
- Em seguida, usando sha padrão rps precauções, mergulhar uma agulha G 30 para o elastómero não endurecida do passo 1.4 e colocar uma gota pequena no fundo de cada poço. Este suaviza o fundo do poço. Deixar curar (endurecer) x 24-48 h.
- Prepare os pinos Minutien.
- Coloque 0,15 mm preto anodizado pinos Minutien em uma fileira em um pedaço de fita de rotulagem do laboratório padrão de 1 polegada. Eixo longo dos pinos devem ser ortogonal ao eixo longitudinal da fita. Cortar a fita ao longo do seu comprimento, a fim de separar cada um dos pinos em duas metades aproximadamente iguais (Figura 3). Use uma meia-pin para cada poço.

Figura 3. Corte as Minutien Pins. Os pinos são alinhados em um pedaço de fita de rotulagem em paralelo. Em seguida, uma tesoura são usados para cortar os pinos ao meio."target =" _ blank ge.jpg "> Clique aqui para ver uma versão maior desta figura.
- Insira cada meia-pin para a elastômero de silicone aproximadamente 1 mm para a direita de cada poço (se destro, se canhoto, insira o pino à esquerda de cada poço). Isto é feito mais facilmente ao visualizar os poços de baixo poder de dissecação sob um estereomicroscópio e é auxiliado pela utilização de uma pinça sem corte. A figura 2 ilustra o posicionamento dos pinos.
2. Preparar Belas vidro Rods
Nota: Neste passo, uma vareta de vidro é preparado, que será utilizado para transferir os túbulos do prato de dissecação para a gota de banho. A vareta de vidro é re-utilizado de experiência para experiência, de modo que este passo é executado apenas uma vez, a menos que as quebras de haste e um novo é necessária.
- Obter folhas de 3 mm (1/8 de polegada) de espessura coradas vidro preto de uma loja de hobby e vidro apropriado-corte equipamentos, tais como um cortador de vidro e um alicate. Use equipamento de segurança apropriado (luvas grossas, óculos de proteção).
- Cortar o vidro em tiras ~ 6 mm de largura x 10 cm de comprimento
- Mantenha uma tira de vidro em cada mão. Suavizar a extremidade curta de cada tira sobre a chama de um bico de Bunsen, usando precauções de segurança adequadas. Em seguida, empurrar as extremidades das duas faixas em conjunto e separar num movimento suave para criar uma vareta de vidro fino com uma pega.
3. Configuração Fisiologia
Nota: Neste passo, o microscópio, o circuito eléctrico e electrómetro está configurado. À excepção periódica re-chloriding (passo 3.2) dos fios de prata e re-calibração do eletrômetro (passo 3.8), esta etapa é realizada apenas uma vez. A Figura 4 ilustra a configuração.

Figura 4. Configuração Fisiologia. A configuração fisiologia é retratado aqui. (A) Visão geral da configuração. O estereomicroscópio é colocado dentro da gaiola de Faraday, com micromanipuladores em ambos os lados. Uma luz de fibra óptica é enfiada através de um furo no lado da gaiola de Faraday. O eletrômetro é colocado fora da gaiola de Faraday. (B) a cloreto de revestir os fios de prata, o fio é imerso em água sanitária. (C) Close-up da configuração. O titular de microeletrodos em linha reta, mostrado nesta foto, à esquerda, está enroscada na sonda do electrometer. O eletrodo íon-específico será então de rosca sobre o fio de prata no suporte do eletrodo. À direita, o eléctrodo de referência é roscada ao longo do fio de prata do suporte microeléctrodo a 45 °. O circuito deve, então, ser devidamente fundamentada. O prato de ensaio é mostrada uma vez que irá ser posicionado ao efectuar medições. Por favorclique aqui para ver uma versão maior desta figura.
- Coloque o stereomicrosope com micrômetro ocular dentro da gaiola de Faraday. Chão para o interior da gaiola de Faraday, que é então ligada à terra para a terra do chassis do electrómetro. Coloque as micromanipuladores em ambos os lados do microscópio (Figura 4A).
- Cloreto de dois fios de prata por imersão em água sanitária, pelo menos, 1 h. Estender dia para o outro (O / N), se necessário (figura 4B). Repita este passo sempre que os fios de prata precisa ser re-clorada, por exemplo, se eles são cinza na aparência ao invés de preto.
- Tópico um clorada fio de prata em cada um dos titulares de microeletrodos.
- Estabelecer o circuito elétrico com aterramento adequado. Por exemplo, coloque o ventilada, titular de microeletrodos em linha reta, que vai realizar o eletrodo íon-específico (ISE), na sonda electrometer, que é fixado para o micromanipulador (Figura 4C).
- Fixe a ventilado, 45 ° titular de microeletrodos, que realizará o eletrodo de referência, para o outro micromanipulador (Figura 4C). Depois moído para o chão circuito no electrometer.
- Aterrar a "AB out" saída BNC do electrómetro à terra do chassi do electrometer.
- Colocar a fonte de luz de fibra óptica fora da gaiola de Faraday, com o tubo de pescoço de ganso de rosca através de um furo para dentro da gaiola de Faraday (Figura 4A).
- Configurar e calibrar o electrometer de acordo com as instruções do fabricante. Recalibrar o electrometer em uma base regular (a cada 1 - 2 semanas). Uma vez completo, e entre as medidas, deixe o electrometer no modo "standby", com a alternância de posição definido como "IN", defina a entrada do medidor "A" e intervalo definido como "200 mV."
4. Prepare as Soluções de dissecação e banho
- Prepare Drosophila salina como detalhado na Tabela 1. Para o uso em experimentos, derrame ~ 40 ml para um tubo de 50 ml e manter à temperatura ambiente. Descartar se houver evidência de crescimento bacteriano ou fúngico.
- Para preparar o meio de banho normal (SBM), mistura de Drosophila salina 1: 1 com meio de Schneider, e passar através de um filtro de seringa de 0,22? M. Prepara-se pequenas aliquotas (~ 10 - 15 mL), armazenar a 4 ° C e descarte se não há evidência de crescimento bacteriano ou fúngico. Os componentes do meio de Schneider estão listados na Tabela 2.
5. Fazer o eletrodo íon específico-: silanizar Pipetas
Nota: Nesta etapa, diclorodimetilsilano é usado para levemente "silanizar" o eletrodo íon específico. Isto acrescenta um revestimento hidrofóbico para o interior do eléctrodo que lhe permite manter o ionóforo hidrofóbico. Silanização excessiva é evitada para impedir a absorção de óleo mineral ao fazer measurements em gotas sob óleo. Silanizados eletrodos são bons para várias semanas. Portanto, esta etapa é realizada a cada poucas semanas.
- Chama-polonês as extremidades de 5 - 6 unfilamented tubos capilares de vidro de borosilicato (diâmetro externo 1,2 mm, diâmetro interno 0,69 milímetros, comprimento de 10 cm) em fogo baixo, usando as precauções de segurança adequadas.
- Colocar os tubos capilares no fundo de um copo de vidro de 1 L.
- Em um capuz e utilizando equipamento de protecção individual adequado, despeje 70% de ácido nítrico (CUIDADO: inflamável e corrosivo, ver Ficha de Segurança para o armazenamento seguro e instruções de manuseio) nos tubos capilares e deixe de molho por 5 min.
- Despeje o ácido nítrico para trás em um frasco de vidro. Re-uso para posterior lavagem com ácido nítrico.
- Adicionar ~ 200 ml de H2O desionizada ao béquer. Resíduos vazio em um frasco de vidro dedicado para os resíduos de ácido nítrico. Repita com um adicional de 200 ml de H 2 O. deionizada Siga as orientações institucionais para the eliminação segura dos resíduos de ácido.
- Do três lavagens adicionais com grandes volumes de água desionizada. Esvazie em pia.
- Na capa, colocar tubos capilares sobre uma placa quente com o conjunto de topo de cerâmica de 200 ° C e seco por um período mínimo de 20 min, 1 h optimamente. Ele também pode ser deixada para períodos mais longos de tempo.
- Em um puxador de pipeta (Figura 5A), pipetas de puxar para um diâmetro da ponta de ~ 1 - 2 um.
- Coloque pipetas puxado de volta para fogão, tomando cuidado para não quebrar pontas, para, pelo menos, 10 min, 30 min de forma ideal, mas pode ser deixado por mais tempo.
- Adicionar 20 l de diclorodimetilsilano (CUIDADO: inflamável, corrosivo, toxicidade aguda, ver Ficha de Segurança para o armazenamento seguro e instruções de manuseio) em um 15 centímetros petri prato de vidro e inverter prato sobre as pipetas na chapa quente (Figura 5B). Deixe no lugar por pelo menos 20 min, de forma ideal 2 horas. A mesma placa de Petri podem ser re-usado em experiências subsequentes.
- Determine o amou nt de diclorodimetilsilano adicionado por tentativa e erro. Depois é adicionado o ionóforo (passo 8.4), assegurar que a interface entre o ionóforo e a solução de aterro é plana (Figura 5C). Se a interface é côncavo, isto indica excesso de silanização e, em menos de silano deve ser usado. Se a interface é convexa, isto indica sub-silanização, e mais de silano deve ser usado.
Nota: O diclorodimetilsilano tende a ir "fora" ao longo do tempo, ou seja, menos eficaz silanização é conseguido com o mesmo volume de silano.. Neste ponto, tanto novo silano podem ser encomendados, ou a quantidade ajustada para atingir silanização equivalente.
- Determine o amou nt de diclorodimetilsilano adicionado por tentativa e erro. Depois é adicionado o ionóforo (passo 8.4), assegurar que a interface entre o ionóforo e a solução de aterro é plana (Figura 5C). Se a interface é côncavo, isto indica excesso de silanização e, em menos de silano deve ser usado. Se a interface é convexa, isto indica sub-silanização, e mais de silano deve ser usado.
- Desligue placa quente e deixe esfriar. Remover vidro placa de petri e transferir pipets a jarra de armazenamento contendo sílica gel, que mantém a dessecação. Manusear com cuidado pipetas (fórceps votos) para evitar ponta quebrando.
5 "src =" / files / ftp_upload / 53144 / 53144fig5.jpg "/>
Figura 5. silanizar Pipetas. (A) Exemplo de pipeta extrator. (B) Imagem das pipetas puxado na chapa quente. O prato de vidro contendo uma gota de diclorodimetilsilano foi invertido sobre as pipetas puxados. (C) esquemático que ilustra a interface entre o cocktail ionóforo e a solução de aterro. Uma interface plana indica silanização ideal. Por favor clique aqui para ver uma versão maior desta figura.
6. Preparar o dispositivo de sucção negativa
Nota: Neste passo, um dispositivo de sucção negativa simples é preparado (Figura 6) que irá ser utilizado para encher o eléctrodo específico de iões. Este passo é realizado apenas uma vez.
- Anexar uma seringa de 3 ml de uma torneira de 3 vias com bloqueio luer. Àsa extremidade oposta da válvula, contendo o colar rotativo e guarda, do parafuso em um conector de bloqueio Luer fêmea com fim farpado. Em seguida, prenda o tubo de silicone, diâmetro interno de 1/16 polegadas com diâmetro externo de 1/8 de polegada, até o fim farpado do conector. Em seguida, insira tubo de plástico com diâmetro interno de 1/32 polegadas e 3/32 polegadas de diâmetro externo
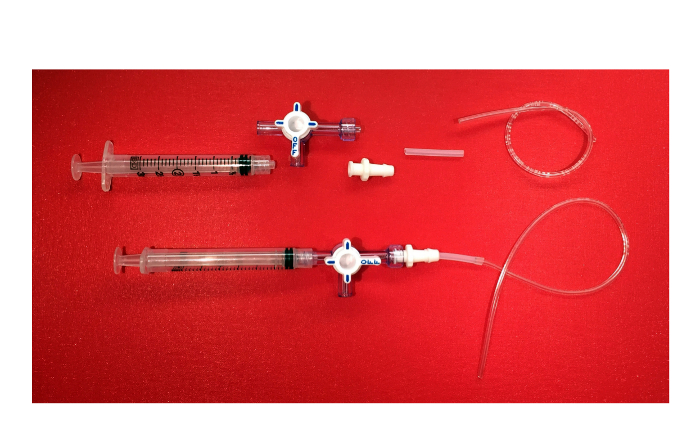
Figura 6. O dispositivo de sucção negativa. Imagem dos componentes do dispositivo de sucção negativa (3 ml com uma seringa luer lock, torneira de passagem de 3 vias com colar rotativo e guarda, do conector de bloqueio Luer fêmea com fim farpado, tubagem de silicone, tubo de plástico) e o produto final. Por favor clique aqui para ver uma versão maior desta figura.
7. Moscas Collect para Dissection < / p>
- Use técnicas de maneio mosca padrão 25 para configurar cruzes mosca e modificar conforme a necessidade. Por exemplo, utilizar o aumento na temperatura (por exemplo, 28 ° C) em experiências onde o aumento da actividade de GAL4 é desejada.
Nota: É importante que as moscas não são criados em condições excessivamente lotados; os números de machos e fêmeas pais devem ser diminuídas, neste caso. Se forem utilizados diferentes genótipos, os números de machos e fêmeas pais devem ser ajustados para obter um número de aproximadamente semelhante da descendência. - Recolha moscas para dissecção (passo 11), utilizando técnicas de maneio mosca padrão 25 dentro de 1 - 2 dias de eclosão. Palhinha de moscas fêmeas são mais facilmente dissecado, mas a partir de túbulos moscas macho também pode ser utilizado, se necessário ou desejado. Lugar voa em um frasco contendo alimentos mosca. Colocar os frascos à temperatura desejada durante 3 - 5 dias antes da dissecção.
8. Encher o eletrodo íon específico do (ISE)
e_content "> Nota:.. Neste passo, o ISE é preenchido com uma solução de sal e, em seguida, o ionóforo é introduzido na ponta O ISE pode ser re-utilizado de dia para dia, enquanto que está a funcionar bem Portanto, este passo é realizada a cada poucos dias conforme necessário.- Para fazer com que um eléctrodo de K + -específica, aterrar uma pipeta silanizada com KCl 0,5 M utilizando uma seringa de 1 ml e microfilamentos (reutilização microfilamentos de experiência para experiência). Certifique-se de que a solução de aterramento enche até a ponta da pipeta - sem ar na ponta. Se não tiver certeza, visualizar em um microscópio composto. Desalojar bolhas de ar sacudindo suavemente a pipeta.
- Para um eléctrodo de espec�ico Na +, aterrar com NaCl 150 mM.
- Insira a extremidade traseira do ISE para o tubo de plástico do dispositivo de sucção negativa preparado na etapa 6. Na capa, coloque o ISE em um plástico de 3,5 centímetros placa de Petri invertida com um pedaço de massa de modelar para assegurar no lugar.
- Gerar negativo pressure utilizando o dispositivo de sucção. Retire-se a seringa com o "fora" da pega torneira apontar na direcção da porta lateral. A quantidade de tiragem de volta irá variar, mas é geralmente na gama de 0,6 - 0,7 ml. Em seguida, gire a manivela torneira de modo que o "off" está apontando na direção da tubulação.
- Na capa e utilizando equipamento de protecção individual adequado, mergulhe um 1 - ul pipeta de ponta na solução ionóforo 10 (ATENÇÃO: tóxico Veja FICHA DE SEGURANÇA para o armazenamento seguro e instruções de manuseio.). Expulsar uma pequena queda, colocando um dedo de luva sobre a abertura maior da ponta da pipeta. Em seguida, toque a gota de ionóforo à ponta do ISE, sem tocar a ponta ISE com a ponta da pipeta para evitar a quebra da ponta ISE.
- Use o ionóforo de potássio listadas na Tabela de Materiais "tal como está". Para preparar o ionóforo de sódio, fazer uma solução de (em% w / w) 10% 4- tert -butylcalix [4] tetraetílico ácido areno-tetra-acético, 890,75% de éter nitrofenil octilo, e 0,25% tetrafenil borato de sódio (ATENÇÃO:. Tóxica Veja FICHA DE SEGURANÇA para o armazenamento seguro e instruções de manuseio). Armazenar num frasco de vidro envolto em folha de a proteger da luz.
- Examinar o ISE sob ampliação de 40X usando um microscópio composto para determinar se o ionóforo foi "elevado" para a ponta da ISE e se a interface de solução de ionóforo / aterro é plana (ver passo 5.10.1 e Figura 5C).
- Se nenhum ionóforo foi levado para cima, aumentar a quantidade de pressão negativa gerada pelo dispositivo de aspiração. Se isso não for bem sucedida, o eletrodo pode ter sido inadequadamente silanizados. Repita o passo 5, utilizando uma quantidade maior de diclorodimetilsilano.
- Coloque a ISE, incline para baixo, sobre a parede de um recipiente parcialmente cheio com KCl 150 mM. Prenda o ISE, colocando massa de modelar para o lado do copo. A ponta encontra-se dentro do KCl 150 mM. Continuar a usar o ov ISEer vários dias, desde que ele está funcionando bem (veja o passo 10.6).
- Para um Na + ISE, guarde o eletrodo em NaCl 150 mM.
9. Prepare o eléctrodo de referência
Nota: Os passos 9.1 - 9.3 pode ser executada antecipadamente. Passos 9,4-9,6 são realizadas a cada dia experimental.
- Chama-polonês as extremidades de 10 tubos capilares de vidro de borosilicato filamentado (diâmetro externo 1,2 mm, diâmetro interno 0,69 milímetros, comprimento de 10 cm) em fogo baixo, usando as precauções de segurança.
- Em um extrator pipeta, puxe pipetas a um diâmetro da ponta de ~ 1-2 mm.
- Loja pipetas em um frasco de armazenamento pipeta até à sua utilização. Pipetas pode ser armazenado indefinidamente.
- No dia da experiência, utilizando uma seringa e microfilamentos, encher a ponta e a haste da pipeta com acetato de sódio 1 M. Garantir que não haja bolhas de ar e que a solução vai para a ponta. Agite suavemente a pipeta se bolhas de ar estão presentes.
- Usando um segundomicrofilament e seringa, aterrar a pipeta com 3 M KCl. Mais uma vez, certifique-se bolhas de ar não estão presentes.
- Armazene o eletrodo de referência em um copo contendo KCl 150 mM (veja o passo 8.6).
10. Calibração do ISE
Nota: Esta etapa é realizada três vezes no dia experiência: no início do dia para garantir que o ISE está trabalhando, e, em seguida, antes e depois de medições dos 20 - 25 gotas líquido secretado (Tabela 3).
- Para a calibração do ISE de potássio, 0,6 ul de colocar duas gotas de cada uma das quatro concentrações de KCl seguintes para a revestido por elastómero 3,5 cm placa de petri de silicone (preparado no passo 1): 15 mm, 75 mm, 150 mm e 200 mm. Camada cuidadosamente 2 ml de óleo mineral sobre as gotas.
- Para ISE de sódio, utilizar gotas de calibração de 15 mM e NaCl 150 mM.
- Colocar a cápsula de calibração para o palco do estereomicroscópio na gaiola de Faraday e iluminar.
- Threanúncio do eléctrodo ISE e de referência sobre os fios de prata e fixar nos suportes de microeletrodos.
- Usando os micromanipuladores, avançar o ISE e eletrodos de referência na gota KCl 15 mM.
- Alterne o electrometer para "operar" mode. Permitir a leitura para resolver.
- Leitura registro no caderno. Repita com a 75 mM, 150 mM e 200 gotas. Calcule inclinação para determinar se ISE está a funcionar bem (veja o passo 13.1 e Tabela 3). Se não, prepare um novo ISE.
Nota: Os sinais de que uma ISE não está funcionando bem: falha para obter uma leitura; lenta para equilibrar (vários segundos ou mais tempo); leitura instável; inclinação <49 mV mudança / decil em K + ou Na + concentração. - Entre a primeira calibração do dia e as medições realizadas na etapa 12, ou seja, durante a execução do passo 11 (dissecções tubulares), armazenar o ISE e eléctrodos de referência em KCl 150 mM (tal como descrito no passo 8.6).
11. Tubule Dissection
Nota: Este passo é executado no dia do experimento.
- Aliquota para fora uma pequena quantidade (~ 500 - 600 uL) de meio de banho normal (SBM), preparado no passo 4.2, para o uso no dia da experiência e deixa-se aquecer até à TA. Isto deve ser feito, pelo menos, 30 min antes da dissecção, mas também pode ser feito antes. Além disso, tem pelo menos 20 ml de solução salina RT Drosophila (passo 4.1) disponível antes de iniciar dissecações.
- Imediatamente antes de se iniciar dissecções: ver o prato de ensaio a ampliação de 10x sob um estereomicroscópio e adicionar SBM quase suficiente para encher cada poço na placa de ensaio, tipicamente entre 10 e 30 ul. Se drogas ou peptídeo vão ser adicionados a SBM meados de experimento, anote o volume exato de SBM adicionado a cada poço. Evitar o excesso de enchimento do poço, pois isso pode levar à túbulo flutuando para longe durante a experiência.
- Camada cuidadosamente ~ 12 - 13 ml de óleo mineral no topo de modo que as cavidades de umrecuperado. Isto irá evitar a evaporação das gotas de fluido que é segregado durante a experiência.
- Lugar voa para ser dissecado em CO 2 pad.
- Pegar uma mosca através da sua perna ou asa com uma pinça e coloque sobre as costas (lado ventral para cima) sobre o prato de dissecação silicone elastômero revestido preparado no passo 1. Para a estaca do tórax com um pino Minutien para garantir a mosca no lugar.
- Adicionar uma gota de solução salina RT Drosophila (passo 4.1), para imergir a mosca em solução salina.
- Opcional: cortaria as asas e pernas. Na prática, isto não é normalmente necessário.
- Use a pinça mão não-dominante para "segurar" abdómen da mosca na junção tóraco-abdominal. Use a pinça mão dominante para descascar a cutícula abdominal distância, a partir da junção tóraco-abdominal e movendo-se em direção ao fim da cauda da mosca. O intestino, com túbulos de Malpighi em anexo, devem ser expostas com esta manobra.
- Sem tocar os túbulos, dissecar livre do intestino médio /intestino grosso e túbulos anexas. Segurar o intestino nos fórceps mão não-dominante e utilizar uma agulha de 30 G para separar o ureter a partir do intestino, destacando os túbulos do intestino e livre do fly.It é essencial que nenhumas lágrimas ou rendas ser introduzido no túbulo, Excepto no ureter.
Nota: O par anterior de túbulos é mais facilmente dissecado, no entanto os túbulos posteriores podem ser usadas também. - Usando o bastão de vidro fino (passo 2), pegar o par túbulo e transferir para um poço do prato ensaio.
- Imediatamente após o par túbulo tenha sido transferida para dentro do poço, escolhe-se a extremidade de um dos túbulos com a vareta de vidro, retirar-se a queda de banho até que a extremidade cortada do ureter é meio caminho entre o pino e a queda de banho, e o envoltório o fim do túbulo em torno do pino, com a vareta de vidro. No final desta manobra, um túbulo permanece em solução salina a gota e o banho secretam fluido a partir da extremidade de corte do ureter, como ilustrado na Figura 1 . A outra túbulo, rotulado de "túbulo âncora" na Figura 1, é enrolada em torno do pino. É a âncora do túbulo secretoras no lugar, está rodeado por óleo, e não secretam fluido.
- Imediatamente após o passo 11,11, anote o bem (por exemplo, A, B, C), túbulo informações de identificação (por ex., O genótipo ou condição), e o tempo (isto é a hora de início quando o líquido começa a ser secretado pelo túbulo na gotícula de solução salina de banho).
- Prossiga com a próxima dissecção. Uma vez que o experimentador é hábil nesta técnica, que normalmente demora 3 - 4 min para dissecar um par de túbulos, transferi-los para a solução salina banho, e enrole o túbulo âncora ao redor do pino. Por conseguinte, 20 - 25 de túbulos pode ser configurado no ensaio de Ramsay dentro de 1,5 horas. A hora de início de cada túbulo será, portanto, de cerca de 3 - 4 minutos após o tempo de início do túbulo anterior.
12. Medidas Factura
Nota: Este passo é realizado no dia do experimento.
- Calibrar o ISE (passo 10), aproximadamente 20 minutos antes da primeira medição. Isso dá tempo para fazer um novo ISE, se necessário.
Nota: Na altura desejada, por exemplo após 2 horas de secreção, segregada a gota de fluido de cada túbulo está pronto para a medição. - Anote o tempo de medição. Meça o diâmetro da gota líquido secretado usando o micrômetro ocular e registro. Note-se a ampliação, por exemplo, 50X.
- Avance o ISE e eletrodo de referência na gota de fluido. Alterne o electrometer para "operar". Permitir que a leitura estabilize. Grave o valor.
- Repita o procedimento para a próxima queda.
- No final da experiência, repetir as medições de calibragem (passo 10).
13. Cálculos
Nota: Esta etapa pode ser realizada quer no final da experiência no dia, ou em um momento posterior.
- Calcular a médiainclinação / decil mudança na concentração de potássio. Consulte a Tabela 3 para obter um exemplo.
Nota: Para sódio, os valores será a diferença entre a 15 mM e 150 mM de NaCl medições. - Determinar o valor médio das duas medidas (antes e depois) de KCl 200 mM (ou 150 mM de NaCl).
- Calcular o volume de cada gotícula. V = πd 3/6, onde d é o diâmetro da gotícula de medida com o micrómetro ocular no passo 12.2.
- Calcula-se a taxa de secreção = V / hora (nl / min / túbulo), em que V é o volume da gotícula determinado no passo 13.3, e o tempo é o período de tempo do túbulo secretada fluido (= tempo de medição - tempo de puxar ureter para fora da gota de banho).
- Calcula-se a concentração de iões utilizando a fórmula [K] = 10E (? V / S) * 200 ou [Na] = 10E (? V / S) * 150, onde? V = a diferença (em mV) entre o potencial medido do líquido segregado gota, e o potencial de a queda de calibração 200 mM (fou de potássio; Gota 150 mM de sódio). S = declive determinado na etapa 13.1.
- Calcular ião fluxo = [ião] x taxa de secreção de fluidos. Para túbulos de Drosophila, este será pmol / min / túbulo.
14. Limpando
Nota: Este passo é realizado no final do dia de experiência.
- A limpeza completa dos poços é essencial para garantir que os cristais de sal residuais não permanecem nos poços, alterando a concentração de íons e osmolaridade em experimentos futuros.
- Permitir que o óleo mineral para drenar.
- Lavar os poços do prato de ensaio. A pipeta de ponta de 200 mL pode ser usado para raspar delicadamente fora cristal de sal residual. Usando tubos de plástico ligado à torneira, espremer o tubo para criar um jato de alta pressão de água quente para lavar cuidadosamente para fora cada poço.
- Deixar secar S / N. Alternativamente, um secador de cabelo pode ser usado para secar os poços.
- Enxaguar com fórceps deionizada H2O eembeber em etanol durante 15 minutos a várias horas.
- Escorra o óleo fora de calibração prato e lavar com água quente. Use sabão, bem como desde que seja completamente enxaguado. Execute o enxágüe final com água destilada H 2 O.
- Microfilamentos flush e seringas com H2O destilada
Resultados
As Figuras 7 e 8 demonstram que a utilização do ensaio de Ramsay com eléctrodos específicos de iões para medir as concentrações de K + e Na + pode distinguir geneticamente e farmacologicamente distintas K + e fluxos de Na +, a informação que não é capturada medindo as taxas de secreção de fluidos sozinho. Figura 7 mostra que a diminuição da secreção de fluido nos túbulos de moscas que transportam uma mutação nula homozigót...
Discussão
A utilização do ensaio de Ramsay, em conjunto com eletrodos íon-específico, permite a medição das taxas de secreção de fluidos e fluxos de iões em insetos isolado Malpighi (renais) túbulos. Vinte ou mais túbulos pode ser ensaiada de cada vez, permitindo que um maior rendimento em comparação com o ensaio in vitro de indivíduo microperfused túbulos. Além disso, os eléctrodos específicos de iões permitir a determinação das concentrações de iões dentro do fluido que é segregado in situ,...
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materiais
| Name | Company | Catalog Number | Comments |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30 G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionophore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Referências
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O'Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O'Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O'Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O'Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O'Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O'Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O'Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados