Method Article
La recuperación de fluorescencia después de combinar una gotita de medir la difusión de dos dimensiones de un fosfolípido monocapa
En este artículo
Resumen
We present a new technique to measure the lateral diffusion of a surface active species at the fluid-fluid interface by merging a droplet monolayer onto a flat monolayer.
Resumen
We introduce a new method to measure the lateral diffusivity of a surfactant monolayer at the fluid-fluid interface, called fluorescence recovery after merging (FRAM). FRAM adopts the same principles as the fluorescence recovery after photobleaching (FRAP) technique, especially for measuring fluorescence recovery after bleaching a specific area, but FRAM uses a drop coalescence instead of photobleaching dye molecules to induce a chemical potential gradient of dye molecules. Our technique has several advantages over FRAP: it only requires a fluorescence microscope rather than a confocal microscope equipped with high power lasers; it is essentially free from the selection of fluorescence dyes; and it has far more freedom to define the measured diffusion area. Furthermore, FRAM potentially provides a route for studying the mixing or inter-diffusion of two different surfactants, when the monolayers at a surface of droplet and at a flat air/water interface are prepared with different species, independently.
Introducción
Los fosfolípidos son componentes principales de las membranas celulares y las membranas de las organelas, y la fluidez de estas capas de membrana a menudo afecta a las funciones celulares mediante la alteración de la actividad de proteínas de membrana 1 - 3. Por ejemplo, la membrana homeostasis de los lípidos se logra mediante la regulación de la fluidez de membrana, que se detecta por las proteínas de membrana, y un nivel anormal de fluidez causa enfermedades graves, como la esteatosis hepática y colestasis 4. Además, la fluidez de una monocapa de fosfolípidos en la interfase líquido-aire alvéolos tiene implicaciones importantes en sus funciones. De alta fluidez de la monocapa de fosfolípido tensioactivo pulmonar facilita la difusión de la capa durante la inhalación, mientras que una fluidez a baja permite que la capa de mantenerse dentro de los alvéolos durante la exhalación 5,6. Por tanto, es importante para estimar la fluidez de las capas de fosfolípidos para entender sus roles.
_content "> A medida directa de la fluidez es la viscosidad, y la viscosidad de las capas de fosfolípidos se ha medido mediante el uso de coloides de tamaño micrométrico 7, agujas magnéticas 8,9, y magnético micro-botones 6,10,11. Sin embargo, estas técnicas se limitan a películas relativamente rígidos, y no se puede medir películas menos viscosos. Para tales casos, la difusividad sería una alternativa para cuantificar la fluidez de las capas de fosfolípidos. Durante varias décadas, una variedad de técnicas para medir las propiedades de difusión de las capas de fosfolípidos se han desarrollado, tal como el método de fluorescencia de temple 12, gradiente de campo pulsado NMR 13, y la espectroscopia de correlación de fluorescencia (FCS) 14. Uno de los métodos más representativa es la recuperación después de fluorescencia photobleaching (FRAP) 15,16. Debido a la simplicidad del procedimiento de medición y relacionados teorías, varios estudios sobre las propiedades de difusión de las capas de fosfolípidos se han realizado utilizando FRAP 17-19. Sin embargo, FRAP por lo general requiere una configuración de microscopio confocal caro con un láser de alta potencia.A continuación, presentamos una nueva técnica para medir la difusión lateral de monocapas de fosfolípidos, denominado como la recuperación de fluorescencia después de la fusión (FRAM). La diferencia clave entre FRAP y FRAM es que la etapa fotoblanqueo se sustituye por la coalescencia gota. La fusión de una gotita cubierto por monocapa no de fluorescencia en una monocapa plana marcada con fluorescencia deja una mancha oscura circular sobre una monocapa plana brillante, estableciendo así el mismo estado inicial con el paso fotoblanqueo. Luego observamos la recuperación de la fluorescencia en la mancha oscura con tiempo para medir la difusividad lateral. Este nuevo "blanqueo" paso a la coalescencia gota ofrece ventajas significativas sobre FRAP: FRAM sólo requiere un microscopio de fluorescencia en lugar de un microscopio confocal caro con un láser de alta potencia que es necesario para FRAP. yon Además, FRAM tiene una amplia selección de colorantes fluorescentes ya que no involucra el proceso fotoblanqueo. Finalmente, las dos monocapas diferentes, una monocapa de las gotitas y una monocapa plana, se pueden preparar de forma independiente, permitiendo así la interdifusión a medir, mientras que sólo el FRAP mide la auto-difusión de monocapas.
FRAM ofrece una amplia gama de mediciones de difusión de materiales altamente viscosos a materiales casi no viscosos. En principio, FRAM puede medir la difusividad máximo de 10 6 m 2 / seg, que es comparable a las técnicas existentes, cuando la difusión se produce a través del área 100 micras por 100 micras durante el tiempo para el proceso de coalescencia gota (~ 10 mseg). Además, el proceso de difusión lenta se puede medir fácilmente a menos monocapas son sólidos. FRAM se puede utilizar para cualquier tipo de materiales activos de superficie, siempre y cuando las moléculas etiquetadas con fluorescencia apropiados están disponibles.
Protocolo
Precaución: Consulte las hojas de datos de seguridad (MSDS) antes de su uso de acetona y cloroformo que son cancerígenos.
1. Preparación de fosfolípidos monocapa en una interfaz plana Aire agua
- Formación de una monocapa de fosfolípido
- Preparación de una solución de fosfolípidos
- Limpiar un vial de 4 ml con un tapón recubierto de politetrafluoroetileno usando acetona, etanol, y agua desionizada al menos tres veces, y soplar gas nitrógeno a fondo en el vial para deshacerse de agua.
- Disolver 1 mg de fosfolípido (por ejemplo, dioleoilfosfatidilcolina, DOPC) a 1 ml de cloroformo en el vial para obtener 1 mg / ml de concentración. Realice este procedimiento en una campana extractora para la seguridad. Usar concentraciones más bajas o más altas de solución de fosfolípido si es necesario.
- Añadir colorante etiquetada fosfolípidos (por ejemplo, dipalmitoilfosfatidiletanolamina rodamina, rodamina DPPE) con menos de 1% en moles del fosfolípido Solución, con el fin de visualizar la monocapa de fosfolípido con un microscopio de fluorescencia. Realice este procedimiento en una campana extractora para la seguridad.
- Envuelva el vial con una cinta de politetrafluoroetileno para evitar la evaporación del disolvente, y almacenar la muestra en un congelador a -20 ° C.
- La deposición de fosfolípidos en la interfase aire-agua
- Limpiar una placa de Petri (55 mm de diámetro y 12 mm de altura) con etanol, y agua desionizada al menos tres veces.
- Llene la placa de Petri con 10 ml de agua desionizada para crear una interfaz aire-agua.
- Spread pocos microlitros de la solución de fosfolípido con una micro-jeringa sobre una interfaz limpia para alcanzar la presión de superficie deseada y esperar durante al menos 30 min para evaporar el disolvente completamente, antes de hacer el experimento.
Nota: Un canal Langmuir se puede utilizar en lugar de una placa de Petri si es necesario un control preciso de la presión de superficie.
- Preparación de una solución de fosfolípidos
- Sumedición de la presión rface
- Medir la presión en la superficie de la monocapa de fosfolípidos con una placa de Wilhelmy tensiómetro. Espere al menos 30 minutos para conseguir el papel de filtro humedecido suficiente si el papel filtro se utiliza como una placa de Wilhelmy. El protocolo detallado está disponible en Kuhn et al. 20.
- Ajustar la cantidad depositada del fosfolípido para controlar la presión de la superficie con precisión. Añadir 4 l de la solución DOPC (1 mg / ml) en el 30,25 cm 2 -Superficie de la interfaz si ~ 5 mN / m de la presión superficial se requiere.
Nota: Si el papel de filtro no está completamente humedecida, presión superficial cambia dramáticamente durante la primera 30 min del experimento debido al cambio de peso del papel de filtro.
- Minimización del flujo convectivo de la monocapa
- Utilice un aparato en forma de cono que contiene un depósito de 3 mm con dos canales delgados, conectado a una sección grande de la placa de Petri, para suprimir el flujo convectivo dela monocapa, lo cual puede perturbar de imágenes morfología y medición de la presión superficial.
- Asegúrese de hacer coincidir los niveles de agua entre el interior y el exterior del aparato de cono forma de garantizar que los fosfolípidos se mueven libremente por toda la región antes de depositar los fosfolípidos en la interfase aire-agua.
2. Preparación de fosfolípido monocapa en la superficie curvada de un droplet
- Proceso se estrecha de un capilar de vidrio utilizando extractor micropipeta
- Coloque un capilar de vidrio (desde 1 mm, Identificación del 0,78 mm, longitud 100 mm) sobre un soporte capilar de un extractor de micropipeta.
- Diseñar un programa para tirar de los capilares con valores de parámetros adecuados (calor: Rampa, Pull: 60, Vel: 70, Delay: 70 y Presión 200) y tire de los capilares con el programa diseñado de acuerdo con el protocolo del fabricante.
Nota: Un capilar termina con unos pocos micrómetros de diámetro es necesario para formar un 100 micras-gotita por Applying una presión con ~ 10 kPa. Si el extremo de la punta del capilar es demasiado pequeño, la presión mucho más alta,> 600 kPa, que se requiere para obtener la gota, mientras que es difícil controlar el tamaño de las gotitas con un extremo demasiado grande punta capilar.
- La absorción de los fosfolípidos sobre la superficie de la gotita
Nota: Para formar una monocapa de fosfolípidos en la interfase curvada de una gota, una solución de fosfolípido sin colorante etiquetada fosfolípidos se utiliza para obtener un contraste de intensidad, en contra de la monocapa plana, preparado por el procedimiento 1. Además, ambos procedimientos 2.2.1 y 2.2 0.2 son permitidos aquí. Si es necesario un control preciso de la presión superficial en la superficie de las gotas, es muy recomendable procedimiento 2.2.2. Sin embargo, si no, 2.2.1 procedimiento, que es una forma mucho más fácil que el procedimiento 2.2.2, es útil.- Proceso de fosfolípidos de recubrimiento a un extremo de punta
- Limpiar un portaobjetos de vidrio usando acetona, etanol, y agua desionizada al menos tres veces.
- Plas del capilar cónico sobre un portaobjetos de vidrio limpio, e incline el capilar para facilitar tocar el cristal deslizante con un extremo de la punta.
- Caer algunas gotas de solución de fosfolípido (1 mg / ml) en el extremo de la punta de un capilar que se adhiere a la lámina de vidrio usando una jeringa de vidrio, y esperar al menos 30 min para evaporar el disolvente completamente.
Nota: Se recomienda para adherir el extremo de la punta del capilar al portaobjetos de vidrio durante el procedimiento de 2.2.1.3 ya que el perímetro del extremo de la punta es demasiado pequeño para contener la gota de los fosfolípidos en el extremo de la punta solamente por la fuerza capilar.
- Preparación de una solución de vesículas
- Limpiar un vial y eliminar el agua del vial, como se introdujo en el procedimiento 1.1.1.1.
- Secar un volumen de 2 ml de la solución de fosfolípido (1 mg / ml) mediante la aplicación de gas nitrógeno suavemente, y desecar el vial durante 1 hora a temperatura ambiente para eliminar cualquier disolvente restante. Realice este procedimiento en una campana extractora para la seguridad.
- Añadir 2ml de agua desionizada en el vial que contiene lípidos se secó, y se incuba el vial en un horno a 60 ° C durante 1 hr.
- Agitar el frasco varias veces, y sonicado (HF-frecuencia: hasta 40 kHz, Potencia: 370 W) durante 30 minutos para obtener vesículas.
- Realizar procesos de extrusión y congelación-descongelación para obtener vesículas unilamelares monodispersas. El protocolo detallado para la preparación de vesículas se describe en Mayer et al., 21.
Nota: la presión en superficie de la interfaz de la gotita se controla con precisión mediante el ajuste del tiempo de espera después de la formación de la gotita que contiene vesículas unilamelares monodispersas. Utilizando un método de gota colgante 22, es necesario medir el cambio de presión superficial en función del tiempo, antes de hacer el experimento.
- Proceso de fosfolípidos de recubrimiento a un extremo de punta
- La formación de una gotita que contiene una monocapa de fosfolípidos en la superficie curvada
- Rellene el capilar cónico con 10 l de agua desionizada de procedure 2.2.1. Alternativamente, utilizar 10 l de la solución de la vesícula de procedimiento 2.2.2.
- Conectar el capilar a un micro-inyector automatizado para proporcionar la presión para formar la gotita.
- Montar el capilar que está conectado a un micro-inyector a un micromanipulador para controlar la posición del capilar con precisión.
- Preparar un microscopio de campo brillante (Microscopio 1, lente del objetivo: 10x NA 0,3) para obtener imágenes de la vista lateral del capilar con una cámara CCD. Microscopio 1 por lo tanto permite observar la posición precisa de la gotita lo largo del eje z y estimar el tamaño de la gotita.
- Mueva el extremo de la punta a una posición donde la vista lateral del extremo de la punta está bien visualizado por Microscopio 1 usando un micromanipulador, y aplicar una presión variable (~ 100 hPa) con el extremo de la punta del capilar, hasta un tamaño apropiado (~ 100 se forma micras de diámetro) de la gotita.
Nota: Se recomienda que automatizada micro-inyector y micromanipulador ser usod, si es necesario un control fino del tamaño de las gotitas y la ubicación de la gotita. También es posible utilizar los manuales.
3. Imágenes de fluorescencia de recuperación después de la fusión de la gotita
Nota: Los principios fundamentales de este protocolo son idénticos a los de la técnica de FRAP, excepto para el proceso de coalescencia de la gota. El Protocolo y relacionados teorías detalladas del FRAP están disponibles en A. López et al. 15 y D. Axelrod et al. 16.
- Monitoreo y control de la ubicación de la gotita
- Preparar un microscopio invertido set (Microscopio 2, lente objetivo: 10X NA 0.3, lente del tubo: longitud focal de 17 cm) que permite tanto un microscopio de fluorescencia con un conjunto de filtro adecuado para Rodamina-DPPES (excitación a 560 nm, emisión a 583 nm) y un microscopio de campo claro. Utilice una cámara CCD aquí para la visualización de las vistas desde arriba de la gotita con un microscopio de fluorescencia moda y un modo de microscopio de campo claro.
- Mover la gotita revestido con un fosfolípido a una interfase aire-agua plana a lo largo del eje z, pero no fusionar la gota, sin embargo, utilizando el micromanipulador. Utilice Microscopio 1 para visualizar la vista lateral de la gotita.
- Ubicar la gotita en el centro de la vista superior de la monocapa plana, utilizando el micromanipulador. Utilice el modo de microscopio de campo brillante del microscopio 2 para visualizar la vista superior de monocapa plana.
- La fusión de la gota en la interfase aire-agua plana
- Mover la gotita más hacia la interfaz plana hasta que la gotita se funde en la interfaz, utilizando el micromanipulador. Si el proceso de fusión se realiza con éxito, una región oscura con una forma circular que está rodeado por un fondo blanco, se observa utilizando el modo de fluorescencia de microscopio 2.
- Registre la serie de imágenes fluorescentes de acuerdo con el tiempo después de la fusión de la gota, usando el modo de fluorescencia de Microshacer frente 2. Utilice una velocidad de fotogramas más rápido que la escala de tiempo de difusión de la monocapa aquí. En DOPC monocapa, toma unos minutos para difundir en el área de 200 m-oscuro por completo.
4. Determinar el coeficiente de difusión por análisis de imagen
Nota: Para determinar el coeficiente de difusión de una serie de imágenes, programa personalizado para el análisis de imagen se construye como se describe a continuación. Un código fuente detallada de este programa está disponible en el sitio web Jove.
- La detección de una región circular de interés
- Detección del centro de la región de interés
- Obtener una serie de imágenes fluorescentes que se han registrado durante un proceso de recuperación que contiene un área oscura circular y un fondo blanco, y establecer la primera imagen de la serie como una imagen de referencia. Aquí, R D es el radio de la zona oscura en una imagen de referencia.
- Convolute la imagen de referencia con un círculo blanco queSE intensidad es uniforme sobre toda una región. Utilice la función incrustada llamado 'CONV2' de convolución como se muestra en el código fuente de la línea de programa personalizado 124. En este caso, el radio del círculo blanco es ligeramente menor que R D.
- Encuentre una posición que indica un valor mínimo en el cálculo de convolución, y fijar esta posición como el centro de la región de interés en la imagen de referencia.
- La determinación de un radio de la región de interés
- Convolute la imagen de referencia con un círculo blanco que contiene una posición central, determinado por un procedimiento de 4,1 y la intensidad uniforme sobre toda una región. Aquí, R S es el radio del círculo blanco. Utilice iteración como 'de' o 'mientras que' con la ecuación de un círculo para que el círculo blanco como se muestra en el código fuente de la línea de programa personalizado 102-109.
- Convolute la imagen de referencia con otro círculo blanco que tiene un pocoradio mayor (5% -10%), R L, R de S. Utilice mismo método con el procedimiento de 4.1.2.1 para hacer el círculo, como se muestra en el código fuente de la línea de programa personalizado 113 a 120.
- Obtenga la diferencia de valor entre los dos cálculos de convolución de 4.1.2.1 y 4.1.2.2.
- Repita el procedimiento anterior de R S = R D / 2 a R S = 2R D, aumentando tanto el R S y R L con un nivel de píxel. Hacer una iteración que contiene los códigos fuente enteros de procedimiento 4.1.2.1 a 4.1.2.3 repetir.
- Encuentra el radio R S que indica la máxima diferencia de valor entre los dos cálculos de convolución. Utilice la función incrustada llamado 'max' para encontrar el radio indica la máxima diferencia en el valor que se muestra en el código fuente de la línea de programa personalizado 148 a 149. Esto R S por lo tanto indica el radio de la zona oscura en la imagen de referencia.
- Detección del centro de la región de interés
- Cálculo de una intensidad fraccional
- Establecer un círculo que contiene una posición central y un radio, determinado por el procedimiento de 4.1 como una región de interés.
- Calcular las intensidades medias de la región de interés en una serie de imágenes de fluorescencia en función del tiempo. Convolute cada cuadro con la región de interés y se divide por el área de la región de interés para calcular la intensidad media. Los detalles están disponibles en el código fuente del programa personalizado que está disponible en el sitio web Jove.
- Calcular una intensidad fraccional, definida como la siguiente ecuación, donde F (t) es la intensidad promedio en el círculo que es una región de interés en función del tiempo, F i es la intensidad inicial en el círculo, y F o es la intensidad de un fondo blanco.
f (t) = (F (t) - F i) / (F o - F i) (Ecuación 1).
- Montaje de la fintensidad ractional a la teoría FRAP
- Ajustar la intensidad fraccional con la siguiente ecuación, donde τ es un tiempo de difusión característico y I 0, 1 I se modifican las funciones de Bessel, usando un programa de ajuste, y obtener τ
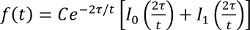 (Ecuación 2).
(Ecuación 2). - Obtener un coeficiente de difusión basado en la relación, τ = a 2/4 D, donde D es el coeficiente de difusión y a es el radio de la zona oscura.
Nota: Durante el proceso de adaptación, es posible cambiar el perfil de intensidad fraccionada a lo largo de un eje de tiempo cuando el proceso de recuperación ya ha comenzado, antes de grabar las imágenes.
- Ajustar la intensidad fraccional con la siguiente ecuación, donde τ es un tiempo de difusión característico y I 0, 1 I se modifican las funciones de Bessel, usando un programa de ajuste, y obtener τ
Resultados
Una serie de imágenes de fluorescencia se obtuvieron con el tiempo durante el proceso de recuperación después de la fusión de una gotita recubierto con una monocapa DOPC sobre una monocapa DOPC plana, como se indica en la Figura 1. La monocapa DOPC en la interfase aire-agua plana se dopó con bajas cantidades de Rodamina-DPPE, y esto por lo tanto hizo posible visualizar un fondo con un color brillante y una región oscura que acaba de agregar a la interfaz plana. Allí, se observó un proceso de recuperación a 23 mN / m de la presión de superficie fija. Un ajuste de la ecuación 1 para el cambio de intensidad fraccional de acuerdo al tiempo se muestra en la Figura 2. El valor de R 2 de este ajuste es 0.999, y este ajuste todavía funciona bien incluso a presiones superficiales inferiores o superiores. El coeficiente de difusión de la monocapa DOPC obtenida de este ajuste fue 27,54 m 2 / seg a 23 mN / m de la presión de superficie.
Para mayor validación del FRAM, coeficientes de difusión de la DOPC y dipalmitoilfosfatidilcolina (DPPC) monocapas se midieron de acuerdo a la presión de la superficie. Como se muestra en la Figura 3, FRAM captura la rápida disminución de coeficiente de difusión de la monocapa DPPC a ~ 9 mN / m de presión de la superficie, donde (condensado líquido) un LC - LE (líquido expandido) de transición de fase se produce 10, y los valores de coeficientes de difusión también se acuerdan bien con las mediciones previamente por Peters et al., 19. Además, se observó un decaimiento exponencial del coeficiente de difusión con la presión superficial en la monocapa DOPC, y esta tendencia es casi idéntica a la medida por Caruso et al., 12.
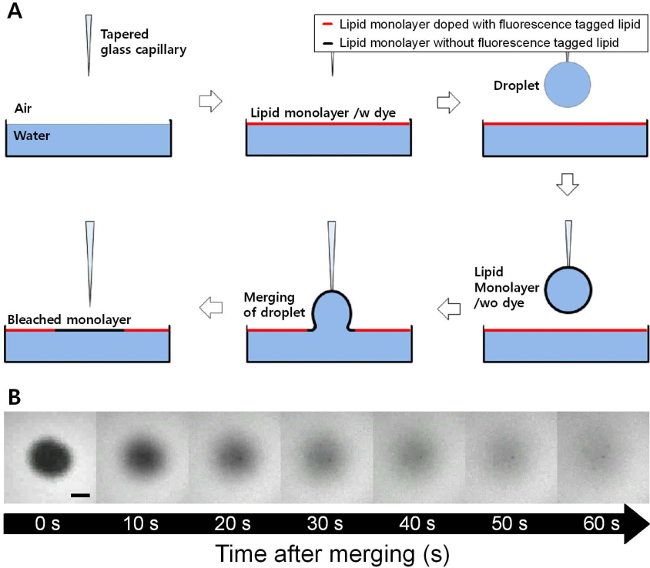
Figura 1. (A) Esquema del FRAM (recuperación de fluorescencia después de la fusión) Técnica. Como el labiogotita recubierto monocapa id se fusionó a la interfaz aire-agua plana, la monocapa lipídica sin fluorescencia etiquetada lípido se inserta en monocapa lipídica plana fluorescente. Imágenes (B) de microscopio de fluorescencia con el tiempo durante el proceso de recuperación de una monocapa DOPC a 23 mN / m de presión superficial (barra de escala = 100 micras). La región oscura de la monocapa DOPC está totalmente recuperado por el proceso de difusión dentro de varios minutos. Por favor haga clic aquí para ver una versión más grande de esta figura.
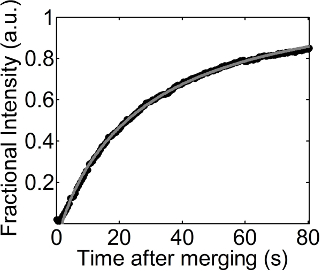
Figura 2. fraccional intensidad en función del tiempo. Círculos negros y la línea de puntos grises indican los valores de intensidades fraccionarios obtenidos a partir de análisis de imagen (procedimientos 4.1 y 4.2) y el ajuste de la ecuación 1 a las intensidades fraccionarios con el tiempo,se muestra en el procedimiento 4.3, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
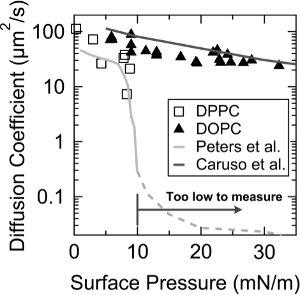
Figura 3. Los coeficientes de difusión de DOPC (triángulo) y DPPC (casilla vacía) monocapas en función de la presión en la superficie. Las líneas con el color gris brillante y con el color gris oscuro indican los valores del coeficiente de difusión se informó anteriormente por Peters et al. y Caruso et al., respectivamente. Esta cifra ha sido modificado de Jeong et al. 23. Reproducido con permiso del Jeong et al. Langmuir. 30 (48), 14.369 a 14374. Derechos de Autor 2014 American Chemical Society. Por favor, haga clic en ellae para ver una versión más grande de esta figura.
Discusión
FRAM comparte una gran cantidad de principios fundamentales con FRAP, especialmente para medir la recuperación de fluorescencia después de blanquear un área específica, pero FRAM utiliza un proceso de fusión de una gotita en la interfaz plana para formar una zona blanqueada, en lugar de aplicar una luz intensa. El proceso de fusión es, pues, el paso más importante en FRAM, y sobre todo, la forma de la mancha oscura en la monocapa plana después de la fusión de una gotita determina la exactitud de la medición de la difusividad. Específicamente, sobre la base de un método actual, sólo se establece el círculo con un radio R como una región de interés para calcular la intensidad media de la mancha oscura, que se muestra en el procedimiento 4, y si hay un exceso de desviación de la forma circular, esto podría perturbar la medición precisa de un coeficiente de difusión. Por lo tanto, es necesario para obtener una región oscura de forma circular, pero, formas no circulares se forman en ocasiones debido a varias razones. En primer lugar, si existe un flujo de convección en el Petplato ri, la forma de la zona oscura se alarga a lo largo de la dirección del flujo. Como se ha mencionado en el procedimiento 1.3, un aparato de cono en forma de ayuda a suprimir el flujo convectivo, y este alargamiento se reduce al mínimo. En segundo lugar, si el extremo de la punta del capilar toca la interfaz plana durante un proceso de fusión, el área oscura está formada con una variedad de formas desde el final capilar interrumpe el proceso de fusión. Con la obtención de una gotita que sólo cuelga desde el extremo del capilar, esta interrupción se puede prevenir. En particular, un tratamiento hidrofóbico del capilar ayuda a la gota para sentarse al final del capilar. Por lo tanto, los tiroteos de problemas anteriores y modificaciones nos permiten medir las propiedades de difusión con mayor precisión.
Así, este proceso bien localizado averías permite FRAM tener varias ventajas significativas sobre FRAP. En primer lugar, FRAM requiere un equipo sencillo que FRAP. Para FRAM, es suficiente para utilizar un simple micros de fluorescenciahacer frente, en lugar de un microscopio confocal caro con un láser de alta potencia cuya longitud de onda debe coincidir con el espectro de absorción del colorante. Además, es necesario utilizar un aparato adicional para ajustar el tamaño a la zona blanqueada en el FRAP, mientras que el FRAM controla el tamaño de la zona de fácil ajustando el tamaño de la gotita, o la presión superficial en la superficie de las gotitas. En segundo lugar, es posible utilizar varias especies de colorantes en FRAM. FRAP sólo utiliza moléculas de colorante cuyo proceso de blanqueo es mucho más rápido que el proceso de difusión. Si la difusión de los colorantes se produce durante el proceso de blanqueo, es difícil estimar con precisión la propiedad de difusión. El FRAM, sin embargo, no requiere un proceso para el blanqueo de colorantes y esto por lo tanto permite el uso de varios tipos de colorantes de la formación de imágenes de fluorescencia. Además, el FRAP requiere láseres de alta potencia y el filtro establece adicionales para cambiar la especie de colorante, mientras que sólo es necesario para reemplazar los conjuntos de filtros en el FRAM. Finalmente, Ya que las monocapas en la superficie de las gotitas y la interfaz plana se puede formar de manera independiente, lo que permite el estudio de la inter-difusión o la mezcla entre dos monocapas de lípidos diferentes mediante la fusión de A-tipo monocapa con el de tipo B monocapa, mientras que sólo el FRAP mide la auto-difusión de una monocapa.
A pesar de estas ventajas, el proceso de fusión de una gota sobre una interfase aire-agua plana potencialmente puede limitar esta técnica debido a varias cuestiones que podrían ser motivo de preocupación, como una falta de coincidencia presión superficial entre las dos monocapas, la escala de tiempo del proceso de fusión , y un aumento en la presión superficial de la monocapa plana después de la fusión de las gotitas. Estos problemas, sin embargo, no afectan a la medición de la difusión de manera significativa por las siguientes razones. En primer lugar, a pesar de las presiones de superficie en las dos monocapas diferentes son bastante diferentes, un proceso de equilibrado se completa en una etapa muy temprana durante el proceso de recuperación. Por ejemplo, si tque la superficie de presión de la monocapa en la superficie de las gotitas es mayor que la de la monocapa en la interfase aire-agua plana, el área oscura se expande hasta que la presión se equilibra superficie. Dado que este proceso se completa dentro de 10 mseg, la presión superficial se equilibró antes de que afecte el proceso de difusión de manera significativa. En segundo lugar, si la escala de tiempo del proceso de fusión es lo suficientemente rápido, no limita la medición de difusión en absoluto. Afortunadamente, un proceso de fusión típica también se completa en 10 ms. Por último, incluso la fusión de varias de las gotitas en la interfaz plana no aumentan la presión superficial ya que el área de la superficie de la cubeta es mucho más grande que el área de la superficie de la gotita. De acuerdo con los tamaños de la vaguada y las gotitas, que se describe en el protocolo, el área por molécula aumenta menos de 0,015% mediante la fusión de una gota. En consecuencia, el aumento de presión en la superficie debido al cambio de área por molécula es menor que 0,1%, que es negligible porque es mucho menor que el error típico de la presión superficial, medida por la placa de Wilhelmy tensiómetro.
En resumen, hemos introducido un nuevo método para medir la propiedad difusión lateral de una monocapa de fosfolípidos mediante la fusión de una monocapa de gotas en la interfaz plana. Esta técnica requiere un equipo relativamente simple y también permite el uso de varios tipos de especies de colorantes. El FRAM es por tanto, potencialmente aplicable para la medición de la difusión de cualquier agente de superficie activa, incluyendo los fosfolípidos, copolímeros de bloque, proteínas e incluso nanopartículas en una interfaz de fluido-fluido. Además, esperamos que el FRAM ofrece una nueva manera de estudiar la interrelación difusión o la mezcla entre dos agentes tensioactivos diferentes.
Divulgaciones
The authors declare no competing financial interest.
Agradecimientos
Este trabajo es apoyado por el Proyecto financiado por el KAIST K-Valle RED & B para el 2014 y el Programa de Investigación de Ciencia Básica a través de la Fundación Nacional de Investigación de Corea (NRF- 2012R1A6A3A040395, NRF-2013R1A1A2057708, NRF- 2012R1A1A1011023).
Materiales
| Name | Company | Catalog Number | Comments |
| Acetone | OCI corporation | Acetone 3.8L Extra Pure | Purity: ≥ 99.5%, Please consult material safety data sheets (MSDS) before use. |
| Ethanol | OCI corporation | Ethanol 3.8L Extra Pure | Purity: ≥ 94%, Please consult material safety data sheets (MSDS) before use. |
| Dioleoylphosphatidylcholine, DOPC | Avanti Polar Lipids | 850375C | Please consult material safety data sheets (MSDS) before use. Chloroform is carcinogenic. |
| Chloroform | LiChrosolv | Chloroform ultrapure (A3633) | Purity: ≥ 99.8%, Please consult material safety data sheets (MSDS) before use. Carcinogenic |
| Rhodamine DPPE | Avanti Polar Lipids | 810158C, 810158P | Avoid direct light exposure to prevent photobleaching |
| Wilhelmy plate tensiometer | R&K ultrathin organic film technology | Wilhelmy tensiometer | http://www.rieglerkirstein.de/index.htm |
| Micropipette puller | Sutter instrument | P-1000 | |
| Micro-injector | Eppendorf | Femtojet | |
| Micromanipulator | Eppendorf | Micromanipulator 5171 | |
| Microscope 1 | Objective lens: Olympus | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3 |
| Microscope 2 | Objective lens: Olympus, Tube lens: Thorlabs | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3, tube lens: focal length 17 cm |
| CCD for Microscope 1 | Jai | CV 950 camera | |
| CCD for Microscope 2 | Andor | iXon3 EMCCD | |
| Filter set | Chroma technology | Catalog Set 49004: ET545, T565, ET605 | Prepare suitable for dye molecules |
| Sonicator | DAIHAN Scientific | Wiseclean WUC-D06H |
Referencias
- Van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nat. Rev. Mol. Cell Biol. 9 (2), 112-124 (2008).
- Christon, R., Even, V., Daveloose, D., Léger, C. L., Viret, J. Modification of fluidity and lipid—protein relationships in pig intestinal brush-border membrane by dietary essential fatty acid deficiency. Biochim. Biophys. Acta - Biomembr. 980 (1), 77-84 (1989).
- Stubbs, C. D., Smith, A. D. The modification of mammalian membrane polyunsaturated fatty acid composition in relation to membrane fluidity and function. Biochim. Biophys. Acta - Rev. Biomembr. 779 (1), 89-137 (1984).
- Holthuis, J. C. M., Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510 (7503), 48-57 (2014).
- Alonso, C., Waring, A., Zasadzinski, J. A. Keeping lung surfactant where it belongs: protein regulation of two-dimensional viscosity. Biophys. J. 89 (1), 266-273 (2005).
- Kim, K., Choi, S. Q., Zell, Z. a., Squires, T. M., Zasadzinski, J. A. Effect of cholesterol nanodomains on monolayer morphology and dynamics. Proc. Natl. Acad. Sci. (U. S. A.). 110 (33), E3054-E3060 (2013).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring Lipid Membrane Viscosity Using Rotational and Translational Probe Diffusion. Phys. Rev. Letters. 112 (18), 188101 (2014).
- Ding, J., Warriner, H. E., Zasadzinski, J. a., Schwartz, D. K. Magnetic needle viscometer for Langmuir monolayers. Langmuir. 18 (13), 2800-2806 (2002).
- Dhar, P., Cao, Y., Fischer, T. M., Zasadzinski, J. A. Active interfacial shear microrheology of aging protein films. Phys. Rev. Letters. 104 (1), 1-4 (2010).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Choi, S. Q., Steltenkamp, S., Zasadzinski, J. A., Squires, T. M. Active microrheology and simultaneous visualization of sheared phospholipid monolayers. Nature Commun. 2 (5), 312 (2011).
- Caruso, F., et al. Determination of lateral diffusion coefficients in air-water monolayers by fluorescence quenching measurements. J. Am. Chem. Soc. 113 (16), 4838-4843 (1991).
- Filippov, A., Orädd, G., Lindblom, G. The effect of cholesterol on the lateral diffusion of phospholipids in oriented bilayers. Biophys. J. 84 (5), 3079-3086 (2003).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36 (3), 176-182 (1999).
- Lopez, A., Dupou, L., Altibelli, A., Trotard, J., Tocanne, J. F. Fluorescence recovery after photobleaching (FRAP) experiments under conditions of uniform disk illumination. Critical comparison of analytical solutions, and a new mathematical method for calculation of diffusion coefficient D. Biophys. J. 53 (6), 963-970 (1988).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Vaz, W. L., Clegg, R. M., Hallmann, D. Translational diffusion of lipids in liquid crystalline phase phosphatidylcholine multibilayers. A comparison of experiment with theory. Biochemistry. 24 (3), 781-786 (1985).
- Wu, E. S., Jacobson, K., Papahadjopoulos, D. Lateral diffusion in phospholipid multibilayers measured by fluorescence recovery after photobleaching. Biochemistry. 16 (17), 3836-3841 (1977).
- Peters, R., Beck, K. Translational diffusion in phospholipid monolayers measured by fluorescence microphotolysis. Proc. Natl. Acad. Sci. (U. S. A.). 80 (23), 7183-7187 (1983).
- Kuhn, H., Mobius, D., Bucher, H., Crawley, J. N., et al. . Physical Methods of Chemistry. 1, Part 3B, 651-653 (1972).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta - Biomembr. 858 (1), 161-168 (1986).
- Rotenberg, Y., Boruvka, L., Neumann, A. Determination of surface tension and contact angle from the shapes of axisymmetric fluid interfaces. J. Colloid Interface Sci. 93 (5), 169-183 (1983).
- Jeong, D. W., Kim, K., Lee, S., Choi, M. C., Choi, S. Q. Fluorescence recovery after merging a surfactant-covered droplet: a novel technique to measure the diffusion of phospholipid monolayers at fluid/fluid interfaces. Langmuir. 30 (48), 14369-14374 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados