Method Article
Recupero della fluorescenza dopo Fusione di una Droplet misurare la diffusione bidimensionale di un fosfolipide monostrato
In questo articolo
Riepilogo
We present a new technique to measure the lateral diffusion of a surface active species at the fluid-fluid interface by merging a droplet monolayer onto a flat monolayer.
Abstract
We introduce a new method to measure the lateral diffusivity of a surfactant monolayer at the fluid-fluid interface, called fluorescence recovery after merging (FRAM). FRAM adopts the same principles as the fluorescence recovery after photobleaching (FRAP) technique, especially for measuring fluorescence recovery after bleaching a specific area, but FRAM uses a drop coalescence instead of photobleaching dye molecules to induce a chemical potential gradient of dye molecules. Our technique has several advantages over FRAP: it only requires a fluorescence microscope rather than a confocal microscope equipped with high power lasers; it is essentially free from the selection of fluorescence dyes; and it has far more freedom to define the measured diffusion area. Furthermore, FRAM potentially provides a route for studying the mixing or inter-diffusion of two different surfactants, when the monolayers at a surface of droplet and at a flat air/water interface are prepared with different species, independently.
Introduzione
I fosfolipidi sono componenti principali delle membrane cellulari e le membrane di organelli, e la fluidità di questi strati di membrana influisce spesso funzioni cellulari alterando l'attività delle proteine di membrana 1 - 3. Ad esempio, membrane omeostasi lipidica si ottiene regolando la fluidità di membrana, che viene rilevato da proteine di membrana, e un livello anormale di fluidità provoca malattie gravi, come steatosi epatica e colestasi 4. Inoltre, la fluidità di un monostrato fosfolipide all'interfaccia liquido-aria alveoli ha implicazioni importanti nelle sue funzioni. Alta fluidità del surfattante polmonare fosfolipide monostrato facilita la diffusione dello strato durante l'inalazione, mentre una bassa fluidità permette lo strato di rimanere entro alveoli durante l'espirazione 5,6. È quindi importante valutare la fluidità degli strati di fosfolipidi di comprendere i loro ruoli.
_content "> una misura diretta della fluidità è la viscosità e la viscosità di strati di fosfolipidi è stato misurato usando colloidi micron dimensioni 7, aghi magnetici 8,9 e magnetici micro-tasti 6,10,11. Tuttavia, queste tecniche sono limitati ai film relativamente rigidi, e non può misurare film meno viscosi. Per tali casi, diffusività sarebbe un'alternativa quantificare fluidità strati di fosfolipidi. Per molti decenni, una varietà di tecniche per misurare le proprietà di diffusione di strati di fosfolipidi sono stati sviluppati, come la fluorescenza metodo di spegnimento 12, campo pulsato gradiente NMR 13, e spettroscopia di fluorescenza di correlazione (FCS) 14. Uno dei metodi più rappresentativi è recupero di fluorescenza dopo photobleaching (FRAP) 15,16. Grazie alla semplicità della procedura di misurazione e relativo teorie, diversi studi sulle proprietà di diffusione dei livelli di fosfolipidi sono stati effettuati utilizzando FRAP 17 - 19. Tuttavia, FRAP di solito richiede un setup costoso microscopio confocale con un laser ad alta potenza.Qui vi presentiamo una nuova tecnica per misurare la diffusione laterale di monostrati di fosfolipidi, definito come il recupero di fluorescenza dopo l'unione (FRAM). La differenza fondamentale tra FRAP e FRAM è che il passo photobleaching è sostituito dal coalescenza goccia. Unire una gocciolina coperto da non-fluorescenza monostrato su un monostrato piatta fluorescente lascia una macchia scura circolare su un monostrato luminoso appartamento, dando così lo stesso stato iniziale con il passo photobleaching. Abbiamo poi osserviamo il recupero di fluorescenza nella macchia scura con il tempo di misurare la diffusività laterale. Questa nuova "bleaching" step by goccia coalescenza offre vantaggi significativi rispetto FRAP: FRAM richiede solo un microscopio a fluorescenza anziché un microscopio confocale costoso con un laser ad alta potenza che è necessario per FRAP. ion Inoltre, FRAM offre una vasta selezione di coloranti fluorescenti in quanto non comporta il processo di photobleaching. Infine, i due monostrati differenti, un monostrato goccia e un monostrato piatta, possono essere preparati in modo indipendente, consentendo così interdiffusione da misurare, mentre FRAP misura solo l'auto-diffusione di monostrati.
FRAM offre una vasta gamma di misure di diffusione di materiali altamente viscosi a materiali quasi non viscosi. In linea di principio, FRAM può misurare la diffusività massimo di 10 6 micron 2 / sec, che è paragonabile a tecniche esistenti, quando si verifica la diffusione attraverso l'area 100 micron da 100 micron durante il tempo per il processo di caduta coalescenza (~ 10 msec). Inoltre, il processo di lenta diffusione può essere facilmente misurato a meno che monostrati sono solidi. FRAM può essere utilizzato per qualsiasi tipo di materiali tensioattivi purché opportune molecole fluorescente contrassegnate sono disponibili.
Protocollo
Attenzione: Far riferimento alla scheda di dati di sicurezza (MSDS) prima dell'uso di acetone e cloroformio cancerogene.
1. Preparazione di Phospholipid monostrato in un acqua-Air Interface piatto
- Formazione di un monostrato fosfolipide
- Preparazione di una soluzione di fosfolipidi
- Pulire un flaconcino da 4 ml con una politetrafluoroetilene rivestita berretto con acetone, etanolo e acqua deionizzata per almeno tre volte, e soffiare accuratamente azoto gassoso nel flaconcino per sbarazzarsi di acqua.
- Sciogliere 1 mg di fosfolipidi (ad esempio, dioleoilfosfatidilcolina, DOPC) a 1 ml di cloroformio nel flacone di ottenere 1 mg / ml di concentrazione. Eseguire questa procedura in una cappa aspirante per la sicurezza. Utilizzare concentrazioni più basse o più alte di soluzione di fosfolipidi, se necessario.
- Aggiungere dye etichettato fosfolipidi (ad esempio, Rodamina dipalmitoylphosphatidylethanolamine, Rodamina PDPE) con meno di 1 mole% della solu fosfolipidezione, per visualizzare il monostrato fosfolipide con un microscopio a fluorescenza. Eseguire questa procedura in una cappa aspirante per la sicurezza.
- Avvolgere la fiala con un nastro politetrafluoroetilene per evitare l'evaporazione del solvente, e memorizzare il campione in un congelatore a -20 ° C.
- Deposizione di fosfolipidi sull'interfaccia aria-acqua
- Pulire un piatto Petri (55 mm di diametro e 12 mm di altezza) con etanolo, e acqua deionizzata per almeno tre volte.
- Riempire la piastra di Petri con 10 ml di acqua deionizzata per creare un'interfaccia aria-acqua.
- Distribuire pochi microlitri della soluzione di fosfolipidi con un micro-siringa sulla un'interfaccia pulita per ottenere una pressione superficie desiderata e attendere almeno 30 minuti per evaporare il solvente completamente, prima di fare l'esperimento.
Nota: Una depressione Langmuir può essere usato al posto di una capsula di Petri, se è necessario un controllo preciso della pressione superficiale.
- Preparazione di una soluzione di fosfolipidi
- Sumisurazione della pressione rfaccia
- Misurare la pressione superficiale del monostrato fosfolipide con un piatto tensiometro Wilhelmy. Attendere almeno 30 minuti per ottenere la carta da filtro inumidita sufficiente se la carta da filtro viene utilizzato come una piastra di Wilhelmy. Il protocollo dettagliato è disponibile in Kuhn et al. 20.
- Regolare la quantità depositata dello fosfolipide per controllare con precisione la pressione superficiale. Aggiungere 4 ml di soluzione DOPC (1 mg / ml) sulla 30.25 cm 2 -Area dell'interfaccia se ~ 5 mN / m della pressione superficiale è richiesto.
Nota: Se la carta da filtro non è completamente bagnata, pressione superficiale cambia drasticamente durante i primi 30 minuti dell'esperimento a causa della variazione di peso della carta da filtro.
- Minimizzazione del flusso convettivo del monostrato
- Utilizzare un apparecchio a forma di cono che contiene un serbatoio 3 mm con due canali sottili, collegato ad una grande sezione del piatto Petri, per sopprimere il flusso convettivo diil monostrato, che può turbare la morfologia delle immagini e la misurazione della pressione superficiale.
- Assicurarsi di abbinare il livello dell'acqua tra l'interno e l'esterno dell'apparecchiatura cono-figura per assicurare che i fosfolipidi muovono liberamente sull'intera regione prima di depositare fosfolipidi sull'interfaccia aria-acqua.
2. Preparazione di fosfolipidi monostrato alla superficie curva di una gocciolina
- Processo si assottiglia di un capillare di vetro con micropipetta estrattore
- Collocare un capillare di vetro (od 1 mm, 0,78 mm id, lunghezza 100 mm) su un supporto capillare di un estrattore micropipetta.
- Progettare un programma per tirare i capillari con valori dei parametri appropriati (Calore: Rampa, Pull: 60, Vel: 70, Delay: 70 e Pressione 200) e tirare i capillari con il programma progettato secondo il protocollo del produttore.
Nota: end Un capillare con pochi micrometri di diametro è necessario formare una gocciolina 100 micron-by applying una pressione con ~ 10 kPa. Se l'estremità di punta del capillare è troppo piccola, la pressione molto più elevata,> 600 kPa, è necessario per ottenere la goccia, mentre è difficile controllare la dimensione delle gocce con una troppo grande estremità di punta capillare.
- Assorbimento di fosfolipidi sulla superficie droplet
Nota: Per formare un monostrato fosfolipide all'interfaccia curvo di una goccia, una soluzione di fosfolipidi senza colorante fosfolipidi etichettato viene utilizzato per ottenere un contrasto intensità, contro il monostrato piatta, preparata mediante procedura 1. Inoltre, entrambe le procedure 2.2.1 e 2.2 .2 sono consentiti qui. Se è necessario un controllo preciso della pressione superficiale sulla superficie gocciolina, procedura 2.2.2 è altamente raccomandato. Tuttavia, se non, procedimento 2.2.1, che è un modo molto più facile che procedura 2.2.2, è utile.- Processo di fosfolipidi Rivestimento in una estremità di punta
- Pulire un vetrino con acetone, etanolo e acqua deionizzata per almeno tre volte.
- Place il capillare conico su un vetrino pulito, e inclinare il capillare per agevolare toccare il vetrino con una estremità di punta.
- Cadere qualche gocce di soluzione di fosfolipidi (1 mg / ml) sull'estremità punta di un capillare che viene fatto aderire al vetrino usando una siringa di vetro, e attendere almeno 30 minuti per evaporare il solvente completamente.
Nota: Si consiglia vivamente di aderire alla fine punta del capillare al vetrino durante la procedura 2.2.1.3 perché il perimetro della fine punta è troppo piccolo per contenere la goccia dei fosfolipidi alla fine punta solo con la forza capillare.
- Preparazione di una soluzione vescicole
- Pulire una fiala, e rimuovere l'acqua dal flaconcino, come introdotto nel procedimento 1.1.1.1.
- Essiccare un volume di soluzione di 2 ml di fosfolipidi (1 mg / ml) applicando azoto delicatamente ed essiccare la fiala per 1 ora a RT per eliminare qualsiasi solvente rimanente. Eseguire questa procedura in una cappa aspirante per la sicurezza.
- Aggiungere 2ml di acqua deionizzata nel flaconcino contenente lipidi essiccato, e incubare la vial in stufa a 60 ° C per 1 ora.
- Agitare il flacone diverse volte, e sonicare (HF-frequenza: fino a 40 kHz, Potenza: 370 W) per 30 minuti per ottenere vescicole.
- Eseguire processi di estrusione e gelo-disgelo per ottenere vescicole unilamellari monodisperse. Il protocollo dettagliato per vescicole preparazione è descritta in Mayer et al. 21.
Nota: la pressione superficiale dell'interfaccia goccia viene controllata in modo preciso regolando il tempo di attesa dopo la formazione della goccia che contiene vescicole unilamellari monodisperse. Utilizzando un metodo pendente goccia 22, è necessario misurare la variazione di pressione superficiale secondo tempo, prima di fare l'esperimento.
- Processo di fosfolipidi Rivestimento in una estremità di punta
- Formazione di una gocciolina che contiene un monostrato fosfolipide alla superficie curva
- Compila il capillare conico con 10 ml di acqua deionizzata da immissioe 2.2.1. In alternativa, utilizzare 10 ml di soluzione di vescicole da procedura 2.2.2.
- Collegare il capillare di un micro-iniettore automatizzato per fornire la pressione per formare la goccia.
- Montare il capillare che è collegato ad un micro-iniettore ad un micromanipolatore per controllare la posizione del capillare con precisione.
- Preparare un microscopio in campo chiaro (Microscopio 1, obiettivo obiettivo: 10X NA 0,3) per l'imaging la vista laterale del capillare con una telecamera CCD. Microscopio 1 permette quindi di osservare la posizione precisa della goccia lungo l'asse z e stimare la dimensione della goccia.
- Spostare la relativa estremità ad una posizione dove la vista laterale della estremità di punta è ben visualizzato mediante microscopio 1 utilizzando un micromanipolatore, e applicare una pressione variabile (~ 100 hPa) con la relativa estremità del capillare, fino dimensioni adeguate (~ 100 micron di diametro) della gocciolina è formato.
Nota: Si raccomanda automatizzata micro-iniettore e micromanipolatore essere usod, se è necessario un controllo preciso della dimensione delle gocce e la posizione della goccia. È anche possibile utilizzare quelli manuali.
3. Imaging di fluorescenza di recupero dopo la fusione Droplet
Nota: I principi fondamentali di questo protocollo sono identiche a quelle della tecnica FRAP, tranne per il processo di coalescenza goccia. Le modalità di protocollo e relative teorie FRAP sono disponibili in A. Lopez et al. 15 e D. Axelrod et al. 16.
- Il monitoraggio e il controllo della posizione della goccia
- Preparare un microscopio invertito set (Microscopio 2, obiettivo obiettivo: 10X NA 0.3, lente del tubo: lunghezza focale 17 cm) che permette sia un microscopio a fluorescenza con un set di filtri appropriato per Rodamina-DPPEs (eccitazione a 560 nm, emissione a 583 nm) e un microscopio in campo chiaro. Usare una camera CCD qui per visualizzare le migliori viste della goccia con un microscopio a fluorescenza mode e una modalità microscopio a campo chiaro.
- Spostare la goccia rivestita con un fosfolipide a un'interfaccia aria-acqua piatta lungo l'asse z, ma non unire la gocciolina ancora, utilizzando il micromanipolatore. Utilizzare Microscopio 1 per visualizzare la vista laterale della goccia.
- Individuare la goccia al centro della vista dall'alto del monostrato piatta, utilizzando micromanipolatore. Utilizzare la modalità microscopio a campo chiaro di microscopio 2 di visualizzare vista dall'alto monostrato piatta.
- Unire la goccia sull'interfaccia aria-acqua piatta
- Spostare la goccia ulteriormente verso l'interfaccia piatta fino a quando la goccia si fonde sull'interfaccia, utilizzando il micromanipolatore. Se il processo di fusione è fatto con successo, una regione scura di forma circolare che è circondato da uno sfondo bianco, si osserva utilizzando la modalità di microscopio a fluorescenza 2.
- Registrare la serie di immagini fluorescenti in base all'anticipo dopo la fusione la goccia, utilizzando la modalità di fluorescenza di Microspiviale 2. Utilizzare un frame rate più veloce che la scala temporale diffusione del monostrato qui. In DOPC monostrato, ci vogliono pochi minuti per diffondere nella zona 200 micron-scuro completamente.
4. Determinazione del coefficiente di diffusione da Image Analysis
Nota: Per determinare il coefficiente di diffusione di una serie di immagini, programma personalizzato per l'analisi delle immagini è costruito come descritto di seguito. Un codice sorgente dettagliata di questo programma è disponibile nel sito web Giove.
- Rilevamento di una regione circolare di interesse
- Rilevazione del centro della regione di interesse
- Ottenere una serie di immagini fluorescenti che sono stati registrati durante un processo di ripristino che contiene una zona scura circolare e uno sfondo bianco, e impostare la prima immagine della serie come immagine di riferimento. Qui, R D è il raggio della zona scura in un'immagine di riferimento.
- Convolute l'immagine di riferimento con un cerchio bianco cheintensità se è uniforme su un'intera regione. Utilizzare funzione incorporata denominata 'CONV2' per convoluzione, come mostrato nel codice sorgente della linea programma personalizzato 124. Qui, il raggio del cerchio bianco è leggermente inferiore rispetto R D.
- Trova una posizione che indica un valore minimo nel calcolo convoluzione, e impostare la posizione come il centro della regione di interesse nell'immagine di riferimento.
- Determinare un raggio della regione di interesse
- Convolute l'immagine di riferimento con un cerchio bianco che contiene una posizione centrale, determinata da una procedura 4.1 e intensità uniforme su un'intera regione. Qui, R S è il raggio del cerchio bianco. Utilizzare iterazione come 'per' o 'mentre' con l'equazione di un cerchio per fare il cerchio bianco come mostrato nel codice sorgente della linea programma personalizzato 102 a 109.
- Convolute l'immagine di riferimento con un altro cerchio bianco che ha un po 'raggio maggiore (5% -10%), R L, a R S. Utilizzare stesso metodo con procedura 4.1.2.1 per rendere il cerchio come mostrato nel codice sorgente della linea programma personalizzato 113 a 120.
- Ottenere la differenza di valore tra i due calcoli convoluzione di 4.1.2.1 e 4.1.2.2.
- Ripetere le procedure sopra da R S = R D / 2 a R S = 2R D, aumentando sia la R S ed R L con un livello di pixel. Effettuare una iterazione che contiene i codici sorgente interi da procedura 4.1.2.1 a 4.1.2.3 ripetere.
- Trovare il raggio di R S che indica la massima differenza di valore tra i due calcoli convoluzione. Utilizzare la funzione incorporata di nome 'max' per trovare il raggio indica la massima differenza di valore, come mostrato nel codice sorgente della linea programma personalizzato 148 a 149. Questo R S indica quindi il raggio della zona scura nell'immagine di riferimento.
- Rilevazione del centro della regione di interesse
- Calcolo di un intensità frazionale
- Impostare un cerchio che contiene una posizione centrale e un raggio, determinata mediante procedura 4.1 come una regione di interesse.
- Calcolare le intensità media della regione di interesse in una serie di immagini di fluorescenza secondo tempo. Convolute ogni fotogramma con la regione di interesse e dividerlo per area della regione di interesse per calcolare l'intensità media. I dettagli sono disponibili nel codice sorgente del programma personalizzato che è disponibile nel sito web Giove.
- Calcolo intensità frazionaria, definita come la seguente equazione, dove F (t) è l'intensità media del cerchio che è una regione di interesse secondo tempo, F i è l'intensità iniziale nel cerchio, e F o è l'intensità di uno sfondo bianco.
f (t) = (F (t) - F i) / (F o - F i) (Equazione 1).
- Montaggio del fintensità ractional alla teoria FRAP
- Montare l'intensità frazionale con la seguente equazione, dove τ è un tempo di diffusione caratteristico e io 0, I 1 vengono modificate funzioni di Bessel, utilizzando un programma di montaggio, e di ottenere τ
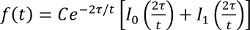 (Equazione 2).
(Equazione 2). - Ottenere un coefficiente di diffusione in base al rapporto, τ = a 2/4 D, dove D è il coefficiente di diffusione e A è il raggio della zona scura.
Nota: Durante il processo di adattamento, è possibile spostare il profilo di intensità frazionaria lungo un asse temporale quando il processo di recupero è già iniziato, prima di registrare le immagini.
- Montare l'intensità frazionale con la seguente equazione, dove τ è un tempo di diffusione caratteristico e io 0, I 1 vengono modificate funzioni di Bessel, utilizzando un programma di montaggio, e di ottenere τ
Risultati
Una serie di immagini di fluorescenza sono stati ottenuti con il tempo durante il processo di recupero dopo la fusione una gocciolina rivestito con un monostrato DOPC su un DOPC monostrato piatta, come indicato in Figura 1. Il monostrato DOPC all'interfaccia aria-acqua piatta stato drogato con basse quantità di Rodamina-DPPE, e questo modo ha permesso di visualizzare uno sfondo con un colore brillante e una regione scura appena aggiunto all'interfaccia piatta. C'è un processo di recupero è stata osservata a 23 mN / m di pressione superficie fissa. Una misura di equazione 1 alla variazione dell'intensità frazionata secondo tempo è mostrato in Figura 2. Il valore R 2 di questa forma è 0.999, e questa forma funziona ancora bene anche a pressioni superficiali inferiori o superiori. Il coefficiente di diffusione del monostrato DOPC ottenuto da questa misura era 27.54 2 micron / sec a 23 mN / m della pressione superficiale.
Per un'ulteriore conferma della FRAM, coefficienti di diffusione della DOPC e dipalmitoilfosfatidilcolina (DPPC) monostrati sono stati misurati in base alla pressione superficiale. Come mostrato in figura 3, FRAM cattura la rapida diminuzione del coefficiente di diffusione del monostrato DPPC a ~ 9 mN / m della pressione superficiale, dove un LC (liquido condensato) - LE (liquido espansa) transizione di fase si verifica 10, ed i valori di coefficienti di diffusione sono anche d'accordo bene con il già misure di Peters et al. 19. Inoltre, un decadimento esponenziale del coefficiente di diffusione con la pressione superficiale è stata osservata nel monostrato DOPC, e questa tendenza è quasi identica a quella misurata da Caruso et al. 12.
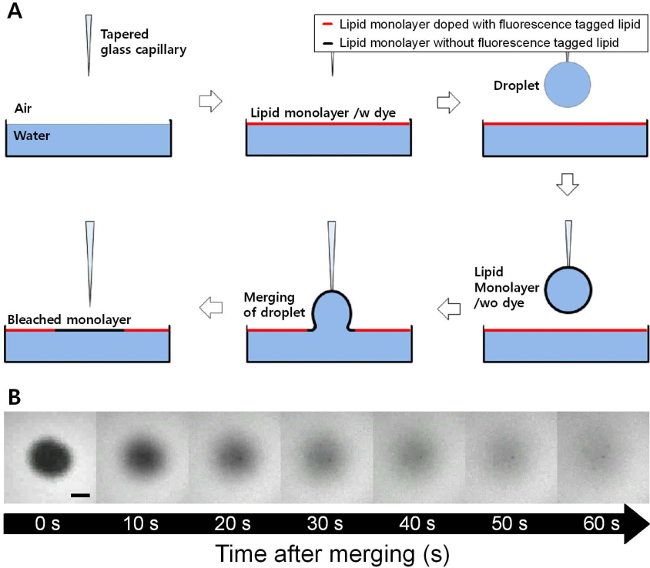
Figura 1. (A) Rappresentazione schematica della FRAM (recupero di fluorescenza dopo la fusione) tecnica. Come labbrogocciolina rivestito id monostrato viene unita all'interfaccia aria-acqua piatta, il monostrato lipidico senza fluorescenza tagged lipidico è inserito nel piano di lipidi monostrato fluorescente. Immagini (B) microscopio a fluorescenza con il tempo durante il processo di recupero di un monostrato DOPC a 23 mN / m di pressione superficiale (scala bar = 100 micron). La regione scura del monostrato DOPC è pienamente recuperato dal processo di diffusione in pochi minuti. Clicca qui per vedere una versione più grande di questa figura.
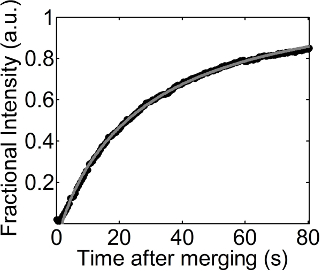
Figura 2. frazionale intensità in funzione del tempo. Cerchi neri e la linea tratteggiata grigia indicano i valori di intensità frazionari ottenuti da analisi di immagine (procedure 4.1 e 4.2) e l'adattamento dell'equazione 1 alle intensità frazionari con il tempo,mostrato nella procedura di 4.3, rispettivamente. Clicca qui per vedere una versione più grande di questa figura.
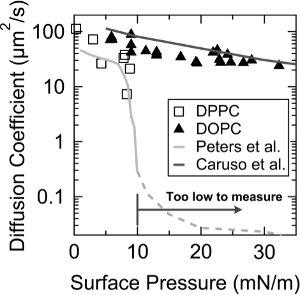
Figura 3. coefficienti di diffusione di DOPC (triangolo) e DPPC (quadrato vuoto) monostrati in funzione della pressione superficiale. Le linee con il colore grigio brillante e con il colore grigio scuro indicano i valori del coefficiente di diffusione precedentemente riportata da Peters et al. e Caruso et al., rispettivamente. Questa cifra è stata modificata da Jeong et al. 23. Ristampato con il permesso di Jeong et al. Langmuir. 30 (48), 14369-14374. Copyright 2014 American Chemical Society. Cliccate suoe per vedere una versione più grande di questa figura.
Discussione
FRAM condivide molte principi fondamentali con FRAP, soprattutto per misurare recupero di fluorescenza dopo candeggio una determinata area, ma FRAM utilizza un processo di unione di una gocciolina sull'interfaccia piatta per formare un'area sbiancato, invece di applicare una luce intensa. Il processo di fusione è quindi più importante passo in FRAM, e in particolare, la forma della macchia scura al monostrato piana dopo la fusione una gocciolina determina la precisione della misurazione diffusività. In particolare, sulla base di un metodo attuale, abbiamo impostato solo il cerchio con un raggio R come una regione di interesse per calcolare l'intensità media della macchia scura, mostrata nella procedura 4, e se c'è una deviazione troppo dalla forma circolare, ciò compromette la misurazione precisa di un coefficiente di diffusione. Pertanto, è necessario ottenere una regione scura di forma circolare, ma, forma non circolare si formano occasionalmente per diversi motivi. Innanzitutto, se esiste un flusso convettivo in Petpiatto ri, la forma dell'area scura viene allungata lungo la direzione del flusso. Come menzionato in Procedura 1.3, un apparato cono-figura aiuta a sopprimere il flusso convettivo, e questo allungamento sarebbe ridotto al minimo. In secondo luogo, se l'estremità di punta del capillare tocca l'interfaccia piatta durante un processo di fusione, l'area scura è formata con una varietà di forme, dalla fine capillare interrompe il processo di fusione. Ottenendo una goccia che pende solo dalla fine del capillare, questa interruzione può essere prevenuto. In particolare, un trattamento idrofobico del capillare aiuta la gocciolina di sedersi alla fine del capillare. Pertanto, sparatorie problemi di cui sopra e le modifiche ci permettono di misurare le proprietà di diffusione più preciso.
Questo processo ben analisi guasti permette quindi FRAM di avere più vantaggi significativi rispetto FRAP. In primo luogo, FRAM richiede attrezzature più semplice rispetto a FRAP. Per FRAM, è sufficiente utilizzare un semplice micro fluorescenzaaffrontare, invece di un microscopio confocale costoso con un laser di potenza elevata cui lunghezza d'onda deve coincidere con lo spettro di assorbimento del colorante. Inoltre, è necessario utilizzare apparati supplementari per regolare la dimensione all'area sbiancato nella FRAP, mentre la FRAM controlla la dimensione dell'area facilmente regolando la dimensione della goccia, o la pressione superficiale sulla superficie gocciolina. In secondo luogo, è possibile utilizzare varie specie di coloranti in FRAM. FRAP utilizza solo molecole di colorante il cui processo di candeggio è molto più veloce il processo di diffusione. Se la diffusione dei coloranti si verifica durante il processo di sbiancamento, è difficile stimare con precisione la proprietà di diffusione. La FRAM, tuttavia, non richiede un processo di sbiancamento coloranti e ciò consente così l'uso di diversi tipi di coloranti in fluorescenza. Inoltre, il FRAP richiede ulteriori laser ad alta potenza e filtro imposta cambiare specie colorante, mentre è solo necessario sostituire i set di filtri nel FRAM. Finalmente, Poiché i monostrati sulla superficie delle gocce e l'interfaccia piatta può essere formato in modo indipendente, consentendo così lo studio di inter-diffusione o miscelazione tra due differenti monostrati lipidici fondendo Un tipo monostrato a B-tipo monostrato, mentre il FRAP misura solo la auto-diffusione di un monostrato.
Nonostante questi vantaggi, il processo di fusione una goccia su un'interfaccia aria-acqua piatta può potenzialmente limitare questa tecnica a causa di diversi problemi che potrebbero essere di interesse, quali un disadattamento pressione superficiale tra le due monostrati, la scala temporale del processo di fusione , e un aumento della pressione superficiale del monostrato piana dopo la fusione goccioline. Questi problemi, tuttavia, non influenzano la misura diffusione significativa per i seguenti motivi. In primo luogo, anche se le pressioni di superficie ai due monostrati diverse sono molto diverse, un processo di equilibrio viene completato in una fase molto precoce durante il processo di recupero. Ad esempio, se tegli superficie pressione del monostrato sulla superficie delle goccioline è superiore a quella del monostrato all'interfaccia aria-acqua piatta, l'area scura espande finché la pressione superficiale equilibra. Poiché questo processo viene completato entro 10 msec, la pressione superficiale sarà equilibrata prima che influisce sul processo di diffusione in modo significativo. In secondo luogo, se la scala temporale del processo di fusione è abbastanza veloce, non limita la misura diffusione affatto. Fortunatamente, un tipico processo di fusione è anche completata entro 10 msec. Infine, anche la fusione multipla delle goccioline sull'interfaccia piatta non aumentare la pressione superficiale in quanto la superficie della vasca è molto più grande della superficie della goccia. Secondo le dimensioni del canale e le goccioline, descritto nel protocollo, la zona per molecola aumenta inferiore a 0,015% fondendo una gocciolina. Di conseguenza, l'aumento della pressione della superficie per effetto della variazione di superficie per molecola è inferiore allo 0,1%, che è negligible perché è molto più piccolo del tipico errore di pressione superficiale, misurata mediante tensiometro Wilhelmy piatto.
In sintesi, abbiamo introdotto un nuovo metodo per misurare la diffusione laterale di proprietà di un monostrato fosfolipide fondendo un monostrato di gocce sull'interfaccia piatta. Questa tecnica richiede attrezzature relativamente semplice e permette anche l'utilizzo di vari tipi di specie di tintura. La FRAM è quindi potenzialmente applicabile per la misurazione diffusione degli agenti tensioattivi, tra fosfolipidi, copolimeri a blocchi, proteine e anche nanoparticelle a un'interfaccia fluido fluido. Inoltre, ci aspettiamo che la FRAM offre un nuovo modo di studiare la inter-diffusione o miscelazione tra due diversi agenti tensioattivi.
Divulgazioni
The authors declare no competing financial interest.
Riconoscimenti
Questo lavoro è sostenuto dal progetto KAIST finanziato K-Valley RED & B per il 2014 e il programma di ricerca di scienza di base attraverso la Fondazione di Ricerca Nazionale di Corea (NRF- 2012R1A6A3A040395, NRF-2013R1A1A2057708, NRF- 2012R1A1A1011023).
Materiali
| Name | Company | Catalog Number | Comments |
| Acetone | OCI corporation | Acetone 3.8L Extra Pure | Purity: ≥ 99.5%, Please consult material safety data sheets (MSDS) before use. |
| Ethanol | OCI corporation | Ethanol 3.8L Extra Pure | Purity: ≥ 94%, Please consult material safety data sheets (MSDS) before use. |
| Dioleoylphosphatidylcholine, DOPC | Avanti Polar Lipids | 850375C | Please consult material safety data sheets (MSDS) before use. Chloroform is carcinogenic. |
| Chloroform | LiChrosolv | Chloroform ultrapure (A3633) | Purity: ≥ 99.8%, Please consult material safety data sheets (MSDS) before use. Carcinogenic |
| Rhodamine DPPE | Avanti Polar Lipids | 810158C, 810158P | Avoid direct light exposure to prevent photobleaching |
| Wilhelmy plate tensiometer | R&K ultrathin organic film technology | Wilhelmy tensiometer | http://www.rieglerkirstein.de/index.htm |
| Micropipette puller | Sutter instrument | P-1000 | |
| Micro-injector | Eppendorf | Femtojet | |
| Micromanipulator | Eppendorf | Micromanipulator 5171 | |
| Microscope 1 | Objective lens: Olympus | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3 |
| Microscope 2 | Objective lens: Olympus, Tube lens: Thorlabs | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3, tube lens: focal length 17 cm |
| CCD for Microscope 1 | Jai | CV 950 camera | |
| CCD for Microscope 2 | Andor | iXon3 EMCCD | |
| Filter set | Chroma technology | Catalog Set 49004: ET545, T565, ET605 | Prepare suitable for dye molecules |
| Sonicator | DAIHAN Scientific | Wiseclean WUC-D06H |
Riferimenti
- Van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nat. Rev. Mol. Cell Biol. 9 (2), 112-124 (2008).
- Christon, R., Even, V., Daveloose, D., Léger, C. L., Viret, J. Modification of fluidity and lipid—protein relationships in pig intestinal brush-border membrane by dietary essential fatty acid deficiency. Biochim. Biophys. Acta - Biomembr. 980 (1), 77-84 (1989).
- Stubbs, C. D., Smith, A. D. The modification of mammalian membrane polyunsaturated fatty acid composition in relation to membrane fluidity and function. Biochim. Biophys. Acta - Rev. Biomembr. 779 (1), 89-137 (1984).
- Holthuis, J. C. M., Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510 (7503), 48-57 (2014).
- Alonso, C., Waring, A., Zasadzinski, J. A. Keeping lung surfactant where it belongs: protein regulation of two-dimensional viscosity. Biophys. J. 89 (1), 266-273 (2005).
- Kim, K., Choi, S. Q., Zell, Z. a., Squires, T. M., Zasadzinski, J. A. Effect of cholesterol nanodomains on monolayer morphology and dynamics. Proc. Natl. Acad. Sci. (U. S. A.). 110 (33), E3054-E3060 (2013).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring Lipid Membrane Viscosity Using Rotational and Translational Probe Diffusion. Phys. Rev. Letters. 112 (18), 188101 (2014).
- Ding, J., Warriner, H. E., Zasadzinski, J. a., Schwartz, D. K. Magnetic needle viscometer for Langmuir monolayers. Langmuir. 18 (13), 2800-2806 (2002).
- Dhar, P., Cao, Y., Fischer, T. M., Zasadzinski, J. A. Active interfacial shear microrheology of aging protein films. Phys. Rev. Letters. 104 (1), 1-4 (2010).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Choi, S. Q., Steltenkamp, S., Zasadzinski, J. A., Squires, T. M. Active microrheology and simultaneous visualization of sheared phospholipid monolayers. Nature Commun. 2 (5), 312 (2011).
- Caruso, F., et al. Determination of lateral diffusion coefficients in air-water monolayers by fluorescence quenching measurements. J. Am. Chem. Soc. 113 (16), 4838-4843 (1991).
- Filippov, A., Orädd, G., Lindblom, G. The effect of cholesterol on the lateral diffusion of phospholipids in oriented bilayers. Biophys. J. 84 (5), 3079-3086 (2003).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36 (3), 176-182 (1999).
- Lopez, A., Dupou, L., Altibelli, A., Trotard, J., Tocanne, J. F. Fluorescence recovery after photobleaching (FRAP) experiments under conditions of uniform disk illumination. Critical comparison of analytical solutions, and a new mathematical method for calculation of diffusion coefficient D. Biophys. J. 53 (6), 963-970 (1988).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Vaz, W. L., Clegg, R. M., Hallmann, D. Translational diffusion of lipids in liquid crystalline phase phosphatidylcholine multibilayers. A comparison of experiment with theory. Biochemistry. 24 (3), 781-786 (1985).
- Wu, E. S., Jacobson, K., Papahadjopoulos, D. Lateral diffusion in phospholipid multibilayers measured by fluorescence recovery after photobleaching. Biochemistry. 16 (17), 3836-3841 (1977).
- Peters, R., Beck, K. Translational diffusion in phospholipid monolayers measured by fluorescence microphotolysis. Proc. Natl. Acad. Sci. (U. S. A.). 80 (23), 7183-7187 (1983).
- Kuhn, H., Mobius, D., Bucher, H., Crawley, J. N., et al. . Physical Methods of Chemistry. 1, Part 3B, 651-653 (1972).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta - Biomembr. 858 (1), 161-168 (1986).
- Rotenberg, Y., Boruvka, L., Neumann, A. Determination of surface tension and contact angle from the shapes of axisymmetric fluid interfaces. J. Colloid Interface Sci. 93 (5), 169-183 (1983).
- Jeong, D. W., Kim, K., Lee, S., Choi, M. C., Choi, S. Q. Fluorescence recovery after merging a surfactant-covered droplet: a novel technique to measure the diffusion of phospholipid monolayers at fluid/fluid interfaces. Langmuir. 30 (48), 14369-14374 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon