Method Article
Fluorescence Recovery nach der Zusammenführung ein Droplet, um die zweidimensionale Diffusion eines Phospholipidschicht Messen
In diesem Artikel
Zusammenfassung
We present a new technique to measure the lateral diffusion of a surface active species at the fluid-fluid interface by merging a droplet monolayer onto a flat monolayer.
Zusammenfassung
We introduce a new method to measure the lateral diffusivity of a surfactant monolayer at the fluid-fluid interface, called fluorescence recovery after merging (FRAM). FRAM adopts the same principles as the fluorescence recovery after photobleaching (FRAP) technique, especially for measuring fluorescence recovery after bleaching a specific area, but FRAM uses a drop coalescence instead of photobleaching dye molecules to induce a chemical potential gradient of dye molecules. Our technique has several advantages over FRAP: it only requires a fluorescence microscope rather than a confocal microscope equipped with high power lasers; it is essentially free from the selection of fluorescence dyes; and it has far more freedom to define the measured diffusion area. Furthermore, FRAM potentially provides a route for studying the mixing or inter-diffusion of two different surfactants, when the monolayers at a surface of droplet and at a flat air/water interface are prepared with different species, independently.
Einleitung
Phospholipide sind wichtige Bestandteile der Zellmembranen und die Membranen von Organellen, und die Fließfähigkeit dieser Membranschichten oft auf Zellfunktionen durch Veränderung der Aktivität von Membranproteinen 1-3. B. Membran Lipidhomöostase durch Regulieren Membranfluidität, die von Membranproteinen detektiert wird erreicht, und ein ungewöhnlich hohes Fließvermögen verursacht schwere Krankheiten, wie Fettleber und Cholestase 4. Zusätzlich Fluidität einer Phospholipidschicht an der Luft-Fluid-Grenzfläche Alveolen hat wichtige Auswirkungen auf seine Funktionen. Hohe Fluidität des Lungensurfactant Phospholipidschicht erleichtert Ausbreiten der Schicht während der Inhalation, während eine geringe Fließfähigkeit ermöglicht die Schicht in den Alveolen während der Ausatmung 5,6 bleiben. Es ist daher wichtig, die Fließfähigkeit der Phospholipidschichten abzuschätzen, ihre Rollen zu verstehen.
_content "> ein direktes Maß für die Fließfähigkeit ist, die Viskosität und die Viskosität der Phospholipidschichten wurde durch die Verwendung von Mikrometergröße Kolloide 7, magnetische Nadeln 8,9 und magnetische Mikrotasten 6,10,11 gemessen. Diese Techniken sind relativ steifen Folien begrenzt und kann nicht weniger viskose Filmen zu messen. In solchen Fällen wäre Diffusivität eine Alternative zur Fluidität Phospholipidschichten quantifizieren. Seit mehreren Jahrzehnten wurden eine Vielzahl von Techniken, um die Diffusionseigenschaften der Phospholipidschichten messen entwickelt, wie Fluoreszenz Abschreckverfahren 12, gepulster Feldgradient NMR 13 und die Fluoreszenzkorrelationsspektroskopie (FCS) 14. Eine der repräsentativen Methoden fluorescence recovery after photo (FRAP) 15,16. Aufgrund der Einfachheit des Messverfahrens und der damit verbundenen Theorien, mehrere Studien über die Diffusionseigenschaften Phospholipidschichten wurden durchgeführt unter Verwendung FRAP 17-19. Allerdings FRAP erfordert in der Regel eine teure konfokalen Mikroskop Setup mit einem Hochleistungslaser.Hier präsentieren wir eine neue Technik, um die laterale Diffusion von Phospholipid-Monoschichten, als Fluoreszenz bezeichnet Erholung nach der Zusammenführung (FRAM) zu messen. Der wesentliche Unterschied zwischen FRAP und FRAM ist, dass die Photobleichschritt wird durch das Zusammenwachsen von Tropfen ersetzt. Zusammenführen eines Tröpfchens durch nicht-Fluoreszenz-Monoschicht abgedeckt auf eine fluoreszenzmarkierte flache Monoschicht hinterlässt einen kreisförmigen dunklen Fleck auf einem hellen flachen Monoschicht, wodurch die Einrichtung des gleichen Anfangszustand mit dem Photobleichschritt. Wir beobachten dann die Fluoreszenz-Erholung in den dunklen Fleck mit der Zeit, um die laterale Diffusionsfähigkeit zu messen. Diese neue "Bleichen" Schritt Tropfenkoaleszenz bietet erhebliche Vorteile gegenüber FRAP: FRAM erfordert nur eine Fluoreszenzmikroskop anstatt eines teuren konfokalen Mikroskop mit einem Hochleistungslaser, die für FRAP notwendig ist. ichn Darüber hinaus hat FRAM eine breite Auswahl von Fluoreszenzfarbstoffen, da sie nicht die Photobleichprozess einzubeziehen. Schließlich können die zwei unterschiedlichen Monoschichten ein Tröpfchen Monoschicht und einer flachen Monoschicht können unabhängig hergestellt werden, so dass die Interdiffusion zu messen, wobei FRAP misst nur die Selbstdiffusion von Monoschichten.
FRAM bietet eine breite Palette von Diffusionsmessungen von hochviskosen Materialien auf nahezu reibungsfreie Materialien. Prinzipiell kann FRAM die maximale Diffusionsvermögen von 10 6 & mgr; m 2 / sec, die vergleichbar ist mit existierenden Techniken zu messen, wenn die Diffusion während der Zeit für den Abfall Koaleszenzprozeß (~ 10 ms), tritt über die Fläche 100 um 100 um. Darüber hinaus kann langsamen Diffusionsprozesses leicht gemessen werden, es sei denn Monoschichten sind fest. FRAM kann für beliebige Arten von oberflächenaktiven Materialien, solange geeignete fluoreszenzmarkierten Molekülen zur Verfügung stehen werden.
Protokoll
Achtung: Siehe Sicherheitsdatenblätter (MSDS) vor der Verwendung von Aceton und Chloroform, die krebserregend sind.
1. Herstellung von Phospholipidschicht an einer Wohnung Luft-Wasser-
- Bildung einer Phospholipidschicht
- Herstellung einer Phospholipidlösung
- Reinigen Sie eine 4 ml mit einem Polytetrafluorethylen Kappe mit Aceton, Ethanol und entionisiertem Wasser mindestens dreimal Fläschchen, und blasen Stickstoffgas gründlich in das Fläschchen, um Wasser zu entfernen.
- Man löst 1 mg Phospholipid (zB Dioleoylphosphatidylcholin, DOPC) auf 1 ml Chloroform in dem Fläschchen auf 1 mg / ml Konzentration zu erhalten. Führen Sie dieses Verfahren in einem Abzug für die Sicherheit. Verwenden Sie niedrigere oder höhere Konzentrationen von Phospholipid-Lösung, falls erforderlich.
- Farbstoff hinzuzufügen markierte Phospholipide (beispielsweise Rhodamin Dipalmitoylphosphatidylethanolamin, Rhodamin DPPE) mit weniger als 1 Mol-% des Phospholipids solution, um die Phospholipidschicht mit einem Fluoreszenzmikroskop sichtbar zu machen. Führen Sie dieses Verfahren in einem Abzug für die Sicherheit.
- Wickeln Sie das Fläschchen mit einem Polytetrafluorethylen-Band auf Lösungsmittelverdampfung zu verhindern, und lagern Sie die Probe in einem Gefrierschrank bei -20 ° C.
- Abscheidung von Phospholipiden auf die Luft-Wasser-Grenz
- Reinigen einer Petrischale (55 mm Durchmesser und 12 mm Höhe) mit Ethanol und entionisiertem Wasser mindestens dreimal.
- Füllen Sie die Petrischale mit 10 ml VE-Wasser, um ein Luft-Wasser-Grenzfläche zu schaffen.
- Verteilt einige Mikroliter der Phospholipid-Lösung mit einer Mikrospritze auf ein sauberes Schnittstelle, um die gewünschte Flächenpressung zu erreichen, und eine Wartezeit von 30 min vollständig vor tut das Experiment verdampfe das Lösungsmittel.
Hinweis: Ein Langmuir-Trog kann anstelle einer Petrischale verwendet werden, wenn eine genaue Steuerung der Oberflächendruck erforderlich ist.
- Herstellung einer Phospholipidlösung
- Sun-Schnittstelle Druckmessung
- Messen Sie die Oberflächendruck des Phospholipid-Monoschicht mit einer Wilhelmy-Platte Tensiometer. Warten Sie mindestens 30 Minuten zu bekommen, das Filterpapier benetzt genug, wenn Filterpapier wird als ein Wilhelmy-Platte verwendet. Die ausführliche Protokoll ist in Kuhn et al. 20.
- Einstellen der abgeschiedenen Menge des Phospholipid um den Oberflächendruck genau zu steuern. In 4 ul der DOPC-Lösung (1 mg / ml) auf die 30,25 cm 2 -Bereich der Schnittstelle, wenn ~ 5 mN / m der Oberflächendruck erforderlich ist.
Hinweis: Wenn das Filterpapier nicht vollständig benetzt werden, ändert Oberflächendruck drastisch während der ersten 30 min des Versuchs aufgrund der Gewichtsänderung des Filterpapiers.
- Minimierung der Konvektionsströmung der Mono
- Verwenden Sie eine kegelförmige Vorrichtung, die eine 3 mm Reservoir mit zwei dünnen Kanälen enthält, zu einem großen Teil von der Petrischale verbunden ist, um die konvektive Strömung des zu unterdrückendie Monoschicht, die Morphologie Bildgebung und Oberflächendruckmessung stören können.
- Achten Sie darauf, die Wasserstände zwischen der Innen- und Außenseite der Kegelform Gerät entsprechen, um sicherzustellen, dass Phospholipide frei bewegen über den gesamten Bereich vor dem Abscheiden Phospholipide auf die Luft-Wasser-Grenzfläche.
2. Herstellung von Phospholipid-Monoschicht an der gekrümmten Oberfläche eines Tropfens
- Verjüngende Prozess einer Glaskapillare mit Mikropipettenzieher
- Legen Sie eine Glaskapillare (od 1 mm, ID 0,78 mm, Länge 100 mm) auf einem Kapillarhalter einer Mikropipette Abzieher.
- Entwerfen Sie ein Programm zum Ziehen der Kapillaren mit entsprechenden Parameterwerte (Heat: Rampe, Ziehen: 60, Vel: 70 Verzögerung: 70 und Druck 200) und die Kapillaren mit dem konzipiertes Programm nach Herstellerprotokoll zu ziehen.
Anmerkung: Eine Kapillare Ende mit einigen Mikrometern Durchmesser ist erforderlich, um eine 100 & mgr; m-Tröpfchen durch appl bildenying einen Druck mit ~ 10 kPa. Wenn das Spitzenende der Kapillare zu gering ist, viel höheren Druck,> 600 kPa, ist erforderlich, um den Tropfen zu erhalten, während es schwierig ist, die Größe der Tröpfchen mit einem zu großen Kapillarspitze Ende zu steuern.
- Absorption von Phospholipiden auf der Tröpfchenoberfläche
Hinweis: Um eine Phospholipidschicht an der gekrümmten Schnittstelle eines Tröpfchens bilden, ein Phospholipid-Lösung ohne Farbstoff markierte Phospholipide verwendet, um einen Intensitätskontrast zu erhalten, gegen die flache Monoschicht nach Verfahren 1 hergestellt Zusätzlich beide Verfahren 2.2.1 und 2.2 0,2 sind hier zulässig. Wenn eine präzise Steuerung der Oberflächendruck an der Tropfenoberfläche notwendig ist, wird Verfahren 2.2.2 sehr zu empfehlen. Aber wenn nicht, Verfahren 2.2.1, die eine viel einfachere Weise als Verfahren 2.2.2, ist nützlich.- Beschichtungsverfahren von Phospholipiden an einem Spitzenende
- Reinigen einer Glasobjektträger unter Verwendung von Aceton, Ethanol und entionisiertem Wasser mindestens dreimal.
- Place den sich verjüngenden Kapillare auf einem gereinigten Glasobjektträger, und kippen Sie die Kapillare zur Erleichterung der Berührung der Glasobjektträger mit einem spitzen Ende.
- Fallen einige Tröpfchen von Phospholipid-Lösung (1 mg / ml) auf die Spitze einer Kapillare, die auf dem Glasträger mit einer Glasspritze angeklebt ist, und warten mindestens 30 min vollständig verdampfen des Lösungsmittels.
HINWEIS: Es wird empfohlen, die Spitze der Kapillare auf den Objektträger während des Verfahrens 2.2.1.3 haften, da der Umfang des Spitzenende zu klein ist, um das Tröpfchen der Phospholipide an der Endspitze nur durch Kapillarkraft zu halten.
- Herstellung eines Vesikellösung
- Reinigen Sie ein Fläschchen, und Wasser zu entfernen aus dem Fläschchen, wie in Verfahren 1.1.1.1 eingeführt.
- Trocknen Sie eine 2 ml Volumen von Phospholipid-Lösung (1 mg / ml), indem Stickstoffgas sanft und trocknet das Fläschchen für 1 h bei RT zu beseitigen alle verbleibenden Lösungsmittels. Führen Sie dieses Verfahren in einem Abzug für die Sicherheit.
- In 2ml VE-Wasser in das Fläschchen mit getrockneten Lipide, und Inkubation das Fläschchen in einem Ofen bei 60 ° C für 1 Stunde.
- Schütteln Sie die Ampulle mehrmals, und beschallen (HF-Frequenz: Bis zu 40 kHz, Leistung: 370 W) für 30 Minuten, um Vesikel zu erhalten.
- Zuführen Extrusion und Gefrier-Auftau-Prozesse, um monodisperse unilamellare Vesikel zu erhalten. Die ausführliche Protokoll zur Herstellung von Vesikeln in Mayer et al. 21 beschrieben.
Anmerkung: Oberflächendruck der Tröpfchengrenzfläche genau durch Einstellen der Wartezeit nach der Bildung der Tröpfchen, das monodisperse unilamellare Vesikel enthält gesteuert. Verwendung einer Pendant Drop Methode 22, ist es notwendig, die Änderung des Oberflächendrucks nach der Zeit vor tut das Experiment zu messen.
- Beschichtungsverfahren von Phospholipiden an einem Spitzenende
- Bildung eines Tröpfchens, das eine Phospholipidschicht an der gekrümmten Oberfläche enthält
- Füllen Sie das verjüngende Kapillare mit 10 ul entionisiertem Wasser aus procedure 2.2.1. Alternativ können Sie 10 ul der Vesikel-Lösung von Verfahren 2.2.2.
- Verbinden die Kapillare an einem automatisierten Mikro Injektor, um den Druck, um das Tröpfchen zu bilden.
- Halterung der Kapillare, die zu einem Mikro Injektor mit einem Mikromanipulator verbunden ist, um die Position der Kapillare genau zu steuern.
- Bereiten Sie eine Hellfeld-Mikroskop (Mikroskop 1, Objektiv: 10x NA 0,3) zur Abbildung der Seitenansicht der Kapillare mit einer CCD-Kamera. Mikroskop 1 ermöglicht somit die exakte Position des Tröpfchens entlang der z-Achse zu beobachten war und die Größe der Tröpfchen.
- Bewegen das Spitzenende zu einer Position, wo die Seitenansicht des vorderen Endes wird auch durch ein Mikroskop 1 visualisiert mit einem Mikromanipulator, und Anwendung einer variablen Druck (~ 100 hPa) mit dem Spitzenende der Kapillare, bis eine geeignete Größe (~ 100 & mgr; m im Durchmesser) von Tröpfchen gebildet.
Hinweis: Es wird empfohlen, automatisierte Mikro-Injektor und Mikromanipulator Nutzen seind, wenn eine Feinsteuerung der Tröpfchengröße und Ort des Tropfens erforderlich. Es ist auch möglich, eine manuelle Platte verwenden.
3. Imaging Fluorescence Recovery After Droplet Merging
Anmerkung: Die Grundprinzipien dieses Protokoll sind identisch zu denen des FRAP-Technik, mit Ausnahme der Tropfenkoaleszenz Prozess. Die detaillierten Protokoll und verwandte Theorien der FRAP sind in A. Lopez et al. 15 und D. Axelrod et al. 16.
- Überwachen und Steuern der Position des Tröpfchens
- Bereiten Sie ein inverses Mikroskop gesetzt (Mikroskop 2, Objektiv: 10x NA 0,3, Rohr Linse: Brennweite 17 cm), die sowohl eine Fluoreszenzmikroskop ermöglicht mit einer geeigneten Filtersatz für Rhodamin-DPPES (Anregung bei 560 nm, Emission bei 583 nm) und eine Hellfeld-Mikroskop. Verwenden Sie eine CCD-Kamera hier zur Visualisierung der Draufsichten auf die Tröpfchen mit einem Fluoreszenzmikroskop mOde und eine Hellfeld-Mikroskop-Modus.
- Bewegen des Tröpfchens mit einem Phospholipid mit einem flachen Luft Wasser-Grenzfläche entlang der Z-Achse überzogen, aber noch nicht das Tröpfchen verschmelzen unter Verwendung des Mikromanipulators. Verwenden Mikroskop 1 die Seitenansicht des Tröpfchens zu visualisieren.
- Lokalisieren das Tröpfchen in der Mitte in der Draufsicht des flachen Monoschicht unter Verwendung des Mikromanipulators. Verwenden Sie das Hellfeld-Mikroskop-Modus des Mikroskop 2 zur Draufsicht auf flachen Monolage zu visualisieren.
- Zusammenführung der Tröpfchen auf die flache Luft-Wasser-Grenzfläche
- Bewegen Sie den Tröpfchen weiter in Richtung der flachen Schnittstelle, bis der Tropfen geht auf die Schnittstelle, mit der Mikromanipulator. Wenn die Zusammenführungsprozess erfolgreich war, ein dunkler Bereich mit einer Kreisform, die durch einen weißen Hintergrund umgeben ist, wird unter Verwendung des Fluoreszenzmodus des Mikroskops 2 beobachtet.
- Notieren Sie sich die Reihe von Fluoreszenzbilder nach Zeit nach der Zusammenführung der Tröpfchen unter Verwendung der Fluoreszenz-Modus des Microsbewältigen 2. Verwenden Sie eine schnellere Bildrate als die Diffusionszeitskala der Monoschicht hier. In DOPC-Monoschicht, dauert es ein paar Minuten, um in die 200 & mgr; m-Dunkel-Bereich vollständig diffundieren.
4. Bestimmung der Diffusionskoeffizient durch Bildanalyse
Hinweis: Um aus einer Reihe von Bildern zu bestimmen, der Diffusionskoeffizient, individuelles Programm zur Bildanalyse aufgebaut wie unten beschrieben. Eine detaillierte Quellcode dieses Programms ist in JoVE Website.
- Nachweis von einem kreisförmigen Bereich von Interesse
- Detektion der Mitte der Region von Interesse
- Besorgen Sie sich eine Reihe von Fluoreszenzbilder, die während eines Wiederherstellungsprozesses, der einen kreisförmigen dunklen Bereich und einem weißen Hintergrund enthält aufgezeichnet worden sind, und legen Sie das erste Bild der Serie als ein Referenzbild. Hier ist R D der Radius des dunklen Bereich in einem Bezugsbild.
- Konvolut das Referenzbild mit einem weißen Kreis, diese Intensität gleichförmig über eine ganze Region. Verwenden Sie eingebettete Funktion namens 'CONV2' für die Faltung, wie in der Quellcode der maßgeschneiderte Programmzeile 124. Hier gezeigt wird, ist der Radius des weißen Kreises etwas kleiner als R D.
- Finden Sie eine Position, die einen Minimalwert in der Faltungsberechnung zeigt, und setzen Sie diese Position als Zentrum der Region von Interesse in dem Referenzbild.
- Bestimmen eines Radius der Region von Interesse
- Konvolut das Referenzbild mit einem weißen Kreis, die eine Mittelstellung, nach einem Verfahren 4.1 und gleichmäßige Intensität über eine ganze Region ermittelt enthält. Hier ist R S der Radius des weißen Kreises. Verwenden Iteration wie 'for' oder 'while' mit Gleichung eines Kreises um den weißen Kreis, wie in den Quellcode des Anwenderprogrammzeile 102 bis 109 dargestellt werden.
- Konvolut das Referenzbild mit einem anderen weißen Kreis, die eine etwas hatgrößeren Radius (5% -10%), R L, als R S. Verwenden Sie dieselbe Methode mit Verfahren 4.1.2.1, um den Kreis, wie in der Quellcode der maßgeschneiderte Programmzeile 113 bis 120 dargestellt werden.
- Besorgen Sie sich die Wertdifferenz zwischen den beiden Faltungsberechnungen 4.1.2.1 und 4.1.2.2.
- Wiederholen der vorstehenden Verfahren von R S = R D / 2 R S = 2R D, durch Erhöhung sowohl der R S und R L mit einem Pixel-Ebene. Stellen Sie eine Iteration, die gesamten Quellcodes von Verfahren 4.1.2.1 enthält, um 4.1.2.3 zu wiederholen.
- Finden Sie den Radius R S, die die maximale Wertunterschied zwischen den beiden Faltungsberechnungen zeigt. Verwenden Sie eingebettete Funktion mit dem Namen 'max', um den Radius zu finden gibt die maximale Differenz der Werte wie in den Quellcode des Anwenderprogrammzeile 148 bis 149. gezeigt Diese Rs zeigt somit an den Radius des dunklen Bereich in dem Referenzbild.
- Detektion der Mitte der Region von Interesse
- Berechnung einer Bruchstärke
- Legen Sie einen Kreis, der eine Mittelposition und einen Radius von 4,1 Verfahren als eine Region von Interesse bestimmt, enthält.
- Berechnen der durchschnittlichen Intensität der dem interessierenden Bereich in einer Reihe von Fluoreszenzbildern nach der Zeit. Convolute jedes Rahmens mit dem Bereich von Interesse und teile es durch Fläche des Bereichs von Interesse, den mittleren Intensitäts berechnen. Die Einzelheiten sind in den Quellcode des Anwenderprogramms, die in JoVE Website ist.
- Berechnen eines Bruchintensität, definiert als die nachstehende Gleichung, wobei F (t) ist die mittlere Intensität im Kreis, der einen interessierenden Bereich nach der Zeit, M i der Ausgangsintensität in dem Kreis und F o die Intensität einen weißen Hintergrund.
f (t) = (F (t) - F i) / (F o - F i) (Gleichung 1).
- Einbau der fractional Intensität FRAP Theorie
- Den Bruch Intensität, mit der folgenden Gleichung, wo τ ist eine charakteristische Diffusionszeit und I 0, I 1 sind Besselfunktionen modifiziert, mit einem passenden Programm und erhalten τ
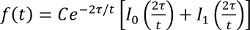 (Gleichung 2).
(Gleichung 2). - Erhalten einen Diffusionskoeffizienten basierend auf der Beziehung, τ = eine 2/4 D, wobei D der Diffusionskoeffizient und a der Radius des dunklen Bereich.
Anmerkung: Während des Anpassungsprozesses, ist es möglich, den Bruchintensitätsprofil entlang einer Zeitachse zu verschieben, wenn der Wiederherstellungsvorgang bereits begonnen hat, vor dem Aufzeichnen der Bilder.
- Den Bruch Intensität, mit der folgenden Gleichung, wo τ ist eine charakteristische Diffusionszeit und I 0, I 1 sind Besselfunktionen modifiziert, mit einem passenden Programm und erhalten τ
Ergebnisse
Eine Serie von Fluoreszenzbilder wurden mit der Zeit während der Wiederherstellung nach dem Zusammenführen ein Tröpfchen mit einer DOPC Monoschicht beschichtet auf eine flache DOPC Monoschicht erhalten wurde, wie in Figur 1 aufgeführt. Die DOPC Monoschicht an der flachen Luft-Wasser-Grenzfläche wurde mit geringen Mengen von dotiertem Rhodamin-DPPE und dieses somit wurde es möglich, einen Hintergrund mit einer hellen Farbe und einem dunklen Bereich neu an das flache Schnittstelle hinzugefügt visualisieren. Es wurde ein Recovery-Prozess auf 23 mN / m fester Oberflächendrucks beobachtet. Eine Anpassung von Gleichung 1, um die Änderung der Bruchintensität nach der Zeit ist in Abbildung 2 dargestellt. Der R 2 -Wert von diesem Sitz ist 0,999 und dieser Sitz noch funktioniert gut, auch bei niedrigeren oder höheren Flächenpressungen. Der Diffusionskoeffizient der DOPC-Monoschicht auf dieser fit betrug 27,54 & mgr; m 2 / s bei 23 mN / m Oberflächendruck.
Zur weiteren Validierung des FRAM, Diffusionskoeffizienten des DOPC und Dipalmitoylphosphatidylcholin (DPPC) Monolayer wurden nach Oberflächendruck gemessen. Wie in 3 gezeigt ist, erfasst FRAM die rasche Abnahme der Diffusionskoeffizient des DPPC-Monoschicht auf ~ 9 mN / m Oberflächendruck, wobei eine LC (Flüssigkeit kondensiert) - LE (flüssig expandiert) Phasenübergang 10, und die Werte von Diffusionskoeffizienten sind ebenfalls gut mit den zuvor Messungen durch Peters et al. 19 vereinbart. Zusätzlich wurde ein exponentielles Abklingen des Diffusionskoeffizienten der Oberflächendruck in der DOPC Monoschicht beobachtet wird, und diese Tendenz ist nahezu identisch mit dem von Caruso et al. 12 gemessen.
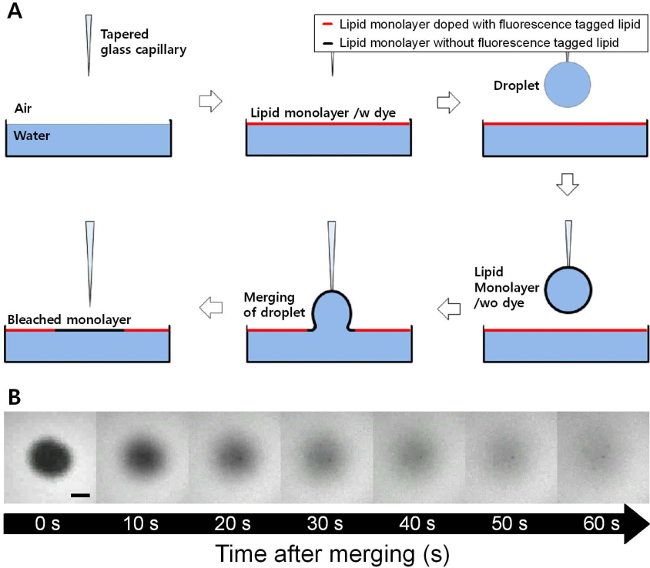
Abbildung 1. (A) Schematische Darstellung des FRAM (Fluoreszenz-Erholung nach dem Zusammenführen) -Technik. Wie der Lippeid Monoschicht beschichtet Tröpfchen auf flache Luft-Wasser-Grenzfläche zusammengeführt, die Lipidmonoschicht ohne Fluoreszenz-markierten Lipid in flachen Leuchtstofflipidmonoschicht eingelegt. (B) Fluoreszenzmikroskop Bilder mit der Zeit bei der Wiederherstellung einer DOPC-Monoschicht auf 23 mN / m der Oberflächendruck (Maßstab = 100 & mgr; m). Der dunkle Bereich des DOPC-Monoschicht vollständig durch den Diffusionsprozess innerhalb weniger Minuten wiederhergestellt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
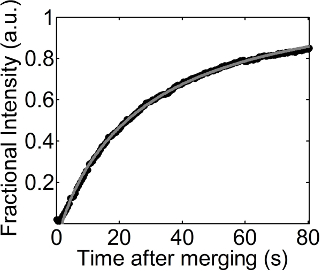
Abbildung 2. Fractional Intensität als Funktion der Zeit. Schwarze Kreise und die graue gestrichelte Linie zeigen die Werte für Spitzenintensitäten von Bildanalyse (Verfahren 4.1 und 4.2) und die Anpassung von Gleichung 1 zu den Bruch Intensitäten mit der Zeit erhalten wird,in Verfahren 4.3 gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
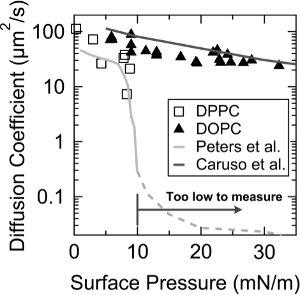
Abbildung 3. Diffusionskoeffizienten von DOPC (Dreieck) und DPPC (leeres Quadrat) Monoschichten als Funktion der Flächenpressung. Die Leitungen mit dem hellen grauen Farbe und mit der dunkelgrauen Farbe geben die Werte des Diffusionskoeffizienten zuvor von Peters et al. und Caruso et al., auf. Diese Zahl wurde von Jeong et al. 23 geändert. Mit freundlicher Genehmigung von Jeong et al. Langmuir. 30 (48), 14.369-14.374 nachgedruckt. Copyright 2014 American Chemical Society. Bitte hier klickene, um eine größere Version dieser Figur zu sehen.
Diskussion
FRAM teilt eine Menge von grundlegenden Prinzipien mit FRAP, vor allem für die Messung der Fluoreszenz Erholung nach dem Bleichen einen bestimmten Bereich, aber FRAM verwendet einen Prozess der Zusammenführung ein Tröpfchen auf die flache Schnittstelle, einen gebleichten Bereich zu bilden, anstelle der Anwendung ein intensives Licht. Der Zusammenführungsprozess ist somit wichtigste Schritt im FRAM und vor allem die Form der dunklen Fleck auf dem flachen Monoschicht nach dem Zusammenführen eines Tröpfchens bestimmt die Genauigkeit der Diffusionsmessung. Insbesondere auf der Grundlage einer aktuellen Methode, wir nur den Kreis mit einem Radius R festgelegt als ein Bereich von Interesse, um die durchschnittliche Intensität der dunklen Fleck, in Verfahren 4 gezeigt zu berechnen, und wenn es eine zu starke Abweichung von der Kreisform, dies würde die genaue Messung des Diffusionskoeffizienten stören. Daher ist es notwendig, einen kreisförmigen dunklen Bereich zu erhalten, aber nicht kreisförmigen Formen werden manchmal aus verschiedenen Gründen gebildet. Erstens, wenn es eine konvektive Strömung in dem Haustierri Schale wird die Form des dunklen Bereichs entlang der Strömungsrichtung langgestreckt ist. Wie in Verfahren 1.3 erwähnt, hilft eine Kegelform Gerät, um die konvektive Strömung zu unterdrücken, und diese Dehnung minimiert werden würde. Zweitens, wenn das Spitzenende der Kapillare die flache Schnittstelle während eines Zusammenführungsprozess berührt, der dunkle Bereich ist mit einer Vielzahl von Formen gebildet, da die Kapillare Ende der Zusammenführungsprozess unterbricht. Mit dem Erwerb einer Tröpfchen, die nur hängen vom Ende der Kapillare, kann diese Unterbrechung verhindert werden. Insbesondere eine Hydrophobierung der Kapillare unterstützt die Tröpfchen am Ende der Kapillare sitzt. Daher obigen Probleme Schießereien und Modifikationen ermöglichen uns, Diffusionseigenschaften genauer zu messen.
Dieses gut Störungsbehebung Verfahren erlaubt somit FRAM, mehrere wesentliche Vorteile gegenüber FRAP haben. Zuerst FRAM erfordert einfachere Geräte im Vergleich zum FRAP. Für FRAM, die ausreicht, um eine einfache Fluoreszenz Mikros benutzen ist esgerecht zu werden, statt eines teuren konfokalen Mikroskop mit einem Hochleistungslaser, dessen Wellenlänge muß mit dem Absorptionsspektrum des Farbstoffes zu treffen. Darüber hinaus ist es notwendig, eine zusätzliche Vorrichtung verwenden, um die Größe auf dem gebleichten Bereich im FRAP einzustellen, während der FRAM steuert die Größe der Fläche, durch Einstellen der Größe der Tröpfchen oder der Oberflächendruck an der Tropfenoberfläche. Zweitens ist es möglich, verschiedene Arten von Farbstoffen in FRAM verwenden. FRAP verwendet nur Farbstoffmoleküle, deren Bleichverfahren ist viel schneller als die Diffusionsprozesses. Wenn während des Bleichprozesses die Diffusion der Farbstoffe auftritt, ist es schwierig, die Diffusionseigenschaft genau zu schätzen. Der FRAM, jedoch nicht ein Verfahren zum Bleichen von Farbstoffen erfordern, und dies ermöglicht somit die Verwendung von verschiedenen Arten von Farbstoffen in der Fluoreszenz-Bildgebungs. Darüber hinaus ist die FRAP erfordert zusätzliche Hochleistungslasern und Filtersätze, um die Farbstoffspezies verändern, während es nur notwendig ist, um die Filtersätze in der FRAM ersetzen. EndlichDa die Monoschichten an der Tropfenoberfläche und der ebenen Schnittstelle kann unabhängig ausgebildet werden, wodurch die Untersuchung von Interdiffusion oder Vermischung zwischen zwei Lipid-Monoschichten durch Zusammenführen A-Typ Monoschicht B-Typ-Monoschicht, während die FRAP misst nur die Selbstdiffusion einer Monoschicht.
Trotz dieser Vorteile kann der Prozess der Zusammenführung ein Tröpfchen auf eine flache Luft-Wasser-Grenzfläche diese Technik möglicherweise begrenzen auf mehrere Fragen, die von Bedeutung sein könnten, wie beispielsweise ein Oberflächendruck Missverhältnis zwischen den beiden Monoschichten, die Zeitskala der Zusammenführungsprozess und eine Erhöhung des Oberflächendrucks des flachen Monoschicht nach dem Zusammenführen Tröpfchen. Diese Probleme jedoch nicht signifikant auf die Diffusionsmessung aus den folgenden Gründen. Erstens, auch wenn die Oberflächendrücke an den beiden unterschiedlichen Monoschichten sind sehr unterschiedlich, eine Gleichgewichtseinstellung in einem sehr frühen Stadium bei der Wiederherstellung abgeschlossen ist. Wenn beispielsweise ter Oberflächendruck der Monoschicht an der Tropfenoberfläche ist höher als der der Monoschicht an der flachen Luft-Wasser-Grenzfläche, dehnt der dunkle Bereich, bis der Oberflächendruck ausgleicht. Da dieses Verfahren innerhalb von 10 ms beendet ist, wird der Oberflächendruck equilibriert, bevor es beeinflusst die Diffusion. Zweitens, wenn der Zeitmaßstab der Zusammenführungsprozess schnell genug ist, es nicht die Diffusionsmessung begrenzen überhaupt. Glücklicherweise ist eine typische Zusammenführungsprozess auch innerhalb von 10 ms abgeschlossen. Schließlich ist sogar mehrere Verschmelzen der Tröpfchen auf die flache Grenzfläche nicht den Oberflächendruck, da die Oberfläche des Trogs erhöht wesentlich größer ist als die Oberfläche des Tropfens. Entsprechend den Größen der Mulde und die Tröpfchen in dem Protokoll beschrieben, ist die Fläche pro Molekül erhöht weniger als 0,015% durch Zusammenführen eines Tröpfchens. Dementsprechend ist die Erhöhung der Oberflächendruck aufgrund der Änderung der Fläche pro Molekül weniger als 0,1%, das ist negligible weil sie viel kleiner als die typischen Fehler im Oberflächendruck, wie von Wilhelmy-Platten-Tensiometers gemessen.
Zusammenfassend haben wir eine neue Methode, um die laterale Diffusion Eigenschaft eines Phospholipid-Monoschicht durch die Zusammenlegung eines Tröpfchens Monoschicht auf der flachen Schnittstelle zu messen. Diese Technik erfordert eine relativ einfache Ausrüstung und ermöglicht auch die Verwendung von verschiedenen Arten von Farbstoffspezies. Der FRAM ist daher potentiell geeignet für Diffusions Messung einer oberflächenaktiven Mitteln, einschließlich Phospholipide, Blockcopolymere, Proteine und auch Nanopartikel in einem Flüssig-Flüssig-Grenzfläche. Darüber hinaus erwarten wir, dass die FRAM bietet einen neuen Weg, um die Interdiffusion oder Vermischung zwischen zwei verschiedenen oberflächenaktiven Mittel zu untersuchen.
Offenlegungen
The authors declare no competing financial interest.
Danksagungen
Diese Arbeit wird durch die KAIST finanzierten K-Tal RED & B-Projekt für 2014 und der Basic Science-Research-Programm durch die National Research Foundation of Korea (NRF- 2012R1A6A3A040395, NRF-2013R1A1A2057708, NRF- 2012R1A1A1011023) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetone | OCI corporation | Acetone 3.8L Extra Pure | Purity: ≥ 99.5%, Please consult material safety data sheets (MSDS) before use. |
| Ethanol | OCI corporation | Ethanol 3.8L Extra Pure | Purity: ≥ 94%, Please consult material safety data sheets (MSDS) before use. |
| Dioleoylphosphatidylcholine, DOPC | Avanti Polar Lipids | 850375C | Please consult material safety data sheets (MSDS) before use. Chloroform is carcinogenic. |
| Chloroform | LiChrosolv | Chloroform ultrapure (A3633) | Purity: ≥ 99.8%, Please consult material safety data sheets (MSDS) before use. Carcinogenic |
| Rhodamine DPPE | Avanti Polar Lipids | 810158C, 810158P | Avoid direct light exposure to prevent photobleaching |
| Wilhelmy plate tensiometer | R&K ultrathin organic film technology | Wilhelmy tensiometer | http://www.rieglerkirstein.de/index.htm |
| Micropipette puller | Sutter instrument | P-1000 | |
| Micro-injector | Eppendorf | Femtojet | |
| Micromanipulator | Eppendorf | Micromanipulator 5171 | |
| Microscope 1 | Objective lens: Olympus | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3 |
| Microscope 2 | Objective lens: Olympus, Tube lens: Thorlabs | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3, tube lens: focal length 17 cm |
| CCD for Microscope 1 | Jai | CV 950 camera | |
| CCD for Microscope 2 | Andor | iXon3 EMCCD | |
| Filter set | Chroma technology | Catalog Set 49004: ET545, T565, ET605 | Prepare suitable for dye molecules |
| Sonicator | DAIHAN Scientific | Wiseclean WUC-D06H |
Referenzen
- Van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nat. Rev. Mol. Cell Biol. 9 (2), 112-124 (2008).
- Christon, R., Even, V., Daveloose, D., Léger, C. L., Viret, J. Modification of fluidity and lipid—protein relationships in pig intestinal brush-border membrane by dietary essential fatty acid deficiency. Biochim. Biophys. Acta - Biomembr. 980 (1), 77-84 (1989).
- Stubbs, C. D., Smith, A. D. The modification of mammalian membrane polyunsaturated fatty acid composition in relation to membrane fluidity and function. Biochim. Biophys. Acta - Rev. Biomembr. 779 (1), 89-137 (1984).
- Holthuis, J. C. M., Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510 (7503), 48-57 (2014).
- Alonso, C., Waring, A., Zasadzinski, J. A. Keeping lung surfactant where it belongs: protein regulation of two-dimensional viscosity. Biophys. J. 89 (1), 266-273 (2005).
- Kim, K., Choi, S. Q., Zell, Z. a., Squires, T. M., Zasadzinski, J. A. Effect of cholesterol nanodomains on monolayer morphology and dynamics. Proc. Natl. Acad. Sci. (U. S. A.). 110 (33), E3054-E3060 (2013).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring Lipid Membrane Viscosity Using Rotational and Translational Probe Diffusion. Phys. Rev. Letters. 112 (18), 188101 (2014).
- Ding, J., Warriner, H. E., Zasadzinski, J. a., Schwartz, D. K. Magnetic needle viscometer for Langmuir monolayers. Langmuir. 18 (13), 2800-2806 (2002).
- Dhar, P., Cao, Y., Fischer, T. M., Zasadzinski, J. A. Active interfacial shear microrheology of aging protein films. Phys. Rev. Letters. 104 (1), 1-4 (2010).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Choi, S. Q., Steltenkamp, S., Zasadzinski, J. A., Squires, T. M. Active microrheology and simultaneous visualization of sheared phospholipid monolayers. Nature Commun. 2 (5), 312 (2011).
- Caruso, F., et al. Determination of lateral diffusion coefficients in air-water monolayers by fluorescence quenching measurements. J. Am. Chem. Soc. 113 (16), 4838-4843 (1991).
- Filippov, A., Orädd, G., Lindblom, G. The effect of cholesterol on the lateral diffusion of phospholipids in oriented bilayers. Biophys. J. 84 (5), 3079-3086 (2003).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36 (3), 176-182 (1999).
- Lopez, A., Dupou, L., Altibelli, A., Trotard, J., Tocanne, J. F. Fluorescence recovery after photobleaching (FRAP) experiments under conditions of uniform disk illumination. Critical comparison of analytical solutions, and a new mathematical method for calculation of diffusion coefficient D. Biophys. J. 53 (6), 963-970 (1988).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Vaz, W. L., Clegg, R. M., Hallmann, D. Translational diffusion of lipids in liquid crystalline phase phosphatidylcholine multibilayers. A comparison of experiment with theory. Biochemistry. 24 (3), 781-786 (1985).
- Wu, E. S., Jacobson, K., Papahadjopoulos, D. Lateral diffusion in phospholipid multibilayers measured by fluorescence recovery after photobleaching. Biochemistry. 16 (17), 3836-3841 (1977).
- Peters, R., Beck, K. Translational diffusion in phospholipid monolayers measured by fluorescence microphotolysis. Proc. Natl. Acad. Sci. (U. S. A.). 80 (23), 7183-7187 (1983).
- Kuhn, H., Mobius, D., Bucher, H., Crawley, J. N., et al. . Physical Methods of Chemistry. 1, Part 3B, 651-653 (1972).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta - Biomembr. 858 (1), 161-168 (1986).
- Rotenberg, Y., Boruvka, L., Neumann, A. Determination of surface tension and contact angle from the shapes of axisymmetric fluid interfaces. J. Colloid Interface Sci. 93 (5), 169-183 (1983).
- Jeong, D. W., Kim, K., Lee, S., Choi, M. C., Choi, S. Q. Fluorescence recovery after merging a surfactant-covered droplet: a novel technique to measure the diffusion of phospholipid monolayers at fluid/fluid interfaces. Langmuir. 30 (48), 14369-14374 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten