Method Article
שחזור הקרינה לאחר מיזוג אגל למדוד דיפוזיה דו ממדים של חד שכבתי פוספוליפידים
In This Article
Summary
We present a new technique to measure the lateral diffusion of a surface active species at the fluid-fluid interface by merging a droplet monolayer onto a flat monolayer.
Abstract
We introduce a new method to measure the lateral diffusivity of a surfactant monolayer at the fluid-fluid interface, called fluorescence recovery after merging (FRAM). FRAM adopts the same principles as the fluorescence recovery after photobleaching (FRAP) technique, especially for measuring fluorescence recovery after bleaching a specific area, but FRAM uses a drop coalescence instead of photobleaching dye molecules to induce a chemical potential gradient of dye molecules. Our technique has several advantages over FRAP: it only requires a fluorescence microscope rather than a confocal microscope equipped with high power lasers; it is essentially free from the selection of fluorescence dyes; and it has far more freedom to define the measured diffusion area. Furthermore, FRAM potentially provides a route for studying the mixing or inter-diffusion of two different surfactants, when the monolayers at a surface of droplet and at a flat air/water interface are prepared with different species, independently.
Introduction
פוספוליפידים הם רכיבים עיקריים של קרום תא והקרומים של האברונים, ואת הנזילות של שכבות קרום אלה לעתים קרובות משפיעים על תפקודים תאיים על ידי שינוי הפעילות של חלבונים בממברנה 1 - 3. לדוגמא, קרום הומאוסטזיס שומנים מושגת על ידי ויסות זרימת קרום, שהוא זוהה על ידי חלבונים בממברנה, ורמה חריגה של נזילות גורמת למחלות קשות, כגון steatosis וcholestasis 4 בכבד. בנוסף, יש נזילות של monolayer פוספוליפידים בממשק נוזל אוויר alveoli השלכות חשובות בפונקציות שלה. נזילות גבוהות של monolayer פוספוליפידים שטח הריאה מקלות הפצה של השכבה בשאיפה, ואילו נזילות נמוכות מאפשרת השכבה להישאר בתוך alveoli במהלך הנשיפה 5,6. מכיוון שכך, חשוב להעריך את הנזילות של שכבות פוספוליפידים להבין את תפקידם.
_content "> מדידה ישירה של הנזילות היא צמיגות, והצמיגות של שכבות פוספוליפידים כבר נמדדה באמצעות קולואידים בגודל מיקרון 7, מחטים מגנטיות 8,9, ומיקרו-כפתורים מגנטיים 6,10,11. עם זאת, טכניקות אלה מוגבלים לסרטים קשיחים יחסית, ולא יכול למדוד סרטים פחות צמיגים. במקרים כאלה, diffusivity יהיה אלטרנטיבה ללכמת נזילות של שכבות פוספוליפידים. במשך כמה עשורים, מגוון של טכניקות כדי למדוד את תכונות דיפוזיה של שכבות פוספוליפידים פותחו, כגון שיטת הקרינה מרווה 12, NMR שיפוע השדה פעמו 13, וספקטרוסקופיה מתאם הקרינה (FCS) 14. אחת השיטות מייצגות ביותר היא התאוששות הקרינה לאחר photobleaching (FRAP) 15,16. בשל הפשטות של הליך המדידה וקשור תאוריות, כמה מחקרים על תכונות דיפוזיה של שכבות פוספוליפידים בוצעו באמצעות FRAP 17-19. עם זאת, בדרך כלל דורש FRAP התקנת מיקרוסקופ confocal יקר עם לייזר בעצמה גבוהה.כאן, אנו מציגים טכניקה חדשה למדידת דיפוזיה לרוחב של monolayers פוספוליפידים, כפי שכונה התאוששות הקרינה לאחר המיזוג (פראם). ההבדל העיקרי בין FRAP ופראם הוא שצעד photobleaching הוא הוחלף על ידי גיבוש הירידה. מיזוג אגל מכוסה על ידי monolayer אינו הקרינה על monolayer השטוח שכותרתו fluorescently משאיר כתם כהה מעגלי על monolayer השטוח בהיר, ולכן הגדרה אותו מצב ראשוני עם צעד photobleaching. לאחר מכן, אנו צופים בהתאוששות הקרינה בכתם הכהה עם זמן למדוד את diffusivity לרוחב. צעד זה חדש "הלבנה" על ידי גיבוש ירידה מספק יתרונות משמעותיים על פני FRAP: פראם דורש מיקרוסקופ פלואורסצנטי ולא מיקרוסקופ confocal יקר עם לייזר בהספק גבוה שיש צורך לFRAP בלבד. אניבנוסף n, יש פראם מבחר רחב של צבעי הקרינה שכן הוא אינו כרוך בתהליך photobleaching. לבסוף, שני monolayers שונה, monolayer אגל וmonolayer שטוח, ניתן להכין באופן עצמאי, ובכך מאפשרים interdiffusion להימדד, בעוד FRAP מודד את דיפוזיה העצמית של monolayers בלבד.
פראם מספק מגוון רחב של מדידות דיפוזיה מחומרים צמיגים מאוד לחומרים כמעט בלתי צמיגים. בעיקרון, פראם ניתן למדוד את diffusivity המרבי של 10 מיקרומטר 6 2 / sec, אשר ניתן להשוות טכניקות קיימות, כאשר מתרחשת דיפוזיה על פני השטח של 100 מיקרומטר על ידי 100 מיקרומטר בזמן לתהליך גיבוש ירידה (~ 10 אלפיות השנייה). יתר על כן, ניתן למדוד תהליך דיפוזיה איטי בקלות, אלא אם כן monolayers הוא מוצקים. פראם יכול לשמש לכל מיני סוגים של חומרים פעילים שטח, כל עוד מולקולות מתויגות fluorescently מתאימים זמינות.
Protocol
זהירות: עיין בגיליונות נתוני בטיחות חומרים (MSDS) לפני השימוש באצטון וכלורופורם שהם מסרטנים.
1. הכנת פוספוליפידים חד שכבתי בשטוח אוויר-מים ממשק
- היווצרות של monolayer פוספוליפידים
- הכנת פתרון פוספוליפידים
- נקה 4 מיליליטר בקבוקון עם כובע polytetrafluoroethylene המצופה באמצעות אצטון, אתנול, ומים ללא יונים לפחות שלוש פעמים, ולפוצץ גז חנקן ביסודיות לתוך הבקבוקון להיפטר ממים.
- ממיסים 1 מ"ג של פוספוליפידים (למשל, dioleoylphosphatidylcholine, dOPC) עד 1 מיליליטר של כלורופורם בבקבוקון להשיג 1 מ"ג / מיליליטר של ריכוז. לבצע הליך זה במנדף לבטיחות. השתמש בריכוזים נמוכים או גבוהים של פתרון פוספוליפידים במידת צורך.
- להוסיף צבע מתויג פוספוליפידים (למשל, dipalmitoylphosphatidylethanolamine Rhodamine, Rhodamine DPPE) עם% מול פחות מ 1 של solu פוספוליפידיםtion, כדי להמחיש את monolayer פוספוליפידים עם מיקרוסקופ פלואורסצנטי. לבצע הליך זה במנדף לבטיחות.
- עטוף את הבקבוקון עם קלטת polytetrafluoroethylene כדי למנוע אידוי ממס, ולאחסן את המדגם במקפיא ב -20 ° C.
- בתצהיר של פוספוליפידים על ממשק אוויר המים
- לנקות צלחת פטרי (55 מ"מ קוטר 12 מ"מ וגובה) עם אתנול, ומים ללא יונים לפחות שלוש פעמים.
- מלא את צלחת פטרי עם 10 מיליליטר של מים deionized כדי ליצור ממשק אוויר מים.
- מורחים כמה מיקרוליטר של פתרון פוספוליפידים עם מיקרו-מזרק על ממשק נקי כדי להשיג לחץ משטח רצוי ולחכות לפחות 30 דקות להתאדות הממס לחלוטין, לפני ביצוע הניסוי.
הערה: שוקת אנגמיור יכול לשמש במקום צלחת פטרי אם שליטה מדויקת של לחץ פני השטח היא הכרחית.
- הכנת פתרון פוספוליפידים
- סומדידת לחץ rface
- מדוד את הלחץ של monolayer פוספוליפידים עם tensiometer צלחת Wilhelmy פני השטח. חכה לפחות 30 דקות כדי לקבל את נייר הסינון רטוב מספיק אם נייר סינון משמש כצלחת Wilhelmy. הפרוטוקול מפורט זמין בקון ואח '. 20.
- התאם את הסכום שהופקד של פוספוליפידים לשלוט בלחץ המשטח בדיוק. הוסף 4 μl של פתרון dOPC (1 מ"ג / מיליליטר) על -area 30.25 סנטימטר 2 של הממשק אם 5 ~ / MN מ 'של לחץ משטח נדרש.
הערה: אם נייר הסינון לא רטוב לחלוטין, לחץ משטח משתנה באופן דרמטי במהלך 30 דקות הראשונות של הניסוי עקב השינוי במשקל של נייר הסינון.
- מזעור של זרימת ההסעה של monolayer
- השתמש במנגנון בצורת חרוט המכיל מאגר 3 מ"מ עם שני ערוצים דקים, מחובר לחלק גדול מצלחת פטרי, כדי לדכא את זרימת ההסעה שלmonolayer, אשר יכול להפריע הדמיה מורפולוגיה ומדידת לחץ פני השטח.
- הקפד להתאים את רמות המים בין בתוך ומחוץ למנגנון קונוס-צורה על מנת להבטיח שפוספוליפידים לנוע בחופשיות על פני האזור כולו לפני הפקדת פוספוליפידים על ממשק אוויר מים.
2. הכנת פוספוליפידים חד שכבתי במשטח המעוגל של אגל
- מתחדד תהליך של זכוכית נימים באמצעות חולץ micropipette
- מניחים זכוכית נימים (1 מ"מ OD, מ"מ id 0.78, אורך 100 מ"מ) על בעל נימים של חולץ micropipette.
- לעצב תכנית למשייכת הנימים עם ערכי פרמטרים מתאימים (חום: רמפה, משוך: 60, אצטדיון החורף: 70, עיכוב: 70 ולחץ 200) ולמשוך את הנימים עם התכנית שנועדה על פי הפרוטוקול של היצרן.
הערה: בסופו של נימים עם מיקרומטר בקוטר כמה הכרחית ליצירת 100 מיקרומטר-טיפה על ידי Applיינג לחץ עם ~ 10 kPa. אם סוף קצה הנימים קטן מדי, לחץ הרבה יותר גבוה,> 600 kPa, נדרש לקבל הטיפה, בזמן שהוא קשה לשלוט על הגודל של הטיפות עם סוף קצה נימים גדול מדי.
- קליטה של פוספוליפידים על גבי משטח אגל
הערה: כדי ליצור monolayer פוספוליפידים בממשק המעוגל של אגל, פתרון פוספוליפידים ללא צבע מתויג פוספוליפידים משמש להשגת ניגוד עוצמה, נגד monolayer השטוח, שהוכן על ידי הליך 1. בנוסף, שני ההליכים 2.2.1 ו -2.2 .2 הם המותר כאן. אם שליטה מדויקת של לחץ המשטח על פני השטח רביב היא הכרחית, הליך 2.2.2 מומלץ מאוד. עם זאת, אם לא, 2.2.1 הליך, אשר היא דרך הרבה יותר קלה מאשר הליך 2.2.2, הוא שימושי.- ציפוי תהליך של פוספוליפידים בסוף הקצה
- נקה זכוכית שקופית באמצעות אצטון, אתנול, ומים ללא יונים לפחות שלוש פעמים.
- Plאס הנימים מחודדות על זכוכית שקופית ניקתה, ולהטות את הנימים כדי להקל לגעת בזכוכית השקופית עם סוף קצה.
- זרוק כמה טיפות של תמיסת פוספוליפידים (1 מ"ג / מיליליטר) על סוף קצה נימים שדבקו בשקופיות הזכוכית באמצעות מזרק זכוכית, ולהמתין לפחות 30 דקות להתאדות הממס לחלוטין.
הערה: מומלץ מאוד לדבוק סוף קצה הנימים לשקופית הזכוכית במהלך הליך 2.2.1.3 כי המערכת של סוף טיפ קטנה מדי כדי להחזיק את הטיפה של פוספוליפידים בסוף הקצה רק בכוח נימים.
- הכנת פתרון שלפוחית
- נקה בקבוקון, ולהסיר מים מהבקבוקון, כהציג בהליך 1.1.1.1.
- ייבש 2 מיליליטר נפח של פתרון פוספוליפידים (1 מ"ג / מיליליטר) על ידי יישום גז חנקן בעדינות, ולייבש את הבקבוקון עבור שעה 1 ב RT לחסל כל שנותר ממס. לבצע הליך זה במנדף לבטיחות.
- הוסף 2מיליליטר של מים ללא יונים לתוך הבקבוקון המכיל שומנים מיובשים, ודגירת הבקבוקון בתנור על 60 מעלות צלזיוס במשך שעה 1.
- לנער מספר פעמים בקבוקון, וsonicate (HF-תדר: עד 40 קילוהרץ, כוח: W 370) למשך 30 דקות כדי להשיג שלפוחית.
- לבצע תהליכי שחול ולהקפיא להפשיר להשיג שלפוחית unilamellar monodisperse. הפרוטוקול מפורט להכנת שלפוחית מתואר במאיר ואח '. 21.
הערה: לחץ Surface של ממשק הטיפה נשלט דווקא על ידי התאמת זמן ההמתנה לאחר היווצרות הטיפה המכילה שלפוחית unilamellar monodisperse. שימוש בשיטת טיפת תליון 22, יש צורך למדוד את השינוי בלחץ משטח לפי זמן, לפני ביצוע הניסוי.
- ציפוי תהליך של פוספוליפידים בסוף הקצה
- היווצרות טיפה המכילה monolayer פוספוליפידים במשטח המעוגל
- מלא את הנימים מחודדות עם 10 μl של מים ללא יונים מprocedurדואר 2.2.1. לחלופין, להשתמש 10 μl של פתרון השלפוחית מההליך 2.2.2.
- חבר את הנימים למייקרו-מזרק אוטומטי כדי לספק את הלחץ כדי ליצור את אגל.
- הר הנימים שמחוברת למייקרו-מזרק לmicromanipulator לשלוט על המיקום של הנימים דווקא.
- הכן מיקרוסקופ שדה בהיר (מיקרוסקופים 1, עדשה אובייקטיבית: 10X NA 0.3) להדמית התצוגה לרוחב של הנימים עם מצלמת CCD. מיקרוסקופ 1 ובכך מאפשר לצפות במיקום המדויק של רביב לאורך ציר z ולהעריך את גודל הטיפה.
- הזז את קצה קצה למצב שבו את התצוגה לרוחב של סוף טיפ היא דמיינה היטב על ידי 1 מיקרוסקופים באמצעות micromanipulator, ולהחיל לחץ משתנה (~ 100 hPa) עם סוף קצה הנימים, עד גודל מתאים (~ 100 מיקרומטר בקוטר) של רביב נוצר.
הערה: מומלץ כי מיקרו-מזרק וmicromanipulator אוטומטיים להיות שימושד, אם שליטת קנס של גודל הטיפה ומיקום של רביב הוא הכרחית. אפשר גם להשתמש במדריך אלה.
3. הדמיה הקרינה שחזור לאחר מיזוג אגל
הערה: עקרונות היסוד של פרוטוקול זה זהים לאלה של טכניקת FRAP, פרט לתהליך גיבוש ירידה. תאוריות הפרוטוקול וקשורים מפורטות של FRAP זמינות בא לופז et al. 15 וד 'ואח אקסלרוד אל. 16.
- ניטור ושליטה על מיקומו של אגל
- הכן מיקרוסקופ הפוכה להגדיר (מיקרוסקופים 2, עדשה אובייקטיבית: 10X NA 0.3, עדשת צינור: אורך מוקד 17 סנטימטרים), המאפשרת מיקרוסקופ פלואורסצנטי עם מערכת סינון מתאימה לRhodamine-DPPEs (עירור ב 560 ננומטר, פליטה ב583 ננומטר) ומיקרוסקופ שדה בהיר. השתמש במצלמת CCD כאן לדמיין את הנוף העליון של הטיפה עם מטר מיקרוסקופ פלואורסצנטישיר הלל ומצב מיקרוסקופ שדה בהיר.
- הזז את אגל מצופה בפוספוליפידים לממשק אוויר מים שטוחים לאורך ציר z, אבל לא למזג את אגל עדיין, באמצעות micromanipulator. השתמש 1 מיקרוסקופים כדי להמחיש את התצוגה לרוחב של רביב.
- אתר את הטיפה במרכז התצוגה העליונה של monolayer השטוח, באמצעות micromanipulator. השתמש במצב מיקרוסקופ השדה הבהיר של מיקרוסקופים 2 לדמיין מבט מלמעלה של monolayer השטוח.
- מיזוג אגל על ממשק אוויר מים השטוח
- הזז את הטיפה נוספת לממשק השטוח עד הטיפה מתמזגת על הממשק, באמצעות micromanipulator. אם תהליך המיזוג נעשה בהצלחה, אזור כהה עם צורה עגולה שמוקפת ברקע לבן, הוא ציין באמצעות מצב הקרינה של מיקרוסקופים 2.
- רשום את הסדרה של תמונות ניאון לפי זמן לאחר מיזוג אגל, שימוש במצב הקרינה של MICROSלהתמודד 2. השתמשו במסגרת שיעור מהיר יותר מהסולם של monolayer כאן זמן דיפוזיה. בmonolayer dOPC, זה לוקח כמה דקות כדי לפזר את האזור 200 מיקרומטר-החשוך לגמרי.
4. קביעת מקדם הדיפוזיה על ידי ניתוח תמונה
הערה: כדי לקבוע את מקדם הדיפוזיה מסדרה של תמונות, תכנית מותאמת אישית לניתוח תמונה בנויה כמתואר להלן. קוד מקור מפורט של תכנית זו זמין באתר האינטרנט של יופיטר.
- איתור של אזור מעגלי של עניין
- איתור של מרכז האזור של עניין
- להשיג סדרה של תמונות ניאון שנרשמו במהלך תהליך החלמה שמכיל אזור כהה מעגלי ורקע לבן, ולהגדיר את התמונה הראשונה בסדרה כתמונת התייחסות. כאן, R D הוא הרדיוס של האזור הכהה בתמונת התייחסות.
- Convolute תמונת ההתייחסות עם עיגול לבן שעוצמת SE היא אחידה על פני אזור כולו. השתמש בפונקציה מוטבעת בשם 'CONV2' לפיתול כפי שמוצג בקוד המקור של קו התכנית המותאם אישית 124. הנה, הרדיוס של העיגול הלבן הוא מעט קטן יותר מR D.
- מצא את מיקום המצביע על ערך מינימאלי בחישוב פיתול, ולהגדיר את עמדה זו כמרכז של האזור של עניין בתמונה ההתייחסות.
- קביעת רדיוס של האזור של עניין
- Convolute תמונת ההתייחסות עם עיגול לבן שמכיל עמדת מרכז, שנקבעה על ידי הליך 4.1 ועוצמה אחידה על פני אזור כולו. כאן, R S הוא הרדיוס של העיגול הלבן. השתמש באיטרציה כגון 'עבור' או 'בעוד' עם משוואה של מעגל כדי להפוך את העיגול הלבן כפי שמוצג בקוד המקור של קו התכנית המותאם אישית 102-109.
- Convolute תמונת ההתייחסות עם עיגול לבן אחר שבו יש מעטרדיוס גדול יותר (5% -10%), L R, מ S R. השתמש באותה שיטה עם הליך 4.1.2.1 לעשות המעגל כפי שמוצג בקוד המקור של קו התכנית המותאם אישית 113-120.
- השג את ההבדל בשווי בין שני חישובי פיתול של 4.1.2.1 ו4.1.2.2.
- חזור על התהליך מתואר לעיל מR S = R D / 2 לR S = 2R D, על ידי הגדלת שניהם S R ו- L R עם רמת פיקסל. הפוך איטרציה המכילה קודי מקור כל מ4.1.2.1 הליך ל4.1.2.3 לחזור.
- מצא את הרדיוס של S R המציין את ההבדל המקסימאלי בשווי בין שני חישובי פיתול. פונקציה מוטבעת שימוש בשם "מקס" כדי למצוא את הרדיוס מציינת את ההבדל המקסימאלי בשווי כפי שמוצג בקוד המקור של קו התכנית המותאם אישית 148 ל149. R S זה כך מציין את הרדיוס של האזור הכהה בתמונה ההתייחסות.
- איתור של מרכז האזור של עניין
- חישוב עוצמת השבר
- הגדר מעגל המכיל את עמדת מרכז ורדיוס, שנקבע על ידי הליך 4.1 כאזור של עניין.
- חשב את העוצמות הממוצעת של האזור של עניין בסדרה של תמונות הקרינה לפי זמן. Convolute כל מסגרת עם אזור של עניין ולחלק אותו לפי תחומי האזור של עניין כדי לחשב את עוצמת הממוצע. הפרטים זמינים בקוד המקור של התכנית המותאמת אישית אשר זמינה באתר האינטרנט של יופיטר.
- חישוב עוצמת השבר, שהוגדרה כמשוואה להלן, בי F (t) היא עוצמת במעגל הממוצעת שהוא אזור של עניין על פי זמן, F הוא אני עוצמת הראשונית במעגל, וo F היא עוצמת רקע לבן.
F (t) = (F (t) - אני F) - (משוואת 1) (i F o F) /.
- התאמה ועוצמת ractional לתאורית FRAP
- התאם את עוצמת השבר עם המשוואה להלן, שבו τ הוא זמן דיפוזיה אופייני ואני 0, 1 אני משתנה פונקציות בסל, באמצעות תכנית מתאימה, ולקבל τ
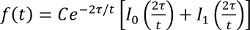 (משוואה 2).
(משוואה 2). - להשיג מקדם הדיפוזיה המבוסס על היחס, τ = 2/4 D, כאשר D הוא מקדם דיפוזיה והוא הרדיוס של האזור הכהה.
הערה: במהלך התהליך הראוי, אפשר להעביר את עוצמת השבר הפרופיל לאורך ציר זמן שבו תהליך ההתאוששות כבר החל, לפני הקלטת התמונות.
- התאם את עוצמת השבר עם המשוואה להלן, שבו τ הוא זמן דיפוזיה אופייני ואני 0, 1 אני משתנה פונקציות בסל, באמצעות תכנית מתאימה, ולקבל τ
תוצאות
סדרה של תמונות הקרינה התקבלו עם זמן בתהליך ההתאוששות לאחר מיזוג אגל מצופה monolayer dOPC על monolayer dOPC שטוח, כפי שמופיעה באיור 1. Monolayer dOPC בממשק אוויר מים השטוח היה מסומם עם כמויות נמוכות של Rhodamine-DPPE, וזה ובכך הפך אותו אפשר לדמיין רקע עם צבע בהיר וכהה באזור חדש שנוסף לממשק השטוח. יש, תהליך התאוששות נצפה בMN 23 / מ 'של לחץ משטח קבוע. בכושר של משוואת 1 לשינוי של עוצמת השבר לפי הזמן מוצג באיור 2. R 2 הערך של כושר זה הוא 0.999, ובכושר זה עדיין עובד היטב גם בלחצי משטח נמוכים או גבוהים יותר. מקדם דיפוזיה של monolayer dOPC מתקבל מכושר זה היה 27.54 מיקרומטר 2 / sec בMN 23 / מ 'של לחץ פני השטח.
לאימות נוספת של פראם, מקדמי דיפוזיה של DOמחשב וdipalmitoylphosphatidylcholine monolayers (DPPC) נמדדו לפי לחץ פני השטח. כפי שניתן לראות באיור 3, פראם לוכד את הירידה המהירה של מקדם הדיפוזיה של monolayer DPPC ב ~ 9 MN / מ 'של לחץ משטח, שבי LC (נוזל מרוכז) - LE (נוזל מורחב) שלב מעבר מתרחש 10, ואת הערכים של מקדמי דיפוזיה גם הסכימו גם עם המדידות בעבר על ידי פיטרס et al. 19. בנוסף, דעיכה מעריכית של מקדם דיפוזיה עם לחץ המשטח נצפתה בשכבת dOPC, ונטייה זו היא כמעט זהה לאחד שנמדד על ידי קארוזו et al. 12.
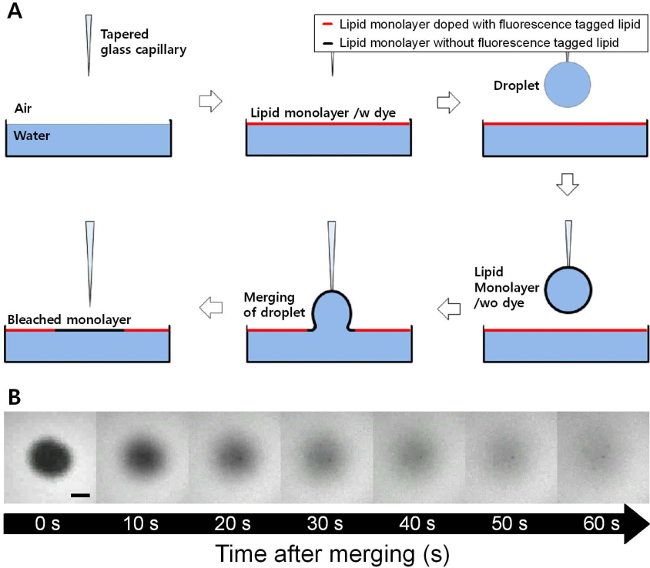
איור 1. איור סכמטי של פראם (התאוששות הקרינה לאחר המיזוג) טכניקה (). כשפהאגל מצופה monolayer id ממוזג לממשק אוויר מים שטוח, monolayer השומנים ללא הקרינה מתויג שומנים מוכנס לתוך monolayer שומנים ניאון שטוח. תמונות מיקרוסקופ (ב) הקרינה עם זמן בתהליך ההתאוששות של monolayer dOPC בMN 23 / מ 'של לחץ משטח (סרגל קנה מידה = 100 מיקרומטר). האזור האפל של monolayer dOPC הוא התאושש באופן מלא על ידי תהליך דיפוזיה בתוך כמה דקות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
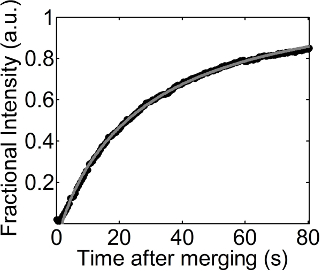
איור 2. עוצמת חלקית לעומת זמן. עיגולים שחורים והקו המקווקו האפור מציינים את הערכים של עוצמות השבר שהתקבלו מניתוח תמונה (נהלים 4.1 ו -4.2) ואת ההתאמה של משוואת 1 לעוצמות השבר עם זמן,הראה בהליך 4.3, בהתאמה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
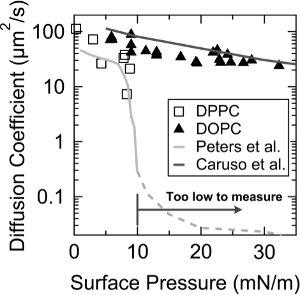
3. מקדמי דיפוזיה איור של dOPC (משולש) וDPPC (ריבוע ריק) monolayers כפונקציה של לחץ פני השטח. הקווים עם הצבע האפור הבהיר ועם הצבע האפור הכהה מצביעים על הערכים של מקדם הדיפוזיה שדווח בעבר על ידי פיטרס et al. וקארוזו et al., בהתאמה. נתון זה שונה מet al ג'אונג. 23. הודפס מחדש באישור מet al ג'אונג. אנגמיור. 30 (48), 14,369-14,374. כל הזכויות שמורות 2,014 האגודה האמריקנית לכימיה. אנא לחץ עליהדואר כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
פראם חולק הרבה עקרונות יסוד עם FRAP, במיוחד למדידת התאוששות הקרינה לאחר הלבנת אזור מסוים, אבל פראם משתמש בתהליך של מיזוג אגל על הממשק השטוח כדי ליצור אזור מולבן, במקום ליישם אור אינטנסיבי. תהליך המיזוג הוא כך צעד החשוב ביותר בפראם, ובמיוחד, את הצורה של הכתם הכהה בmonolayer השטוח לאחר מיזוג טיפה קובעת את הדיוק של מדידת diffusivity. באופן ספציפי, המבוססים על שיטה נוכחית, שרק להגדיר את המעגל עם רדיוס R כאזור של עניין כדי לחשב את העצמה הממוצעת של הכתם הכהה, המוצגת בהליך 4, ואם יש סטייה גדולה מדי מהצורה העגולה, זה יפריע המדידה המדויקת של מקדם הדיפוזיה. לכן, יש צורך להשיג אזור כהה בצורה מעגלית, אבל, צורות noncircular נוצרות לעתים בשל מספר סיבות. ראשית, אם קיים זרימת הסעה בחיות המחמדצלחת רי, את הצורה של האזור הכהה הופכת מוארכת לאורך כיוון הזרימה. כאמור בהליך 1.3, מכשיר קונוס-צורה מסייע לדכא את זרימת ההסעה, והתארכות זו תהיה מזערית. שנית, אם סוף קצה הנימים נוגע ממשק השטוח בתהליך מיזוג, האזור הכהה נוצר עם מגוון רחב של צורות מאז סוף הנימים קוטע את תהליך המיזוג. על ידי קבלת טיפה שתלוי רק מהסוף מאוד של הנימים, ניתן למנוע הפרעה זו. בפרט, טיפול הידרופובי של הנימים עוזר הטיפה לשבת בסוף מאוד של הנימים. לכן, ירי צרות לעיל ושינויים יאפשרו לנו למדוד תכונות דיפוזיה מדויקת יותר.
תהליך זה troubleshot גם כך מאפשר פראם יש כמה יתרונות משמעותיים על פני FRAP. ראשית, פראם דורש ציוד פשוט בהשוואה לFRAP. לפראם, זה מספיק כדי להשתמש במייקרו הקרינה פשוטלהתמודד, במקום מיקרוסקופ confocal יקר עם לייזר בהספק גבוה באורך גל שחייב להתאים עם ספקטרום הבליעה של הצבע. בנוסף, יש צורך להשתמש במכשיר נוסף כדי להתאים את הגודל לאזור מולבן בFRAP, תוך פראם שולט בגודל השטח בקלות על ידי התאמת גודל הטיפה, או לחץ המשטח על פני השטח אגל. שנית, ניתן להשתמש במינים שונים של צבעים בפראם. FRAP משתמש רק מולקולות צבע הלבנה שתהליך הוא הרבה יותר מהר מאשר תהליך דיפוזיה. אם דיפוזיה של הצבעים מתרחשת במהלך תהליך ההלבנה, קשה להעריך את רכוש דיפוזיה מדויקת. פראם, לעומת זאת, אינו דורש תהליך להלבנת צבעים וזה ובכך מאפשר שימוש בסוגים שונים של צבעים בהדמית הקרינה. בנוסף, דורש FRAP לייזרי מתח גבוה נוספים ומסנן קובע לשנות את מיני צבע, בזמן שהוא רק צורך להחליף את מערכות הסינון בפראם. לבסוף, מאז monolayers על פני השטח אגל והממשק השטוח יכול להיווצר באופן עצמאי, ובכך לאפשר את הלימוד בין-דיפוזיה או ערבוב בין שני monolayers שומנים שונה על ידי מיזוג מסוג monolayer לmonolayer B-הסוג, בעוד FRAP מודד רק דיפוזיה עצמית של שכבה.
למרות יתרונות אלה, תהליך איחוד אגל על ממשק אוויר מים שטוח עלול להגביל בטכניקה זו בשל כמה בעיות שעלולות להיות לדאגה, כגון אי-התאמת לחץ משטח בין שני monolayers, בקנה מידה של תהליך מיזוג הזמן , ועלייה בלחץ פני השטח של monolayer השטוח לאחר מיזוג טיפות. נושאים אלה, עם זאת, אינם משפיעים על מדידת דיפוזיה באופן משמעותי מהסיבות הבאות. ראשית, למרות שלחצי המשטח בשני monolayers שונה הם שונים לגמרי, תהליך איזון יושלם בשלב מוקדם מאוד בתהליך ההחלמה. לדוגמא, אם לאהוא משטח לחץ של monolayer על פני השטח הטיפה גבוה יותר מזה של monolayer בממשק אוויר מים השטוח, האזור הכהה מתרחב עד לחץ משטח equilibrates. מכיוון שתהליך זה יושלם בתוך 10 אלפיות שני, לחץ המשטח יהיה equilibrated לפני זה משפיע על תהליך דיפוזיה באופן משמעותי. שנית, אם בקנה מידה של תהליך מיזוג הזמן הוא מספיק מהר, זה לא להגביל את מדידת דיפוזיה בכלל. למרבה המזל, תהליך מיזוג אופייני גם יושלם בתוך 10 אלפיות שניים. לבסוף, גם מיזוג מרובה של הטיפות על הממשק השטוח לא להגביר את הלחץ מאז את שטח הפנים של שוקת המשטח הוא גדול בהרבה משטח הפנים של הטיפה. על פי הגדלים של השוקת והטיפין, שתוארה בפרוטוקול, האזור למולקולה מגביר פחות מ 0.015% על ידי מיזוג אגל. בהתאם לכך, הגידול של לחץ משטח עקב השינוי של אזור כל מולקולה הוא פחות מ -0.1%, שהוא negligiblדואר כי זה הרבה יותר קטן מהשגיאה האופיינית בלחץ משטח, כפי שנמדד על ידי tensiometer צלחת Wilhelmy.
לסיכום, הצגנו שיטה חדשה למדידת רכוש דיפוזיה לרוחב של monolayer פוספוליפידים ידי מיזוג monolayer אגל על הממשק השטוח. טכניקה זו דורשת ציוד פשוט יחסית וגם מאפשרת השימוש בסוגים שונים של מיני צבע. פראם הוא בכך שעלול להיות רלוונטי למדידת דיפוזיה של כל סוכנים פעילים שטח, כוללים פוספוליפידים, קופולימרים לחסום, חלבונים ואפילו חלקיקים בנוזל ממשק-נוזל. יתר על כן, אנו מצפים שפראם מספק דרך חדשה ללמוד בין-דיפוזיה או ערבוב בין שני סוכנים פעילים שטח שונים.
Disclosures
The authors declare no competing financial interest.
Acknowledgements
עבודה זו נתמכת על ידי הפרויקט ממומן על-KAIST K-העמק האדום וארוחת בוקר לשינה 2014 ותכנית מחקר המדע בסיסי באמצעות קרן המחקר הלאומית של קוריאה (NRF- 2012R1A6A3A040395, NRF-2013R1A1A2057708, NRF- 2012R1A1A1011023).
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | OCI corporation | Acetone 3.8L Extra Pure | Purity: ≥ 99.5%, Please consult material safety data sheets (MSDS) before use. |
| Ethanol | OCI corporation | Ethanol 3.8L Extra Pure | Purity: ≥ 94%, Please consult material safety data sheets (MSDS) before use. |
| Dioleoylphosphatidylcholine, DOPC | Avanti Polar Lipids | 850375C | Please consult material safety data sheets (MSDS) before use. Chloroform is carcinogenic. |
| Chloroform | LiChrosolv | Chloroform ultrapure (A3633) | Purity: ≥ 99.8%, Please consult material safety data sheets (MSDS) before use. Carcinogenic |
| Rhodamine DPPE | Avanti Polar Lipids | 810158C, 810158P | Avoid direct light exposure to prevent photobleaching |
| Wilhelmy plate tensiometer | R&K ultrathin organic film technology | Wilhelmy tensiometer | http://www.rieglerkirstein.de/index.htm |
| Micropipette puller | Sutter instrument | P-1000 | |
| Micro-injector | Eppendorf | Femtojet | |
| Micromanipulator | Eppendorf | Micromanipulator 5171 | |
| Microscope 1 | Objective lens: Olympus | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3 |
| Microscope 2 | Objective lens: Olympus, Tube lens: Thorlabs | Objective lens: UPlanFl 10x | Objective lens: 10X NA 0.3, tube lens: focal length 17 cm |
| CCD for Microscope 1 | Jai | CV 950 camera | |
| CCD for Microscope 2 | Andor | iXon3 EMCCD | |
| Filter set | Chroma technology | Catalog Set 49004: ET545, T565, ET605 | Prepare suitable for dye molecules |
| Sonicator | DAIHAN Scientific | Wiseclean WUC-D06H |
References
- Van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nat. Rev. Mol. Cell Biol. 9 (2), 112-124 (2008).
- Christon, R., Even, V., Daveloose, D., Léger, C. L., Viret, J. Modification of fluidity and lipid—protein relationships in pig intestinal brush-border membrane by dietary essential fatty acid deficiency. Biochim. Biophys. Acta - Biomembr. 980 (1), 77-84 (1989).
- Stubbs, C. D., Smith, A. D. The modification of mammalian membrane polyunsaturated fatty acid composition in relation to membrane fluidity and function. Biochim. Biophys. Acta - Rev. Biomembr. 779 (1), 89-137 (1984).
- Holthuis, J. C. M., Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510 (7503), 48-57 (2014).
- Alonso, C., Waring, A., Zasadzinski, J. A. Keeping lung surfactant where it belongs: protein regulation of two-dimensional viscosity. Biophys. J. 89 (1), 266-273 (2005).
- Kim, K., Choi, S. Q., Zell, Z. a., Squires, T. M., Zasadzinski, J. A. Effect of cholesterol nanodomains on monolayer morphology and dynamics. Proc. Natl. Acad. Sci. (U. S. A.). 110 (33), E3054-E3060 (2013).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring Lipid Membrane Viscosity Using Rotational and Translational Probe Diffusion. Phys. Rev. Letters. 112 (18), 188101 (2014).
- Ding, J., Warriner, H. E., Zasadzinski, J. a., Schwartz, D. K. Magnetic needle viscometer for Langmuir monolayers. Langmuir. 18 (13), 2800-2806 (2002).
- Dhar, P., Cao, Y., Fischer, T. M., Zasadzinski, J. A. Active interfacial shear microrheology of aging protein films. Phys. Rev. Letters. 104 (1), 1-4 (2010).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Choi, S. Q., Steltenkamp, S., Zasadzinski, J. A., Squires, T. M. Active microrheology and simultaneous visualization of sheared phospholipid monolayers. Nature Commun. 2 (5), 312 (2011).
- Caruso, F., et al. Determination of lateral diffusion coefficients in air-water monolayers by fluorescence quenching measurements. J. Am. Chem. Soc. 113 (16), 4838-4843 (1991).
- Filippov, A., Orädd, G., Lindblom, G. The effect of cholesterol on the lateral diffusion of phospholipids in oriented bilayers. Biophys. J. 84 (5), 3079-3086 (2003).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36 (3), 176-182 (1999).
- Lopez, A., Dupou, L., Altibelli, A., Trotard, J., Tocanne, J. F. Fluorescence recovery after photobleaching (FRAP) experiments under conditions of uniform disk illumination. Critical comparison of analytical solutions, and a new mathematical method for calculation of diffusion coefficient D. Biophys. J. 53 (6), 963-970 (1988).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Vaz, W. L., Clegg, R. M., Hallmann, D. Translational diffusion of lipids in liquid crystalline phase phosphatidylcholine multibilayers. A comparison of experiment with theory. Biochemistry. 24 (3), 781-786 (1985).
- Wu, E. S., Jacobson, K., Papahadjopoulos, D. Lateral diffusion in phospholipid multibilayers measured by fluorescence recovery after photobleaching. Biochemistry. 16 (17), 3836-3841 (1977).
- Peters, R., Beck, K. Translational diffusion in phospholipid monolayers measured by fluorescence microphotolysis. Proc. Natl. Acad. Sci. (U. S. A.). 80 (23), 7183-7187 (1983).
- Kuhn, H., Mobius, D., Bucher, H., Crawley, J. N., et al. . Physical Methods of Chemistry. 1, Part 3B, 651-653 (1972).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta - Biomembr. 858 (1), 161-168 (1986).
- Rotenberg, Y., Boruvka, L., Neumann, A. Determination of surface tension and contact angle from the shapes of axisymmetric fluid interfaces. J. Colloid Interface Sci. 93 (5), 169-183 (1983).
- Jeong, D. W., Kim, K., Lee, S., Choi, M. C., Choi, S. Q. Fluorescence recovery after merging a surfactant-covered droplet: a novel technique to measure the diffusion of phospholipid monolayers at fluid/fluid interfaces. Langmuir. 30 (48), 14369-14374 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved