Method Article
Los protocolos para analizar el papel de las células de Paneth en Regeneración del Murino Intestino utilizando condicional
En este artículo
Resumen
Las células madre epiteliales intestinales (ISCS) se entremezclan con las células de Paneth. Estas células se diferencian progenie del ISC, que apoyan el ISC y proporcionar protección antibacteriana. Aquí se demuestra la forma en que utilizamos modelos de ratones transgénicos condicionales para establecer que las células de Paneth juegan un papel crucial en el mantenimiento de los epitelios intestinales.
Resumen
La superficie epitelial del intestino de mamífero es un tejido dinámico que se renueva cada 3 - 7 días. La comprensión de este proceso de renovación identificó una población de ciclos rápidos células madre intestinales (ISC) que se caracterizan por su expresión del gen LGR5. Estos son apoyados por una población de células madre en reposo, marcado por Bmi-1 de expresión, capaz de sustituirlos en caso de lesión. La investigación de las interacciones entre estas poblaciones es crucial para entender su papel en la enfermedad y el cáncer. Los ISC existen dentro de las criptas en la superficie intestinal, estos nichos apoyan el ISC en la reposición de los epitelios. La interacción entre el ISC y recidivantes probable involucra otras células diferenciadas dentro del nicho, ya que previamente se ha demostrado que la '' troncalidad '' del LGR5 ISC está estrechamente ligada a la presencia de sus células de Paneth vecinos. Usando condicional ratón cre-loxmodelos que probamos el efecto de la supresión de la mayoría de los CSI activos en la presencia o ausencia de las células de Paneth. Aquí se describen las técnicas y análisis realizados para caracterizar el intestino y demuestran que las células de Paneth juegan un papel crucial en el nicho de ISC en ayudar a la recuperación tras el insulto sustancial.
Introducción
La superficie luminal del intestino de mamíferos características unidades de criptas y el dedo repitiendo como proyecciones, denominado vellosidades, que sobresalen en el lumen. Esta superficie es una lámina continua de los epitelios que se somete a auto-renovación completa aproximadamente cada 3 - 4 días 1. Este tejido dinámico con el apoyo de una población de células madre de ciclos rápidos (ISCS, también conocida como base de la cripta células columnares), que fueron identificados inicialmente por su expresión del gen LGR5 2,3. Estas células existen en un nicho especializado en el fondo de las criptas de Lieberkuhn. Inicialmente, el descubrimiento de que el ISC se ciclismo rápidamente fue discordante con la idea predominante de que una célula madre estaba en reposo en la naturaleza. Anterior a la identificación de la LGR5 + ISC se postuló que una población de células quiescentes etiqueta en la posición 4, en relación a la base de la cripta de retención, fueron el ISC 1. Investigaciones recientes hcomo ahora reconciliado estas observaciones demostrando que principalmente hay una piscina del ciclismo equipotente ISC en cada cripta cuyo destino se regulan por sus vecinos de 4,5. En el caso de que se pierdan estos pueden ser sustituidos por células en reposo que normalmente están comprometidos con el linaje secretora, pero puede volver a ISC si la población ISC está dañado 6.
Vecinos ISC pueden ser o bien ISC o sus células hijas. Los ISC producen células hijas vírgenes que se multiplican y se diferencian en los tipos de células especializadas que forman la lámina epitelial que recubre la luz intestinal 1. La copa, enteroendocrina, enterocitos, penacho y células M migran hacia arriba a la superficie luminal donde proporcionan varias funciones de absorción y de regulación, sin embargo, las células de Paneth permanecen en el fondo de la cripta donde existen entremezclan con el ISC. En los últimos años se ha demostrado que una proporción de la Daught naïveer células destinadas a un linaje de secreción son etiquetas de reposo retener células LGR5 Lo capaces de revertir a un ISC sobre la lesión 6,7.
Debido a su importancia en la regeneración cripta se colocó una prioridad en la comprensión de las interacciones entre el ISC y sus vecinos, en particular las células de Paneth. Las células de Paneth juegan un papel crucial en el nicho que apoya el ISC 8. Además de los productos bactericidas las células de Paneth producen moléculas de señalización que activan las vías que regulan la renovación ISC o diferenciación. Estudios previos demostraron que la LGR5 + ISC sólo puede existir cuando podrían competir por señales de nicho esenciales proporcionados por sus hijas células de Paneth 8. Estos estudios examinaron el papel de las células de Paneth en LGR5 normales + ISC y no en una situación en la que están dañadas y requieren la reposición de una población LGR5 lo.
Para entender la biología y el modelo de enfermedad intestinal examinamos el papel funcional de las células y / o genes utilizando modelos de ratones transgénicos 9,10. Frecuentemente, estos modelos utilizan la tecnología cre-lox para modificar condicionalmente gen (s) 9,10. Cre (causas recombinación) recombinasa es una recombinasa específica del sitio de la familia de la integrasa, aislado del bacteriófago P1. Cre cataliza la recombinación específica entre el sitio definido 34 pb ' Lox P '(locus χ de P1 de cruce) sitios. Los ratones diseñados genéticamente para contener sitios LoxP que flanquean las regiones de interés, que tras la expresión de la recombinasa Cre son extirpados. La vinculación de la expresión del gen Cre a una célula o promotor específico del desarrollo permite la alteración que se hizo de una manera espacial 9,10, esto es especialmente útil en la superación de mutaciones letales embrionarios. Vincular aún más la expresión de Cre a una vía del receptor,que se puede activar artificialmente, permite alteraciones temporales.Utilizando esta tecnología nos inactivado el gen Catnb 11 en los epitelios intestinales. β-catenina, el producto del gen Catnb, es un regulador clave de la vía de señalización Wnt canónica que regula la homeostasis de ISC. Dos estudios anteriores utilizando esta estrategia produjeron resultados contradictorios 12,13. El estudio de FEVR et al. 12, demostró la pérdida de las células madre y la homeostasis intestinal. Considerando que el Ireland et al. 14 estudio informó que tras una reducción de la viabilidad celular del eje cripta-vellosidad fue repoblada a partir de células de tipo salvaje que expresan Catnb. La principal diferencia en estos estudios fue el promotor utilizado para expresar Cre en los epitelios intestinales. El FEVR et al., Estudio utilizó el promotor del gen vilina ligado al receptor de estrógeno que puede ser activado mediante la administración de tamoxifen (vil-Cre-ER T2) 15,16. En contraste Ireland et al., Utiliza el elemento promotor del gen del citocromo P450A1 rata (CYP1A1) para conducir la expresión Cre en respuesta a la β-naftoflavona xenobiótico (Ah-CRE). Las características de estos diferentes sistemas generan dos hipótesis para explicar estas diferentes observaciones. El primero que Catnb se elimina de manera más eficiente en el ISC usando el sistema T2 vil-Cre-ER en comparación con el Ah-cre, reduciendo así el número de ISC a niveles sub-repoblación. Alternativamente que era debido a la diferencia de eliminación Catnb en la población celular diferenciado. El sistema T2 vil-Cre-ER objetivos todas las células epiteliales de la cripta y vellosidad mientras que el sistema de Ah-cre únicos blancos las células no Paneth del nicho ISC y la cripta. Estos sistemas proporcionan herramientas ideales para examinar la behavior del ISC y su interacción con las células de Paneth. Aquí presentamos varios protocolos detallados basados en la forma en que usamos estos sistemas para determinar que las células de Paneth juegan un papel crucial en la mediación de la respuesta intestinal a la lesión 17.
Protocolo
La información sobre todos los materiales utilizados se da en la Tabla 1. Todos los experimentos con animales se realizaron bajo la autoridad de una licencia de proyecto del Reino Unido Home Office.
1. Catnb Supresión utilizando el Ah-cre y Vil-Cre-ER Sistemas T2
- Cruzar las cepas de ratones para generar 10-14 semanas de edad cohortes de Ah-cre + Catnb + / +, Ah-cre + Catnb flox / flox, vil-Cre-ER T2 Catnb + / + y vil-Cre-ER T2 Catnb flox / flox. Para el análisis visual de la recombinación, a través de una mancha gal β, cohortes deben contener el reportero Rosa26R-lacZ 17. Las cohortes deben controlar la presencia de los genes y el uso de agentes de inducción modificados, el tamaño de las cohortes requeridos deben estimarse utilizando un análisis de poder.
- Para inducir el transgén Ah-cre preparar β; -Naphthoflavone (BNF), o para el transgén vil-Cre-ER T2 tamoxifeno (TAM) en aceite de maíz para dar una solución de trabajo de 10 mg / ml. NOTA: Los agentes deben sopesarse a cabo en una campana extractora usar protección personal adecuado.
- Soluciones de calor en una botella ámbar (BNF es sensible a la luz) a cualquiera de 99,9 ° C durante BNF o 80 ° C durante TAM en un baño de agua.
- Pasar a un agitador climatizada fijado en 100 ° C durante BNF, o 80 ° C durante TAM, y se agita durante 10 min.
- Para BNF repetir 1.3 a 1.4 hasta que se disuelva (puede tomar> 1 h).
- Alícuota en pequeñas botellas de color ámbar (~ 5 ml) y luego congelar a -20 ° C. Botellas deben desecharse después de 3 ciclos de congelación / descongelación. Antes de utilizar agentes de deshielo y volver a calentar a la temperatura apropiada si han caído fuera de la solución. Dejar enfriar a <37 ° C antes de la inyección.
- Inyectar los ratones por vía intraperitoneal (IP) con una dosis de 80 mg / kg, por ejemplo, un ratón 25 g recibe 0,2 ml de la appropagente de inducción piados. Para Ah-cre entregar tres inyecciones en el 24 período de horas, por vil-Cre-ER T2 dar una inyección por día durante 4 días.
2. Disección de Intestino de Visualización Reporter y La inmunohistoquímica (IHC)
- La eutanasia el ratón por dislocación cervical sin anestesia previa, de conformidad con la aprobación ética. Coloque ratón en una posición supina y humedecer la piel usando 70% de EtOH, abrir la cavidad intra-peritoneal longitudinalmente a lo largo de la línea media usando unas tijeras.
- Asegurar el estómago con un fórceps y cortar la conexión al esófago. Retire el intestino delgado hasta el apéndice tirando suavemente el estómago. Retire el intestino grueso hasta el ano tirando suavemente en el apéndice.
- Una vez que los intestinos se han aislado eliminar el estómago y el apéndice. Intestinos Enjuagar con 1x PBS utilizando una jeringa con una punta de pipeta de extremo romo. NOTA: Cada intestino debe ser immediately procesado para una de las aplicaciones posteriores se describen a continuación.
3. La formalina Fijación de Intestino
- Cortar el intestino enrojecida en 3 secciones de igual tamaño y la etiqueta proximal, medio y distal. Cortar cada sección en trozos de 1 cm. Tomar una pequeña tira de cinta quirúrgica 2 cm x 2 cm. Coloque tres a cinco piezas de 1 cm en el centro de la cinta quirúrgica en una formación de pirámide.
- Cerrar y sellar la cinta alrededor de las piezas longitudinalmente, para dar un efecto de "pila del registro". Coloque el tejido en un recipiente de fondo plano que contiene un gran exceso de fijador de formalina tamponada neutra, al menos 10 veces el volumen de fijador para el volumen de tejido. NOTA: Evite colocar cantidades en exceso de tejido dentro de un tubo para la fijación, dividirlo en varios contenedores.
- Colocar las muestras a 4 ° C durante al menos 18 - 24 horas antes de la inclusión y corte. Para evitar la pérdida de β-catenina nuclear, no lo arregles más allá de las 24 horas.Después de la transferencia de tejido de fijación a un recipiente de fondo plano que contiene un gran exceso de 70% de EtOH, al menos 10 veces el volumen de tejido.
4. methacarn Fijación del Intestino
- Antes de la disección preparar fijador methacarn mediante la combinación de 300 ml de MeOH, 150 ml de cloroformo y 75 ml de ácido acético glacial (4: 2: 1). Cortar el intestino enrojecida en 3 secciones de igual tamaño proximal, media y distal.
- Coloca cada pieza de lado a lado delgado en un pedazo de papel de filtro (15 cm x15 cm) y usar un Springbow tijeras se abren hacia arriba 'en la cara'. Coloque el intestino y el papel de filtro en un recipiente de vidrio que contiene methacarn por 3 - 24 horas a temperatura ambiente. Después de la fijación recoger al final de una sección de intestino mediante una pinza.
- Enrolle el intestino alrededor de los fórceps para formar un "brazo de gitano" y asegure el rollo abriendo ligeramente la pinza y poner una aguja de 25 G a través de él. Coloque el tejido en un recipiente de fondo plano que contiene a laRGE exceso de fijador de formalina tamponada neutra, al menos 10 veces el volumen de fijador para el volumen de tejido y almacenar durante al menos 1 hr antes de proceder al procesamiento.
5. Todo el montaje LacZ Visualización (Modificado de El Marjou et al. 18)
- Preparar placas de cera mediante la combinación de ralwax fundido con aceite mineral a 10: 1. Vierta la mezcla en 15 platos cm de Petri y dejar enfriar. Preparar fijador X-gal según la Tabla 1 y almacenar en hielo.
- Retire toda intestino y eliminar a través con 1x PBS helado, según apartado 2. Fix intestino por lavado con 25 ml de helado de X-gal fijador.
- Usando una tijera cortó el intestino en 3 - 5 secciones iguales (máximo 5 por plato). Coloque cada sección sobre la placa de cera y precisar cada extremo por lo que la sección se estira ligeramente con la más alta línea mesentérica; recortar cualquier exceso de mesenterio. Usando una tijera Springbow cortó el intestino longitudinalmente y el pin a cabo a lo largo del camino.60;
- Inunda el plato con fijador X-gal para cubrir las secciones y dejar actuar durante al menos 1 hora a 4 ° C. Eliminar fijador X-gal utilizando una pipeta de 25 ml y lavar una vez con 30 ml de PBS 1x. Secciones cubren con 30 ml de solución demucifying TDT de 30 - 60 minutos a temperatura ambiente, idealmente en una plataforma oscilante.
- Retire la solución demucifiying usando una pipeta de 25 ml y la inundación de la placa con 30 ml de PBS 1x. Utilizando una pipeta pasteur lavar las secciones delgado con el PBS 1x en la placa para eliminar el moco.
- Retire PBS 1x con una pipeta de 25 ml y de inundaciones con 30 ml de tinción X-gal. Incubar toda la noche a temperatura ambiente en la oscuridad con agitación suave en una plataforma oscilante.
- Tras la incubación durante la noche de verificación que las secciones han desarrollado un / mancha verde azul, si el color de fondo es aún blanco, se puede añadir solución de tinción fresco y monitoreado hasta tinción se desarrolla. NOTA: Una vez que las secciones han manchado luego sin más tinción se puede intentar.
- Quite la mancha X-galutilizando una pipeta y las inundaciones placa de 25 ml con 30 ml de PBS 1x y se deja durante 3 min con agitación suave. Quite alfileres y recoger, con pinzas, el final de una sección de intestino. Enrolle el intestino alrededor de los fórceps para formar un "brazo de gitano", asegure el rollo abriendo ligeramente la pinza y poner una aguja de 25 G a través de él.
- Coloque el tejido en una amplia recipiente de fondo plano que contiene la boca un gran exceso de fijador de formalina tamponada neutra, al menos 10 veces el volumen de fijador para el volumen de tejido. Colocar las muestras a 4 ° C durante al menos 24 horas antes de la inclusión y corte.
6. Extracción de criptas del intestino
- Aislar los primeros 20 cm del intestino delgado, según apartado 2. Coloque el intestino en una superficie de disección limpia y usando unas pinzas y tijeras eliminar cualquier adjunto grasa / mesenterio. Usando unas tijeras Springbow abren el intestino longitudinalmente.
- El uso de una cubierta de portaobjetos de microscopio, firmly raspar la luz intestinal para eliminar vellosidades y mucosidad. Usando unas tijeras cortar el intestino a ~ 5 mm piezas y transferir a un tubo de 50 ml con 25 ml de 1x HBSS suplementado con penicilina (100 U / ml) y estreptomicina (100 U / ml).
- Incubar durante 10 min a TA. Retire el papel de antibióticos que contienen al pasar las muestras a través de un filtro de células 70 micras.
- Coloque secciones intestinales en un tubo de 50 ml fresco que contiene 10 ml 1x HBSS y coloque la tapa.
- Invertir suavemente dos veces y quitar el 1x HBSS mediante el paso a través de un filtro de células de 70 micras. Además lavar las piezas intestinales mediante la repetición de 6.4 y 6.5 de tres veces y asegúrese de que la fracción final es relativamente clara.
- Transferencia de tejido a un tubo de 50 ml que contiene 10 ml fresca de EDTA (8 mM) / 1x HBSS y dejar a temperatura ambiente durante 5 min. Agitar enérgicamente (20 - 30x) o vórtice, pasan por un tamiz de 70 micras de células y tejidos de transferencia de piezas a un tubo de 50 ml que contiene EDTA fresco (8 mM) / 1x HBSS. NOTA:El flujo a través de cualquiera de los dos puede ser desechada o retenido si se requiere un análisis de los epitelios vellosidades.
- Incubar las piezas de tejido en hielo durante 30 min, agitar la muestra vigorosamente (20 - 30x) o vórtice. Pasar las muestras a través de un filtro de células 70μm y retener el flujo a través, ya que contiene las criptas.
- Transferir las piezas de tejido a un tubo de 50 ml fresco que contiene 10 ml de 1x HBSS. Agitar vigorosamente (20 - 30x) o vórtice, pasar por un filtro de células de 70 micras y retener el flujo a través. Repetir una vez más para asegurar la máxima recuperación de las criptas de piezas intestinales. Combinar el flujo a través de las fracciones y se centrifuga a 300 xg durante 5 min. Verter el sobrenadante y retener el sedimento cripta. NOTA: Los pellets se pueden utilizar inmediatamente para el cultivo (si procede) o se almacenaron a -80 ° C antes de procedimientos estándar de extracción de ADN / ARN / proteína.
7. Norma inmunohistoquímica Visualización
- Cortar 5 μm secciones de parafina de tejido embebido en poli-L-lisina (PLL) se desliza. Nota: Un protocolo estándar para la tinción con un anticuerpo B-catenina se da a continuación, los parámetros para otros anticuerpos se dan en la Tabla 2.
- De-cera con 2x 3 min lavados en baños de diapositivas que contienen xileno fresco. Rehidrate haciendo pasar los portaobjetos durante 3 min a través de baños de diapositivas que contienen fresco: 100% EtOH (2x), 95% de EtOH y 70% de EtOH y finalmente en 1x PBS.
- Colocar los portaobjetos en un baño de diapositiva que contiene tampón de citrato (pH 6) y se calienta 99,9 ° C durante 20 min para recuperar antígenos. Permitir que las diapositivas se enfríen y luego se lavan 3x 5 min en un baño de diapositivas contiene 1xTBS / T durante 5 min. Eliminar diapositivas de último lavado, dibujar inmediatamente alrededor del tejido con un lápiz PAP, y para abarcar la sección con un bloque comercial peroxidasa o 1,5% de H 2 O 2 (en destilada H 2 O).
- Incubar durante 20 minutos a temperatura ambiente (TA) luego lavar 3 veces en los baños de diapositivas que contienen TBS 1x fresca / T durante 5 min. Después de lavadoing secciones de cubierta, utilizando una pipeta, en 5% de suero normal de conejo (NRS) / 1xTBS / T durante 30 min a TA para bloquear hidrófobo unión no específica de su anticuerpo primario.
- Retire el bloque NRS con una pipeta y la cubierta de la sección Pasteur de anticuerpo primario-B catenina diluido 1: 200 con 5% NRS. Lavar los portaobjetos de 3x 5 min en baños de diapositivas que contienen 1xTBS frescas / T. Nota - otros anticuerpos requerirán optimización para la dilución y especificidad. Para asegurar la especificidad de un anticuerpo, se deben realizar apropiadas no hay anticuerpos de isotipo y las manchas de control. Un control de isotipo está adaptado a las especies huéspedes y isotipo de su anticuerpo primario.
- Visualizar ya sea con un kit comercial de detección de HRP o con un anticuerpo secundario marcado con fluorescencia apropiado (Tabla 2). NOTA: La longitud de desarrollo difiere para cada anticuerpo, por β-catenina 10 - 15 segundos es normalmente suficiente. Para optimizar el desarrollo de una primera est anticuerpoablish la longitud de tiempo requerido para visualizar las células positivas utilizando un portaobjetos de control positivo y luego aplicar esto a todas las diapositivas posteriores.
- Lavar los portaobjetos de 3x 5 min en baños de diapositivas que contienen frescos TBS / T. Contratinción diapositivas mediante la inmersión en un baño de diapositivas contiene hematoxilina de ~ 45 segundos (no es necesario si usando la etiqueta fluorescente anticuerpos secundarios). Ponga las diapositivas en un baño portaobjetos limpio y enjuague con agua corriente durante ~ 1 min, asegurando la hematoxilina no está completamente lavada.
- Deshidratar diapositivas haciendo pasar a través de baños de diapositivas que contienen concentraciones crecientes de alcoholes; 1x 30 seg en 70% de EtOH, 1x 30 seg en 95% EtOH, 2x 30 seg lavados en EtOH al 100%, 2x 2 min en xileno.
- Monte desliza bajo un cubreobjetos usando un medio de montaje comercial. NOTA: Si utiliza el anticuerpo marcado con fluorescencia montar con un medio que contiene DAPI para etiquetar el núcleo.
8. Identificación de histológico específico intestinaLas células epiteliales l
- Enterocitos
- Preparar secciones utilizando la sección 7 con el anticuerpo vellosidades y las condiciones descritas en la Tabla 2.
- Células entero-endocrinas (Grimelius mancha 18,19).
- Preparar secciones siguiendo los pasos 7.1 a 7.2. Lavar los portaobjetos en un baño de diapositivas que contiene agua ultrapura durante 3 min. Transferir los portaobjetos a un baño de diapositiva que contiene solución de plata precalentado (Tabla 1) y se incuba a 60 ° C durante 3 hr.
- Retire las diapositivas de la solución de plata y el lugar en un baño de diapositivas que contiene solución reductor precalentado recién preparada (Tabla 2) a 45 ° C durante 3 min. Retire los portaobjetos y colocar en un baño de diapositivas que contiene agua ultrapura fresca durante 3 min. Siga los pasos de la sección 7 7/6 a 7/8.
- Las células caliciformes (Alcian azul mancha).
- Preparar secciones siguiendo los pasos 7,1-7,2 .. diapositivas de transferencia a un baño de diapositivas contiene Alcián Blue pH 2,5 durante 5 min a RT. Quite la mancha azul Alcian con una pipeta y el lugar de baño de diapositivas bajo el grifo durante 3 - 5 min. Siga los pasos 7.6 a 7.8. NOTA: solución de azul de Alcian puede retenerse para su uso posterior.
- ISC.
- Para identificar los ISC sección 9 siguen.
- Células de Paneth.
- Preparar secciones sección 7 utilizando el anticuerpo lisozima y las condiciones descritas en la Tabla 2 siguiente.
9. Detección de ARN in situ con el murino Intestino 19-21
- Coloque 5 micras secciones de formalina delgado fijo (sección 3) en portaobjetos de PLL. Preparar una digoxigenina etiquetados sonda de ARN linealizado para detectar Olfm4 expresión 21. Desparafinar y rehidratar secciones según la sección 7. NOTA: Este protocolo se debe realizar en un ambiente libre de RNAsa para prevenir la degradación de la sonda de ARN.
- Dibuja alrededor de tproblema con una pluma PAP para minimizar los reactivos. Incubar las secciones en un baño de diapositivas con 6% de H 2 O 2 (en H2O destilada) durante 30 minutos. Lavar dos veces en un baño de diapositivas con 1x PBS fresca durante 3 min. Deseche PBS 1x y, usando una pipeta, sección de la cubierta con paraformaldehído al 4% durante 20 minutos en hielo.
- Lavar dos veces en un baño de diapositivas con 1x PBS fresca durante 3 min. El uso de un tramos cubierta pipeta con solución de proteinasa K durante 5 minutos en un baño de lavado de diapositivas con 1x PBS fresca durante 3 min. Con una pipeta secciones post-fix cubriendo en paraformaldehído al 4% durante 5 minutos a temperatura ambiente.
- Lave en un baño de diapositivas con DEPC H 2 0 tratados durante 2 min. Usando una pipeta de secciones de cubierta en solución anhídrido acético durante 10 min con agitación. Lavar en un baño fresco de diapositivas con 1x PBS / 3 min, seguido de 1x solución salina / 3 min. Pase diapositivas a través de baños que contienen concentraciones crecientes de alcoholes; 1x 30 seg en 70% de EtOH, 1x 30 seg en 95% EtOH, 2x 30 lavados en la SEC fresca 100% EtOH,2x 2 min en xileno dulce y dejar secar al aire.
- Diluir Olfm4 sonda 1: 100 en tampón de hibridación y desnaturalizar la sonda por calentamiento a 80ºC durante 3 min. Aplicar 100 l de sonda para cada sección y cubrir con parafina para prevenir la deshidratación de la diapositiva. Incubar durante la noche en una cámara húmeda oscuridad a 65 ° C.
- Lave en un baño de diapositivas con 5 × SSC a 65 ° C durante 15 minutos. Lavar las secciones en un baño de diapositivas fresco dos veces con 50% de formamida / 5 x SSC / 1% de SDS durante 30 min a 65 ° C. Lávese las secciones dos veces en un baño de diapositiva en fresco PBT durante 10 minutos, el primero a los 65 ° C y la segunda a RT. El uso de un tramos cubierta pipeta con PBT que contiene 25 mg de ARNasa durante 45 minutos a 37 ° C. Lavar las secciones en un baño de diapositiva en PBT durante 5 min a RT.
- Lavar las secciones en un baño de diapositivas fresco dos veces con 50% de formamida / 5 x SSC durante 30 min a 65 ° C. Para bloquear las secciones de la cubierta utilizando una pipeta con 10% de suero de ovejas en PBT y guárdela en un lugar oscuro, moicámara de st a temperatura ambiente durante 2-3 horas.
- Preparar la dilución de anticuerpo de anticuerpos por la fosfatasa alcalina anti-digoxigenina conjugado a 1: 500 con 10% de suero de ovejas en PBT que contiene 5 mg / ml de polvo intestinal de ratón. Incubar durante 3 horas a 4 ° C en la oscuridad en una plataforma oscilante. Haga girar hacia abajo para quitar el exceso de polvo intestinal y agregar volúmenes 3x de 1% de suero de ovejas en PBT al sobrenadante.
- Retire cuadra de diapositivas con una pipeta y añadir 100 l de la solución de anticuerpo a cada sección, cubrir con parafilm y se incuba en una cámara húmeda oscuridad a 4 ° C durante la noche. Lávese las secciones en un baño de diapositivas 3 × con frescos PBT durante 5 min. Para bloquear secciones se lavan en un baño de diapositivas 3 x con tampón NTMT fresca durante 5 min.
- Para visualizar, usando cubre una pipeta cada sección con BM púrpura y se incuba en la oscuridad a temperatura ambiente durante 24 a 72 horas hasta que un color suficientemente fuerte desarrolla. Lávese las secciones en un baño de diapositivas una vez en la valoración PBT y contrateñir sumergiendo en eosina durante 1 min. Remove exceso de eosina de secciones de lavado en un baño de diapositivas bajo un chorro de agua durante 3 - 5 min. Sumergir los portaobjetos en xileno y dejar secar al aire. Monte bajo un cubreobjetos utilizando los medios de comunicación comerciales.
10. histológico Caracterización de Intestinal epitelios
- Coloque 5 micras secciones del tejido fijado (artículo 3 y 4) en portaobjetos de PLL. Analizar ≥25 entero aleatorio (o ≥50 media) criptas de ≥ 4 ratones de cada cohorte para cada uno de los siguientes parámetros. NOTA: Para mantener la coherencia analizar criptas desde la misma ubicación de cada delgado (sólo utilice el extremo proximal).
- Parámetros celulares de las secciones teñidas estándar H & E (a menos que se indique lo contrario): número de la cripta, la altura, la apoptosis y la mitosis.
- Número Cripta.
- Utilice una magnificación de baja potencia (por ejemplo, 4X o 10X) para contar manualmente el número de criptas en contacto con la capa basal. Cuente ≥10 transversal secta delgado proximaliones a partir de al menos 4 ratones.
- Altura Cripta.
- Utilice una magnificación de alta energía (por ejemplo, 20X o 40X) para contar manualmente el número de células de la parte inferior de la cripta a la cripta / vellosidad eje (Figura 3b).
- La apoptosis 22, 23.
- Método 1: Utilizar una magnificación de alta potencia (por ejemplo, 20X o 40X.) Para contar manualmente el número de células apoptóticas en cada cripta. Las células apoptóticas pueden ser identificados por el encogimiento celular, la condensación de la cromatina, formación de vesículas citoplasmáticas y cuerpos apoptóticos (figura 3A).
- Método 2: Realice una mancha IHC (sección 7) para la caspasa-3 usando las condiciones descritas en la Tabla 2 Usando una magnificación de alta energía (por ejemplo, 20X o 40X.) Contar manualmente el número de células positivas en cada cripta para cuantificar las células en el. fase de ejecución de la apoptosis.
- Mitosis.
- Utilice una magnificación de alta energía (por ejemplo, 20X o 40X) para contar manualmente el número de células mitóticas en cada cripta. Células mitóticas contienen condensan material de ADN y son típicamente simétrica y bien formados (Figura 3b).
- Proliferación.
- Realizar una IHC (sección 7) la mancha para Ki-67 usando las condiciones descritas en la Tabla 2. Contar manualmente las células positivas para cuantificar la proporción de células de las criptas en proliferación.
- Número Cripta.
Resultados
Al comparar ISC recombinación Eficiencia en el Ah-cre y Vil-Cre-ER Sistemas T2
El uso de estos sistemas cre-lox para evaluar el papel de las células de Paneth, en repoblar el intestino después del daño, la caracterización requerida de la eficiencia de la recombinación dentro de la ISC. Usando el reportero condicional Rosa26R-lacZ demostramos que en ambos sistemas de 3 días después de la inducción (dpi) hay ~ 100% de recombinación en el intestino delgado (Figura 1a). Cuantificar la presencia del alelo recombinado mediante qPCR se confundió por las diferencias en los patrones de expresión Cre entre los sistemas. El sistema T2 Vil-Cre-ER mostró un aumento de 3,53 veces en la presencia del alelo recombinado en comparación con el sistema de Ah-cre, debido a su expresión en una mayor proporción de la epitheliun 16. Para superar esto hemos adoptado una estrategia diferente que nos permitió comparar directamente los sistemas. Nos induce a los ratones con diferentes regímenes de inducción y analizado a 30 dpi, a la que criptas positivos punto LacZ y vellosidades representan un evento de recombinación ISC. Con este enfoque hemos demostrado que en ambos sistemas, 3 inyecciones de agente inductor (entregado IP a 80 mg / kg en 24 h), recombinados en un número equivalente de ISC a pesar de los niveles de recombinación iniciales siendo mucho mayor en el vil-Cre-ER T2 sistema 16 (Figura 1b-d). Además, utilizando el ADN extraído de las criptas recombinados, qPCR para los alelos recombinados demostró un aumento no significativo en la recombinación utilizando el sistema de ER T2 Vil-Cre, potencialmente debido a la recombinación en las células de Paneth no observado utilizando el sistema de Ah-cre (Figura 1d). Además, la tinción de tipos de células epitelios no lo hizo indiCate cualquier alteración al patrón de diferenciación, las imágenes representativas de cada tipo de célula investigado se muestra en la Figura 2e-2h.
Caracterización de los epitelios intestinales siguiente Catnb Supresión
La cuantificación de la pérdida de Cripta
La caracterización de la cinética de la recombinación en estos sistemas Cre nos permitió analizar el intestino del ratón cuando se recombinan números equivalentes de ISC. Usando el reportero LacZ ambos sistemas mostraron una pérdida completa de las células recombinadas (azul) en 3 dpi (Figura 2a). Como se informó anteriormente tres días después de la eliminación de Catnb los ratones Ah-cre mostraron pérdida parcial cripta, mientras que los ratones T2 vil-Cre-ER demostraron la destrucción completa de la cripta / vellosidad eje 13,16,24 (Figura 2b-d).
Dinámica de epitelial Repoblación
Utilizando las técnicas anteriormente nos caracteriza múltiples parámetros que nos permiten entender esta observación. Imágenes representativas de los parámetros y tipos celulares analizadas utilizando protocolos de 7 - 10 de se dan en la (Figura 3a y 3b). En pocas palabras, la pérdida de criptas fue consistente con los niveles elevados de apoptosis mostradas en ambos sistemas (Figura 3e). Sin embargo, la mitosis, la proliferación, la altura celular cripta, cripta y de expresión (no se muestra) datos indicaron el sistema Ah-cre pudiera recuperarse, presumiblemente debido a la repoblación por las Naciones Unidas ISC-recombinado (Figura 3C). En comparación cruda, el vil-Cre-ER T2 no logró recuperarse a pesar de retener células de las criptas epiteliales (Figura 3d).
Caracterización de fenotipos celulares dentro de la cripta
Para entender por qué las criptas de los ratones Cre-Ah podrían repoblar mientras que el vil-Cre-ER T2 no podía nos caracteriza a las células epiteliales de tres días después de la eliminación de Catnb. El uso de la hibridación in situ (artículo 9) y el análisis IHC (sección 7, 8 y 10) hemos demostrado que las células de las criptas en las / los ratones flox vil-Cre-ER T2 Catnb flox eran no-proliferativa y carecíamos de expresión del marcador ISC Olfm4 , a diferencia de las criptas en los ratones Cre-Ah (Figura 4 C & F). A medida que la caracterización inicial había demostrado que la recombinación en criptas fue equivalente se procedió a examinar el papel de las células de Paneth. Se realizó una doble fluorescente IHC contra Catnb y Lyz1 para identificar qué células habían perdido β-catenina y si eran células de Paneth (Figura 5a-5c). Como ya se ha descrito que demonstrated que todas las células de las criptas se dirigen utilizando el sistema T2 vil-Cre-ER. En comparación, el sistema de Ah-cre perdonó las células de Paneth y el epitelio de las vellosidades. Otras células de Paneth fueron sólo observó apoptosis después de la eliminación Catnb utilizando el sistema T2 vil-Cre-ER (Figura 5d y 5e).
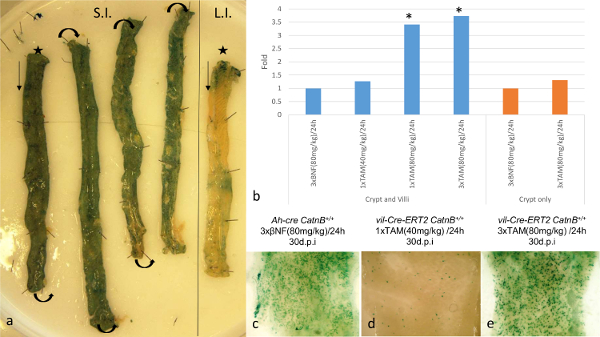
Figura 1: Comparación de la especificidad y la eficiencia de Cre / Lox recombinación dentro del intestino epitelio mediante el Ah-cre y Vil-Cre-ER Sistemas T2 (a):. Visualización de Ah-cre expresión reportero lacZ en wholemount pequeña (SI; * extremo distal) y grandes (LI; extremo distal *) de un tipo de ratón salvaje. (b): Resultados de qPCR Cambiar Listado de veces para el alelo Catnb flox recombinado en 1 ppp para comparar diferentes regímenes de inducción en Ah-cre Catnb flox / flox (BNF inducida) y vil-Cre-ER T2 Catnb flox / flox (TAM inducida ); * P> 0,05 (Mann-Whitney [2-tail] en comparación con el control). (c) - (e):.. intestino delgado wholemount mostrando LacZ cripta positivo 30 dpi El panel (b) - (e) modificado de Parry et al 16 Haga clic aquí para ver una versión más grande de esta figura.
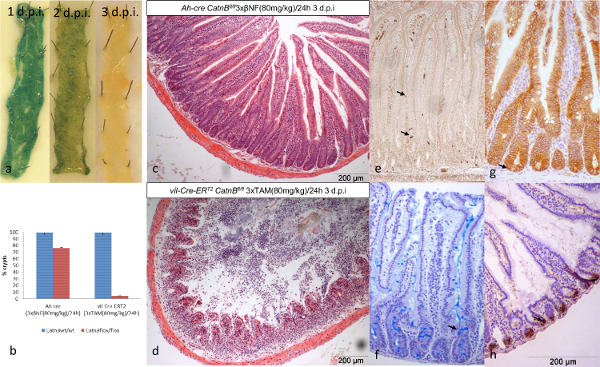
Figura 2: Comparación de los Ah-cre y Vil-Cre-ER T2 Sistemas de condicionalmente Eliminación Catnb en intestino delgado epitelio (a):. intestino delgado wholemount que muestra la pérdida de las células recombinados en ratones Ah-cre Catnb flox / flox LacZ + más de 3 días. (b): La cuantificación de la pérdida de la cripta de 3 días después de la eliminación de Catnb; * P> 0,05 (Mann-Whitney [2-tail] en comparación con el control). (c + d): Transversales en H & E de formalina delgado fijo que demuestran la pérdida de criptas después de la eliminación Catnb. (e) - (h) Ejemplo de tipos de células de ratones de control: (e) células entero-endocriine, (f) las células caliciformes, (g) Catnb IHC indica un ISC (→) con nuclear B-catenina y (h) Paneth las células. El panel (b) modificar desde Parry et al. 16. Haga clic aquí para ver una versión más grande de esta figura.
gether.within-page = "always"> 
Figura 3: Caracterización de la aparición de fenotipo cuando se utiliza el Ah-cre y Vil-Cre-ER Sistemas T2 para condicionalmente Eliminación Catnb en Números similares de ISC dentro del intestino delgado epitelio (ayb) H & E formalina manchado secciones fijas que indica la ubicación de la cripta. altura ([), un apoptótica (←) y celular mitótico (↓). La cuantificación del número medio de células por cripta entre el tipo salvaje (azul) y Catnb flox (naranja) ratones en tres puntos temporales (DPI) (C) de altura cripta, (d) la mitosis y (e) la apoptosis (barras de error indican la desviación estándar ). Panel (c) - (e) modificado a partir de Parry et al 16.3429fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 4:. Comparación de las Características del ISC utilizando Ah-cre y Vil-Cre-ER Sistemas T2 para condicionalmente Eliminación Catnb en las células de las criptas epitelios epiteliales del intestino delgado de 3 días después de la eliminación de Catnb utilizando el Ah-cre (ac) o vil- Cre-ER T2 sistema (df). (A & D) Sección H & E mostrando áreas de pérdida de la cripta; (b + d) Ki-67 IHC pérdida demostrando de las células proliferantes utilizando vil-Cre-ER T2; (C & F) Olfm4 in situ que demuestra presencia de ISC funcionales utilizando Ah-cre. El panel (a) -. (f) modificado de Parry et al 16 Haga clic aquí para ver una versión más grande de esta figura.
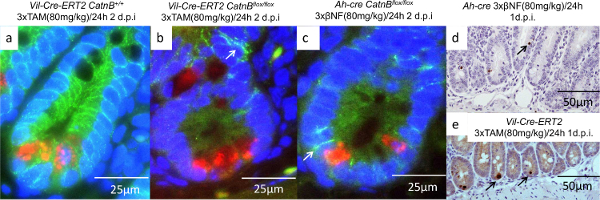
Figura 5: Caracterización de las células de Paneth después Catnb Supresión utilizando los sistemas T2 Vil-Cre-ER y Ah-cre (ac):. Inmunofluorescencia imágenes de criptas que muestran células Paneth (rojo), B-catenina (verde) y el núcleo (azul ), flecha indicará unida a la membrana β-catenina; (de) IHC para la caspasa-3 que indica las células de Paneth apoptóticos están ausentes en el Ah-cre (d), pero presente en el sistema Cre-vil-ER T2 (e). Panel (a) - (e) modificado a partir deParry et al 16. Haga clic aquí para ver una versión más grande de esta figura.
| Tampón de acetato | * | * | Para hacer 100 ml: 4,8 ml de 0,2 M de ácido acético, 45,2 ml de 0,2 M de sodio acetato y 50 ml de agua destilada |
| Ácido acético | Fisher Scientific | C / 0400 / PB17 | |
| Anhídrido acético | Sigma | A6404 | |
| Solución de anhídrido acético | * | * | 2 M anhídrido acético en hidrocloruro de trietanolamina 0,1 M |
| Azul Alcian | Sigma | A5268 | |
| Alcián PH Azul 2.5 | * | * | Para hacer 500 ml: 15 ml de ácido acético, agua 5 g Alcian Blue & 485 ml destilada |
| anti-digoxigenina fosfatasa alcalina anticuerpo conjugado | Abcam | ab119345 | |
| B (beta) -Naphthoflavone | Sigma | N3633 | BNF, inyectar sin permitir que la solución se enfríe demasiado, ya compuesto caerá fuera de la solución. Solución puede ser reutilizado - almacenar a -20 ° C entre los usos, no recalentar más de dos veces. |
| Bloxall | Vector Labs | SP-6000 | |
| BM púrpura | Roche | 11442074001 | |
| BSA | Sigma | A4503 | Albúmina de suero bovino |
| Cloroformo | Fisher Scientific | C / 4920/17 | |
| Citrato de búfer / Antígeno Solución Desenmascarando | Vector Labs | H-3300 | |
| Aceite de maíz | Sigma | C8627 | |
| Solución Demucifiying | * | * | Por 500 ml: 50 ml de glicerol, 50 ml de Tris 0,1 M pH 8,8, 100 ml de EtOH, 300 ml de solución salina (0,9% NaCl en agua), DTT 1,7 g. Solución Demucifying se puede hacer de antemano y se almacena, pero TDT sholud se añadirá justo antes de la incubación (340 mg / 100 ml). |
| DEPC agua tratada | Life Technologies | 750.023 | |
| TDT | Sigma | 101509944 | |
| EDTA | Sigma | O3690 | 0,5 M |
| Etanol | Fisher Scientific | E / 0650DF / 17 | |
| Papel de filtro | Qué hombre | 3000917 | |
| Formaldehído | Sigma | F8775 | |
| Formalina | Sigma | SLBL11382V | Formalina tamponada neutra |
| Formamida | Sigma | F5786 | |
| Glutaraldehído | Sigma | G6257 | |
| H 2 O 2 | Sigma | 216763 | |
| Hematoxilina | Raymond A Cordero | 12698616 | |
| HBSS | Gibco | 14175-053 | HBSS (-MgCl2 +; -CaCl2) |
| El tampón de hibridación | * | * | 5 x SSC, formamida al 50%, 5% SDS, 1 mg / ml de heparina, 1 mg / ml de tRNA de la pantorrilla hígado |
| La hidroquinona | Sigma | H9003 | |
| IMMPACT DAB peroxidasa | Vector Labs | SK-4105 | |
| Kit Immpress IgG anti-ratón HRP | Vector Labs | MP-7402 | |
| Immpress HRP anti-conejo IgG Kit | Vector Labs | MP-7401 | |
| Polvo de tejido intestinal | * | * | El intestino delgado de 5 ratones adultos se combinaron y se homogeneizaron en el volumen mínimo de PBS enfriado con hielo. 4 volúmenes de acetona enfriada con hielo se añadieron al intestino homogeneizada, que se mezcló a fondo y se incubó en hielo durante 30 min. Esto se centrifugó y el sedimento se lavó utilizando acetona enfriada con hielo. Este fue centrifugó adicionalmente y el sedimento resultante se extendió sobre papel de filtro y se deja secar. Una vez que se seque completamente el material se molió a un polvo fino utilizando un mortero. |
| K-ferricianuro | Sigma | P-3667 | |
| K-ferrocianuro | Sigma | P3289 | |
| Levamisol | Sigma | L0380000 | |
| Methacarn | * | * | 60% de metanol: 30% de cloroformo: ácido acético 10% |
| Metanol | Fisher Scientific | M / 4000/17 | |
| MgCl2 | Sigma | M8266 | |
| Suero normal de cabra | Vector Labs | S-1012 | NGS |
| Suero normal de conejo | Dako | X0902 | NRS |
| NTMT | * | * | NaCl 100 mM, Tris HCl 100 mM, MgCl2 50 mM, 0,1% de Tween 20, 2 mM Levamisol |
| PAP pluma | Vector | H-400 | |
| Paraformaldehído | Sigma | P6148 | |
| PBT | * | * | NaCl 0,5 M, T 10 mMrisHCL pH 7,5, 0,1% de Tween 20 |
| Penicilina / estreptomicina | Gibco | 15140-122 | Solutiuon 100x. |
| Tampón fosfato salino (10x) | Fisher Scientific | BP3994 | Diluidas 1:10 con agua destilada para hacer 1x |
| Diapositivas PLL | Sigma | P0425-72EA | Portaobjetos de poli-L-lisina |
| Proteinasa K | Sigma | P2308 | |
| Solución de proteinasa K | * | * | Diluir proteinasa K a 200 g / ml en Tris 50 mM, EDTA 5 mM. |
| Ralwax | BDH | 36154 7N | |
| Solución Reductor | * | * | Para hacer 100 ml: 1 g hidroquinona, 5 g de sulfito sódico y 100 ml de agua destilada |
| RNaseA | Sigma | R6148 | |
| Salina | * | * | 0,9% de NaCl en agua destilada |
| SDS | Sigma | I3771 | |
| Suero de oveja | Sigma | S3772 | |
| Nitrato de plata | Sigma | S / 1240/46 | |
| Solución de plata | * | * | Para hacer 100 ml: 10 ml de tampón de acetato, 87 ml de agua destilada, 3 ml 1% de nitrato de plata |
| Acetato de sodio | Fisher Scientific | S / 2120/53 | |
| Cloruro de sodio | Sigma | S6753 | NaCl |
| Sulfito de sodio | Sigma | 239.321 | |
| SSC | Sigma | 93017 | 20x citrato sódico salino |
| Cinta quirúrgica | Fisher Scientific | 12960495 | |
| El tamoxifeno | Sigma | T5648 | TAM, inyectar sin permitir que la solución se enfríe demasiado, ya compuesto caerá fuera de la solución. Solución puede ser reutilizado - almacenar a -20 ° C entre los usos, no recalentar más de dos veces. |
| TBS / T | Señalización Celular | # 9997 | |
| Hidrocloruro de trietanolamina | Sigma | T1502 | |
| Tris-HCl | Invitrogen | 15567-027 | |
| Tween 20 | Sigma | TP9416 | |
| VectaMount | Vector Labs | H-5000 | |
| VectaShield Hardset medio de montaje con DAPI | Vector Labs | H-1500 | |
| Kit Vectastain ABC | Vecto laboratorios | PK-4001 | |
| X-gal | Promega | V3941 | |
| Fijador X-gal | * | * | 2% de formaldehído, 0,1% de glutaraldehído en 1xPBS |
| Tinción X-gal | * | * | Tinción X-gal; 200 l X-gal (A) en 50 ml de solución B (0,214 g MgCl2, 0,48 g de K-ferricianuro, 0,734 g K-ferrocianuro en 500 ml de PBS). Solución B puede estar formado por oin antelación y se almacenó a 4 ° C |
| Xileno | Fisher Scientific | X / 0200/21 |
Tabla 1: Materiales y Métodos
d> 1/200, 30 min a TA| Objetivo | beta-catenina | La lisozima | Ki67 | Caspasa-3 | Villin |
| Fuente comercial de Ab primaria | Transduction Labs | Neomarkers | Vector Labs | R & D Systems | Santa Cruz |
| Número de catálogo | 610.154 | RB-372 | VP-K452 | AF835 | SC-7672 |
| Ab primaria creció en | Mouse (MAB) | Conejo (PAB) | Mouse (MAB) | Conejo (PAB) | Cabra (PAB) |
| La recuperación de antígenos | Baño de agua hirviendo / Tampón Citrato | Baño de agua hirviendo / tampón citrato | Baño de agua hirviendo / tampón citrato | Baño de agua hirviendo / tampón citrato | Baño de agua hirviendo / tampón citrato |
| Bloque peroxidasa | Bloxall o 2% de H 2 O 2, 45 s | Bloxall o 1,5% de H 2 O 2, 30 min | Bloxall o 0,5% de H 2 O 2, 20 min | Bloxall o 2%H 2 O 2, 45 s | Bloxall o 3% de H 2 O 2, 20 min |
| Bloque de Suero | 1% de BSA, 30 min | 10% NGS, 30min | 20% NRS, 20 min | 10% NGS, 45 min | 10% NRS, 30 min |
| Tampón de lavado | PBS | TBS / T | TBS / T | PBS | TBS / T |
| Condiciones para Ab primaria | 1/300, 2 horas a RT | 1/100, 1 hora a RT | 1/50, 1 hora a RT | 1/750, o / n a 4 ° C | 1/500, 1 hora a RT |
| Ab secundaria | Kit Immpress IgG anti-ratón HRP | Immpress HRP anti-conejo IgG Kit | Conejo biotinilado anti-ratón | Biotina cabra anti-conejo | Conejo biotinilado anti-cabra |
| Condiciones para Ab secundaria | 1 hr a RT | 30 minutos a RT | 1/200, 30 min a TA | 1/200, 30 min a TA | |
| Amplificación de señal | N / A | N / A | Kit ABC | Kit ABC | Kit ABC |
| La detección de la señal | IMMPACT DAB peroxidasa | IMMPACT DAB peroxidasa | IMMPACT DAB peroxidasa | IMMPACT DAB peroxidasa | IMMPACT DAB peroxidasa |
| Anticuerpos de inmunofluorescencia | Alexafluor 488 | Alexafluor 594 | N / A | N / A | N / A |
| Propiedades de inmunofluorescencia | Excitación Max 488 / Emisión Max 525 | Excitación Max 595 / Emisión Max 617 | |||
| Común Set Filter | FITC | Texas Red |
Discusión
Utilizando ratones transgénicos condicionales Cre-lox para diseccionar la función de los genes y las células es un enfoque comúnmente utilizado. Estos modelos se han utilizado con gran éxito en el intestino para identificar y caracterizar las células madre 2,4-6 y comprender su papel en la enfermedad 25. Para aprovechar al máximo estos modelos requiere una caracterización completa del sistema para permitir que los datos deben interpretarse correctamente. Una comprensión completa de estos sistemas es difícil de lograr debido a los genes rara vez ser específico para un tipo de célula solitario o ubicación, una falta de conocimiento biológico y la ineficiencia de los sistemas utilizados para inducir la expresión Cre. Los métodos descritos aquí demuestran cómo podemos superar estos problemas a través del diseño experimental y aplicación del conocimiento existente. Aunque hemos utilizado estos métodos para responder a una pregunta específica de investigación las técnicas que aquí se presenta es genérico y puede ser explotado para cualquier investigación que investiga el muridelgado ne.
Preparación de tejido intestinal
El paso fundamental para garantizar resultados sólidos es la recolección y procesamiento de los tejidos, que necesita ser procesada de una manera y de fijación oportunos protocolos estrictamente. Como casi todos los temas significativos aguas abajo se pueden atribuir a artefactos asociados con el secado del tejido y / o fijación incompleta. El tiempo es crucial para prevenir la degradación de la arquitectura del tejido y / o ácidos nucleicos y proteínas. Fijación incompleta o exceso de celo puede resultar en la pérdida de resolución histoquímica. Fijación incompleta por falta de tiempo o secciones demasiado gruesas para permitir la penetración fijador puede resultar en la pérdida de resolución dentro de las criptas intestinales que pueden observarse como una "marca de la marea" en el análisis IHC insuficiente. Además, es crucial que la fijación no se extiende por mucho tiempo, como β-catenina nuclear puede difundirse fuera del núcleo a menos de inmediato prorebajada y cera incrustado tras la fijación en formol.
Papel de las células de Paneth en el nicho de ISC
Los datos presentados aquí muestran efectivamente la importancia de las células de Paneth en la regeneración cripta en el intestino de adultos después de la pérdida de ISC. Sin embargo quedaba la posibilidad de que Ah-cre escatima una población de ISC que los objetivos T2 vil-Cre-ER. Tian et al. 26 demostraron elegantemente que los hi ISC LGR5 se sustituyen por una población de ISC reserva LGR5 del lo. Ahora parece probable que estos ISC se libran en el sistema de Ah-cre debido a la población de reserva de haber sido identificado como precursores de células secretoras 6,7. La importancia de la célula de Paneth madura en el apoyo a estos precursores de células secretoras cuando sea necesario para volver a un estado ISC queda por responder. Como las células de Paneth constituyen la ISC nicho 8 y desempeñar un papel en la regulación de las respuestas del ISC a la ingesta de calorías y la inflamación 27 28 sigue siendo probable que sus funciones de enfermería se extenderán a sus precursores.
Nuevos enfoques y tecnologías para Efectivamente Modelo Humano Cáncer Colorrectal
El descubrimiento de la ISC condujo a la identificación de los genes que están siendo utilizados para generar nuevos modelos de ratón para investigar el papel de los genes y las células en la biología y la enfermedad intestinal, revisado por Clarke et al 9. Las únicas limitaciones de esta técnica es la identificación de genes para expresar la proteína Cre. Actualmente ISC se investigan rutinariamente utilizando ratones transgénicos condicionales basados en el patrón de expresión génica LGR5. Los ratones que expresan Cre a partir del promotor LGR5 se han utilizado para eliminar Apc, el gen más comúnmente mutado en el cáncer colorrectal (CRC), Lo que demuestra la ISC como la célula de origen 25. Selectivamente borrar otros genes CRC en estas células está proporcionando información sobre progresión de la enfermedad y se extendió por ejemplo. PTEN 29. Una mayor comprensión de la función de ISC está siendo recuperado por ablación específicamente LGR5 expresando células en ratones usando un receptor de toxina de la difteria humana gen (DTR) noqueó en el LGR5 locus 26. Otras estrategias usan el sistema Tet-O, que permite la expresión reversible en curso de las proteínas mutantes 30. El uso de estas herramientas para modificar el gen (s) en diferentes células 31 y ubicaciones 32,33 se utiliza para comprender cómo iniciar el cáncer, el progreso y la metástasis 34. Alternativamente mutagénesis usando el sistema de la belleza transposón dormir es la identificación de nuevos controladores de CRC. El continuo desarrollo de los ratones, las técnicas y estrategias de alteración genética continúa desarrollando modelos relevantes más pacientes.
Nueva métodos se han desarrollado para la caracterización de los epitelios intestinales y ISC. Caracterización de la proporción de tipos de células epiteliales se puede lograr utilizando citometría de flujo basado en la expresión diferencial de lectina y CD24 35. Potencialmente el mayor progreso en la biología comprensión ISC y su papel en la enfermedad se realizarán mediante el sistema vivo organoid ex cultura 36. Este sistema permite ISC normales y malignas a la cultura en 3D, donde se replican y se diferencian de una manera más fisiológicamente relevante. Se espera que estos permitirán a la prueba directa de las drogas en muestras de pacientes in vitro, allanando el camino para la medicina personalizada 37.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors would like to thank Mark Bishop, Mathew Zverev, Victoria Marsh-Durban, Adam Blackwood and Sylvie Robine. This work was funded by a programme grant from Cancer Research UK.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetate buffer | * | * | To make 100 ml: 4.8 ml 0.2 M Acetic acid, 45.2 ml 0.2 M Sodium acetate & 50 ml distilled water |
| Acetic acid | Fisher Scientific | C/0400/PB17 | |
| Acetic anhydride | Sigma | A6404 | |
| Acetic anhydride solution | * | * | 2 M Acetic anhydride in 0.1 M triethanolamine hydrochloride |
| Alcian Blue | Sigma | A5268 | |
| Alcian Blue pH 2.5 | * | * | To make 500 ml: 15 ml acetic acid, 5 g Alcian Blue & 485 ml distilled water |
| anti-digoxigenin alkaline phosphatase conjugated antibody | Abcam | ab119345 | |
| B(beta)-Naphthoflavone | Sigma | N3633 | BNF, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| Bloxall | Vector Labs | SP-6000 | |
| BM purple | Roche | 11442074001 | |
| BSA | Sigma | A4503 | Bovine serum albumin |
| Chloroform | Fisher Scientific | C/4920/17 | |
| Citrate Buffer/Antigen Unmasking Solution | Vector Labs | H-3300 | |
| Corn oil | Sigma | C8627 | |
| Demucifiying solution | * | * | For 500 ml: 50 ml glycerol, 50 ml Tris 0.1M pH8.8, 100 ml EtOH, 300 ml saline (0.9% NaCl in water), DTT 1.7 g. Demucifying solution can be made in advance and stored, but DTT sholud be added just before incubation (340 mg/100 ml). |
| DEPC treated water | Life Technologies | 750023 | |
| DTT | Sigma | 101509944 | |
| EDTA | Sigma | O3690 | 0.5M |
| Ethanol | Fisher Scientific | E/0650DF/17 | |
| Filter paper | Whatman | 3000917 | |
| Formaldehyde | Sigma | F8775 | |
| Formalin | Sigma | SLBL11382V | Neutral buffered formalin |
| Formamide | Sigma | F5786 | |
| Glutaraldehye | Sigma | G6257 | |
| H2O2 | Sigma | 216763 | |
| Haematoxylin | Raymond A Lamb | 12698616 | |
| HBSS | Gibco | 14175-053 | HBSS (-MgCl2+; -CaCl2) |
| Hybridisation buffer | * | * | 5× SSC, 50% formamide, 5% SDS, 1 mg/ml heparin, 1 mg/ml calf liver tRNA |
| Hydroquinone | Sigma | H9003 | |
| ImmPACT DAB Peroxidase | Vector Labs | SK-4105 | |
| Immpress HRP Anti-Mouse IgG Kit | Vector Labs | MP-7402 | |
| Immpress HRP Anti-Rabbit IgG Kit | Vector Labs | MP-7401 | |
| Intestinal tissue powder | * | * | The small intestines of 5 adult mice were combined and homogenised in the minimum volume of ice cold PBS. 4 volumes of ice cold acetone were added to the homogenised intestine, which was mixed thoroughly and incubated on ice for 30 min. This was centrifuged and the pellet was washed using ice cold acetone. This was further centrifuged and the resulting pellet spread onto filter paper and allowed to dry. Once thoroughly dry the material was ground to a fine powder using a pestle and mortar. |
| K-ferricyanide | Sigma | P-3667 | |
| K-ferrocyanide | Sigma | P3289 | |
| Levamisole | Sigma | L0380000 | |
| Methacarn | * | * | 60% Methanol:30% Chloroform:10% Acetic acid |
| Methanol | Fisher Scientific | M/4000/17 | |
| MgCl2 | Sigma | M8266 | |
| Normal goat serum | Vector Labs | S-1012 | NGS |
| Normal rabbit serum | Dako | X0902 | NRS |
| NTMT | * | * | 100 mM NaCl, 100 mM Tris HCl, 50 mM MgCl2, 0.1% Tween20, 2 mM Levamisole |
| PAP pen | Vector | H-400 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBT | * | * | 0.5 M NaCl, 10 mM TrisHCL pH7.5, 0.1% Tween 20 |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100x solutiuon. |
| Phosphate buffered saline (10x) | Fisher Scientific | BP3994 | Dilluted 1:10 with distilled water to make 1x |
| PLL slides | Sigma | P0425-72EA | Poly-L-lysine microscope slides |
| Proteinase K | Sigma | P2308 | |
| Proteinase k solution | * | * | Dilute Proteinase K at 200 µg/ml in 50 mM Tris, 5 mM EDTA. |
| Ralwax | BDH | 36154 7N | |
| Reducer Solution | * | * | To make 100 ml: 1 g Hydroquinone, 5 g sodium sulphite & 100 ml distilled water |
| RnaseA | Sigma | R6148 | |
| Saline | * | * | 0.9% NaCl in distilled water |
| SDS | Sigma | I3771 | |
| Sheep serum | Sigma | S3772 | |
| Silver nitrate | Sigma | S/1240/46 | |
| Silver solution | * | * | To make 100 ml: 10 ml Acetate buffer, 87 ml distilled water, 3 ml 1% silver nitrate |
| Sodium acetate | Fisher Scientific | S/2120/53 | |
| Sodium Chloride | Sigma | S6753 | NaCl |
| Sodium sulfite | Sigma | 239321 | |
| SSC | Sigma | 93017 | 20x saline sodium citrate |
| Surgical tape | Fisher Scientific | 12960495 | |
| Tamoxifen | Sigma | T5648 | TAM, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| TBS/T | Cell Signalling | #9997 | |
| Triethanolamine hydrochloride | Sigma | T1502 | |
| Tris-HCL | Invitrogen | 15567-027 | |
| Tween20 | Sigma | TP9416 | |
| VectaMount | Vector Labs | H-5000 | |
| VectaShield Hardset mounting Medium with DAPI | Vector Labs | H-1500 | |
| Vectastain ABC Kit | Vector Labs | PK-4001 | |
| X-gal | Promega | V3941 | |
| X-gal fixative | * | * | 2% formaldehyde, 0.1% glutaraldehyde in 1x PBS |
| X-gal stain | * | * | X-gal stain; 200 μl X-gal (A) in 50 ml solution B (0.214 g MgCl2, 0.48 g K-ferricyanide, 0.734 g K-ferrocyanide in 500 ml PBS). Solution B can be made up oin advance and stored at 4 °C |
| Xylene | Fisher Scientific | X/0200/21 |
Referencias
- Cheng, H., Origin Leblond, C. P. differentiation and renewal of the four main epithelial cell types in the mouse small intestine. V. Unitarian Theory of the origin of the four epithelial cell types. Am J Anat. 141 (4), 537-561 (1974).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Clevers, H. The gut, a clonal conveyor belt. , Available from: http://www.molecularmovies.com/movies/view/96 (2015).
- Snippert, H., et al. Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells. Cell. 143 (1), 134-144 (2010).
- Lopez-Garcia, C., Klein, A. M., Simons, B. D., Winton, D. J. Intestinal stem cell replacement follows a pattern of neutral drift. Science. 330 (6005), 822-825 (2010).
- Buczacki, S. J., et al. Intestinal label-retaining cells are secretory precursors expressing Lgr5. Nature. 495 (7439), 65-69 (2013).
- Basak, O., et al. Mapping early fate determination in Lgr5+ crypt stem cells using a novel Ki67-RFP allele. EMBO J. 33 (18), 2057-2068 (2014).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Young, M., Ordonez, L., Clarke, A. R. What are the best routes to effectively model human colorectal cancer. Molecular oncology. 7 (2), 178-189 (2013).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proc Natl Acad Sci U.S.A. 85 (14), 5166-5170 (1988).
- Brault, V., et al. Inactivation of the beta-catenin gene by Wnt1-Cre-mediated deletion results in dramatic brain malformation and failure of craniofacial development. Development. 128 (8), 1253-1264 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/β-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Molecular and Cellular Biology. 27 (21), 7551-7559 (2007).
- Ireland, H., et al. Inducible Cre-mediated control of gene expression in the murine gastrointestinal tract: effect of loss of beta-catenin. Gastroenterology. 126 (5), 1236-1246 (2004).
- Kemp, R., et al. Elimination of background recombination: somatic induction of Cre by combined transcriptional regulation and hormone binding affinity. Nucleic Acids Res. 32 (11), e92(2004).
- Madison, B. B., et al. Cis elements of the villin gene control expression in restricted domains of the vertical (crypt) and horizontal (duodenum, cecum) axes of the intestine. J Biol Chem. 277 (36), 33275-33283 (2002).
- Parry, L., Young, M., El Marjou, F., Clarke, A. R. Evidence for a crucial role of paneth cells in mediating the intestinal response to injury. Stem Cells. 31 (4), 776-785 (2013).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21 (1), 70-71 (1999).
- el Marjou, F., et al. Tissue-specific and inducible Cre-mediated recombination in the gut epithelium. Genesis. 39 (3), 186-193 (2004).
- Guillemot, F., Nagy, A., Auerbach, A., Rossant, J., Joyner, A. L. Essential role of Mash-2 in extraembryonic development. Nature. 371 (6495), 333-336 (1994).
- Gregorieff, A., et al. Expression pattern of Wnt signaling components in the adult intestine. Gastroenterology. 129 (2), 626-638 (2005).
- van der Flier, L. G., Haegebarth, A., Stange, D. E., van de Wetering, M., Clevers, H. OLFM4 is a robust marker for stem cells in human intestine and marks a subset of colorectal cancer cells. Gastroenterology. 137 (1), 15-17 (2009).
- Merritt, A., Allen, T., Potten, C., Hickman, J. Apoptosis in small intestinal epithelial from p53-null mice: evidence for a delayed, p53-independent G2/M-associated cell death after gamma-irradiation. Oncogene. 14 (23), 2759-2766 (1997).
- Marshman, E., Ottewell, P., Potten, C., Watson, A. Caspase activation during spontaneous and radiation-induced apoptosis in the murine intestine. J Pathol. 195 (3), 285-292 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/beta-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Mol Cell Biol. 27 (21), 7551-7559 (2007).
- Barker, N., et al. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature. 457 (7229), 608-611 (2009).
- Tian, H., et al. A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable. Nature. 478 (7368), 255-259 (2011).
- Yilmaz, O. H., et al. mTORC1 in the Paneth cell niche couples intestinal stem-cell function to calorie intake. Nature. 486 (7404), 490-495 (2012).
- Adolph, T. E., et al. Paneth cells as a site of origin for intestinal inflammation. Nature. 503 (7475), 272-276 (2013).
- Marsh, V., et al. Epithelial Pten is dispensable for intestinal homeostasis but suppresses adenoma development and progression after Apc mutation. Nat Genet. 40 (12), 1436-1444 (2008).
- Jardé, T., et al. In vivo and in vitro models for the therapeutic targeting of Wnt signaling using a Tet-OΔN89β-catenin system. Oncogene. 32 (7), 883-893 (2013).
- Hung, K. E., et al. Development of a mouse model for sporadic and metastatic colon tumors and its use in assessing drug treatment. Proc Natl Acad Sci U S A. 107 (4), 1565-1570 (2010).
- Dacquin, R., Starbuck, M., Schinke, T., Karsenty, G. Mouse alpha1(I)-collagen promoter is the best known promoter to drive efficient Cre recombinase expression in osteoblast. Dev Dyn. 224 (2), 245-251 (2002).
- Hinoi, T., et al. Mouse model of colonic adenoma-carcinoma progression based on somatic Apc inactivation. Cancer Res. 67 (20), 9721-9730 (2007).
- Sansom, O. J., et al. Loss of Apc allows phenotypic manifestation of the transforming properties of an endogenous K-ras oncogene in vivo. Proc Natl Acad Sci U.S.A. 103 (38), 14122-14127 (2006).
- Wong, V. W., et al. Lrig1 controls intestinal stem-cell homeostasis by negative regulation of ErbB signalling. Nat Cell Biol. 14 (4), 401-408 (2012).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- van de Wetering, M., et al. Prospective Derivation of a Living Organoid Biobank of Colorectal Cancer Patients. Cell. 161 (4), 933-945 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados