Method Article
Protocolos para analisar o papel das células Paneth em Regenerar o Intestino Murino utilizando Condicional
Neste Artigo
Resumo
Células-tronco do epitélio intestinal (ISC) são misturados com células de Paneth. Estas células são diferenciadas progênie do ISC, que suportam o ISC e fornecer proteção antibacteriana. Aqui demonstramos como nós usamos modelos de ratos transgénicos condicionais para estabelecer que as células de Paneth desempenham um papel crucial na manutenção dos epitélio intestinal.
Resumo
A superfície epitelial do intestino de mamífero é um tecido dinâmico que renova a cada 3 - 7 dias. Entender esse processo de renovação identificou uma população de células-tronco rapidamente de bicicleta intestinais (ISC) caracterizados pela sua expressão do gene Lgr5. Estas são suportadas por uma população de células estaminais quiescentes, marcado por Bmi-1 expressão, capaz de substitui-los em caso de danos. Investigar as interações entre essas populações é crucial para entender seu papel na doença e cancro. As ISC existir dentro de criptas na superfície intestinal, esses nichos apoiar a ISC na reposição do epitélio. A interação entre ISC ativos e quiescentes provável envolve outras células diferenciadas dentro do nicho, como já foi anteriormente demonstrado que a '' stemness '' do Lgr5 ISC está intimamente ligada à presença de vizinhos as suas células de Paneth. Usando condicional rato cre-loxmodelos testámos o efeito da delecção da maior parte do ISC activo na presença ou ausência das células de Paneth. Aqui nós descrevemos as técnicas e análises realizados para caracterizar o intestino e demonstrar que as células de Paneth desempenham um papel crucial dentro do nicho ISC em ajudar a recuperação após insulto substancial.
Introdução
A superfície luminal do intestino de mamífero apresenta unidades de criptas e repetindo dedo como projecções, denominado vilosidades, que se projectam para dentro do lúmen. Esta superfície é uma folha contínua do epitélio, que é submetido a auto-renovação completa aproximadamente a cada 3 - 4 dias 1. Este tecido dinâmico é suportado por uma população de células estaminais rapidamente bicicleta (ISC, também conhecido como base de cripta células colunares), que foram inicialmente identificadas pela sua expressão do gene Lgr5 2,3. Estas células existir num nicho especializado na parte inferior das criptas de Lieberkuhn. Inicialmente, a descoberta de que ISC foram ciclismo rapidamente foi discordante com a idéia predominante de que uma célula-tronco foi de repouso na natureza. Anterior à identificação do Lgr5 + ISC foi postulado que uma população de células quiescentes etiqueta na posição 4, em relação à base da cripta de retenção, foram a ISC 1. Recentes pesquisas hcomo agora reconciliou essas observações, demonstrando que principalmente há uma piscina de ciclismo equipotent ISC em cada cripta cujo destino são regulados por seus vizinhos 4,5. No caso de serem perdidos estes podem ser substituídos por células quiescentes que normalmente são comprometidos com a linhagem secretora, mas pode reverter a ISC se a população ISC está danificado 6.
Vizinhos ISC pode ser ISC ou suas células filhas. As ISC produzir células filhas virgens de tratamento que se multiplicam e se diferenciam em tipos de células especializadas que compõem a folha epitelial que reveste o lúmen intestinal 1. O cálice, enteroend�rina, enterócitos, topete e células M migrar para cima, para a superfície luminal onde eles fornecem várias funções de absorção e de regulamentação, no entanto, as células de Paneth permanecem no fundo da cripta onde eles existem misturados com o ISC. Nos últimos anos, tem sido demonstrado que uma parte do daught naïveer células destinados a uma linhagem secretora são etiqueta de repouso reter células Lgr5 lo capaz de reverter a uma ISC sobre lesão 6,7.
Devido a sua importância na regeneração cripta uma prioridade foi colocado na compreensão das interações entre a ISC e os seus vizinhos, particularmente as células de Paneth. As células de Paneth desempenham um papel crucial no nicho que apoia a ISC 8. Em adição aos produtos bactericidas as células de Paneth produzir moléculas de sinalização que activam as vias que regulam ISC renovação ou diferenciação. Estudos anteriores mostraram que o Lgr5 + ISC só poderia existir quando eles poderiam competir para sinais de nicho essenciais prestados por sua filha células Paneth 8. Estes estudos investigaram o papel de células de Paneth em Lgr5 + normais ISC e não numa situação em que eles são danificado e necessitar reabastecimento a partir de uma população Lgr5 Lo.
Para entender a biologia e modelo de doença intestinal que examinar o papel funcional das células e / ou genes utilizando modelos de ratos transgênicos 9,10. Freqüentemente, esses modelos utilizam tecnologia cre-lox para modificar condicionalmente gene (s) 9,10. Cre (Causas recombinação) recombinase é uma recombinase específica do local da família integrase, isolado do bacteriófago P1. Cre catalisa recombinação sítio específica definida entre 34 pb ' Lox P '(lócus χ de cruzamento P1) sites. Os ratinhos são geneticamente manipuladas para conter sítios loxP que flanqueiam regiões de interesse que após a expressão da recombinase Cre são excisadas. Ligando a expressão do gene Cre para uma célula ou um promotor específico do desenvolvimento permite a alteração a ser feita de uma forma espacial 9,10, isto é especialmente útil em superar as mutações letais embrionárias. Além disso ligando a expressão de Cre para uma via do receptor,que pode ser activada artificialmente, permite alterações temporais.Utilizando esta tecnologia, o gene inactivado CatnB 11 nos epitélios intestinais. β-catenina, o produto do gene CatnB, é um regulador chave da via de sinalização Wnt canónica que regula a homeostase do ISC. Dois estudos anteriores usando essa estratégia produziu resultados conflitantes 12,13. O estudo de FEVR et al. 12, demonstraram perda de células-tronco e homeostase intestinal. Considerando que o Ireland et al. 14 estudo relatou que a sequência de uma redução na viabilidade das células da cripta-vilosidade eixo foi repovoada a partir de células de tipo selvagem que expressam CatnB. A diferença principal nestes estudos era o promotor utilizado para expressar CRE na epitélios intestinais. O FEVR et ai., Foi utilizado o promotor do gene de vilina ligado ao receptor de estrogénio, que pode ser activado através da administração de tamoxifen (vil-Cre-ER T2) 15,16. Em contraste Ireland et al., Utilizou-se o elemento promotor do gene da citocromo rato P450A1 (CYP1A1) para conduzir a expressão de Cre em resposta ao β-naftoflavona xenobióticos (Ah-CRE). As características destes diferentes sistemas gerado duas hipóteses para explicar essas observações diferentes. A primeira é que CatnB mais eficientemente eliminado na ISC usando o sistema Cre-T2 Vil-ER em comparação com o AH-CRE, reduzindo assim o número de ISCs para níveis sub-repovoamento. Alternativamente, foi devido ao diferencial CatnB deleção na população de células diferenciadas. Os vil-Cre-ER alvos de sistemas T2 todas as células epiteliais da cripta e das vilosidades Considerando que o sistema Ah-cre tem como alvo apenas as células não Paneth do nicho ISC e cripta. Estes sistemas, desde ferramentas ideais para examinar o behavior do ISC e sua interação com as células de Paneth. Aqui nós apresentamos vários protocolos detalhados com base em como usamos estes sistemas para determinar que as células de Paneth desempenham um papel crucial na mediação da resposta intestinal à injúria 17.
Protocolo
Informações sobre todo o material utilizado é dada na Tabela 1. Todas as experiências com animais foram realizados sob a autoridade de uma licença de projeto UK Home Office.
1. CatnB Exclusão usando o Ah-cre e Vil-CRE-ER T2 Sistemas
- Cruze as linhagens de camundongos para gerar 10-14 semana coortes antigas do Ah-cre + CatnB + / +, Ah-cre + CatnB Flox / Flox, vil-Cre-ER T2 CatnB + / + e vil-Cre-ER T2 CatnB flox / flox. Para a análise visual de recombinação, através de uma mancha gal β, coortes deve conter o repórter lacZ Rosa26R-17. Coortes deve controlar a presença de genes e uso de agentes de indução modificados, o tamanho das coortes necessários devem ser estimada utilizando uma análise de poder.
- Para induzir o transgene Ah-cre preparar β; -naftoflavona (BNF), ou para o transgene Cre-Vil-ER T2 tamoxifeno (TAM) em óleo de milho para se obter uma solução de trabalho de 10 mg / ml. NOTA: Os agentes devem ser pesados para fora em um exaustor usando proteção individual adequados.
- Soluções de calor em uma garrafa âmbar (BNF é sensível à luz) para ambos os 99,9 ° C para BNF ou 80 ° C para a TAM em um banho de água.
- Transferir para um agitador aquecida fixada em 100 ° C durante BNF, ou 80 ° C durante a TAM, e agita-se durante 10 min.
- Para BNF repetir 1,3-1,4 até dissolver (pode demorar> 1 hora).
- Aliquota em pequenos frascos de âmbar (~ 5 ml) e, em seguida, congelar a -20 ° C. As garrafas devem ser descartados depois de 3 ciclos de congelamento / descongelamento. Antes de usar agentes de descongelamento e reaquecimento à temperatura adequada se eles caíram fora da solução. Deixa-se arrefecer a <37 ° C antes da injecção.
- Injectar a ratinhos por via intraperitoneal (IP) com uma dose de 80 mg / kg, por exemplo, um 25 g do rato recebe 0,2 ml da appropagente de indução riate. Para Ah-cre entregar três injecções em 24 hr período, por vil-Cre-ER T2 dar uma injeção por dia durante 4 dias.
2. Dissecção do Intestino para Visualization Reporter e imuno-histoquímica (IHQ)
- Euthanize o mouse usando deslocamento cervical, sem anestesia prévia, em conformidade com a aprovação ética. Coloque o mouse em decúbito dorsal e molhar a pele usando etanol 70%, abrir a cavidade intra-peritoneal longitudinalmente ao longo da linha média usando uma tesoura.
- Fixar o estômago com um fórceps e cortar a ligação para o esófago. Remova o intestino delgado até o apêndice puxando suavemente sobre o estômago. Remova o intestino grosso até o ânus, puxando suavemente no apêndice.
- Uma vez o intestino ter sido isolado remover o estômago e apêndice. Intestinos nivelada com 1x PBS, utilizando uma seringa com uma ponta de pipeta ended Blunt. NOTA: Cada intestino deve ser immediately processados para uma das aplicações a jusante descritos abaixo.
3. Fixação de formalina Intestino
- Cortar o intestino ruborizada em 3 seções de tamanhos iguais e etiqueta proximal, média e distal. Corte cada seção em 1 cm pedaços. Pegue uma pequena tira de fita cirúrgica 2 cm x 2 cm. Coloque três a cinco peças de 1 cm para o meio da cassete cirúrgica com a formação de pirâmide.
- Feche e selar a fita em torno das peças longitudinalmente, para dar um efeito de "pilha do registro". Colocar o tecido em um recipiente de fundo plano contendo um grande excesso de formalina tamponada neutra fixador, pelo menos 10x o volume de fixador para o volume de tecido. NOTA: Evite colocar quantidades excessivas de tecido dentro de um tubo para a fixação, dividi-lo em vários containers.
- Colocar as amostras a 4 ° C durante pelo menos 18 - 24 h antes da incorporação e seccionamento. Para evitar a perda de nuclear β-catenina, não conserte além de 24 horas.Após a transferência de fixação do tecido a um recipiente de fundo plano contendo um grande excesso de EtOH a 70%, pelo menos 10 vezes o volume do tecido.
4. Methacarn Fixação de Intestino
- Antes de preparar a dissecção Methacarn fixador através da combinação de 300 ml de MeOH, 150 ml de clorofórmio e 75 ml de ácido acético glacial (4: 2: 1). Cortar o intestino ruborizada em 3 seções de tamanhos iguais proximais, médias e distais.
- Coloque cada pedaço de intestino lado a lado em um pedaço de papel de filtro (15 cm x15 cm) e usando uma tesoura Springbow abri-lo 'en face'. Coloque o intestino e papel de filtro para um prato de vidro contendo Methacarn durante 3 - 24 horas à TA. Após a fixação pegar o fim de uma seção de intestino usando uma pinça.
- Enrole o intestino em torno dos fórceps para formar uma "Swiss roll" e fixar o rolo abrindo ligeiramente a pinça e colocando uma agulha de 25 G por ela. Colocar o tecido em um recipiente de fundo plano contendo a laRGE excesso de formalina tamponada neutra fixador, pelo menos 10x o volume de fixador para o volume de tecido e armazenamento durante pelo menos 1 hora antes de prosseguir para o processamento.
5. Monte todo LacZ Visualization (Modificado de El Marjou et al. 18)
- Prepare placas de cera através da combinação ralwax fundido com o óleo mineral a 10: 1. Despeje em 15 pratos cm de Petri e deixe esfriar. Prepare de X-gal como fixador de acordo com a Tabela 1 e armazenar em gelo.
- Remova todo intestino e lave completamente com 1x PBS gelado, conforme a secção 2. Fix intestino por lavagem com 25 ml gelada X-gal fixador.
- Usando uma tesoura cortar o intestino para 3 - 5 partes iguais (máximo de 5 por placa). Coloque cada seção na placa de cera e fechar cada extremidade de modo que a secção está um pouco esticado com a mais alta linha mesentérica; aparar qualquer excesso de mesentério. Usando uma tesoura Springbow cortar o intestino longitudinalmente e fixá-se ao longo do caminho.60;
- Inundar a placa com X-gal fixador para cobrir as secções e deixar durante pelo menos 1 hora a 4 ° C. Remover fixador de X-gal utilizando uma pipeta de 25 ml e lava-se uma vez com 30 ml de PBS 1x. Secções de cobertura com 30 ml de solução de DTT demucifying durante 30 - 60 min à temperatura ambiente, idealmente sobre uma plataforma oscilante.
- Remover demucifiying solução utilizando uma pipeta de 25 mL e inundar a placa com 30 ml de PBS 1x. Usando uma pipeta de pasteur lavar as secções do intestino com 1x PBS na placa para remover o muco.
- Remover 1x PBS com uma pipeta de 25 mL e inundação com 30 ml de X-gal mancha. Incubar durante a noite à temperatura ambiente no escuro, com suave agitação numa plataforma de agitação.
- Após incubação durante a noite a verificação de que as secções desenvolveram uma mancha azul / verde, se a cor de fundo é ainda branco, solução corante fresco pode ser adicionado e monitorizada até que a coloração se desenvolve. NOTA: Uma vez seções têm manchado, então não precisa mais coloração pode ser tentada.
- Remova a mancha X-galutilizando uma pipeta de inundação e placa de 25 ml com 30 ml de PBS 1x e deixar durante 3 minutos, com agitação suave. Remova os pinos e pegar, com uma pinça, o fim de uma seção de intestino. Enrole o intestino em torno dos fórceps para formar um "rocambole", fixe o rolo abrindo ligeiramente a pinça e colocando uma agulha de 25 G por ela.
- Colocar o tecido de um recipiente de boca larga de fundo plano contendo um grande excesso de formalina tamponada neutra fixador, pelo menos 10x o volume de fixador para o volume de tecido. Colocar as amostras a 4 ° C durante pelo menos 24 h antes da incorporação e seccionamento.
6. Extracção das criptas do intestino
- Isolar os primeiros 20 cm do intestino delgado, conforme a secção 2. Coloque o intestino sobre uma superfície limpa de dissecação e utilizando um fórceps e tesouras remover qualquer gordura / mesentério associado. Utilizando uma tesoura Springbow abrir o intestino longitudinalmente.
- Usando uma capa de lâmina de microscópio, firmly raspar do lúmen intestinal para remover vilosidades e muco. Utilizando uma tesoura cortar o intestino para ~ 5 mm peças e transferir para um tubo de 50 ml com 25 ml de 1x HBSS suplementado com penicilina (100 U / ml) e estreptomicina (100 U / mL).
- Incubar durante 10 min à TA. Remover o meio contendo antibiótico por passagem das amostras através de um filtro celular de 70 uM.
- Coloque seções intestinais em um tubo de 50 ml fresco contendo 10 ml de 1x HBSS e coloque a tampa.
- Inverter cuidadosamente duas vezes e remover a HBSS 1x por passagem através de um filtro celular de 70 uM. Além disso lavar as peças intestinais, repetindo 6.4 & 6.5 três vezes e assegurar que a fracção final é relativamente claro.
- Tecido Transferir para um tubo de 50 ml fresco contendo 10 ml de EDTA (8 mM) / 1x HBSS e deixar à temperatura ambiente durante 5 min. Agite vigorosamente (20 - 30x) ou vortex, passam através de um filtro de 70 mm de células e tecidos de transferência de peças para um tubo de 50 ml fresco contendo EDTA (8 mM) / 1x HBSS. NOTA:O fluxo através de qualquer um deles pode ser descartado ou mantidas se for necessária uma análise das vilosidades epitélios.
- Incubar os pedaços de tecido sobre gelo durante 30 minutos, agitar vigorosamente a amostra (20 - 30x) ou vórtice. Passar as amostras através de um filtro de células de 70μm e reter o fluxo através de como esta contém as criptas.
- Transferir os pedaços de tecido para um tubo de 50 ml fresco contendo 10 ml de 1x HBSS. Agita-se vigorosamente (20 - 30x) ou de vórtice, passar através de um filtro de células de 70 ^ m e reter o fluxo através. Repita mais uma vez para assegurar a recuperação máxima de criptas de peças intestinais. Combinar o fluxo através de fracções e centrifugar a 300 xg durante 5 min. Decantar o sobrenadante e o sedimento de reter cripta. NOTA: As pelotas podem ser utilizadas imediatamente para a cultura (se aplicável) ou armazenada a -80 ° C antes de procedimentos de extracção de ADN / ARN / proteína padrão.
7. Norma Immunohistochemical Visualization
- Corte 5 μm secções de parafina de tecido incorporado em poli-L-lisina (PLL) desliza. Nota: Um protocolo padrão para a coloração com um anticorpo B-catenina é dada abaixo, os parâmetros para outros anticorpos estão apresentados na Tabela 2.
- De-cera com 2x mínimo de 3 lavagens em banhos de deslizamento contendo xileno fresco. Hidratadas passando as lâminas durante 3 min por meio de banhos de deslizamento fresco contendo: EtOH a 100% (2x), 95% de EtOH e EtOH a 70% e finalmente em 1 x PBS.
- Colocar as lâminas em um banho de lâmina contendo tampão citrato (pH 6) e aquecer 99,9 ° C durante 20 min para recuperar antigénios. Permitir slides para esfriar e, em seguida, lavar 3x 5 minutos num banho de slide contendo 1xTBS / T para 5 min. Remover as lâminas da última lavagem, chamar imediatamente em torno do tecido com uma caneta PAP, e cobrir a secção com um bloco comercial peroxidase ou 1,5% H 2 O 2 (em destilada H 2 O).
- Incubar durante 20 minutos à temperatura ambiente (RT), em seguida lavar 3x em banhos de deslizamento contendo TBS 1x fresco / T durante 5 min. Depois de lavageming secções de cobertura, usando uma pipeta, em 5% de soro de coelho normal (NRS) / 1xTBS / T durante 30 min à temperatura ambiente para bloquear a ligação não-específica hidrofóbica do seu anticorpo primário.
- Remova o bloco NRS com uma seção de pipeta e tampa Pasteur em anticorpo primário B-catenina diluído 1: 200 com 5% NRS. Lavagem das lâminas para 3x 5 min em banhos de slides contendo 1xTBS frescos / T. Nota - outros anticorpos exigirá otimização para a diluição e especificidade. Para assegurar a especificidade de um anticorpo, não há anticorpos apropriados de isotipo e manchas de controlo devem ser executadas. Um controle isotipo é comparado com as espécies hospedeiras e do isotipo de seu anticorpo primário.
- Visualizar com qualquer um kit de detecção de HRP comercial ou com um anticorpo secundário marcado de modo fluorescente apropriado (Tabela 2). NOTA: Comprimento de desenvolvimento é diferente para cada um dos anticorpos, para β-catenina 10 - 15 s é geralmente suficiente. Para otimizar o desenvolvimento de um primeiro anticorpo establish o período de tempo necessário para a visualização de células positivas usando uma lâmina de controlo positivo e, em seguida, aplicar isto a todas as lâminas subsequentes.
- Lavagem das lâminas para 3x 5 min em banhos de slides contendo fresco TBS / T. Lâminas contracoloração por imersão num banho de slide contendo hematoxilina para ~ 45 segundos (não é necessário se estiver usando fluorescente etiquetado anticorpos secundários). Coloque slides em um banho de lâmina limpa e enxaguar com água corrente durante ~ 1 min, garantindo a hematoxilina não está completamente lavada.
- Desidratar lâminas por passagem através de banhos de deslizamento contendo concentrações crescentes de álcoois; 1x 30 s em 70% de EtOH, 1 x 30 seg em EtOH a 95%, 2x 30 seg lavagens em EtOH a 100%, 2x 2 min em xileno.
- Montagem desliza sob uma lamela utilizando um meio de montagem comercial. NOTA: Se estiver usando o anticorpo marcado por fluorescência montar com uma mídia contendo DAPI para rotular o núcleo.
8. Identificação de histológica Intestina específicol Células Epiteliais
- Enterócitos
- Preparar utilizando secções secção 7 com o anticorpo vilina e condições descritas na Tabela 2.
- Células entero-endócrinas (Grimelius manchar 18,19).
- Prepare seções seguindo os passos 7,1-7,2. Lavagem das lâminas num banho de lâmina contendo água ultrapura durante 3 min. Transferir as lâminas para um banho contendo solução de prata corrediça pré-aquecido (Tabela 1) e incuba-se a 60 ° C durante 3 h.
- Remover os diapositivos da solução de prata e colocar num banho contendo solução de redutor de corrediça preparada de fresco pré-aquecido (Quadro 2) a 45 ° C durante 3 min. Retire as lâminas e colocar em um banho slide contendo água ultrapura fresca por 3 min. Siga os passos de 7,6-7,8 da secção 7.
- As células caliciformes (Alcian Blue mancha).
- Prepare seções seguindo os passos 7,1-7,2 .. lâminas de transferência para um banho slide contendo Alcian Blue pH 2,5 durante 5 min à TA. Remover Alcian mancha azul com uma pipeta e lugar de banho de slides sob uma torneira aberta por 3-5 min. Siga os passos 7,6-7,8. NOTA: solução de azul Alcian pode ser retido para utilização posterior.
- ISC.
- Para identificar as ISC siga secção 9.
- Células de Paneth.
- Prepare secções seguinte secção 7, utilizando o anticorpo de lisozima e condições descritas na Tabela 2.
9. detecção in situ de RNA com a Murino Intestino 19-21
- Coloque 5 mm seções de formalina intestino fixo (seção 3) em lâminas de PLL. Prepare um digoxigenina sonda marcada RNA linearizados para a detecção de expressão Olfm4 21. Dewax e reidratar seções conforme a secção 7. NOTA: Este protocolo deve ser realizada em um ambiente livre de RNAse para evitar a degradação da sonda RNA.
- Empate em torno de tproblema com uma caneta PAP para minimizar reagentes. Incubar secções num banho de corrediça com 6% H 2 O 2 (em H2O destilada) durante 30 min. Lavar duas vezes em um banho fresco corrediça com PBS 1x durante 3 min. Descartar 1x PBS e, usando uma pipeta, com a secção de tampa 4% de paraformaldeído durante 20 min em gelo.
- Lavar duas vezes em um banho fresco corrediça com PBS 1x durante 3 min. Usando uma pipeta de secções de cobertura com proteinase K solução de lavagem durante 5 minutos em um banho fresco corrediça com PBS 1x durante 3 min. Usando uma pipeta de pós-fix secções, cobrindo em paraformaldeído a 4% durante 5 min à TA.
- Lavar num banho de corrediça com DEPC H 2 0 tratadas durante 2 min. Usando uma pipeta de secções de cobertura em solução de anidrido acético durante 10 min com agitação. Lavar com um banho fresco corrediça com PBS 1x / 3 min, seguido por solução salina 1x / 3 min. Passa através de lâminas de banhos contendo concentrações crescentes de álcoois; 1x 30 segundos em 70% EtOH, 1x 30 segundos em 95% EtOH, 2x 30 lavagens seg fresco em EtOH a 100%,2x 2 min em xileno fresco e deixar secar ao ar.
- Diluir Olfm4 sonda 1: 100 em tampão de hibridação e sonda desnaturar por aquecimento a 80 ° C durante 3 min. Adicionar 100 ul de sonda para cada secção e cobrir com parafilme para evitar a desidratação da corrediça. Incubar durante a noite em uma câmara úmida escuro a 65 ° C.
- Lavar num banho de corrediça com 5 x SSC a 65 ° C durante 15 min. Lave os cortes em um banho de corrediça fresco duas vezes com 50% formamida / 5 x SSC / SDS a 1% durante 30 min a 65 ° C. Lavar duas vezes em secções de um banho fresco corrediça em PBT durante 10 min, o primeiro a 65 ° C e a segunda à TA. Usando uma pipeta de secções de cobertura com PBT contendo 25 ug de ARNase durante 45 minutos a 37 ° C. Lave os cortes em um banho de corrediça em PBT durante 5 min à TA.
- Lave os cortes em um banho de corrediça fresco duas vezes com 50% formamida / 5 x SSC durante 30 min a 65 ° C. Para bloquear, secções de cobertura utilizando uma pipeta com 10% de soro de ovelhas em PBT e armazenar em um escuro, moicâmara r à temperatura ambiente durante 2 - 3 h.
- Preparar por diluição de anticorpo de fosfatase alcalina anticorpo anti-digoxigenina conjugado a 1: 500 com 10% de soro de carneiro em PBT contendo 5 mg / ml de pó de rato intestinal. Incubar durante 3 horas a 4 ° C no escuro, numa plataforma oscilante. Gire para baixo para remover o excesso de pó intestinal e adicionar volumes 3x de 1% de soro de ovelhas em PBT para o sobrenadante.
- Remova o bloco de lâminas com uma pipeta e adicionar 100 ul de solução de anticorpo para cada secção, cobrir com parafilme e incubar numa câmara húmida escura a 4 ° C durante a noite. Lave os cortes em um banho de slides 3 × com fresco PBT para 5 min. Para bloquear seções lavar em um banho de slides 3 × com tampão NTMT fresco para 5 min.
- Para visualizar, utilizando uma pipeta de cobrir cada secção com a BM roxo e incubar no escuro à temperatura ambiente durante 24 - 72 horas até que uma cor suficientemente forte desenvolve. Lave os cortes em um banho de corrediça em vez de PBT e contracoloração por imersão em eosina durante 1 min. Remove excesso eosina por seções de lavagem em um banho de slides sob uma água corrente durante 3-5 min. Imergir as lâminas em xileno e deixar secar ao ar. Montagem sob uma lamela usando mídia comercial.
10. histológica Epitélio Intestinal de Caracterização
- Coloque 5 mm seções do tecido fixo (seção 3 e 4) em lâminas de PLL. Analise ≥25 conjunto aleatório (ou ≥50 metade) a partir de criptas ≥4 ratinhos de cada grupo para cada um dos seguintes parâmetros. NOTA: Para manter a consistência analisar criptas do mesmo local de cada intestino (utilizar apenas a extremidade proximal).
- Parâmetros celulares de cortes corados padrão H & E (exceto quando indicado): número Crypt, altura, apoptose e mitose.
- Número Crypt.
- Utilize uma ampliação de baixa energia (por exemplo, 4x ou 10x) para contar manualmente o número de criptas em contacto com a camada basal. Contagem ≥10 transversal seita intestino proximaliões de pelo menos 4 ratos.
- Altura Crypt.
- Utilize uma ampliação de alta potência (por exemplo, 20X ou 40X) para contar manualmente o número de células a partir do fundo da cripta para a cripta / vilosidade eixo (Figura 3b).
- Apoptose 22, 23.
- Método 1: Usar uma ampliação alta potência (por exemplo 20X ou 40X.) Para contar manualmente o número de células em apoptose em cada cripta. As células apoptóticas podem ser identificados por encolhimento celular, condensação de cromatina, formação de bolhas citoplasmáticas e de corpos apoptóticos (Figura 3A).
- Método 2: Executar uma mancha IHC (secção 7) para a caspase-3, utilizando as condições descritas na Tabela 2 utilizando um aumento de alta potência (por exemplo, 20X ou 40X.) Contagem manual do número de células positivas em cada cripta para quantificar as células no. fase de execução da apoptose.
- Mitose.
- Utilize uma ampliação de alta potência (por exemplo, 20X ou 40X) para contar manualmente os números de células mitóticas na cripta cada. As células mitóticas contêm material de ADN condensado e são geralmente simétrica e bem formada (Figura 3b).
- Proliferação.
- Executar uma mancha IHC (secção 7) para o Ki-67 utilizando as condições descritas na Tabela 2. Contar manualmente células positivas para quantificar a percentagem de células da cripta em proliferação.
- Número Crypt.
Resultados
Comparando ISC Recombinação Eficiência no Ah-cre e Vil-CRE-ER T2 Sistemas
A utilização destes sistemas de cre-lox para avaliar o papel das células de Paneth, no repovoamento do intestino depois de dano, caracterização necessária da eficiência de recombinação dentro do ISC. Usando o repórter lacZ-Rosa26R condicional demonstramos que em ambos os sistemas de 3 dias após indução (dpi) há ~ 100% de recombinação no intestino delgado (Figura 1a). Quantificar a presença do alelo recombinados por qPCR foi confundido pelas diferenças nos padrões de expressão de Cre entre os sistemas. O sistema Cre-T2 Vil-ER mostraram um aumento de 3,53 vezes na presença do alelo recombinados em comparação com o sistema cre-Ah, devido à sua expressão em uma proporção maior do epithelia 16. Para superar isso, adotou uma estratégia diferente, que nos permitiu comparar diretamente os sistemas. Nós induzido os ratos com diferentes regimes de indução e analisadas em 30 dpi, em que criptas positivas ponto LacZ e vilosidades representam um evento de recombinação ISC. Utilizando esta abordagem, demonstrou que, em ambos os sistemas, 3 injecções de agente indutor (entregue IP a 80 mg / kg em 24 h), recombinados em um número equivalente de ISC apesar dos níveis de recombinação iniciais são muito maior no Vil-Cre-ER T2 16 (Figura 1b-d) do sistema. Além disso, utilizando ADN extraído das criptas recombinadas, qPCR para os alelos recombinadas demonstraram um aumento não significativo em usar o sistema de recombinação ER T2 Vil-Cre, potencialmente devido à recombinação nas células de Paneth não observados utilizando o sistema cre-Ah (Figura 1d). Além disso, a coloração para os tipos de células epiteliais não indiCate qualquer alteração ao padrão de diferenciação, imagens representativas de cada tipo de célula investigada é mostrada na Figura 2e-2h.
Caracterização de Intestinal Epithelia seguinte CatnB Exclusão
Quantificação da perda Crypt
Caracterizar a cinética de recombinação nestes sistemas Cre nos permitiu analisar o intestino do rato quando os números equivalentes de ISCs são recombinados. Usando o repórter LacZ ambos os sistemas mostrou perda completa das células recombinantes (azul) em 3 dpi (Figura 2a). Como relatado anteriormente três dias após a supressão do CatnB os ratinhos Ah-cre mostrou perda de cripta parcial, ao passo que os ratinhos T2 Vil-Cre-ER demonstrou destruição completa da cripta / vilosidade eixo 13,16,24 (Figura 2b-d).
Dinâmica de Epithelial Repovoamento
Usando as técnicas acima caracterizamos vários parâmetros que nos permitam entender essa observação. Imagens representativas dos tipos de células e parâmetros analisados utilizando protocolos de 7 - 10 são apresentados na (Figura 3a e 3b). Resumidamente, a perda de criptas era consistente com os níveis elevados de apoptose indicadas em ambos os sistemas (Figura 3e). No entanto, a mitose, proliferação celular altura da cripta, cripta e de expressão (não mostrado) do sistema de dados indicaram Ah-cre pode recuperar, presumivelmente devido à repopulação por ISC recombinado-un (Figura 3C). Em comparação gritante, o vil-Cre-ER T2 não conseguiu se recuperar apesar da manutenção de células da cripta epiteliais (Figura 3d).
Caracterização de celulares fenótipos dentro Crypt
Para entender por que as criptas de camundongos Ah-CRE poderia repovoar Considerando que o vil-Cre-ER T2 não poderia foram caracterizadas as células epiteliais três dias após eliminação de CatnB. Usando hibridização in situ (secção 9) e análise de IHC (seção 7, 8 e 10) que demonstraram que as células da cripta nas vil-Cre-ER T2 CatnB flox / mice flox eram não-proliferativa e faltava expressão do marcador ISC Olfm4 , ao contrário das criptas nos ratinhos Ah-Cre (Figura 4C & F). À medida que a caracterização inicial tinha demonstrado que a recombinação em criptas era equivalente procedeu-se examinar o papel das células de Paneth. Foi realizada uma dupla fluorescente IHC contra CatnB e Lyz1 para identificar quais as células tinham perdido β-catenina e se eram células de Paneth (Figura 5a-5c). Como anteriormente descrito que demonstrated que todas as células da cripta são segmentados usando o sistema Cre-T2 Vil-ER. Em comparação o sistema Ah-cre poupou as células Paneth e os epitélios das vilosidades. Mais células Paneth foram apenas observados em apoptose após CatnB eliminação utilizando o sistema T2 vil-Cre-ER (Figura 5d & 5e).
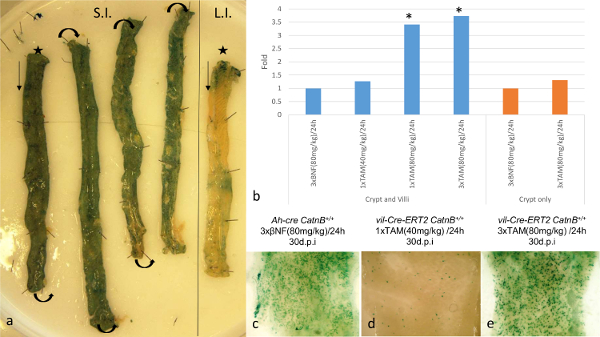
Figura 1: Comparação da Especificidade e Eficiência de Cre / Lox recombinação dentro da Intestinal Epithelia usando o Ah-cre e Vil-CRE-ER T2 Sistemas (a):. Visualização do Ah-cre expressão LacZ repórter em wholemount pequeno (SI; * extremidade distal) e grande (LI; * extremidade distai) a partir de um ratinho de tipo selvagem. (b): Resultados de qPCR mudança vezes mostrando para o alelo CatnB flox recombinados em uma dpi para comparar diferentes regimes de indução em Ah-cre CatnB Flox / Flox (BNF induzido) e vil-Cre-ER T2 CatnB Flox / Flox (TAM induzido ); * P <0,05 (Mann-Whitney [2-cauda] comparado com o controlo). (c) - (e):.. intestino delgado Wholemount mostrando LacZ cripta positiva 30 dpi Panel (b) - (e) modificado a partir Parry et al 16 Por favor, clique aqui para ver uma versão maior desta figura.
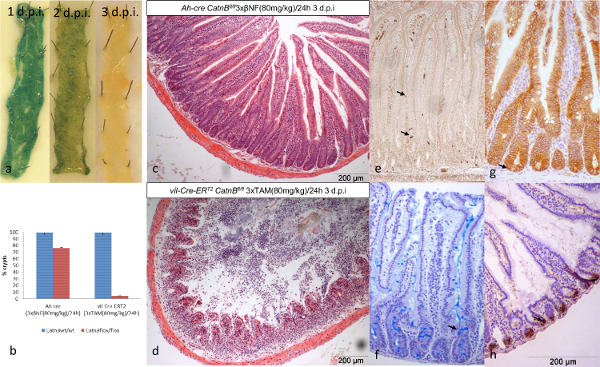
Figura 2: Comparação de AH-CRE e T2 Vil-Cre-ER Sistemas para Condicionalmente Excluindo CatnB no Intestino Delgado Epithelia (a):. intestino delgado Wholemount que mostra a perda de células recombinadas em camundongos AH-cre CatnB Flox / Flox LacZ + ao longo de 3 dias. (b): Quantificação da perda cripta 3 dias após eliminação de CatnB; * P <0,05 (Mann-Whitney [2-cauda] comparado com o controlo). (c & d): transversais secções H & E de formalina intestino fixo demonstrando perda de criptas após CatnB eliminação. (e) - (h) Exemplo de tipos de células a partir de ratinhos de controlo: (e) células entero-endocriine, (f) as células caliciformes, (g) CatnB IHC indicando uma ISC (→) com nuclear B-catenina e (h) Paneth células. O painel (b) modificado a partir Parry et al. 16. Por favor clique aqui para ver uma versão maior desta figura.
gether.within-page = "always"> 
Figura 3: Caracterização do início da Fenótipo ao usar o Ah-cre e Vil-CRE-ER T2 Sistemas para Condicionalmente Excluindo CatnB em Números semelhantes de ISC dentro do Intestino Delgado Epithelia (a & b) H & E seções fixas em formalina manchado indicando a localização da cripta. altura ([), um apoptótica (←) e células mitóticas (↓). Quantificação do número médio de células por cripta entre o tipo selvagem (azul) e CatnB Flox (laranja) ratos em três pontos de tempo (ppp) (c) Altura cripta, (d) mitose e (E) de apoptose (barras de erro indicam o desvio padrão ). O painel (c) - (e) modificado a partir Parry et al 16."Target =" _ blank 3429fig3large.jpg "> Clique aqui para ver uma versão maior desta figura.

Figura 4:. Comparação das características do ISC usando Ah-cre e Vil-CRE-ER Sistemas T2 para Condicionalmente Excluindo CatnB nas células epiteliais das criptas Epithelia Intestino Delgado 3 dias após a eliminação de CatnB usando o Ah-cre (ac) ou vil- Cre-ER T2 sistema (df). (a & d) secção H & E mostrando áreas de perda cripta; (b & d) Ki-67 IHC perda demonstração de células de proliferação utilizando vil-Cre-ER T2; (c & f) Olfm4 in situ demonstrando presença de ISC funcionais usando Ah-cre. Painel (a.) - (f) modificado a partir Parry et al 16 Por favor, clique aqui para ver uma versão maior desta figura.
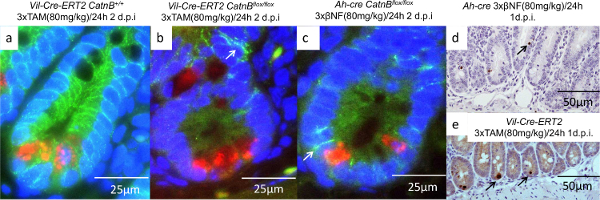
Figura 5: Caracterização das células de Paneth após CatnB Exclusão usando os Vil-Cre-ER T2 e Ah-cre Sistemas (ac):. Imagens de imunofluorescência de criptas mostrando Paneth células (vermelho), B-catenina (verde) e núcleo (azul ), seta indicam ligada à membrana β-catenina; (DE) IHC para a caspase-3 de células de Paneth indicando apoptóticos estão ausentes na ah-CRE (d), mas presente no sistema Vil-Cre-ER T2 (E). O painel (a) - (e) a partir modificadoParry et al 16. Por favor clique aqui para ver uma versão maior desta figura.
| O tampão de acetato | * | * | Para perfazer 100 ml: 4,8 ml de ácido acético 0,2 M, 45,2 ml de 0,2 M de acetato de sódio e 50 ml de água destilada |
| Ácido acético | Fisher Scientific | C / 0400 / PB17 | |
| Anidrido acético | Sigma | A6404 | |
| Solução de anidrido acético | * | * | 2 M de anidrido acético em cloridrato de trietanolamina 0,1 M |
| Alcian Blue | Sigma | A5268 | |
| Alcian PH azul 2,5 | * | * | Para fazer 500 ml: 15 ml de ácido acético, água 5 g Alcian Blue & 485 ml destilada |
| fosfatase alcalina anti-digoxigenina conjugado anticorpo | Abcam | ab119345 | |
| B (beta) -naftoflavona | Sigma | N3633 | BNF, injetar, sem permitir que a solução para esfriar muito como composto vai cair fora da solução. A solução pode ser re-utilizado - armazenar a -20 ° C entre as utilizações, não mais do que duas vezes reaquecer. |
| Bloxall | Vector Labs | SP-6000 | |
| BM roxo | Roche | 11442074001 | |
| BSA | Sigma | A4503 | Albumina de soro bovino |
| Clorofórmio | Fisher Scientific | C / 4920/17 de | |
| Tampão citrato / Antigen Solução desmascaramento | Vector Labs | H-3300 | |
| Óleo de milho | Sigma | C8627 | |
| Solução Demucifiying | * | * | Por 500 ml: 50 ml de glicerol, 50 ml de Tris 0,1 M pH 8,8, 100 mL de EtOH, 300 mL de solução salina (NaCl a 0,9% em água), 1,7 g de DTT. Demucifying solução pode ser feita antecipadamente e armazenado, mas DTT sholud ser adicionado imediatamente antes da incubação (340 mg / 100 ml). |
| DEPC água tratada | Life Technologies | 750.023 | |
| TDT | Sigma | 101509944 | |
| EDTA | Sigma | O3690 | 0,5 M |
| Etanol | Fisher Scientific | E / 0650DF / 17 | |
| Filtro de papel | Que homem | 3000917 | |
| Formaldeído | Sigma | F8775 | |
| Formalina | Sigma | SLBL11382V | Formalina tamponada neutra |
| Formamida | Sigma | F5786 | |
| Glutaraldehye | Sigma | G6257 | |
| H 2 O 2 | Sigma | 216763 | |
| Haematoxylin | Raymond A Lamb | 12698616 | |
| HBSS | Gibco | 14175-053 | HBSS (-MgCl2 +; -CaCl2) |
| Tampão de hibridação | * | * | 5 x SSC, 50% formamida, 5% de SDS, 1 mg / ml de heparina, 1 mg / ml de tRNA de fígado de bezerro |
| Hidroquinona | Sigma | H9003 | |
| IMMPACT DAB peroxidase | Vector Labs | SK-4105 | |
| Kit Immpress HRP IgG anti-murganho | Vector Labs | MP-7402 | |
| Kit Immpress HRP anti-coelho IgG | Vector Labs | MP-7401 | |
| Pó de tecido intestinal | * | * | Os intestinos delgados de 5 ratinhos adultos foram combinadas e homogeneizadas num volume mínimo de PBS gelado. 4 volumes de acetona gelada foram adicionados ao intestino homogeneizado, o qual foi cuidadosamente misturada e incubada em gelo durante 30 min. Esta foi centrifugada e o sedimento foi lavado com acetona gelada. Este foi ainda centrifugado e o sedimento resultante espalhada sobre papel de filtro e deixada a secar. Depois de secar completamente o material foi moído até um pó fino usando um almofariz e pilão. |
| K-ferricianeto | Sigma | P-3667 | |
| K-ferrocianeto | Sigma | P3289 | |
| Levamisol | Sigma | L0380000 | |
| Methacarn | * | * | 60% de metanol: 30% clorofórmio: 10% de ácido acético |
| Metanol | Fisher Scientific | M / 4000/17 de | |
| MgCl2 | Sigma | M8266 | |
| Soro normal de cabra | Vector Labs | S-1012 | NGS |
| Soro normal de coelho | Dako | X0902 | NRS |
| NTMT | * | * | 100 mM de NaCl, 100 mM Tris-HCl, MgCl2 50 mM, 0,1% de Tween 20, 2 mM de Levamisol |
| PAP caneta | Vetor | H-400 | |
| Paraformaldeído | Sigma | P6148 | |
| PBT | * | * | 0,5 M de NaCl, 10 mM de trisHCL pH 7,5, 0,1% de Tween 20 |
| Penicilina / Estreptomicina | Gibco | 15140-122 | 100x solutiuon. |
| Salina tamponada com fosfato (10x) | Fisher Scientific | BP3994 | Diluído 1:10 com água destilada para fazer 1x |
| Lâminas PLL | Sigma | P0425-72EA | Lâminas de microscópio poli-L-lisina |
| Proteinase K | Sigma | P2308 | |
| Solução de proteinase K | * | * | Dilui-se proteinase K a 200 jig / mL em Tris 50 mM, EDTA 5 mM. |
| Ralwax | BDH | 36154 7N | |
| Solução Redutor | * | * | Para perfazer 100 ml de 1: g de hidroquinona, 5 g de sulfito de sódio e 100 ml de água destilada |
| ARNase | Sigma | R6148 | |
| Salina | * | * | NaCl a 0,9% em água destilada |
| SDS | Sigma | I3771 | |
| Soro de ovelha | Sigma | S3772 | |
| Nitrato de prata | Sigma | S / 1240/46 | |
| Solução de prata | * | * | Para fazer 100 ml: 10 ml de tampão de acetato, 87 ml de água destilada, de nitrato de prata 3 ml de 1% |
| Acetato de sódio | Fisher Scientific | S / 2120/53 | |
| Cloreto de sódio | Sigma | S6753 | NaCl |
| O sulfito de sódio | Sigma | 239321 | |
| SSC | Sigma | 93.017 | Citrato de sódio salino 20x |
| Fita cirúrgica | Fisher Scientific | 12960495 | |
| Tamoxifen | Sigma | T5648 | TAM, injetar, sem permitir que a solução para esfriar muito como composto vai cair fora da solução. A solução pode ser re-utilizado - armazenar a -20 ° C entre as utilizações, não mais do que duas vezes reaquecer. |
| TBS / T | Cell Signalling | # 9997 | |
| Cloridrato de trietanolamina | Sigma | T1502 | |
| Tris-HCL | Invitrogen | 15567-027 | |
| Tween20 | Sigma | TP9416 | |
| VectaMount | Vector Labs | H-5000 | |
| Vectashield Hardset meio de montagem com DAPI | Vector Labs | H-1500 | |
| Vectastain Kit ABC | Vectou Labs | PK-4001 | |
| X-gal | Promega | V3941 | |
| X-gal fixador | * | * | 2% de formaldeído, 0,1% de glutaraldeído em 1xPBS |
| X-gal mancha | * | * | X-gal mancha; 200 uL de X-gal (A) em 50 ml de solução B (0,214 g de MgCl2, 0,48 g de K-ferricianeto, 0,734 g de K-ferrocianeto em 500 ml de PBS). Solução B pode ser constituído por oin antecedência e guardadas a 4 ° C |
| Xileno | Fisher Scientific | X / 0200/21 |
Tabela 1: Materiais e Métodos
d> 1/200, 30 min à TA| Alvo | beta-catenin | A lisozima | Ki67 | A caspase-3 | Vilina |
| Fonte comercial de Ab primário | Transduction Labs | Neomarkers | Vector Labs | Sistemas de I & D | Santa Cruz |
| Número de catálogo | 610154 | RB-372 | VP-K452 | AF835 | SC-7672 |
| Ab primária cresceu em | Mouse (mAb) | Coelho (PAB) | Mouse (mAb) | Coelho (PAB) | Goat (PAB) |
| Recuperação antigênica | Banho maria / tampão citrato | Tampão banho maria / Citrato | Tampão banho maria / Citrato | Tampão banho maria / Citrato | Tampão banho maria / Citrato |
| Bloqueio da peroxidase | Bloxall ou 2% de H 2 O 2, 45 seg | Bloxall ou 1.5% de H 2 O 2, 30 min | Bloxall ou 0,5% de H 2 O 2, 20 min | Bloxall ou 2%H 2 O 2, 45 seg | Bloxall ou 3% de H 2 O 2, 20 min |
| Bloco de soro | BSA a 1%, 30 min | 10% NGS, 30min | 20% NRS, 20 min | NGS 10%, 45 min | 10% NRS, 30 min |
| Tampão de lavagem | PBS | TBS / T | TBS / T | PBS | TBS / T |
| Condições para Ab primário | 1/300, 2 h à TA | 1/100, 1 h à TA | 1/50, 1 h à TA | 1/750, o / n a 4 ° C | 1/500, 1 h à TA |
| Ab secundário | Kit Immpress HRP IgG anti-murganho | Kit Immpress HRP anti-coelho IgG | Coelho anti-ratinho biotinilada | Biotinilado de cabra anti-coelho | Coelho biotinilado anti-cabra |
| Condições para Ab secundário | 1 h à TA | 30 min à TA | 1/200, 30 min à TA | 1/200, 30 min à TA | |
| Amplificação do sinal | N / D | N / D | Kit ABC | Kit ABC | Kit ABC |
| Detecção de sinal | IMMPACT DAB peroxidase | IMMPACT DAB peroxidase | IMMPACT DAB peroxidase | IMMPACT DAB peroxidase | IMMPACT DAB peroxidase |
| Imunofluorescência | AlexaFluor 488 | AlexaFluor 594 | N / D | N / D | N / D |
| Propriedades de imunofluorescência | Max Excitação 488 / Emissão Max 525 | Excitação Max 595 / Emissão Max 617 | |||
| Conjunto de Filtros comum | FITC | Vermelho do Texas |
Discussão
Usando camundongos transgênicos cre-lox condicionais para dissecar a função dos genes e células é um método comumente usado. Estes modelos têm sido utilizados com grande sucesso no intestino para identificar e caracterizar as células-tronco 2,4-6 e compreender o seu papel na doença 25. Para explorar plenamente destes modelos requer uma caracterização global do sistema para permitir que os dados sejam interpretados corretamente. Uma compreensão completa destes sistemas é difícil de realizar devido a genes raramente ser específico para um tipo celular ou localização solitária, uma falta de conhecimento biológico e ineficiência dos sistemas utilizados para induzir a expressão de Cre. Os métodos descritos aqui demonstrar como podemos superar esses problemas através de planejamento experimental e aplicação do conhecimento existente. Embora tenhamos usado esses métodos para responder a uma pergunta de investigação específico das técnicas apresentadas aqui são genéricas e podem ser explorado para qualquer pesquisa que investiga o muriintestino ne.
Preparação de tecido intestinal
O passo fundamental para garantir resultados robustos é a colheita e processamento do tecido, o que precisa ser processado de uma maneira oportuna e de fixação protocolos rigorosamente respeitados. Como quase todos os problemas significativos a jusante podem ser atribuídas a artefactos associados com a secagem do tecido para fora e / ou fixação incompleta. O tempo é essencial para evitar a degradação da arquitectura do tecido e / ou os ácidos nucleicos e proteínas. Fixação incompleta ou exagerada pode resultar em perda de resolução histoquímica. Fixação incompleta por falta de tempo ou seções muito grossas para permitir a penetração fixador pode resultar em perda de resolução dentro das criptas intestinais que podem ser observados como uma "marca da maré" na análise IHC. Além disso, é fundamental que a fixação não se estenda por muito tempo, como nuclear β-catenina pode difundir para fora do núcleo, a menos que imediatamente pronão transformados e cera incorporado seguinte fixação em formalina.
Papel de Paneth Células no nicho ISC
Os dados aqui apresentados demonstram de forma eficaz a importância das células de Paneth na regeneração cripta no intestino adulto após perda ISC. No entanto, há a possibilidade de que permaneceu Ah-cre poupa uma população de ISC que as metas T2 vil-Cre-ER. 26 Tian et al. Elegantemente demonstrou que as ISC hi Lgr5 são substituídos por uma população de Lgr5 lo ISC reserva. Agora parece provável que estes ISC são poupadas no sistema cre-Ah devido à população de reserva tenham sido identificados como precursores de células secretoras 6,7. A importância da célula de Paneth maduro no apoio a estes precursores de células secretoras quando necessário para reverter a um estado ISC continua a ser respondida. Como as células de Paneth constituem o ISC nicho 8 e desempenham um papel na regulação das respostas do ISC a ingestão de calorias 27 e 28 de inflamação permanece provável que as suas funções de enfermagem se estenderá para os seus próprios precursores.
Novas abordagens e tecnologias para efetivamente Modelo Câncer Colorretal Humano
A descoberta do ISC levou à identificação de genes que estão agora a ser utilizados para gerar novos modelos de ratos para investigar os papéis de genes e células em biologia intestinal e doença, revisado por Clarke et al 9. As únicas limitações para esta técnica é a identificação de genes para expressar a proteína Cre. Actualmente ISC são rotineiramente investigada utilizando ratinhos transgénicos condicionais baseados no padrão de expressão do gene Lgr5. Os ratinhos que expressam Cre a partir do promotor Lgr5 foram utilizados para excluir APC, o gene mais comummente mutado no cancro colo-rectal (CRC), Demonstrando a ISC como a célula de origem 25. Seletivamente apagar outros genes nessas células CRC está fornecendo informações sobre a progressão da doença e se espalhou por exemplo. PTEN 29. Uma visão mais aprofundada função ISC está sendo recuperado por especificamente ablação Lgr5 -expressing células em camundongos usando um receptor de toxina da difteria humana (DTR) gene bateu na Lgr5 lócus 26. Outras estratégias usar o sistema Tet-O que permite a expressão reversíveis em curso de proteínas mutantes 30. O uso dessas ferramentas para modificar gene (s) em diferentes células 31 e locais 32,33 é usado para entender como câncer de iniciar, o progresso ea metástase 34. Alternativamente mutagénese utilizando o sistema de beleza transposon dormir é identificar novos drivers de CRC. O desenvolvimento contínuo de ratinhos, técnicas e estratégias de alteração genética continua a desenvolver modelos mais relevantes do paciente.
New métodos têm sido desenvolvidos para a caracterização dos epitélios intestinais e ISC. Caracterização do rácio de tipos de células epiteliais podem ser alcançados utilizando citometria de fluxo com base na expressão diferencial de lectina e de CD24 35. Potencialmente o maior progresso na compreensão da biologia ISC eo seu papel na doença será feita utilizando o sistema vivo organ�de ex cultura 36. Este sistema permite ISC normais e malignas à cultura em 3D, onde eles diferenciam e replicar de um modo mais fisiologicamente relevante. Espera-se que estes irão permitir o teste direto de drogas em amostras de pacientes in vitro, abrindo o caminho para a medicina personalizada 37.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors would like to thank Mark Bishop, Mathew Zverev, Victoria Marsh-Durban, Adam Blackwood and Sylvie Robine. This work was funded by a programme grant from Cancer Research UK.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetate buffer | * | * | To make 100 ml: 4.8 ml 0.2 M Acetic acid, 45.2 ml 0.2 M Sodium acetate & 50 ml distilled water |
| Acetic acid | Fisher Scientific | C/0400/PB17 | |
| Acetic anhydride | Sigma | A6404 | |
| Acetic anhydride solution | * | * | 2 M Acetic anhydride in 0.1 M triethanolamine hydrochloride |
| Alcian Blue | Sigma | A5268 | |
| Alcian Blue pH 2.5 | * | * | To make 500 ml: 15 ml acetic acid, 5 g Alcian Blue & 485 ml distilled water |
| anti-digoxigenin alkaline phosphatase conjugated antibody | Abcam | ab119345 | |
| B(beta)-Naphthoflavone | Sigma | N3633 | BNF, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| Bloxall | Vector Labs | SP-6000 | |
| BM purple | Roche | 11442074001 | |
| BSA | Sigma | A4503 | Bovine serum albumin |
| Chloroform | Fisher Scientific | C/4920/17 | |
| Citrate Buffer/Antigen Unmasking Solution | Vector Labs | H-3300 | |
| Corn oil | Sigma | C8627 | |
| Demucifiying solution | * | * | For 500 ml: 50 ml glycerol, 50 ml Tris 0.1M pH8.8, 100 ml EtOH, 300 ml saline (0.9% NaCl in water), DTT 1.7 g. Demucifying solution can be made in advance and stored, but DTT sholud be added just before incubation (340 mg/100 ml). |
| DEPC treated water | Life Technologies | 750023 | |
| DTT | Sigma | 101509944 | |
| EDTA | Sigma | O3690 | 0.5M |
| Ethanol | Fisher Scientific | E/0650DF/17 | |
| Filter paper | Whatman | 3000917 | |
| Formaldehyde | Sigma | F8775 | |
| Formalin | Sigma | SLBL11382V | Neutral buffered formalin |
| Formamide | Sigma | F5786 | |
| Glutaraldehye | Sigma | G6257 | |
| H2O2 | Sigma | 216763 | |
| Haematoxylin | Raymond A Lamb | 12698616 | |
| HBSS | Gibco | 14175-053 | HBSS (-MgCl2+; -CaCl2) |
| Hybridisation buffer | * | * | 5× SSC, 50% formamide, 5% SDS, 1 mg/ml heparin, 1 mg/ml calf liver tRNA |
| Hydroquinone | Sigma | H9003 | |
| ImmPACT DAB Peroxidase | Vector Labs | SK-4105 | |
| Immpress HRP Anti-Mouse IgG Kit | Vector Labs | MP-7402 | |
| Immpress HRP Anti-Rabbit IgG Kit | Vector Labs | MP-7401 | |
| Intestinal tissue powder | * | * | The small intestines of 5 adult mice were combined and homogenised in the minimum volume of ice cold PBS. 4 volumes of ice cold acetone were added to the homogenised intestine, which was mixed thoroughly and incubated on ice for 30 min. This was centrifuged and the pellet was washed using ice cold acetone. This was further centrifuged and the resulting pellet spread onto filter paper and allowed to dry. Once thoroughly dry the material was ground to a fine powder using a pestle and mortar. |
| K-ferricyanide | Sigma | P-3667 | |
| K-ferrocyanide | Sigma | P3289 | |
| Levamisole | Sigma | L0380000 | |
| Methacarn | * | * | 60% Methanol:30% Chloroform:10% Acetic acid |
| Methanol | Fisher Scientific | M/4000/17 | |
| MgCl2 | Sigma | M8266 | |
| Normal goat serum | Vector Labs | S-1012 | NGS |
| Normal rabbit serum | Dako | X0902 | NRS |
| NTMT | * | * | 100 mM NaCl, 100 mM Tris HCl, 50 mM MgCl2, 0.1% Tween20, 2 mM Levamisole |
| PAP pen | Vector | H-400 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBT | * | * | 0.5 M NaCl, 10 mM TrisHCL pH7.5, 0.1% Tween 20 |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100x solutiuon. |
| Phosphate buffered saline (10x) | Fisher Scientific | BP3994 | Dilluted 1:10 with distilled water to make 1x |
| PLL slides | Sigma | P0425-72EA | Poly-L-lysine microscope slides |
| Proteinase K | Sigma | P2308 | |
| Proteinase k solution | * | * | Dilute Proteinase K at 200 µg/ml in 50 mM Tris, 5 mM EDTA. |
| Ralwax | BDH | 36154 7N | |
| Reducer Solution | * | * | To make 100 ml: 1 g Hydroquinone, 5 g sodium sulphite & 100 ml distilled water |
| RnaseA | Sigma | R6148 | |
| Saline | * | * | 0.9% NaCl in distilled water |
| SDS | Sigma | I3771 | |
| Sheep serum | Sigma | S3772 | |
| Silver nitrate | Sigma | S/1240/46 | |
| Silver solution | * | * | To make 100 ml: 10 ml Acetate buffer, 87 ml distilled water, 3 ml 1% silver nitrate |
| Sodium acetate | Fisher Scientific | S/2120/53 | |
| Sodium Chloride | Sigma | S6753 | NaCl |
| Sodium sulfite | Sigma | 239321 | |
| SSC | Sigma | 93017 | 20x saline sodium citrate |
| Surgical tape | Fisher Scientific | 12960495 | |
| Tamoxifen | Sigma | T5648 | TAM, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| TBS/T | Cell Signalling | #9997 | |
| Triethanolamine hydrochloride | Sigma | T1502 | |
| Tris-HCL | Invitrogen | 15567-027 | |
| Tween20 | Sigma | TP9416 | |
| VectaMount | Vector Labs | H-5000 | |
| VectaShield Hardset mounting Medium with DAPI | Vector Labs | H-1500 | |
| Vectastain ABC Kit | Vector Labs | PK-4001 | |
| X-gal | Promega | V3941 | |
| X-gal fixative | * | * | 2% formaldehyde, 0.1% glutaraldehyde in 1x PBS |
| X-gal stain | * | * | X-gal stain; 200 μl X-gal (A) in 50 ml solution B (0.214 g MgCl2, 0.48 g K-ferricyanide, 0.734 g K-ferrocyanide in 500 ml PBS). Solution B can be made up oin advance and stored at 4 °C |
| Xylene | Fisher Scientific | X/0200/21 |
Referências
- Cheng, H., Origin Leblond, C. P. differentiation and renewal of the four main epithelial cell types in the mouse small intestine. V. Unitarian Theory of the origin of the four epithelial cell types. Am J Anat. 141 (4), 537-561 (1974).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Clevers, H. The gut, a clonal conveyor belt. , Available from: http://www.molecularmovies.com/movies/view/96 (2015).
- Snippert, H., et al. Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells. Cell. 143 (1), 134-144 (2010).
- Lopez-Garcia, C., Klein, A. M., Simons, B. D., Winton, D. J. Intestinal stem cell replacement follows a pattern of neutral drift. Science. 330 (6005), 822-825 (2010).
- Buczacki, S. J., et al. Intestinal label-retaining cells are secretory precursors expressing Lgr5. Nature. 495 (7439), 65-69 (2013).
- Basak, O., et al. Mapping early fate determination in Lgr5+ crypt stem cells using a novel Ki67-RFP allele. EMBO J. 33 (18), 2057-2068 (2014).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Young, M., Ordonez, L., Clarke, A. R. What are the best routes to effectively model human colorectal cancer. Molecular oncology. 7 (2), 178-189 (2013).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proc Natl Acad Sci U.S.A. 85 (14), 5166-5170 (1988).
- Brault, V., et al. Inactivation of the beta-catenin gene by Wnt1-Cre-mediated deletion results in dramatic brain malformation and failure of craniofacial development. Development. 128 (8), 1253-1264 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/β-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Molecular and Cellular Biology. 27 (21), 7551-7559 (2007).
- Ireland, H., et al. Inducible Cre-mediated control of gene expression in the murine gastrointestinal tract: effect of loss of beta-catenin. Gastroenterology. 126 (5), 1236-1246 (2004).
- Kemp, R., et al. Elimination of background recombination: somatic induction of Cre by combined transcriptional regulation and hormone binding affinity. Nucleic Acids Res. 32 (11), e92(2004).
- Madison, B. B., et al. Cis elements of the villin gene control expression in restricted domains of the vertical (crypt) and horizontal (duodenum, cecum) axes of the intestine. J Biol Chem. 277 (36), 33275-33283 (2002).
- Parry, L., Young, M., El Marjou, F., Clarke, A. R. Evidence for a crucial role of paneth cells in mediating the intestinal response to injury. Stem Cells. 31 (4), 776-785 (2013).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21 (1), 70-71 (1999).
- el Marjou, F., et al. Tissue-specific and inducible Cre-mediated recombination in the gut epithelium. Genesis. 39 (3), 186-193 (2004).
- Guillemot, F., Nagy, A., Auerbach, A., Rossant, J., Joyner, A. L. Essential role of Mash-2 in extraembryonic development. Nature. 371 (6495), 333-336 (1994).
- Gregorieff, A., et al. Expression pattern of Wnt signaling components in the adult intestine. Gastroenterology. 129 (2), 626-638 (2005).
- van der Flier, L. G., Haegebarth, A., Stange, D. E., van de Wetering, M., Clevers, H. OLFM4 is a robust marker for stem cells in human intestine and marks a subset of colorectal cancer cells. Gastroenterology. 137 (1), 15-17 (2009).
- Merritt, A., Allen, T., Potten, C., Hickman, J. Apoptosis in small intestinal epithelial from p53-null mice: evidence for a delayed, p53-independent G2/M-associated cell death after gamma-irradiation. Oncogene. 14 (23), 2759-2766 (1997).
- Marshman, E., Ottewell, P., Potten, C., Watson, A. Caspase activation during spontaneous and radiation-induced apoptosis in the murine intestine. J Pathol. 195 (3), 285-292 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/beta-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Mol Cell Biol. 27 (21), 7551-7559 (2007).
- Barker, N., et al. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature. 457 (7229), 608-611 (2009).
- Tian, H., et al. A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable. Nature. 478 (7368), 255-259 (2011).
- Yilmaz, O. H., et al. mTORC1 in the Paneth cell niche couples intestinal stem-cell function to calorie intake. Nature. 486 (7404), 490-495 (2012).
- Adolph, T. E., et al. Paneth cells as a site of origin for intestinal inflammation. Nature. 503 (7475), 272-276 (2013).
- Marsh, V., et al. Epithelial Pten is dispensable for intestinal homeostasis but suppresses adenoma development and progression after Apc mutation. Nat Genet. 40 (12), 1436-1444 (2008).
- Jardé, T., et al. In vivo and in vitro models for the therapeutic targeting of Wnt signaling using a Tet-OΔN89β-catenin system. Oncogene. 32 (7), 883-893 (2013).
- Hung, K. E., et al. Development of a mouse model for sporadic and metastatic colon tumors and its use in assessing drug treatment. Proc Natl Acad Sci U S A. 107 (4), 1565-1570 (2010).
- Dacquin, R., Starbuck, M., Schinke, T., Karsenty, G. Mouse alpha1(I)-collagen promoter is the best known promoter to drive efficient Cre recombinase expression in osteoblast. Dev Dyn. 224 (2), 245-251 (2002).
- Hinoi, T., et al. Mouse model of colonic adenoma-carcinoma progression based on somatic Apc inactivation. Cancer Res. 67 (20), 9721-9730 (2007).
- Sansom, O. J., et al. Loss of Apc allows phenotypic manifestation of the transforming properties of an endogenous K-ras oncogene in vivo. Proc Natl Acad Sci U.S.A. 103 (38), 14122-14127 (2006).
- Wong, V. W., et al. Lrig1 controls intestinal stem-cell homeostasis by negative regulation of ErbB signalling. Nat Cell Biol. 14 (4), 401-408 (2012).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- van de Wetering, M., et al. Prospective Derivation of a Living Organoid Biobank of Colorectal Cancer Patients. Cell. 161 (4), 933-945 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados