Method Article
Protocoles pour analyser le rôle des cellules de Paneth dans la régénération de l'intestin murin utilisant conditionnelle
Dans cet article
Résumé
Cellules souches épithéliales intestinales (CSI) sont entremêlées avec des cellules de Paneth. Ces cellules se différencient descendance de l'ISC, qui soutiennent la CSI et de fournir une protection antibactérienne. Ici, nous démontrons comment nous avons utilisé des modèles de souris transgéniques conditionnelles pour établir que les cellules de Paneth jouent un rôle crucial dans le maintien de l'épithélium intestinal.
Résumé
La surface de l'épithélium de l'intestin des mammifères est un tissu dynamique qui renouvelle toutes les 3 - 7 jours. Comprendre ce processus de renouvellement identifié une population de vélo rapidement les cellules souches intestinales (CSI) caractérisées par leur expression du gène LGR5. Ceux-ci sont prises en charge par une population de cellules souches quiescentes, marqué par Bmi-1 expression, capable de les remplacer en cas de dommage. Enquêter sur les interactions entre ces populations est cruciale pour comprendre leurs rôles dans la maladie et le cancer. Les entrepreneurs indépendants existent dans des cryptes sur la surface intestinale, ces niches soutiennent l'ISC à reconstituer l'épithélium. L'interaction entre les ISC actives et inactives implique probablement d'autres cellules différenciées dans le créneau, comme il a déjà été démontré que le '' stemness '' de l'LGR5 ISC est étroitement liée à la présence de leurs cellules de Paneth voisins. Utilisation conditionnelle souris cre-loxon modèles testés pour effet de supprimer la majorité des CSI actifs dans la présence ou l'absence des cellules de Paneth. Nous décrivons ici les techniques et les analyses menées pour caractériser l'intestin et démontrent que les cellules de Paneth jouent un rôle crucial dans le créneau ISC en aidant la récupération après l'insulte substantielle.
Introduction
La surface luminale de l'intestin des mammifères caractéristiques des unités de cryptes et de répéter doigt comme des projections, appelées villosités, qui font saillie dans la lumière. Cette surface est une feuille continue de l'épithélium qui subit une auto-renouvellement complet environ tous les 3 - 4 jours 1. Ce tissu dynamique est supporté par une population de vélo rapidement les cellules souches (CSI; également connu en tant que base de crypte des cellules cylindriques), qui ont été initialement identifiés par leur expression du gène LGR5 2,3. Ces cellules existent dans un créneau spécialisé au fond des cryptes de Lieberkuhn. Initialement, la découverte que les CSI sont rapidement cyclisme est discordante avec l'idée répandue selon laquelle une cellule souche est au repos dans la nature. Avant l'identification de la LGR5 + ISC il a été postulé qu'une population de cellules retenant l'étiquette de repos à la position 4, par rapport à la base de la crypte, ont été les CSI 1. Des recherches récentes hcomme maintenant réconcilié ces observations en démontrant que surtout il ya une piscine du cyclisme équipotente ISC dans chaque crypte dont le sort sont régis par ses voisins de 4,5. Dans le cas où ils sont perdus ceux-ci peuvent être remplacés par des cellules au repos qui habituellement se sont engagés à la lignée de sécrétion, mais peut revenir à CSI si la population ISC est endommagé 6.
Voisins ISC peuvent être soit des entrepreneurs indépendants ou leurs cellules filles. Les entrepreneurs indépendants produisent des cellules filles naïves qui se multiplient et se différencient en types de cellules spécialisées qui composent la feuille épithéliale qui tapisse les lumière intestinale 1. Le gobelet, entéroendocrine, entérocytes, touffe et les cellules M migrent vers le haut pour la surface luminale où ils fournissent diverses fonctions d'absorption et réglementaires, cependant, les cellules de Paneth restent au fond de la crypte où ils existent entremêlées avec l'ISC. Ces dernières années, il a été démontré qu'une proportion de la daught naïfcellules er destinés à une lignée de sécrétion sont étiquette de repos en conservant les cellules LGR5 lo capables de revenir à un entrepreneur indépendant sur blessure 6,7.
En raison de son importance dans la régénération crypte une priorité a été placée sur la compréhension des interactions entre la CSI et ses voisins, en particulier les cellules de Paneth. Les cellules de Paneth jouent un rôle crucial dans la niche qui soutient la CSI 8. En plus des produits bactéricides les cellules de Paneth produisent des molécules qui activent les voies qui régissent le renouvellement ISC ou la différenciation de signalisation. Des études antérieures ont montré que le LGR5 + CSI ne pouvait exister quand ils pourraient concurrencer pour les signaux de niche essentiels fournis par leur fille cellules de Paneth 8. Ces études ont examiné le rôle des cellules de Paneth sur LGR5 normale + CSI et non pas dans une situation où ils sont endommagés et nécessitent reconstitution d'une population LGR5 lo.
Pour comprendre la biologie et le modèle maladie intestinale nous examinons le rôle fonctionnel de cellules et / ou des gènes en utilisant des modèles de souris transgéniques 9,10. Souvent, ces modèles utilisent la technologie cre-lox de modifier conditionnellement gène (s) 9,10. Cre (causes recombinaison) recombinase est une recombinase spécifique du site de la famille de l'intégrase, isolé de bactériophage P1. Cre catalyse recombinaison spécifique de site entre défini 34 pb ' Lox P '(locus χ de CrossOver P1) sites. Les souris sont génétiquement modifiées pour contenir des sites LoxP qui flanquent les régions d'intérêt qui lors de l'expression de la recombinase Cre sont excisés. Lier l'expression du gène Cre à une cellule ou promoteur spécifique de développement permet de changement qui pourra être fait de façon spatiale 9,10, ce qui est particulièrement utile pour surmonter les mutations létales embryonnaires. Relierons encore davantage l'expression Cre à une voie du récepteur,qui peuvent être activés artificiellement, permet des modifications temporelles.Grâce à cette technologie, nous inactivé le gène CatnB 11 dans l'épithélium intestinal. β-caténine, le produit du gène CatnB, est un régulateur clé de la voie de signalisation Wnt canonique qui régit l'homéostasie ISC. Deux études précédentes en utilisant cette stratégie a produit des résultats contradictoires 12,13. L'étude par févr et al. 12, a montré une perte de cellules souches et de l'homéostasie intestinale. Alors que l'Irlande et al. 14 étude a signalé que suite à une réduction de la viabilité cellulaire de l'axe crypte-villosité a été repeuplé à partir de cellules de type sauvage exprimant CatnB. La principale différence dans ces études était le promoteur utilisé pour exprimer la Cre dans l'épithélium intestinal. La févr et al., Étude a utilisé le promoteur du gène de la villine lié au récepteur d'œstrogène qui peut être activé par administration de tamoxifen (vil-Cre-ER T2) 15,16. En revanche Ireland et al., Utilise l'élément promoteur du gène du cytochrome rat P450A1 (CYP1A1) pour diriger l'expression Cre en réponse à la β-naphtoflavone xénobiotique (Ah-cre). Les caractéristiques de ces différents systèmes ont généré deux hypothèses pour expliquer ces différentes observations. La première est que CatnB plus efficacement supprimée dans la CAI en utilisant le système de T2 vil-Cre-ER par rapport à la Ah-cre, réduisant ainsi le nombre d'entrepreneurs indépendants à des niveaux sous-repeuplement. Alternativement, il est dû à une différence de CatnB suppression dans la population de cellules différenciées. Le système T2 vil-Cre-ER cibles toutes les cellules épithéliales de la crypte et de villosités alors que le système Ah-cre ne cible les cellules non-Paneth de la niche ISC et la crypte. Ces systèmes constituent des outils idéaux pour examiner le comporIOR de l'ISC et leur interaction avec les cellules de Paneth. Ici, nous présentons plusieurs protocoles détaillés basés sur la façon dont nous avons utilisé ces systèmes pour déterminer que les cellules de Paneth jouent un rôle crucial dans la médiation de la réponse à une lésion intestinale 17.
Protocole
Informations sur tous les matériaux utilisés est donnée dans le tableau 1. Toutes les expériences animales ont été réalisées sous l'autorité d'une licence de projet Home Office britannique.
1. Suppression CatnB utilisant le Ah-cre et Vil-CRE-ER Systems T2
- Traverser les souches de souris pour générer 10 - 14 semaine vieux cohortes de Ah-cre + CatnB + / +, Ah-cre + CatnB flox / flox, vil-Cre-ER T2 CatnB + / + et vil-Cre-ER T2 CatnB flox / flox. Pour l'analyse visuelle de la recombinaison, via une tache Gal β, cohortes devraient contenir le journaliste Rosa26R-lacZ 17. Cohortes devrait contrôler la présence de gènes et de l'utilisation des agents induction modifiés, la taille des cohortes nécessaires devraient être estimées en utilisant une analyse de puissance.
- Pour induire le transgène Ah-cre préparer β; -Naphthoflavone (BNF), ou pour le transgène Cre-vil-ER T2 tamoxifène (TAM) à l'huile de maïs pour obtenir une solution de travail de 10 mg / ml. REMARQUE: Les agents doivent être pesés dans une hotte en utilisant la protection individuelle approprié.
- Solutions de chaleur dans une bouteille ambre (BNF est sensible à la lumière) soit 99,9 ° C pendant BNF ou 80 ° C pendant TAM dans un bain d'eau.
- Transfert à un agitateur chauffée fixée à 100 ° C pendant BNF, ou 80 ° C pendant TAM, et remuez pendant 10 min.
- Pour BNF répéter 1,3-1,4 jusqu'à dissolution (peut prendre> 1 h).
- Aliquote dans de petites bouteilles d'ambre (~ 5 ml) et puis congeler à -20 ° C. Les bouteilles doivent être jetés après 3 cycles de gel / dégel. Avant d'utiliser des agents de dégel et réchauffer à la température appropriée si ils sont tombés hors de la solution. Laisser refroidir à <37 ° C avant l'injection.
- Injecter par voie intraperitoneale aux souris (IP) avec une dose de 80 mg / kg, par exemple une souris reçoit 25 g 0,2 ml de la appropriée agent d'induction. Pour Ah-cre livrer trois injections en période de 24 heures, par vil-Cre-ER T2 donner une injection par jour pendant 4 jours.
2. Dissection de l'intestin pour Reporter Visualisation et immunohistochimie (IHC)
- Euthanasier la souris par dislocation cervicale sans anesthésie préalable, conformément à l'approbation éthique. Placez la souris dans une position couchée et mouiller la fourrure en utilisant 70% de EtOH, ouvrir la cavité intra-péritonéale longitudinalement le long de la ligne médiane en utilisant une paire de ciseaux.
- Fixez l'estomac avec une pince et de rompre la connexion à l'oesophage. Retirer l'intestin grêle à l'annexe en tirant doucement sur le ventre. Retirez le gros intestin jusqu'à l'anus en tirant doucement sur l'annexe.
- Une fois que les intestins ont été isolés retirer l'estomac et l'appendice. Rincer les intestins 1x PBS en utilisant une seringue avec une pointe de pipette extrémités franches. REMARQUE: Chaque intestin devrait être immédiatement traité pour une des applications en aval décrits ci-dessous.
3. La fixation au formol de l'intestin
- Couper l'intestin rincé en 3 sections de taille égale et étiquette proximale et distale, moyen. Couper chaque section en morceaux de 1 cm. Prenez une petite bande de ruban adhésif chirurgical 2 cm x 2 cm. Placez trois à cinq morceaux de 1 cm sur le milieu de la bande chirurgicale dans une formation de pyramide.
- Fermer et sceller le ruban autour des pièces longitudinalement, pour donner un effet de «tas de bûches". Placez le tissu dans un récipient à fond plat contenant un grand excès de fixatif neutre de formaline tamponnée, au moins 10 fois le volume de fixateur pour le volume de tissu. REMARQUE: Évitez de placer des quantités excessives de tissu dans un tube pour la fixation, le diviser en plusieurs conteneurs.
- Placer les échantillons à 4 ° C pendant au moins 18 - 24 h avant l'enrobage et de sectionnement. Pour éviter toute perte de β-caténine nucléaire, ne fixe pas au-delà de 24 h.Après transfert du tissu de fixation à un récipient à fond plat contenant un grand excès de EtOH à 70%, au moins 10 fois le volume du tissu.
4. Methacarn Fixation de l'intestin
- Avant la dissection méthacarne fixateur préparer en combinant 300 ml de MeOH, d'acide acétique glacial 150 ml de chloroforme et 75 ml (4: 2: 1). Couper l'intestin rincé en 3 sections de taille égale proximales, intermédiaires et distales.
- Placez chaque morceau de l'intestin côté à côte sur un morceau de papier filtre (15 cm x15 cm) et en utilisant une paire de ciseaux springbow l'ouvrent «en face». Placez l'intestin et le papier filtre dans un plat en verre contenant méthacarne pour les 3 - 24 heures à température ambiante. Après fixation ramasser la fin d'une section intestin aide d'une pince.
- Enroulez l'intestin autour de la pince pour former un "swiss roll» et fixer le rouleau en ouvrant légèrement la pince et de mettre une aiguille de 25 G à travers elle. Placez le tissu dans un récipient à fond plat contenant à large excès de fixatif neutre de formaline tamponnée, au moins 10 fois le volume de fixateur pour le volume de tissu et pour stocker au moins une heure avant de procéder au traitement.
5. Mont entiers LacZ visualisation (Modifié à partir de El Marjou et al. 18)
- Préparer des plaques de cire en combinant ralwax fondu avec l'huile minérale à 10: 1. Verser dans des plats 15 cm de Pétri et laisser refroidir. Préparer X-gal fixateur selon le Tableau 1 et les stocker sur la glace.
- Retirer toute intestin et rincer à travers avec glacée 1x PBS, conformément à l'article 2. Fix intestin par rinçage avec 25 ml de glace-froid X-gal fixateur.
- En utilisant une paire de ciseaux couper l'intestin en 3 - 5 sections égales (maximum 5 par assiette). Placez chaque section sur la plaque de cire et de cerner chaque extrémité de sorte que la section est légèrement étiré avec le plus haut de la ligne de mésentérique; couper tout excès mésentère. Utilisation d'un springbow ciseaux couper l'intestin longitudinalement et épingle le long du chemin.60;
- Inonder la plaque avec X-gal fixateur pour couvrir les sections et laisser reposer au moins 1 h à 4 ° C. Retirer X-gal fixateur en utilisant une pipette de 25 ml et laver une fois avec 30 ml de PBS 1x. Couvrir les coupes avec 30 ml de solution de demucifying TNT pour 30 - 60 min à température ambiante, idéalement sur une plate-forme à bascule.
- Retirer demucifiying solution en utilisant une pipette de 25 ml et inonder la plaque avec 30 ml de PBS 1x. En utilisant une pipette de Pasteur laver les sections de l'intestin avec l'1x PBS dans la plaque pour éliminer le mucus.
- Retirer 1x PBS avec une pipette de 25 ml et les inondations avec 30 ml de X-gal tache. Incuber une nuit à température ambiante dans le noir avec une légère agitation sur une plate-forme à bascule.
- Suite à la vérification de l'incubation pendant la nuit que les sections ont développé un / tache bleu-vert, si la couleur de fond est toujours blanc, solution de coloration frais peut être ajouté et surveillé jusqu'à coloration se développe. NOTE: Une fois que les sections ont souillé aucune autre coloration peut être tentée.
- Retirez la tache X-galaide d'une pipette et les inondations plaque de 25 ml avec 30 ml de PBS 1x et laisser reposer pendant 3 min avec agitation douce. Retirer les épingles et ramasser, avec une pince, la fin d'une section de l'intestin grêle. Enroulez l'intestin autour de la pince pour former un "roulé", de fixer le rouleau en ouvrant légèrement la pince et de mettre une aiguille de 25 G à travers elle.
- Placez le tissu dans un récipient à fond plat large bouche contenant un grand excès de fixatif neutre de formaline tamponnée, au moins 10 fois le volume de fixateur pour le volume de tissu. Placer les échantillons à 4 ° C pendant au moins 24 heures avant l'enrobage et de sectionnement.
6. Extraction de cryptes de l'intestin
- Isoler les 20 premiers cm de l'intestin grêle, conformément à l'article 2. Placez l'intestin sur une surface de dissection propre et en utilisant une pince et des ciseaux supprimer toute graisse / mésentère ci-joint. En utilisant une paire de ciseaux springbow ouvrent l'intestin longitudinalement.
- L'utilisation d'un couvercle lame de microscope, firmly gratter la lumière intestinale pour enlever villosités et de mucus. En utilisant une paire de ciseaux coupe dans l'intestin ~ 5 mm et des pièces de transférer dans un tube de 50 ml avec 25 ml de HBSS additionné de 1 x pénicilline (100 U / ml) et streptomycine (100 U / ml).
- Incuber pendant 10 min à température ambiante. Retirer l'antibiotique contenant les médias en passant les échantillons à travers un tamis cellulaire de 70 pm.
- Placez sections intestinales dans un tube de 50 ml frais contenant 10 ml 1x HBSS et remplacer le bouchon.
- Retourner doucement deux fois et enlever le 1x HBSS en passant à travers un tamis cellulaire de 70 pm. Laver davantage les morceaux intestinales en répétant 6.4 & 6.5 trois fois et veiller à ce que la fraction finale est relativement clair.
- Transfert tissus à un tube de 50 ml frais contenant 10 ml de EDTA (8 mm) / 1x HBSS et de laisser à température ambiante pendant 5 min. Agiter vigoureusement (20 - 30x) ou vortex, passer à travers un tamis de 70 um de cellules et de tissus de transfert des pièces à un tube de 50 ml contenant de l'EDTA frais (8 mm) / 1x HBSS. NOTE:Le débit à travers peut soit être jeté ou conservé si l'analyse des villosités épithéliums est nécessaire.
- Incuber les morceaux de tissu sur la glace pendant 30 min, secouez vigoureusement l'échantillon (20 - 30x) ou vortex. Passez les échantillons à travers un tamis cellulaire de 70 pm et de conserver le débit à travers car il contient les cryptes.
- Transférer les morceaux de tissu dans un tube de 50 ml frais contenant 10 ml de HBSS 1x. Agiter vigoureusement (20 - 30x) ou vortex, passer à travers un tamis cellulaire 70 um et de conserver le débit à travers. Répéter une fois de plus pour assurer une récupération maximale de cryptes de pièces intestinaux. Combiner l'écoulement à travers les fractions et centrifuger à 300 g pendant 5 min. Décanter le surnageant et conserver le culot de crypte. REMARQUE: Les pastilles peuvent être utilisés immédiatement pour la culture (le cas échéant) ou conservés à -80 ° C avant les procédures d'extraction d'ADN / ARN / protéine standard.
7. Norme immunohistochimique Visualisation
- Couper 5 μdes sections de paraffine de tissu m incorporé SUR DES poly-L-lysine (PLL) diapositives. Note: Un protocole standard pour la coloration avec un anticorps B-caténine est donnée ci-dessous, les paramètres pour les autres anticorps sont donnés dans le tableau 2.
- De la cire avec 2x 3 min lavages dans des bains de diapositives contenant xylène frais. Réhydrater en faisant passer les lames pendant 3 min à travers des bains de glissement contenant fraîche: 100% EtOH (2x), de l'EtOH à 95% et 70% d'EtOH et finalement dans du PBS 1x.
- Placer les lames dans un bain de tampon citrate contenant du coulisseau (pH 6) et 99,9 ° C chaleur pendant 20 minutes pour récupérer les antigènes. Laisser les lames refroidir et laver 3x 5 min dans un bain de diapositive contenant 1xTBS / T pendant 5 min. Retirer les lames du dernier lavage, dessiner immédiatement autour du tissu avec un stylo à PAP, et couvrir section avec un bloc commercial de la peroxydase ou 1,5% de H 2 O 2 (en distillée H 2 O).
- Incuber pendant 20 min à température ambiante (RT) puis laver 3x dans des bains de diapositives contenant 1x SCT frais / T pendant 5 min. Après lavageing sections de couverture, à l'aide d'une pipette, dans 5% de sérum de lapin normal (NRS) / 1xTBS / T pour 30 min à température ambiante pour bloquer la liaison hydrophobe non-spécifique de votre anticorps primaire.
- Retirer le bloc de NRS avec une section de pipette et la couverture Pasteur en anticorps primaire B-caténine dilué à 1: 200 avec 5% des ORA. Laver les lames pour 3x 5 min dans des bains de diapositives contenant 1xTBS frais / T. Remarque - autres anticorps auront besoin d'optimisation pour la dilution et la spécificité. Pour assurer la spécificité d'un anticorps, d'anticorps appropriés aucun isotype taches et de contrôle doivent être effectuées. Un contrôle isotypique est adaptée à l'espèce hôte et isotype de votre anticorps primaire.
- Visualiser soit avec un kit de détection de HRP commercial ou avec un anticorps marqué par fluorescence approprié secondaire (tableau 2). NOTE: Longueur de développement diffère pour chaque anticorps, pour β-caténine 10-15 secondes est généralement suffisant. Pour optimiser le développement d'une première is anticorpsablish la longueur du temps nécessaire pour visualiser les cellules positives à l'aide d'une lame de contrôle positif et ensuite appliquer ce à toutes les diapositives suivantes.
- Laver les lames pour 3x 5 min dans des bains de diapositives contenant frais SCT / T. Counterstain lames en les immergeant dans un contenant hématoxyline de bain de toboggan pour ~ 45 secondes (pas nécessaire si vous utilisez marqué par fluorescence Anticorps secondaires). Mettre les lames dans un bain de lame propre et rincer avec de l'eau du robinet pendant ~ 1 min, assurant l'hématoxyline est pas complètement délavé.
- Déshydrater diapositives en passant par les bains de diapositives contenant des concentrations d'alcools de plus en plus; 1x 30 secondes dans 70% EtOH, 1x 30 secondes dans 95% EtOH, 2x 30 lavages sec dans EtOH à 100%, 2x 2 min dans le xylène.
- Montage glisse sous une lamelle en utilisant un milieu de montage commerciale. NOTE: Si en utilisant un anticorps marqué par fluorescence monter avec un milieu contenant DAPI pour marquer le noyau.
8. histologique identification des intestina spécifiqueLes cellules épithéliales l
- Entérocytes
- Préparer les sections à l'aide de l'article 7 avec l'anticorps et les conditions villine décrit dans le tableau 2.
- Cellules entéro-endocrines (Grimelius tache 18,19).
- Préparer sections en suivant les étapes 7,1-7,2. Laver les lames dans un bain de glissement contenant de l'eau ultrapure pendant 3 min. Placer les lames dans un bain de diapositives contenant une solution d'argent préchauffé (tableau 1) et incuber à 60 ° C pendant 3 heures.
- Retirez les diapositives de la solution d'argent et le placer dans un bain de diapositives contenant une solution de réducteur préchauffé fraîchement préparé (tableau 2) à 45 ° C pendant 3 min. Retirez les lames et les placer dans un bain de diapositives contenant de l'eau ultra pure frais pendant 3 min. Suivez les étapes de la section 7 7,6-7,8.
- Les cellules caliciformes (Bleu Alcian tache).
- Préparer sections en suivant les étapes 7,1-7,2 .. diapositives de transfert à un bain de diapositive contenant Alcian Blue pH 2,5 pendant 5 min à température ambiante. Retirer bleu alcian avec une pipette et le lieu bain de glisser sous un robinet de course pour les 3 - 5 min. Suivez les étapes 7,6-7,8. REMARQUE: solution de bleu Alcian peut être conservé pour un usage ultérieur.
- CSI.
- Pour identifier les entrepreneurs indépendants suivent l'article 9.
- Les cellules de Paneth.
- Préparer les sections suivantes de l'article 7 en utilisant l'anticorps et les conditions lysozyme décrit dans le tableau 2.
9. détection in situ de l'ARN avec le murin Intestin 19-21
- Placez 5 um sections de formol intestin fixe (section 3) sur des lames de PLL. Préparer une digoxigénine marqué sonde d'ARN linéarisé pour détecter Olfm4 expression 21. Déparaffiner et réhydrater sections conformément à l'article 7. NOTE: Ce protocole doit être effectué dans un environnement exempt de RNAse pour empêcher la dégradation de la sonde d'ARN.
- Dessiner autour tproblème avec un stylo de PAP pour minimiser réactifs. Incuber les coupes dans un bain de glissement avec 6% de H 2 O 2 (dans H 2 O distillée) pendant 30 minutes. Laver deux fois dans un bain de diapositives avec des produits frais 1x PBS pendant 3 min. Jeter 1x PBS et, à l'aide d'une pipette, section de couvercle avec 4% de paraformaldehyde pendant 20 min sur la glace.
- Laver deux fois dans un bain de diapositives avec des produits frais 1x PBS pendant 3 min. Utilisation d'un sections de couverture de la pipette avec la solution proteinase K pendant 5 min dans un bain de lavage à glissière avec 1 x PBS fraîche pendant 3 min. Utilisation d'un sections post-fix pipette en couvrant dans 4% de paraformaldehyde pendant 5 min à température ambiante.
- Lavez dans un bain de diapositive avec DEPC traitées H 2 0 pendant 2 min. Utilisation d'un sections de couverture de la pipette dans une solution d'anhydride acétique pendant 10 minutes avec agitation. Lavez dans un bain de diapositives avec des produits frais 1x PBS / 3 min, suivie par une solution saline 1x / 3 min. Passez diapositives dans des bains contenant des concentrations d'alcools de plus en plus; 1x 30 secondes dans 70% EtOH, 1x 30 secondes dans 95% EtOH, 2x 30 lavages de Sec en frais EtOH à 100%,2x 2 min dans le xylène douce et laisser sécher à l'air.
- Diluer Olfm4 sonde 1: 100 dans un tampon d'hybridation et de dénaturer la sonde par chauffage à 80 ° C pendant 3 min. Appliquer 100 pi de sonde pour chaque section et couvrir avec du parafilm pour éviter la déshydratation de la diapositive. Incuber une nuit dans une chambre sombre et humide à 65 ° C.
- Lavez dans un bain de diapositive avec 5 x SSC à 65 ° C pendant 15 min. Laver les coupes dans un bain de diapositive deux fois avec des produits frais 50% de formamide / 5 x SSC / SDS à 1% pendant 30 min à 65 ° C. Laver deux fois les articles dans un bain de glissement en PBT frais pendant 10 minutes, le premier à 65 ° C et la seconde à la température ambiante. Utilisation d'un sections de couverture de la pipette avec PBT contenant 25 ug RNAse pendant 45 min à 37 ° C. Laver les coupes dans un bain de diapositive dans PBT pendant 5 min à température ambiante.
- Laver les coupes dans un bain de diapositive deux fois avec des produits frais 50% de formamide / 5 x SSC pendant 30 min à 65 ° C. Pour bloquer, sections de couvercle à l'aide d'une pipette avec du sérum de mouton de 10% de PBT et de stocker dans un endroit sombre, moist chambre à température ambiante pendant 2 - 3 h.
- Préparation de l'anticorps par dilution de l'anticorps anti-digoxigénine conjugué à la phosphatase alcaline à 1: 500 avec du sérum de mouton à 10% dans du PBT contenant 5 mg / ml de poudre d'intestin de la souris. Incuber pendant 3 heures à 4 ° C dans l'obscurité sur un agitateur oscillant. Centrifuger pour éliminer l'excès de poudre intestinal et ajouter 3x volumes de sérum de mouton à 1% dans le surnageant de PBT.
- Retirer le bloc de diapositives avec une pipette et ajouter 100 ul de la solution d'anticorps à chaque section, couvrir avec du parafilm et incuber dans une chambre humide obscurité à 4 ° C pendant la nuit. Laver les coupes dans un bain de diapositives 3 × avec des produits frais PBT pendant 5 min. Pour bloquer les sections de lavage dans un bain de diapositives 3 × avec un tampon NTMT frais pendant 5 min.
- Pour visualiser, à l'aide d'une pipette couvrir chaque section avec BM pourpre et incuber dans l'obscurité à température ambiante pendant 24 à 72 h jusqu'à une couleur suffisamment forte développe. Laver les sections dans un bain de glissement une fois en contre-colorer PBT et par immersion dans l'éosine pendant 1 min. Remove excès éosine par sections de lavage dans un bain de glisser sous une eau courante pendant 3 - 5 min. Immerger les lames dans le xylène et laisser sécher à l'air. Monter sous une lamelle en utilisant les médias commerciaux.
10. histologique intestinal Caractérisation des épithéliums
- Placez 5 um sections du tissu fixe (section 3 & 4) sur des lames de PLL. Analyser ≥25 entier aléatoire (ou ≥50 moitié) de cryptes ≥ 4 souris de chaque cohorte pour chacun des paramètres suivants. REMARQUE: Pour maintenir la cohérence analyser cryptes partir du même emplacement de chaque intestin (utiliser uniquement l'extrémité proximale).
- Paramètres cellulaires de coupes colorées standards H & E (sauf indication contraire): nombre Crypte, la hauteur, l'apoptose et la mitose.
- Numéro crypte.
- Utilisez une alimentation faible grossissement (par exemple 4X ou 10X) de compter manuellement le nombre de cryptes en contact avec la couche basale. Comptez ≥10 transversal proximal intestin sectedes ions d'au moins 4 souris.
- Hauteur crypte.
- Utilisez un grossissement de puissance élevée (par exemple 20X ou 40X) de compter manuellement le nombre de cellules du fond de la crypte de la crypte / villosités axe (Figure 3b).
- Apoptose 22, 23.
- Méthode 1: utiliser un grossissement de puissance élevée (par exemple 20X ou 40X.) De compter manuellement les numéros de cellules apoptotiques dans chaque crypte. Les cellules apoptotiques peuvent être identifiés par le rétrécissement cellulaire, la condensation de la chromatine, la formation de vésicules cytoplasmiques et de corps apoptotiques (figure 3a).
- Méthode 2: Effectuer une tache IHC (article 7) pour la caspase-3 en utilisant des conditions décrites dans le Tableau 2 Utilisation d'un agrandissement de puissance élevée (par exemple 20X ou 40X.) Compter manuellement le nombre de cellules positives dans chaque crypte pour quantifier les cellules de la. phase d'exécution de l'apoptose.
- Mitose.
- Utilisez un grossissement de puissance élevée (par exemple 20X ou 40X) de compter manuellement les numéros de cellules en mitose dans chaque crypte. Les cellules en mitose contiennent la Matière Condensée de l'ADN et sont généralement symétrique et bien formé (Figure 3b).
- Prolifération.
- Effectuer une IHC (section 7) tache pendant Ki-67 en utilisant des conditions décrites dans le tableau 2. Compter manuellement les cellules positives pour quantifier la proportion de cellules proliférantes de la crypte.
- Numéro crypte.
Résultats
En comparant ISC recombinaison efficacité dans le Ah-cre et Vil-CRE-ER Systems T2
L'utilisation de ces systèmes cre-lox pour évaluer le rôle des cellules de Paneth, dans repeupler l'intestin après une lésion, la caractérisation requise de l'efficacité de la recombinaison à l'intérieur de la CSI. Utilisation de la journaliste conditionnelle Rosa26R-lacZ nous avons démontré que dans les deux systèmes 3 jours après l'induction (dpi), il est de ~ 100% recombinaison dans l'intestin grêle (figure 1a). Quantifier la présence de l'allèle recombiné par qPCR a été confondu par les différences dans les modes d'expression Cre entre les systèmes. Le système de T2 vil-Cre-ER a montré une augmentation d'un facteur 3,53 dans la présence de l'allèle recombiné par rapport au système cre-Ah, en raison de son expression dans une plus grande proportion de la epitheliun 16. Pour surmonter ce que nous avons adopté une stratégie différente qui nous a permis de comparer directement les systèmes. Nous induit la souris avec différents régimes d'induction et analysé à 30 dpi, à quel point LacZ cryptes positifs et villosités représentent un événement de recombinaison ISC. En utilisant cette approche, nous avons démontré que dans les deux systèmes, 3 injections d'agent inducteur (livré IP à 80 mg / kg en 24 h), recombinés dans un nombre équivalent de CSI malgré des niveaux de recombinaison initial étant beaucoup plus grande dans le vil-Cre-ER T2 système 16 (figure 1b-d). En outre, en utilisant l'ADN extrait des cryptes recombinés, qPCR pour les allèles recombinées démontré une augmentation non significative de la recombinaison en utilisant le système ER T2 vil-Cre, potentiellement en raison de la recombinaison dans les cellules de Paneth pas observées en utilisant le système Ah-cre (Figure 1d). De plus, la coloration de types de cellules épithéliums n'a pas indicat toute modification de motif de différenciation, des images représentatives de chaque type de cellule étudié est représenté sur la figure 2e-2h.
Caractérisation des épithéliums intestinal suivante CatnB Suppression
Quantification de perte Crypt
Caractériser les cinétiques de recombinaison dans ces systèmes Cre nous a permis d'analyser l'intestin de la souris lorsque des nombres équivalents de CSI sont recombinés. Utilisation du rapporteur LacZ deux systèmes ont montré une perte complète de cellules recombinées (bleu) à 3 dpi (Figure 2a). Comme indiqué précédemment, trois jours après la suppression d'CatnB les souris Ah-Cre ont montré une perte de cryptes partielle, alors que les souris T2 vil-Cre-ER ont montré une destruction complète de la crypte / villosités axe 13,16,24 (figure 2b-d).
Dynamique de épithéliale Repeuplement
En utilisant les techniques ci-dessus nous avons caractérisé plusieurs paramètres afin de nous permettre de comprendre cette observation. Des images représentatives des paramètres et les types cellulaires analysés en utilisant des protocoles 7-10 sont donnés dans (Figure 3a et 3b). En bref, la perte de cryptes était en accord avec les niveaux élevés d'apoptose affichées dans les deux systèmes (figure 3e). Toutefois, la mitose, la prolifération, la hauteur cellulaire crypte, crypte et d'expression (non représenté) données indiquent le système Ah-cre pourrait récupérer, probablement en raison de repeuplement par les ISC de l'ONU-recombiné (figure 3C). En comparaison Stark, le vil-Cre-ER T2 n'a pas réussi à récupérer malgré conservant les cellules épithéliales des cryptes (Figure 3d).
Caractérisation des phénotypes cellulaires dans Crypte
Pour comprendre pourquoi les cryptes de souris Ah-CRE pourraient repeupler alors que le vil-Cre-ER T2 ne pouvait pas nous caractérisé les cellules épithéliales trois jours après la suppression de CatnB. Par hybridation in situ (article 9) et l'analyse IHC (section 7, 8 et 10), nous avons démontré que les cellules des cryptes dans les / souris flox vil-Cre-ER T2 CatnB flox étaient non-prolifération et manquait de l'expression du marqueur ISC Olfm4 , à la différence des cryptes dans les souris Ah-Cre (figure 4C et F). Comme la caractérisation initiale avait montré que la recombinaison dans des cryptes était équivalent nous avons procédé à examiner le rôle des cellules de Paneth. Nous avons effectué un double fluorescent IHC contre CatnB et Lyz1 pour identifier les cellules qui avaient perdu β-caténine et si elles étaient des cellules de Paneth (figure 5a-5c). Comme décrit précédemment, nous Demonstrated que toutes les cellules glandulaires sont ciblés en utilisant le système Cre-T2 vil-ER. En comparaison le système Ah-cre épargné les cellules de Paneth et l'épithélium des villosités. D'autres cellules de Paneth étaient seulement observée subissant une apoptose après CatnB deletion en utilisant le système Cre-T2 vil-ER (figure 5d et 5e).
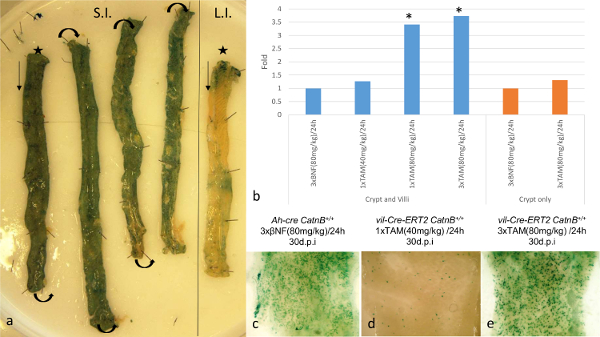
Figure 1: Comparaison de la spécificité et de l'efficacité de Cre / Lox recombinaison au sein de la intestinale épithéliums utilisant le Ah-cre et Vil-CRE-ER Systems T2 (a):. Visualisation de Ah-cre expression rapporteur LacZ dans wholemount petite (SI; * extrémité distale) et grande (LI; * extrémité distale) d'un type souris sauvage. (b): Résultats de qPCR changement démontrant de pliage pour l'allèle CatnB flox recombiné à 1 dpi pour comparer les différents régimes d'induction en Ah-cre CatnB flox / flox (BNF induite) et vil-Cre-ER T2 CatnB flox / flox (TAM induite ); * P> 0,05 (Mann-Whitney [2-queue] par rapport au témoin). (c) - (e):.. intestin grêle Wholemount montrant LacZ crypte positif 30 dpi Panel (b) - (e) modifiée de Parry et al 16 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
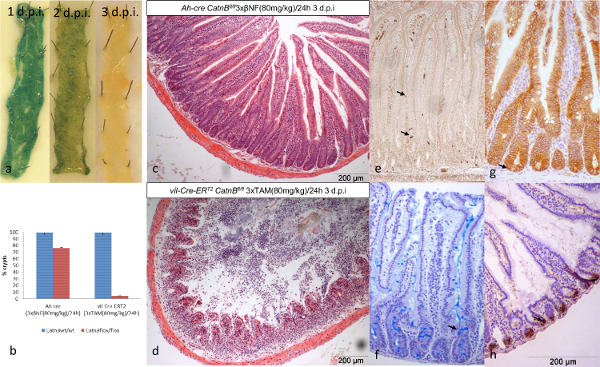
Figure 2: Comparaison de l'Ah-cre et Vil-Cre-ER T2 Systèmes pour conditionnellement Suppression CatnB dans l'intestin grêle épithéliums (a):. intestin grêle Wholemount montrant la perte de cellules recombinées chez la souris Ah-cre CatnB flox / flox LacZ + pendant 3 jours. (b): Quantification de la perte de la crypte 3 jours après la suppression de CatnB; * P> 0,05 (Mann-Whitney [2-queue] par rapport au témoin). (C & D): Les sections transversales H & E de formol intestin fixe démontrant la perte de cryptes après CatnB suppression. (e) - (h) Exemple de types de cellules provenant de souris de contrôle: (e) des cellules entéro-endocriine, (f) des cellules caliciformes, (g) CatnB IHC indiquant une ISC (→) avec nucléaire B-caténine et (h) Paneth cellules. Panneau (b) modification de Parry et al. 16. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
gether.within-page = "always"> 
Figure 3: Caractérisation de l'apparition du phénotype lorsque vous utilisez le Ah-cre et Vil-CRE-ER Systems T2 conditionnellement Suppression CatnB en chiffres similaires de CSI dans l'intestin grêle épithéliums (A & B) H & E formol teinté sections fixes indiquant l'emplacement de la crypte. hauteur ([), un apoptotique (←) et de la cellule mitotique (↓). Quantification du nombre moyen de cellules par crypte entre le type sauvage (bleu) et CatnB flox (orange) souris à trois points de temps (dpi) (c) de hauteur crypte, (d) la mitose et (e) l'apoptose (barres d'erreur indiquent l'écart-type ). Panneau (c) - (e) modifié à partir de 16 Parry et al.3429fig3large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4:. Comparaison des caractéristiques de l'ISC en utilisant Ah-cre et Vil-CRE-ER Systems T2 conditionnellement Suppression CatnB dans les cellules de la crypte épithéliums épithéliales Intestin grêle 3 jours après la suppression de CatnB utilisant le Ah-cre (AC) ou vil- Cre-ER T2 système (df). (A & D) H & E coupe montrant les zones de la perte de la crypte; (B & D) Ki-67 IHC perte de cellules prolifératives utilisant vil-Cre-ER T2 démontrer; (C & F) Olfm4 in situ démontrant présence de CSI fonctionnels utilisant Ah-cre. Panneau (un) -. (f) modifiée de Parry et al 16 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
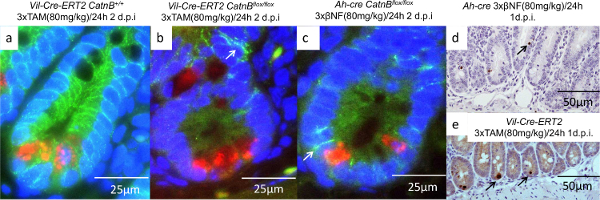
Figure 5: Caractérisation des cellules de Paneth après CatnB suppression en utilisant les Vil-Cre-ER T2 et Ah-CRE Systems (AC):. Images immunofluorescence de cryptes montrant cellule de Paneth (rouge), B-caténine (vert) et le noyau (en bleu ), flèche indiquent liée à la membrane β-caténine; (de) IHC pour la caspase-3 en indiquant les cellules de Paneth apoptotiques sont absents dans le Ah-cre (d), mais présent dans le système vil-Cre-ER T2 (e). Panneau de (a) - (e) modifié à partir deParry et al 16. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Un tampon d'acétate | * | * | Pour obtenir 100 ml: 4,8 ml 0,2 M d'acide acétique, de l'eau de 45,2 ml 0,2 M d'acétate de sodium et 50 ml d'eau distillée |
| Acide acétique | Fisher Scientific | C / 0400 / PB17 | |
| De l'anhydride acétique | Sigma | A6404 | |
| Solution de l'anhydride acétique | * | * | L'anhydride acétique 2 M à 0,1 M de chlorhydrate de triéthanolamine |
| Bleu Alcian | Sigma | A5268 | |
| Bleu Alcian PH 2,5 | * | * | Pour faire 500 ml: 15 ml d'acide acétique, de l'eau 5 g Alcian Blue & 485 ml d'eau distillée |
| anti-digoxigénine phosphatase alcaline anticorps conjugué | Abcam | ab119345 | |
| B (bêta) -Naphthoflavone | Sigma | N3633 | BNF, sans permettre d'injecter la solution refroidir trop comme composé chutera de la solution. Solution peut être réutilisé - conserver à -20 ° C entre les utilisations, ne réchauffez pas plus de deux fois. |
| Bloxall | Vector Labs | SP-6000 | |
| BM violet | Roche | 11442074001 | |
| BSA | Sigma | A4503 | Albumine de sérum bovin |
| Chloroforme | Fisher Scientific | C / 4.920 / 17 | |
| Citrate Buffer / démasquage antigénique Solution | Vector Labs | H-3300 | |
| L'huile de maïs | Sigma | C8627 | |
| Solution Demucifiying | * | * | Pour 500 ml: 50 ml de glycerol, 50 ml de Tris 0,1 M pH8.8, 100 ml d'EtOH, 300 ml de solution saline (0,9% NaCl dans de l'eau), 1,7 g de DTT. Demucifying solution peut être faite à l'avance et stocké, mais sholud DTT est ajouté juste avant l'incubation (340 mg / 100 ml). |
| DEPC eau traitée | Life Technologies | 750023 | |
| TNT | Sigma | 101509944 | |
| EDTA | Sigma | O3690 | 0,5 M |
| Éthanol | Fisher Scientific | E / 0650DF / 17 | |
| Papier filtre | Quel homme | 3000917 | |
| Formaldéhyde | Sigma | F8775 | |
| Formol | Sigma | SLBL11382V | Formol tamponné neutre |
| Formamide | Sigma | F5786 | |
| Glutaraldéhyde | Sigma | G6257 | |
| H 2 O 2 | Sigma | 216763 | |
| Hématoxyline | Raymond A Lamb | 12698616 | |
| HBSS | Gibco | 14175-053 | HBSS (-MgCl2 +; -CaCl2) |
| Un tampon d'hybridation | * | * | 5 x SSC, 50% de formamide, 5% de SDS, 1 mg / ml d'héparine, 1 mg / ml d'ARNt de foie de veau |
| Hydroquinone | Sigma | H9003 | |
| IMMPACT DAB peroxydase | Vector Labs | SK-4105 | |
| Kit Immpress HRP IgG anti-souris | Vector Labs | MP-7402 | |
| Immpress HRP anti-lapin Kit IgG | Vector Labs | MP-7401 | |
| Poudre de tissu intestinal | * | * | Les intestin grêle de 5 souris adultes ont été combinés et homogénéisés dans un volume minimum de PBS glacé. 4 volumes d'acétone glacée ont été ajoutés à la homogénéisé intestin, qui a été bien mélangé et mis en incubation sur de la glace pendant 30 min. Ceci a été centrifugé et le culot a été lavé avec de la glace de l'acétone froide. Ceci a encore été centrifugé et le culot résultant a étalée sur un papier filtre et on le laisse sécher. Une fois sécher le matériau a été broyé en une poudre fine en utilisant un pilon et un mortier. |
| K-ferricyanure | Sigma | P-3667 | |
| K-ferrocyanure | Sigma | P3289 | |
| Levamisole | Sigma | L0380000 | |
| Methacarn | * | * | 60% de methanol: chloroforme 30%: 10% d'acide acétique |
| Méthanol | Fisher Scientific | M / 4000/17 | |
| MgCl2 | Sigma | M8266 | |
| Sérum de chèvre normal | Vector Labs | S-1012 | NGS |
| Sérum de lapin normal | Dako | X0902 | NRS |
| NTMT | * | * | NaCl 100 mM, Tris HCl 100 mM, MgCl2 50 mM, 0,1% de Tween 20, 2 mM de lévamisole |
| PAP stylo | Vecteur | H-400 | |
| Paraformaldéhyde | Sigma | P6148 | |
| PBT | * | * | 0,5 M de NaCl, 10 mM TrisHCL pH 7,5, 0,1% de Tween 20 |
| Pénicilline / Streptomycine | Gibco | 15140-122 | Solutiuon 100x. |
| Une solution saline tamponnée au phosphate (10x) | Fisher Scientific | BP3994 | Dilluted 1:10 avec de l'eau distillée pour faire 1x |
| Diapositives PLL | Sigma | P0425-72EA | Des lames de microscope Poly-L-lysine |
| Proteinase K | Sigma | P2308 | |
| Solution protéinase k | * | * | Diluer la proteinase K à 200 pg / ml dans du Tris 50 mM, EDTA 5 mM. |
| Ralwax | BDH | 36154 7N | |
| Réducteur Solution | * | * | Pour obtenir 100 ml: 1 g Hydroquinone, 5 g de sulfite de sodium et 100 ml d'eau distillée |
| RNaseA | Sigma | R6148 | |
| Saline | * | * | 0,9% de NaCl dans de l'eau distillée |
| SDS | Sigma | I3771 | |
| Sérum de mouton | Sigma | S3772 | |
| Nitrate d'argent | Sigma | S / 1240/46 | |
| Solution Argent | * | * | Pour obtenir 100 ml: 10 ml du tampon acétate, 87 ml d'eau distillée, 3 ml 1% de nitrate d'argent |
| L'acétate de sodium | Fisher Scientific | S / 2120/53 | |
| Chlorure de sodium | Sigma | S6753 | NaCl |
| Le sulfite de sodium | Sigma | 239321 | |
| SSC | Sigma | 93017 | 20x saline de citrate de sodium |
| Ruban adhésif chirurgical | Fisher Scientific | 12960495 | |
| Tamoxifen | Sigma | T5648 | TAM, sans permettre d'injecter la solution refroidir trop comme composé chutera de la solution. Solution peut être réutilisé - conserver à -20 ° C entre les utilisations, ne réchauffez pas plus de deux fois. |
| SCT / T | Signalisation cellulaire | # 9997 | |
| Chlorhydrate de triéthanolamine | Sigma | T1502 | |
| Tris-HCl | Invitrogen | 15567-027 | |
| Tween20 | Sigma | TP9416 | |
| VectaMount | Vector Labs | H-5000 | |
| Vectashield Hardset moyen de montage avec DAPI | Vector Labs | H-1500 | |
| Vectastain Kit ABC | Vectou Labs | PK-4001 | |
| X-gal | Promega | V3941 | |
| X-gal fixateur | * | * | 2% de formaldehyde, 0,1% de glutaraldéhyde dans 1xPBS |
| X-gal tache | * | * | Tache X-gal; 200 ul de X-gal (A) dans 50 ml de solution B (0,214 g de MgCl2, 0,48 g de K-ferricyanure, 0,734 g de K-ferrocyanure dans 500 ml de PBS). La solution B peut être constitué oin avance et stocké à 4 ° C |
| Xylène | Fisher Scientific | X / 0200/21 |
Tableau 1: Matériels et méthodes
d> 1/200, 30 min à température ambiante| Cible | bêta-caténine | Lysozyme | Ki67 | Caspase-3 | Villin |
| Source commerciale de primaire Ab | Transduction Labs | Neomarkers | Vector Labs | R & D Systems | Santa Cruz |
| Numéro de catalogue | 610154 | RB-372 | VP-K452 | AF835 | SC-7672 |
| Ab primaire soulevée dans | Souris (mAb) | Lapin (PAB) | Souris (mAb) | Lapin (PAB) | Goat (PAB) |
| La récupération de l'antigène | Bain d'eau bouillante / tampon citrate | Tampon d'ébullition du bain d'eau / Citrate | Tampon d'ébullition du bain d'eau / Citrate | Tampon d'ébullition du bain d'eau / Citrate | Tampon d'ébullition du bain d'eau / Citrate |
| Bloc de peroxydase | Bloxall ou 2% de H 2 O 2, 45 sec | Bloxall ou 1,5% de H 2 O 2, 30 min | Bloxall ou 0,5% de H 2 O 2, 20 min | Bloxall ou 2%H 2 O 2, 45 sec | Bloxall ou 3% de H 2 O 2, 20 min |
| Bloc de Sérum | 1% de BSA, 30 min | 10% NGS, 30min | 20% des ORA, 20 min | 10% NGS, 45 min | 10% des ORA, 30 min |
| Le tampon de lavage | PBS | SCT / T | SCT / T | PBS | SCT / T |
| Conditions pour l'enseignement primaire Ab | 1/300, 2 h à température ambiante | 1/100, 1h à température ambiante | 1/50, 1h à température ambiante | 1/750, o / n à 4 ° C | 1/500, 1h à température ambiante |
| Ab secondaire | Kit Immpress HRP IgG anti-souris | Immpress HRP anti-lapin Kit IgG | Lapin anti-souris biotinylé | Biotinylé chèvre anti-lapin | Lapin biotinylé anti-chèvre |
| Conditions d'Ab secondaire | 1 heure à température ambiante | 30min à température ambiante | 1/200, 30 min à température ambiante | 1/200, 30 min à température ambiante | |
| L'amplification du signal | N / A | N / A | Kit ABC | Kit ABC | Kit ABC |
| Signal de détection | IMMPACT DAB peroxydase | IMMPACT DAB peroxydase | IMMPACT DAB peroxydase | IMMPACT DAB peroxydase | IMMPACT DAB peroxydase |
| Anticorps par immunofluorescence | AlexaFluor 488 | AlexaFluor 594 | N / A | N / A | N / A |
| Propriétés d'immunofluorescence | Excitation Max 488 / Emission Max 525 | Excitation Max 595 / Emission Max 617 | |||
| Ensemble de filtre commun | FITC | Texas Red |
Discussion
En utilisant des souris transgéniques de Cre-lox conditionnelles à disséquer la fonction des gènes et des cellules est une approche couramment utilisée. Ces modèles ont été utilisés avec succès dans l'intestin pour identifier et caractériser les cellules souches 2,4-6 et de comprendre leur rôle dans la maladie 25. Pour exploiter pleinement ces modèles requiert une caractérisation complète du système pour permettre aux données d'être interprété correctement. Une compréhension complète de ces systèmes est difficile à réaliser en raison de gènes étant rarement spécifiques à un type de cellule d'isolement ou de l'emplacement, un manque de connaissances biologiques et l'inefficacité des systèmes utilisés pour induire l'expression Cre. Les méthodes décrites ici montrent comment nous surmontons ces questions par le biais de la conception expérimentale et l'application des connaissances existantes. Bien que nous avons utilisé ces méthodes pour répondre à une question spécifique de recherche les techniques présentées ici sont génériques et peuvent être exploitées pour toute recherche portant sur la muriintestin ne.
Préparation du tissu intestinal
L'étape cruciale pour assurer des résultats robustes est la récolte et la transformation du tissu, qui doit être traité en temps opportun des protocoles de modalités et la fixation strictement respectés. Comme la quasi-totalité des questions importantes peuvent être attribués à l'aval des artefacts liés à l'assèchement des tissus sur et / ou la fixation incomplète. Le timing est crucial pour empêcher la dégradation de l'architecture tissulaire et / ou des acides nucléiques et des protéines. Fixation incomplète ou trop zélé peut entraîner la perte de la résolution histochimique. Fixation incomplète en raison de temps ou sections trop épaisse pour permettre la pénétration du fixateur peut entraîner la perte de la résolution dans les cryptes intestinales qui peuvent être observés comme une «marque de marée» sur l'analyse IHC insuffisante. En outre, il est crucial que la fixation ne se prolonge pas trop longtemps, comme β-caténine nucléaire peut diffuser hors du noyau à moins immédiatement proétat brut et la cire incorporé après la fixation du formol.
Rôle des cellules de Paneth dans la niche ISC
Les données présentées ici montrent effectivement l'importance des cellules de Paneth dans la crypte de régénération dans l'intestin de l'adulte en cas de perte ISC. Cependant, il restait la possibilité que Ah-cre épargne une population de CSI que les objectifs de T2 vil-Cre-ER. Tian et al. 26 élégamment démontré que les CSI hi LGR5 sont remplacés par une population de LGR5 lo CSI de réserve. Il semble maintenant probable que ces entrepreneurs indépendants sont épargnés dans le système Ah-cre en raison de la population de réserve ayant été identifié comme précurseurs de cellules de sécrétion 6,7. L'importance de la cellule mûre Paneth au soutien de ces précurseurs de cellules sécrétoires en cas de besoin de revenir à un état ISC reste à répondre. Comme les cellules de Paneth constituent le jeSC niche 8 et jouer un rôle dans la régulation des réponses Icc à l'apport calorique et l'inflammation 28 27 il reste probable que leurs fonctions infirmières vont étendre à leurs propres précurseurs.
Nouvelles approches et technologies pour modéliser efficacement du cancer colorectal humain
La découverte de l'ISC a conduit à l'identification des gènes qui sont actuellement utilisés pour générer de nouveaux modèles de souris pour étudier les rôles des gènes et des cellules en biologie et les maladies intestinales, examiné par Clarke et al 9. Les seules limitations de cette technique est l'identification des gènes à exprimer la protéine Cre. Actuellement CSI sont systématiquement étudiés en utilisant des souris transgéniques conditionnels basés sur le profil d'expression génique LGR5. Les souris qui expriment Cre à partir du promoteur LGR5 ont été utilisées pour supprimer APC, le gène le plus fréquemment muté dans le cancer colorectal (CRC), Ce qui démontre l'ISC que la cellule 25 d'origine. Suppression sélective d'autres gènes dans ces cellules CRC fournit un aperçu de progression de la maladie et la propagation par exemple. PTEN 29. En outre aperçu ISC fonction est extraite par l'ablation de cellules exprimant spécifiquement LGR5 chez la souris en utilisant un récepteur de la toxine diphtérique humain (DTR) dans le gène frappé LGR5 26 locus. D'autres stratégies utilisent le système Tet-O qui permet l'expression réversible cours des 30 protéines mutantes. En utilisant ces outils pour modifier gène (s) dans différentes cellules 31 et 32,33 emplacements est utilisée pour comprendre comment le cancer initier, de progrès et métastaser 34. Alternativement mutagenèse en utilisant le système de transposon beauté de couchage est d'identifier de nouveaux pilotes de CRC. La poursuite du développement des souris, des techniques et des stratégies de modification génétique continue de développer des modèles plus pertinents patients.
Nouveau modes ont été développés pour la caractérisation des épithéliums et CSI intestinaux. Caractérisation du ratio de types de cellules epitheliales peuvent être obtenus en utilisant la cytométrie de flux basé sur l'expression différentielle de 35 lectine et CD24. Potentiellement, le plus grand progrès dans la compréhension de la biologie ISC et leur rôle dans la maladie seront effectués en utilisant l'ex vivo organoïde système de culture 36. Ce système permet CSI normales et malignes à la culture en 3D, où ils se répliquent et se différencient d'une manière plus physiologiquement pertinent. Il est à espérer que ces tests permettront directe des médicaments sur des échantillons de patients in vitro, ouvrant la voie à la médecine personnalisée 37.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors would like to thank Mark Bishop, Mathew Zverev, Victoria Marsh-Durban, Adam Blackwood and Sylvie Robine. This work was funded by a programme grant from Cancer Research UK.
matériels
| Name | Company | Catalog Number | Comments |
| Acetate buffer | * | * | To make 100 ml: 4.8 ml 0.2 M Acetic acid, 45.2 ml 0.2 M Sodium acetate & 50 ml distilled water |
| Acetic acid | Fisher Scientific | C/0400/PB17 | |
| Acetic anhydride | Sigma | A6404 | |
| Acetic anhydride solution | * | * | 2 M Acetic anhydride in 0.1 M triethanolamine hydrochloride |
| Alcian Blue | Sigma | A5268 | |
| Alcian Blue pH 2.5 | * | * | To make 500 ml: 15 ml acetic acid, 5 g Alcian Blue & 485 ml distilled water |
| anti-digoxigenin alkaline phosphatase conjugated antibody | Abcam | ab119345 | |
| B(beta)-Naphthoflavone | Sigma | N3633 | BNF, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| Bloxall | Vector Labs | SP-6000 | |
| BM purple | Roche | 11442074001 | |
| BSA | Sigma | A4503 | Bovine serum albumin |
| Chloroform | Fisher Scientific | C/4920/17 | |
| Citrate Buffer/Antigen Unmasking Solution | Vector Labs | H-3300 | |
| Corn oil | Sigma | C8627 | |
| Demucifiying solution | * | * | For 500 ml: 50 ml glycerol, 50 ml Tris 0.1M pH8.8, 100 ml EtOH, 300 ml saline (0.9% NaCl in water), DTT 1.7 g. Demucifying solution can be made in advance and stored, but DTT sholud be added just before incubation (340 mg/100 ml). |
| DEPC treated water | Life Technologies | 750023 | |
| DTT | Sigma | 101509944 | |
| EDTA | Sigma | O3690 | 0.5M |
| Ethanol | Fisher Scientific | E/0650DF/17 | |
| Filter paper | Whatman | 3000917 | |
| Formaldehyde | Sigma | F8775 | |
| Formalin | Sigma | SLBL11382V | Neutral buffered formalin |
| Formamide | Sigma | F5786 | |
| Glutaraldehye | Sigma | G6257 | |
| H2O2 | Sigma | 216763 | |
| Haematoxylin | Raymond A Lamb | 12698616 | |
| HBSS | Gibco | 14175-053 | HBSS (-MgCl2+; -CaCl2) |
| Hybridisation buffer | * | * | 5× SSC, 50% formamide, 5% SDS, 1 mg/ml heparin, 1 mg/ml calf liver tRNA |
| Hydroquinone | Sigma | H9003 | |
| ImmPACT DAB Peroxidase | Vector Labs | SK-4105 | |
| Immpress HRP Anti-Mouse IgG Kit | Vector Labs | MP-7402 | |
| Immpress HRP Anti-Rabbit IgG Kit | Vector Labs | MP-7401 | |
| Intestinal tissue powder | * | * | The small intestines of 5 adult mice were combined and homogenised in the minimum volume of ice cold PBS. 4 volumes of ice cold acetone were added to the homogenised intestine, which was mixed thoroughly and incubated on ice for 30 min. This was centrifuged and the pellet was washed using ice cold acetone. This was further centrifuged and the resulting pellet spread onto filter paper and allowed to dry. Once thoroughly dry the material was ground to a fine powder using a pestle and mortar. |
| K-ferricyanide | Sigma | P-3667 | |
| K-ferrocyanide | Sigma | P3289 | |
| Levamisole | Sigma | L0380000 | |
| Methacarn | * | * | 60% Methanol:30% Chloroform:10% Acetic acid |
| Methanol | Fisher Scientific | M/4000/17 | |
| MgCl2 | Sigma | M8266 | |
| Normal goat serum | Vector Labs | S-1012 | NGS |
| Normal rabbit serum | Dako | X0902 | NRS |
| NTMT | * | * | 100 mM NaCl, 100 mM Tris HCl, 50 mM MgCl2, 0.1% Tween20, 2 mM Levamisole |
| PAP pen | Vector | H-400 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBT | * | * | 0.5 M NaCl, 10 mM TrisHCL pH7.5, 0.1% Tween 20 |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100x solutiuon. |
| Phosphate buffered saline (10x) | Fisher Scientific | BP3994 | Dilluted 1:10 with distilled water to make 1x |
| PLL slides | Sigma | P0425-72EA | Poly-L-lysine microscope slides |
| Proteinase K | Sigma | P2308 | |
| Proteinase k solution | * | * | Dilute Proteinase K at 200 µg/ml in 50 mM Tris, 5 mM EDTA. |
| Ralwax | BDH | 36154 7N | |
| Reducer Solution | * | * | To make 100 ml: 1 g Hydroquinone, 5 g sodium sulphite & 100 ml distilled water |
| RnaseA | Sigma | R6148 | |
| Saline | * | * | 0.9% NaCl in distilled water |
| SDS | Sigma | I3771 | |
| Sheep serum | Sigma | S3772 | |
| Silver nitrate | Sigma | S/1240/46 | |
| Silver solution | * | * | To make 100 ml: 10 ml Acetate buffer, 87 ml distilled water, 3 ml 1% silver nitrate |
| Sodium acetate | Fisher Scientific | S/2120/53 | |
| Sodium Chloride | Sigma | S6753 | NaCl |
| Sodium sulfite | Sigma | 239321 | |
| SSC | Sigma | 93017 | 20x saline sodium citrate |
| Surgical tape | Fisher Scientific | 12960495 | |
| Tamoxifen | Sigma | T5648 | TAM, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| TBS/T | Cell Signalling | #9997 | |
| Triethanolamine hydrochloride | Sigma | T1502 | |
| Tris-HCL | Invitrogen | 15567-027 | |
| Tween20 | Sigma | TP9416 | |
| VectaMount | Vector Labs | H-5000 | |
| VectaShield Hardset mounting Medium with DAPI | Vector Labs | H-1500 | |
| Vectastain ABC Kit | Vector Labs | PK-4001 | |
| X-gal | Promega | V3941 | |
| X-gal fixative | * | * | 2% formaldehyde, 0.1% glutaraldehyde in 1x PBS |
| X-gal stain | * | * | X-gal stain; 200 μl X-gal (A) in 50 ml solution B (0.214 g MgCl2, 0.48 g K-ferricyanide, 0.734 g K-ferrocyanide in 500 ml PBS). Solution B can be made up oin advance and stored at 4 °C |
| Xylene | Fisher Scientific | X/0200/21 |
Références
- Cheng, H., Origin Leblond, C. P. differentiation and renewal of the four main epithelial cell types in the mouse small intestine. V. Unitarian Theory of the origin of the four epithelial cell types. Am J Anat. 141 (4), 537-561 (1974).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Clevers, H. . The gut, a clonal conveyor belt. , (2015).
- Snippert, H., et al. Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells. Cell. 143 (1), 134-144 (2010).
- Lopez-Garcia, C., Klein, A. M., Simons, B. D., Winton, D. J. Intestinal stem cell replacement follows a pattern of neutral drift. Science. 330 (6005), 822-825 (2010).
- Buczacki, S. J., et al. Intestinal label-retaining cells are secretory precursors expressing Lgr5. Nature. 495 (7439), 65-69 (2013).
- Basak, O., et al. Mapping early fate determination in Lgr5+ crypt stem cells using a novel Ki67-RFP allele. EMBO J. 33 (18), 2057-2068 (2014).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Young, M., Ordonez, L., Clarke, A. R. What are the best routes to effectively model human colorectal cancer. Molecular oncology. 7 (2), 178-189 (2013).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proc Natl Acad Sci U.S.A. 85 (14), 5166-5170 (1988).
- Brault, V., et al. Inactivation of the beta-catenin gene by Wnt1-Cre-mediated deletion results in dramatic brain malformation and failure of craniofacial development. Development. 128 (8), 1253-1264 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/β-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Molecular and Cellular Biology. 27 (21), 7551-7559 (2007).
- Ireland, H., et al. Inducible Cre-mediated control of gene expression in the murine gastrointestinal tract: effect of loss of beta-catenin. Gastroenterology. 126 (5), 1236-1246 (2004).
- Kemp, R., et al. Elimination of background recombination: somatic induction of Cre by combined transcriptional regulation and hormone binding affinity. Nucleic Acids Res. 32 (11), e92 (2004).
- Madison, B. B., et al. Cis elements of the villin gene control expression in restricted domains of the vertical (crypt) and horizontal (duodenum, cecum) axes of the intestine. J Biol Chem. 277 (36), 33275-33283 (2002).
- Parry, L., Young, M., El Marjou, F., Clarke, A. R. Evidence for a crucial role of paneth cells in mediating the intestinal response to injury. Stem Cells. 31 (4), 776-785 (2013).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21 (1), 70-71 (1999).
- el Marjou, F., et al. Tissue-specific and inducible Cre-mediated recombination in the gut epithelium. Genesis. 39 (3), 186-193 (2004).
- Guillemot, F., Nagy, A., Auerbach, A., Rossant, J., Joyner, A. L. Essential role of Mash-2 in extraembryonic development. Nature. 371 (6495), 333-336 (1994).
- Gregorieff, A., et al. Expression pattern of Wnt signaling components in the adult intestine. Gastroenterology. 129 (2), 626-638 (2005).
- van der Flier, L. G., Haegebarth, A., Stange, D. E., van de Wetering, M., Clevers, H. OLFM4 is a robust marker for stem cells in human intestine and marks a subset of colorectal cancer cells. Gastroenterology. 137 (1), 15-17 (2009).
- Merritt, A., Allen, T., Potten, C., Hickman, J. Apoptosis in small intestinal epithelial from p53-null mice: evidence for a delayed, p53-independent G2/M-associated cell death after gamma-irradiation. Oncogene. 14 (23), 2759-2766 (1997).
- Marshman, E., Ottewell, P., Potten, C., Watson, A. Caspase activation during spontaneous and radiation-induced apoptosis in the murine intestine. J Pathol. 195 (3), 285-292 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/beta-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Mol Cell Biol. 27 (21), 7551-7559 (2007).
- Barker, N., et al. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature. 457 (7229), 608-611 (2009).
- Tian, H., et al. A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable. Nature. 478 (7368), 255-259 (2011).
- Yilmaz, O. H., et al. mTORC1 in the Paneth cell niche couples intestinal stem-cell function to calorie intake. Nature. 486 (7404), 490-495 (2012).
- Adolph, T. E., et al. Paneth cells as a site of origin for intestinal inflammation. Nature. 503 (7475), 272-276 (2013).
- Marsh, V., et al. Epithelial Pten is dispensable for intestinal homeostasis but suppresses adenoma development and progression after Apc mutation. Nat Genet. 40 (12), 1436-1444 (2008).
- Jardé, T., et al. In vivo and in vitro models for the therapeutic targeting of Wnt signaling using a Tet-OΔN89β-catenin system. Oncogene. 32 (7), 883-893 (2013).
- Hung, K. E., et al. Development of a mouse model for sporadic and metastatic colon tumors and its use in assessing drug treatment. Proc Natl Acad Sci U S A. 107 (4), 1565-1570 (2010).
- Dacquin, R., Starbuck, M., Schinke, T., Karsenty, G. Mouse alpha1(I)-collagen promoter is the best known promoter to drive efficient Cre recombinase expression in osteoblast. Dev Dyn. 224 (2), 245-251 (2002).
- Hinoi, T., et al. Mouse model of colonic adenoma-carcinoma progression based on somatic Apc inactivation. Cancer Res. 67 (20), 9721-9730 (2007).
- Sansom, O. J., et al. Loss of Apc allows phenotypic manifestation of the transforming properties of an endogenous K-ras oncogene in vivo. Proc Natl Acad Sci U.S.A. 103 (38), 14122-14127 (2006).
- Wong, V. W., et al. Lrig1 controls intestinal stem-cell homeostasis by negative regulation of ErbB signalling. Nat Cell Biol. 14 (4), 401-408 (2012).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- van de Wetering, M., et al. Prospective Derivation of a Living Organoid Biobank of Colorectal Cancer Patients. Cell. 161 (4), 933-945 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon