Method Article
조건을 사용하여 쥐 소장에서 재생성 Paneth 세포의 역할을 분석하기위한 프로토콜
요약
장 상피 줄기 세포 (ISCS)는 Paneth 셀과 혼합된다. 이러한 세포 ISCS을 지원 항균 보호를 제공 ISC의 자손을 차별화한다. 여기에서 우리는 우리가 Paneth 세포가 장 상피 세포를 유지하는데 중요한 역할을한다는 설정하는 형질 전환 조건부 마우스 모델을 사용하는 방법을 보여줍니다.
초록
칠일 - 포유류의 소장의 상피 표면은 매 3를 갱신 역동적 인 조직이다. 빠르게 Lgr5 유전자의 발현을 특징으로 장 줄기 세포 (ISCS)를 순환의 인구는이 갱신 프로세스를 발견 이해. 이러한 손상의 경우에 이들을 대체 할 수있는 BMI-1의 발현에 의해 표시 정지 줄기 세포 집단, 지원된다. 이러한 집단 사이의 상호 작용을 조사하는 질환과 암에 자신의 역할을 이해하는 데 매우 중요하다. ISCS는 장 표면에 지하실 내에 존재하는,이 틈새는 상피 세포를 보충에 ISC를 지원합니다. 것은 이미 Lgr5 ISC의 '가 stemness'밀접 그들의 이웃 Paneth 세포의 존재에 묶여 있다는 입증 된 바와 같이 활성 및 대기 ISCS 사이의 상호 작용 가능성, 틈새 내의 다른 분화 된 세포를 포함한다. 조건부 CRE-LOX 마우스를 사용하여모델 우리 Paneth 세포의 존재 또는 부재하에 활성 ISCS의 대부분을 삭제하는 효과를 시험 하였다. 여기에서 우리는 소장의 특성을하고 수행 기술과 분석은 Paneth 세포가 상당한 모욕 다음과 같은 복구를 돕기에 ISC 틈새 내에서 중요한 역할을한다는 것을 증명에 대해 설명합니다.
서문
포유 동물의 창자 내강 표면이 돌기처럼 지하실과 손가락의 반복 단위 기능, 루멘 내로 돌출 융모를 불린다. 4 일 (1) -이 표면은 대략 매 3 완전한 자기 갱신을 거쳐 상피의 연속 시트입니다. 이 역동적 인 조직을 빠른 속도로 줄기 세포 순환의 인구에 의해 지원됩니다 (ISCS을, 또한 토굴베이스 원주 세포라고도 함) 처음 Lgr5 유전자 2,3의 발현에 의해 확인되었다. 이러한 세포 Lieberkuhn의 지하실 하단에 특화된 틈새에 존재한다. 처음 ISCS 빠르게 순환 하였다 발견 줄기 세포가 본질적으로 정지했다 지배적 아이디어와 불일치이다. 이 대기 라벨의 인구가 지하실의 기본에 대해 네 위치에서 세포를 유지하는 것으로 가정 된 Lgr5 + ISC의 식별에 이전, ISCS 1이었다. 최근 연구 시간지금처럼 주로 운명 이웃 4,5에 의해 조절되는 각각의 토굴에 효능이 동등 자전거 ISCS의 풀 (pool)이 있음을 보여줌으로써 이러한 관찰을 조정. 이벤트에서 그들은 이러한 일반적으로 분비 혈통에 최선을 다하고 있습니다 만 ISC 인구 6 손상된 경우 ISCS으로 되돌릴 수 있습니다 정지 세포에 의해 대체 될 수 있습니다 손실됩니다.
ISC의 이웃 ISCS 또는 딸 세포가 될 수 있습니다. ISCS는 번성하는 선 장 루멘 (1) 상피 시트를 구성하는 특수 세포 유형으로 분화 순진한 딸 세포를 생성합니다. 잔, 장 내분비, 장 세포, 터프 트와 M 세포들이 다양한 흡 규제 기능을 제공 내강 표면을 위쪽으로 이동하지만, Paneth 세포들이 ISCS 섞여 존재 토굴의 바닥에 남아있다. 최근 몇 년 동안이 입증되었다 그 순진한 daught의 비율분비 혈통 향하는 어 세포는 손상 6,7에 ISC에 복귀 할 수있는 Lgr5 싸다 세포를 유지하는 대기 라벨입니다.
토굴에 의한 재생의 중요성에 순위가 ISCS과 이웃 특히 Paneth 세포 간의 상호 작용을 이해 넣었다. Paneth 세포 ISCS 8을 지원 틈새에 중요한 역할을한다. 살균 제품 이외에도 Paneth 세포는 ISC 갱신 또는 차별화를 지배하는 경로를 활성화 분자 신호를 생성한다. 이전의 연구들은 자신의 딸 Paneth 세포 (8)에 의해 제공되는 필수 틈새 신호를 경쟁 할 수있을 때 Lgr5 + ISCS는 존재할 수 있음을 보여 주었다. 이러한 연구는 정상 Lgr5 + ISCS과하지들이 손상 Lgr5 LO 인구에서의 보충을 필요로되는 상황에서 Paneth 세포의 역할을 조사 하였다.
우리는 형질 전환 마우스 모델 (9, 10)를 사용하여 세포 및 / 또는 유전자의 기능적 역할을 조사 장 생물학 및 모델 질병을 이해합니다. 자주 이러한 모델은 조건부 유전자 (들) 9,10을 수정 CRE-LOX 기술을 활용. Cre 호텔은 재조합 박테리오파지 (P1)에서 고립 된 인테그라 가족의 사이트 특이 적 재조합 효소이다 (재조합이되게합니다). Cre 호텔은 정의 (34) BP 사이에 위치 특이 적 재조합을 촉매로 ' 훈제 연어 P '사이트 (크로스 오버 (P1)의 궤적 χ). 마우스는 유전자 Cre 호텔 재조합 효소의 발현에 절제되어 관심 지역의 측면에 loxP 사이트를 포함하도록 설계되었습니다. 세포 발달 또는 특정 프로모터 Cre 호텔 유전자의 발현을 연결하면 변경이 공간적 패션 9,10 이루어져야하는 경우,이 배아 치사 돌연변이를 극복하는데 특히 유용 할 수 있습니다. 또한 수용체 경로에 Cre 호텔 식을 연결하는,즉 인위적으로 활성화 될 수있는, 시간 변경을 허용한다.이 기술을 이용하여, 우리는 장 상피에서 11 CatnB 유전자를 불 활성화. β 카테닌, CatnB 유전자 산물은 ISC 항상성에 적용되는 표준이 Wnt 신호 전달 경로의 조절 키이다. 이 전략을 사용하여 두 개의 이전 연구는 충돌하는 결과 12, 13을 생산했다. Fevr 등. (12)에 의한 연구는 줄기 세포와 장내 항상성의 손실을 보여 주었다. 아일랜드 외. 반면 14 연구 세포 생존율의 감소를 수행하는 것은 토굴-융모 축 CatnB 야생형 발현 세포에서의 증식을보고 하였다. 이 연구의 주요 차이점은 장내 상피 세포에 Cre 호텔을 표현하는 데 사용되는 발기인이었다. Fevr 등 알. 연구는 t를 투여함으로써 활성화 될 수있는 에스트로겐 수용체에 결합 villin 유전자 프로모터를 사용amoxifen (VIL-Cre 호텔 - 응급실 T2) (15, 16). 반면 아일랜드 등., 생체이 β-naphthoflavone (AH-CRE)에 대한 응답으로 Cre 호텔 식을 구동하기 위해 쥐 시토크롬 P450A1 (CYP1A1) 유전자의 프로모터 요소를 이용했다. 이러한 서로 다른 시스템의 특성은 서로 다른 관찰을 고려하여 두 가지 가설을 생성. CatnB보다 효율적하여 하위 레벨로 다시 채우기 ISCS의 수를 줄여, AH-CRE 비교 VIL-Cre 호텔 T2-ER의 시스템을 이용하여 ISC에서 삭제되는 제. 다른 방법으로는 분화 된 세포 인구에 CatnB 삭제 차동 예정이었다. VIL-Cre 호텔-ER T2 시스템 대상 AH-CRE 시스템 반면 crypt와 융모의 모든 상피 세포는 ISC 틈새과 토굴의 비 Paneth 세포를 대상으로합니다. 이러한 시스템은 검사 behav 이상적인 툴을 구비ISCS의 IOR과 Paneth 세포와의 상호 작용. 여기에서 우리는 우리가 Paneth 세포가 손상 17 장 반응을 중재에 중요한 역할을하는지 결정하기 위해이 시스템을 사용하는 방법에 따라 여러 가지 세부적인 프로토콜을 제시한다.
프로토콜
사용 된 모든 재료에 대한 정보는 표 1에 제시되어있다. 모든 동물 실험은 영국 홈 오피스 프로젝트 라이센스의 권한으로 수행되었다.
1. CatnB 삭제는 AH-CRE와 VIL-Cre 호텔-ER (T2) 시스템을 사용하여
- 아 - CRE + CatnB + / +, AH-CRE + CatnB flox / flox, VIL-Cre 호텔-ER T2 CatnB + / +와 VIL-Cre 호텔-ER T2 CatnB flox 14 주 이전 동료 - (10)를 생성하기 위해 마우스 균주를 건너 / flox. β-β-gal을 얼룩을 통해 재결합의 시각적 분석을 위해, 동료는 Rosa26R-의 lacZ 기자 (17)를 포함해야합니다. 유전자 변형 유도 제제의 사용 유무를 제어한다 동료는 필요 코호트의 크기는 전력 분석을 이용하여 추정되어야한다.
- β 준비 AH-CRE의 유전자를 유도하기 위해; 또는 10 ㎎ / ㎖의 작업 솔루션을 제공하기 위해 옥수수 기름에 (TAM) 타목시펜 VIL-Cre 호텔 - 응급실 T2 형질 전환 유전자에 대한 -Naphthoflavone (BNF). 참고 : 에이전트는 적절한 개인 보호구를 사용하여 흄 후드에서 무게해야합니다.
- 수조에 BNF 99.9 ° C 또는 TAM 80 ° C 중 하나에 주황색 병에 열 솔루션 (BNF 민감한 빛).
- BNF 100 ℃로 설정된 가열 교반기로 전송하거나 TAM 80 ° C, 10 분간 교반 하였다.
- 용해 될 때까지 BNF가 1.3-1.4를 반복은 (> 1 시간이 걸릴 수 있습니다.)
- 작은 호박색 병 (~ 5 ㎖)로 분취 한 다음 -20 ℃에서 동결. 병 3 동결 / 해동 사이클 후 폐기해야합니다. 앞서 해동 약품을 사용하고 솔루션에서 떨어진 경우, 적절한 온도로 재가열합니다. 주입하기 전에 <37 ° C로 냉각시킵니다.
- 25g의 마우스 approp 0.2ml를 수신, 예를 들어 80 ㎎ / ㎏의 용량으로 마우스에 복강 내 (IP)에 삽입riate 유도 에이전트. AH-CRE의 경우 4 일 동안 하루에 한 주사를 제공 VIL-Cre 호텔 - 응급실 (T2)에 대한 24 시간 동안 세 주사를 제공합니다.
리포터 시각화 및 면역에 대한 소장 2. 해부 (IHC)
- 윤리적 승인에 따라 이전에 마취없이 경추 탈구를 사용하여 마우스를 안락사. 부정사 위치에 마우스를 놓고 70 %의 EtOH를 사용하여 모피 젖은, 가위를 사용하여 중간 선을 따라 길이 방향으로 내 복강을 엽니 다.
- 집게로 위장을 안전하고 식도의 연결을 단절. 부드럽게 위장 당겨 부록에 소장을 제거합니다. 부드럽게 부록 당겨 항문에 대장을 제거합니다.
- 창자가 고립되고 나면 위장과 부록을 제거합니다. 무딘 종단 피펫 팁과 주사기를 사용하여 1X PBS로 세척 장. 참고 : 각 장 내가해야mmediately 아래에서 설명하는 다운 스트림 응용 프로그램 중 하나에 대한 처리.
소장 3. 포르말린 고정
- 중간 및 원위부 3 동일한 크기 섹션과 라벨 근위로 플러시 소장을 잘라. 1cm 조각으로 각 섹션을 잘라. 외과 테이프 2cm X 2cm의 작은 조각을 가져 가라. 피라미드 형성에 수술 테이프의 중간에 세 1 다섯 형상 조각을 놓습니다.
- 닫기과 "로그 파일"효과를주고, 길이 방향으로 조각 주위에 테이프를 밀봉. 적어도 10 배, 조직 부피 정착액의 체적을 중성 완충 포르말린 고정액을 과량 함유 평평한 바닥 조직을 용기에 놓는다. , 고정 용 튜브 내에서 조직을 초과하는 금액을 두지 마십시오 여러 개의 컨테이너로 분할 : 주.
- 이전에 포함하고 절편에 24 시간 - 적어도 18 4 ° C에서 개최 샘플. 핵 β-catenin이 손실을 방지하기 위해 24 시간 이상 해결되지 않습니다.적어도 10 배 조직 부피, 70 %의 EtOH를 함유하는 과량의 평평한 바닥 컨테이너 정착 후의 전사 조직.
소장 4. Methacarn 고정
- 300 ml의 메탄올, 150 ml의 클로로포름 75 ㎖의 빙초산 조합 methacarn 정착액을 준비하기 전에 해부 (4 : 2 : 1). 근위 중간 및 원위부 3 동일한 크기의 섹션으로 플러시 소장을 잘라.
- 종이 필터 (15cm의 X15의 CM) 및 springbow 가위 'en 얼굴'을 열어를 사용하여 조각에 나란히 소장 측의 각 부분을 놓습니다. 실온에서 24 시간 - 3 methacarn를 포함하는 유리 접시에 소장 및 필터 종이를 놓습니다. 고정 후 집게를 사용하여 소장 섹션의 끝을 선택합니다.
- "스위스 롤"을 형성하고 약간 집게를 열고 그것을 통해 25 G 바늘을 넣어 롤을 고정 집게 주위에 장을 바람. 라를 포함하는 평면 바닥 용기에 조직을 배치중성 완충 포르말린 고정액의 RGE 초과, 처리를 진행하기 전에 적어도 1 시간 동안 조직과 저장소의 볼륨에 정착 적어도 10 배 볼륨.
5. 전체 마운트 LacZ를 시각화 (엘 Marjou 등에서 수정. 18)
- 10에서 미네랄 오일 용융 ralwax을 결합하여 왁스 판을 준비 : 1. 15cm 페트리 접시에 붓고 냉각 둡니다. 표 1에 따라 X-여자 정착액을 준비하고 얼음에 저장합니다.
- 전체 대장을 제거하고 25 ml의 얼음처럼 차가운 X-여자 정착액로 세척하여 제 2 절 수정 소장에 따라, 얼음처럼 차가운 1X PBS로 통해 세척합니다.
- 5 동일한 섹션 (플레이트 당 5 최대) - 가위를 사용하면 3로 장을 잘라. 왁스 판에 각 섹션을 놓고 부분이 약간 장간막 라인 맨으로 늘어 각각의 끝을 아래로 핀; 초과 장간막 트림. springbow 가위를 사용하여 길이 방향으로 창자를 잘라 길을 따라 핀.(60);
- 섹션을 커버하고 4 ℃에서 최소 1 시간 동안 떠나 X-여자 정착액와 함께 접시 홍수. 25 ML의 피펫을 사용하여 X-여자 정착액을 제거하고 1X PBS의 30 ㎖로 한 번 씻는다. 이상적으로 락 플랫폼에서 실온에서 60 분, - 30 DTT의 demucifying 용액 30 mL를 커버 섹션.
- 25 ML의 피펫을 사용하여 demucifiying 솔루션을 제거하고 1X PBS의 30 mL로 판을 홍수. 파스퇴르 피펫 사용하여 점액을 제거하는 판에 1X PBS로 장 섹션을 씻는다.
- X-여자 얼룩의 30 mL를 25 mL를 피펫과 홍수로 1X PBS를 제거합니다. 락 플랫폼에서 교반과 함께 어둠 속에서 실온에서 하룻밤 품어.
- 배경색이 백색 인 경우 여전히 섹션, 청색 / 녹색 얼룩을 개발했는지 밤새 배양 검사 다음, 신선한 염색 액을 첨가하고, 염색이 발전까지 모니터 할 수있다. 참고 : 섹션이 다음 염색하면 더 염색을 시도 할 수 없습니다.
- X-여자의 얼룩 제거1X PBS의 30 ㎖로 25 ML의 피펫과 홍수 플레이트를 사용하여 부드러운 교반과 함께 3 분 동안 둡니다. 핀을 제거하고, 포셉, 소장 섹션의 마지막을 선택합니다. , "스위스 롤"을 형성 약간 집게를 열고 그것을 통해 25 G 바늘을 넣어 롤을 고정 집게 주위에 장을 바람.
- 적어도 10 배 조직 부피 정착액의 체적을 중성 완충 포르말린 고정액을 과량 함유 넓은 입이 큰 용기에 평평한 바닥 조직을 놓는다. 이전에 포함하고 절편에 최소 24 시간 동안 4 ° C에서 장소 샘플.
소장에서 납골당 6. 추출
- 섹션 2. 깨끗한 해부 표면에 장 당과 집게와 가위에 장착 된 모든 지방 / 장간막을 제거 사용하는 등, 소장의 첫 번째 20cm를 분리합니다. springbow 가위는 길이 방향으로 장을 열 사용.
- F를 커버 현미경 슬라이드를 사용하여irmly 융모와 점액을 제거하는 창자 루멘을 긁어. 가위를 사용하여 페니실린 (100 U / mL) 및 스트렙토 마이신 (100 U / ㎖)으로 보충 ~ 5mm 조각으로 절단 부위를 25 ㎖ 1X HBSS로 50 ㎖ 튜브에 옮긴다.
- 실온에서 10 분 동안 품어. 70 μm의 셀 스트레이너를 통해 샘플을 전달하여 항생제를 포함하는 용지를 제거합니다.
- 10 ㎖의 1X HBSS를 포함하는 새로운 50 ML 튜브에 장 섹션을 놓고 뚜껑을 교체합니다.
- 조심스럽게 두 번 반전 및 70 μm의 셀 스트레이너를 통과하여 1X HBSS를 제거합니다. 또한 6.4 및 6.5 세 번 반복하여 장 조각을 씻고 마지막 부분이 상대적으로 깨끗한 지 확인합니다.
- EDTA (8 mM)을 / 1X HBSS 10 ㎖를 함유하는 신선한 50 ㎖ 튜브에 옮기고 조직을 5 분 동안 실온에서 떠난다. 적극적으로 (20 - 30 배) 흔들거나 소용돌이, EDTA (8 밀리미터) / 1X HBSS를 포함하는 새로운 50 ML 튜브에 70 μm의 셀 스트레이너 및 전송 조직 조각을 통해 전달합니다. 노트:폐기 또는 융모 상피의 분석이 필요한 경우 유지 될 수있는 방식을 통해 흐름.
- 30 분 동안 얼음에 조직 조각을 품어 적극적으로 샘플 흔들 (20 - 30 배) 또는 소용돌이를. 70μm 셀 스트레이너를 통해 샘플을 전달하고이 지하실을 포함로 흐름을 통해 유지.
- 1X HBSS 10 ㎖를 함유하는 신선한 50 ㎖ 튜브에 조직 조각을 전송. 적극적으로 (20 - 30 배) 흔들거나 소용돌이를, 70 μm의 셀 스트레이너를 통과 통해 흐름을 유지합니다. 장 조각에서 지하실의 최대 복구를 보장하기 위해 한 번 더 반복한다. 5 분 동안 300 XG에 분획 원심 분리를 통한 유동을 결합한다. 상층 액을 붓고 지하실 펠렛을 유지합니다. 참고 : 펠렛 배양을 위해 즉시 사용 (해당하는 경우) 또는 이전에 표준 DNA / RNA / 단백질 추출 절차에 -80 ℃에서 저장 될 수있다.
7. 표준 면역 시각화
- 5 μ 컷폴리 -L- 라이신 (PLL)의 슬라이드 상 파라핀 조직 m 섹션. 참고 : B-카테닌 항체로 염색하는 표준 프로토콜은 아래와 같습니다, 다른 항체 매개 변수는 표 2에 제시되어있다.
- 신선한 자일 렌을 포함하는 슬라이드 화장실에 2 배 3 분 세척과 드 왁스. 신선한 포함 슬라이드 화장실을 통해 3 분 동안 슬라이드를 전달하여 재수 : 1X PBS로 100 %의 EtOH (2 배), 95 % EtOH로 70 % EtOH로 마지막을.
- 20 분 항원을 검색하는 구연산 완충액 (pH 6)과 열 99.9 ° C를 포함하는 슬라이드 욕조에 배치 슬라이드. 슬라이드를 냉각 한 후 5 분 동안 1xTBS / T를 포함하는 슬라이드 욕조에 3 배 5 분 세척 할 수 있습니다. 바로 PAP 펜으로 조직 주위에 그려, 마지막 세척에서 슬라이드를 제거하고 (증류수 H 2 O)에 상용 퍼 옥시 다제 블록 또는 1.5 % H 2 O 2 섹션 커버.
- 실온 (RT)에서 20 분 동안 배양 한 다음 5 분 동안 신선한 1X의 TBS / T를 포함하는 슬라이드 조에 3X 씻는다. 세척 후(NRS) 실온에서 30 분 기본 항체의 비특이적 소수성 결합을 차단하기 위해 / 1xTBS는 / T 5 % 정상 토끼 혈청에서, 피펫을 사용하여, 커버 섹션을 보내고.
- 5 % NRS 200 : 1로 희석 B-catenin이 차 항체의 파스퇴르 피펫 커버 섹션 NRS 블록을 제거합니다. 워시 / T 신선한 1xTBS를 포함하는 슬라이드 화장실에서 배 5 분 동안 슬라이드. 주 - 다른 항체를 희석 및 특이성에 대한 최적화가 필요합니다. 항체의 특이성을 보장하기 위해, 적절한 더 항체 및 이소 제어 얼룩이 수행 될 수 없습니다. 이소 제어는 호스트 종과 차 항체의 이소 타입에 매칭된다.
- 중 상용 HRP 검출 키트 또는 적절한 형광 표지 된 이차 항체 (표 2)와 시각화. 참고 : - 15 초 충분합니다 개발의 길이는 10 β-catenin이 경우, 각 항체 다릅니다. 항체 처음 EST에 대한 개발을 최적화하려면다음, 양성 대조군 슬라이드를 사용하여 양성 세포를 시각화하는데 필요한 시간의 길이는 모든 후속 슬라이드에 이것을 적용 ablish.
- 워시 신선한 TBS / T를 포함하는 슬라이드 화장실에서 배 5 분 동안 슬라이드. ~ 45 초 동안 슬라이드 목욕 포함 헤 마톡에 침지하여 슬라이드를 Counterstain과 (형광 이차 항체를 표지 사용하는 경우에는 필요하지 않음). 깨끗한 슬라이드 목욕에 슬라이드를 넣고 완전히 세척되지 않은 헤 마톡을 보장합니다 ~ 1 분 동안 수돗물을 실행 씻어.
- 알코올의 농도를 증가 함유 슬라이드 화장실 통과하여 슬라이드를 탈수; 1X 70 % EtOH 중 30 초, 95 % EtOH 중 1X 30 초, 100 % EtOH 중 2 × 30 초간 세척, 크실렌에 2 × 2 분.
- 마운트는 상용 설치 미디어를 사용하여 커버 슬립 아래 슬라이드. 참고 : 형광 표지 된 항체를 사용하는 경우 핵 레이블을 DAPI를 포함하는 미디어를 탑재합니다.
특정 Intestina 8. 조직 학적 확인L 상피 세포
- 장 세포
- 표 2에 설명 된 villin 항체 및 조건 섹션 7을 사용 섹션을 준비합니다.
- 엔테로 - 내분비 세포 (Grimelius는 18, 19 얼룩).
- 단계 7.1-7.2에 따라 섹션을 준비합니다. 세척은 3 분간의 초순수를 포함하는 슬라이드 욕에서 슬라이드. 예열은 용액 (표 1)을 함유하는 슬라이드 조에 슬라이드를 전송하고 3 시간 동안 60 ℃에서 배양한다.
- 3 분 동안 45 ℃에서 예열 된 감속기 갓 준비한 용액을 함유하는 욕 슬라이드 (표 2)에서의은 용액과 장소에서 슬라이드를 제거한다. 슬라이드를 제거하고 3 분 동안 신선한 초순수를 포함하는 슬라이드 욕에 배치했다. 팔로우 섹션 7에서 7.6-7.8 단계를 반복합니다.
- 잔 세포 (알 시안 블루 염색).
- 알 시안 (BL)을 포함하는 슬라이드 화장실에 .. 다음 단계 7.1-7.2로 전송 슬라이드를 섹션을 준비RT에서 5 분 동안 UE 산도 2.5. 5 분 - 3 실행 탭에서 피펫과 장소 슬라이드 욕조 알 시안 블루 얼룩을 제거합니다. 단계 7.6-7.8를 수행합니다. 참고 : 알 시안 블루 솔루션은 더 사용을 위해 유지 될 수있다.
- ISCS.
- ISCS 부 (9)에 따라 식별합니다.
- Paneth 세포.
- 표 2에서 설명하는 라이소자임 항체와 조건을 사용하여 7 항 다음 섹션을 준비합니다.
쥐의 소장 19-21으로 제자리 RNA를 검출 9.
- PLL 슬라이드에 포르말린 고정 소장 (섹션 3)에서 5 μm의 섹션을 놓습니다. Olfm4 식 (21)을 검출하기위한 선형화 된 디그 옥시 제닌 표지 된 RNA 프로브를 준비한다. 왁스 제거 및 부 7. 주 당 부분을 재수 :이 프로토콜은 RNA 프로브의 열화를 방지 할 RNAse가없는 환경에서 수행되어야한다.
- T 주위 그리기PAP 펜 문제는 시약을 최소화합니다. 30 분 동안 (증류수 H 2 O)에서 6 % H 2 O 2와 슬라이드 목욕 섹션을 품어. 3 분 동안 신선한 1X PBS로 슬라이드 욕조에 두 번 씻으십시오. 얼음 위에서 20 분 동안 4 % 파라 포름 알데하이드 피펫, 덮개 부를 이용하여, 1X PBS 버리고.
- 3 분 동안 신선한 1X PBS로 슬라이드 욕조에 두 번 씻으십시오. 3 분 동안 신선한 1X PBS로 슬라이드 욕조에서 5 분간 세척에 대한 테 K 솔루션 피펫 커버 섹션을 사용. 실온에서 5 분 동안 4 % 파라 포름 알데히드 취재하여 피펫 후 수정 섹션을 사용.
- DEPC와 슬라이드 화장실에서 씻어 2 분 동안 H 2 0을 처리 하였다. 교반하면서 10 분 동안 아세트산 무수물 용액에 피펫 커버 부 사용. 1X 식염수 / 3 분 뒤에 신선한 1X PBS / 3 분으로 슬라이드 화장실에서 씻으십시오. 알코올의 농도를 증가 포함 된 화장실을 통해 슬라이드를 통과; 1X 30 초 70 %에서 EtOH로, 1X 30 초 95 %에서 EtOH로, 신선한 100 %의 2 배 30 초 세척 EtOH로,배 2 신선한 크실렌 분, 공기 건조하도록 허용합니다.
- 혼성화 버퍼 (100)를 3 분 동안 80 ℃로 가온하여 프로브를 변성 : Olfm4 프로브 1 희석. 각 섹션에 프로브의 100 μl를 적용하고 슬라이드의 탈수를 방지하기 위해 파라 필름 커버. 65 ℃에서 어둡고 습한 챔버에서 하룻밤 품어.
- 15 분 동안 65 ℃에서 5 × SSC와 슬라이드 화장실에서 씻으십시오. 65 ℃에서 30 분 동안 / 신선한 50 % 포름 아미드로 두 번 슬라이드 욕조에 5 × SSC / 1 % SDS를 섹션을 씻으십시오. 10 분, 65 ℃에서 제 실온에서 두 번째 신선한 PBT에서 슬라이드 욕조에 두 번 절을 씻으십시오. PBT는 37 ℃에서 45 분 동안 25 μg의의 RNAse를 포함와 피펫 커버 섹션을 사용. 실온에서 5 분간 PBT에서 슬라이드 목욕 섹션을 씻으십시오.
- 65 ℃에서 30 분 동안 / 신선한 50 % 포름 아미드로 두 번 슬라이드 욕조에 5 × SSC를 섹션을 씻으십시오. 차단하려면, 어두운, MOI에서 PBT 및 저장 10 % 양의 혈청 피펫을 사용하여 커버 섹션3 시간 - 2 RT 세인트 실.
- 5 ㎎ / ㎖ 마우스 장 분말을 함유 PBT 10 %의 양 혈청 500 : 1 항 디곡 시게 닌 알칼리 포스파타제에 접합 된 항체를 희석하여 항체를 준비한다. 락 플랫폼에서 어둠 속에서 4 ° C에서 3 시간 동안 품어. 과량 장내 분말을 제거하고 상청액을 PBT에 1 %의 양의 3 배 양의 혈청을 추가 스핀 다운.
- 피펫 슬라이드에서 블록을 제거하고 각 섹션에 항체 용액 100 μl를 추가, 파라 필름으로 커버하고 4 ° C에서 하룻밤 어두운, 습기 챔버에 품어. 5 분 동안 신선한 PBT와 슬라이드 욕조에 3 ×를 섹션을 씻으십시오. 섹션 5 분 동안 신선한 NTMT 버퍼와 슬라이드 욕조에 3 × 씻어 차단합니다.
- 충분히 강한 색상이 개발 될 때까지 72 시간 - 피펫 BM 보라색 각 부분을 커버하고 24 실온에서 어둠 속에서 부화하여 시각화합니다. PBT 번 슬라이드 목욕 섹션을 세척하고 1 분 동안 에오신에 침지 Counterstain과. 레모5 분 - 3 흐르는 물 슬라이드 목욕 세척 섹션으로 초과 에오신을했습니다. 크실렌에 슬라이드를 담그고 공기 건조하도록 허용합니다. 상업 미디어를 사용하여 커버 슬립 아래에 마운트합니다.
장내 상피 10. 조직 학적 특성
- PLL 슬라이드에 고정 된 조직 (섹션 3 & 4)에서 5 μm의 섹션을 놓습니다. ≥25 임의 전체 (또는 ≥50 반) 다음 각 매개 변수에 대한 각 집단의 ≥4 마우스에서 지하실을 분석합니다. 참고 : 일관성 (만 기단부를 사용) 각 장의 동일한 위치에서 지하실을 분석 유지합니다.
- 표준 H & E 염색 부분에서 세포 매개 변수 (달리 명시되지 않는 한) : 크립트 수, 높이, 세포 사멸 및 유사 분열.
- 크립트 번호.
- 수동 기저층과 접촉 소낭의 수를 카운트하는 저전력 배율 (예를 들면 4 배 또는 10 배)를 사용한다. 카운트 ≥10 가로 근위 대장 분파를적어도 4 생쥐 이온.
- 크립트 높이입니다.
- 수동 토굴 / 융모 축 (도 3b)에 토굴의 바닥으로부터 세포의 수를 계산하기 위해 고전력 배율 (예를 들면 20 배 또는 40 배)를 사용한다.
- 아폽토시스 22, 23.
- 방법 1 : 수동으로 각 토굴에서 사멸 세포의 수를 계산하는 높은 전력 배율 (. 예를 들어 20 배 또는 40 배)를 사용합니다. 사멸 세포는 세포 수축, 염색질 응축, 세포 내 소포 및 세포 자멸 소체 (도 3a)의 형성에 의해 식별 될 수있다.
- 방법 2 : IHC 염색을 수행 대 (7) 카스파 제 -3 수동에 세포를 정량화하기 위해 각 토굴에서 양성 세포의 수를 계산 고전력 배율 (예 : 20 배 또는 40 배한다.)를 사용하여 표 2 기재된 조건 사용.을 세포 사멸의 실행 단계.
- 유사 분열.
- 수동으로 각각의 토굴에서 유사 분열 세포의 수를 계산하는 높은 전력 배율 (예를 들어 20 배 또는 40 배)를 사용합니다. 유사 분열 세포는 DNA 물질을 응축하고 일반적으로 대칭 및 웰 (도 3b)이 형성된다 포함.
- 분아 증식.
- 기 - 67 표 2에 기재된 조건을 사용한 IHC (7) 염색을 수행한다. 수동 토굴 증식 세포의 비율을 정량하는 양성 세포를 셀.
- 크립트 번호.
결과
AH-CRE에 ISC 재결합 효율을 비교하고 Vil의-Cre 호텔-ER T2 시스템
다음의 손상 부위, ISCS 내의 재결합 효율의 필요 특성을 다시 채우기에 Paneth 세포의 역할을 평가하기 위해 이러한 CRE-LOX 시스템의 용도. Rosa26R-lacZ의 조건부 기자를 사용하여 우리는 소장 (그림 1a)에서 100 %의 재결합이 ~이 두 시스템 3 일 유도 수 (dpi)를 게시하는 것을 보여 주었다. qPCR에 의해 재조합 된 대립 유전자의 존재를 정량하는 것은 시스템 사이 Cre 호텔 발현 패턴의 차이에 의해 혼동 하였다. VIL-Cre 호텔의 ER-T2 시스템 인해 epitheli의 큰 비율로 발현, AH-CRE 시스템에 비해 재결합 대립 유전자의 존재하에 3.53 배 증가 하였다(16). 이 문제를 극복하기 위해 우리는 우리가 직접 시스템을 비교 할 수는 다른 전략을 채택했다. 우리는 다른 유도 정권과 쥐를 유도하는 점 LacZ를 긍정적 인 지하실 및 융모가 ISC 재조합 이벤트를 나타내고, 30 dpi로 분석했다. 이 방법을 사용하여 우리가 보여 그 VIL-Cre 호텔 - 응급실 (T2)에 훨씬 더 큰 것으로 초기 재조합 수준에도 불구하고 ISCS의 동등한 수의 재결합 두 시스템 (24 시간에서 80 ㎎ / ㎏에서 IP 전달) 유도제의 3 주사에 시스템 16 (그림 1b-D). 또한, 재결합 움에서 추출한 DNA을 사용하여, 재조합 대립 유전자 qPCR에 잠재적으로 인해 AH-CRE 시스템을 이용하여 관찰되지 Paneth 세포에서 재조합에 VIL-CRE- ER T2 시스템을 사용하여 재조합의 비 상당한 증가를 보여 (그림 1D). 또한, 상피 세포 유형에 대한 염색 INDI하지 않았다케이트 분화 패턴에 어떤 변화가, 조사 각 세포 유형의 대표적인 이미지가도 2e-2H에 도시된다.
장내 상피의 특성은 CatnB 삭제를 다음
크립트 손실의 정량화
이러한 Cre 호텔 시스템의 재결합의 반응 속도를 특성화하는 ISCS의 동등한 숫자가 재결합 할 때 마우스 소장을 분석 할 수있었습니다. LacZ를 기자를 사용하여 두 시스템은 3 dpi의 (그림 2a)에서 재결합 (파란색) 세포의 완전한 손실을 보였다. 이전에 삼일 CatnB 삭제 후 보도 된 바와 같이 VIL-Cre 호텔 - 응급실 T2 마우스는 지하실 / 융모 축 13,16,24 (그림 2b-D)의 완전한 파괴를 보여 반면 AH-CRE 마우스는 부분 토굴 손실을 보였다.
상피 다시 채우기의 역학
여러 매개 변수를 기술을 우리가 특징 위의 사용이 관찰을 이해 할 수있게합니다. 파라미터 및 세포 유형의 대표적인 이미지를 사용하여 분석 프로토콜 7 - 10에 나타낸다을 (도 3a 및도 3b). 요약하면, 소낭의 손실은 두 시스템 (도 3E)에 표시 아폽토시스 수준 상승과 일치했다. 그러나 유사 분열, 증식, 토굴 세포 높이, crypt와 식 (도시하지 않음) 데이터는 AH-CRE 시스템이 취소 재결합 ISCS (그림 3C)에 의해 아마도 인해 다시 채우기에 복구 할 수 표시. 스탁 비교, VIL-Cre 호텔-ER (T2)는 상피 토굴 세포를 (그림 3D)를 유지에도 불구하고 복구하는 데 실패했습니다.
크립트 내에서 세포 표현형의 특성
아 - CRE 마우스의 지하실이 VIL-Cre 호텔-ER (T2)이 아닌 우리가 CatnB의 삭제 후 상피 세포에게 삼일을 특징으로 할 수있는 반면 다시 채울 수있는 이유를 이해합니다. 현장 하이브리드 (제 9 조) 및 IHC 분석 (7, 8 및 10)에 사용하여 우리는 VIL-Cre 호텔-ER T2 CatnB flox / flox 마우스의 토굴 세포가 비 증식했다 것을 증명하고 ISC 마커 Olfm4의 표현 부족 , AH-CRE 마우스의 지하실 (도 4c & F)와 달리. 초기 특성은 지하실에서 재조합 동등한 것을 증명 한 바와 같이 우리는 Paneth 세포의 역할을 조사하기 위해 진행. 우리는 β-catenin이를 잃은하는 세포 식별 CatnB과 Lyz1에 대해 이중 형광 IHC를 수행 그들은 Paneth 세포는 (그림 5a-5C)되었는지. 이전에 우리가 거라고 바와 같이모든 세포 토굴 VIL-Cre 호텔의 ER-T2 시스템을 사용하여 타겟 것을 emonstrated. 비교 AH-CRE 시스템 Paneth 세포 및 융모 상피를 스페어. 또한 Paneth 세포 만 VIL-Cre 호텔의 ER-T2 시스템 (도 5D 및 5E)를 사용 CatnB 삭제 이후 아폽토시스를 진행이 관찰되었다.
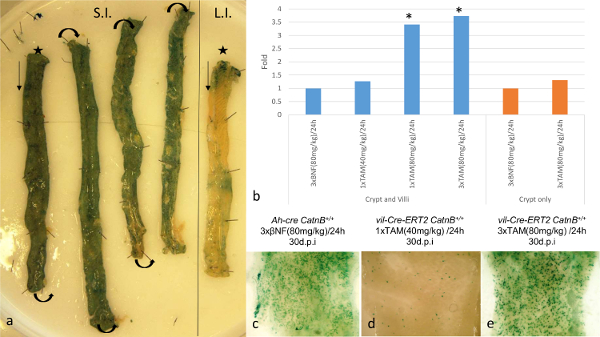
그림 1 : AH-CRE와 Vil의-Cre 호텔-ER (T2) 시스템을 사용하여 장 상피 내에서 특이 Cre 호텔 / 훈제 연어 재조합의 효율 비교 (A). wholemount 작은 (SI에서 AH-CRE LacZ를 리포터 표현의 시각화; * 말단부)과 대형 (LI, 야생형 마우스에서 * 선단). (B) : 1 dpi 해상도에서 재결합 CatnB flox 대립 유전자에 대한 qPCR에 게재 배 변화의 결과는 AH-CRE CatnB flox / flox (BNF 유도)에서 다른 유도 정권을 비교하고 VIL-Cre 호텔-ER T2 CatnB flox / flox (TAM 유도 ); * P> 0.05 (맨 - 휘트니 [2 꼬리] 컨트롤에 비해). (C) - (E) :.. Wholemount 소장 보여주는 LacZ를 긍정적 인 토굴 30 dpi의 패널 (B) - (E) 패리 등 (16)에서 수정 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
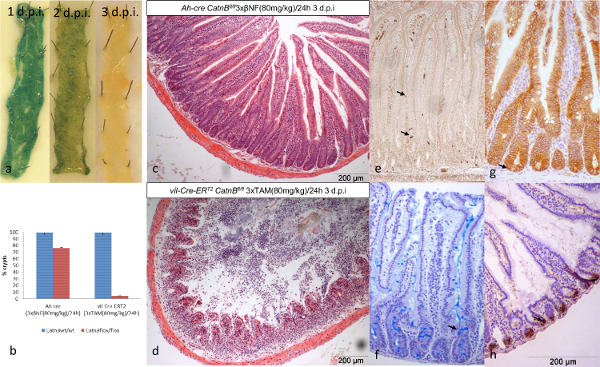
그림 2 : AH-CRE와 Vil의-Cre 호텔-ER (T2)의 비교 소장 상피에서 조건부 삭제 CatnB ()에 대한 시스템 :. 삼일 동안 AH-CRE CatnB flox / flox LacZ를 + 마우스의 재조합 세포의 Wholemount 소장 보여주는 손실. (B) : 3 일 CatnB의 삭제 후 토굴 손실의 정량화; * P> 0.05 (맨 - 휘트니 [2 꼬리] 컨트롤에 비해). (C & D) : CatnB 삭제 후 지하실의 손실을 보여 포르말린 고정 소장의 가로 H & E 섹션. (E) - (H) 대조군 마우스로부터의 세포 유형의 예 : (E) 엔테로-endocriine 세포, (f)는 술잔 세포, 핵 B 카테닌 및 (H)와 ISC (→)를 나타내는 (g) CatnB IHC Paneth 세포. 패널 (b)는 패리 등. (16)에서 수정했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
gether.within 페이지 "항상"=> 
그림 3 : 표현형의 발병의 특성 소장 상피 내 ISCS 비슷한 숫자의 조건부 삭제 CatnB의 AH-CRE와 Vil의-Cre 호텔-ER T2 시스템 (A & B) H & E 염색 포르말린 고정 섹션 납골당의 위치를 나타내는를 사용하는 경우. 높이 ([), 세포 사멸 (←)과 유사 분열 세포 (↓). 세 시점 수 (dpi) (c) 토굴 높이 (d) 유사 분열 및 (e) 세포 자멸사의 야생형 (파란색)와 CatnB flox (오렌지) 생쥐 사이 토굴 당 세포의 평균 수 정량 (오차 막대는 표준 편차를 나타낸다 ). 패널 (C) - 패리 등 (16)로부터 개질 (E).3429fig3large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 :. 아-CRE 3 일 CatnB AH-CRE를 사용 (AC) 또는 삭제 후 소장 상피 상피 토굴 세포에서 조건부 삭제 CatnB에 대한 Vil의-Cre 호텔-ER (T2) 시스템을 사용하여 ISC 특성의 비교 vil- CRE-ER T2 (DF) 시스템. (A & D) 토굴 손실의 영역을 표시 H & E 섹션; (B & D) VIL-Cre 호텔 - 응급실 (T2)를 사용하여 증식 세포의 기-67 IHC을 보여주는 손실; (C & F) Olfm4은 현장에서 AH-CRE를 사용하여 기능 ISCS의 존재를 증명. 패널 () -. (F) 패리 등 (16)에서 수정 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
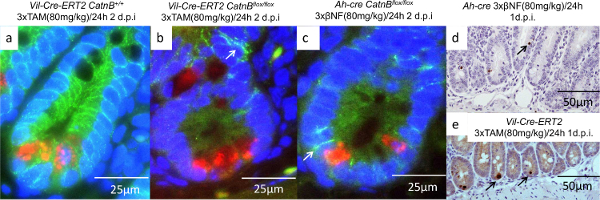
그림 5 : CatnB 삭제가 Vil의-Cre 호텔 - 응급실 (T2)와 AH-CRE 시스템을 사용 후 Paneth 세포의 특성 (AC) :. Paneth 세포 (적색), B-카테닌 (녹색)과 핵을 보여주는 지하실의 면역 형광 이미지 (블루 ), 막 결합 된 β-catenin이를 나타내는 화살표; 세포 사멸 Paneth 세포를 나타내는 카스파 제 3의 (비) IHC는 VIL-Cre 호텔 - 응급실 T2 시스템 (E)의 AH-CRE (d)에 존재하지만 존재한다. 패널 (A) - (E)에서 개질패리 등 16. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 아세테이트 버퍼 | * | * | 100 ㎖하려면 : 4.8 ml의 0.2 M 아세트산을, 45.2 ml의 0.2 M 나트륨 아세테이트 50 ㎖의 증류수 |
| 아세트산 | 피셔 과학 | C / 0400 / PB17 | |
| 무수 초산 | 시그마 | A6404 | |
| 아세트산 무수물 용액 | * | * | 트리에탄올 아민 0.1 M 염산의 2 M 아세트산 무수물 |
| 알 시안 블루 | 시그마 | A5268 | |
| 알 시안 블루 PH 2.5 | * | * | 500 ml를 만들려면 : 15 ml의 아세트산, 5g 알 시안 블루 & 485 ml의 증류수 |
| 안티 제닌 알칼리 포스 파타 아제 결합 항체 | Abcam | ab119345 | |
| B (베타) -Naphthoflavone | 시그마 | N3633 | BNF는, 화합물은 용액으로부터 떨어질로 용액이 너무 많이 방냉없이 주입. 용액은 다시 사용될 수있다 - 스토어를 사용 사이 -20 ℃에서 두번 이상 재가열하지 않는다. |
| Bloxall | 벡터 연구소 | SP-6000 | |
| 보라색 BM | 로슈 | 11442074001 | |
| BSA | 시그마 | A4503 | 소 혈청 알부민 |
| 클로로포름 | 피셔 과학 | C / 17분의 4,920 | |
| 구연산 버퍼 / 항원에 마스크 솔루션 | 벡터 연구소 | H-3300 | |
| 옥수수 기름 | 시그마 | C8627 | |
| Demucifiying 솔루션 | * | * | 50 ㎖ 글리세롤, 50 ㎖ 트리스 0.1M pH8.8, 100 ㎖의 EtOH (물에 0.9 %의 NaCl) 300 ml의 생리 식염수, DTT 1.7 g을 500 ml의하십시오. Demucifying 용액을 사전에 저장하고 있지만, DTT는 배양 (340 밀리그램 / 100 ㎖)을 첨가하기 전에 sholud 될 수있다. |
| DEPC 물을 치료 | Life 기술 | 750023 | |
| DTT | 시그마 | 101509944 | |
| EDTA | 시그마 | O3690 | 0.5 M |
| 에탄올 | 피셔 과학 | E / 0650DF / 17 | |
| 필터 종이 | 워트 먼지 | 3000917 | |
| 포름 알데히드 | 시그마 | F8775 | |
| 포르말린 | 시그마 | SLBL11382V | 중성 완충 포르말린 |
| 포름 아미드 | 시그마 | F5786 | |
| Glutaraldehye | 시그마 | G6257 | |
| H 2 O 2 | 시그마 | 216763 | |
| 헤 마톡 | 레이몬드 어린 양 | 12698616 | |
| HBSS | 기브 | 14175-053 | HBSS (-MgCl2 +; -CaCl2) |
| 하이브리드 버퍼 | * | * | 5 × SSC, 50 % 포름 아미드, 5 % SDS, 1 ㎎ / ㎖의 헤파린, 1 ㎎ / ㎖ 소 간암의 tRNA |
| 하이드로 퀴논 | 시그마 | H9003 | |
| ImmPACT DAB 퍼 옥시 다제 | 벡터 연구소 | SK-4105 | |
| Immpress HRP 안티 - 마우스 IgG 키트 | 벡터 연구소 | MP-7402 | |
| Immpress HRP 안티 - 토끼 IgG의 키트 | 벡터 연구소 | MP-7401 | |
| 장내 조직 분말 | * | * | 5 성인 마우스의 소장을 합하고 빙냉 PBS의 최소 부피 균질화시켰다. 차가운 얼음 아세톤 4 권 철저히 혼합하고 30 분간 빙상에서 인큐베이션 하였다 균질화 대장에 첨가 하였다. 이것을 원심 분리하고 펠릿을 얼음 냉 아세톤을 이용하여 세척 하였다. 이것은 더 원심 분리하고 생성 된 펠릿을 여과지 위에 퍼져 건조시킨다. 일단 철저하게 물질이 봉과 박격포를 사용하여 미세 분말로 분쇄 건조. |
| K-페리시 아나이드 | 시그마 | P-3667 | |
| K-페로 | 시그마 | P3289 | |
| 레바 미솔 | 시그마 | L0380000 | |
| Methacarn | * | * | 60 % 메탄올 : 30 % 클로로포름 : 10 % 아세트산 |
| 메탄올 | 피셔 과학 | M / 17분의 4,000 | |
| 의 MgCl2 | 시그마 | M8266 | |
| 정상 염소 혈청 | 벡터 연구소 | S-1012 | NGS |
| 정상 토끼 혈청 | 다코 | X0902 | NRS |
| NTMT | * | * | 100 mM의 NaCl을, 100 mM 트리스 염산, 50 mM의 MgCl2를, 0.1 % 트윈 20, 2 mM의 레바 미솔 |
| PAP 펜 | 벡터 | H-400 | |
| 파라 포름 알데히드 | 시그마 | P6148 | |
| PBT | * | * | 0.5 M의 NaCl, 10 mM의 TrisHCL의 pH 7.5, 0.1 % 트윈 20 |
| 페니실린 / 스트렙토 마이신 | 기브 | 15140-122 | 100 배의 solutiuon. |
| 인산염 완충 식염수 (10 배) | 피셔 과학 | BP3994 | 1X을 증류수로 1:10 Dilluted |
| PLL 슬라이드 | 시그마 | P0425-72EA | 폴리 -L- 라이신 현미경 슬라이드 |
| 테 K | 시그마 | P2308 | |
| 테의 K 솔루션 | * | * | 50 mM 트리스, 5 mM의 EDTA 200 μg의 / ㎖에서 테 K 희석. |
| Ralwax | BDH | 36154 7N | |
| 감속기 솔루션 | * | * | 1g 하이드로 퀴논, 5g의 황산나트륨 및 100 ml의 증류수 100 mL로 |
| RnaseA | 시그마 | R6148 | |
| 식염 | * | * | 증류수에 0.9 % 염화나트륨 |
| SDS | 시그마 | I3771 | |
| 양 혈청 | 시그마 | S3772 | |
| 실버 질산 | 시그마 | S / 46분의 1,240 | |
| 실버 솔루션 | * | * | 10 ml의 아세테이트 버퍼, 87 ml의 증류수, 3 ml의 1 % 질산은 : 100 mL로 |
| 아세트산 나트륨 | 피셔 과학 | S / 53분의 2,120 | |
| 염화나트륨 | 시그마 | S6753 | 염화나트륨 |
| 황산나트륨 | 시그마 | 239321 | |
| SSC | 시그마 | 93017 | 20 배의 생리 식염수 시트르산 나트륨 |
| 외과 테이프 | 피셔 과학 | 12960495 | |
| 타목시펜 | 시그마 | T5648 | TAM은 화합물 용액으로부터 떨어질로 용액이 너무 많이 방냉없이 주입. 용액은 다시 사용될 수있다 - 스토어를 사용 사이 -20 ℃에서 두번 이상 재가열하지 않는다. |
| TBS / T | 세포 신호 | # 9997 | |
| 트리에탄올 아민 염산염 | 시그마 | T1502 | |
| 트리스 HCL | 인비 트로겐 | 15567-027 | |
| 트윈 20 | 시그마 | TP9416 | |
| VectaMount | 벡터 연구소 | H-5000 | |
| VectaShield Hardset DAPI와 매체를 장착 | 벡터 연구소 | H-1500 | |
| ABC 키트 Vectastain | VECT또는 연구소 | PK-4001 | |
| X-여자 | 프로 메가 | V3941 | |
| X-여자 정착액 | * | * | 2 % 포름 알데히드, 1 x PBS를 0.1 % 글루 타르 알데히드 |
| X-여자 얼룩 | * | * | X-여자의 얼룩; 50 ㎖ 용액 B (0.214 g의 MgCl2, 0.48 g을 K-페리 시안화, 500 ml의 PBS에서 0.734 g을 K-페로) 200 μL의 X-GAL (A). 솔루션 B는 4 ° C에서 미리 OIN 만들어 저장 될 수 있습니다 |
| 크실렌 | 피셔 과학 | X / 0200 / 21 |
표 1 : 재료 및 방법
RT에서 D> 1/200, 30 분간| 목표 | 베타 - 카테닌 | 리소자임 | 사료된다 | 카스파 제 -3 | Villin |
| 차 Ab의 상용 소스 | 형질 도입 연구소 | Neomarkers | 벡터 연구소 | R & D 시스템 | 산타 크루즈 |
| 카탈로그 번호 | 610154 | RB-372 | VP-K452 | AF835 | SC-7672 |
| 차 AB를 제기 | 마우스 (단클론 항체) | 토끼 (PAB) | 마우스 (단클론 항체) | 토끼 (PAB) | 염소 (PAB) |
| 항원 검색 | 끓는 물에 목욕 / 구연산 버퍼 | 끓는 물에 목욕 / 구연산 버퍼 | 끓는 물에 목욕 / 구연산 버퍼 | 끓는 물에 목욕 / 구연산 버퍼 | 끓는 물에 목욕 / 구연산 버퍼 |
| 퍼 옥시 다제 블록 | Bloxall 2 % H 2 O 2, 45 초 | Bloxall 또는 1.5 % H 2 O 2, 30 분간 | Bloxall 0.5 % H 2 O 2, 20 분 | Bloxall 2 %H 2 O 2, 45 초 | Bloxall 또는 3 % H 2 O 2, 20 분 |
| 혈청 블록 | 1 % BSA, 30 분간 | 10 % NGS, 30 분 | NRS 20 %, 20 분 | 10 % NGS, 45 분 | NRS 10 %, 30 분 |
| 워시 버퍼 | PBS | TBS / T | TBS / T | PBS | TBS / T |
| 차 Ab의 조건 | 1/300, RT에서 2 시간 | 1/100, 1 시간 실온에서 | 1/50, 1 시간 실온에서 | 750분의 1, O / N 4 ° C에서 | 1/500, 1 시간 실온에서 |
| 차 Ab의 | Immpress HRP 안티 - 마우스 IgG 키트 | Immpress HRP 안티 - 토끼 IgG의 키트 | 비오틴 화 래빗 항 - 마우스 | 바이오틴 염소 항 - 토끼 | 바이오틴 화 토끼 항 - 염소 |
| 차 Ab의 조건 | RT에서 1 시간 | 실온에서 30 분 | RT에서 1/200, 30 분간 | RT에서 1/200, 30 분간 | |
| 신호 증폭 | N / A | N / A | ABC 키트 | ABC 키트 | ABC 키트 |
| 신호 검출 | ImmPACT DAB 퍼 옥시 다제 | ImmPACT DAB 퍼 옥시 다제 | ImmPACT DAB 퍼 옥시 다제 | ImmPACT DAB 퍼 옥시 다제 | ImmPACT DAB 퍼 옥시 다제 |
| 면역 형광 항체 | Alexafluor 488 | Alexafluor 594 | N / A | N / A | N / A |
| 면역 형광 등록 | 여기 최대 488 / 배출 최대 525 | 여기 최대 595 / 배출 최대 617 | |||
| 일반 필터 설정 | FITC | 텍사스 레드 |
토론
유전자와 세포의 기능을 해부 조건부 CRE-LOX 트랜스 제닉 마우스를 사용하는 것은 일반적으로 사용되는 접근 방법이다. 이 모델의 특성을 식별하고 줄기 세포를 2,4-6 질병 25에서의 역할을 이해하기 위해 소장에서 큰 성공으로 사용되어왔다. 이러한 모델을 충분히 활용하기 위해서는 올바르게 해석 할 데이터를 사용하는 시스템의 종합적인 특성을 요구한다. 이러한 시스템의 완전한 이해 인해 유전자 거의 독방 세포 유형 또는 위치, 생물학적 기술 및 Cre 호텔 발현을 유도하기 위해 사용되는 시스템의 비 효율성의 부족 특이성 없음으로 달성하기 어렵다. 여기에 설명 된 방법은 우리가 실험 설계 및 기존 지식의 응용 프로그램을 통해 이러한 문제를 극복하는 방법을 보여줍니다. 우리는 여기에 제시된 일반적인하고 Muri의 조사를 어떤 연구에 이용 될 수있는 기술 특정 연구 질문에 대답하기 위해 이러한 방법을 사용하지만NE 소장.
창자 조직의 준비
견고한 결과를 보장하기위한 중요한 단계는 엄격하게 부착 및 고정 적시 프로토콜에서 처리 될 필요가 조직의 수확 처리이다. 거의 모든 중요한 문제는 하류 티슈 건조 아웃 및 / 또는 불완전한 정착과 관련된 인공물에 기인 할 수있다. 타이밍은 조직 구조 및 / 또는 핵산 및 단백질의 분해를 방지하기 위해 매우 중요하다. 불완전하거나 지나치게 열성적인 고정은 조직 화학적 해상도의 손실이 발생할 수 있습니다. 시간이 부족하거나 정착 침투 IHC 분석에 따라 "조류 마크"로 관찰 할 수있는 장 지하실 내에서 해상도의 손실이 발생할 수 있도록 너무 두꺼운 부분으로 인해 불완전한 고정. 또한 그것은 핵 β-catenin이 바로 프로 않는 한 핵 밖으로 확산 될 수로 고정이 너무 오래 연장하지 않는 것이 중요합니다가공품의 수출입을 담 당하고과 포르말린 고정 다음 포함 된 왁스.
ISC 틈새에서 Paneth 세포의 역할
여기에 제시된 데이터는 효과적으로 감소 ISC 다음 성인 부위에 토굴 재생성 Paneth 세포의 중요성을 보여준다. 그러나이 아 - CRE가 VIL-Cre 호텔 - 응급실 T2 대상 ISCS의 인구 여분 가능성을 유지했다. 티안 등. (26)은 우아 Lgr5 안녕하세요 ISCS는 Lgr5 싸다 예약 ISCS의 인구에 의해 대체되는 것을 보여 주었다. 지금이 ISCS 인해 예비 인구가 분비 세포 전구체 6,7로 확인 된에 AH-CRE 시스템에서 절약되는 것으로 보인다. ISC 상태로 복귀하는 데 필요한 때이 분비 세포 전구체를 지원하는 성숙한 Paneth 세포의 중요성은 대답 일이다. Paneth 세포를 구성하는 I로서SC 틈새 8 그들의 간호 기능을 자신의 전구체로 확장 할 가능성이 남아 칼로리 섭취량 (27)과 염증 28 ISC 반응을 조절하는 역할을한다.
새로운 접근 방식 및 기술을 효과적으로 모델 인간의 대장 암에
ISC의 발견은 지금 클라크 등의 검토에 의해 알 9 장 질환 및 생물학, 유전자 및 세포의 역할을 조사하는 새로운 마우스 모델을 생성하는 데 사용되는 유전자의 동정되었다. 이 기술에 대한 유일한 제한은 Cre 호텔 단백질을 발현하는 유전자를 확인한다. 현재 ISCS는 정기적으로 Lgr5 유전자 발현 패턴을 기반으로 조건부 형질 전환 마우스를 사용하여 조사하고 있습니다. Lgr5 프로모터로부터 발현 생쥐를 Cre 호텔은 APC, 가장 일반적으로 대장 암에서 돌연변이 된 유전자 (CRC를 제거하는데 사용되어왔다), 원점 (25)의 셀로서 ISC 시연. 선택적으로 삭제 이들 세포에서 다른 CRC 유전자는 질병의 진행에 대한 통찰력을 제공하고 확산된다 예. PTEN (29). ISC 기능에 추가 통찰력은 특히 절제 Lgr5 인간 디프테리아 독소 수용체를 사용하여 마우스의 세포를 발현에 의해 검색되고 (DTR) 유전자 Lgr5에 궤적 (26) 혔어요. 다른 전략이 돌연변이 단백질 (30)의 지속적인 가역 식을 수있는 구정-O 시스템을 사용합니다. 다른 셀 (31) 및 위치 (32, 33)의 유전자 (들)을 수정할 이러한 도구를 사용하는 것은 암이 시작하는 방법을 이해, 진보와 34 전이하는 데 사용됩니다. 또한 잠자는 아름다움 트랜스포존 시스템을 사용하여 돌연변이는 CRC의 새 드라이버를 식별한다. 마우스, 기술과 유전자 변형 전략의 지속적인 발전은 더 많은 환자 관련 모델 개발을 계속하고있다.
새로운 Methods는 장 상피와 ISCS의 특성을 위해 개발되었다. 유량을 이용하여 달성 될 수 상피 세포 유형의 비 특성화 계측법 렉틴과 CD24 (35)의 발현 차이에 기초. 잠재적으로 가장 큰 이해 ISC 생물학의 발전과 질병에서의 역할은 생체 organoid 문화 시스템 (36)을 사용하여 만들 수 있습니다. 이 시스템은 복제하고보다 생리 학적으로 중요한 방법으로 차별화 3D, 문화에 정상 및 악성 ISCS 수 있습니다. 이들 맞춤 의학 (37)에 대한 방법을 포장, 체외에서 환자 샘플에 약물을 직접 테스트를 가능하게 될 것으로 기대된다.
공개
The authors have nothing to disclose.
감사의 말
The authors would like to thank Mark Bishop, Mathew Zverev, Victoria Marsh-Durban, Adam Blackwood and Sylvie Robine. This work was funded by a programme grant from Cancer Research UK.
자료
| Name | Company | Catalog Number | Comments |
| Acetate buffer | * | * | To make 100 ml: 4.8 ml 0.2 M Acetic acid, 45.2 ml 0.2 M Sodium acetate & 50 ml distilled water |
| Acetic acid | Fisher Scientific | C/0400/PB17 | |
| Acetic anhydride | Sigma | A6404 | |
| Acetic anhydride solution | * | * | 2 M Acetic anhydride in 0.1 M triethanolamine hydrochloride |
| Alcian Blue | Sigma | A5268 | |
| Alcian Blue pH 2.5 | * | * | To make 500 ml: 15 ml acetic acid, 5 g Alcian Blue & 485 ml distilled water |
| anti-digoxigenin alkaline phosphatase conjugated antibody | Abcam | ab119345 | |
| B(beta)-Naphthoflavone | Sigma | N3633 | BNF, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| Bloxall | Vector Labs | SP-6000 | |
| BM purple | Roche | 11442074001 | |
| BSA | Sigma | A4503 | Bovine serum albumin |
| Chloroform | Fisher Scientific | C/4920/17 | |
| Citrate Buffer/Antigen Unmasking Solution | Vector Labs | H-3300 | |
| Corn oil | Sigma | C8627 | |
| Demucifiying solution | * | * | For 500 ml: 50 ml glycerol, 50 ml Tris 0.1M pH8.8, 100 ml EtOH, 300 ml saline (0.9% NaCl in water), DTT 1.7 g. Demucifying solution can be made in advance and stored, but DTT sholud be added just before incubation (340 mg/100 ml). |
| DEPC treated water | Life Technologies | 750023 | |
| DTT | Sigma | 101509944 | |
| EDTA | Sigma | O3690 | 0.5M |
| Ethanol | Fisher Scientific | E/0650DF/17 | |
| Filter paper | Whatman | 3000917 | |
| Formaldehyde | Sigma | F8775 | |
| Formalin | Sigma | SLBL11382V | Neutral buffered formalin |
| Formamide | Sigma | F5786 | |
| Glutaraldehye | Sigma | G6257 | |
| H2O2 | Sigma | 216763 | |
| Haematoxylin | Raymond A Lamb | 12698616 | |
| HBSS | Gibco | 14175-053 | HBSS (-MgCl2+; -CaCl2) |
| Hybridisation buffer | * | * | 5× SSC, 50% formamide, 5% SDS, 1 mg/ml heparin, 1 mg/ml calf liver tRNA |
| Hydroquinone | Sigma | H9003 | |
| ImmPACT DAB Peroxidase | Vector Labs | SK-4105 | |
| Immpress HRP Anti-Mouse IgG Kit | Vector Labs | MP-7402 | |
| Immpress HRP Anti-Rabbit IgG Kit | Vector Labs | MP-7401 | |
| Intestinal tissue powder | * | * | The small intestines of 5 adult mice were combined and homogenised in the minimum volume of ice cold PBS. 4 volumes of ice cold acetone were added to the homogenised intestine, which was mixed thoroughly and incubated on ice for 30 min. This was centrifuged and the pellet was washed using ice cold acetone. This was further centrifuged and the resulting pellet spread onto filter paper and allowed to dry. Once thoroughly dry the material was ground to a fine powder using a pestle and mortar. |
| K-ferricyanide | Sigma | P-3667 | |
| K-ferrocyanide | Sigma | P3289 | |
| Levamisole | Sigma | L0380000 | |
| Methacarn | * | * | 60% Methanol:30% Chloroform:10% Acetic acid |
| Methanol | Fisher Scientific | M/4000/17 | |
| MgCl2 | Sigma | M8266 | |
| Normal goat serum | Vector Labs | S-1012 | NGS |
| Normal rabbit serum | Dako | X0902 | NRS |
| NTMT | * | * | 100 mM NaCl, 100 mM Tris HCl, 50 mM MgCl2, 0.1% Tween20, 2 mM Levamisole |
| PAP pen | Vector | H-400 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBT | * | * | 0.5 M NaCl, 10 mM TrisHCL pH7.5, 0.1% Tween 20 |
| Penicillin/Streptomycin | Gibco | 15140-122 | 100x solutiuon. |
| Phosphate buffered saline (10x) | Fisher Scientific | BP3994 | Dilluted 1:10 with distilled water to make 1x |
| PLL slides | Sigma | P0425-72EA | Poly-L-lysine microscope slides |
| Proteinase K | Sigma | P2308 | |
| Proteinase k solution | * | * | Dilute Proteinase K at 200 µg/ml in 50 mM Tris, 5 mM EDTA. |
| Ralwax | BDH | 36154 7N | |
| Reducer Solution | * | * | To make 100 ml: 1 g Hydroquinone, 5 g sodium sulphite & 100 ml distilled water |
| RnaseA | Sigma | R6148 | |
| Saline | * | * | 0.9% NaCl in distilled water |
| SDS | Sigma | I3771 | |
| Sheep serum | Sigma | S3772 | |
| Silver nitrate | Sigma | S/1240/46 | |
| Silver solution | * | * | To make 100 ml: 10 ml Acetate buffer, 87 ml distilled water, 3 ml 1% silver nitrate |
| Sodium acetate | Fisher Scientific | S/2120/53 | |
| Sodium Chloride | Sigma | S6753 | NaCl |
| Sodium sulfite | Sigma | 239321 | |
| SSC | Sigma | 93017 | 20x saline sodium citrate |
| Surgical tape | Fisher Scientific | 12960495 | |
| Tamoxifen | Sigma | T5648 | TAM, inject without allowing the solution to cool too much as compound will drop out of solution. Solution can be re-used – store at -20 °C between uses, do not reheat more than twice. |
| TBS/T | Cell Signalling | #9997 | |
| Triethanolamine hydrochloride | Sigma | T1502 | |
| Tris-HCL | Invitrogen | 15567-027 | |
| Tween20 | Sigma | TP9416 | |
| VectaMount | Vector Labs | H-5000 | |
| VectaShield Hardset mounting Medium with DAPI | Vector Labs | H-1500 | |
| Vectastain ABC Kit | Vector Labs | PK-4001 | |
| X-gal | Promega | V3941 | |
| X-gal fixative | * | * | 2% formaldehyde, 0.1% glutaraldehyde in 1x PBS |
| X-gal stain | * | * | X-gal stain; 200 μl X-gal (A) in 50 ml solution B (0.214 g MgCl2, 0.48 g K-ferricyanide, 0.734 g K-ferrocyanide in 500 ml PBS). Solution B can be made up oin advance and stored at 4 °C |
| Xylene | Fisher Scientific | X/0200/21 |
참고문헌
- Cheng, H., Origin Leblond, C. P. differentiation and renewal of the four main epithelial cell types in the mouse small intestine. V. Unitarian Theory of the origin of the four epithelial cell types. Am J Anat. 141 (4), 537-561 (1974).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Clevers, H. . The gut, a clonal conveyor belt. , (2015).
- Snippert, H., et al. Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells. Cell. 143 (1), 134-144 (2010).
- Lopez-Garcia, C., Klein, A. M., Simons, B. D., Winton, D. J. Intestinal stem cell replacement follows a pattern of neutral drift. Science. 330 (6005), 822-825 (2010).
- Buczacki, S. J., et al. Intestinal label-retaining cells are secretory precursors expressing Lgr5. Nature. 495 (7439), 65-69 (2013).
- Basak, O., et al. Mapping early fate determination in Lgr5+ crypt stem cells using a novel Ki67-RFP allele. EMBO J. 33 (18), 2057-2068 (2014).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 469 (7330), 415-418 (2011).
- Young, M., Ordonez, L., Clarke, A. R. What are the best routes to effectively model human colorectal cancer. Molecular oncology. 7 (2), 178-189 (2013).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proc Natl Acad Sci U.S.A. 85 (14), 5166-5170 (1988).
- Brault, V., et al. Inactivation of the beta-catenin gene by Wnt1-Cre-mediated deletion results in dramatic brain malformation and failure of craniofacial development. Development. 128 (8), 1253-1264 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/β-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Molecular and Cellular Biology. 27 (21), 7551-7559 (2007).
- Ireland, H., et al. Inducible Cre-mediated control of gene expression in the murine gastrointestinal tract: effect of loss of beta-catenin. Gastroenterology. 126 (5), 1236-1246 (2004).
- Kemp, R., et al. Elimination of background recombination: somatic induction of Cre by combined transcriptional regulation and hormone binding affinity. Nucleic Acids Res. 32 (11), e92 (2004).
- Madison, B. B., et al. Cis elements of the villin gene control expression in restricted domains of the vertical (crypt) and horizontal (duodenum, cecum) axes of the intestine. J Biol Chem. 277 (36), 33275-33283 (2002).
- Parry, L., Young, M., El Marjou, F., Clarke, A. R. Evidence for a crucial role of paneth cells in mediating the intestinal response to injury. Stem Cells. 31 (4), 776-785 (2013).
- Soriano, P. Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat Genet. 21 (1), 70-71 (1999).
- el Marjou, F., et al. Tissue-specific and inducible Cre-mediated recombination in the gut epithelium. Genesis. 39 (3), 186-193 (2004).
- Guillemot, F., Nagy, A., Auerbach, A., Rossant, J., Joyner, A. L. Essential role of Mash-2 in extraembryonic development. Nature. 371 (6495), 333-336 (1994).
- Gregorieff, A., et al. Expression pattern of Wnt signaling components in the adult intestine. Gastroenterology. 129 (2), 626-638 (2005).
- van der Flier, L. G., Haegebarth, A., Stange, D. E., van de Wetering, M., Clevers, H. OLFM4 is a robust marker for stem cells in human intestine and marks a subset of colorectal cancer cells. Gastroenterology. 137 (1), 15-17 (2009).
- Merritt, A., Allen, T., Potten, C., Hickman, J. Apoptosis in small intestinal epithelial from p53-null mice: evidence for a delayed, p53-independent G2/M-associated cell death after gamma-irradiation. Oncogene. 14 (23), 2759-2766 (1997).
- Marshman, E., Ottewell, P., Potten, C., Watson, A. Caspase activation during spontaneous and radiation-induced apoptosis in the murine intestine. J Pathol. 195 (3), 285-292 (2001).
- Fevr, T., Robine, S., Louvard, D., Huelsken, J. Wnt/beta-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Mol Cell Biol. 27 (21), 7551-7559 (2007).
- Barker, N., et al. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature. 457 (7229), 608-611 (2009).
- Tian, H., et al. A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable. Nature. 478 (7368), 255-259 (2011).
- Yilmaz, O. H., et al. mTORC1 in the Paneth cell niche couples intestinal stem-cell function to calorie intake. Nature. 486 (7404), 490-495 (2012).
- Adolph, T. E., et al. Paneth cells as a site of origin for intestinal inflammation. Nature. 503 (7475), 272-276 (2013).
- Marsh, V., et al. Epithelial Pten is dispensable for intestinal homeostasis but suppresses adenoma development and progression after Apc mutation. Nat Genet. 40 (12), 1436-1444 (2008).
- Jardé, T., et al. In vivo and in vitro models for the therapeutic targeting of Wnt signaling using a Tet-OΔN89β-catenin system. Oncogene. 32 (7), 883-893 (2013).
- Hung, K. E., et al. Development of a mouse model for sporadic and metastatic colon tumors and its use in assessing drug treatment. Proc Natl Acad Sci U S A. 107 (4), 1565-1570 (2010).
- Dacquin, R., Starbuck, M., Schinke, T., Karsenty, G. Mouse alpha1(I)-collagen promoter is the best known promoter to drive efficient Cre recombinase expression in osteoblast. Dev Dyn. 224 (2), 245-251 (2002).
- Hinoi, T., et al. Mouse model of colonic adenoma-carcinoma progression based on somatic Apc inactivation. Cancer Res. 67 (20), 9721-9730 (2007).
- Sansom, O. J., et al. Loss of Apc allows phenotypic manifestation of the transforming properties of an endogenous K-ras oncogene in vivo. Proc Natl Acad Sci U.S.A. 103 (38), 14122-14127 (2006).
- Wong, V. W., et al. Lrig1 controls intestinal stem-cell homeostasis by negative regulation of ErbB signalling. Nat Cell Biol. 14 (4), 401-408 (2012).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- van de Wetering, M., et al. Prospective Derivation of a Living Organoid Biobank of Colorectal Cancer Patients. Cell. 161 (4), 933-945 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유