Method Article
El mantenimiento de una
En este artículo
Resumen
This manuscript reports a detailed protocol for culturing, on a regular basis, a population of Drosophila melanogaster using a fly population cage.
Resumen
Large quantities of DNA, RNA, proteins and other cellular components are often required for biochemistry and molecular biology experiments. The short life cycle of Drosophila enables collection of large quantities of material from embryos, larvae, pupae and adult flies, in a synchronized way, at a low economic cost. A major strategy for propagating large numbers of flies is the use of a fly population cage. This useful and common tool in the Drososphila community is an efficient way to regularly produce milligrams to tens of grams of embryos, depending on uniformity of developmental stage desired. While a population cage can be time consuming to set up, maintaining a cage over months takes much less time and enables rapid collection of biological material in a short period. This paper describes a detailed and flexible protocol for the maintenance of a Drosophila melanogaster population cage, starting with 1.5 g of harvested material from the previous cycle.
Introducción
La capacidad de combinar los enfoques genéticos y bioquímicos ha hecho Drosophila un organismo especialmente adecuado para bioquímica y biología molecular estudios 1-3. Estos estudios a menudo requieren grandes cantidades de material biológico, no sólo de las moscas adultas, sino también de las larvas de 4, 5 y pupas embriones 6-8. Para obtener grandes cantidades de material, los investigadores tienen moscas cultivadas utilizando grandes contenedores conocidos como volar "jaulas de población". Estas jaulas consisten en un cilindro de plástico cubierto por una red en ambos lados para permitir la introducción de los alimentos dentro de la jaula sin las moscas escapen. Estas jaulas pueden ser hechos en casa 9-11 o comprado a una empresa (véase la tabla de materiales específicos / equipo).
Una ventaja principal de utilizar este sistema para crecer un gran número de moscas es que el ciclo de la mosca de la fruta 12 se puede controlar de una manera que todas las moscas se desarrollan en un relativamente sincronizado manera. Esta sincronización se logra mediante la siembra de nuevos embriones, la alimentación de larvas / moscas y sacrificando las moscas adultas en los momentos precisos. Utilizando una población de moscas sincronizada es particularmente útil para los estudios de desarrollo 13.
El inicio de una nueva jaula población de unas cuantas moscas es un proceso que consume tiempo que requiere muchos ciclos de amplificación 9-11. Incluso el uso de contenedores más grandes, como botellas de cultivo mosca o minicages, todo el proceso puede durar meses. Para evitar este paso mucho tiempo, muchos laboratorios de Drosophila mantienen regularmente este tipo de jaulas. Es más conveniente para iniciar una nueva jaula a partir de una recogida de embriones a partir de una jaula de población ya establecida. En general, la mayoría de los laboratorios mantienen jaulas de población de tipo salvaje, como Oregon R o S. Cantón Este manuscrito presenta un protocolo detallado para mantener las jaulas de la población de moscas.
Protocolo
1. Inicio del Ciclo: Los embriones Siembra
NOTA: El ciclo comienza con 1,5 g de material recogido (una mezcla compuesta de embriones y / o algunos larvas de primer instar) del ciclo anterior. Este material será colocado en un recipiente de plástico (véase la tabla de materiales específicos / equipo) con una mezcla de levadura activa hasta la fase de pupa. El recipiente se cierra después de la introducción de la mezcla biológica de los embriones y larvas con la tapa para evitar que permite que las larvas se escape. Es necesario para hacer los agujeros en la tapa con el fin de permitir la circulación de aire. Para evitar que escape de las larvas a través de los agujeros, se utilizan tapones de espuma. Por último, se recomienda el uso de guantes y ropa de laboratorio, no sólo en esta sección, sino también en todo el protocolo, para evitar que la ropa sucia o tinción con lejía.
- Configurar el contenedor de plástico.
- Haga tres agujeros cuadrados con una hoja de afeitar en la tapa del recipiente de plástico de unproximadamente 2,2 cm. Añadir cinta (cinta de etiquetar 3/4 pulgadas) a las cuatro esquinas de cada agujero para asegurar un ajuste apretado para los tapones de espuma (50 x 55 mm, dxl), y luego se coloca una clavija de espuma en cada hoyo.
- Cubra el interior del recipiente de plástico con una envoltura de plástico. Sobre esta película, añadir una capa de algodón para cubrir el fondo del recipiente de plástico. Rasgar el algodón con los dedos.
- Preparar la comida mosca.
- Añadir 333 ml de agua desionizada en un vaso de precipitados de 500 ml. Mientras se agita el vaso de precipitados con una barra magnética, añadir 167 l de ácido propiónico y 1,08 ml de ácido fosfórico, a partir de las soluciones madre (99,96% y 85%, respectivamente).
- Añadir lentamente 77,5 g de levadura seca activa, evitando las grandes aglomeraciones. Después de disolver la levadura seca, añadir 38,8 g de sacarosa.
NOTA: La sacarosa debe ser que se añade el último ingrediente, porque inmediatamente después de la adición de este componente, se iniciará la fermentación.
- Inmediatamente después de la disolución de la sacarosa, se vierte laalimentos sobre el algodón, y asegúrese de cubrir el algodón de manera uniforme. Cierre el recipiente de plástico con la tapa para evitar moscas escapado en el laboratorio de contaminación de los alimentos.
- Resuspender 1,5 g de los embriones recolectados (no dechorionated) del ciclo anterior con 5 ml de 70% de etanol. Cut en medio de dos papeles de filtro y distribuir la mezcla biológica de manera uniforme sobre las 4 piezas utilizando una espátula o una pipeta de transferencia de una amplia punta (cortar si es necesario). Coloque los papeles de filtro en la parte superior del algodón empapado y cierre la tapa. Finalmente, incubar el recipiente de plástico a temperatura ambiente (24ºC) y humedad (35%) hasta que la fase de pupa.
NOTA: El recipiente de plástico no debe ser colocado en una cámara húmeda, de lo contrario esto fomentará el crecimiento de bacterias.
2. Continuación del ciclo: a partir de embriones de moscas.
NOTA: Esta parte del ciclo va de los embriones colocados en el recipiente de plástico en el día 1 hasta 9 días después, cuando las moscas adultas emergeránde las pupas. Durante estos 8 días nada se tiene que hacer, pero el seguimiento de los embriones que progresan correctamente a las siguientes etapas del ciclo de vida de Drosophila hasta la eclosión. Si las larvas empiezan a morir y girando negro durante este tiempo, comprobar que los tapones de espuma no están demasiado ajustadas y que exista una ventilación adecuada. Este período es un buen momento para limpiar la jaula de población de la mosca del ciclo anterior.
- Observar los embriones se convierten en larvas 1 st alrededor de 24 horas después de la hembra adulta deposita en ellos la comida mosca (ver paso 3). Las larvas resultantes se alimentan de la comida mosca preparado en la etapa 1 durante 4 días, el cultivo y la muda dos veces en 2 ° y 3 º estadio las larvas.
- Limpiar la jaula población de moscas.
- Coloque la jaula en 4 ºC durante al menos 30 min para retrasar la actividad de las moscas. Retire la red que cubre un lado de la jaula, y con un movimiento rápido, tapar el lado abierto con un gran plástico de riesgo biológicobolso. Verter el contenido de la jaula en la bolsa.
- Con la bolsa de riesgo biológico que todavía cubre un lado de la jaula, la jaula posicionar verticalmente sobre un fregadero con la bolsa de riesgo biológico lado hacia abajo. Retirar con cuidado la bolsa de plástico para evitar que las moscas escapen y desecharla en un envase para peligros biológicos.
- Abra cuidadosamente la malla superior suficiente para crear un pequeño agujero, enjuague el interior de la jaula con agua, que se lave las moscas en el fregadero. Poco a poco aumentar el tamaño del agujero y eliminar todas las moscas dentro de la jaula.
- Limpiar la jaula y las dos redes con agua y jabón. Mientras que las redes están todavía húmedas fijarlos en ambos lados de la jaula limpia y seca, y finalmente poner dentro de un documento de laboratorio de remojo, que evitará que la película de plástico preparado en la etapa 1.1.2 se pegue a la jaula. Ahora la jaula está listo para el siguiente ciclo.
- Cuatro días después de la configuración inicial, observar la pupa las larvas. Las larvas permanecerá en esta etapa durante 4 días más.
NOTA: Durante esta fase las pupas cubrirá toda la superficie de algodón en el interior del recipiente de plástico. - Durante la fase de pupa y antes de las primeras moscas emergen, abrir el recipiente de plástico y colocar la lámina de plástico que contiene el algodón con todo el pupas sobre el papel de laboratorio de remojo dentro de la jaula limpia población. Cierre de la red con un nudo doble y limpiar el recipiente de plástico y la tapa para el siguiente ciclo.
NOTA: Las pupas colocada en la tapa debe ser desechada y destruida por autoclave o congelación antes de la eclosión.
3. moscas adultas.
NOTA: Después de los 4 días de la pupa en escena las primeras moscas surgirá de las pupas. Dentro de 24 - 48 h todas las moscas deberían haber eclosed. En esta parte del ciclo, es importante que les proporcione alimento con el fin de crear el entorno adecuado para la reproducción.
- Preparar las bandejas de melaza.
- Combinar en un matraz de 1 L 556.25 ml de H2O desionizada, 90 ml de melaza y 22 g de agar. Autoclave con una barra de agitación durante 30 minutos, enfriar y añadir 9,25 ml de 10% Tegosept en EtOH al 95%.
- Verter la mezcla en una bandeja de carne de 21 x 14,5 cm. Asegúrese de que el volumen es suficiente para cubrir 15 - 17 bandejas. Espere 10 - 20 min para solidificar y cubrir cada bandeja con una película de plástico para evitar el secado. Varios frascos de 1 L se pueden preparar al mismo tiempo. Almacenar las bandejas de melaza a 4 ºC envuelto en plástico hasta que sea necesario.
- Añadir una bandeja cubierta con melaza de levadura húmeda dentro de la jaula con las moscas adultas.
- Antes de la adición de la placa, colocar la jaula en 4 ºC en la sala fría durante 30 min.
- Añadir 200 ml de H2O desionizada en un vaso de precipitados y verter lentamente la levadura seca mientras se agita con una cuchara. Dejar de añadir la levadura seca, cuando la mezcla se vuelve aproximadamente a la consistencia de la mantequilla de maní para evitar que las moscas quedarse atascado en la comida.
NOTA: Es importante no permitir que la solución de alimentación se solidifique lo contrario será muy difícil de cubrirla melaza bandeja y extraer los huevos durante el proceso de recolección (ver sección 4.3). - Retire la lámina de plástico desde una bandeja de melaza y se cubre con una capa de la levadura húmeda preparada fresca con una cuchara o espátula. Asegúrese de que toda la superficie está cubierta.
- Mientras que la jaula se encuentra todavía en la cámara fría, abrir la red y añadir cuidadosamente la bandeja de melaza con levadura húmeda en la jaula. Cierre la red y colocar la jaula a TA.
NOTA: Puede ser útil para cubrir la placa con una bandeja de carne de vacío durante la inserción, pero asegúrese de no bloquear el acceso de las moscas a la bandeja de melaza.
- Cambiar el plato de comida cada 24 - 48 horas para evitar la levadura para obtener demasiado seco. Las moscas adultas son muy sensibles a la desecación.
4. Parte del Ciclo: La recolección de los embriones
NOTA: La mejor la fertilidad de la mosca es de 3 - 5 días después de la eclosión. Por lo tanto, la cosecha durante este tiempo será obtener el mejor rendimiento del embrión. Después de colecciones deseados son compleTed, el ciclo ha terminado. Las moscas deben ser sacrificados y limpiar la jaula como se especifica en el paso 2.2.
- Por lo general, 2 días después de la eclosión mosca, introducen un nuevo melaza bandeja con comida húmeda fresca en la jaula, como se explica en el apartado 3.2.5. Para aumentar el rendimiento de los huevos de deposición, con la ayuda de los dedos, hacer que la superficie de la levadura húmeda como irregular como sea posible. Si una bandeja de comida vieja está presente en la jaula, antes de añadir la nueva placa, retire con cuidado y desechar en una bolsa de riesgo biológico. Otro consejo para incrementar el rendimiento es eliminar la capa de algodón para que todos los huevos serán depositados en la comida. Mantener la jaula a TA.
- Observar los embriones como pequeños puntos blancos.
NOTA: Los huevos están listos para ser recogidos. Para el mantenimiento rutinario de la jaula mosca, Colección 2 días es el tiempo recomendado. Esta colección contendrá todo embriones y larvas pocos 1 st. Ver resultados representativos de los rendimientos típicos de embriones cosechados para varios Collepuntos de tiempo cción. - Cosecha de los embriones
- Colocar la jaula en la cámara fría durante aproximadamente 30 min. Mientras tanto preparar el recipiente de plástico y la comida de la mosca para el siguiente ciclo, como se explica en el apartado 1.
- En una bandeja de autoclave de 8 L añadir agua a ¼ de la capacidad total y luego agregar 1 ml de 10% de Triton X-100. Mientras que la jaula está en el cuarto frío retirar con cuidado la placa de melaza y colocarlo dentro de una bolsa de riesgo biológico.
- Retire la bandeja de la bolsa y sumergirlo rápidamente (para evitar que las moscas se escape) en la solución de detergente en la bandeja del autoclave. Cierre la bolsa de riesgo biológico y poner en un contenedor de residuos sanitarios. Las moscas no se ahogan en el agua que no contiene detergente.
- Utilice una brocha y pistola de agua destilada para lavar los embriones y la levadura fuera de la melaza. Desechar las placas y la melaza en la caja de riesgo biológico.
- Verter la solución cuidadosamente a través de un conjunto de tres tamiz (tamiz más grueso en la parte superior 30, 40 en el centro y 100 en la parte inferior). matas de lavado on nivel superior con pistola de agua destilada hasta que no haya grumos permanecen.
NOTA: El moscas adultas y larvas 3ª será retenido en el tamiz de 30.- Enjuague la bandeja de autoclave con agua destilada y se vierte el agua de enjuague a través de los tamices. Retire la parte superior proceso de criba y repita si aparecen grumos levadura permanecen. La mayor parte de la 1ª y todo el estadio las larvas 2º permanecerá en el tamiz de 40.
- Retire el segundo tamiz. El material de color amarillento en el tercer tamiz (inferior) es la mezcla de los embriones y larvas pequeñas 1ª. Utilice pistola de agua destilada para mover todos los huevos a un lado de la criba. Recoger con una espátula y pesarlos.
- Durante estos ciclos el rendimiento de recogida de embriones / larvas oscila entre 7 y 13 g. Utilice sólo 1,5 g de este material para comenzar un nuevo ciclo (sección 1). Utilizar el resto de los embriones para su posterior procesamiento o pueden ser descartados.
5. OtrosTratamiento
NOTA: Los embriones no utilizados para la continuación de la población se pueden utilizar inmediatamente para experimentos o, alternativamente, se puede congelar a -80 ºC. Para ambas opciones, los embriones pueden necesitar ser dechorionated primero.
- Para dechorionation, lavar los embriones durante 2 minutos en una solución de lejía al 50% y enjuagar bien con agua destilada.
- Para congelar los embriones, primero en seco, presionando firmemente con una toalla de papel, y pesar y colocarlos, con la ayuda de una espátula, en un tubo cónico de 15 o 50 ml. Finalmente sumergir el tubo cónico en N líquido 2 por unos pocos segundos.
Resultados
El mantenimiento de una población jaula mosca se basa en el ciclo de vida de la mosca. Por lo tanto, después de colocar la mezcla biológica inicial de embriones y larvas en el recipiente de plástico (Figura 1) los huevos fertilizados se convertirán en larvas en no más de 2 días y las larvas crezcan durante 4 días, relativamente sincronizados a través de las diferentes etapas de larvas de instar ( véase la Figura 1B).
Después de las larvas han completado la etapa larval instar 3 rd se empupar y cubrir la superficie del algodón en el interior del recipiente de plástico con un poco en la superficie interna de la tapa (Figura 1C). Este período de la fase de pupa irá en los próximos 4 días hasta que las moscas de finalizar el proceso de metamorfosis. Durante este período, se recomienda encarecidamente para transferir las moscas en la jaula. Las primeras moscas adultas empezarán a eclose en el día 9 - 10 en elinicio del ciclo (Figura 1D) y para el día 11 todos ellos habrá surgido de las pupas.
Se obtiene el mejor rendimiento de la recolección de los embriones de 3 - 5 días después de la eclosión (día 13 al 15) y finalmente declina en el día 17 (7 días después de la eclosión). Por lo tanto, se recomienda añadir la última bandeja de comida fresca en el día 13 y recoger los huevos en el Día 15 (Figura 1E y F). Esto permitirá que la recogida del número máximo de embriones. Adición de un tercio día adicional antes de la recogida puede resultar en la comida ser demasiado seco y, por consiguiente disminuirá el rendimiento de los embriones recogidos. Tabla 1 muestra el rendimiento de 6 colecciones de ciclo consecutivos, con un material de partida de 1,5 g en cada ciclo, y la Figura 2 es el programa recomendado para una colección de ciclo completo.
El material cosechado en 2 días60; períodos está compuesta principalmente de embriones. Sin embargo, un pequeño número de larvas también están presentes. Para fines de mantenimiento de la jaula estas larvas no son un problema, ya que se espera algún grado de asincronía. Sin embargo, para algunos experimentos bioquímica, la pureza de estos embriones es muy importante, pero al mismo tiempo, también es necesario para recoger grandes cantidades de huevos para llevar a cabo estos experimentos. Por esta razón varias colecciones consecutivas cortas se realizaron a 1 hr y 3 hr, después de añadir rápidamente a TA una nueva placa con los alimentos, para proporcionar una estimación del rendimiento y la pureza que se puede obtener con este método (Tabla 2 y Figura 3) . Las colecciones consecutivos de 1 hora comenzaron con un rendimiento muy bajo (14,5 mg), pero luego las cantidades de embriones aumento para cada hora de la recogida, pero la última vez. El bajo rendimiento en un primer momento puede ser debido a las moscas que se destacaron durante el proceso de cambio de la comida, pero más tarde para aclimatarse. Por otra parte, no larVAE se observaron en las cinco colecciones secuenciales (Figura 3A), que muestra que las colecciones más cortos producen una mayor pureza. Si el algodón no se elimina de la jaula, la probabilidad de que las larvas de los puntos de tiempo anteriores se mantendrá y entrar se incrementa la placa fresca. Incluso cuando se quita el algodón, a veces larvas vagarán en el lado de la jaula y entrar en el alimento durante una colección.
Para las colecciones consecutivas de 3 horas, el rendimiento varió de 840 a la 1250 mg, que es aproximadamente 10 veces más que los rendimientos obtenidos en las colecciones HR 1. La pureza de estos embriones era cerca de 100% (Figura 3B). se observaron larvas de vez en cuando. Algunos estudios de desarrollo requieren una sincronización muy estricta para los embriones recogidos. Para aumentar la pureza de sincronización, se recomienda para descartar la primera placa de recogida, porque si las condiciones no son ideales, las hembras pueden retienen huevos más maduros y depositar elm cuando las condiciones mejoran, tales como con la introducción de una placa fresca. También es importante saber que las moscas adultas mayores (> 6 días) producen embriones de menos sincronizados. Para verificar el grado de sincronización con una alta precisión, se recomienda una tinción DAPI de los embriones recogidos.

Figura 1. El ciclo de Drosophila melanogaster de vida en una población de la jaula de la mosca. (A) inicio del ciclo de siembra de 1,5 g de los embriones en el recipiente de caja de plástico. Como referencia, en el panel inferior, la longitud del papel de filtro es 8,5 cm. (B) Las larvas creciendo relativamente sincronizada 5 días después del inicio del ciclo. (C) En el día 8, la mayoría de las moscas están en la fase de pupa. Los paneles inferiores en B (B ') y C (C ') son fragmentos ampliados de las zonas indicadas en los paneles superiores. Moscas (D) para adultos emergieron de las pupas de 10 días después del inicio del ciclo. (E) moscas adultas dentro de la jaula de la población antes de iniciar el proceso de recolección de los embriones, en el día 15. El material amarillento en la comida de la mosca son los huevos fertilizados. (F) Los embriones (y unas pocas larvas) recogidos en la parte inferior del tamiz 100 más gruesa, después de un ciclo de la jaula entera. Haga clic aquí para ver una versión más grande de esta figura.
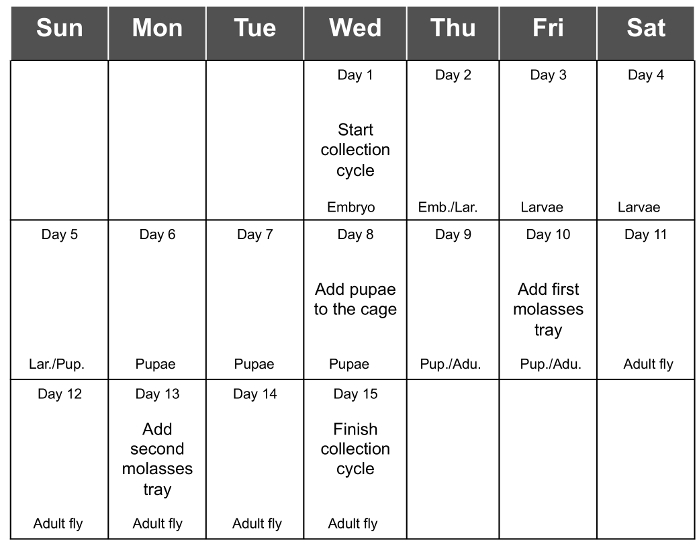
Figura 2. Total Horario Colección Ciclo. La Figura 2 muestra el programa recomendado para una colección de ciclo completo. t = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
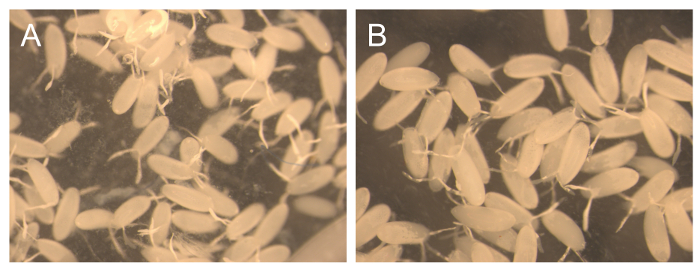
Figura 3. La pureza de 1 hr y 3 hr colecciones consecutivas. Imagen representativa de los embriones recogidos al cabo de 1h (A) y 3 horas (B) después de añadir una nueva bandeja de comida. Haga clic aquí para ver una versión más grande de esta figura.
| número de ciclo | Rendimiento (g) |
| 1 | 10.3 |
| 2 | 9.5 |
| 3 | 10.3 |
| 4 | 12.7 |
| 5 | 10 |
| 6 | 7.1 |
| colección # | Longitud de la recolección (h) | Rendimiento (mg) |
| 1 | 1 | 14.5 |
| 2 | 1 | 21.6 |
| 3 | 1 | 56.1 |
| 4 | 1 | 160.1 |
| 5 | 1 | 106.1 |
| 1 | 3 | 960 |
| 2 | 3 | 840 |
| 3 | 3 | 1250 |
Tabla 2. Rendimiento de 1 hr y 3 hr consecutivos Colecciones. La Tabla 2 muestra el rendimiento de 5 colecciones consecutivos de 1 hora después de la adición de nuevos alimentos y 3 colecciones consecutivas 3 horas después de la colocación de una nueva placa de melaza.
Discusión
A partir de 1,5 g de un material se puede obtener un rendimiento de embriones recogidos entre 7 y 13 g por ciclo. Para obtener una cantidad de material tal que es crucial para mantener las condiciones de cultivo adecuadas para todas las etapas del ciclo de marcha.
Los parámetros más importantes son la temperatura y la humedad, que debe ser 24 ºC y 35%, respectivamente. Si estos dos parámetros no pueden mantenerse constantes en el ambiente normal del laboratorio, una posibilidad sería colocar la jaula mosca en una incubadora o en una cámara ambiental. Otros protocolos recomiendan 70% de humedad y también un ciclo de luz-oscuridad de 24 horas constante para aumentar el rendimiento de los huevos producidos 9,10. Sin embargo manteniendo la humedad alrededor de 35% evita la contaminación bacteriana, y ya que el propósito de este protocolo es sólo el mantenimiento de una jaula de población, las moscas se mantiene en el entorno de luz normal del laboratorio.
Otro punto importante es mantener disturbances al moscas adultas lo más bajo posible. Puede ser aconsejable mantener la jaula en un lugar separado de la sala de marcha para evitar la contaminación cruzada de otras moscas.
No se recomienda el cultivo de grandes poblaciones de transgénicos y moscas mutantes, ya que es muy difícil de mantener su pureza y pueden exhibir comportamiento de apareamiento anormal pronunciado en grandes jaulas de población 14.
Un posible problema mientras que el cultivo de Drosophila en grandes cantidades es la presencia de otros organismos como los ácaros y / o molde, que competirán por la comida y por lo tanto reducen el rendimiento de los huevos producidos. Para evitar esto, es muy importante mantener todo el equipo limpio, lavado de la jaula, redes y volar cajas con agua y jabón, y descartando el material desechable (tapones de espuma) después de cada ciclo. Para reducir el moho que crece, propiónico y ácido fosfórico se añaden a la levadura húmeda en la preparación de la comida en el paso de la mosca1.2 y Tegosept en la preparación de la melaza bandeja en el paso 3.1. A veces es útil para colocar materiales como el plástico o caja de tamices de -20 ° C cuando el tiempo es corto y materiales no se puede limpiar de forma inmediata.
Un ciclo de recogida de todo se produce en 14 - 15 días, comenzando cuando los embriones se sembraron en la caja de la mosca y terminando con el último día de recogida. Durante este periodo de tiempo, se recomienda organizar un horario con el fin de recordar todos los pasos necesarios para el mantenimiento de una jaula mosca población (Fig. 2), detallados en la sección de protocolo. Desde el día que los huevos se siembran, hasta que las moscas adultas emergen, es necesario solamente para inspeccionar la caja de plástico, y cuando se produce la fase de pupa, para colocarlos dentro de la jaula. Después de eso, las moscas tienen que ser alimentados cada 2 - 3 días hasta que los embriones se sembraron para un nuevo ciclo. En todo el protocolo, el día más largo es durante la recolección y la siembra de los embriones para iniciar un nuevo ciclo. UNs comentado en el protocolo, el mejor rendimiento de huevo es de 3 - 5 días después de la eclosión de adultos, y finalmente declina 2 días más tarde. Esto nos da una cierta flexibilidad con el fin de elegir el día en el que se llevará a cabo la cosecha de los huevos.
Si por alguna razón el rendimiento de los embriones es menor que la cantidad inicial deseado (1,5 g), siempre se puede añadir una nueva bandeja de melaza y recoger más huevos al día siguiente. Para las colecciones constantes, se recomienda mantener 2 jaulas en paralelo, y si se requieren mayores cantidades de embriones, también se es posible utilizar jaulas más grandes. En caso de hacer colecciones de tiempo cortos, una manera de aumentar el rendimiento es tomar ventaja de la ráfaga de la puesta de huevos por la mañana.
Hay muchas ventajas de la recogida de grandes cantidades de diversas etapas de desarrollo. Por ejemplo, los embriones obtenidos de las jaulas de población se han utilizado con mucho éxito en los ensayos de inmunoprecipitación 6-8, Collectio de masasn de los tejidos de las larvas de larvas disociada ha demostrado ser una muy buena fuente de 3C experimentos 4 y 15 preparaciones de ARN, y las cabezas de moscas adultas han sido utilizados para experimentos chip 16. Además, los adultos a menudo son necesarios para hacer extractos de moscas para el cultivo de tejidos 17.
Una de las aplicaciones más prometedoras de la jaula es proporcionar material para ensayos de alto rendimiento que permiten el análisis y la detección de genes, transcripciones, proteínas y metabolitos en respuesta a la exposición de los patógenos, moléculas biológicas, sustancias químicas y la radiación ionizante. En estos ensayos a gran escala se requieren grandes cantidades de individuos, y la jaula población de moscas se describe aquí pueden ser muy útiles con el fin de obtener grandes cantidades de material durante las diferentes fases del ciclo de vida de Drosophila para su análisis y detección 18.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank Yixian Zheng (Carnegie Institution of Washington, Baltimore, MD) for the original protocol and assistance in initial setup and members of the Lei laboratory for critical reading of the manuscript. This work was funded by the Intramural Research Program of the National Institute of Diabetes and Digestive and Kidney Diseases.
Materiales
| Name | Company | Catalog Number | Comments |
| Bacto-Agar | Beckton Dickinson | 214010 | |
| Curity practical cotton roll | Kendall | 2287 | |
| Dry yeast | Affymetrix | 23540 | |
| Filter paper | GE Healthcare Life Science | 1001-085 | |
| Foam tube plugs | Jaece | L800-D2 | 50 mm Diameter x 55 mm Length |
| Fly population cage | Flystuff | 59-116 | 9″ Diameter x 14.4″ Length. Includes the nets for the cage. |
| Meat tray | Genpak | 1002S (#2S) | 8.25 x 5.75 x 0.5 inches |
| Molasses | Grandma´s | ||
| Plastic container | Rubbermaid | 4022-00 | |
| Plastic film | Glad | ||
| Phosphoric acid | Fisher Scientific | S 93326 | Toxic. Handle in Chemistry Hood |
| Propionic acid | Fisher Scientific | A258-500 | Toxic. Handle in Chemistry Hood |
| Stainless steel sieve #100 | VWR | 57324-400 | |
| Stainless steel sieve #40 | VWR | 57324-272 | |
| Stainless steel sieve #30 | VWR | 57324-240 | |
| Sucrose | MP | 152584 | |
| Tegasept | LabScientific | FLY5501 | |
| Triton-X100 | Fisher Scientific | BP151-500 |
Referencias
- Lim, S. J., Boyle, P. J., Chinen, M., Dale, R. K., Lei, E. P. Genome-wide localization of exosome components to active promoters and chromatin insulators in Drosophila. Nucleic Acids Res. 41, 2963-2980 (2013).
- Ong, C. T., Van Bortle, K., Ramos, E., Corces, V. G. Poly(ADP-ribosyl)ation regulates insulator function and intrachromosomal interactions in Drosophila. Cell. 26, 148-159 (2013).
- Gonzalez, I., Mateos-Langerak, J., Thomas, A., Cheutin, T., Cavalli, G. Identification of regulators of the three-dimensional polycomb organization by a microscopy-based genome-wide RNAi screen. Mol Cell. 8, 485-499 (2014).
- Magbanua, J. P., Runneburger, E., Russell, S., White, R. A variably occupied CTCF binding site in the ultrabithorax gene in the Drosophila bithorax complex. Mol Cell Biol. 35, 318-330 (2014).
- Maksimenko, O. Two new insulator proteins, Pita and ZIPIC, target CP190 to chromatin. Genome Res. 25, 89-99 (2015).
- Lei, E. P., Corces, V. G. RNA interference machinery influences the nuclear organization of a chromatin insulator. Nat Genet. 38, 936-941 (2006).
- Matzat, L. H., Dale, R. K., Moshkovich, N., Lei, E. P. Tissue-specific regulation of chromatin insulator function. PLoS Genet. 8, e1003069 (2012).
- King, M. R., Matzat, L. H., Dale, R. K., Lim, S. J., Lei, E. P. The RNA-binding protein Rumpelstiltskin antagonizes gypsy chromatin insulator function in a tissue-specific manner. J Cell Sci. 1, 2956-2966 (2014).
- Sisson, J. C. Culturing large populations of drosophila for protein biochemistry. Cold Spring Harb Protoc. , (2007).
- Shaffer, C. D., Wuller, J. M., Elgin, S. C. Raising large quantities of Drosophila for biochemical experiments. Methods Cell Biol. 44, 99-108 (1994).
- Roberts, D. B., Standen, G. N., Roberts, D. B. The elements of Drosophila biology and genetics. Drosophila: A practical approach. , 1-53 (1998).
- Ashburner, M., Roote, J. Culture of Drosophila: The laboratory setup. Cold Spring Harb Protoc. , (2007).
- Dahlberg, O., Shilkova, O., Tang, M., Holmqvist, P. H., Fb Mannervik, M. P-TEb, The super elongation complex and mediator regulate a subset of non-paused genes during early Drosophila embryo development. PLOS Genet. 13, e1004971 (2015).
- Zhang, S. D., Odenwald, W. F. Misexpression of the white (w) gene triggers male-male courtship in Drosophila. Proc Natl Acad Sci USA. 6, 5525-5529 (1995).
- Chak, L. L., Mohammed, J., Lai, E. C., Tucker-Kellogg, G., Okamura, K. A deeply conserved, noncanonical miRNA hosted by ribosomal DNA. RNA. 21, 375-384 (2015).
- Moshkovich, N., Lei, E. P. HP1 recruitment in the absence of argonaute proteins in Drosophila. PLOS Genet. 12, e1000880 (2010).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol Rev. 63, 411-436 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados