Method Article
Le maintien d'un
Dans cet article
Résumé
This manuscript reports a detailed protocol for culturing, on a regular basis, a population of Drosophila melanogaster using a fly population cage.
Résumé
Large quantities of DNA, RNA, proteins and other cellular components are often required for biochemistry and molecular biology experiments. The short life cycle of Drosophila enables collection of large quantities of material from embryos, larvae, pupae and adult flies, in a synchronized way, at a low economic cost. A major strategy for propagating large numbers of flies is the use of a fly population cage. This useful and common tool in the Drososphila community is an efficient way to regularly produce milligrams to tens of grams of embryos, depending on uniformity of developmental stage desired. While a population cage can be time consuming to set up, maintaining a cage over months takes much less time and enables rapid collection of biological material in a short period. This paper describes a detailed and flexible protocol for the maintenance of a Drosophila melanogaster population cage, starting with 1.5 g of harvested material from the previous cycle.
Introduction
La capacité de combiner des approches génétiques et biochimiques a Drosophila un organisme particulièrement adapté pour biochimie et biologie moléculaire des études 1-3. Ces études nécessitent souvent de grandes quantités de matériel biologique, non seulement des mouches adultes, mais aussi des larves 4, 5 et pupes embryons 6-8. Pour obtenir de grandes quantités de matériaux, les chercheurs ont mouches cultivées en utilisant de grands conteneurs connus comme voler "cages de population». Ces cages sont constitués d'un cylindre en matière plastique recouverte d'un filet sur les deux côtés pour permettre l'introduction de la denrée alimentaire à l'intérieur de la cage sans que les mouches qui fuient. Ces cages peuvent être faits maison 9-11 ou achetés auprès d' une société (voir tableau des matériaux / équipements spécifiques).
Un avantage majeur de l' utilisation de ce système pour développer un grand nombre de mouches est que le cycle de la mouche à fruit 12 peut être contrôlée de manière à ce que tous les mouches se développent dans une rélativement synchronisée manière. Cette synchronisation est réalisée par ensemencement de nouveaux embryons, se nourrissant de larves / mouches et sacrifier les mouches adultes à des moments précis. L' utilisation d' une population de mouches synchronisée est particulièrement utile pour les études de développement 13.
Le début d'une nouvelle cage de population de quelques mouches est un processus de longue haleine nécessitant de nombreux cycles d'amplification 9-11. Même en utilisant de plus grands récipients comme des bouteilles de culture de mouche ou minicages, l'ensemble du processus peut durer des mois. Pour éviter ce pas de temps long, de nombreux laboratoires de Drosophila maintiennent régulièrement ces cages. Il est plus commode de commencer une nouvelle cage à partir d'une collecte d'embryons à partir d'une cage de population déjà établie. En général, la plupart des laboratoires maintiennent des cages de type sauvage population, comme l'Oregon R ou Canton S. Ce manuscrit présente un protocole détaillé pour maintenir la mouche des cages de population.
Protocole
1. Démarrage du cycle: Embryons Semis
NOTE: Le cycle débute par 1,5 g de matière recueillie (un mélange composé d'embryons et / ou certaines larves au premier stade larvaire) du cycle précédent. Ce matériel sera placé dans un récipient en plastique (voir tableau des matériaux / équipements spécifiques) avec un mélange de levure active jusqu'à ce que la phase de chrysalide. Le récipient est fermé après l'introduction du mélange biologique des embryons et des larves avec le couvercle pour éviter de laisser échapper les larves. Il est nécessaire de faire des trous dans le couvercle afin de permettre la circulation de l'air. Pour éviter d'avoir des larves échapper à travers les trous des bouchons en mousse sont utilisés. Enfin, il est recommandé de porter des gants et une blouse de laboratoire, non seulement dans cette section, mais aussi dans le protocole entier, pour éviter d'avoir des vêtements sales ou coloration avec l'eau de Javel.
- Mettre en place le récipient en plastique.
- Faites trois trous carrés avec une lame de rasoir dans le couvercle du récipient en plastique d'unnviron 2,2 cm. Ajouter bande (étiquetage de bande 3/4 de pouce) aux quatre coins de chaque trou pour assurer un ajustement serré pour les bouchons en mousse (50 x 55 mm, DXL), puis placer un bouchon de mousse dans chaque trou.
- Couvrir l'intérieur du récipient en plastique avec une pellicule de plastique. Au-dessus de ce film, ajouter une couche de coton pour couvrir le fond du récipient en plastique. Déchirer le coton avec vos doigts.
- Préparer la nourriture à la mouche.
- Ajouter 333 ml d'eau déminéralisée dans un bêcher de 500 ml. Tout en agitant le bécher avec un barreau magnétique, ajouter 167 pi d'acide propionique et 1,08 ml d'acide phosphorique, des solutions d'achat d'actions (99,96% de 85%, respectivement).
- Ajouter lentement 77,5 g de levure sèche active, évitant les grandes touffes. Après la dissolution de la levure sèche, ajouter 38,8 g de saccharose.
NOTE: sucrose devrait être le dernier ingrédient à ajouter, car immédiatement après l'ajout de cette composante, la fermentation commence.
- Immédiatement après la dissolution du saccharose, versez lela nourriture sur le coton, et assurez-vous de couvrir le coton uniformément. Fermer le récipient en plastique avec le couvercle pour éviter les mouches échappées au sein du laboratoire de contaminer la nourriture.
- Remettre en suspension 1,5 g des embryons récoltés (non dechorionated) du cycle précédent avec 5 ml d'éthanol à 70%. Couper en deux deux papiers filtres et distribuer le mélange biologique uniformément sur les 4 morceaux à l'aide d'une spatule ou d'une pipette de transfert avec une pointe large (couper si nécessaire). Jeter les papiers filtres sur le dessus du coton imbibé et fermer le couvercle. Enfin, incuber le récipient en plastique à température ambiante (24ºC) et d'humidité (35%) jusqu'à ce que le stade de pupe.
NOTE: Le récipient en plastique ne doit pas être placé dans une chambre humide, sinon cela va encourager la croissance des bactéries.
2. Poursuite du cycle: De Embryons à mouches.
NOTE: Cette partie du cycle va des embryons placés dans le récipient en plastique le jour 1 jusqu'à 9 jours plus tard, lorsque les mouches adultes émergerontdes chrysalides. Pendant ces 8 jours , rien n'a à faire , mais la surveillance que les embryons progressent correctement aux prochaines étapes du cycle de vie de Drosophila jusqu'à eclosion. Si les larves commencent à mourir et devient noir pendant ce temps, vérifier que les bouchons en mousse ne sont pas trop serrés et que la ventilation est adéquate. Cette période est un bon moment pour nettoyer la cage de population de mouches du cycle précédent.
- Observer les embryons deviennent 1 er stade larvaire environ 24 heures après la femelle adulte les a déposés dans la nourriture à la mouche (voir l' étape 3). Les larves résultant nourrir de la nourriture à la mouche préparée à l' étape 1 pendant 4 jours, la croissance et la mue deux fois en 2 ème et 3 ème larves larvaire.
- Nettoyez la cage de population de mouches.
- Placez la cage à 4 ° C pendant au moins 30 minutes pour ralentir l'activité des mouches. Retirer le filet qui recouvre un côté de la cage, et avec un mouvement rapide, plafonner le côté ouvert avec un grand plastique biohazardsac. Verser le contenu de la cage dans le sac.
- Avec le sac biohazard couvrant toujours un côté de la cage, positionner la cage verticalement au-dessus d'un évier avec le sac côté biohazard vers le bas. Retirez délicatement le sac en plastique pour empêcher les mouches qui fuient et le jeter dans un conteneur de déchets biologiques dangereux.
- Ouvrez soigneusement le filet supérieur suffisant pour créer un petit trou, rincer l'intérieur de la cage avec de l'eau, qui va se laver les mouches dans l'évier. Lentement augmenter la taille du trou et éliminer toutes les mouches à l'intérieur de la cage.
- Nettoyez la cage et les deux filets avec de l'eau et du savon. Alors que les filets sont encore humides les fixer sur les deux côtés de la cage propre et sec, et enfin mettre à l'intérieur d'un papier de laboratoire suintant, qui empêchera le film plastique préparé à l'étape 1.1.2 de coller à la cage. Maintenant, la cage est prêt pour le cycle suivant.
- Quatre jours après l'installation initiale, observer la nymphose. Les larves restera dans ce stade pendant 4 jours.
C'EST NOTÉurant cette phase, le pupes couvrira toute la surface de coton à l'intérieur du récipient en plastique. - Pendant la phase de chrysalide et avant les premières mouches émergent, ouvrir le récipient en plastique et placer le film plastique contenant le coton avec tous les pupes sur le papier laboratoire suintant l'intérieur de la propre cage de population. Fermez le filet avec un double nœud et nettoyer le récipient en plastique et le couvercle pour le prochain cycle.
NOTE: pupes apposé sur le couvercle doit être jeté et détruit par autoclavage ou le gel avant l'éclosion.
3. mouches adultes.
NOTE: Après les 4 jours de la chrysalide en scène les premières mouches vont émerger de la pupes. Dans 24-48 h toutes les mouches devraient avoir éclos. Dans cette partie du cycle, il est important de leur fournir de la nourriture dans le but de créer un environnement propice pour la reproduction.
- Préparer les plateaux de mélasse.
- Mélanger dans un ballon de 1 L 556,25 ml de H 2 O désionisée, 90 ml de mélasse, et 22 g d'agar - agar. Autoclave avec une barre d'agitation pendant 30 minutes, refroidir et ajouter 9,25 ml de 10% Tegosept dans 95% EtOH.
- Verser le mélange dans un plateau de viande de 21 x 14,5 cm. Assurez-vous que le volume est suffisant pour couvrir 15 - 17 plateaux. Attendre 10 - 20 min pour solidifier et couvrir chaque plateau d'un film plastique pour éviter le séchage. Plusieurs flacons de 1 L peuvent être préparés en même temps. Stocker les mélasse plateaux à 4 ºC enveloppés dans du plastique jusqu'à ce que nécessaire.
- Ajouter un plateau de mélasse couvert avec de la levure humide dans la cage avec les mouches adultes.
- Avant d'ajouter la plaque, placer la cage à 4 ° C dans la chambre froide pendant 30 min.
- Ajouter 200 ml de H 2 O désionisée dans un bêcher et versez lentement la levure sèche en remuant avec une cuillère. Arrêter l'addition de levure sèche lorsque le mélange devient à peu près la consistance du beurre d'arachide pour empêcher les mouches de se coincer dans la nourriture.
NOTE: Il est important de ne pas laisser la solution alimentaire pour solidifier sinon il sera très difficile de couvrirla mélasse plateau et d'extraire les oeufs pendant le processus de récolte (voir rubrique 4.3). - Retirez le film plastique d'une mélasse plateau et recouvrir d'une couche de la levure humide préparée frais à l'aide d'une cuillère ou d'une spatule. Assurez-vous que toute la surface est couverte.
- Alors que la cage est encore dans la chambre froide, ouvrez le net et soigneusement ajoutez la mélasse plateau avec de la levure humide dans la cage. Fermez le filet et placer la cage à la température ambiante.
NOTE: Il peut être utile pour couvrir la plaque avec un plateau de viande vide lors de l'insertion, mais veillez à ne pas bloquer l'accès des mouches à la mélasse plateau.
- Changer la plaque de nourriture tous les 24-48 heures pour éviter la levure pour obtenir trop sec. Les mouches adultes sont très sensibles à la dessiccation.
4. Fin du cycle: La récolte du Embryons
NOTE: La meilleure fertilité des mouches est 3 - 5 jours après l'éclosion. Par conséquent, la récolte pendant ce temps va obtenir le meilleur rendement de l'embryon. collections Après désirées sont completed, le cycle est terminé. Les mouches doivent être sacrifiés et la cage nettoyée comme spécifié à l'étape 2.2.
- En règle générale, 2 jours après la mouche eclosion, introduire une nouvelle mélasse plateau avec des aliments frais humide dans la cage, comme expliqué dans la section 3.2.5. Pour augmenter le rendement des oeufs dépôt, avec l'aide des doigts, rendre la surface de la levure humide aussi irrégulière que possible. Si un vieux plateau de nourriture est présente dans la cage, avant d'ajouter la nouvelle plaque, retirez soigneusement et jetez-le dans un sac biohazard. Une autre astuce pour augmenter le rendement est d'enlever la couche de coton de sorte que tous les oeufs seront pondus dans la nourriture. Maintenir la cage à la température ambiante.
- Observer les embryons que de petits points blancs.
NOTE: Les œufs sont prêts à être collectés. Pour l'entretien de routine de la cage à la mouche, 2 collection de jour est le temps recommandé. Cette collection contient principalement des embryons et quelques 1 er stade larvaire. Voir les résultats représentatifs des rendements typiques d'embryons récoltés pour divers COLLEdes points de temps ction. - Récolter les embryons
- Placer la cage dans la chambre froide pendant environ 30 min. Dans le même temps préparer le récipient en plastique et de la nourriture à la mouche pour le prochain cycle, comme expliqué dans la section 1.
- Dans un bac autoclave 8 L ajouter de l'eau à ¼ de la capacité totale, puis ajouter 1 ml de 10% de Triton X-100. Alors que la cage est dans la chambre froide retirer soigneusement la plaque de mélasse et le placer dans un sac biohazard.
- Retirez le plateau du sac et le plonger rapidement (pour empêcher les mouches de s'échapper) dans la solution de détergent dans le bac d'autoclave. Fermez le sac biohazard et mis dans un container prévu. Les mouches ne se noyer dans l'eau qui ne contient pas de détergent.
- Utilisez un pinceau large et distillé pistolet à eau pour se laver les embryons et la levure hors de la mélasse. Jeter des plaques et de la mélasse dans la boîte de biohazard.
- Verser la solution soigneusement à travers un ensemble tamis trois (tamis grossier 30 sur le dessus, 40 au milieu et 100 sur le fond). grumeaux Laver on top niveau distillée pistolet à eau jusqu'à ce qu'il ne reste des touffes.
NOTE: L'adulte vole et 3 ème stade larvaire sera retenu dans le tamis 30.- Rincez le plateau de l'autoclave avec de l'eau distillée et verser l'eau de rinçage à travers les tamis. Retirer le dessus tamis et répéter le processus si des touffes de levure restent. La plupart d' entre le 1 er et toutes les larves du 2 ème restera dans le tamis 40.
- Retirez le second tamis. Le matériau jaunâtre dans le troisième (inférieur) tamis est le mélange des embryons et des petits 1 er stade larvaire. Utiliser un pistolet à eau distillée pour déplacer tous les oeufs sur un côté du tamis. les Collecter avec une spatule et peser.
- Pendant ces cycles, le rendement de la collecte d'embryons / larves se situe entre 7 et 13 g. Utilisez seulement 1,5 g de ce matériau pour démarrer un nouveau cycle (section 1). Utilisez le reste des embryons pour un traitement ultérieur ou peut être mis au rebut.
5. AutresEn traitement
NOTE: Les embryons non utilisés pour la poursuite de la population peuvent être utilisées immédiatement pour des expériences ou bien peut être congelé à -80 ° C. Pour les deux options, il faudra peut d'abord être dechorionated les embryons.
- Pour dechorionation, laver les embryons pendant 2 min dans une solution d'eau de Javel à 50% et rincer abondamment à l'eau distillée.
- Pour congeler les embryons, d'abord à sec en appuyant fermement avec une serviette en papier, puis peser et les placer, avec l'aide d'une spatule, dans un tube conique de 15 ou 50 ml. Enfin immerger le tube conique dans N2 liquide pendant quelques secondes.
Résultats
Le maintien d'une population mouche de la cage est basé sur le cycle de vie de mouche. Par conséquent, après avoir placé le mélange biologique initial des embryons et des larves dans le récipient en matière plastique (figure 1A) , les oeufs fécondés vont devenir larves dans pas plus de 2 jours , et les larves se développeront pendant 4 jours, relativement synchronisées à travers les différentes étapes du stade larvaire ( voir la figure 1B).
Après les larves ont complété le stade 3 e stade larvaire ils pupifier et couvrir la surface du coton à l' intérieur du récipient en plastique avec un peu sur la surface interne du couvercle (figure 1C). Cette période de nymphose ira pour les 4 prochains jours jusqu'à ce que les mouches terminer le processus de métamorphose. Pendant cette période, il est fortement recommandé de transférer les mouches dans la cage. Les premières mouches adultes vont commencer à Eclose au jour 9 - 10 après lainitiation du cycle (figure 1D) et par jour 11 chacun d'entre eux aura émergé des pupes.
Le meilleur rendement de la collecte d'embryons est obtenu 3 - 5 jours après l'éclosion (jour 13 à 15) et diminue enfin en 17 jours (7 jours après l'éclosion). Par conséquent, il est recommandé d'ajouter le dernier plateau d'aliments frais au jour 13 et ramasser les oeufs au jour 15 (Figure 1E et F). Cela va permettre la collecte du nombre maximal d'embryons. L' ajout d' un troisième jour supplémentaire avant la collecte peut conduire à la nourriture est trop sec et par conséquent , va diminuer le rendement en embryons collectés. Le tableau 1 indique le rendement en 6 collections de cycles consécutifs, avec un matériau de départ de 1,5 g dans chaque cycle, et la figure 2 est le calendrier recommandé pour une collection de cycle entier.
Le matériel récolté en deux jours60; périodes est principalement composée d'embryons. Cependant, un petit nombre de larves sont également présents. À des fins d'entretien de la cage de ces larves ne sont pas un problème car un certain degré d'asynchronisme est attendue. Néanmoins, pour certaines expériences, de biochimie, de la pureté de ces embryons est très important, mais en même temps, il est également nécessaire de recueillir de grandes quantités d'oeufs pour effectuer ces expériences. Pour cette raison , plusieurs collections consécutives courtes ont été effectuées à 1 h et 3 h, après avoir ajouté rapidement à la température ambiante une nouvelle plaque avec de la nourriture, de fournir une estimation du rendement et la pureté qui peut être obtenu avec cette méthode (tableau 2 et figure 3) . Les 1 h collections consécutives ont commencé avec un rendement très faible (14,5 mg) mais les quantités d'embryons a augmenté pour chaque fois collectés, mais la dernière fois. Le faible rendement à première peut être due à vol étant souligné au cours du processus de changement de la nourriture, mais plus tard, l'acclimatation. D'autre part, aucune larvae ont été observées dans les cinq collections séquentielles (figure 3A), montrant que les collections plus courtes donnent une plus grande pureté. Si le coton est pas retiré de la cage, la probabilité que les larves de points de temps antérieurs restera et entrez la nouvelle plaque est augmentée. Même lorsque le coton est enlevé, parfois les larves vont se promener sur le côté de la cage et entrer dans la nourriture pendant une collection.
Pour les 3 h collections consécutives, le rendement varie de 840 à 1250 mg, ce qui est environ 10 fois plus que les rendements obtenus dans les collections 1 hr. La pureté de ces embryons était proche de 100% (figure 3B). Les larves occasionnels ont été observées. Certaines études de développement nécessitent une synchronisation très stricte pour les embryons collectés. Pour augmenter la pureté de synchronisation, il est recommandé de jeter la première plaque de collecte parce que si les conditions ne sont pas idéales, les femelles peuvent conserver les œufs plus matures et déposent lam lorsque les conditions améliorent, par exemple avec l'introduction d'une nouvelle plaque. En outre, il est important de savoir que plus âgés mouches adultes (> 6 jours) produisent des embryons moins synchronisés. Pour vérifier le degré de synchronisation avec une grande précision, une coloration DAPI des embryons collectés est recommandé.

Figure 1. Le cycle Drosophila melanogaster vie dans une mouche Population Cage. (A) Initiation du cycle d' ensemencement de 1,5 g d'embryons dans le récipient de boîte en plastique. A titre de référence, dans le panneau inférieur, la longueur du papier filtre est de 8,5 cm. (B) Larves croissance relativement synchronisée 5 jours après le début du cycle. (C) Au jour 8, la plupart des mouches sont au stade de la chrysalide. Les panneaux inférieurs B (B ') et C (C ') sont grossissements des zones indiquées dans les panneaux supérieurs. Mouches (D) adultes ont émergé des pupes 10 jours après le début du cycle. (E) mouches adultes dans la cage de la population avant de commencer le processus de collecte des embryons, au jour 15. Le matériau jaunâtre sur la nourriture à la mouche sont des œufs fécondés. (F) Embryons (et quelques larves) recueilli au fond du tamis 100 grossier, après un cycle de cage ensemble. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
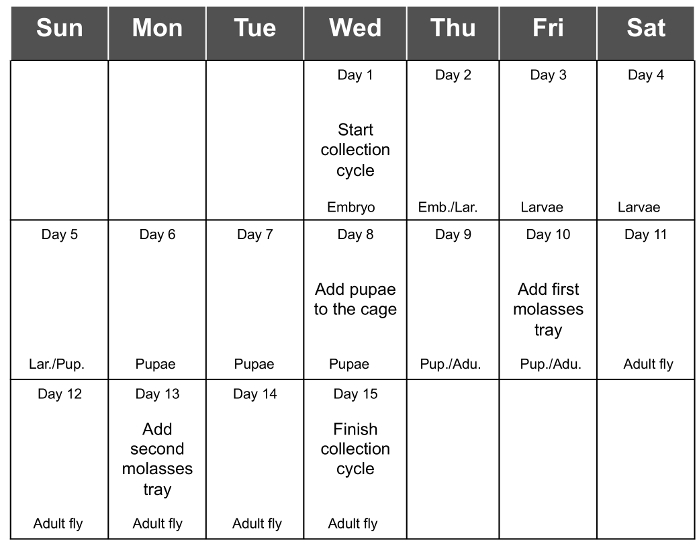
Figure 2. Le total de l' annexe de la collection de Cycle. La figure 2 montre le calendrier recommandé pour une collection complète de cycle. t = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
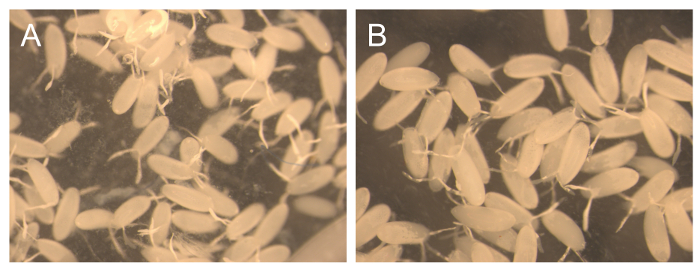
Figure 3. Pureté de 1 h et 3 h collections consécutives. Représentant l' image des embryons collectés à 1 h (A) et 3 h (B) après avoir ajouté un nouveau plateau de nourriture. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Numéro de cycle | Rendement (g) |
| 1 | 10.3 |
| 2 | 9.5 |
| 3 | 10.3 |
| 4 | 12.7 |
| 5 | dix |
| 6 | 7.1 |
| Collection # | Durée de la collection (hr) | Rendement (mg) |
| 1 | 1 | 14.5 |
| 2 | 1 | 21,6 |
| 3 | 1 | 56.1 |
| 4 | 1 | 160,1 |
| 5 | 1 | 106,1 |
| 1 | 3 | 960 |
| 2 | 3 | 840 |
| 3 | 3 | 1250 |
Tableau 2. Rendement de 1 h et 3 h Collections consécutives. Le tableau 2 montre le rendement de 5 collections consécutives 1 h après l' ajout de nouveaux aliments et de 3 collections consécutives 3 heures après avoir placé une nouvelle plaque de mélasse.
Discussion
À partir de 1,5 g de matière on peut obtenir un rendement d'embryons collectés entre 7 et 13 g par cycle. Pour obtenir une telle quantité de matériau, il est essentiel de maintenir les conditions de culture adéquates pour tous les stades du cycle de mouche.
Les paramètres les plus importants sont la température et l'humidité, ce qui devrait être de 24 ° C et 35% respectivement. Si ces deux paramètres ne peuvent pas être maintenus constants dans l'environnement normal du laboratoire, une possibilité serait de placer la cage à la mouche dans un incubateur ou une chambre environnementale. D' autres protocoles recommandent 70% d' humidité et aussi un cycle constant de lumière-obscurité de 24 heures pour augmenter le rendement des œufs produits 9,10. Cependant en gardant l'humidité autour de 35% évite la contamination bactérienne, et puisque le but de ce protocole est que le maintien d'une cage de la population, les mouches sont conservés dans l'environnement lumière normale du laboratoire.
Un autre point important est de garder disturbances à l'adulte vole aussi bas que possible. Il peut être conseillé de garder la cage dans un endroit séparé de la salle de volée pour éviter la contamination croisée d'autres mouches.
La mise en culture de grandes populations de mouches mutantes transgéniques et est déconseillé, car il est très difficile de maintenir leur pureté et elles peuvent présenter un comportement anormal d'accouplement prononcé dans les grandes cages de population 14.
Un problème possible en culture de Drosophila en grandes quantités est la présence d'autres organismes tels que les acariens et / ou de moisissures, qui seront en compétition pour la nourriture et donc de réduire le rendement des œufs produits. Pour éviter cela, il est très important de garder tout l'équipement propre, le lavage de la cage, filets et voler des boîtes avec de l'eau et du savon, et à rejeter le matériel jetable (des bouchons en mousse) après chaque cycle. Pour réduire la moisissure, propionique et l'acide phosphorique sont ajoutés dans la levure humide lors de la préparation de la nourriture à la mouche dans l'étape1.2 et Tegosept lors de la préparation de la mélasse plateau dans l'étape 3.1. Il est parfois utile de placer des matériaux tels que la boîte en plastique ou en tamis -20 ° C lorsque le temps est court et les matériaux ne peut pas être nettoyé immédiatement.
Un cycle de toute la collection se produit dans 14 - 15 jours, en commençant lorsque les embryons sont ensemencées dans la boîte de mouche et se terminant le dernier jour de la collecte. Pendant cette période de temps, il est recommandé d'organiser un calendrier afin de se rappeler toutes les étapes nécessaires à l'entretien d'une cage à la mouche de la population (Fig. 2), détaillées dans la section de protocole. Depuis le jour où les œufs sont ensemencées, jusqu'à ce que les mouches adultes émergent, il est seulement nécessaire d'inspecter la boîte en plastique, et quand la nymphose a lieu, pour les placer dans la cage. Après cela, les mouches doivent être alimentés tous les 2 - 3 jours jusqu'à ce que les embryons sont ensemencés pour un nouveau cycle. Dans le protocole ensemble, est le plus long jour lors de la collecte et l'ensemencement des embryons pour le démarrage d'un nouveau cycle. UNEs commenté dans le protocole, le meilleur rendement de l'œuf est 3 - 5 jours après l'éclosion des adultes, et diminue finalement 2 jours plus tard. Cela nous donne une certaine souplesse afin de choisir le jour où la récolte des oeufs sera effectuée.
Si pour une raison quelconque, le rendement des embryons collectés est inférieur au montant de départ souhaité (1,5 g), on peut toujours ajouter une nouvelle mélasse plateau et de recueillir plus d'oeufs le lendemain. Pour les collections constants, il est recommandé de maintenir 2 cages en parallèle, et si des quantités plus élevées d'embryons sont nécessaires, il est également possible d'utiliser de plus grandes cages. En cas de faire des collections de courte durée, une façon d'augmenter le rendement est de tirer parti de l'éclatement de la ponte dans la matinée.
Il existe de nombreux avantages de la collecte de grandes quantités de divers stades de développement. Par exemple, les embryons prélevés dans les cages de la population ont été utilisées avec succès dans des essais d'immunoprécipitation 6-8, collectio massen des tissus larvaires de larves dissocié a démontré être une très bonne source pour 3C expériences 4 et préparations d'ARN 15 et têtes de mouches adultes ont été utilisées pour des expériences de ChIP 16. En outre, les adultes sont souvent nécessaires pour faire des extraits de mouches pour la culture de tissus 17.
L'une des applications les plus prometteuses de la cage est de fournir du matériel pour des essais à haut débit qui permettent l'analyse et le dépistage des gènes, des transcriptions, des protéines et des métabolites en réponse à l'exposition des agents pathogènes, des molécules biologiques, des substances chimiques et des rayonnements ionisants. Dans ces essais à grande échelle un grand nombre de personnes sont nécessaires, et la cage de population de mouches décrit ici peuvent être très utiles pour obtenir de grandes quantités de matériel au cours des différentes phases du cycle de vie de Drosophila pour leur analyse et de dépistage 18.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank Yixian Zheng (Carnegie Institution of Washington, Baltimore, MD) for the original protocol and assistance in initial setup and members of the Lei laboratory for critical reading of the manuscript. This work was funded by the Intramural Research Program of the National Institute of Diabetes and Digestive and Kidney Diseases.
matériels
| Name | Company | Catalog Number | Comments |
| Bacto-Agar | Beckton Dickinson | 214010 | |
| Curity practical cotton roll | Kendall | 2287 | |
| Dry yeast | Affymetrix | 23540 | |
| Filter paper | GE Healthcare Life Science | 1001-085 | |
| Foam tube plugs | Jaece | L800-D2 | 50 mm Diameter x 55 mm Length |
| Fly population cage | Flystuff | 59-116 | 9″ Diameter x 14.4″ Length. Includes the nets for the cage. |
| Meat tray | Genpak | 1002S (#2S) | 8.25 x 5.75 x 0.5 inches |
| Molasses | Grandma´s | ||
| Plastic container | Rubbermaid | 4022-00 | |
| Plastic film | Glad | ||
| Phosphoric acid | Fisher Scientific | S 93326 | Toxic. Handle in Chemistry Hood |
| Propionic acid | Fisher Scientific | A258-500 | Toxic. Handle in Chemistry Hood |
| Stainless steel sieve #100 | VWR | 57324-400 | |
| Stainless steel sieve #40 | VWR | 57324-272 | |
| Stainless steel sieve #30 | VWR | 57324-240 | |
| Sucrose | MP | 152584 | |
| Tegasept | LabScientific | FLY5501 | |
| Triton-X100 | Fisher Scientific | BP151-500 |
Références
- Lim, S. J., Boyle, P. J., Chinen, M., Dale, R. K., Lei, E. P. Genome-wide localization of exosome components to active promoters and chromatin insulators in Drosophila. Nucleic Acids Res. 41, 2963-2980 (2013).
- Ong, C. T., Van Bortle, K., Ramos, E., Corces, V. G. Poly(ADP-ribosyl)ation regulates insulator function and intrachromosomal interactions in Drosophila. Cell. 26, 148-159 (2013).
- Gonzalez, I., Mateos-Langerak, J., Thomas, A., Cheutin, T., Cavalli, G. Identification of regulators of the three-dimensional polycomb organization by a microscopy-based genome-wide RNAi screen. Mol Cell. 8, 485-499 (2014).
- Magbanua, J. P., Runneburger, E., Russell, S., White, R. A variably occupied CTCF binding site in the ultrabithorax gene in the Drosophila bithorax complex. Mol Cell Biol. 35, 318-330 (2014).
- Maksimenko, O. Two new insulator proteins, Pita and ZIPIC, target CP190 to chromatin. Genome Res. 25, 89-99 (2015).
- Lei, E. P., Corces, V. G. RNA interference machinery influences the nuclear organization of a chromatin insulator. Nat Genet. 38, 936-941 (2006).
- Matzat, L. H., Dale, R. K., Moshkovich, N., Lei, E. P. Tissue-specific regulation of chromatin insulator function. PLoS Genet. 8, e1003069 (2012).
- King, M. R., Matzat, L. H., Dale, R. K., Lim, S. J., Lei, E. P. The RNA-binding protein Rumpelstiltskin antagonizes gypsy chromatin insulator function in a tissue-specific manner. J Cell Sci. 1, 2956-2966 (2014).
- Sisson, J. C. Culturing large populations of drosophila for protein biochemistry. Cold Spring Harb Protoc. , (2007).
- Shaffer, C. D., Wuller, J. M., Elgin, S. C. Raising large quantities of Drosophila for biochemical experiments. Methods Cell Biol. 44, 99-108 (1994).
- Roberts, D. B., Standen, G. N., Roberts, D. B. The elements of Drosophila biology and genetics. Drosophila: A practical approach. , 1-53 (1998).
- Ashburner, M., Roote, J. Culture of Drosophila: The laboratory setup. Cold Spring Harb Protoc. , (2007).
- Dahlberg, O., Shilkova, O., Tang, M., Holmqvist, P. H., Fb Mannervik, M. P-TEb, The super elongation complex and mediator regulate a subset of non-paused genes during early Drosophila embryo development. PLOS Genet. 13, e1004971 (2015).
- Zhang, S. D., Odenwald, W. F. Misexpression of the white (w) gene triggers male-male courtship in Drosophila. Proc Natl Acad Sci USA. 6, 5525-5529 (1995).
- Chak, L. L., Mohammed, J., Lai, E. C., Tucker-Kellogg, G., Okamura, K. A deeply conserved, noncanonical miRNA hosted by ribosomal DNA. RNA. 21, 375-384 (2015).
- Moshkovich, N., Lei, E. P. HP1 recruitment in the absence of argonaute proteins in Drosophila. PLOS Genet. 12, e1000880 (2010).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol Rev. 63, 411-436 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon