Method Article
Manutenção de um
Neste Artigo
Resumo
This manuscript reports a detailed protocol for culturing, on a regular basis, a population of Drosophila melanogaster using a fly population cage.
Resumo
Large quantities of DNA, RNA, proteins and other cellular components are often required for biochemistry and molecular biology experiments. The short life cycle of Drosophila enables collection of large quantities of material from embryos, larvae, pupae and adult flies, in a synchronized way, at a low economic cost. A major strategy for propagating large numbers of flies is the use of a fly population cage. This useful and common tool in the Drososphila community is an efficient way to regularly produce milligrams to tens of grams of embryos, depending on uniformity of developmental stage desired. While a population cage can be time consuming to set up, maintaining a cage over months takes much less time and enables rapid collection of biological material in a short period. This paper describes a detailed and flexible protocol for the maintenance of a Drosophila melanogaster population cage, starting with 1.5 g of harvested material from the previous cycle.
Introdução
A capacidade de combinar abordagens genéticas e bioquímicas fez Drosophila um organismo particularmente adequada para Bioquímica e Biologia Molecular estudos 1-3. Estes estudos muitas vezes exigem grandes quantidades de material biológico, não só a partir de moscas adultas, mas também de larvas 4, pupas 5 e embriões 6-8. Para obter grandes quantidades de material, os pesquisadores têm moscas cultivadas usando recipientes grandes conhecidos como voar "gaiolas população". Estas gaiolas consistem de um cilindro feito de plástico coberta por uma rede em ambos os lados para permitir a introdução do alimento no interior da gaiola, sem as moscas que escapam. Essas gaiolas podem ser caseiros 9-11 ou comprado de uma empresa (veja a tabela de materiais específicos / equipamento).
Uma das principais vantagens da utilização deste sistema para crescer um grande número de moscas é que o ciclo de mosca da fruta 12 pode ser controlada de uma maneira que todas as moscas desenvolver em um relatively sincronizado maneira. Essa sincronização é conseguida semeando novos embriões, alimentando larvas / moscas e sacrificar as moscas adultas em momentos precisos. Usando uma população de moscas sincronizados é particularmente útil para estudos de desenvolvimento 13.
O início de uma nova gaiola população de algumas moscas é um processo demorado que requer muitos ciclos de amplificação 9-11. Mesmo usando maiores recipientes como garrafas de cultura mosca ou minicages, todo o processo pode durar meses. Para evitar este passo demorado, muitos laboratórios de Drosophila manter regularmente essas gaiolas. É mais conveniente para iniciar uma nova gaiola a partir de uma colheita de embriões a partir de uma população gaiola já estabelecida. Em geral, a maioria dos laboratórios manter gaiolas população de tipo selvagem, tais como Oregon R ou S. Canton Este manuscrito apresenta um protocolo detalhado para manter gaiolas população de moscas.
Protocolo
1. Iniciar o ciclo: Embriões de sementeira
NOTA: O ciclo inicia-se com 1,5 g de material recolhido (uma mistura composta de embriões e / ou algumas larvas de primeiro estádio) a partir do ciclo anterior. Este material vai ser colocado num recipiente de plástico (ver tabela de materiais específicos / equipamento) com uma mistura de fermento activo até que a fase de pupa. O recipiente é fechado depois da introdução da mistura biológica de embriões e larvas com a tampa para evitar que as larvas de escapar. É necessário fazer furos na tampa, a fim de permitir a circulação de ar. Para evitar ter de escape larvas através dos orifícios, tampões de espuma são utilizados. Finalmente, recomenda-se usar luvas e bata de laboratório, não só nesta seção, mas também em todo o protocolo, para evitar que a roupa suja ou de coloração com lixívia.
- Configure o recipiente de plástico.
- Adicione três furos quadrados com uma lâmina de barbear na tampa do recipiente de plástico de umproximadamente 2,2 cm. Adicionar fita (fita de rotulagem de 3/4 de polegada) para os quatro cantos de cada orifício para assegurar um ajuste apertado para os tampões de espuma (50 x 55 mm, dxl), e, em seguida, colocar um tampão de espuma em cada buraco.
- Cobrir o interior do recipiente de plástico com plástico. Sobre esta película, adicionar uma camada de algodão para cobrir o fundo do recipiente de plástico. Rasgar o algodão com os dedos.
- Preparar a comida mosca.
- Adicionar 333 ml de água desionizada num copo de 500 ml. Enquanto se agitava a proveta com uma barra magnética, adicionar 167 mL de ácido propiónico e 1,08 ml de ácido fosfórico, a partir das soluções de reserva (99,96% e 85%, respectivamente).
- Lentamente, adicionar 77,5 g da levedura seca, evitando grandes aglomerações. Depois de dissolver a levedura seca, adicionar 38,8 g de sacarose.
NOTA: Sacarose deve ser o último ingrediente a ser adicionado, porque imediatamente após a adição desse componente, a fermentação começa.
- Imediatamente após a dissolução da sacarose, o derramealimentos sobre o algodão, e certifique-se para cobrir o algodão uniformemente. Fechar o recipiente de plástico com a tampa para evitar moscas escaparam dentro do laboratório contaminando a comida.
- Ressuspender 1,5 g de os embriões colhidos (não dechorionated) a partir do ciclo anterior com 5 ml de etanol a 70%. Cortado ao meio dois papéis de filtro e distribuir a mistura biológica uniformemente ao longo dos 4 pedaços usando uma espátula ou uma pipeta de transferência com uma grande ponta (corte se necessário). Coloque os papéis de filtro na parte superior do algodão embebido e feche a tampa. Finalmente, o recipiente de plástico incubar à TA (24ºC) e humidade (35%) até que a fase de pupa.
NOTA: O recipiente de plástico não devem ser colocadas numa câmara húmida, de modo que esta vai estimular o crescimento de bactérias.
2. Continuação do Ciclo: a partir de embriões de moscas.
NOTA: Esta parte do ciclo continua a partir dos embriões colocados no recipiente de plástico, no dia 1 até 9 dias mais tarde, quando as moscas adultas surgirãodo pupas. Durante estes 8 dias nada a ser feito, mas o acompanhamento que os embriões progredir corretamente para as próximas fases do ciclo de vida Drosophila até a eclosão. Se as larvas começam a morrer e se tornando negro durante este tempo, verifique se os plugs de espuma não estão muito apertadas e que haja uma ventilação adequada. Este período é um bom momento para limpar a gaiola população de moscas do ciclo anterior.
- Observar os embriões tornam-se 1 larvas st cerca de 24 horas após a fêmea adulta depositou-os na comida mosca (veja o passo 3). As larvas resultante irá alimentar a partir dos alimentos mosca preparada no passo 1 durante 4 dias, crescendo e muda duas vezes em 2 e 3 de larvas rd instar.
- Limpar a gaiola população de moscas.
- Coloque a gaiola a 4 ° C durante pelo menos 30 min para abrandar a actividade das moscas. Remover o líquido que está cobrindo um lado da jaula, e com um movimento rápido, a tampa do lado aberto com um grande risco biológico de plásticoBolsa. Verter o conteúdo da gaiola dentro do saco.
- Com o saco de risco biológico ainda cobrindo um lado da jaula, posicionar a gaiola verticalmente sobre uma pia com saco lateral do risco biológico para baixo. Retire cuidadosamente o saco plástico para evitar moscas escapando e descartá-lo em um recipiente de resíduos de risco biológico.
- abra cuidadosamente o líquido superior o suficiente para criar um pequeno buraco, lavar o interior da gaiola com água, que vai lavar as moscas na pia. Lentamente, aumentar o tamanho do buraco e eliminar todas as moscas dentro da gaiola.
- Limpar a gaiola e as duas redes com água e sabão. Enquanto as redes ainda estão molhadas fixá-los em ambos os lados da gaiola limpo e seco e, finalmente, colocar dentro de um papel de laboratório de imersão, o que impedirá o filme plástico preparado no passo 1.1.2 de degola para a gaiola. Agora, a gaiola está pronto para o próximo ciclo.
- Quatro dias após a configuração inicial, observar o pupate larvas. As larvas permanecem nesta fase por mais 4 dias.
NOTADOurante esta fase da pupa vai cobrir a superfície de algodão inteiro dentro do recipiente de plástico. - Durante a fase de pupa e antes do primeiro moscas emergem, abrir o recipiente de plástico e colocar a película de plástico que contém o algodão com todas as pupas sobre o papel de imersão de laboratório dentro da gaiola população limpo. Feche o líquido com um nó duplo e limpar o recipiente de plástico e a tampa para o próximo ciclo.
NOTA: As pupas afixada na tampa deve ser descartada e destruída por autoclavagem ou congelamento antes da eclosão.
3. moscas adultas.
NOTA: Após os 4 dias da pupa andares, o primeiro moscas vai sair da pupa. Dentro de 24-48 hr todas as moscas deveria ter eclosed. Nesta parte do ciclo, é importante proporcionar-lhes alimentos com o objectivo de criar o ambiente certo para a reprodução.
- Preparar as bandejas de melaço.
- Combinar num balão de 1 L 556,25 ml de H2O desionizada, 90 ml de melaço, e 22 g de ágar. Autoclave com uma barra de agitação durante 30 min, arrefecer e adicionar 9,25 mL de 10% Tegosept em 95% de EtOH.
- Despeje a mistura em uma bandeja de carne de 21 x 14,5 cm. Verifique se o volume é suficiente para cobrir 15 - 17 bandejas. Esperar 10 - 20 minutos para solidificar e cobrir cada bandeja com uma película de plástico para evitar a secagem. Vários frascos de 1 L podem ser preparados ao mesmo tempo. Armazenar as bandejas de melaço a 4 ºC embrulhado em plástico até ser necessário.
- Adicionar uma bandeja melaço coberto com levedura molhada dentro da gaiola com as moscas adultas.
- Antes de adicionar o prato, coloque a gaiola a 4 ºC na câmara fria durante 30 minutos.
- Adicionar 200 ml de H2O desionizada para um copo e lentamente verter levedura seca, com agitação com uma colher. Interromper a adição de levedura seca, quando a mistura torna-se aproximadamente a consistência de manteiga de amendoim para evitar moscas ficar preso na comida.
NOTA: É importante não permitir que a solução alimentar para solidificar caso contrário, será muito difícil para cobriro melaço bandeja e extrair os ovos durante o processo de colheita (ver secção 4.3). - Remover a película de plástico a partir de um tabuleiro de melaço e cobri-lo com uma camada de levedura fresca húmida preparada usando uma colher ou espátula. Certifique-se de que toda a superfície é coberta.
- Enquanto a gaiola está ainda na câmara fria, abrir o líquido e adicionar cuidadosamente o tabuleiro de melaço com fermento húmido para dentro da gaiola. Fechar a rede e colocar a gaiola à TA.
NOTA: Pode ser útil para cobrir a placa com uma bandeja de carne vazia durante a inserção, mas não se esqueça de bloquear o acesso das moscas para a bandeja de melaço.
- Mudar a placa de alimentos a cada 24-48 horas para evitar o fermento para ficar muito seco. moscas adultas são muito sensíveis à dessecação.
4. Fim do Ciclo: Colhendo os embriões
NOTA: A melhor fertilidade mosca é de 3 - 5 dias após a eclosão. Portanto, a colheita durante este tempo vai obter o melhor rendimento do embrião. coleções Após desejados são completed, o ciclo é longo. As moscas deve ser sacrificado e a gaiola feita conforme especificado no passo 2.2.
- Normalmente, 2 dias após a eclosão da mosca, introduzir uma nova melaço bandeja com comida molhada fresca na gaiola, conforme explicado na secção 3.2.5. Para aumentar o rendimento da deposição de ovos, com a ajuda dos dedos, tornar a superfície do fermento molhado como irregulares quanto possível. Se uma bandeja de comida velha está presente na gaiola, antes de adicionar a nova placa, remova-o com cuidado e descartá-lo em um saco de risco biológico. Outra dica para aumentar o rendimento é remover a camada de algodão para que todos os ovos serão colocados no alimento. Manter a gaiola à TA.
- Observe os embriões como pequenos pontos brancos.
NOTA: Os ovos estão prontos para serem recolhidos. Para manutenção de rotina da gaiola mosca, coleta de 2 dias é o tempo recomendado. Esta coleção irá conter principalmente embriões e alguns 1 larvas st. Veja resultados representativos para os rendimentos típicos de embriões colhidos para vários collepontos de tempo cção. - Colher as embriões
- Coloque a gaiola na câmara fria por cerca de 30 min. No tempo médio preparar o recipiente de plástico e a comida mosca para o próximo ciclo, como explicado na secção 1.
- Em uma autoclave de bandeja 8 L adicionar água a ¼ da capacidade total e, em seguida, adicionar 1 ml de 10% Triton X-100. Enquanto a gaiola está na sala fria remova cuidadosamente a placa de melaço e colocá-lo dentro de um saco de risco biológico.
- Remova a bandeja do saco e submergi-lo rapidamente (para evitar moscas de escapar) na solução de detergente na gaveta do autoclave. Feche o saco de risco biológico e colocar em um recipiente de risco biológico. Moscas não vai se afogar em água que não contenha detergente.
- Use um pincel grande e pistola de água destilada para lavar os embriões e levedura fora de melaço. Descartar placas e melaço na caixa de risco biológico.
- Despeje solução cuidadosamente através de um conjunto de três peneira (mais grosseira crivo 30 no topo, 40 no meio e 100 na parte inferior). aglomerados de lavagem Sn nível superior com injetor de água destilada até que não haja aglomerados permanecem.
NOTA: O moscas adultas e larvas 3 rd será retida na peneira 30.- Lavar a bandeja de autoclave com água destilada e despeje a água de lavagem através das peneiras. Remover superior processo de peneira e repita se contiver pedaços de leveduras permanecem. A maior parte do 1 r e todas as larvas instar 2 ND permanecerá na peneira 40.
- Retirar o segundo crivo. O material amarelado na (parte inferior) terceira peneira é a mistura de embriões e pequeno 1 larvas st. Use pistola de água destilada para mover todos os ovos para um dos lados da peneira. Recolha-os com uma espátula e pesar.
- Durante estes ciclos de o rendimento de recolha de embriões / larvas varia entre 7 e 13 g. Use apenas 1,5 g deste material para iniciar um novo ciclo (seção 1). Usar o resto dos embriões para processamento adicional ou podem ser descartados.
5. DemaisEm processamento
NOTA: Os embriões não utilizados para a continuação da população pode ser usado imediatamente para experiências ou, alternativamente, pode ser congelado a -80 ºC. Para ambas as opções, os embriões podem precisar de ser primeiro dechorionated.
- Para dechorionation, lave os embriões por 2 min em solução de água sanitária 50% e enxaguar abundantemente com água destilada.
- Para congelar os embriões, primeiro secar pressionando firmemente com uma toalha de papel, e em seguida pesar e colocá-los, com a ajuda de uma espátula, em um 15 ou tubo de 50 ml. Finalmente submergir o tubo cónico em N2 líquido durante alguns segundos.
Resultados
A manutenção de uma população de moscas gaiola baseia-se no ciclo de vida da mosca. Portanto, após a colocação da mistura biológica inicial dos embriões e larvas no recipiente de plástico (Figura 1A) os ovos fertilizados se tornará larvas em não mais do que dois dias e as larvas irão crescer durante 4 dias, relativamente sincronizado através das diferentes fases de larvas instar ( ver Figura 1B).
Depois de as larvas tenham completado o 3 rd instar fase larval eles vão pupate e cobrir a superfície do algodão no interior do recipiente de plástico com alguma na superfície interna da tampa (Figura 1C). Este período pupation vão para os próximos 4 dias até que as moscas concluir o processo de metamorfose. Durante este período, é altamente recomendável para transferir as moscas na gaiola. Os primeiros moscas adultas vai começar a EFeche no dia 9-10 após ainício do ciclo (Figura 1D) e dia 11 todos eles surgiram a partir da pupa.
O melhor rendimento do conjunto de embriões é obtida 3 - 5 dias após a eclosão (dias 13 a 15) e, finalmente, diminui no dia 17 (7 dias após a eclosão). Portanto, recomenda-se adicionar a última bandeja de alimentos frescos no dia 13 e recolher os ovos no dia 15 (Figura 1E e F). Isto irá permitir a recolha de o número máximo de embriões. A adição de um terceiro dia extra, antes de recolher pode resultar no alimento ser demasiado seco e, consequentemente, diminuir o rendimento de embriões recolhidos. A Tabela 1 apresenta o rendimento de 6 colecções de ciclo consecutivos, com um material de partida de 1,5 g em cada ciclo, e a Figura 2 é a programação recomendada para uma coleção ciclo todo.
O material colhido em dois dias60; períodos é na sua maioria composta de embriões. No entanto, um pequeno número de larvas são também presente. Para efeitos de manutenção gaiola estas larvas não são um problema, uma vez que é esperado algum grau de assincronia. No entanto, para algumas experiências bioquímica, a pureza destes embriões é muito importante, mas, ao mesmo tempo que também é necessário recolher grandes quantidades de ovos de realizar estas experiências. Por esta razão várias colecções consecutivos curtos foram realizadas a 1 h e 3 h, depois adicionar rapidamente à TA uma nova placa com os alimentos, para fornecer uma estimativa do rendimento e a pureza que pode ser obtida com este método (Tabela 2 e Figura 3) . Os 1 hr coleções consecutivas começou com um rendimento muito baixo (14,5 mg), mas, em seguida, as quantidades de embriões aumento para cada vez recolhido, mas a última vez. O baixo rendimento no início pode ser devido a que as moscas que está sendo forçada durante o processo de mudança da comida, mas mais tarde se aclimatando. Por outro lado, não LarVAE foram observados nos cinco colecções sequenciais (Figura 3A), que mostra que colecções mais curtos se obter uma pureza mais elevada. Se o algodão não é retirado da gaiola, a probabilidade de que as larvas de pontos de tempo anteriores permanecerá e introduzir a placa fresca é aumentada. Mesmo quando o algodão é removido, por vezes larvas irão caminhar sobre o lado da gaiola e entrar no alimento durante a recolha.
Para os 3 hr coleções consecutivas, o rendimento variou 840-1250 mg, que é cerca de 10 vezes mais do que os rendimentos obtidos nas coleções hr 1. A pureza destes embriões foi próximo de 100% (Figura 3B). Foram observadas larvas ocasional. Alguns estudos de desenvolvimento requerem uma sincronização muito rigoroso para os embriões colhidos. Para aumentar a pureza de sincronização, é recomendado para descartar a primeira placa de recolha porque, se as condições não são ideais, as fêmeas podem reter mais ovos maduros e depositar om quando as condições de melhorar, por exemplo, com a introdução de uma placa fresca. Também é importante saber que as moscas adultas mais velhas (> 6 dias) produzir embriões menos sincronizados. Para verificar o grau de sincronização com alta precisão, uma coloração DAPI dos embriões colhidos é recomendado.

Figura 1. O Ciclo de Drosophila melanogaster Life in a Fly População Cage. (A) Início do ciclo de semeadura de 1,5 g de embriões para o recipiente caixa de plástico. Como uma referência, no painel inferior, o comprimento do papel de filtro é de 8,5 cm. (B) larvas em desenvolvimento relativamente sincronizado 5 dias após o início do ciclo. (C) No dia 8, a maior parte das moscas estão na fase de pupa. Os painéis inferiores em B (B) e C (C ') são ampliações das áreas indicadas nos painéis superiores. Moscas (D) Adulto emergiu da pupas 10 dias após o início do ciclo. (E) Adulto voa dentro da gaiola população antes de iniciar o processo de recolha dos embriões, no dia 15. O material amarelado na comida mosca são ovos fertilizados. (F) Embriões (e um larvas alguns) recolhido na parte inferior da peneira 100 grosseiro, depois de um ciclo de gaiola todo. Por favor clique aqui para ver uma versão maior desta figura.
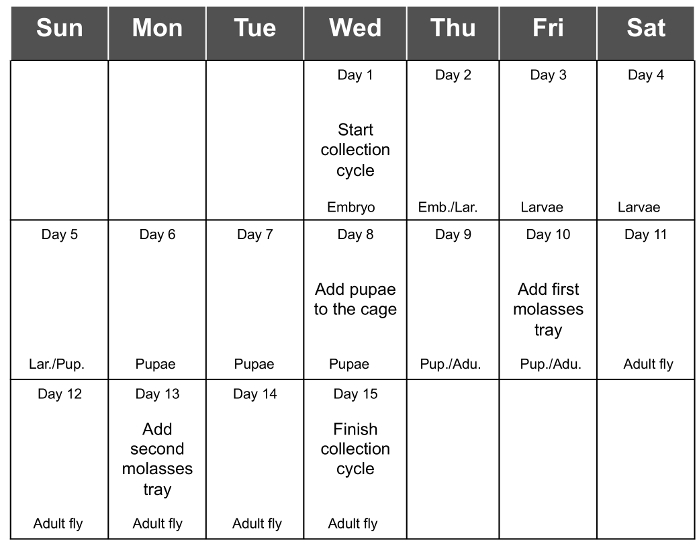
Figura 2. Toda Coleção Ciclo de Programação. A Figura 2 mostra o esquema recomendado para um ciclo completo de recolha. t = "_ blank"> Clique aqui para ver uma versão maior desta figura.
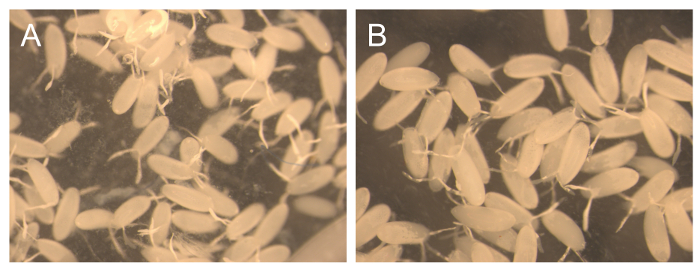
Figura 3. Pureza de 1 hora e 3 horas coleções consecutivos. Imagem representativa dos embriões colhidos em 1 hr (A) e 3 horas (B) após a adição de uma nova bandeja de comida. Por favor clique aqui para ver uma versão maior desta figura.
| número do ciclo | Rendimento (g) |
| 1 | 10.3 |
| 2 | 9.5 |
| 3 | 10.3 |
| 4 | 12,7 |
| 5 | 10 |
| 6 | 7.1 |
| Coleção # | Comprimento de coleta (hr) | Rendimento (mg) |
| 1 | 1 | 14,5 |
| 2 | 1 | 21,6 |
| 3 | 1 | 56,1 |
| 4 | 1 | 160,1 |
| 5 | 1 | 106,1 |
| 1 | 3 | 960 |
| 2 | 3 | 840 |
| 3 | 3 | 1250 |
Tabela 2. Rendimento de 1 hora e 3 horas consecutivos Collections. A Tabela 2 mostra o rendimento de 5 coleções consecutivos 1 hora após a adição de novos alimentos e 3 coleções consecutivos de 3 horas depois de colocar uma nova placa de melaço.
Discussão
Começando com 1,5 g de um material pode obter um rendimento de embriões recolhidos entre 7 e 13 g por ciclo. Para obter uma tal quantidade de material que é crucial para manter as condições de cultura adequadas para todas as fases do ciclo de mosca.
Os parâmetros mais importantes são a temperatura e umidade, que deve ser de 24 ºC e 35%, respectivamente. Se estes dois parâmetros não pode ser mantido constante no ambiente normal do laboratório, uma possibilidade seria a de colocar a gaiola mosca em uma incubadora ou numa câmara ambiental. Outros protocolos recomendado 70% de humidade e também um ciclo de luz-escuro de 24 h constante para aumentar o rendimento dos ovos produzidos 9,10. No entanto mantendo a humidade cerca de 35% evita contaminação bacteriana, e uma vez que o objectivo deste protocolo é apenas a manutenção de uma população gaiola, as moscas são mantidas em ambiente de luz normal do laboratório.
Outro ponto importante é manter disturbances para o adulto voa tão baixo quanto possível. Pode ser aconselhável manter a gaiola em um local separado da sala de voar para evitar a contaminação cruzada de outras moscas.
A cultura de grandes populações de moscas mutantes transgénicos e não é recomendada, uma vez que é muito difícil manter a sua pureza e podem exibir um comportamento de acasalamento anormal pronunciada em grandes gaiolas populacionais 14.
Um problema possível, enquanto a cultura de Drosophila em grandes quantidades, é a presença de outros organismos como os ácaros e / ou do molde, que irá competir para a comida e, por conseguinte, reduzir o rendimento de ovos produzidos. Para evitar isso, é muito importante para manter todo o equipamento limpa, lavagem da gaiola, redes e voar caixas com água e sabão, e desprezando o material descartável (tampões de espuma) depois de cada ciclo. Para reduzir o molde crescer, propiónico e ácido fosfórico são adicionados na levedura quando molhado preparando a comida mosca na etapa1.2 e Tegosept ao preparar o melaço bandeja no passo 3.1. Às vezes é útil para materiais lugar, como a caixa de plástico ou peneiras em -20 C, quando o tempo é curto e os materiais não podem ser limpos imediatamente.
Um ciclo coleção inteira ocorre em 14 - 15 dias, começando quando os embriões são semeadas na caixa de mosca e termina com o último dia da coleta. Durante este período de tempo, recomenda-se para organizar uma agenda para lembrar todos os passos necessários para a manutenção de uma gaiola mosca população (Fig. 2), detalhados na seção de protocolo. A partir do dia em que os ovos são semeadas, até que as moscas adultas emergem, é necessário apenas para inspeccionar a caixa de plástico, e quando ocorre a formação da pupa, a colocá-los dentro da gaiola. Depois disso, as moscas têm de ser alimentadas a cada 2 - 3 dias até que os embriões são semeadas para um novo ciclo. Em todo o protocolo, o dia mais longo é durante a colheita e semeadura dos embriões para iniciar um novo ciclo. UMAs comentou no protocolo, a melhor produção de ovos é de 3 - 5 dias após a eclosão de adultos e, finalmente declina 2 dias mais tarde. Isso nos dá uma certa flexibilidade, a fim de escolher o dia em que a colheita dos ovos será realizada.
Se por qualquer motivo o rendimento dos embriões colhidos é menor do que o montante de partida desejado (1,5 g), pode-se sempre adicionar uma nova bandeja de melaço e recolher mais ovos no dia seguinte. Para colecções constantes, recomenda-se manter a 2 gaiolas em paralelo, e se são necessárias quantidades mais elevadas de embriões, é também é possível utilizar maiores gaiolas. No caso de se fazer colecções de tempo curtos, uma maneira de aumentar o rendimento é o de tirar vantagem do sinal de sincronismo de postura de ovos pela manhã.
Há muitas vantagens de recolher grandes quantidades de vários estádios de desenvolvimento. Por exemplo, embriões colhidos em gaiolas população têm sido usadas com muito sucesso em ensaios de imunoprecipitação 6-8, collectio massan dos tecidos larvais de larvas dissociada tem demonstrado ser uma boa fonte para 3C experiências 4 e preparações de ARN 15, e as cabeças de moscas adultas têm sido utilizados para experimentos chip 16. Além disso, os adultos são muitas vezes necessários para fazer extractos de voar por cultura de tecidos 17.
Uma das aplicações mais promissoras da gaiola é fornecer material para ensaios de elevada produtividade que permitem a análise e rastreio de genes, transcrições, proteínas e metabolitos, em resposta à exposição de agentes patogénicos, as moléculas biológicas, substâncias químicas e radiação ionizante. Nestes ensaios em grande escala são necessários um grande número de indivíduos, e a população de moscas gaiola descrito aqui pode ser muito útil para a obtenção de grandes quantidades de material durante as diferentes fases do ciclo de vida de Drosophila para a sua análise e rastreio 18.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We thank Yixian Zheng (Carnegie Institution of Washington, Baltimore, MD) for the original protocol and assistance in initial setup and members of the Lei laboratory for critical reading of the manuscript. This work was funded by the Intramural Research Program of the National Institute of Diabetes and Digestive and Kidney Diseases.
Materiais
| Name | Company | Catalog Number | Comments |
| Bacto-Agar | Beckton Dickinson | 214010 | |
| Curity practical cotton roll | Kendall | 2287 | |
| Dry yeast | Affymetrix | 23540 | |
| Filter paper | GE Healthcare Life Science | 1001-085 | |
| Foam tube plugs | Jaece | L800-D2 | 50 mm Diameter x 55 mm Length |
| Fly population cage | Flystuff | 59-116 | 9″ Diameter x 14.4″ Length. Includes the nets for the cage. |
| Meat tray | Genpak | 1002S (#2S) | 8.25 x 5.75 x 0.5 inches |
| Molasses | Grandma´s | ||
| Plastic container | Rubbermaid | 4022-00 | |
| Plastic film | Glad | ||
| Phosphoric acid | Fisher Scientific | S 93326 | Toxic. Handle in Chemistry Hood |
| Propionic acid | Fisher Scientific | A258-500 | Toxic. Handle in Chemistry Hood |
| Stainless steel sieve #100 | VWR | 57324-400 | |
| Stainless steel sieve #40 | VWR | 57324-272 | |
| Stainless steel sieve #30 | VWR | 57324-240 | |
| Sucrose | MP | 152584 | |
| Tegasept | LabScientific | FLY5501 | |
| Triton-X100 | Fisher Scientific | BP151-500 |
Referências
- Lim, S. J., Boyle, P. J., Chinen, M., Dale, R. K., Lei, E. P. Genome-wide localization of exosome components to active promoters and chromatin insulators in Drosophila. Nucleic Acids Res. 41, 2963-2980 (2013).
- Ong, C. T., Van Bortle, K., Ramos, E., Corces, V. G. Poly(ADP-ribosyl)ation regulates insulator function and intrachromosomal interactions in Drosophila. Cell. 26, 148-159 (2013).
- Gonzalez, I., Mateos-Langerak, J., Thomas, A., Cheutin, T., Cavalli, G. Identification of regulators of the three-dimensional polycomb organization by a microscopy-based genome-wide RNAi screen. Mol Cell. 8, 485-499 (2014).
- Magbanua, J. P., Runneburger, E., Russell, S., White, R. A variably occupied CTCF binding site in the ultrabithorax gene in the Drosophila bithorax complex. Mol Cell Biol. 35, 318-330 (2014).
- Maksimenko, O. Two new insulator proteins, Pita and ZIPIC, target CP190 to chromatin. Genome Res. 25, 89-99 (2015).
- Lei, E. P., Corces, V. G. RNA interference machinery influences the nuclear organization of a chromatin insulator. Nat Genet. 38, 936-941 (2006).
- Matzat, L. H., Dale, R. K., Moshkovich, N., Lei, E. P. Tissue-specific regulation of chromatin insulator function. PLoS Genet. 8, e1003069 (2012).
- King, M. R., Matzat, L. H., Dale, R. K., Lim, S. J., Lei, E. P. The RNA-binding protein Rumpelstiltskin antagonizes gypsy chromatin insulator function in a tissue-specific manner. J Cell Sci. 1, 2956-2966 (2014).
- Sisson, J. C. Culturing large populations of drosophila for protein biochemistry. Cold Spring Harb Protoc. , (2007).
- Shaffer, C. D., Wuller, J. M., Elgin, S. C. Raising large quantities of Drosophila for biochemical experiments. Methods Cell Biol. 44, 99-108 (1994).
- Roberts, D. B., Standen, G. N., Roberts, D. B. The elements of Drosophila biology and genetics. Drosophila: A practical approach. , 1-53 (1998).
- Ashburner, M., Roote, J. Culture of Drosophila: The laboratory setup. Cold Spring Harb Protoc. , (2007).
- Dahlberg, O., Shilkova, O., Tang, M., Holmqvist, P. H., Fb Mannervik, M. P-TEb, The super elongation complex and mediator regulate a subset of non-paused genes during early Drosophila embryo development. PLOS Genet. 13, e1004971 (2015).
- Zhang, S. D., Odenwald, W. F. Misexpression of the white (w) gene triggers male-male courtship in Drosophila. Proc Natl Acad Sci USA. 6, 5525-5529 (1995).
- Chak, L. L., Mohammed, J., Lai, E. C., Tucker-Kellogg, G., Okamura, K. A deeply conserved, noncanonical miRNA hosted by ribosomal DNA. RNA. 21, 375-384 (2015).
- Moshkovich, N., Lei, E. P. HP1 recruitment in the absence of argonaute proteins in Drosophila. PLOS Genet. 12, e1000880 (2010).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol Rev. 63, 411-436 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados