Method Article
Поддержание
В этой статье
Резюме
This manuscript reports a detailed protocol for culturing, on a regular basis, a population of Drosophila melanogaster using a fly population cage.
Аннотация
Large quantities of DNA, RNA, proteins and other cellular components are often required for biochemistry and molecular biology experiments. The short life cycle of Drosophila enables collection of large quantities of material from embryos, larvae, pupae and adult flies, in a synchronized way, at a low economic cost. A major strategy for propagating large numbers of flies is the use of a fly population cage. This useful and common tool in the Drososphila community is an efficient way to regularly produce milligrams to tens of grams of embryos, depending on uniformity of developmental stage desired. While a population cage can be time consuming to set up, maintaining a cage over months takes much less time and enables rapid collection of biological material in a short period. This paper describes a detailed and flexible protocol for the maintenance of a Drosophila melanogaster population cage, starting with 1.5 g of harvested material from the previous cycle.
Введение
Умение сочетать генетические и биохимические подходы сделало Drosophila особенно подходящий организм для биохимии и молекулярной биологии исследований 1-3. Эти исследования часто требуют большого количества биологического материала, а не только от взрослых мух, но и от личинок 4, 5 и куколок эмбрионов 6-8. Для получения больших количеств материала, исследователи культивируемых мух, используя большие контейнеры, известные как летают "клетей населения". Эти клетки состоят из цилиндра, изготовленного из пластика, покрытого сеткой с обеих сторон, чтобы обеспечить введение пищи внутри клетки без мух, вылетающих. Эти клетки могут быть домашние 9-11 или приобрести у компании (см таблицу конкретных материалов / оборудования).
Одним из основных преимуществ использования этой системы , чтобы вырастить большие количества мух является то , что цикл дрозофилы 12 может управляться таким образом , что все мухи развиваются в реlatively синхронизированным образом. Эта синхронизация достигается за счет засева новых эмбрионов, кормление личинок мух / и принесения в жертву взрослых мух в точные моменты времени. Использование синхронизированный муха населения особенно полезна для исследований в области развития 13.
Начало новой клетке населения от нескольких мух является трудоемкий процесс требует много циклов амплификации 9-11. Даже при использовании больших контейнеров, таких как бутылки муха культуры или minicages, весь процесс может длиться в течение нескольких месяцев. Чтобы избежать этого времени шаг потребляющего, многие лаборатории Drosophila регулярно поддерживать такие клетки. Наиболее удобно, чтобы начать новую клетку, начиная от сбора эмбрионов из уже установленной клетке населения. В целом, большинство лабораторий поддерживать клетки дикого типа населения, таких как Oregon R или Canton S. Эта рукопись представляет собой подробный протокол для поддержания мух клетей населения.
протокол
1. Запуск цикла: ПОСЕВНОЙ зародыши
Примечание: Цикл начинается с 1,5 г собранного материала (смесь состоит из эмбрионов и / или несколько первых личинок возрастной стадии) из предыдущего цикла. Этот материал будет помещен в пластиковый контейнер (см таблицу конкретных материалов / оборудования) с активным смесь дрожжей до куколки фазы. Контейнер будет закрыт после введения биологической смеси эмбрионов и личинок с крышкой, чтобы избежать попадания личинок, чтобы избежать. Это необходимо сделать отверстия в крышке для того, чтобы обеспечить циркуляцию воздуха. Чтобы избежать личинки выходят через отверстия, используются пенопластовые заглушки. Наконец, рекомендуется носить перчатки и лабораторный халат, а не только в этом разделе, но и в целом протокола, чтобы избежать загрязнения или окрашивания одежды с отбеливателем.
- Установите пластиковый контейнер.
- Сделайте три квадратные отверстия с бритвенным лезвием в пластиковом контейнере крышкеpproximately 2,2 см. Добавить ленту (3/4 дюйма маркировки ленты) к четырем углам каждого отверстия, чтобы обеспечить плотное прилегание для пены пробками (50 х 55 мм, DXL), а затем поместить один пенный пробку в каждое отверстие.
- Накройте внутри пластикового контейнера с полиэтиленовой пленкой. За этот фильм, добавить слой хлопка, чтобы покрыть дно пластикового контейнера. Tear хлопок пальцами.
- Приготовить летучую пищу.
- Добавить 333 мл деионизированной воды в химическом стакане емкостью 500 мл. При перемешивании химический стакан с магнитной мешалкой, добавляют 167 мкл пропионовой кислоты и 1,08 мл фосфорной кислоты, из маточных растворов (99,96% и 85% соответственно).
- Медленно добавляют 77,5 г активных сухих дрожжей, избегая больших комков. После растворения сухих дрожжей, добавить 38,8 г сахарозы.
Примечание: Сахароза должен быть последним ингредиент должен быть добавлен, так как сразу же после добавления этого компонента, брожение начнется.
- Сразу же после растворения сахарозы, залитьпищи на хлопке, и убедитесь, чтобы равномерно покрыть хлопок. Закройте пластиковый контейнер с крышкой, чтобы избежать сбежавших мух в лаборатории, загрязняя пищу.
- Ресуспендируют 1,5 г заготовленной эмбрионов (не dechorionated) из предыдущего цикла с 5 мл 70% -ного этанола. Разрезать пополам два фильтровальной бумаги и распределяют биологическую смесь равномерно в течение 4-х частей с помощью шпателя или переноса пипеткой с широким наконечником (вырезать, если это необходимо). Положите на фильтровальную бумагу поверх пропитанной хлопка и закройте крышку. Наконец, инкубировать пластиковый контейнер при комнатной температуре (24 ° C) и влажности (35%), до стадии куколки.
Примечание: Пластиковый контейнер не следует размещать во влажной камере, в противном случае это будет стимулировать рост бактерий.
2. Продолжение цикла: От эмбрионы мух.
Примечание: Эта часть цикла выходит из эмбрионов не помещенных в пластиковый контейнер на 1-й день до 9 дней спустя, когда взрослые особи насекомых будут появлятьсяиз куколок. За эти 8 дней ничего не делать , но контроль , что эмбрионы правильно не переходить к следующим этапам жизненного цикла дрозофилы до вылупления. Если личинки начинают умирать и чернеет в течение этого времени, убедитесь, что пена пробки не слишком плотно, и при условии, что соответствующая вентиляция. Этот период является хорошее время, чтобы очистить клетку муха населения от предыдущего цикла.
- Наблюдайте эмбрионы становятся 1 - й возрастной стадии личинки около 24 часа после того, как взрослая самка хранение их в летучей пищи (см шаг 3). В результате личинки будут питаться от пищи мухи , полученного на стадии 1 в течение 4 -х дней, растут и линьки два раза в 2 - й и 3 - й возрастной стадии личинок.
- Очистите клетку муха населения.
- Поместите клетку при 4 ° С в течение не менее 30 минут, чтобы замедлить активность мух. Удалить сеть который покрывает одну сторону клетки, и с быстрым движением, крышка открытую сторону с большой биологической опасности пластмассымешок. Вылейте содержимое клетки в мешок.
- С биологическая_опасность сумка все еще охватывающих одну сторону клетки, расположить клетку вертикально над раковиной с мешком биологической стороной вниз. Осторожно снимите пластиковый пакет, чтобы предотвратить мух убегающих и выбросьте его в контейнер для биологически опасных отходов.
- Аккуратно откройте верхнюю сетку достаточно, чтобы создать небольшое отверстие, промыть внутреннюю часть клетки с водой, которая будет мыть мух в раковину. Медленно увеличить размер отверстия и устранить все мухи внутри клетки.
- Очистите клетку и обе сетки с водой и мылом. В то время как сети еще влажные закрепить их по обе стороны от сухой чистой клетке, и, наконец, положить внутрь лабораторный проливной дождь бумагу, которая будет препятствовать пластиковой пленки, приготовленной на стадии 1.1.2 прилипать к клетке. Теперь клетка готова к следующему циклу.
- Через четыре дня после первоначальной настройки, наблюдения личинки окукливаются. Личинки будут оставаться на этой стадии в течение еще 4 дней.
ОТМЕТИЛрительными эта фаза куколки будет покрывать всю поверхность хлопковой внутри пластикового контейнера. - Во время фазы куколки и до того, как первые мухи появляются, открыть пластиковый контейнер и поместите пластиковую пленку, содержащую хлопок со всеми куколок над лабораторным проливной дождь бумаги внутри чистой клетке населения. Закройте сеть с двойным узлом и очистить пластиковый контейнер и крышку для следующего цикла.
Примечание: куколки прикреплены к крышке должны быть отброшены и уничтожены автоклавированием или замораживания, прежде чем Eclosion.
3. Взрослый Мухи.
Примечание: После того, как 4 дня куколки этапе первые мухи выйдут из куколок. В течение 24 - 48 часов все мухи должны eclosed. В этой части цикла, важно, чтобы обеспечить им пищу с целью создания надлежащих условий для размножения.
- Подготовьте патоки лотки.
- Комбайн в колбе объемом 1 л 556,25 мл деионизированной H 2 O, 90 мл мелассы и 22 г агара, Автоклавы с мешалкой в течение 30 мин, охлаждают и добавляют 9,25 мл 10% -ного Tegosept в 95% этанола.
- Вылейте смесь в мясной лоток 21 х 14,5 см. Убедитесь в том, что объем достаточно, чтобы покрыть 15 - 17 тарелок. Подождите 10 - 20 минут, чтобы затвердеть и накрыть каждый поднос с пластиковой пленкой, чтобы избежать высыхания. Несколько Колбы 1 л могут быть получены одновременно. Храните патоки лотки при 4 ° С, завернутые в пластик, пока не требуется.
- Добавьте поднос патоки, покрытую мокрой дрожжей внутри клетки с взрослых мух.
- Перед добавлением пластины, поместите клетку при 4 ° С в холодном помещении в течение 30 мин.
- Добавить 200 мл деионизированной H 2 O в стакан и медленно льют сухие дрожжи при перемешивании ложкой. Прекратите добавлять сухие дрожжи, когда смесь становится примерно консистенцию арахисового масла, чтобы предотвратить мух застрять в пищу.
Примечание: Важно не допустить, чтобы пища решение затвердеть в противном случае это будет очень трудно охватитьмеласса лоток и извлечь яйца во время уборки процесса (смотри раздел 4.3). - Снимите пластиковую пленку с одного мелассы лотка и покрыть ее слоем свежей приготовленной влажных дрожжей с помощью ложки или шпателя. Убедитесь, что вся поверхность покрыта.
- В то время как клетка все еще находится в холодном помещении, откройте сетку и осторожно добавьте лоток патоки с влажных дрожжей в клетку. Закройте сеть и поместить клетку при комнатной температуре.
ПРИМЕЧАНИЕ: Это может быть полезно, чтобы покрыть плиту с пустым подносом мяса во время вставки, но будьте уверены, чтобы не блокировать доступ мух к поддону мелассы.
- Изменение пищевой пластина каждые 24 - 48 часов, чтобы избежать дрожжи, чтобы получить слишком сухой. Взрослые мухи очень чувствительны к высыханию.
4. Конец цикла: Сбор эмбрионы
ПРИМЕЧАНИЕ: Лучший плодородие муха 3 - 5 дней после вылупления. Таким образом, сбор урожая в течение этого времени будет получить лучший выход эмбриона. После того, как желаемые коллекции КомплексыTed, цикл заканчивается. Мухи должны быть принесены в жертву, и клетка очищается, как указано в пункте 2.2.
- Как правило, через 2 дня после вылупления мух, ввести новый мелассы поднос со свежими влажный корм в клетку, как описано в разделе 3.2.5. Для увеличения выхода осаждения яиц, с помощью пальцев, делает поверхность влажных дрожжей, как нерегулярные, насколько это возможно. Если старый поднос еды присутствует в клетке, перед добавлением новой пластинкой, осторожно удалите его и выбросить его в сумку для биологически опасных отходов. Еще один совет для повышения урожайности, чтобы удалить слой из хлопка, так что все яйца будут заложены в пище. Поддерживать клетки при комнатной температуре.
- Обратите внимание на зародыши в виде небольших белых точек.
ПРИМЕЧАНИЕ: Яйца готовы быть собраны. Для планового технического обслуживания летучей клетки, 2 день сбора является рекомендуемым время. Эта коллекция будет содержать в основном эмбрионов и мало 1 личинок INSTAR ул. См репрезентативные результаты для типичных выходов добываемых эмбрионов для различных Коллемоменты времени фикция. - Урожай эмбрионов
- Поместите клетки в холодном помещении в течение приблизительно 30 мин. В то же время подготовить пластиковый контейнер и Муха пищу для следующего цикла, как описано в разделе 1.
- В 8-литровый автоклав лоток добавить воду до ¼ от общей емкости, а затем добавляют 1 мл 10% -ного Тритона Х-100. В то время как клетка находится в холодном помещении тщательно удалить пластину патоки и поместите его в биологически опасных сумку.
- Выньте лоток из сумки и погрузить его быстро (чтобы предотвратить мух от побега) в растворе моющего средства в лотке в автоклаве. Закройте сумку биологической опасности и поместить в контейнер для биологически опасных. Мухи не тонут в воде, которая не содержит моющее средство.
- Используйте большую кисть и дистиллированную воду пистолет мыть эмбрионов и дрожжи от патоки. Выбросьте тарелки и патоку в текущем окне биологической опасности.
- Аккуратно налить раствор через три сита набора (сито 30 грубая на вершине, 40 в середине и 100 на дне). Вымойте сгустки Oп верхний уровень дистиллированной воды пушки, пока не комки не останется.
Примечание: для взрослых мух и личинок 3 - й возрастной стадии , будут сохранены в сите 30.- Ополосните автоклавного поднос с дистиллированной водой и залить промывочную воду через сито. Удалите верхнее сито и повторите процесс, если дрожжи остаются комочки. Большую часть 1 - го и все личинки возрастной стадии 2 - й останется в сите 40.
- Удалите второе сито. Желтоватый материал в третьей (нижней) ситом является смесь эмбрионов и личинок маленькой 1 - й стадии ул. Использовать дистиллированную воду пистолет, чтобы переместить все яйца в одну сторону сита. Соберите их с помощью шпателя и взвесить их.
- В течение этих циклов выход сбор эмбрионов / личинок колеблется в пределах от 7 до 13 г. Используйте только 1,5 г этого материала, чтобы начать новый цикл (раздел 1). Используйте остальную часть эмбрионов для дальнейшей обработки или могут быть отброшены.
5. Далееобработка
Примечание: Эмбрионы не используется для продолжения населения могут быть немедленно использованы для экспериментов или в качестве альтернативы могут быть заморожены при -80 ° С. Для обоих вариантов, эмбрионы, возможно, должны быть сначала dechorionated.
- Для dechorionation, мыть эмбрионов в течение 2 мин в 50% растворе хлорной извести и тщательно промыть дистиллированной водой.
- Для замораживания эмбрионов, сначала сухой, нажав твердо с бумажным полотенцем, а затем взвесить и разместить их с помощью шпателя, в 15 или 50 мл коническую трубку. Наконец погрузить коническую трубку в жидком N 2 в течение нескольких секунд.
Результаты
Поддержание популяции мухи клетка основана на муху жизненного цикла. Таким образом, после размещения первичной биологической смеси эмбрионов и личинок в пластиковом контейнере (рисунок 1А) оплодотворенные яйца станут личинок не более чем в 2 дня и личинки будут расти в течение 4 -х дней, относительно синхронизированы через различные стадии личинки возрастной стадии ( см Рисунок 1В).
После того, как личинки завершили 3 - й возрастной стадии личиночной стадии они будут окукливания и покрывают поверхность хлопка внутри пластикового контейнера с некоторыми на внутренней поверхности крышки (рис 1C). Этот период окукливания будет идти в течение следующих 4-х дней, пока мухи не закончить процесс метаморфоза. В этот период настоятельно рекомендуется перевести мух в клетку. Первые взрослые мухи начнут Эклоз в день 9 - 10 после того, какначало цикла (рис 1D) и 11 -й день все они вышли из куколок.
Лучший выход сбора эмбрионов получают 3 - 5 дней после того, как Eclosion (день 13 до 15 лет) и, наконец, снижение в 17-й день (через 7 дней после вылупления). Поэтому, рекомендуется , чтобы добавить последний лоток свежих продуктов на 13 -й день и собирать яйца на 15 -й день (рис 1E и F). Это позволит сбор максимального количества эмбрионов. Добавление третьего дополнительный день до сбора может привести к пищевой слишком сухой и , следовательно , будет уменьшать выход собранных эмбрионов. В таблице 1 показан выход 6 сборников последовательных циклов, с исходного материала , т.е. 1,5 г в каждом цикле, и фиг 2 рекомендуемый график сбора цикла в целом.
Материал собран в 2-х дней60; периоды в основном состоит из эмбрионов. Однако небольшое количество личинок также присутствуют. Для целей обслуживания клетки эти личинки не являются проблемой, так как некоторая степень асинхронности, как ожидается. Тем не менее для некоторых экспериментов биохимия, чистота этих эмбрионов очень важно, но в то же время также необходимо собрать большое количество яиц для выполнения этих экспериментов. По этой причине несколько коротких последовательных коллекции были выполнены в 1 ч и 3 ч, после того, как быстро добавляя при комнатной температуре в новую плиту с пищей, чтобы обеспечить оценку выхода и чистоты , которые могут быть получены этим методом (таблица 2 и рисунок 3) , В 1 час подряд коллекции началось с очень низким выходом (14,5 мг), а затем количества эмбрионов увеличилось за каждый раз, когда собрано, но в последний раз. Низкий выход в первую очередь может быть связано с мухами подчеркивается в процессе изменения пищи, но позже акклиматизации. нет С другой стороны, ни один LARVAE наблюдались в пяти последовательных коллекций (фиг.3А), показывая , что более короткие коллекции дают более высокую чистоту. Если хлопок не удаляется из клетки, вероятность того, что личинки из более ранних моментов времени останется и ввести свежий пластины увеличивается. Даже когда хлопок удаляется, иногда личинки будут бродить на стороне клетки и войти в пищу во время сбора.
В течение 3 ч последовательных коллекций, доходность колебалась от 840 до 1250 мг, что составляет около 10 раз больше, чем доходность, полученных в час коллекции 1. Чистота этих эмбрионов была близка к 100% (Рисунок 3В). наблюдались Повод личинок. Некоторые исследования развития требуют очень строгой синхронизации для эмбрионов, собранных. Для повышения чистоты синхронизации, рекомендуется отказаться от первой коллекции пластины, потому что, если условия не идеальны, женщины могут сохранять более зрелые яйца и депонироватьм, когда условия улучшаются, например, с введением свежей пластины. Кроме того, важно знать, что более старые взрослые мухи (> 6 дней) производят менее синхронизированные эмбрионов. Чтобы проверить степень синхронизации с высокой точностью, рекомендуется DAPI окрашивание собранных эмбрионов.

Рисунок 1. дрозофилы Жизненный цикл в области народонаселения Fly Кейджа. (A) Начало цикла высева 1,5 г эмбрионов в контейнер пластиковой коробке. В качестве ссылки, в нижней панели, длина фильтровальной бумаги составляет 8,5 см. (Б) Личинки относительно выращивания синхронизирован через 5 дней после начала цикла. (C) На 8 -й день, большинство мух находятся в стадии куколки. Нижние панели в B (B ') и C (C ') являются увеличениях указанных областей в верхних панелях. (D) Взрослые мухи вышли из куколок через 10 дней после начала цикла. (E) для взрослых мух внутри клетки населения , прежде чем начать процесс сбора эмбрионов, на 15 день Желтоватый материал на лету пищи оплодотворенные яйца. (F) Эмбрионы (и несколько личинок) , собранных в нижней части 100 грубом сито, после целой клетки цикла. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
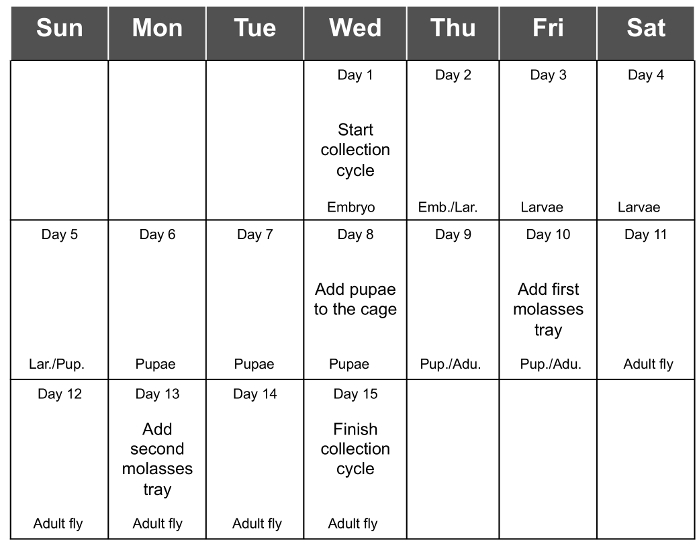
Рисунок 2. Всего Расписание цикла сбора. На рисунке 2 показан рекомендуемый график для полного цикла сбора. т = "_blank"> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
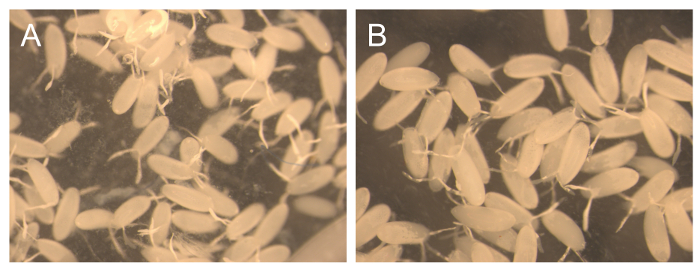
Рисунок 3. Чистота 1 ч и 3 ч последовательных коллекций. Представитель изображения эмбрионов , собранных в 1 ч (А) и 3 ч (б) после добавления нового поднос с едой. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| номер цикла | Выход (г) |
| 1 | 10.3 |
| 2 | 9.5 |
| 3 | 10.3 |
| 4 | 12,7 |
| 5 | 10 |
| 6 | 7.1 |
| Коллекция # | Длина сбора (ч) | Выход (мг) |
| 1 | 1 | 14,5 |
| 2 | 1 | 21,6 |
| 3 | 1 | 56,1 |
| 4 | 1 | 160,1 |
| 5 | 1 | 106,1 |
| 1 | 3 | 960 |
| 2 | 3 | 840 |
| 3 | 3 | 1250 |
Таблица 2. Выход 1 ч и 3 ч Последовательные Collections. В таблице 2 показан выход 5 последовательных коллекций 1 час после добавления новых продуктов питания и 3 последовательных коллекции 3 часа после размещения новой патоки пластины.
Обсуждение
Начиная с 1,5 г материала, можно получить выход, собранных эмбрионов в период между 7 и 13 г за один цикл. Чтобы получить такое количество материала, что имеет решающее значение для поддержания правильных условий культивирования на всех этапах цикла лету.
Наиболее важными параметрами являются температура и влажность воздуха, которая должна быть 24 ° С и 35% соответственно. Если эти два параметра не может поддерживаться постоянной в нормальных условиях лаборатории, одним из возможных вариантов было бы поместить клетку мухи в инкубатор или климатическую камеру. Другие протоколы рекомендуют 70% влажности , а также постоянный 24 ч свет-темнота цикла , чтобы увеличить выход производимых яиц 9,10. Тем не менее сохраняя влажность около 35% предотвращает бактериальное загрязнение, и поскольку цель этого протокола является только содержание клетки населения, мухи находятся в нормальной освещенности лаборатории.
Другим важным моментом является то, чтобы держать диsturbances к взрослому летит как можно более низкой. Это может быть целесообразным, чтобы держать клетку в месте отдельно от зольной помещении, чтобы избежать перекрестного загрязнения от других мух.
Культивирование больших популяций трансгенных и мутантных мух не рекомендуется, так как очень трудно поддерживать чистоту и они могут проявлять выраженный ненормальное поведение сопрягаемую в крупных населенных клетках 14.
Одна из возможных проблем во время культивирования дрозофилы в больших количествах является наличие других организмов , таких как клещи и / или плесени, которые будут конкурировать за пищу и , следовательно , уменьшить выход производства яиц. Чтобы избежать этого, очень важно, чтобы все оборудование в чистоте, промывая клетки, сетки и летать коробки с водой и мылом, и отбрасывая одноразового использования материала (пены) пробки после каждого цикла. Для того, чтобы уменьшить плесени, пропионовую и фосфорную кислоту добавляют в мокрую дрожжей при приготовлении пищи летучую на этапе1.2 и Tegosept при подготовке патоку лотка на шаге 3.1. Иногда полезно размещать материалы, такие как пластиковой коробке или ситах в -20 ° С, когда мало времени и материалы не могут быть очищены сразу же.
Целый цикл коллекции происходит в течение 14 - 15 дней, начиная, когда эмбрионы высевают в коробку летучей и заканчивая последний день сбора. В течение этого периода времени, рекомендуется организовать расписание, чтобы запомнить все необходимые шаги для поддержания популяции мух клетки (рис. 2), подробно описаны в разделе протокола. Со дня, что яйца высевают, пока взрослые мухи не появляются, необходимо только, чтобы осмотреть пластмассовую коробку, а когда происходит окукливание, чтобы поместить их в клетке. После этого мух должны быть поданы через каждые 2 - 3 дней до тех пор, пока зародыши высевают для нового цикла. В целом по протоколу, самый длинный день во время сбора и обсеменения эмбрионов для начала нового цикла.ы прокомментировал в протоколе, лучший выход яиц на 3 - 5 дней после вылупления взрослой особи, и, наконец, снижается через 2 дня. Это дает нам некоторую гибкость, чтобы выбрать день, в котором будет выполняться урожай яиц.
Если по какой-либо причине выход собранных эмбрионов меньше желаемого исходного количества (1,5 г), всегда можно добавить новый патоки лоток и собирать больше яиц на следующий день. Для постоянных коллекций, рекомендуется поддерживать 2 клетей параллельно, а если более высокие количества эмбрионов необходимы, также можно использовать более крупные клетки. В случае делать короткие коллекции времени, один из способов повышения урожайности является воспользоваться яйцекладки взрыв утром.
Есть много преимуществ сбора большого количества различных стадий развития. Например, собранные эмбрионы из клеток населения были очень успешно используются в иммунопреципитации 6-8, масса Collectioп личиночных тканей из диссоциированного личинок показал, что является очень хорошим источником для 3C экспериментов 4 и препаратов РНК 15, и головы от взрослых мух были использованы для ChIP экспериментов 16. Кроме того, взрослые часто необходимы , чтобы сделать муху экстракты для тканевой культуры 17.
Одним из наиболее перспективных применений клетки является создание материала для высокой пропускной анализов, которые позволяют анализировать и скрининг генов, транскриптов, белков и метаболитов в ответ на воздействия патогенов, биологических молекул, химических веществ и ионизирующего излучения. В этих крупномасштабных анализах большое число людей требуется, и клетка муха населения описанная здесь может быть очень полезным для того , чтобы получить большие количества материала на различных этапах жизненного цикла дрозофилы для их анализа и скрининга 18.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We thank Yixian Zheng (Carnegie Institution of Washington, Baltimore, MD) for the original protocol and assistance in initial setup and members of the Lei laboratory for critical reading of the manuscript. This work was funded by the Intramural Research Program of the National Institute of Diabetes and Digestive and Kidney Diseases.
Материалы
| Name | Company | Catalog Number | Comments |
| Bacto-Agar | Beckton Dickinson | 214010 | |
| Curity practical cotton roll | Kendall | 2287 | |
| Dry yeast | Affymetrix | 23540 | |
| Filter paper | GE Healthcare Life Science | 1001-085 | |
| Foam tube plugs | Jaece | L800-D2 | 50 mm Diameter x 55 mm Length |
| Fly population cage | Flystuff | 59-116 | 9″ Diameter x 14.4″ Length. Includes the nets for the cage. |
| Meat tray | Genpak | 1002S (#2S) | 8.25 x 5.75 x 0.5 inches |
| Molasses | Grandma´s | ||
| Plastic container | Rubbermaid | 4022-00 | |
| Plastic film | Glad | ||
| Phosphoric acid | Fisher Scientific | S 93326 | Toxic. Handle in Chemistry Hood |
| Propionic acid | Fisher Scientific | A258-500 | Toxic. Handle in Chemistry Hood |
| Stainless steel sieve #100 | VWR | 57324-400 | |
| Stainless steel sieve #40 | VWR | 57324-272 | |
| Stainless steel sieve #30 | VWR | 57324-240 | |
| Sucrose | MP | 152584 | |
| Tegasept | LabScientific | FLY5501 | |
| Triton-X100 | Fisher Scientific | BP151-500 |
Ссылки
- Lim, S. J., Boyle, P. J., Chinen, M., Dale, R. K., Lei, E. P. Genome-wide localization of exosome components to active promoters and chromatin insulators in Drosophila. Nucleic Acids Res. 41, 2963-2980 (2013).
- Ong, C. T., Van Bortle, K., Ramos, E., Corces, V. G. Poly(ADP-ribosyl)ation regulates insulator function and intrachromosomal interactions in Drosophila. Cell. 26, 148-159 (2013).
- Gonzalez, I., Mateos-Langerak, J., Thomas, A., Cheutin, T., Cavalli, G. Identification of regulators of the three-dimensional polycomb organization by a microscopy-based genome-wide RNAi screen. Mol Cell. 8, 485-499 (2014).
- Magbanua, J. P., Runneburger, E., Russell, S., White, R. A variably occupied CTCF binding site in the ultrabithorax gene in the Drosophila bithorax complex. Mol Cell Biol. 35, 318-330 (2014).
- Maksimenko, O. Two new insulator proteins, Pita and ZIPIC, target CP190 to chromatin. Genome Res. 25, 89-99 (2015).
- Lei, E. P., Corces, V. G. RNA interference machinery influences the nuclear organization of a chromatin insulator. Nat Genet. 38, 936-941 (2006).
- Matzat, L. H., Dale, R. K., Moshkovich, N., Lei, E. P. Tissue-specific regulation of chromatin insulator function. PLoS Genet. 8, e1003069 (2012).
- King, M. R., Matzat, L. H., Dale, R. K., Lim, S. J., Lei, E. P. The RNA-binding protein Rumpelstiltskin antagonizes gypsy chromatin insulator function in a tissue-specific manner. J Cell Sci. 1, 2956-2966 (2014).
- Sisson, J. C. Culturing large populations of drosophila for protein biochemistry. Cold Spring Harb Protoc. , (2007).
- Shaffer, C. D., Wuller, J. M., Elgin, S. C. Raising large quantities of Drosophila for biochemical experiments. Methods Cell Biol. 44, 99-108 (1994).
- Roberts, D. B., Standen, G. N., Roberts, D. B. The elements of Drosophila biology and genetics. Drosophila: A practical approach. , 1-53 (1998).
- Ashburner, M., Roote, J. Culture of Drosophila: The laboratory setup. Cold Spring Harb Protoc. , (2007).
- Dahlberg, O., Shilkova, O., Tang, M., Holmqvist, P. H., Fb Mannervik, M. P-TEb, The super elongation complex and mediator regulate a subset of non-paused genes during early Drosophila embryo development. PLOS Genet. 13, e1004971 (2015).
- Zhang, S. D., Odenwald, W. F. Misexpression of the white (w) gene triggers male-male courtship in Drosophila. Proc Natl Acad Sci USA. 6, 5525-5529 (1995).
- Chak, L. L., Mohammed, J., Lai, E. C., Tucker-Kellogg, G., Okamura, K. A deeply conserved, noncanonical miRNA hosted by ribosomal DNA. RNA. 21, 375-384 (2015).
- Moshkovich, N., Lei, E. P. HP1 recruitment in the absence of argonaute proteins in Drosophila. PLOS Genet. 12, e1000880 (2010).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol Rev. 63, 411-436 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены