Method Article
のメンテナンス
要約
This manuscript reports a detailed protocol for culturing, on a regular basis, a population of Drosophila melanogaster using a fly population cage.
要約
Large quantities of DNA, RNA, proteins and other cellular components are often required for biochemistry and molecular biology experiments. The short life cycle of Drosophila enables collection of large quantities of material from embryos, larvae, pupae and adult flies, in a synchronized way, at a low economic cost. A major strategy for propagating large numbers of flies is the use of a fly population cage. This useful and common tool in the Drososphila community is an efficient way to regularly produce milligrams to tens of grams of embryos, depending on uniformity of developmental stage desired. While a population cage can be time consuming to set up, maintaining a cage over months takes much less time and enables rapid collection of biological material in a short period. This paper describes a detailed and flexible protocol for the maintenance of a Drosophila melanogaster population cage, starting with 1.5 g of harvested material from the previous cycle.
概要
遺伝的および生化学的ア プローチを組み合わせる能力は、 ショウジョウバエを生化学および分子生物学的研究1-3に特に適した生物を行いました。これらの研究は、多くの場合、大人のハエから、だけでなく、幼虫4、蛹5および胚6-8からだけでなく、生物学的材料を大量に必要とします。大量の材料を得るために、研究者は、フライ「人口ケージ」として知られている大きな容器を用いて培養ハエを持っています。これらのケージは、ハエが逃げることなく、ケージの中に食品の導入を可能にするために、両側のネットで覆われたプラスチック製の円筒で構成されています。これらのケージは、(特定の材料/機器の表を参照)9-11自家製や会社から購入することができます。
ハエの大量の成長を、このシステムを使用することの主な利点は、果物のサイクル12を飛ぶすべてのハエは、再で開発する方法で制御することができるということですlatively方法を同期。この同期は、新しい胚を播種幼虫/ハエを供給し、正確な時刻に大人のハエを犠牲にすることによって達成されます。同期ハエ集団を使用すると、発生研究13のために特に有用です。
いくつかのハエからの新しい人口ケージの開始が増幅9-11の多くのサイクルを必要とする時間のかかるプロセスです。でもフライ培養ボトルまたはminicagesのような大きなコンテナを使用して、全体のプロセスは数ヶ月続くことができます。ステップを消費し、この時間を回避するために、多くのショウジョウバエの研究室は、定期的に、このようなケージを維持します。すでに確立された人口ケージから胚コレクションから始まる新しいケージを開始することが最も便利です。一般的に、ほとんどのラボではこの原稿がフライ人口ケージを維持するための詳細なプロトコルを提示するようにオレゴンRやカントンSなどの野生個体群のケージを、維持します。
プロトコル
1.サイクルの開始:胚を播種
注:サイクルは、前のサイクルから収集した材料の1.5グラム(胚および/またはいくつかの1齢幼虫からなる混合物)で始まります。この材料は、蛹の段階までアクティブ酵母混合物を用いてプラスチック容器(特定の材料/機器の表を参照)に配置されます。コンテナは、幼虫が脱出することができます回避するために、蓋付きの胚および幼虫の生物学的混合物の導入後に閉じられます。空気の循環を可能にするために蓋に穴を作る必要があります。スルーホール幼虫の脱出を回避するには、フォームのプラグが使用されています。最後に、漂白剤で汚れや染色の服を避けるために、このセクションではなく、全体のプロトコルだけでなく、手袋、白衣を着用することをお勧めします。
- プラスチック容器を設定します。
- のプラスチック製容器蓋にカミソリの刃で3正方形の穴を作りますpproximately 2.2センチメートル。発泡栓(50×55ミリメートル、DXL)のためのタイトなフィット感を確保し、各穴に1泡プラグを配置するために、各穴の四隅にテープ(3/4インチ表示用テープ)を追加します。
- プラスチック製のラップでプラスチック容器の内部をカバーしています。この膜上に、プラスチック容器の底部をカバーするために、綿の層を追加します。指で綿を引き裂きます。
- フライ食品を準備します。
- 500ミリリットルのビーカーに脱イオン水333ミリリットルを追加します。磁気棒を入れたビーカーを攪拌しながら、原液(99.96パーセントと85パーセント、それぞれ)から、プロピオン酸の167μlのリン酸の1.08ミリリットルを追加します。
- ゆっくりと大きな塊を避け、活性乾燥酵母の77.5グラムを追加します。乾燥酵母を溶解させた後、ショ糖の38.8グラムを追加します。
注:スクロースはすぐにこのコンポーネントを追加した後、発酵が開始されますので、追加する最後の成分であるべきです。
- すぐにスクロースを溶解させた後、注ぎます綿の上に食べ物、そして均等に綿をカバーするようにしてください。食品を汚染し、実験室の中にエスケープハエを避けるために蓋付きプラスチック容器を閉じます。
- 70%エタノール5mlと前のサイクルから回収胚(dechorionatedない)を1.5gを懸濁。半分にカット2濾紙、スパチュラまたは(必要に応じてカット)広い先端との転送ピペットを用いて4個に均等に生物学的混合物を配布します。浸した綿の上に濾紙を置き、ふたを閉めます。最後に、蛹期までプラスチックRTでコンテナ(24ºC)、湿度(35%)をインキュベートします。
注:プラスチック容器は、そうでなければ、これは細菌の増殖を促進する、湿ったチャンバ内に配置すべきではありません。
サイクルの2継続:胚からハエに。
注:サイクルのこの部分は、9日後に成虫が出てくる時まで、1日目にプラスチック製の容器に入れた胚から行きます蛹から。これらの8日間は何も実行する必要がありませんが、胚が羽化するまで、 ショウジョウバエのライフサイクルの次のステージに正しく進行していることを監視します。幼虫が死んこの間黒を回して起動した場合、発泡プラグはあまりにもタイトではなく、その十分な換気が提供されていることを確認してください。この期間は、前のサイクルからフライ人口ケージをきれいにする良い時期です。
- 成人女性は、フライ食品(ステップ3を参照)にそれらを堆積した後に観察した胚は、1 番目の齢幼虫24の周りの時間になります。得られた幼虫は成長しており、第2および第3齢幼虫に二回脱皮、4日の間にステップ1で調製したフライ食品から送ります。
- フライ人口ケージを清掃してください。
- ハエの活性を遅くするために、少なくとも30分間、4ºCでケージを置きます。ケージの一方の側を覆っているネットを削除し、高速移動に伴って、大規模なバイオハザードプラスチックで開放側をキャップバッグ。袋にケージの内容を注ぎます。
- バイオハザードバッグはまだケージの1側を覆うとともに、バイオハザードバッグ側を下にして、シンクの上に垂直にケージを置きます。慎重に逃げるのハエを防止し、バイオハザード廃棄物容器に廃棄するビニール袋を取り外します。
- 慎重に、小さな穴を作成流しにハエを洗いますと水とケージの内部を洗浄するために十分な上部のネットを開きます。ゆっくりと穴のサイズを大きくし、ケージ内のすべてのハエをなくします。
- 水と石鹸でケージとの両方のネットを清掃してください。ネットはまだ湿っているが、ドライクリーンケージの両側にそれらを確保し、最終的にケージに付着するステップ1.1.2で作製したプラスチックフィルムを防ぐことができますラボ浸す紙、内側に置きます。今、ケージは次のサイクルの準備ができています。
- 四日間の初期セットアップ後、幼虫の蛹化を観察します。幼虫は4日間以上、この段階のままになります。
注:Duringこのフェーズは、蛹は、プラスチック容器の内部全体を綿の表面をカバーします。 - 蛹期の間と最初のハエが出現する前に、プラスチック容器を開き、きれいな人口ケージの中にラボ浸す紙の上のすべての蛹と綿を含むプラスチックフィルムを配置します。ダブルノットでネットを閉じ、プラスチック容器、次のサイクルのためのふたを清掃してください。
注:蓋に取り付けられた蛹は破棄され、オートクレーブまたは羽化する前に凍結によって破壊されるべきです。
3.アダルトハエ。
注:蛹期の4日後、最初のハエがさなぎから出てきます。 24内 - 48時間すべてのハエがeclosedている必要があります。サイクルのこの部分では、再生のための適切な環境づくりを目指して彼らに食べ物を提供することが重要です。
- 糖蜜トレイを準備します。
- 1リットルのフラスコに脱イオンH 2 Oの556.25ミリリットル、糖蜜の90ミリリットル、及び寒天の22グラムでコンバイン。クールな30分間攪拌棒、オートクレーブし、95%エタノールで10%Tegoseptの9.25ミリリットルを追加します。
- 21のx 14.5センチメートルの肉トレイに混合物を注ぎます。 17トレイ - ボリュームは15をカバーするのに十分であることを確認してください。固化し、乾燥を避けるために、プラスチックフィルムで各トレイをカバーするために20分 - 10待ちます。 1 Lのいくつかのフラスコを同時に製造することができます。必要になるまでプラスチックに包まれた4ºCで糖蜜トレイを保管してください。
- 大人のハエとケージの中に濡れた酵母で覆われた糖蜜トレイを追加します。
- プレートを追加する前に、30分間の低温室で4ºCでケージを置きます。
- ビーカーに脱イオンH 2 Oの200ミリリットルを加え、スプーンで撹拌しながら、ゆっくりと乾燥酵母を注ぎます。混合物は、約食品に立ち往生ハエを防ぐために、ピーナッツバターの一貫性になったときにドライイーストを加える停止します。
注:食品の溶液は、カバーすることは非常に困難であろう他の方法で凝固させないことが重要です糖蜜は(セクション4.3を参照)トレイと収穫プロセス中に卵を抽出します。 - 1糖蜜トレイからプラスチックフィルムを取り外し、スプーンまたはスパチュラを用いて新たに調製したウェット酵母の層でそれをカバーしています。表面全体が覆われていることを確認してください。
- ケージが冷たい部屋に入れたまま、ネットを開き、慎重にケージに濡れた酵母と糖蜜トレイを追加します。ネットを閉じて、RTでケージを置きます。
注:挿入中に空の肉のトレイにプレートをカバーするのに有用であることが、糖蜜トレイにハエのアクセスをブロックしないようにしてください場合があります。
- 乾燥しすぎ得るために酵母を避けるために、48時間 - 食品皿ごとに24を変更します。大人のハエは、乾燥に非常に敏感です。
サイクルの4終了:胚を収穫
注:最高のフライの肥沃度が3 - 5日羽化後。したがって、この時間の間に収穫は最高の胚の収量を取得します。希望のコレクションはcompleされた後テッドは、サイクルが終わりました。ハエが犠牲にされるべきであり、ケージがステップ2.2で指定されるように洗浄します。
- セクション3.2.5で説明したように一般的に、2日間フライ羽化後、ケージに新鮮なウェットフードを使用して新しい糖蜜トレイをご紹介します。卵堆積の収率を増加させるために、指の助けを借りて、できるだけ湿潤酵母の表面のような不規則します。古い食品トレーがケージの中に存在する場合、新しいプレートを追加する前に、慎重にそれを削除し、バイオハザードバッグにそれを捨てます。収量を増加させるための別のチップは、すべての卵が食品に敷設されるように綿の層を除去することです。 RTでケージを維持します。
- 小さな白い点として胚を観察します。
注:卵を収集する準備ができています。フライケージの定期的なメンテナンスのために、2日間のコレクションが推奨される時間です。このコレクションは、主に胚および少数の1 番目の齢幼虫が含まれています。様々なコレのための収穫胚の典型的な収量のための代表的な結果を参照してください。ction時点。 - 胚を収穫
- 約30分間の低温室でケージを置きます。セクション1で説明したようにその間に次のサイクルのためのプラスチック容器やフライ食品を準備します。
- 8 Lのオートクレーブトレイで、総容量の1/4まで水を追加し、10%トリトンX-100の1ミリリットルを追加します。ケージは低温室でありながら慎重に糖蜜プレートを取り外し、バイオハザードバッグの内側に配置します。
- 袋からトレイを取り外し、すぐにそれを沈めるオートクレーブトレイの洗剤溶液中で(逃げるのハエを防ぐため)。バイオハザードバッグを閉じて、バイオハザード容器に入れ。ハエは、洗剤を含まない水に溺れないであろう。
- 糖蜜のオフ胚および酵母を洗浄するために大規模な絵筆と蒸留水の銃を使用してください。バイオハザードボックスにプレートと糖蜜を捨てます。
- 3ふるいセット(上部の粗いふるい30、真ん中に40と底部の100)を介して慎重にソリューションを注ぎます。ウォッシュ塊Onは蒸留水銃を持つトップレベルには塊がなくなるまで。
注:大人のハエと第3齢幼虫はふるい30に保持されます。- 蒸留水でオートクレーブトレイをすすぎ、ふるいを通してすすぎ水を注ぎます。トップふるいを削除し、酵母塊が残っている場合、プロセスを繰り返します。 1 番目と2 番目の齢幼虫のすべてのほとんどは、篩40のままになります。
- 第2のシーブを削除してください。第三(下)ふるいで黄色がかった材料は、胚および小1 番目の齢幼虫の混合物です。ふるいの片側にすべての卵を移動するために、蒸留水の銃を使用してください。スパチュラでそれらを収集し、それらの重量を量ります。
- これらのサイクルの間の胚/幼虫の回収収率は7と13グラムの範囲です。新しいサイクル(セクション1)を起動するには、この材料の唯一の1.5グラムを使用してください。更なる処理のための胚の残りの部分を使用するか、廃棄することができます。
5.さらに、処理
注:人口の継続のために利用されない胚を実験のために直ちに使用することができるか、あるいは-80ºCで凍結することができます。両方のオプションについては、胚は最初にdechorionatedする必要があるかもしれません。
- dechorionationについては、50%の漂白剤溶液中で2分間胚を洗浄し、蒸留水でよくすすぎます。
- ペーパータオルで強く押して胚、第1のドライ、凍結した後、15または50ミリリットルコニカルチューブに、へらの助けを借りて、それらを比較検討し、配置します。最後に、数秒間、液体N 2にコニカルチューブを沈めます。
結果
フライケージ集団の維持は、ハエのライフサイクルに基づいています。したがって、プラスチック容器に( 図1A)胚および幼生の初期生物学的混合物を配置した後、受精卵は、これ以上の2日以内に幼虫になりますし、幼虫は4日間増殖し、比較的(異なる齢幼虫の段階を経て同期) 図1Bを参照してください。
幼虫は第3齢幼虫の段階を完了した後、彼らは蛹になると蓋( 図1C)の内部表面上のいくつかのプラスチック容器内の綿の表面をカバーします。ハエは変態のプロセスを終了するまで、この蛹期間は、次の4日間のために行くだろう。この期間中に強くケージにハエを転送することをお勧めします。後に10 - 最初の成虫は9日目に孵化するために開始されますそれらのすべてのサイクル( 図1D)の日11による開始は蛹から浮上しているだろう。
5日羽化(13日目〜15)の後、最終的に17日目の下落(7日羽化後) - 胚コレクションの最高の収量が3得られます。したがって、13日目での生鮮食品の最後のトレイを追加し、15日目の卵( 図1EおよびF)を収集することをお勧めします。これは、胚の最大数の収集を可能にします。 表1は、各サイクルで1.5グラムの出発物質で、6つの連続サイクルコレクションの収率を示している。食品が乾燥しすぎている可能性があり、その結果、収集した胚の収率が減少する収集する前に三日余分を追加し、 図2全サイクルの収集のための推奨される予定です。
2日に収穫物60;期間は、主に胚から構成されています。しかし、幼虫の数が少ないにも存在します。ケージのメンテナンスのために、これらの幼虫は、非同期のある程度が期待されているので、問題はありません。それにもかかわらず、いくつかの生化学的実験のために、これらの胚の純度は非常に重要であるが、同時にこれらの実験を実行するために卵を大量に収集するためにも必要です。この理由のためにいくつかの短い連続したコレクションを迅速に室温で食品と新しいプレートを追加した後、この方法で得られる収率および純度の評価を提供するために、1時間、3時間で行った( 表2および図3) 。 1時間の連続したコレクションは、非常に低い収率(14.5 mg)を用いて開始したが、その後胚の量は毎回収集が、最後の時間のために増加しました。最初は低い収率は、食品を変更したが、後に順応する過程で強調されているハエに起因する可能性があります。一方、LARありませんVAEは、より短いコレクションは高純度をもたらすことを示し、5シーケンシャルコレクション( 図3A)で観察されました。綿がケージから削除されていない場合は、以前の時点から幼虫可能性が新鮮なプレートが増加されたままとなります。綿が削除された場合であっても、時間に幼虫は、ケージの側面にさまようし、収集中に食べ物を入力します。
3時間連続したコレクションの場合、収量は840から約1時間のコレクションで得られる収率よりも10倍以上である1250 mgの、の範囲でした。これらの胚の純度は100%( 図3B)の近くにありました。時折幼虫が観察されました。いくつかの発達の研究では、収集された胚のための非常に厳格な同期を必要とします。条件が理想的ではない場合、女性はより成熟した卵を保持し、堆積することができるので、同期の純度を高めるためには、最初のコレクションプレートを破棄することをお勧めします条件は、このような新しいプレートの導入と同様に、改善メートル。また、高齢者のハエ(> 6日)が少ない同期胚を作り出すことを知っておくことが重要です。高精度の同期の程度を確認するために、収集された胚のDAPI染色をお勧めします。

図1. フライ人口ケージ内の キイロショウジョウバエ のライフサイクルは、サイクルの(A)開始はプラスチックの箱の容器に胚の1.5グラムを播種します。基準として、下のパネルでは、フィルタ紙の長さ8.5 cmです。 (B)幼虫は比較的5日サイクルの開始後に同期し成長しています。 8日目において(C)は 、ハエのほとんどは、蛹の段階にあります。 B(B ')とCで下パネル (C ')は 、上部のパネルで示された領域の倍率です。 (D)大人のハエは、10日周期の開始後に蛹から現れました。 (E)大人の胚を収集するプロセスを開始する前に、人口のケージの内側に飛ぶ、15日目でのフライ食品に黄色がかった材料は、受精卵です。 100粗いふるいの底に収集された(F)胚(およびいくつかの幼虫)は、全体のケージサイクルの後。 この図の拡大版をご覧になるにはこちらをクリックしてください。
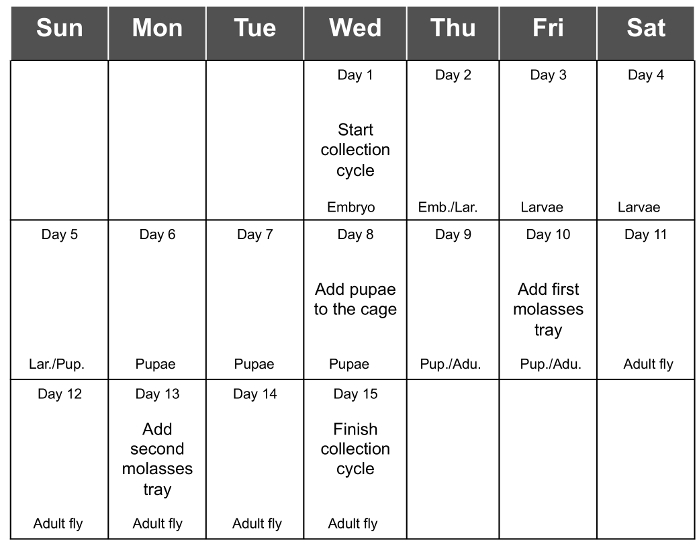
図2.全サイクルの収集スケジュール。図2は、完全なサイクル・コレクションの推奨スケジュールを示しています。トン= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
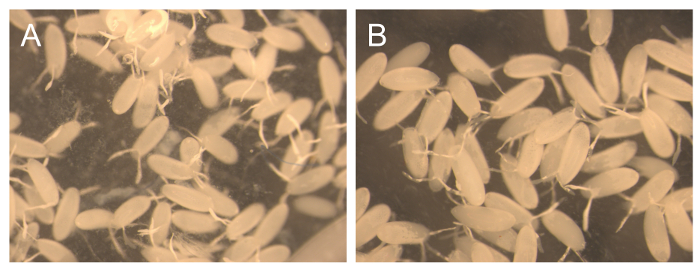
1時間、3時間連続したコレクションの図3.純度。1時間(A)で収集した胚や食品の新たなトレイを追加した後3時間(B)の代表的な画像。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| サイクル数 | 収量(G) |
| 1 | 10.3 |
| 2 | 9.5 |
| 3 | 10.3 |
| 4 | 12.7 |
| 5 | 10 |
| 6 | 7.1 |
| コレクション# | コレクションの長さ(時間) | 収量(mg)を |
| 1 | 1 | 14.5 |
| 2 | 1 | 21.6 |
| 3 | 1 | 56.1 |
| 4 | 1 | 160.1 |
| 5 | 1 | 106.1 |
| 1 | 3 | 960 |
| 2 | 3 | 840 |
| 3 | 3 | 1250 |
表2 1時間、3時間連続コレクションの収量 。 表2は、新たな糖蜜プレートを配置した後、新しい食品と3回連続コレクション3時間を追加した後、1時間5回連続コレクションの収率を示しています。
ディスカッション
材料1の1.5グラムで起動すると、サイクルごとに7と13グラムの間に収集された胚の収率を得ることができます。そのような材料の量を得るためには、フライサイクルのすべての段階のための右の培養条件を維持することが重要です。
最も重要なパラメータは、それぞれ、24ºC35%であるべきである温度及び湿度です。これら2つのパラメータは、実験室の通常の環境下で一定に保つことができない場合、一つの可能性は、インキュベータまたは環境室にフライケージを配置することであろう。他のプロトコルは産卵9,10の収量を増加させるために70%の湿度も一定の24時間の明暗サイクルをお勧めします。しかし、35%の周りの湿度を維持することは細菌汚染を回避し、このプロトコルの目的は、人口のケージのメンテナンスだけであるため、ハエは、ラボの通常の光環境に保存されています。
もう一つ重要な点は、ジを維持することです大人へのsturbancesはできるだけ低く飛びます。他のハエからの交差汚染を避けるために、フライ部屋から別の場所にケージを保つことが望ましいことがあります。
それは彼らの純度を維持するために、彼らは大規模な人口ケージ14に顕著な異常な交尾行動を示すことが非常に困難であるため、トランスジェニックおよび変異ハエの大集団の培養は、推奨されません。
一つの可能性のある問題は、大量にショウジョウバエを培養しながら、食品のために競うため、生産卵の収量を減少させるダニおよび/ またはカビのような他の生物の存在です。これを避けるために、きれいなすべての機器を維持するために非常に重要であるケージを洗浄し、ネット、水と石鹸でボックスを飛ぶし、すべてのサイクルの後に使い捨て材料(発泡栓)を廃棄します。ステップにおいてフライ食品を製造する場合、金型成長を減少させるために、プロピオン酸およびリン酸が湿潤酵母に添加します1.2とTegoseptステップ3.1で糖蜜トレイを準備します。時間が短く、材料はすぐに洗浄することができないときに-20℃で、このようなプラスチックの箱や篩などの材料を配置することも、役に立つ場合があります。
胚はフライボックスに播種し、最後の収集日で終了したときに開始、15日 - コレクション全体のサイクルが14で起こります。この間、プロトコルセクションで詳述人口フライケージ( 図2)、の維持に必要なすべてのステップを覚えておくために、スケジュールを整理することをお勧めします。成虫が出現するまで卵は、播種することを日から、唯一のプラスチックの箱を検査する必要があり、蛹化が発生したときに、ケージの内側に配置します。胚は新しいサイクルのために播種するまで3日 - その後、ハエは、すべての2を供給しなければなりません。全体のプロトコルでは、最も長い日が新しいサイクルを開始するための胚の収集および播種の間にあります。 A5日大人の羽化後、最後に2日後に低下 - プロトコルにコメント秒、最高の卵の収量は3です。これは、卵の収穫が実行される中で一日を選択するために私たちにいくつかの柔軟性を提供します。
収集された胚の収率は所望の出発量(1.5グラム)未満の何らかの理由により、1は常に新しい糖蜜トレイを追加し、次の日より多くの卵を集めることができます。一定のコレクションのために、並列に2ケージを維持するために推奨され、そして胚のより高い量が必要な場合、また、大きなケージを使用することが可能です。短時間のコレクションを行う場合には、収量を増加させる一つの方法は、午前中に産卵バーストを利用することです。
種々の発生段階を大量に収集する多くの利点があります。例えば、人口のケージから収集した胚は、免疫沈降アッセイ6-8、質量collectioで非常に首尾よく使用されてきました解離した幼虫から幼虫組織のnが3C実験4およびRNA調製15のための非常に良い源であることが実証されていて、大人のハエからのヘッドはChIP実験16のために利用されてきました。また、成人は、しばしば、組織培養用17ハエ抽出物を作るために必要とされます。
ケージの最も有望な用途の一つは、病原体、生体分子、化学物質及び電離放射線の暴露に応答した遺伝子、転写産物、タンパク質および代謝産物の分析及びスクリーニングを可能にするハイスループットアッセイのための材料を提供することにあります。これらの大規模アッセイにおいて個体の多数が必要とされており、ここで説明するハエ集団ケージは、その分析およびスクリーニング18のためのショウジョウバエのライフサイクルの異なる段階中に材料の大きな量を得るために非常に有用であることができます。
開示事項
The authors have nothing to disclose.
謝辞
We thank Yixian Zheng (Carnegie Institution of Washington, Baltimore, MD) for the original protocol and assistance in initial setup and members of the Lei laboratory for critical reading of the manuscript. This work was funded by the Intramural Research Program of the National Institute of Diabetes and Digestive and Kidney Diseases.
資料
| Name | Company | Catalog Number | Comments |
| Bacto-Agar | Beckton Dickinson | 214010 | |
| Curity practical cotton roll | Kendall | 2287 | |
| Dry yeast | Affymetrix | 23540 | |
| Filter paper | GE Healthcare Life Science | 1001-085 | |
| Foam tube plugs | Jaece | L800-D2 | 50 mm Diameter x 55 mm Length |
| Fly population cage | Flystuff | 59-116 | 9″ Diameter x 14.4″ Length. Includes the nets for the cage. |
| Meat tray | Genpak | 1002S (#2S) | 8.25 x 5.75 x 0.5 inches |
| Molasses | Grandma´s | ||
| Plastic container | Rubbermaid | 4022-00 | |
| Plastic film | Glad | ||
| Phosphoric acid | Fisher Scientific | S 93326 | Toxic. Handle in Chemistry Hood |
| Propionic acid | Fisher Scientific | A258-500 | Toxic. Handle in Chemistry Hood |
| Stainless steel sieve #100 | VWR | 57324-400 | |
| Stainless steel sieve #40 | VWR | 57324-272 | |
| Stainless steel sieve #30 | VWR | 57324-240 | |
| Sucrose | MP | 152584 | |
| Tegasept | LabScientific | FLY5501 | |
| Triton-X100 | Fisher Scientific | BP151-500 |
参考文献
- Lim, S. J., Boyle, P. J., Chinen, M., Dale, R. K., Lei, E. P. Genome-wide localization of exosome components to active promoters and chromatin insulators in Drosophila. Nucleic Acids Res. 41, 2963-2980 (2013).
- Ong, C. T., Van Bortle, K., Ramos, E., Corces, V. G. Poly(ADP-ribosyl)ation regulates insulator function and intrachromosomal interactions in Drosophila. Cell. 26, 148-159 (2013).
- Gonzalez, I., Mateos-Langerak, J., Thomas, A., Cheutin, T., Cavalli, G. Identification of regulators of the three-dimensional polycomb organization by a microscopy-based genome-wide RNAi screen. Mol Cell. 8, 485-499 (2014).
- Magbanua, J. P., Runneburger, E., Russell, S., White, R. A variably occupied CTCF binding site in the ultrabithorax gene in the Drosophila bithorax complex. Mol Cell Biol. 35, 318-330 (2014).
- Maksimenko, O. Two new insulator proteins, Pita and ZIPIC, target CP190 to chromatin. Genome Res. 25, 89-99 (2015).
- Lei, E. P., Corces, V. G. RNA interference machinery influences the nuclear organization of a chromatin insulator. Nat Genet. 38, 936-941 (2006).
- Matzat, L. H., Dale, R. K., Moshkovich, N., Lei, E. P. Tissue-specific regulation of chromatin insulator function. PLoS Genet. 8, e1003069 (2012).
- King, M. R., Matzat, L. H., Dale, R. K., Lim, S. J., Lei, E. P. The RNA-binding protein Rumpelstiltskin antagonizes gypsy chromatin insulator function in a tissue-specific manner. J Cell Sci. 1, 2956-2966 (2014).
- Sisson, J. C. Culturing large populations of drosophila for protein biochemistry. Cold Spring Harb Protoc. , (2007).
- Shaffer, C. D., Wuller, J. M., Elgin, S. C. Raising large quantities of Drosophila for biochemical experiments. Methods Cell Biol. 44, 99-108 (1994).
- Roberts, D. B., Standen, G. N., Roberts, D. B. The elements of Drosophila biology and genetics. Drosophila: A practical approach. , 1-53 (1998).
- Ashburner, M., Roote, J. Culture of Drosophila: The laboratory setup. Cold Spring Harb Protoc. , (2007).
- Dahlberg, O., Shilkova, O., Tang, M., Holmqvist, P. H., Fb Mannervik, M. P-TEb, The super elongation complex and mediator regulate a subset of non-paused genes during early Drosophila embryo development. PLOS Genet. 13, e1004971 (2015).
- Zhang, S. D., Odenwald, W. F. Misexpression of the white (w) gene triggers male-male courtship in Drosophila. Proc Natl Acad Sci USA. 6, 5525-5529 (1995).
- Chak, L. L., Mohammed, J., Lai, E. C., Tucker-Kellogg, G., Okamura, K. A deeply conserved, noncanonical miRNA hosted by ribosomal DNA. RNA. 21, 375-384 (2015).
- Moshkovich, N., Lei, E. P. HP1 recruitment in the absence of argonaute proteins in Drosophila. PLOS Genet. 12, e1000880 (2010).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol Rev. 63, 411-436 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved