Method Article
Grabación de ratón de ultrasonidos Las vocalizaciones de Evaluación de la Comunicación Social
En este artículo
Resumen
Mouse ultrasonic vocalizations are used as proxies to model the genetic bases of vocal communication deficits in mouse models for neuropsychiatric disorders. The present protocol describes three experimental contexts that reliably elicit ultrasonic vocalizations from pups (throughout development) and adult mice (same-sex interactions, male-estrus female interactions).
Resumen
Mice emit ultrasonic vocalizations in different contexts throughout development and in adulthood. These vocal signals are now currently used as proxies for modeling the genetic bases of vocal communication deficits. Characterizing the vocal behavior of mouse models carrying mutations in genes associated with neuropsychiatric disorders such as autism spectrum disorders will help to understand the mechanisms leading to social communication deficits. We provide here protocols to reliably elicit ultrasonic vocalizations in pups and in adult mice. This standardization will help reduce inter-study variability due to the experimental settings. Pup isolation calls are recorded throughout development from individual pups isolated from dam and littermates. In adulthood, vocalizations are recorded during same-sex interactions (without a sexual component) by exposing socially motivated males or females to an unknown same-sex conspecific. We also provide a protocol to record vocalizations from adult males exposed to an estrus female. In this context, there is a sexual component in the interaction. These protocols are established to elicit a large amount of ultrasonic vocalizations in laboratory mice. However, we point out the important inter-individual variability in the vocal behavior of mice, which should be taken into account by recording a minimal number of individuals (at least 12 in each condition). These recordings of ultrasonic vocalizations are used to evaluate the call rate, the vocal repertoire and the acoustic structure of the calls. Data are combined with the analysis of synchronous video recordings to provide a more complete view on social communication in mice. These protocols are used to characterize the vocal communication deficits in mice lacking ProSAP1/Shank2, a gene associated with autism spectrum disorders. More ultrasonic vocalizations recordings can also be found on the mouseTube database, developed to favor the exchange of such data.
Introducción
Los pacientes con trastornos neuropsiquiátricos suelen mostrar déficits en la comunicación social (por ejemplo, los pacientes con trastornos del espectro del autismo, la esquizofrenia o la enfermedad de Alzheimer) 1. Modificaron genéticamente ratones son cada vez más frecuentemente utilizados para modelar las causas genéticas de estos trastornos 2. El estudio de la comunicación social en estos modelos de ratón es de gran interés para la comprensión de los mecanismos de mutaciones genéticas que conducen a disfunciones sociales atípicas y para probar nuevas terapias. Dado que los ratones son animales sociales y se comunican entre otros usando olfativo, táctil, señales visuales y acústicas, que son modelos adecuados para evaluar la comunicación social.
Vocalizaciones ultrasónicas ratón ahora se utilizan actualmente como un proxy para el modelado de las bases genéticas de déficit de comunicación vocal 3,4 (pero la existencia de aprendizaje vocal en esta especie aún se debate 5,6, aunque la mayoría de los estudios recientes ARGUe por la ausencia de aprendizaje vocal 7). Los ratones de laboratorio se han encontrado para emitir vocalizaciones ultrasónicas en las relaciones madre-hijo, en las interacciones socio-sexuales entre hombres y mujeres, en las interacciones sociales del mismo sexo (revisado en referencia 8) y en las interacciones sociales juveniles-juvenil 9. Las crías de ratón emiten llamadas de aislamiento durante sus dos primeras semanas de vida cuando se aíslan de la presa y sus compañeros de camada 10. Los machos emiten vocalizaciones ultrasónicas cuando está en presencia de una hembra estro (o señales urinarios de ella) 11,12. Los machos y las hembras emiten vocalización ultrasónica al interactuar con una misma especie desconocida del mismo sexo 13,14. La organización y funciones de estas vocalizaciones no son del todo claras y necesitan más investigaciones. El conocimiento actual sobre el aspecto funcional se limita a la obtención de un comportamiento de recuperación en las madres escuchar las llamadas de aislamiento de las crías, la facilitación de la proximidad de las hembras adultas hacia vocalizat varón adultoiones 15 y el aumento de la conducta exploratoria de los varones adultos auditivos para adultos vocalizaciones femeninas 16.
La caracterización de las alteraciones en la comunicación vocal en modelos de ratón de los trastornos neuropsiquiátricos debe llevarse a cabo en condiciones estandarizadas para descartar la importante contribución de las condiciones experimentales. Tales caracterizaciones, en combinación con la evaluación de las interacciones sociales simultáneas y estudios neurobiológicos, en diferentes modelos genéticos deberían mejorar nuestro conocimiento sobre la contribución genética a los diferentes aspectos de la comunicación ultrasónica del ratón. Durante un largo plazo, debe dar más luz sobre algunas bases neurobiológicas de la comunicación social en los seres humanos. actualmente Nuestro objetivo es proporcionar protocolos sencillos para obtener de forma fiable las vocalizaciones ultrasónicas durante el desarrollo y en la edad adulta, tanto para ratones macho y hembra en el laboratorio. Dichos protocolos deberían facilitar la normalización de las grabaciones para comparar de manera más fiable ultrlas emisiones de vocalización Asonic entre las cepas y laboratorios. También debería facilitar la creación de tales grabaciones en laboratorios que no tienen experiencia previa con vocalizaciones ultrasónicas grabaciones de ratón. También destacamos la posibilidad actual para combinar los datos de vocalizaciones ultrasónicas con los datos detallados de comportamiento recogidos de forma simultánea durante las interacciones sociales en ratones adultos, para obtener información crucial sobre deficiencias sociales, así como en el contexto de la emisión de vocalizaciones ultrasónicas. Tales análisis arrojen nueva luz sobre la organización y funciones de las vocalizaciones ultrasónicas de ratón. Por último, también publicidad de la posibilidad de compartir las grabaciones de vocalización ultrasónica con toda la comunidad científica sobre la base de datos mouseTube (http://mousetube.pasteur.fr). El acceso abierto a los datos de grabación de audio debe aumentar el conocimiento sobre la comunicación ultrasónica del ratón, permitiendo a los científicos comparar sus propios datos con vocalizaciones ultrasónicas registradas en otras laboratorios (con cepas / protocolos similares o diferentes), y / o para desafiar a sus métodos de análisis con archivos grabados en diferentes condiciones.
Protocolo
Ética declaración: Los procedimientos que implican sujetos animales han sido aprobados por el Comité d'Ethique en Expérimentation animale (CETEA) n ° 89 en el Instituto Pasteur, París.
1. Preparación de los animales
- Para grabar las llamadas de aislamiento de las crías, las hembras embarazadas obtener a partir de la cepa de ratón de interés. Nota: raza machos y hembras heterocigóticos para obtener al menos 10 litros incluyendo de tipo silvestre, heterocigotos y knock-out para obtener crías de los animales de control robusto.
- Obtener dos categorías de ratones adultos para grabar vocalizaciones durante las interacciones entre personas del mismo sexo.
- Obtener al menos 12 machos o hembras 12 de cada genotipo como los ratones de prueba a partir de la cepa de interés (para tener en cuenta la variabilidad interindividual). Nota: Este protocolo está bien adaptada para los adultos, pero se puede ajustar a los menores, con una reducción de tiempo de aislamiento antes del experimento 9. Esta prueba funciona para hombres o mujeres. Sin embargo, evite las pruebas masculinas de cepas de ratones que muestran un fenotipo agresivo clara en la prueba de interacción social macho-macho.
- Para maximizar la cantidad de interacciones de afiliación, aislar los animales de ensayo antes de los experimentos. Casa individual varones durante 3 semanas (para reducir las interacciones agresivas al mínimo 14,17) y las hembras de 3 días (E. Ey, datos no publicados) para aumentar su motivación social.
- Obtener machos o hembras a partir de cepas representativas de los antecedentes genéticos de la cepa de prueba para utilizarlos como los recién llegados (por ejemplo, como los ratones que interactúan, ver 3.1.3). Por ejemplo, si la cepa mutante en estudio se ha generado en el fondo C57BL / 6J, utilizar ratones C57BL / 6J como los recién llegados. Calcular el número de animales necesarios para que cada uno de estos ratones no se utiliza más de 2 veces al día como recién llegado. Alojarlos en grupos.
- Obtener dos categorías de ratones adultos para grabar vocalizaciones del macho en presencia de una hembra estro.
- Obtener al leste 12 machos sexualmente maduros de cada genotipo de la cepa de interés (para tener en cuenta la variabilidad interindividual). Nota: Si los hombres nunca han tenido experiencia con las mujeres antes, ponerlos en jaulas individuales y dejarlos pasar una noche con una hembra de dos días antes de la prueba para aumentar su motivación para emitir vocalizaciones ultrasónicas 6.
- Obtener hembras sexualmente maduras a partir de la cepa de fondo de los machos registrados. Por ejemplo, si los machos mutantes siendo estudiados se han generado en el fondo C57BL / 6J, utilice C57BL / 6J hembras. Calcular el número de hembras necesarias para que cada uno de estos ratones no se utiliza más de 3 veces al día. Alojarlos en grupos.
2. Pide aislamiento Pup
- identificación de las crías
- Tres días antes de que el día predicho de nacimiento, aislar las hembras embarazadas.
- Compruebe las hembras de luz cada mañana y cada tarde. Tenga en cuenta el día de nacimiento como P0.
- Identificar los cachorros en P1 utilizando larga duración tatuajes pata (inyección subcutánea de tatuaje verde pasta con un 0,3 mm x 13 mm [30 G ½ "] aguja). Crear un código con uno, dos, tres o cuatro patas marcadas. Sea lo más rápido posible, para perturbar mínimamente los cachorros, y ponerlos de nuevo en el nido tan pronto como sea posible.
- Configurar la jaula a Llamadas de aislamiento Registro Pup.
- Utilice una cámara de hecho a sí mismo a prueba de sonido (Figura 1 A) o una caja de espuma de poliestireno sencilla. Coloque un termómetro dentro de la caja para controlar la temperatura para cada grabación. Asegúrese de que la temperatura se mantenga entre 18 ° C y 22 ° C.
- Colocar un micrófono en la parte superior (a través de un agujero en la parte superior de la caja). Ajuste la altura del micrófono para que la membrana del micrófono es de 12-15 cm por encima del fondo de la caja, donde el cachorro va a acostarse. Conectar el micrófono a la tarjeta de sonido y la tarjeta de sonido del ordenador.
- Para ajustar la ganancia del sound tarjeta, llevar a cabo una grabación de prueba con un cachorro que no será utilizado en el experimento. Ponga el cachorro en las mismas condiciones que en el experimento (véase 2.3.1). Cierre la puerta. Ajustar la ganancia de la tarjeta de sonido, por lo que es en el valor máximo (que tiene la mayor amplitud posible de las vocalizaciones), pero sin sobrecargar (comprobar en la pantalla espectrograma en vivo en el software de grabación).
Nota: Algunas llamadas pueden ser sobrecargados si la amplitud de la mayoría de las llamadas se mantiene en el nivel más alto posible. - Registrar el nivel de ganancia para cada sesión de grabación y no lo cambie entre cachorros camadas / / sesiones. Las variaciones en los niveles de ganancia daría lugar a la detección de llamadas inexacta y las variables medidas acústicas con los mismos umbrales en los análisis basados en la detección y medición (véase 5.1 a 5.4) automático.
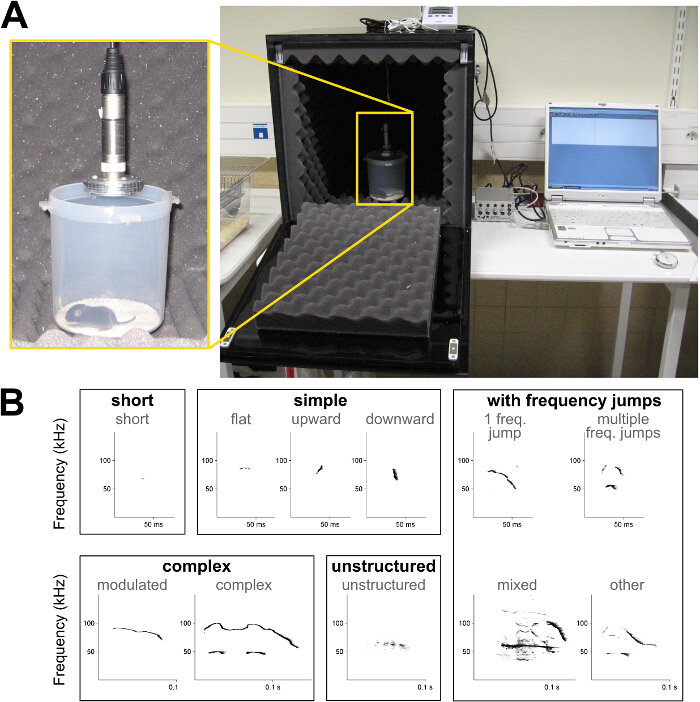
Figura 1: Configuración para la grabación de llamadas de aislamiento crías de ratón y espectrogramas de vocalizaciones ultrasónicas (A) Ejemplo de una cámara a prueba de sonido hecho a sí mismo para grabar las llamadas de aislamiento de las crías.. (B) Los espectrogramas de los diferentes tipos de llamadas utilizados en la presente clasificación de tipo de llamada; Véase la descripción en la Tabla 1. Haga clic aquí para ver una versión más grande de esta figura.
- Llevar a cabo la grabación de aislamiento pup llama cada dos días. Realizar grabaciones en la mañana para cachorros nacidos en la noche, y por la tarde para los cachorros nacidos durante el día para evitar la categorización de los mismos cachorros clases de edad con la mitad de un día de diferencia de edad. Esto es más notable para la etapa muy temprana P2 y P4.
- Tome un cachorro de la camada. Coloque lo más rápido y suavemente como sea posible en un recipiente de plástico se lavó con etanol al 10% y se secó (diámetro: 9cm; Altura: 10 cm para evitar que las crías de mayor edad se escape del área cubierta por el micrófono). Ponga el recipiente justo debajo del micrófono.
- Cierre el cuadro de forma más rápida y silenciosamente como sea posible. Iniciar la grabación de vocalizaciones ultrasónicas de crías en el software de grabación (formato de 16 bits, 300 kHz frecuencia de muestreo para capturar amplitud del sonido de hasta 150 kHz con una alta calidad).
- Una vez transcurrido el tiempo requerido de la grabación (hasta 5 minutos), detener la grabación. Tome el cachorro fuera de la caja. Anote los tatuajes pata del cachorro.
- Tomar la temperatura axilar del cachorro con una sonda de termómetro. Marcar el cachorro en su parte posterior con un punto minúsculo, con una pluma olor-menos (tinta al agua), para reconocer más fácilmente los cachorros ya grabadas en el nido cuando se elige el siguiente y evitar la manipulación de todos los cachorros cada vez que un nuevo es elegido. Ponga el cachorro de nuevo en el nido.
- Se lava el recipiente de plástico y el plástico que cubre su parte inferior con 10% de etanol y se seca bienantes de colocar la siguiente crías en el interior.
- Elegir el siguiente cachorro de la camada y repetir 2.3.
- Compruebe el peso corporal, la coordinación motora, geotaxis negativos, y las marcas de desarrollo (para más detalles de la batería de pruebas reducida consulte las secciones de métodos en Schmeisser et al. 18 y en Ey et al. 19) después de un período de descanso de 1 hora para permitir los cachorros se recuperen después de la emisión de vocalizaciones ultrasónicas agotador. Use otra cohorte de animales si la batería de pruebas de desarrollo completo, como en Chadman et al. 20 y Scattoni et al. 21 se lleva a cabo.
- Repita estas grabaciones cada dos días entre P2 y P12 para caracterizar el comportamiento vocal cachorro y el desarrollo en sus dos primeras semanas de vida.
3. Ultrasonic vocalizaciones durante el mismo sexo interacciones sociales
- Grabaciones de vocalización
- Preparar una jaula de ensayo (50 x 25 cm x 30 cm 3; Plexiglás, 100 lux [luz blanca de baja intensidad]) limpiarse con agua y jabón, se secan y se llenaron con 2 cm de material limpio en la cámara a prueba de sonido.
- Coloque el micrófono de forma que las vocalizaciones emitidas desde todos los rincones de la jaula se pueden grabar. Fijar el micrófono en una esquina de la jaula de prueba (ya sea en la jaula o en un trípode) y ajustar la parte inferior del micrófono de jaula de ángulo para cubrir toda la superficie de la jaula.
Nota: Los ultrasonidos son muy direccionales. - Colocar una cámara de vídeo en la parte superior de la cámara a prueba de sonido para captar toda la superficie de la jaula de ensayo.
Nota: Compruebe que el micrófono no está ocultando una esquina de la jaula de ensayo en el vídeo. - Antes del ensayo, ajustar la ganancia de la tarjeta de sonido con un macho y una hembra de repuesto de repuesto que no será utilizado en el experimento posterior. Ponga estos animales en la jaula de prueba en la cámara de registro. Ajuste el nivel de ganancia en la tarjeta de sonido para maximizar la amplitud de las vocalizaciones grabadas but para minimizar la sobrecarga como se ve en la pantalla espectrograma en vivo en el software de grabación.
Nota: La ganancia depende de la distancia entre el micrófono y los animales vocalización.
- Coloque el micrófono de forma que las vocalizaciones emitidas desde todos los rincones de la jaula se pueden grabar. Fijar el micrófono en una esquina de la jaula de prueba (ya sea en la jaula o en un trípode) y ajustar la parte inferior del micrófono de jaula de ángulo para cubrir toda la superficie de la jaula.
- Introducir el animal a ensayar (masculino o femenino, sino que será llamado el "ocupante") en la jaula de prueba en ropa de cama fresca. Deje que habituarse a la jaula de ensayo en la cámara a prueba de sonido durante 20 minutos para maximizar su interés para la misma especie desconocida introducido en 3.1.3.
- Después de este tiempo la habituación, introducir el animal 2º de la interacción (masculina o femenina, mismo sexo que el ocupante, pero diferentes marcas para las orejas / tatuaje de la pata para identificarlos más tarde, sino que será llamado el "recién llegado").
- Comenzar a grabar las vocalizaciones ultrasónicas (formato de 16 bits, frecuencia de muestreo de 300 kHz para capturar amplitud del sonido de hasta 150 kHz con una alta calidad) y el vídeo para capturar la introducción del recién llegado en la jaula de ensayo. Comienza la grabación del Tvocalizaciones ltrasonic durante la habituación (ocupante solo) si se necesita una comparación entre el nivel de referencia de emisión de la vocalización durante la exploración de la jaula y la interacción social.
- Sincronizar manualmente visualmente las grabaciones de vídeo / audio y pulsando en el reloj de tiempo (sonido "bip" cerca del micrófono) exactamente cuando las patas traseras del ratón recién llegado tocan el suelo.
- Dejar los dos animales interactúan durante el tiempo deseado (por ejemplo, 4 min, un tiempo suficiente para recoger suficientes vocalizaciones ultrasónicas).
- Ponga el ocupante y el recién llegado de nuevo en sus respectivas jaulas. Vaciar la ropa de cama usada de la jaula de ensayo, lavar con agua y jabón y secar con toallas de papel. Ponga la ropa de cama fresca y colocarlo de nuevo en la cámara a prueba de sonido para la próxima prueba.
- Preparar una jaula de ensayo (50 x 25 cm x 30 cm 3; Plexiglás, 100 lux [luz blanca de baja intensidad]) limpiarse con agua y jabón, se secan y se llenaron con 2 cm de material limpio en la cámara a prueba de sonido.
4. vocalizaciones del macho durante la interacción con un estro Mujer
- Temprano por la mañana el día de la pruebavarones, toman frotis vaginal de cada hembra para determinar su condición sexual dentro del ciclo estral.
- Mantenga la hembra por la cola y mantener su posición de la parrilla jaula. Utilizar una pipeta para enjuagar la vagina varias veces con 20 l de PBS (es decir, inyectar y recordar las mismas 20 l de PBS varias veces). Recordar el 20 l de PBS con la misma punta de la pipeta. Utilice PBS estéril, para evitar cualquier infección si las hembras son para ser probado durante varios días consecutivos.
- Corre la PBS que contenía la suspensión de células vaginales en una diapositiva. Ponga cuatro muestras en una diapositiva (identificar a los individuos en el lado de la corredera con un lápiz). Deje que los portaobjetos se sequen antes de realizar la tinción.
- Trabajar bajo el extractor de laboratorio.
- Preparar un baño de puro May-Grünwald, un baño de solución de fosfato tampón (0,1 M) y un baño de Giemsa R (1/20 en solución tampón de fosfato).
- Ponga los portaobjetos en el baño de pura May-Grünwald durante 3 minutos, a continuación,enjuague en el baño de solución de tampón fosfato durante 1 min y finalmente transferirlos de 10 min en el baño de Giemsa R (1/20 en solución tampón de fosfato).
- Después de eso, enjuague las diapositivas de nuevo en el baño de solución tampón de fosfato durante 10 segundos y dejar que se sequen.
- Examinar los portaobjetos teñido bajo el microscopio. Las hembras que se pueden utilizar durante el día son aquellos cuyas muestras presentes sólo grandes células epiteliales cornificadas (sin núcleo, teñido en azul; estro completa).
- Ponga los machos en la sala de ensayo de al menos 30 minutos antes de ponerlos a prueba.
- Grabaciones de vocalización
- Repetir si es necesario 3.1.
- Introducir el macho a ensayar (en la ropa de cama fresca). Dejar le habituarse a la jaula de ensayo en la cámara de prueba de sonido de 10 min.
- Después de este tiempo la habituación, introducir una hembra en celo (entre los seleccionados de la tinción).
- Comenzar a grabar las vocalizaciones ultrasónicas y el videopara capturar la introducción de la hembra en la jaula de ensayo. Comenzar a grabar las vocalizaciones ultrasónicas durante la habituación (macho solo) si se necesita una comparación entre el nivel de referencia de emisión de la vocalización durante la exploración de la jaula y la interacción social.
- Sincronizar manualmente visualmente las grabaciones de vídeo / audio y pulsando en el reloj de tiempo (sonido "bip" cerca del micrófono) exactamente cuando las patas traseras del ratón hembra tocan el suelo.
- Dejar los dos animales interactúan durante el tiempo deseado (por ejemplo, 4 min, un tiempo suficiente para recoger suficientes vocalizaciones ultrasónicas).
- Ponga el macho y la hembra de nuevo en sus respectivas jaulas. Vaciar la ropa de cama usada de la jaula de ensayo, lavar con agua y jabón y secar con toallas de papel. Ponga la ropa de cama fresca y colocarlo de nuevo en la cámara a prueba de sonido para la próxima prueba.
Nota: Es óptimo utilizar cada mujer estro sólo una vez cada día (pero si es necesario se puedeser utilizado hasta 3 veces en el mismo día, pero no en una fila).
5. Variables a extraer
- Preparar los archivos de audio para los análisis. Nota: El siguiente procedimiento es específico de un ViSoft SASLab Pro y puede cambiar según el software utilizado.
- Cortar los archivos de manera que comiencen exactamente en el "bip" del reloj de tiempo, y después de terminar la duración deseada (5 min para las grabaciones de las crías, 4 min para las grabaciones de adultos).
- Filtrar la amplitud menor de 30 kHz mediante el uso de un filtro de paso alto (Editar> Filtro> Filtro FIR de dominio de tiempo; de paso alto con una frecuencia de 30 kHz cortada). Utilizar el procesamiento por lotes para filtrar todos los archivos de interés (Acciones> Procesamiento por lotes> filtro FIR).
- Identificar cada vocalización ultrasónica mediante su etiquetado con el software.
- Utilice la detección automática de las grabaciones de las crías (Herramientas> Etiquetas> Crear etiquetas de sección de eventos de forma de onda). Ajuste del umbral, el tiempo de retención y el margen de fo la detección más precisa. comprobar manualmente la detección y ajustar las etiquetas si es necesario (recomendado).
- Usar la detección visual (inserción manual de etiquetas) para grabaciones de adultos con el ruido de fondo (seleccione las vocalizaciones, haga clic derecho, e insertar la etiqueta de sección de marcador).
- Crear el espectrograma. Activar las medidas automáticas de parámetros (Herramientas> Las mediciones de parámetros automáticos> mediciones de parámetros de Configuración automática).
- Marque la casilla "Habilitar medidas automáticas", los "parámetros Calcular la totalidad de espectrograma", y las cajas de "actualización automática". Seleccione "separación de elementos": de forma interactiva (etiquetas de sección).
- Las casillas de verificación para calcular los parámetros deseados temporales (Duración del elemento, a intervalos, de inicio / Hora de finalización) y los parámetros basados en el espectro (frecuencia de pico), y la localización de las mediciones (Inicio del elemento, Fin del elemento, media, máxima, mínima) .
- Copiar las mediciones y pegar elm en una hoja de cálculo.
Nota: Para las grabaciones realizadas con los adultos, las mediciones de parámetros basados en el espectro podría ser imposible debido al ruido de fondo. Utilizar las mediciones manuales de frecuencia pico haciendo clic en los diferentes valores de frecuencia directamente en el espectrograma y pegar los valores manualmente en una tabla.
- Determinar la tasa de llamada, es decir, el número de llamadas por minuto determinando en primer lugar el número de vocalizaciones emitidas (número total de etiquetas). Entonces, el cálculo de la tarifa de llamadas dividiendo el número total de vocalizaciones grabadas por la duración (en minutos) del archivo.
- Determinar la organización temporal, es decir, la distribución de los intervalos de tiempo entre las llamadas para determinar la secuencia de la organización.
- Calcular los intervalos de tiempo entre el final de la vocalización n y el inicio de la vocalización n + 1 utilizando el tiempo de inicio / fin de cada etiqueta.
- Establecer la densidad de distribución de los intervalos de tiempo entre ultrasonvocalizaciones CI.
- Determinar repertorio de llamada, es decir, definir los tipos de llamadas presentes en la grabación. Utilice el ejemplo de clasificación presentada en la Tabla 1 y la Figura 1B.
- Al etiquetar cada vocalización en el punto 5.1.3, escribir el nombre del tipo de llamada en la etiqueta.
- Calcular el número exacto y la proporción de cada tipo de llamada para construir el repertorio vocal.
- Determinar las características acústicas de cada vocalización, es decir, la duración, la frecuencia pico (es decir, la frecuencia con la amplitud más alta) en el comienzo y el final de la llamada, la frecuencia máxima y mínima de pico, y la media de la frecuencia si la medición automática es posible (Figura 1B) .
- Utilice la función automática de mediciones de parámetros en el software para medir la duración de forma automática, las características de los picos de frecuencia (por ejemplo, inicio, fin, media, máxima, mínima) en las grabaciones de las crías.
- Utilice la duración de la etiqueta como la duración de la vocalización para las grabaciones de adultos. Mida manualmente en la ventana de espectrograma de las características de frecuencia pico (por ejemplo, comienzo, al final, máximo, mínimo).
- Pareja de datos de interacción social, los datos y la vocalización ultrasónica (MiceProfiler plugin desde la plataforma ICY 22).
- Asegúrese de sincronizar la mayor precisión posible el las grabaciones de vídeo como se describe en el protocolo de audio y.
- Codificar el vídeo de la interacción social usando los ratones de perfiles Rastreador plug-in de la plataforma ICY como se describe en de Chaumont et al. 22. Inicia el seguimiento exactamente cuando las patas traseras del animal introducido tocan el suelo.
- Sube el archivo de vídeo codificado y su correspondiente archivo XML (generada por los ratones de perfiles tracker) en los ratones de perfiles de vídeo Label Maker plug-in de la plataforma ICY como se describe en de Chaumont etal. 22.
Nota: Los ratones de perfiles de vídeo Label Maker complemento enlazará automáticamente el archivo de vídeo y el archivo de texto generado a partir del análisis del archivo de audio si tienen el mismo nombre (ver: http://icy.bioimageanalysis.org/plugin/Mice_Profiler_Video_Label_Maker) . - Después de comprobar que la escala del ratón es correcta, haga clic en "crear" USV estadísticas para cada archivo para obtener el número y la proporción de vocalizaciones emitidas durante cada evento social en un archivo separado.
6. Carga de archivos en la base de datos mouseTube
- Asegúrese de que los archivos están en un servidor de almacenamiento que se puede acceder desde fuera de la institución.
Nota: Los servidores alojados en algunas instituciones con altos niveles de seguridad tendrán una configuración específica para ser accesible por las personas que se conectan desde fuera de la institución. - Ir a la página web mouseTube (http://mousetube.pasteur.fr). Conectarse (Entrar And contraseña se atribuyen a cada usuario por los administradores).
- Compruebe si la cepa de ratón ya grabada existe en la base de datos mouseTube haciendo clic en el botón "cepas". Si no es así, pida a los administradores para crearlo.
- Crear sujetos usando los "temas> Crear". Introduzca los códigos de identificación de los animales registrados. Reunirlos en grupos para facilitar la recuperación posterior de los datos.
- Introduce la descripción del protocolo que se utiliza para grabar vocalizaciones ultrasónicas utilizando los "Protocolos> Crear".
- Crear un experimento para cada sesión de grabación usando los "Experimentos> Crear". Especificar el protocolo, el grupo de individuos que han sido grabados, el hardware y el software utilizado y sus especificidades.
Nota: El experimento reúne todos los metadatos correspondientes a los archivos de vocalización. - Crear el enlace a los archivos de vocalización utilizando las vocalizaciones "> Crear & #34; botón. Seleccione el experimento dentro de la lista. Copiar y pegar la URL del archivo de la vocalización (este enlace comienza con http: // ...) en el campo correspondiente de la "Archivos para vincular" la columna. Validar las entradas haciendo clic en el botón "Crear un vínculo entre mouseTube y los archivos".
Nota: No se requiere para llenar cada casilla para cada archivo al mismo tiempo. - Si es necesario, modificar los enlaces introducidos en cualquier momento, y añadir detalles en la sección "Notas". No dude en escribir notas para dar más detalles. Por ejemplo, si se ha introducido un enlace hacia un archivo de vídeo que se grabó simultáneamente con el archivo de audio, esto se puede especificar en las "Notas".
Resultados
Con los protocolos actuales, que caracteriza el comportamiento vocal de los ratones que carecen ProSAP1 / SHANK2, un gen asociado con trastornos del espectro autista (TEA) 23-25. TEA se caracteriza por déficits en la comunicación social y los comportamientos estereotipados 1. Nuestros SHANK2 - / - ratones muestran hiperactividad, aumento de la ansiedad y la comunicación vocal atípica 18,26. De hecho, hemos observado que SHANK2 - / - ratones muestran un perfil de desarrollo atípico en su tasa de emisión de llamadas de aislamiento de las crías en comparación con la típica curva en forma de U invertida en sus compañeros de camada de tipo salvaje SHANK2 -. / - Ratones muestran una tasa de llamadas aumento en P4 y disminución de la tasa de llamadas en P6 en comparación con sus compañeros de camada de tipo salvaje (Figura 2). También se observó una tasa de llamadas disminución en las interacciones femeninas que implica un SHANK2 - / - femenino en COMPARACIÓNn con las interacciones que implican una camada de tipo salvaje (Figura 2). Se examinó el repertorio de los 5 diferentes categorías de llamadas. Parecía ser diferente entre las crías (por ejemplo aquí P2, P6 y P10) y adultos (Figura 3). diferencias relacionadas con el genotipo fueron significativos sobre todo en la edad adulta. Durante las interacciones sociales que involucran adultos SHANK2 - / - machos o hembras con una hembra C57BL / 6N, se registraron llamadas más cortas y llamadas no estructurados en comparación con las interacciones que implican sus compañeros de camada de tipo salvaje (Figura 3D y E). Las llamadas de menor complejidad y frecuencia de saltos también se registraron llamadas durante las interacciones con una hembra C57BL / 6N que implica SHANK2 adultos - / - hembras en comparación con las interacciones que implican SHANK2 + / + hembras (Figura 3E). Por último, también medimos las variables acústicas manualmente. No hubo significativo relacionado con el genotipo-du diferenciadesarrollo anillo. Por el contrario, la duración de las llamadas registradas durante las interacciones que implican SHANK2 adultos - / - hembras eran más cortos que los registrados durante las interacciones que implican sus compañeros de camada de tipo salvaje (Figura 4A). También destacamos que el pico de frecuencia de vocalizaciones ultrasónicas se incrementó durante el desarrollo de las crías, sin diferencia significativa relacionada con el genotipo-26. Durante las interacciones que implican SHANK2 - / - machos o hembras con una hembra C57BL / 6N, vocalizaciones ultrasónicas tenían una frecuencia pico más bajo en comparación con las llamadas grabadas durante las interacciones que implican sus compañeros de camada de tipo salvaje (Figura 4B).
Además, el presente protocolo también permitió estudiar el contexto de la emisión de vocalizaciones ultrasónicas mediante la combinación de los datos de las grabaciones de audio a los datos de comportamiento extraídos de MiceProfiler (software helado, Institut Pasteur, París). Por ejemplo, en las interacciones entre las hembras, la mayoría de las vocalizaciones ultrasónicas se emiten cuando los animales estaban en contacto y más específicamente el ocupante olfateando región ano-genital del recién llegado, o al menos el ocupante estar detrás del recién llegado. Los ratones también emite muchas vocalizaciones ultrasónicas cuando el ocupante se acercó al recién llegado (Figura 5, panel superior). Menos vocalizaciones se registraron cuando el ocupante SHANK2 - / - ratones estaban en contacto físico con el recién llegado (por ejemplo, olfateando la región ano-genital del recién llegado) que cuando el ocupante era un ratón de tipo salvaje. Menos vocalizaciones se desencadenaron cuando el ocupante detrás del recién llegado era un SHANK2 - / - ratón que cuando era un ratón de tipo salvaje. Más vocalizaciones se registraron también cuando el recién llegado estaba en el campo visual del ratón de los ocupantes, y más aún en los tipos silvestres que en los mutantes (Figura 5, panel inferior).
s = "jove_content" fo: keep-together.within-page = "1"> 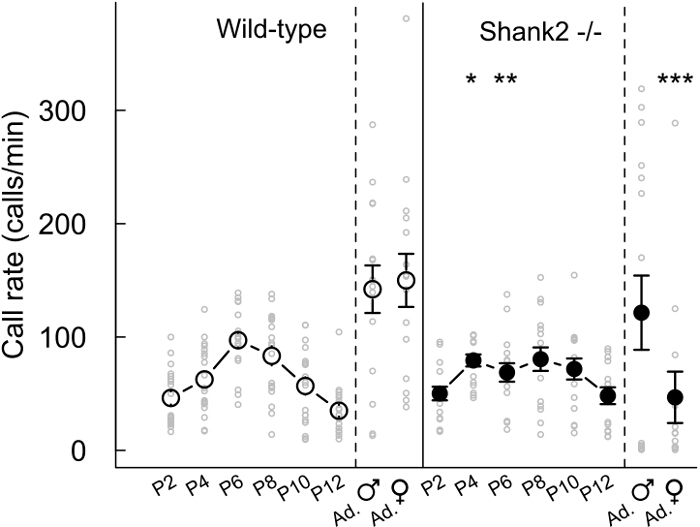
Figura 2:. Índice de emisión de vocalizaciones ultrasónicas durante el desarrollo y en el adulto de sexo masculino y femenino SHANK2 - / - de tipo salvaje ratones hermanos de camada y llamada tasa de crías (cada dos días a partir de P2 a P12, n = 18-19 SHANK2 + / +, n = 15-16 SHANK2 - / -) y adultos durante el macho-hembra en estro interacciones (n = 15 SHANK2 + / +, n = 16 SHANK2 - / -) y las interacciones hembra-hembra (n = 15 SHANK2 + / +, n = 13 SHANK2 - / -) en ratones de tipo salvaje (panel izquierdo) y SHANK2 - / - ratones (panel derecho). Los datos se presentan como media +/- SEM y puntos individuales (no apareados prueba de Wilcoxon: * p <0,05, ** p <0,01, *** p <0,001).ge.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
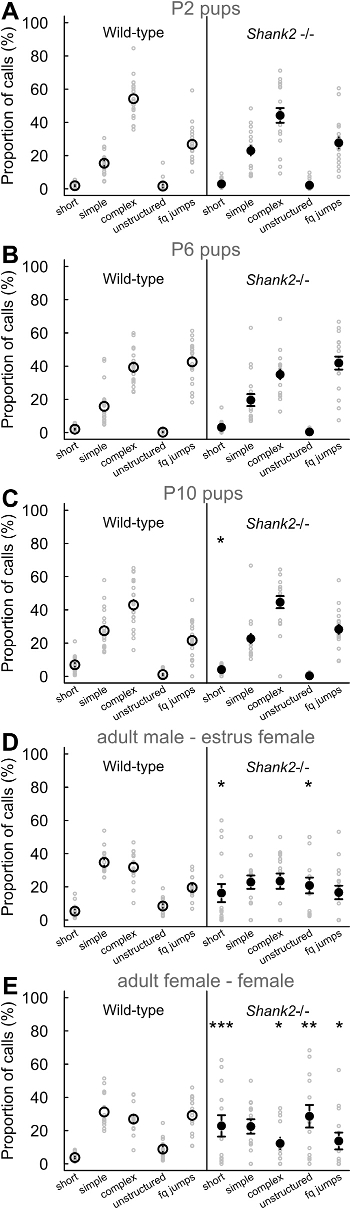
Figura 3:. Repertorio vocal de SHANK2 - / - ratones y de tipo salvaje de camada proporciones de los cinco tipos de llamada diferentes emitidas por cachorros P2 (A; n = 20 SHANK2 + / +, n = 18 SHANK2 - / -), crías P6 (B, n = 19 SHANK2 + / +, n = 18 SHANK2 - / -), los cachorros P10 (C; n = 20 SHANK2 + / +, n = 18 SHANK2 - / -), machos adultos con una hembra estro (D ; n = 16 SHANK2 + / +, n = 16 SHANK2 - / -) y adultos hembras con otra hembra (e; n = 15 SHANK2 + / +, n = 13 SHANK2 - / -) en ratones de tipo salvaje (paneles de la izquierda) y SHANK2 - / - ratones (paneles de la derecha). Los datos se presentan como media +/- SEM y puntos individuales (pruebas de chi-cuadrado: * p <0,05, ** p <0,01, *** p <0,001). Haga clic aquí para ver una versión más grande de esta figura.
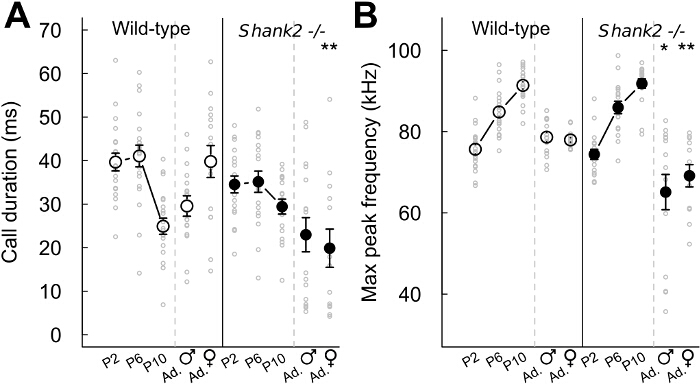
Figura 4:. Las variables acústicos extraídos de vocalizaciones ultrasónicas en SHANK2 - / - ratones y de tipo salvaje hermanos de camada (A) Duración de todos los tipos de llamadas confundido emitida por cachorros P2 (n = 20 SHANK2 + / +, n = 18 SHANK2 - / - ), crías de P6 (n = 19 SHANK2 + / +, n = 18 SHANK2 - / -), los cachorros P10 (n = 20 SHANK2 + / + , n = 18 SHANK2 - / -), los machos adultos con una hembra estro (n = 16 SHANK2 + / +, n = 16 SHANK2 - / - hembras) y adultos con otra hembra (n = 15 SHANK2 + / +, n = 13 SHANK2 - / -) en ratones de tipo salvaje (panel izquierdo) y SHANK2 - / - ratones (panel derecho). (B) Frecuencia máxima de pico medida en todos los tipos de llamadas confundió en crías de cachorros P2, P6, P10, las crías machos adultos con una hembra estro y la hembra adulta con otra hembra (Ns mismo que el anterior). Los datos se presentan como media +/- SEM y puntos individuales (no apareados de Wilcoxon prueba: * p <0,05, ** p <0,01, *** p <0,001). Haga clic aquí para ver una versión más grande de esta figura.
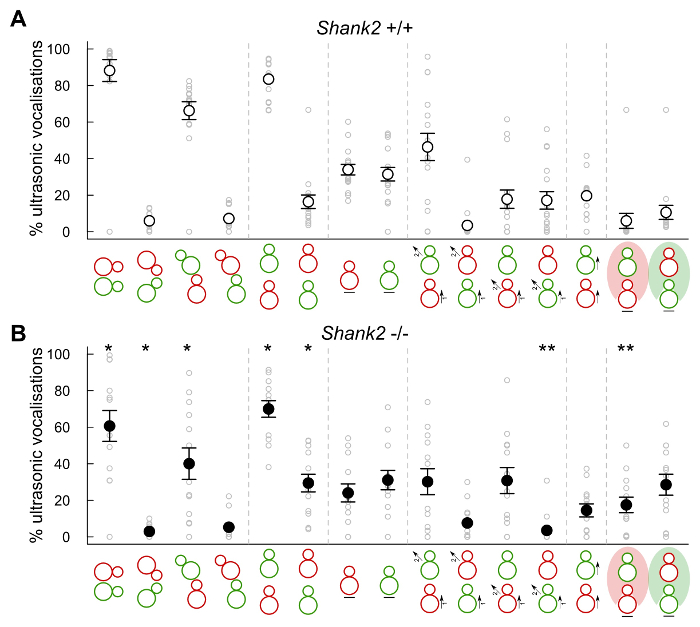
Figura 5: Contexto. s de emisión de vocalizaciones ultrasónicas de ratón en las interacciones adultos hembra-hembra sociales Proporción de vocalizaciones ultrasónicas emitidas por pares que implican un SHANK2 + / + con un ratón C57BL / 6N (n = 16, A) y pares que implican un SHANK2 - / - con a / ratón C57BL 6N (n = 13, B) durante los siguientes tipos de eventos conductuales (rojo: los ocupantes, verde: recién llegado): contactos sociales, oro-oral de contacto, inhalación de ano-genital desde el ratón ocupante, ano- genital de oler en el ratón recién llegado, los ocupantes detrás recién llegado, recién llegado detrás de los ocupantes, la inmovilidad de los ocupantes, la inmovilidad del recién llegado, el enfoque de los ocupantes y escapar del recién llegado, el enfoque del recién llegado y escapar del ocupante, el enfoque y escapar del ocupante, el enfoque y escapar del recién llegado, los ocupantes tras el recién llegado, recién llegado en el campo de visión del ocupante, de los ocupantes en el campo de visión del recién llegado. Los datos son presentido como media +/- SEM y puntos individuales (pruebas no apareados de Wilcoxon: * p <0,05, ** p <0,01). Los datos no publicados. Haga clic aquí para ver una versión más grande de esta figura.
| tipos de llamadas | Descripción |
| corto | ≤5 ms de duración y frecuencia gama ≤6.25 kHz |
| sencillo | duración> 5 ms y la frecuencia de gama ≤6.25 kHz (plana), o la modulación de frecuencia en una sola dirección (hacia arriba o hacia abajo) con la frecuencia de gama> 6,25 kHz |
| complejo | modulaciones de frecuencia en más de una dirección y la frecuencia gama> 6,25 kHz (modulada), o la inclusión de uno o más adicional de frecuencia component (fenómenos armónicos o no lineal, pero no de saturación) pero no limitación en rango de frecuencia (complejo) |
| saltos de frecuencia | inclusión de un salto (un salto de frecuencia) o más saltos (saltos de frecuencia, otros) en la frecuencia y sin intervalo de tiempo entre los componentes de frecuencia consecutivos, con (mixta) o sin ninguna parte ruidosa dentro de la convocatoria de tonos puros |
| no estructurada | no identificable componente de tono puro; llamadas "ruidosos" |
Tabla 1:. Características de los cinco tipos de vocalizaciones ultrasónicas ratón Ejemplos de criterios de duración, rango de frecuencia, modulación de frecuencia y de saltos de frecuencia utilizadas para determinar 5 tipos de llamada diferentes dentro de vocalizaciones ultrasónicas de ratón.
Discusión
El protocolo presentado aquí proporciona formas estandarizadas y fiables para recoger las vocalizaciones ultrasónicas de ratones en el laboratorio. Estas situaciones muy restringidas presentan la ventaja de la normalización. Se utilizan con éxito para comparar cepas o genotipos dentro de cepas 18,19,26,27. Como se presenta en los resultados representativos, estos métodos permiten la identificación de la comunicación social atípica en ratones mutados para SHANK2, un gen asociado con trastornos del espectro autista. Las comparaciones entre las cepas de ratón, entre los diferentes contextos o incluso entre laboratorios se desencadenan por la disponibilidad de grandes conjuntos de datos en la base de datos mouseTube. Esta herramienta debería impulsar estudios sobre las vocalizaciones ultrasónicas ratón, permitiendo el análisis multivariado.
Los protocolos descritos aquí están optimizados para poner a prueba los ratones de diferentes genotipos dentro de una cepa, como se hace en la mayoría de los estudios de modelado de la c genéticaONTRIBUCIÓN a los trastornos neuropsiquiátricos. Se recomienda diseñar cada estudio experimental para tener los mejores controles posibles. De hecho, los efectos de camada pueden enmascarar o artificialmente inflar efectos genéticos 28,29. Por tanto, es aconsejable incluir controles de la misma camada para cada genotipo. Por lo tanto, la cría de los padres heterocigotos se debe favorecer, ya que permitirá la correcta adecuación de los ratones mutantes y de control dentro de una camada. Esto justifica el marcado de todos los cachorros del tatuaje de la pata (sin conocer el genotipo) para realizar un seguimiento de las personas a través de las grabaciones cada dos días. El genotipado se realiza en el destete, tomando muestras de la cola. Al grabar las llamadas de aislamiento de las crías en P2, que no recomendaría la toma de muestras de la cola ya en las crías, ya que esta operación incluye la manipulación adicional y el estrés muy cerca en el tiempo para una sesión de grabación.
Los protocolos sugeridos aquí para provocar vocalizaciones ultrasónicas en los adultos no permite una identificación clara de la EMItter de las vocalizaciones. Esto explica por qué manipulamos la motivación del animal de ensayo. De hecho, los ratones de prueba están aislados y no el recién llegado y los animales de ensayo se habitúan durante mucho tiempo a la jaula de prueba durante las interacciones del mismo sexo. En las interacciones hombre-mujer, la hembra introducido no es aislado y el macho se habitúa prueba por el tiempo más corto ya que la motivación podría ser mayor en este contexto sexual. Estas manipulaciones de la motivación deben maximizar la probabilidad de que el ratón de prueba de emisión de las vocalizaciones y no la introducida. Para grabar vocalizaciones ultrasónicas macho en un contexto sexual, un hisopo de algodón sencilla con la orina (es decir, no congelado) fresco de una hembra estro también se puede introducir en la jaula 30. Este método permite la asignación de vocalizaciones ultrasónicas a la masculina prueba con 100% de certeza pero impide recoger cualquier información específica sobre el contexto social actual de emisión de estas vocalizaciones. Por lo tanto, estamos a favor de la protocol describe aquí (con una hembra estro libremente en movimiento). También recomendamos utilizar siempre los ratones introducido de la misma cepa al probar los ratones de una cepa mutante y analizar los datos como un par de ratones que vocalizan. Un estudio reciente promueve el uso de la triangulación para localizar el emisor 31. En este estudio, se encontró que las hembras también para emitir vocalizaciones ultrasónicas durante los encuentros con un macho. Esto podría explicarse por el hecho de que se aislaron durante al menos dos semanas antes de la sesión de grabación. Sin embargo, la generalización del uso de la triangulación propuesto en este estudio debe permitir la identificación del emisor de las vocalizaciones en la mayoría de los casos, si las grabaciones de vídeo se sincronizan correctamente.
Las llamadas de aislamiento de cachorros registrados durante el desarrollo no se vean perturbadas por el ruido de fondo de la ropa de cama. Por lo general, un análisis automático funciona muy bien para extraer las variables principales. Por el contrario, las vocalizaciones grabadas de los adultos son disturbed por el ruido de fondo de los animales que se mueven en la ropa de cama. Análisis automático puede fallar, y por lo tanto el análisis manual debe ser utilizado. Sin embargo, la adición de ropa de cama en la jaula de ensayo deberá proporcionar condiciones que son menos estresante para los animales que el suelo desnudo (que los ratones no les gusta). Más esfuerzos en la comunidad se concentran en mejorar la detección automática de vocalizaciones ultrasónicas en diversas condiciones, incluso aquellas que implican ruidos de fondo. Por ejemplo, el software de voz permite analizar las vocalizaciones que habían sido seleccionados de forma manual por la ausencia de ruido de fondo 32. En este software, la extracción de las variables acústicas es automática sino que necesita la selección manual inicial.
Cabe señalar que la variabilidad inter-individual es muy importante en el comportamiento vocal de los ratones. Por ejemplo, el tipo de interés de los hombres adultos en presencia de una hembra estro está muy distribuido (Figura 1). nos Doggest estos protocolos estandarizados para provocar vocalizaciones ultrasónicas ya de limitar la variabilidad relacionada con el contexto experimental. Sin embargo, nos gustaría señalar la importancia de presentar no sólo la media y SEM para los datos, pero lo más importante los puntos individuales en muestras de pequeño tamaño 33. También es muy relevante - si no es necesario - para registrar al menos 12 individuos de cada grupo / genotipo para reunir datos representativos. En muchos casos, la variabilidad interindividual no debe ser ocultada (por lo general no puede ser), y que podría ser de gran importancia para identificar a las personas que llevan la mutación genética estudiada pero no exhiben ningún fenotipo atípico. Tales individuos podrían proporcionar pistas sobre las compensaciones, lo que podría abrir nuevas vías para tratamientos de trastornos genéticos.
En la mayoría de las caracterizaciones del comportamiento de los modelos de ratón para los trastornos neuropsiquiátricos, comportamiento vocal y contactos sociales son considerared aparte (por ejemplo, 19,27,34,35). Métodos de análisis recientes proporcionan ahora una caracterización detallada semi-automático de los eventos sociales y secuencias de eventos durante una interacción (usando MiceProfiler por ejemplo) 36, así como la posibilidad de combinar este análisis con datos de grabaciones de audio. La principal ventaja de este método es proporcionar una visión global de la comunicación social en modelos de ratón de TEA, para identificar con mayor precisión lo que se ven afectados los aspectos de la comunicación social. En el presente protocolo de la sincronización es todavía manual, pero esto puede ser mejorado mediante la activación de la grabación de vídeo a través del software de grabación de audio. Este tipo de análisis debe convertirse en el estándar para proporcionar una visión más completa de los déficits de comunicación social en modelos de ratón de los trastornos neuropsiquiátricos. Además, hasta ahora, las señales vocales se analizan sobre todo desde el lado emisor (es decir, las pruebas se construyen para favorecer la emisión de voseñales de cal por el ratón probado, como en los protocolos actuales). La atención debe centrarse ahora también se puede ajustar en el receptor de estas señales, para identificar mejor las funciones de estas señales acústicas. Esto debe hacerse mediante la evaluación también el comportamiento de los ratones nuevos productores en los protocolos actuales en adultos (usando MiceProfiler por ejemplo) 36, mediante el uso de experimentos de reproducción 16, o mediante la creación de nuevos protocolos. De hecho, los protocolos actuales proporcionan situaciones muy restringidas que podrían no reflejar las condiciones etológicas exactas de las emisiones de vocalización en ratones. La emisión espontánea de vocalizaciones ultrasónicas tendrá que ser mejor caracterizados usando grabaciones de audio y de video continuo para arrojar más luz sobre el comportamiento vocal espontánea de ratones.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by the Fondation de France; by the ANR FLEXNEURIM [ANR09BLAN034003]; by the ANR [ANR- 08-MNPS-037-01-SynGen]; by Neuron-ERANET (EUHF-AUTISM); by the Fondation Orange; by the Fondation FondaMentale; by the Fondation de France; by the Fondation Bettencourt-Schueller. The research leading to this article has also received support from the Innovative Medicine Initiative Joint Undertaking under grant agreement no. 115300, resources of which are composed of financial contribution from the European Union's Seventh Framework Program (FP7/2007-2013) and EFPIA companies' in kind contribution. We thank Julie Lévi-Strauss for helpful comments on the manuscript and six anonymous reviewers whose comments noticeably improved the manuscript.
Materiales
| Name | Company | Catalog Number | Comments |
| needles 0.3mm x 13 mm [30 G 1/2"] | BD Microlance | 304000 | - |
| green tattoo paste | Ketchum Manufacturing Inc., Ottawa, Canada | 329AA | - |
| thermometer | Fisherbrand, Waltham, USA | 4126 (W255NA) | - |
| self-made soundproof chamber (pups) | Institut Pasteur, Paris | - | acoustic foam + plexiglas; inside dimensions (W x H x D): 32 cm x 33 cm x 32 cm |
| small surface thermister + single probe thermocouple | Harvard Apparatus | 599814 + 601956 | - |
| smell-less pen | for instance: Giotto | - | ink made with water, washable: these pens are designed for babies |
| Ethanol absolute (100%) | Sigma Aldrich, Saint-Quentin Fallavier, France | 24103 | diluted 1/10 |
| Condenser ultrasound microphone Avisoft-Bioacoustics CM16/CMPA | Avisoft Bioacoustics, Berlin, Germany | #40011 | furnished with extension cables by the Avisoft company |
| Ultrasound Gate 416H | Avisoft Bioacoustics, Berlin, Germany | #34163 | sound card |
| Avisoft Recorder USGH | Avisoft Bioacoustics, Berlin, Germany | #10301; #10302 | recording software for Windows Vista, 7 and 8 |
| Avisoft SASLab Pro | Avisoft Bioacoustics, Berlin, Germany | #10101, 10111; #10102, 10112; | Windows 10, 8.1, 8, 7 or Vista including Intel-based Apple Macintosh running Boot Camp, Parallels or similar virtualization software. |
| Laptop or Apple Macintosh running Boot Camp | - | - | running Windows 10, 8.1, 8, 7 or Vista; for the Apple Macintosh, Boot Camp is preferred to virtualizations softwares such as Parallels due to memory constraints |
| plastic recipient (pup recordings) | Lock & Lock, Chatswood, USA | HPL932D | Lock & Lock Stackable Airtight Container Round 700 ml; use without the cover; dimensions: 9 cm diameter, 10 cm height |
| PBS 1x (pH = 7.4) | Gibco (Life Technologies) | 10010-023 | - |
| slides | Menzel-Gläser, Thermo Scientific | J1800AMNZ | Superfrost Plus |
| May-Grünwald solution 500 ml | RAL Réactifs, Martillac, France | 320070-0500 | - |
| Giemsa R 500 ml | RAL Réactifs, Martillac, France | 720-1107 | diluted 1/20 in phosphate buffer solution |
| phosphate buffer solution (self-made) | - | - | pH = 7, 0.1 M: 39 ml NaH2PO4 0.2 M + 61 ml Na2HPO4 0.2 M + 100 ml H2O (final volume: 200 ml) |
| test cage | Institut Pasteur, Paris | - | 50 x 25 cm, 30 cm height; Plexiglas |
| self-made soundproof chamber (adult recordings) | Institut Pasteur, Paris | - | acoustic foam + PVC; inside dimensions (W x H x D): 66 cm x 90 cm x 46 cm |
| video camera | From Noldus Information Technologies, Wageningen, The Netherlands | - | high-resolution CamTech Super-Hi-Res video camera; 25 fps |
| EthoVision XT | Noldus Information Technology, Wageningen, The Netherlands | http://www.noldus.com/animal-behavior-research/products/ethovision-xt | video acquisition software |
| Mice Profiler Tracker plugin from the ICY platform | Bio Image Analysis, Institut Pasteur, Paris | http://icy.bioimageanalysis.org/plugin/Mice_Profiler_Tracker | tracking software to analyse behavioral events during social interactions |
Referencias
- American Psychiatric Association. . , (2013).
- Ey, E., Leblond, C. S., Bourgeron, T. Behavioral Profiles of Mouse Models for Autism Spectrum Disorders. Autism Res. 4 (1), 5-16 (2011).
- Bourgeron, T., Jamain, S., Granon, S. Animal Models of Autism - Proposed Behavioral Paradigms and Biological Studies. Contemporary Clinical Neuroscience: Transgenic and Knockout Models of Neuropsychiatric Disorders. , 151-174 (2006).
- Scattoni, M. L., Crawley, J., Ricceri, L. Ultrasonic vocalizations: A tool for behavioural phenotyping of mouse models of neurodevelopmental disorders. Neurosci. Biobehav. Rev. 33 (4), 508-515 (2009).
- Portfors, C. V., Perkel, D. J. The role of ultrasonic vocalizations in mouse communication. Cur. Opin. Neurobiol. 28, 115-120 (2014).
- Arriaga, G., Zhou, E. P., Jarvis, E. D. Of mice, birds, and men: the mouse ultrasonic song system has some features similar to humans and song-learning birds. PLOS ONE. 7, e46610 (2012).
- Hammerschmidt, K., Schreiweis, C., Minge, C., Pääbo, S., Fischer, J., Enard, W. A humanized version of Foxp2 does not affect ultrasonic vocalization in adult mice: Ultrasonic vocalization of "humanized" FoxP2 mice. Genes Brain Behav. , (2015).
- Portfors, C. V. Types and functions of ultrasonic vocalizations in laboratory rats and mice. J. Am. Assoc. Lab. Anim. Sci. 46, 28-34 (2007).
- Panksepp, J. B., et al. Affiliative Behavior, Ultrasonic Communication and Social Reward Are Influenced by Genetic Variation in Adolescent Mice. PLOS ONE. 2, (2007).
- Zippelius, H. -. M., Schleidt, W. M. Ultraschall-Laute bei jungen Mäusen. Naturwissenschaften. 43, 502 (1956).
- Whitney, G., Coble, J. R., Stockton, M. D., Tilson, E. F. Ultrasonic emissions: do they facilitate courtship of mice. J. Comp. Physiol. Psychol. 84, 445-452 (1973).
- Holy, T. E., Guo, Z. S. Ultrasonic songs of male mice. PLOS Biol. 3, 2177-2186 (2005).
- Maggio, J. C., Whitney, G. Ultrasonic vocalizing by adult female mice (Mus musculus). J. Comp. Psychol. 99, 420-436 (1985).
- Chabout, J., et al. Adult Male Mice Emit Context-Specific Ultrasonic Vocalizations That Are Modulated by Prior Isolation or Group Rearing Environment. PLOS ONE. 7 (1), e29401 (2012).
- Hammerschmidt, K., Radyushkin, K., Ehrenreich, H., Fischer, J. Female mice respond to male ultrasonic "songs" with approach behaviour. Biol. Lett. 5, 589-592 (2009).
- Wöhr, M., Moles, A., Schwarting, R. K. W., D'Amato, F. R. Lack of social exploratory activation in male -opioid receptor KO mice in response to playback of female ultrasonic vocalizations. Soc. Neurosci. 6, 76-87 (2011).
- Granon, S., Faure, P., Changeux, J. -. P. Executive and social behaviors under nicotinic receptor regulation. Proc. Nat. Acad. Sci. 100 (16), 9596-9601 (2003).
- Schmeisser, M. J., et al. Autistic-like behaviours and hyperactivity in mice lacking ProSAP1/Shank2. Nature. 486 (7402), 256-260 (2012).
- Ey, E., et al. Absence of Deficits in Social Behaviors and Ultrasonic Vocalizations in Later Generations of Mice Lacking Neuroligin4. Genes Brain Behav. 11, 928-941 (2012).
- Chadman, K. K., et al. Minimal Aberrant Behavioral Phenotypes of Neuroligin-3 R451C Knockin Mice. Autism Res. 1, 147-158 (2008).
- Scattoni, M. L., Gandhy, S. U., Ricceri, L., Crawley, J. N. Unusual Repertoire of Vocalizations in the BTBR T plus tf/J Mouse Model of Autism. PLOS ONE. 3, (2008).
- De Chaumont, F., Coura, R. D. -. S., et al. Computerized video analysis of social interactions in mice. Nat. Methods. 9, 410-417 (2012).
- Leblond, C. S., et al. Genetic and Functional Analyses of SHANK2 Mutations Suggest a Multiple Hit Model of Autism Spectrum Disorders. PLOS Genet. 8 (2), e1002521 (2012).
- Berkel, S., et al. Mutations in the SHANK2 synaptic scaffolding gene in autism spectrum disorder and mental retardation. Nat. Genet. 42, 489-491 (2010).
- Pinto, D., et al. Functional impact of global rare copy number variation in autism spectrum disorders. Nature. 466, 368-372 (2010).
- Ey, E., et al. The autism ProSAP1/Shank2 mouse model displays quantitative and structural abnormalities in ultrasonic vocalisations. Behav. Brain Res. 256, 677-689 (2013).
- Scattoni, M. L., Ricceri, L., Crawley, J. N. Unusual repertoire of vocalizations in adult BTBR T plus tf/J mice during three types of social encounters. Genes Brain Behav. 10, 44-56 (2010).
- Zorrilla, E. P. Multiparous species present problems (and possibilities) to developmentalists. Dev. Psychobiol. 30 (2), 141-150 (1997).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neurosci. 14 (1), 37 (2013).
- Hoffmann, F., Musolf, K., Penn, D. J. Freezing urine reduces its efficacy for eliciting ultrasonic vocalizations from male mice. Physiol. Behav. 96, 602-605 (2009).
- Neunuebel, J. P., Taylor, A. L., Arthur, B. J., Egnor, S. R. Female mice ultrasonically interact with males during courtship displays. eLife. 4, (2015).
- Burkett, Z. D., Day, N. F., Peñagarikano, O., Geschwind, D. H., White, S. A. VoICE: A semi-automated pipeline for standardizing vocal analysis across models. Sci. Rep. 5, 10237 (2015).
- Weissgerber, T. L., Milic, N. M., Winham, S. J., Garovic, V. D. Beyond Bar and Line Graphs: Time for a New Data Presentation Paradigm. PLOS Biol. 13 (4), e1002128 (2015).
- Jamain, S., et al. Reduced social interaction and ultrasonic communication in a mouse model of monogenic heritable autism. Proc. Nat. Acad. Sci. U. S. A. 105, 1710-1715 (2008).
- Won, H., et al. Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function. Nature. 486, 261-265 (2012).
- Ferhat, A. -. T., Le Sourd, A. -. M., de Chaumont, F., Olivo-Marin, J. -. C., Bourgeron, T., Ey, E. Social Communication in Mice - Are There Optimal Cage Conditions?. PLOS ONE. 10 (3), e0121802 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados