Method Article
La determinación de las especies y cuantificación de mezclas Uso de MRM espectrometría de masas de los péptidos Aplicada a la autenticación de carne
En este artículo
Resumen
We present a protocol for identifying and quantifying the components in mixtures of species possessing similar proteins. Mass spectrometry detects peptides for identification, and gives relative quantitation by ratios of peak areas. As a tool food for fraud detection, the method can detect 1% horse in beef.
Resumen
We describe a simple protocol for identifying and quantifying the two components in binary mixtures of species possessing one or more similar proteins. Central to the method is the identification of 'corresponding proteins' in the species of interest, in other words proteins that are nominally the same but possess species-specific sequence differences. When subject to proteolysis, corresponding proteins will give rise to some peptides which are likewise similar but with species-specific variants. These are 'corresponding peptides'. Species-specific peptides can be used as markers for species determination, while pairs of corresponding peptides permit relative quantitation of two species in a mixture. The peptides are detected using multiple reaction monitoring (MRM) mass spectrometry, a highly specific technique that enables peptide-based species determination even in complex systems. In addition, the ratio of MRM peak areas deriving from corresponding peptides supports relative quantitation. Since corresponding proteins and peptides will, in the main, behave similarly in both processing and in experimental extraction and sample preparation, the relative quantitation should remain comparatively robust. In addition, this approach does not need the standards and calibrations required by absolute quantitation methods. The protocol is described in the context of red meats, which have convenient corresponding proteins in the form of their respective myoglobins. This application is relevant to food fraud detection: the method can detect 1% weight for weight of horse meat in beef. The corresponding protein, corresponding peptide (CPCP) relative quantitation using MRM peak area ratios gives good estimates of the weight for weight composition of a horse plus beef mixture.
Introducción
The European horse meat scandal of 2013, in which undeclared horse meat was found in a number of supermarket beef products1, highlights the need for testing methods capable of detecting and measuring food fraud in meat. Several technologies have been explored, especially enzyme-linked immunosorbent assay (ELISA) and DNA-based methods2. An alternative route, based on mass spectrometry, targets species-specific peptides which in turn arise from species-specific proteins. Here we outline one such peptide-based approach that offers both identification and relative quantitation of the adulterant species in a meat mixture3.
The protocol is framed in the context of red meats and the desire to determine the presence of one in another at the level of 1% by weight, the level considered by some to represent fraudulent food adulteration as opposed to contamination4. The method relies in the first instance on identifying a protein which is nominally 'the same' in all target meats. Myoglobin, the protein responsible for the red color of meat, is a good candidate since it is abundant, relatively heat tolerant and water soluble, and has been used for species determination of meat previously5,6. The myoglobins for beef (Bos Taurus), pork (Sus scrofa), horse (Equus caballus) and lamb (Ovis aries)3, for instance, are nominally the same, as required, but their sequences are not identical. Such groups of 'similar but different' proteins, like these four myoglobins, can conveniently be described as 'corresponding proteins'. The sequence differences in these four myoglobins are species-specific: for example, the full myoglobin proteins for beef and horse, P02192 and P68082 respectively, each comprise 154 amino acids with 18 sequence differences between the two. Subject to proteolysis using trypsin these proteins produce two sets of peptides, some of which are identical, and some which show one or more species-specific amino acid differences: corresponding proteins therefore give rise to corresponding peptides.
The CPCP approach, therefore, seeks first to identify proteins from two or more species where these proteins exhibit limited species-specific sequence variants. These are corresponding proteins. Following proteolysis, corresponding proteins give rise to peptides, some of which likewise display species-specific sequence variants inherited from the parent protein. These are corresponding peptides. The CPCP approach can be used to compare levels of two corresponding proteins in a mixed species sample by monitoring the levels of corresponding peptides.
The natural technology for the detection of known peptides is multiple reaction monitoring mass spectrometry, or MRM-MS7. Species-specific peptides yield precursor ions, which along with their mass spectrometry fragment ions, are easily itemized in advance by software tools. These lists are then used to instruct the mass spectrometer to record only specific precursor plus fragment ion pairs, called transitions. A particular target peptide is therefore identified not only by its retention time in the chromatography preceding the mass spectrometer, but also by a set of transitions sharing a common precursor ion. This is a highly selective means of detecting known peptides that makes efficient use of the mass spectrometer resource.
Other authors have used mass spectrometry to test for meat adulteration via peptide markers but from disparate proteins8-14. Using the corresponding proteins, corresponding peptides (CPCP) scheme, however, means experimental conditions can be optimized, aiding identification of the species in the mixture from known species-specific transitions. In addition, corresponding proteins and peptides will generally behave similarly in the extraction, proteolysis and detection stages. Since transition peak areas are quantitative and reproducible, ratios of peak areas arising from pairs of corresponding peptides from different species provide a direct estimate of the relative quantities of two meats in a mixture. In contrast, more traditional quantitation routes exploit calibrations based on reference materials to establish absolute quantitation14,15.
Though the protocol is outlined in the context of myoglobin and meat, proteins other than myoglobin could be used for identification and relative quantitation via the CPCP strategy in meat mixtures, though potentially with modifications to the protocol. In addition the strategy is also applicable to binary mixtures of other species sharing one or more corresponding proteins.
The starting point for the protocol is purified 'reference' myoglobin, which for some species can be purchased but which for others must be prepared by conventional size-exclusion chromatography. The procedure for preparing reference myoglobin is not included in the protocol, but is described elsewhere3. Software tools16 are used to list candidate peptides and transitions arising from myoglobins of interest. Each reference myoglobin is subjected to proteolysis and the resultant peptides analyzed by liquid chromatography electrospray ionization tandem mass spectrometry (LC-ESI-MS/MS) to discover which of the candidate precursor ions and transitions are most useful, and to determine the matching peptide retention times. The outcome of this stage is a revised list of target peptides with their transitions, suitable for species determination, and a list of CPCP pairs, suitable for relative quantitation. To test real meats, sample extractions are prepared then subjected to proteolysis to generate peptides both from myoglobin and other extraneous proteins. The myoglobin-based peptides are then monitored by LC-ESI-MS/MS based on their listed transitions. The species present in a mixture are identified by the transition peaks associated with marker peptides. Estimates of the relative amounts of two meats in a binary mixture are calculated using ratios of transition peak areas. A set of test mixtures of pairs of meats will allow the ratio of peak areas for a given pair of transitions to be checked and calibrated against actual mixtures.
Protocolo
1. La proteólisis y Análisis de mioglobinas de referencia
- La proteólisis de mioglobinas de referencia
- Preparar soluciones de los mioglobinas referencia purificados (rango desde 0,2 hasta 0,5 mg / ml en bicarbonato de amonio 25 mM) 3.
- Transferir 1 ml de alícuota de cada muestra a 2 ml tubos de centrífuga.
- Térmicamente desnaturalizar las proteínas extraídas mediante el calentamiento de la muestra en un bloque caliente a 95 ° C durante 30 minutos. Se enfría la muestra durante aproximadamente 15 min hasta que alcanza la temperatura ambiente. Añadir 30 mg de urea (concentración final 0,5 M) para mejorar la digestión, a continuación, mezclar.
- proteólisis tríptico
- Preparar una solución de 1 mg / ml de tripsina en bicarbonato de amonio 25 mM y almacenar en hielo según se requiera. Añadir un volumen suficiente de tripsina de tal manera que la actividad de la enzima final es 420 BAEE (benzoil-L-arginina N- hidrocloruro de éster etílico de) unidades / mg de proteína extraída, a continuación, mezclar mediante agitación suave y se deja durante la noche a 3 proteolizar7 ° C.
- Llevar a cabo la electroforesis en dodecil sulfato de sodio poliacrilamida gel (SDS-PAGE) 17 para demostrar la integridad de la proteólisis.
- El desalado de la muestra después de la proteólisis
- Diluir la muestra 1: 2 v: v con agua.
- Activar una de fase inversa polimérica (RP) de cartucho llena con material RP 30 mg mediante la adición de 1 ml de metanol, a continuación, equilibrar el cartucho mediante la adición de ácido fórmico 1 ml de 1%.
- Cargar la muestra en el cartucho por gravedad.
- Lavar con 1 ml de ácido fórmico al 5% de metanol / 1% por gravedad.
- La elución de los péptidos con 1 ml de acetonitrilo / agua (90:10 v: v; 0,1% de ácido fórmico) por gravedad en 2 ml tubos de microcentrífuga precargadas con 5 l de dimetilsulfóxido (DMSO).
- Eliminar el disolvente bajo vacío a 50 ° C usando un evaporador centrífugo para 120 min, a continuación, volver a disolver el residuo en 250 l de acetonitrilo / agua (3:97 v: v; 0,1% de ácido fórmico).
- Transferirla solución a un vial de automuestreador de bajo volumen.
Nota: Las muestras pueden ser almacenadas a 4 ° C hasta que esté listo para la espectrometría de masas de cromatografía líquida (LC / MS) análisis.
- Generación de listas de transición para MRM
- Localizar las secuencias mioglobina para las distintas carnes de la base de datos UniProt.
- Introduzca las secuencias de mioglobina en el cuadro 'Target' del software de predicción de péptidos y de transición (por ejemplo, del horizonte). Si es necesario, coloque el cursor sobre un péptido para revelar su lista de fragmentos.
- Haga clic en "Configuración" y seleccione "Configuración Péptido '. Introducir las preferencias para la digestión (es decir, tripsina) y el número de divisiones perdidas (0). Introducir la selección requerida para parámetros adicionales, en particular, la longitud del péptido (6-25), exclusiones N-terminal (0) y supone modificaciones de aminoácidos (ninguno).
- Haga clic en "Configuración" y seleccione "Configuración de transición '. Seleccione las preferencias deel tipo de instrumento que se utiliza para el análisis LC / MS.
- Haga clic en "Exportar" y seleccione "Lista de transición 'para crear una hoja de cálculo que contiene las transiciones y parámetros de GRM generados.
- El análisis por LC / MS
- Establecer un sistema de gradiente binario (de agua (A) y acetonitrilo (B), cada uno con 0,1% de ácido fórmico v: v) cromatógrafo de líquidos de alta resolución (HPLC) con muestreador automático, columna núcleo de carcasa HPLC C18 (10 cm x 2,1 mm , 2,6 micras de tamaño de partículas) conectado a un espectrómetro de masas de triple cuadrupolo opere en modo de electropulverización positiva con detección MRM.
- En el software de recogida de datos (por ejemplo, Analyst), seleccione "Archivo" y "Nuevo" y haga clic en "Adquisición Método" en el cuadro desplegable a continuación, haga clic en 'Aceptar'.
Nota: Esto abre el instrumento editor de método, que contiene una lista de los dispositivos conectados que permitan a la configuración de un nuevo método LC / MS. - Haga clic en "Bomba Binaria 'y yonput el valor de caudal (300 l / min) y los tiempos de gradiente en la tabla, el establecimiento de un perfil de gradiente binario de 3% de B a 30% de B durante 22 min, aumentando a 100% de B en 23 min para un 5 minutos se lavan a cabo antes de volver a las condiciones iniciales y re-equilibrio durante otros 6 min.
- Haga clic en "inyector automático 'e introduzca el volumen de inyección (5 l). Habilitar el "Ciclo de lavado de aguja 'y entrar en el" tiempo de lavado "(30 seg) y seleccione' puerto de lavado '.
- Haga clic en "Controlador de columna termostatizada 'y en' Columna Horno Propiedades 'establecer la' temperatura izquierda" y "derecha Temperatura '(40 ° C).
- Haga clic en "Espectrómetro de Masas 'y haga clic en" Editar Parámetros "para entrar en las condiciones del gas de origen. Seleccione el "Tipo de escaneo 'como' MRM (MRM)" y la "polaridad" como "positivo". Ir a "Resumen Período 'y entrar en el' tiempo de duración ', el tiempo total para el análisis de un LCd de equilibrado (35 min).
- En la tabla de la derecha y selecciona 'desagrupación potencial (DP) "y" energía de colisión (CP)' para agregar estas columnas de la tabla. Introduzca los Q1, Q3, Tiempo (ms), ID, los valores DP y CE para todas las transiciones, de una sola especie de carne, creados en la lista de transición (véase el paso 1.4.5).
Nota: Tiempo (mseg) se refiere al tiempo de permanencia, el tiempo de espectrómetro de masas pasa el escaneo de cada transición, la suma de los cuales no debe exceder de 3 seg. - Guarde el archivo de Adquisición Método (archivo de extensión .dam).
Nota: Los pasos 1.5.2 - 1.5.8 se debe repetir para cada especie de carne. Esto creará un archivo único método para cada especie de carne en el modo de pantalla en la preparación para el análisis a continuación. - En el software de recopilación de datos, haga clic en 'Acquire' y seleccione 'Equilibre'. En el cuadro que se abre, seleccione el método de adquisición requerido para comenzar el equilibrado de instrumentos.
- Ponga los viales de muestra en arack en el muestreador automático.
- Haga clic en "Archivo" y seleccione "Nuevo" y luego "Adquisición por lotes". En la pestaña "Muestra" seleccionar "Añadir Set" y luego "Añadir muestras '. Introduce el número de muestras a analizar y haga clic en 'Aceptar'. En el cuadro 'Adquisición' seleccione el archivo de método que se utilizará para el análisis desde el menú desplegable.
- En la tabla, seleccione 'Código Plate' y seleccionar la configuración de la bandeja apropiada desde el menú desplegable. clic izquierdo en el 'Código Plate' cabecera de la columna a continuación, haga clic derecho y seleccione 'Rellenar hacia abajo'. En "Posición Vial 'entrar en la posición de cada muestra en el muestreador automático en las filas.
- En 'Archivo de datos' introduzca el nombre de archivo para la adquisición, a continuación, haga clic izquierdo en la cabecera de la columna seguido por el botón derecho y seleccione 'Rellenar hacia abajo'. En 'nombre de la muestra' insertar la identidad de cada una de las muestras a analizar. Guardar como un archivo por lotes de adquisición (archivo de correoXTension .dab).
- Haga clic en la pestaña "Enviar" a continuación, poner de relieve las muestras que deben analizarse en el LC / MS. Haga clic en "Enviar". Haga clic en "Adquirir" y "Iniciar la muestra 'para comenzar el análisis.
Nota: Cada método de adquisición escaneará para las transiciones de MRM en toda la longitud del cromatógrafo para una sola especie de carne. ajustes del espectrómetro de masas para una adquisición MRM pueden variar según el tipo de instrumento y el péptido. - Ver los archivos de datos generados utilizando el software de visualización de datos. Haga clic en XIC (iones extraídos) y en la lista desplegable resaltar todos los fragmentos (valores Q3) para un único precursor (Q1). Un nuevo panel se abrirá que muestra sólo las transiciones seleccionadas.
- Registre el tiempo de retención (Rt) para grupos de transiciones simultáneas ya que estos corresponden a un único péptido.
- Repita los dos pasos anteriores para cada conjunto de transiciones con el fin de asignar los picos de sus respectivos péptidos para cadade las especies de carne.
- Registrar los péptidos marcadores que son adecuados para proporcionar la identificación de especies (por ejemplo, péptido HPGDFGADAQGAMTK, precursor m / z = 752, R t = 12,0 min, para el caballo), junto con sus tiempos de retención, y tenga en cuenta que forman pares adecuados para la cuantificación relativa correspondiente .
Nota: Por ejemplo, el péptido marcador de caballo (precursor m / z = 752) tiene un péptido carne correspondiente, HPSDFGADAQAAMSK (precursor m / z = 767, R t = 13,2 min). - Con el fin de crear un solo método dinámico que abarca todas las especies de carne, en el software de visualización de datos, para cada especie de carne, a su vez, abrir los datos de transición XIC para cada precursor (asignado a un péptido particular en 1.5.8).
- Zoom en el grupo de picos en el tiempo de retención seleccionado haciendo clic izquierdo y arrastrando el cursor debajo del clúster. Identificar las transiciones más intensos (haciendo clic derecho en la etiqueta del pico).
- registrar manualmente las transicionesy tiempos de retención en una hoja de cálculo.
- Para introducir los parámetros como un nuevo método dinámico en el software LC / MS, haga clic en "Espectrómetro de Masas 'y haga clic en" Editar Parámetros "para entrar en las condiciones del gas de origen. Seleccione el "Tipo de escaneo 'como' MRM (MRM)" y la "polaridad" como "positivo".
- Ir a "Período resumido 'e introduzca el tiempo de duración (establecido como el tiempo total para el análisis LC y el equilibrio). En la tabla de la derecha y selecciona 'desagrupación potencial (DP) "y" energía de colisión (CP)' para agregar estas columnas de la tabla.
Nota: La columna 'Time' se refiere ahora al tiempo de retención esperado (min) para cada transición. - En la sección de la / MS software de recogida de datos LC 'Editar Parámetros', marca la casilla 'Scheduled MRM'. Entrada de la Q1, Q3, Tiempo (min), ID, los valores de DP y CE para las transiciones creadas en la hoja de cálculo (1.5.21) y guardar el método de adquisición (file extensión .dam).
Nota: Este método reduce típicamente el número de MRM pasa al 4 más intensa para cada péptido y escanea solamente a través de la ventana de tiempo de retención para cada pico de péptido, dando una sensibilidad mejorada y calidad de los datos. Un método "dinámico" es un método de "retención de guiado de ventanas de tiempo ', a veces llamada la programación.
2. Preparación y análisis de muestras de calibración
- La extracción de las mezclas de carne
- El uso de carne previamente congelado luego se muelen en un polvo, preparar una gama de mezclas de carne pesando respectivas cantidades de carne (masa total de alrededor de 300 mg) en 15 ml de tubos de plástico de centrífuga.
- Añadir 4 ml de tampón de extracción (0,15 M de cloruro de potasio + tampón de fosfato 0,15 M a pH 6,5). Vortex durante 30 segundos. Extraer en un agitador de laboratorio a temperatura ambiente durante 2 horas a 250 ciclos / min.
Nota: Ciclos / min se refiere a un movimiento oscilatorio. - Transferencia de 2 ml de laextraer en un tubo de microcentrífuga de 2 ml. Centrifugar durante 5 min a 4 ° C a 17000 x g.
- Transferencia de 200 ml de alícuotas del sobrenadante (reservando una pequeña cantidad para ensayo de proteínas, véase 2.2) en 2 ml tubos de centrífuga y seco usando un evaporador centrífugo (programa pre-establecido: 50 ° C, sin ventilación y 120 minutos de duración).
- ensayo de proteínas
- Transferencia de 7 ml de alícuotas del sobrenadante reservada (véase 2.1.4), por triplicado en los pocillos de una placa de 96 pocillos.
- Transferencia de 7 ml de alícuotas de una serie de patrones de proteína, por triplicado, rango de 0 a 1,0 mg / ml de albúmina de suero bovino (BSA), a la misma placa de 96 pocillos.
- Añadir 200 l de Coomassie más reactivo de ensayo de proteína a cada pocillo.
- comparar visualmente el color de los pocillos de muestra con los estándares de proteína para comprobar las muestras están en el rango de los patrones de calibración. Si es necesario, repetir la muestra diluida por lo que se convierte en el rango.
- Deja la placa para sty por 3 min.
- Burst las burbujas que se han formado con una aguja hipodérmica.
- Analizar la placa en el lector de placas usando un protocolo de punto final estándar a una longitud de onda de 595 nm.
- Determinar la concentración de proteína de las muestras usando los datos de calibración a partir de los estándares de proteína.
Nota: Esto es necesario para el cálculo de la cantidad de tripsina utilizada en el digesto tríptico.
- La proteólisis de las mezclas de carne
- Se vuelve a disolver el residuo seco de la etapa 2.1.4 en 1 ml de solución de bicarbonato de amonio 25 mM. Mezclar bien en un mezclador rotatorio.
- Siga el protocolo de la etapa 1.1.3 a 1.3.7.
- El análisis por LC / MS
- Configurar la LC / MS como antes (paso 1.5.1).
- Crear un nuevo lote de adquisición como se describe anteriormente (pasos 1.5.9 - 1.5.14), la selección del método de adquisición creado en el paso a 1.5.24 que utiliza un método dinámico LC / MS combinación de todas las especies de carne, y adquirir los datos para los Digesmuestras de carne TED.
- Visualizar el cromatograma completo en el software de visualización de datos. Mostrar la XIC para cada transición fijado alternadamente. confirmar visualmente cada grupo contiene el número requerido de picos en forma de campana en el tiempo de retención esperado, lo que confirma la existencia del péptido seleccionado.
- Realizar la cuantificación utilizando los datos de software de visualización para integrar las áreas de pico para cada una de las transiciones de interés haciendo doble clic sobre "Construir Cuantificación Método 'en la barra de navegación.
- En el panel "Seleccionar la muestra 'seleccione la opción' Archivo de datos" y la "muestra" para ser analizados para generar una tabla '' Los analitos.
- Haga clic en la pestaña 'Integración' para mostrar la primera de las transiciones (analitos) que integrarse.
- Haga clic en la casilla de 'analito' para mostrar la lista desplegable de las transiciones hacia abajo. Seleccione cada transición a su vez para mostrarla y visualmente confirmar el pico correcto está seleccionado para la integración. para modificar o forzar la integración, haga clic izquierdo y arrastrar el cursor sobre el pico de destino (esto será resaltado en verde). Haga clic en el botón 'Seleccionar pico' y haga clic en 'Aplicar'.
- Guardar el espacio de trabajo como un archivo de método (.qmf).
Nota: Esto crea un archivo Cuantificación Método para el cálculo posterior de áreas de los picos de la muestra. - Doble click 'Asistente de cuantificación' en la barra de navegación. En la ventana 'Seleccione Ejemplos' crear 'La cuantificación Set' mediante la selección de un único 'Archivo de Datos ", a continuación, una o más muestras disponibles' '. Seleccione 'Next' para mostrar 'Seleccione Configuración y consulta de' caja. Los dejo con valores predeterminados, seleccione 'Siguiente' para que aparezca "Seleccionar método '. En el menú desplegable cuadro "Método" seleccione el archivo 'Método de Integración' creado en el paso 2.4.8, a continuación, seleccione 'Terminar'.
Nota: Esto crea una "Tabla de Resultados ', incluyendo áreas de los picos de transición que surgen a partir de mezclas de carne. - Save the 'Resultados En la tabla' (archivo de extensión .rdb), la exportación como un archivo de texto (.txt) y abrirlo en una hoja de cálculo para revisar los datos.
- gráficos de trama de la porcentaje (por área del pico de transición) de una carne en otro frente al porcentaje medido (w / w) de las dos carnes para la MRM seleccionado para las transiciones seleccionadas de péptidos correspondientes, centrándose en los casos en que los dos fragmentos contienen la mismo número de aminoácidos como contado desde el extremo C-terminal.
Nota: Los fragmentos idénticos con los sitios de fragmentación idénticos dan resultados óptimos. - Examine las parcelas de 2.4.11 anterior. Ya sea visualmente o mediante una herramienta de línea de tendencia en el paquete de trazado, identificar un grupo de parcelas que son tanto lineales como de gradiente similar. Utilice uno cualquiera o más de estos CPCP más fragmentos de combinaciones para la calibración en muestras de carne real.
Nota: Un gráfico que muestra un gradiente de inusual puede indicar ya sea péptido o supresión fragmento con la consiguiente reducción de Stre señalngth. parcelas no lineales pueden indicar la detección de pico pobres u otros problemas.
3. Las muestras de carne
- La extracción de proteínas a partir de muestras de carne de destino
- Cuando, especiales extraña material no carne aplicable de la muestra usando una espátula. Por ejemplo, raspe la salsa y la pasta de lasaña fría.
- Pesar 20 g de la carne en un vaso de precipitados de metal.
- Añadir 100 ml de cloruro de potasio 0,15 M / M de potasio tampón de monofosfato de 0,15 a pH 6,5.
- Extraer las proteínas mediante la mezcla de la carne en un homogeneizador de alta velocidad para 1 min.
- Siga el protocolo de la etapa 2.1.4 - 2.3.2.
- Análisis de muestras por LC / MS
- Repita el paso 2.4.2 para la adquisición de datos utilizando el método LC / MS dinámico.
- Identificar los péptidos de cada mioglobina de la carne tal como se realizó en el paso 2.4.3.
- Para la cuantificación, utilizar el software de cuantificación para integrar las áreas de los picos para cada transición de interés,como se indica en el paso 2.4.9.
- Para la identificación de las especies en una mezcla, grabar esos péptidos marcadores que satisface los criterios acordados para los números de transiciones y de señal a ruido para esas transiciones.
- Para la cuantificación, utilizar áreas de los picos de transición integrados según lo acordado desde el paso 2.4.12 y, usando porcentaje en área del pico de transición, calcular el porcentaje de mioglobina a partir de las dos especies en la mezcla.
- Utilizar el conocimiento previo de la literatura 18 de mioglobina probables en las carnes para estimar las cantidades p / p respecto de dos carnes presentes en la muestra.
Resultados
En un solo experimento MRM-modo dinámico cada transición programada se registra por separado (como conteos del detector por segundo, cps) más de una ventana de tiempo de retención especificado. Por lo tanto, de todos los datos recogidos en un experimento, la intensidad del pico para cada transición se puede extraer individualmente. A continuación, la única señal finito es para la ventana de tiempo de retención fijado para esa transición. Fuera de la ventana, la señal es cero por definición. La señal para cualquier transición, por ejemplo, 752 → 1269 de caballo (péptido monoisotopic masa 1,501.66 daltons, ion precursor m / z 751.84 daltons, cargo Estado = 2, fragmento y de iones 13) por lo general tiene que competir solamente con ruido de medición y no de otros picos de transición que tal vez podrían ser de otras especies. Por tanto, la salida es un conjunto de picos limpias, una por transición, a un tiempo de retención común para esas transiciones que comparten un ion precursor común.
Figura 1 muestra el resultado para el conjunto de cuatro transiciones 752 → (1269, 706, 248, 1366) para una mezcla de 1% w / w caballo en la carne de vacuno. Desde las cuatro transiciones mostradas están asociados con el caballo, y están ausentes en las muestras de carne pura, cordero o cerdo, estos picos significan la presencia de caballo. En función de los criterios de robustez, un conjunto de dos o más transiciones cada una superior a una cierta señal especificada al nivel de ruido establece la identificación. Por tanto, esta figura se establece la presencia de caballo en la mezcla de 1% w / w de caballos en carne de vacuno.
De vez en cuando, se detecta una sola transición aislado. Esto indica un partido de probabilidad de ion precursor y un solo fragmento, posiblemente de una proteína extraña, con los esperados del sistema y programado en el espectrómetro de masas. La singularidad del pico, y su suceso en un tiempo de retención inesperado, es el SIgnature de una transición accidental que puede ser ignorada.
El área bajo cada pico de transición puede ser calculado de forma individual. Sobre la base de un fragmento adecuado, la relación de caballo para áreas de los picos de transición carne de vaca, por ejemplo, 752 → 1269 (caballo) a 767 → 1299 (carne), será proporcional a la relación de carnes reales en la mezcla. La figura 2 muestra una parcela de porcentaje en el área del pico para estas dos transiciones frente al porcentaje en peso para el peso del caballo en una mezcla de caballo con carne de vacuno. Si las áreas de los picos de transición porcentaje coincide con el porcentaje en peso para el peso de la carne, entonces la pendiente es 1. La pendiente de esta parcela es de 1,03, lo que indica que, para estas transiciones y par CPCP, las áreas de los picos de transición dan una medida fiable de las cantidades relativas de los dos carnes en la mezcla. Si la carne de caballo en la muestra era dos veces más rica en mioglobina como la carne a continuación, con otros factores sin cambios, la pendiente de la línea sería mayor que uno.
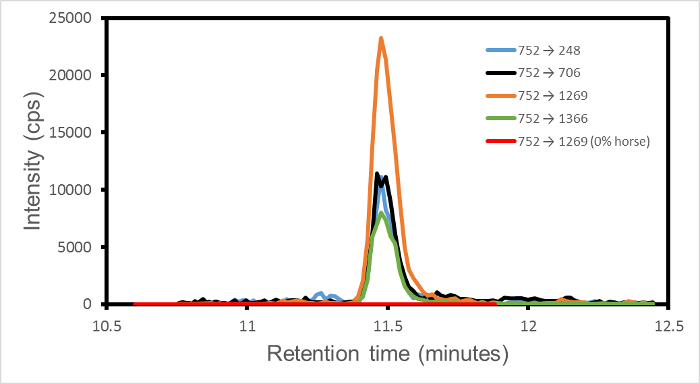
Figura 1. Las intensidades de transición MRM en función del tiempo de retención de 1% w / w de caballos en la carne de vacuno. Las transiciones son 752 → (1269, 706, 248, 1366), que se muestra en naranja, negro, azul y verde, respectivamente. El péptido marcador es HPGDFGADAQGAMTK. Los cuatro fragmentos de transición pueden designarse y 13, y 7, y 2 e y 14, respectivamente, donde y n indica el recuento en los aminoácidos n desde el extremo de péptido C-terminal. La relación señal a ruido varía 23 y 53 sobre las cuatro transiciones. Una línea roja indica la transición adicional 752 → 1269 para el caballo 0%, 100% carne de vacuno para la comparación. Sólo se muestra la región que no sea cero del tiempo de retención. Esta cifra ha sido modificado a partir de Watson et al. 3.en / ftp_upload / 54420 / 54420fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
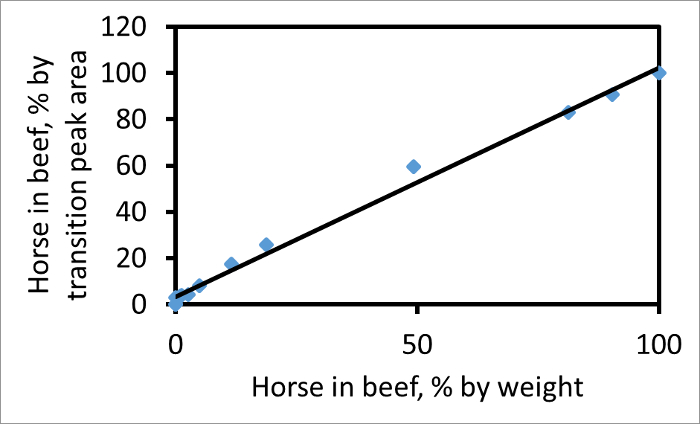
Figura 2. Parcela de caballo en la carne de vacuno, como porcentaje en peso para el peso, en comparación con el caballo en la carne de vacuno como área de pico por ciento de transición. La trama se utiliza el par de péptidos de ternera (767) y el caballo (752) y el fragmento de iones y 13 para ambos. Si A representa el área del pico y luego la ordenada es 100 A H / (A + H A B). La pendiente de la línea de mejor ajuste (R2 = 0.99) es de 1.03. Esta cifra ha sido modificado a partir de Watson et al. 3. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La selección de una proteína diana adecuado es importante. Una buena proteína diana necesita tener formas correspondientes de las especies de interés, suficiente variación en la secuencia dependiente de la especie, la especificidad de especie, y existen en cantidades accesibles dentro de los organismos. Para la evaluación de las mezclas que han sido objeto de procesamiento (por ejemplo, tratamiento de calor), una proteína que tiene una secuencia relativamente inmune a que el procesamiento es deseable. La mioglobina es un buen candidato para carnes rojas, incluyendo carnes rojas cocidas, pero no es la única posibilidad. Una vez que se decide la proteína diana, la parte más crítica del protocolo es la proteólisis de proteínas. Una proteína diferente de la mioglobina también puede exigir un protocolo alternativo proteólisis.
El protocolo que se describe incluye un segmento en función de la proteína purificada de referencia. Esta tiene como objetivo descubrir retención ventanas de tiempo y los iones precursores y fragmento adecuado. Este segmento es muy útil, pero no esencial.
Aunque pares de péptidos correspondientes de dos especies de interés se pueden enumerar incluso sin experimento, a veces es el caso de que una diferencia en la secuencia tiene dramáticas consecuencias sobre el perfil de la digestión. Por ejemplo, el par de péptidos VLGFHG (carne) y ELGFQG (caballo) dan un resultado anómalo cuantificación (manifiesto como un gradiente inferior a uno en la Figura 2). Esto es debido a que el último péptido surge de una escisión KE relativamente suprimido, causando una sub-estimación del nivel de caballo en la mezcla. por lo tanto, mejor péptidos correspondientes empezando con diferentes aminoácidos se evitan. A menudo los fragmentos de dos péptidos correspondientes tienen secuencias de aminoácidos idénticas y tienen un buen comportamiento, pero esto no es siempre el caso y necesita ser comprobada durante el desarrollo del método. La identificación de especies es mucho menos sensible a estos temas que la cuantificación relativa.El protocolo se ha demostrado para cuatro carnes rojass 3. especies de carne adicionales pueden ser incluidos, aunque la calidad de la forma de pico de transición puede deteriorarse si demasiados péptidos marcadores co-eluyen, reduciendo efectivamente el tiempo de permanencia y, finalmente degradar estimaciones cuantificación relativa. Mejora de la instrumentación, ya disponible, va a mejorar esto. Un tema relacionado es que no todas las carnes tienen diferentes mioglobina. Por ejemplo, caballo, burro y cebra mioglobina son idénticos y por lo tanto estrictamente hablando, el método sólo es capaz de detectar caballo o burro o cebra en la carne de vacuno. En algunos casos, aunque la mioglobina no son idénticos, algunos péptidos clave puede ser. Por ejemplo, algunos de mioglobina derivados de péptidos marcadores de cordero también aparecen en cabra.
Una complicación frente a este y cualquier otro método de cuantificación basada en proteínas es que el nivel de proteína debe suponerse constante a través de todas las especies de si los niveles de proteínas o péptidos son trivialmente equiparar a los niveles de las carnes en una mezcla. Para la mioglobina y los cuatro m rojacome esto no es una verdad universal. Los niveles en general son especies dependientes, con carne de cerdo que exhiben el nivel más bajo de los cuatro. Además, el nivel de mioglobina varía con el corte de carne y la edad del animal. Así, aunque las proporciones de áreas de los picos de transición mapa de forma fiable a las relaciones de la mioglobina, la asignación a la proporción de carnes reales es un dibujo de estimación en supuestos sobre posibles fuentes de las carnes en la mezcla.
El enfoque descrito en este trabajo difiere en un número de maneras de otras contribuciones publicadas. Una ruta más típico es utilizar métodos proteómicos para identificar varios péptidos marcadores dependiente de especie dispares, en cuyo caso los marcadores de diferentes especies poseen ninguna relación particular entre sí 8-12,14,19. Por el contrario, hemos seleccionado las proteínas comunes a todas las especies de interés hasta las especies que dependen de variantes de secuencia 3. Además de ser el centro de nuestra estrategia de cuantificación relativa, esto tiene la ventaja de que la muestraestrategias de preparación se pueden optimizar. Además, podría esperarse que tales proteínas correspondientes a comportarse de manera similar, por ejemplo, en la extracción o en el procesamiento comercial de muestras tales como cocinar o enlatado. La identificación de especies luego procede normalmente a través de la detección de los péptidos marcadores dispares, mientras que en el enfoque de identificación de especies CPCP producto a través de la detección de péptidos estrechamente relacionados que poseen típicamente una o dos diferencias en la secuencia. Por último, la cuantificación de proteínas para estimar el porcentaje en peso de una especie en otra podría proceder de manera convencional a través de la cuantificación absoluta de cada proteína basada separado en estándares conocidos 7,14,15. Sin embargo, utilizando el método de CPCP no hay necesidad de métodos de calibración. En lugar de ello, los niveles relativos se calcularon mediante la comparación de intensidades de señal de dos péptidos correspondientes de las dos especies, sin pasar por la etapa de medición absoluta por completo. Dado que el objetivo último es un porcentaje en peso de una especie en AnoTher, una cuantificación relativa, entonces el CPCP es a la vez más directo y más simple que la comparación de dos mediciones de cuantificación absoluta. Estas características se traducen en tiempos cortos experimentales, previstos para ser aproximadamente dos horas a través de protocolos refinados, por lo que la técnica útil como herramienta de vigilancia rápida en el ámbito de la detección de fraudes alimentarios.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We acknowledge financial support from Institute of Food research BBSRC Core Strategic Grant funds, BBSRC Project BB/J004545/1.
Materiales
| Name | Company | Catalog Number | Comments |
| Uniprot database | www.uniprot.org | Freely accessible database of protein sequences | |
| Skyline software | www.skyline.gs.washington.edu | Free software to download that enables the creation of targeted methods for proteomic studies, peptide and fragment prediction | |
| Ammonium bicarbonate | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | O9830 | |
| Methanol, HPLC grade | Fisher Scientific, Loughoborough, UK www. fisher.co.uk | 10674922 | |
| Acetonitrile, HPLC grade | Fisher Scientific, Loughoborough, UK www. fisher.co.uk | 10010010 | |
| Urea | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | U5378 | |
| Trypsin(from bovine pancreas treated with TPCK) | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | T1426 | |
| Formic acid | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | F0507 | |
| Coomassie Plus Protein Assay Reagent | Thermo Fisher Scientific www.thermofisher.com | 1856210 | |
| Protein standard | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | P0914 | |
| Ultra Turrax homogeniser T25 | Fisher Scientific, Loughoborough, UK www. fisher.co.uk | 13190693 | |
| Edmund and Buhler KS10 lab shaker | |||
| Heraeus Fresco 17 Centrifuge | Thermo Fisher Scientific www.thermoscientific.com | 75002420 | |
| Vacuum centrifuge RC 1022 | Jouan | ||
| Plate Reader | |||
| Strata-X 33u polymeric reversed-phase cartridges 60 mg/3 ml tubes | Phenomenex, Macclesfield, UK | 8B-S100-UBJ | |
| 4000 QTrap triple-quadrupole mass spectrometer | AB Sciex, Warrington, UK www.sciex.com | ||
| 1200 rapid resolution LC system | Agilent, Stockport, UK | ||
| XB C18 reversed-phase capillary column (100 mm x 2.1 mm, 2.6 µm particle size) | Phenomenex, Macclesfield, UK www.phenomenex.com | ||
| Analyst 1.6.2 software | AB Sciex, Warrington, UK www.sciex.com | QTrap data acquisition and analysis, including peak area integration | |
| Autosampler vials |
Referencias
- O'Mahony, P. J. Finding horse meat in beef products-a global problem. QJM-An Int. J. Med. 106, 595-597 (2013).
- Sentandreu, M. A., Sentandreu, E. Authenticity of meat products: Tools against fraud. Food Res. Int. 60, 19-29 (2014).
- Watson, A. D., Gunning, Y., Rigby, N. M., Philo, M., Kemsley, E. K. Meat Authentication via Multiple Reaction Monitoring Mass Spectrometry of Myoglobin Peptides. Anal. Chem. 87, 10315-10322 (2015).
- Food Standards Agency. . Report of the investigation by the Food Standards Agency into incidents of adulteration of comminuted beef products with horse meat and DNA. , (2013).
- Taylor, A. J., Linforth, R., Weir, O., Hutton, T., Green, B. Potential of electrospray mass-spectrometry for meat pigment identification. Meat Science. 33, 75-83 (1993).
- Ponce-Alquicira, E., Taylor, A. J. Extraction and ESI-CID-MS/MS analysis of myoglobins from different meat species. Food Chem. 69, 81-86 (2000).
- Gallien, S., Duriez, E., Domon, B. Selected reaction monitoring applied to proteomics. J. Mass Spectrom. 46, 298-312 (2011).
- Orduna, A. R., Husby, E., Yang, C. T., Ghosh, D., Beaudry, F. Assessment of meat authenticity using bioinformatics, targeted peptide biomarkers and high-resolution mass spectrometry. Food Addit. Contam. Part A-Chem. 32, 1709-1717 (2015).
- Claydon, A. J., Grundy, H. H., Charlton, A. J., Romero, M. R. Identification of novel peptides for horse meat speciation in highly processed foodstuffs. Food Addit. Contam. Part A-Chem. 32, 1718-1729 (2015).
- von Bargen, C., Brockmeyer, J., Humpf, H. U. Meat Authentication: A New HPLC-MS/MS Based Method for the Fast and Sensitive Detection of Horse and Pork in Highly Processed Food. J. Agric. Food Chem. 62, 9428-9435 (2014).
- von Bargen, C., Dojahn, J., Waidelich, D., Humpf, H. U., Brockmeyer, J. New Sensitive High-Performance Liquid Chromatography Tandem Mass Spectrometry Method for the Detection of Horse and Pork in Halal Beef. J. Agric. Food Chem. 61, 11986-11994 (2013).
- Montowska, M., Alexander, M. R., Tucker, G. A., Barrett, D. A. Authentication of processed meat products by peptidomic analysis using rapid ambient mass spectrometry. Food Chem. 187, 297-304 (2015).
- Montowska, M., Alexander, M. R., Tucker, G. A., Barrett, D. A. Rapid detection of Peptide markers for authentication purposes in raw and cooked meat using ambient liquid extraction surface analysis mass spectrometry. Anal. Chem. 86, 10257-10265 (2014).
- Sentandreu, M. A., Fraser, P. D., Halket, J., Patel, R., Bramley, P. M. A Proteomic-Based Approach for Detection of Chicken in Meat Mixes. J. Proteome Res. 9, 3374-3383 (2010).
- Elliott, M. H., Smith, D. S., Parker, C. E., Borchers, C. Current trends in quantitative proteomics. J. Mass Spectrom. 44, 1637-1660 (2009).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26, 966-968 (2010).
- Keeton, J. T., Ellerbeck, S. M., Nunez de Gonzalez, M. T., Devine, C., Dikeman, M. . Encyclopedia of Meat Sciences. 1, 235-243 (2014).
- Montowska, M., Alexander, M. R., Tucker, G. A., Barrett, D. A. Rapid Detection of Peptide Markers for Authentication Purposes in Raw and Cooked Meat Using Ambient Liquid Extraction Surface Analysis Mass Spectrometry. Anal. Chem. 86, 10257-10265 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados