Method Article
Et kimlik doğrulaması için peptidler Uygulanan MRM Kütle Spektrometresi kullanarak karışımlar türlerin belirlenmesi ve miktar tayini
Bu Makalede
Özet
We present a protocol for identifying and quantifying the components in mixtures of species possessing similar proteins. Mass spectrometry detects peptides for identification, and gives relative quantitation by ratios of peak areas. As a tool food for fraud detection, the method can detect 1% horse in beef.
Özet
We describe a simple protocol for identifying and quantifying the two components in binary mixtures of species possessing one or more similar proteins. Central to the method is the identification of 'corresponding proteins' in the species of interest, in other words proteins that are nominally the same but possess species-specific sequence differences. When subject to proteolysis, corresponding proteins will give rise to some peptides which are likewise similar but with species-specific variants. These are 'corresponding peptides'. Species-specific peptides can be used as markers for species determination, while pairs of corresponding peptides permit relative quantitation of two species in a mixture. The peptides are detected using multiple reaction monitoring (MRM) mass spectrometry, a highly specific technique that enables peptide-based species determination even in complex systems. In addition, the ratio of MRM peak areas deriving from corresponding peptides supports relative quantitation. Since corresponding proteins and peptides will, in the main, behave similarly in both processing and in experimental extraction and sample preparation, the relative quantitation should remain comparatively robust. In addition, this approach does not need the standards and calibrations required by absolute quantitation methods. The protocol is described in the context of red meats, which have convenient corresponding proteins in the form of their respective myoglobins. This application is relevant to food fraud detection: the method can detect 1% weight for weight of horse meat in beef. The corresponding protein, corresponding peptide (CPCP) relative quantitation using MRM peak area ratios gives good estimates of the weight for weight composition of a horse plus beef mixture.
Giriş
The European horse meat scandal of 2013, in which undeclared horse meat was found in a number of supermarket beef products1, highlights the need for testing methods capable of detecting and measuring food fraud in meat. Several technologies have been explored, especially enzyme-linked immunosorbent assay (ELISA) and DNA-based methods2. An alternative route, based on mass spectrometry, targets species-specific peptides which in turn arise from species-specific proteins. Here we outline one such peptide-based approach that offers both identification and relative quantitation of the adulterant species in a meat mixture3.
The protocol is framed in the context of red meats and the desire to determine the presence of one in another at the level of 1% by weight, the level considered by some to represent fraudulent food adulteration as opposed to contamination4. The method relies in the first instance on identifying a protein which is nominally 'the same' in all target meats. Myoglobin, the protein responsible for the red color of meat, is a good candidate since it is abundant, relatively heat tolerant and water soluble, and has been used for species determination of meat previously5,6. The myoglobins for beef (Bos Taurus), pork (Sus scrofa), horse (Equus caballus) and lamb (Ovis aries)3, for instance, are nominally the same, as required, but their sequences are not identical. Such groups of 'similar but different' proteins, like these four myoglobins, can conveniently be described as 'corresponding proteins'. The sequence differences in these four myoglobins are species-specific: for example, the full myoglobin proteins for beef and horse, P02192 and P68082 respectively, each comprise 154 amino acids with 18 sequence differences between the two. Subject to proteolysis using trypsin these proteins produce two sets of peptides, some of which are identical, and some which show one or more species-specific amino acid differences: corresponding proteins therefore give rise to corresponding peptides.
The CPCP approach, therefore, seeks first to identify proteins from two or more species where these proteins exhibit limited species-specific sequence variants. These are corresponding proteins. Following proteolysis, corresponding proteins give rise to peptides, some of which likewise display species-specific sequence variants inherited from the parent protein. These are corresponding peptides. The CPCP approach can be used to compare levels of two corresponding proteins in a mixed species sample by monitoring the levels of corresponding peptides.
The natural technology for the detection of known peptides is multiple reaction monitoring mass spectrometry, or MRM-MS7. Species-specific peptides yield precursor ions, which along with their mass spectrometry fragment ions, are easily itemized in advance by software tools. These lists are then used to instruct the mass spectrometer to record only specific precursor plus fragment ion pairs, called transitions. A particular target peptide is therefore identified not only by its retention time in the chromatography preceding the mass spectrometer, but also by a set of transitions sharing a common precursor ion. This is a highly selective means of detecting known peptides that makes efficient use of the mass spectrometer resource.
Other authors have used mass spectrometry to test for meat adulteration via peptide markers but from disparate proteins8-14. Using the corresponding proteins, corresponding peptides (CPCP) scheme, however, means experimental conditions can be optimized, aiding identification of the species in the mixture from known species-specific transitions. In addition, corresponding proteins and peptides will generally behave similarly in the extraction, proteolysis and detection stages. Since transition peak areas are quantitative and reproducible, ratios of peak areas arising from pairs of corresponding peptides from different species provide a direct estimate of the relative quantities of two meats in a mixture. In contrast, more traditional quantitation routes exploit calibrations based on reference materials to establish absolute quantitation14,15.
Though the protocol is outlined in the context of myoglobin and meat, proteins other than myoglobin could be used for identification and relative quantitation via the CPCP strategy in meat mixtures, though potentially with modifications to the protocol. In addition the strategy is also applicable to binary mixtures of other species sharing one or more corresponding proteins.
The starting point for the protocol is purified 'reference' myoglobin, which for some species can be purchased but which for others must be prepared by conventional size-exclusion chromatography. The procedure for preparing reference myoglobin is not included in the protocol, but is described elsewhere3. Software tools16 are used to list candidate peptides and transitions arising from myoglobins of interest. Each reference myoglobin is subjected to proteolysis and the resultant peptides analyzed by liquid chromatography electrospray ionization tandem mass spectrometry (LC-ESI-MS/MS) to discover which of the candidate precursor ions and transitions are most useful, and to determine the matching peptide retention times. The outcome of this stage is a revised list of target peptides with their transitions, suitable for species determination, and a list of CPCP pairs, suitable for relative quantitation. To test real meats, sample extractions are prepared then subjected to proteolysis to generate peptides both from myoglobin and other extraneous proteins. The myoglobin-based peptides are then monitored by LC-ESI-MS/MS based on their listed transitions. The species present in a mixture are identified by the transition peaks associated with marker peptides. Estimates of the relative amounts of two meats in a binary mixture are calculated using ratios of transition peak areas. A set of test mixtures of pairs of meats will allow the ratio of peak areas for a given pair of transitions to be checked and calibrated against actual mixtures.
Protokol
1. Proteoliz ve Referans Myoglobins analizi
- Referans myoglobins Proteoliz
- (- 25 mM amonyum bikarbonat içinde 0.5 mg / ml aralığı 0,2) 3, saflaştırılmış bir referans myoglobins çözeltilerini hazırlamak.
- Aktarım 1 2 ml santrifüj tüplerine her numunenin ml'lik eş payları.
- Isı 30 dakika boyunca 95 ° C 'de sıcak bir blok numune ısıtılmasıyla ekstre proteinleri denatüre. bu sırada oda sıcaklığına ulaşana kadar, yaklaşık 15 dakika boyunca numune soğumaya. daha sonra, sindirimini arttırmak karıştırmak için üre (nihai konsantrasyon 0.5 M) 30 mg ekleyin.
- triptik proteoliz
- 25 mM amonyum bikarbonat içinde tripsin 1 mg / mL çözelti ve gerektiğinde buz üzerinde muhafaza edin. Tripsin yeterli hacim ekleme son enzim aktivitesi 420 BAEE olduğu (N-benzoil-L-arginin, etil ester hidroklorür) birim / ekstre mg protein, daha sonra yumuşak bir vorteks ile karıştırın ve 3 gece boyunca proteolyze izin örneğin7 ° C.
- Proteoliz tamamlanmasını göstermek için sodyum dodesil sülfat poliakrilamid jel elektroforez (SDS-PAGE) 17 yapınız.
- Post-proteoliz numunenin Tuzdan arındırma
- 2: v: su ile v örnek 1 seyreltin.
- bir polimerik ters faz etkinleştirir (RP) kartuş metanol 1 ml eklenerek 30 mg RP malzemesi ile doldurulmuş, daha sonra 1 ml% 1 formik asit ilave edilerek kartuşu dengeye.
- yerçekimi altında kartuşun üzerine örnek yükleyin.
- yerçekimi altında% 5 metanol /% 1 formik asit içinde, 1 ml ile yıkayınız.
- yerçekimi altında 5 ul dimetilsülfoksit (DMSO) ile doldurulmuş 2 mL mikrosantrifüj tüpleri içine;: asetonitril / su, 1 ml (% 0.1 formik asit hac 90:10 h) ile peptidlerin elüt edilmesi.
- Daha sonra 250 ul asetonitril / su içinde bir tortu çözülür, 120 dakika süre ile santrifüj buharlaştırıcı kullanılarak 50 ° C'de vakum altında çözücüyü çıkarın (3:97 h: h;% 0.1 formik asit).
- transferdüşük hacimli bir otomobil örnekleyici flakon çözüm.
Not: Örnekler sıvı kromatografi kütle spektrometrisi (LC / MS) analizi için hazır olana kadar 4 ° C'de saklanabilir.
- MRM geçiş listelerinin oluşturulması
- UniProt veritabanından farklı etler için miyoglobin dizileri bulun.
- (Örneğin, Skyline) peptid ve geçiş tahmin yazılımı 'Hedef' kutu içine miyoglobin dizileri girin. Gerekirse, kendi fragman listesini ortaya çıkarmak için bir peptid üzerinde gezdirin.
- 'Ayarlar' tıklayın ve 'Peptit Ayarlar' seçeneğini seçin. Girdi sindirim için tercihleri (yani tripsin) ve cevapsız bölünmeler sayısı (0). Özellikle, ek parametreler için gerekli olan seçim butonu, peptid uzunluğu (6-25), N-terminal hariç tutma (0) ve (yok) amino asit modifikasyonları almıştır.
- 'Geçiş Ayarları' Ayarlar 'tıklayın ve seçin. tercihlerini seçmekLC / MS analizi için kullanılan alet türü.
- 'İhracat' tıklayın ve üretilen MRM geçişleri ve parametreleri içeren bir tablo oluşturmak için 'Geçiş Listesini' seçeneğini seçin.
- LC / MS ile analiz
- yüksek performanslı sıvı kromatografisi (HPLC), otomatik örnekleyici, C18 çekirdek-kabuk HPLC sütunu (10 sm x 2.1 mm: İkili gradyan sistemi (h su (A) ve asetonitril (B)% 0.1 formik asit V ile her biri) ayarlama MRM algılama pozitif elektrosprey modunda çalışan bir üçlü dört kutuplu kütle spektrometresi bağlı 2.6 um parçacık büyüklüğü).
- Veri toplama yazılımı (örneğin, Analist) 'de,' Dosya 've' Yeni 'seçin ve pop-up kutusu' Edinim Yöntemi 'üzerine tıklayın ardından' Tamam 'üzerine tıklayın.
Not: Bu yeni bir LC / MS yöntemi kurulumu sağlayacak bağlı cihazların bir listesini içeren alet yöntemi düzenleyicisi açar. - 'İkili Pump "ve i tıklayınTemel giriş 5 dakika boyunca 23 dakikada% 100 B'ye artan akış hızı değeri (300 ul / dak) ve 22 dakika boyunca% 30 B% 3 B, bir ikili gradyan profili ayar tablosunda gradyan kez, yıkayın daha 6 dakika başlangıç koşullarına ve yeniden dengeleme dönmeden önce.
- 'Otomatik örnekleyici' tıklayın ve enjeksiyon hacmi (5 ul) yerleştirin. 'İğne Yıkama Döngüsü' etkinleştirin ve 'Yıkama Süresi' (30 sn) girin ve 'Flush Bağlantı Noktası' seçiniz.
- 'Termostatlı Kolon Kontrolörü' ve 'Kolon Fırını Özellikleri' set 'Sol Sıcaklık' ve 'Sağ Sıcaklık' (40 ° C) tıklayın.
- 'Kütle spektrometresi' tıklayın ve ardından kaynak gaz koşullarını girmek için 'Edit Parametreleri' tıklayın. 'Pozitif' olarak 'MRM (MRM)' ve 'Polarite' olarak 'Tarama Tipi' seçeneğini seçin. LC analizi için, toplam zamanı 'Dönem Özeti' gidin ve 'Süresini' girinD, dengeleme (35 dakika).
- Tabloda sağ tıklayın ve masaya bu sütunları eklemek için 'Declustering Potansiyeli (DP)' ve 'Çarpışma Enerjisi (CP)' seçiniz. Geçiş listesi (adım 1.4.5 bakınız) oluşturulan bir tek et türü için, geçişler için tüm Q1, Q3, Zaman (msn), kimliği, DP ve CE değerlerini girin.
Not: Saat (msn), bekleme süresi kütle spektrometresi her geçişi tarayarak harcadığı zamanı ifade eder, toplama olan 3 sn geçmemelidir. - Toplama Yöntemi dosyası (dosya uzantısı .dam) kaydedin.
Not: - 1.5.8 Her et türü için tekrar edilmesi gerekir 1.5.2 adımları. Bu, aşağıdaki analiz için hazırlık ekran modunda her et türleri için tek bir yöntem dosyası oluşturur. - veri toplama yazılımındaki, 'Edinme' tıklayın ve 'dengeye' seçeneğini seçin. Açılan kutuda, enstrüman dengelenmesini başlamak için gerekli Toplama Yöntemi seçin.
- ar örnek şişeleri koymakoto Örnekleyicide ack.
- 'Dosya' tıklayın ve 'Yeni' ardından 'Edinim Toplu' seçeneğini seçin. 'Örnek' sekmesinde 'Örnekleri Ekle ardından' Set 'seçeneğini seçin. numune sayısı analiz edilecek takın ve 'OK' tıklayın. 'Edinim' kutusuna açılır menüden analizi için kullanılacak yöntem dosyasını seçin.
- Tabloda, 'Plaka Kodu' seçin ve açılır menüden uygun tepsi yapılandırmasını seçin. sonra sağ tıklayın sütun başlığını 'Kodu Plaka' ve 'Aşağı Doldur' de sol tıklayın. 'Flakon Pozisyonu'nda satırların otomatik örnekleyici her numunenin konumunu girin.
- 'Veri Dosyası' in edinimi için dosya adını girin, sütun başlığında sonra sol tıklama sağ tıklama ile takip ve 'Aşağı Doldur' seçeneğini seçin. 'Örnek Adı' numunelerin her kimlik analiz edilecek yerleştirin. Bir satın alma toplu iş dosyası olarak kaydet (dosya, extension .dab).
- LC / MS analiz edilmesi gereken örnekleri vurgulamak 'Gönder' sekmesini tıklayın. 'Gönder' üzerine tıklayın. analiz başlamak için 'örnek başla' Edinme 've tıklayın.
Not: Her satın alma yöntemi tek et türün kromatograf tüm uzunluğu boyunca MRM geçişleri için tarar. Bir MRM edinimi için kütle spektrometresi ayarları enstrüman tipi ve peptit göre değişir. - veri görüntüleme yazılımı kullanılarak oluşturulan veri dosyaları görüntüleme. XIC (çıkarılan iyonları) ve tek bir öncü (Q1) için tüm parçaları (Q3 değerleri) vurgulamak Açılır listeden tıklayın. Yeni bir bölmesi sadece seçili geçişleri gösteren açılacaktır.
- Bu, tek bir peptide karşılık gelmektedir çünkü aynı anda geçiş grupları için tutma süresi (Rt) kaydedin.
- Her biri için kendi peptidler zirveleri atamak için geçişlerin her set için önceki iki adımı tekrarlayınEt türlerinin.
- Tür tanımlamak temin edilmesi için uygun olan markör peptidleri kaydedin (örneğin, peptit HPGDFGADAQGAMTK, ön-madde: m / z = 752, RT = at için 12.0 dakika) nispi nicelik için müsait çift karşılık gelen oluşturan birlikte tutma süreleri ile, ve dikkat .
Not: Örneğin, at işaretleyici peptit (ön-madde, m / z = 752) karşılık gelen bir sığır peptidi HPSDFGADAQAAMSK (ön-madde, m / z = 767, Rt = 13.2 dakika) sahiptir. - , Sırayla her et türleri için, veri görüntüleme yazılımı, et türlerinin tüm kucaklayan tek bir dinamik yöntem oluşturmak (1.5.8 belirli bir peptid atanan) her habercisi için XIC geçiş verilerini açmak için.
- Sol tıklayarak seçilen tutma anda tepe kümede yakınlaştırmak ve küme altında imleci sürükleyerek. (Pik etikette sağ tıklayarak) en yoğun geçişler belirleyin.
- El ile geçişler kayıtBir e-tabloda ve saklama süreleri.
- LC / MS yazılımına yeni bir dinamik yöntem olarak parametreleri girmek için, 'Kütle Spektrometre' tıklayın ve ardından kaynak gaz koşullarını girmek için "Düzenle Parametreleri 'üzerine tıklayın. 'Pozitif' olarak 'MRM (MRM)' ve 'Polarite' olarak 'Tarama Tipi' seçeneğini seçin.
- 'Dönem Özeti' gidin ve (LC analizi ve dengeleme için toplam süre olarak ayarlanır) süreyi girin. Tabloda sağ tıklayın ve masaya bu sütunları eklemek için 'Declustering Potansiyeli (DP)' ve 'Çarpışma Enerjisi (CP)' seçiniz.
Not: 'Zaman' sütunu artık her geçiş için beklenen tutma süresi (dk) karşılık gelir. - LC / MS veri toplama yazılımı 'Düzenleme Parametreler' bölümünde, 'Programlı MRM' kutusunu işaretleyin. Q1, Q3, Süresi (dak), kimlik, elektronik tablo (1.5.21) 'de oluşturulan geçişleri için DP ve CE değerleri ve Devralma Yöntemi kaydetmek (fil girişie uzatma .dam).
Not: Bu yöntem genellikle MRM sayısı her peptid için 4 en yoğun için geçişler ve gelişmiş hassasiyet ve veri kalitesini veren, sadece her peptit tepe tutma süresi penceresinde karşısında tarar azaltır. Bir 'dinamik' yöntemi 'güdümlü tutma süresi pencere' yöntemi, bazen denilen zamanlama olduğunu.
Kalibrasyon Örneklerinin 2. Hazırlama ve Analizler
- et karışımlarının ekstraksiyonu
- Daha önce, sonra bir toz haline dondurulmuş et kullanılarak, 15 ml plastik santrifüj tüplerine et ilgili miktarda (yaklaşık 300 mg toplam kütlesi) tartılarak et karışımlarının bir dizi hazırlar.
- ekstraksiyon tamponu (pH 6.5 + 0.15 M fosfat tamponu, 0.15 M potasyum klorür) 4 ml. 30 saniye vorteksleyin. 250 devir / dakika ile 2 saat boyunca oda sıcaklığında bir laboratuar karıştırıcısı üzerinde ekstrakte edin.
Not: devir / dk bir titreşimli hareketine karşılık gelir. - 2 ml aktarın2 ml mikrosantrifüj tüpü içine ekstrakte edin. 17,000 x g'da 4 ° C'de 5 dakika boyunca santrifüje.
- Aktarım 200 ul 2 mi santrifüj tüplerine süpernatanın alikotlan (protein tahlili için küçük bir miktar saklı 2.2) ve bir santrifüj buharlaştırıcı kullanılarak kuru (önceden belirlenmiş bir program: 50 ° C, havalandırma ve 120 dakika süre ile).
- protein deneyi
- Aktarım, 96 gözlü bir levhanın gözleri içine üç kopya halinde ayrılmış süpernatan 7 ul tam bölünen miktarları (2.1.4).
- Aktarım üç kopya halinde Protein standartlarının bir dizi 7 ul alikotları, aralık 0-1,0 mg / ml sığır serumu albümini (BSA), aynı 96 plaka.
- Her bir oyuğa, Coomassie protein tahlili artı reaktif 200 ul ekle.
- Görme numuneler kalibrasyon standartları aralığında olup olmadığını kontrol etmek için protein standartları ile örnek kuyuların renk karşılaştırın. Gerekirse bu aralıkta olur böylece, seyreltilmiş numune ile tekrarlayın.
- st plaka bırakınve 3 dakika boyunca.
- Bir derialtı iğne ile oluşmuş herhangi bir kabarcıkları patlamaya.
- 595 nm'lik bir dalga boyunda bir standart uç protokolü kullanılarak plaka okuyucusu üzerinde plaka analiz edin.
- Protein standartlarının kalibrasyon verilerini kullanarak örneklerin protein konsantrasyonunu belirleyin.
Not: Bu, triptik sindirimi kullanılan tripsin miktarının hesaplanması için gereklidir.
- et karışımlarının Proteoliz
- 25 mM amonyum bikarbonat solüsyonu, 1 ml Aşama 2.1.4 kurutulmuş tortu yeniden çözülmemiştir. Bir rotamixer üzerinde iyice karıştırın.
- 1.3.7 adım 1.1.3 den protokolü uygulayın.
- LC / MS ile analiz
- Daha önce (adım 1.5.1) olarak LC / MS ayarlayın.
- Et türlerinin hepsi birleştiren bir dinamik LC / MS yöntemi kullanır 1.5.24 de adımda oluşturulan satın alma yöntemi seçerek, ve için veri elde - Daha önce belirtildiği gibi, yeni bir satın alma toplu oluşturun (1.5.14 1.5.9 adımlar) Digested et örnekleri.
- veri görüntüleme yazılımı tam kromatogram gösterir. sırayla belirlenen her bir geçiş için Xic görüntüler. Görme her küme böylece seçilen peptid varlığını teyit beklenen tutma anda çan şeklindeki zirvelerinden gerekli sayı içerir onaylayın.
- Navigasyon bar 'kantitasyonu Yöntemi kurmak' üzerine çift tıklayarak ilgi geçişleri her biri için pik alanları entegre görüntüleme yazılımı verileri kullanarak kantitatif gerçekleştirin.
- 'Select Örnek' bölmesinde 'Veri Dosyası' ve 'Örnek' seçeneğini bir 'analitlerin' tablo oluşturmak için analiz edilecek.
- entegre edilecek geçişler (analitler) ilk görüntülemek için 'Bütünleşme' sekmesine tıklayın.
- Geçişlerin listesinde açılan görüntülemek için 'analit' kutusuna tıklayın. görüntülemek ve görsel doğru tepe entegrasyonu için seçilmiş onaylamak için sırayla her geçişi seçin. m'yeodify veya entegrasyon, sol tıklama zorlamak ve hedef zirve üzerine imleci (bu yeşil vurgulanır) sürükleyin. 'Select Tepe' butonuna tıklayın ve 'Uygula' düğmesine tıklayın.
- Bir yöntem dosyası (.qmf) olarak çalışma alanını kaydedin.
Not: Bu örnek pik alanlarının izleyen hesaplamada bir kantitasyonu Yöntemi dosyası oluşturur. - Navigasyon çubuğundaki çift tık 'kantitasyonu Sihirbazı'. 'Seçkin örnekleri' penceresinde sonra, bir veya daha fazla 'Mevcut Örnekler' tek bir 'Veri Dosyası' seçerek 'kantitasyonu Set' yaratmak. Seç 'İleri' 'Seç Ayarlar ve Query' kutusunu görüntülemek için. 'İleri' 'Seç Yöntemi' göstermek için seçin varsayılan ile bırakın. 'Yöntem' kutu adımda 2.4.8 oluşturulan 'Entegrasyon Yöntem' dosyayı seçin açılan, daha sonra 'Finish' seçeneğini seçin.
Not: Bu et karışımlarının kaynaklanan geçiş pik alanları da dahil olmak üzere bir 'Sonuçlar Tablo' oluşturur. - 'Sonuçlar Tablo' (dosya uzantısı .rdb), bir metin dosyası olarak ihracat (.txt) kaydedin ve verileri gözden geçirmek için e-tabloda açın.
- , Peptidleri ilgili iki parça içeren durumlarda odaklanan seçilen geçişler için seçilen MRM iki etler ölçülen yüzdesine göre başka bir et (geçiş pik alan ile) yüzde arsa grafikler (a / a) C-terminal ucunda sayılır gibi amino asitlerin aynı sayıda.
Not: aynı parçalanma siteleri ile Özdeş parçaları optimum sonuçlar verir. - Yukarıdaki 2.4.11 gelen araziler inceleyin. Ya görsel veya çizim paketinde bir eğilim satırı aracını kullanarak, doğrusal ve benzeri gradyan hem araziler bir grup tanımlamak. gerçek et örneklerinde kalibrasyon için, bu CPCP ek parçası kombinasyonlardan herhangi birini ya da daha fazlasını kullanarak.
Not: sıradışı gradyanı gösteren bir çizim sinyal stre müteakip bir azalma ile peptit veya fragman bastırma ya da gösterebilirngth. Doğrusal Olmayan araziler kötü tepe algılama veya başka sorunlara işaret edebilir.
3. Et Örnekleri
- Hedef et örneklerinden proteinlerin ekstraksiyonu
- Nerede bir spatula kullanarak örnekten uygulanabilir, tüketim yabancı olmayan et malzeme. Örneğin, bir soğutulmuş lazanya gelen sos ve makarna kazınması.
- bir metal kap içine et 20 g tartılır.
- pH 6.5, 0.15 M potasyum klorür / 0.15 M potasyum monofosfat tamponu 100 ml.
- 1 dakika boyunca yüksek hızlı bir homojenleştiricide et karıştırma proteinleri çıkarın.
- 2.3.2 - Adım 2.1.4 den protokolü uygulayın.
- LC / MS vasıtasıyla numunelerin analizi
- Adımı tekrarlayın 2.4.2 dinamik LC / MS yöntemi kullanılarak veri elde etmek.
- Adım 2.4.3 gerçekleştirilen her et miyoglobinden peptidler belirleyin.
- nicelendirilmesi için, ilgi konusu her bir geçiş için pik alanları birleştiren niceleme yazılım kullanımı,gibi adım 2.4.9 olarak açıklamıştır.
- bir karışım türlerin tanımlanması için, geçişler numaralar için kararlaştırılan kriterleri karşılayan bu işaretleyici peptidler kaydedebilir ve bu geçişler için gürültü sinyal.
- kantitatif için, geçiş pik alanı ile yüzdesini kullanarak, adım 2.4.12 den anlaşmaya varıldığı şekilde entegre geçiş pik alanları kullanmak ve karışım iki türe miyoglobin yüzdesini hesaplar.
- Numunede mevcut iki etler göreceli ağırlık / ağırlık miktarları tahmin etmek etlerde muhtemel miyoglobin düzeyleri Literatürde 18 önceden bilgiyi kullanmak.
Sonuçlar
tek bir dinamik mod MRM deneyde her programlanmış geçiş ayrı kaydedilir belirli bir tutma süresi penceresi üzerinde (saniyede dedektör sayısı, cps gibi). Tüm veriler bir deneyde elde gelen bu nedenle, her bir geçiş için pik yoğunluğu ayrı ayrı elde edilebilir. Sonra sadece sonlu sinyal geçiş için belirlenen tutma süresi penceresinde içindir. Pencerenin dışında, sinyal tanımı gereği sıfırdır. Örneğin, herhangi bir geçiş için sinyal, attan 752 → 1269 (kütle 1,501.66 dalton, haberci iyon m / z 751,84 dalton, devlet = 2, fragmanı iyon y 13 şarj Monoizotopik peptid), tipik olarak ölçüm gürültü ve sadece rekabet etmek zorunda belki de diğer türlerden olabilir başka geçiş uç noktalarından korur. çıkışı, bu nedenle, ortak bir ön-madde iyonu paylaşan bu geçişler için ortak bir retansiyon süresinde temiz tepe geçiş başına bir, bir dizi.
Şekil 1, ağ / ağ% 1 bir karışımı dört geçişleri 752 → (1269, 706, 248, 1366) grubu çıkışını gösteren sığır atı. Görüntülenen dört geçişler atı ile ilişkili ve saf sığır, kuzu ya da domuz eti örneklerinde bulunmadığına olduğundan, bu zirveleri at varlığının işaretidir. gürültü seviyesi kimlik kurar için sağlamlık kriterlerine, iki veya daha fazla geçişler bir dizi bağlı olarak her bazı belirtilen sinyali aşan. Bu şekil, bu nedenle sığır, at a / a% 1 karışımında at varlığını belirler.
Bazen, bir tek izole geçiş tespit edilir. Bu kütle spektrometresi içine sistemden beklenen ve programlı olanlarla, muhtemelen bir yabancı protein, haberci iyonu ve tek parçanın bir şans maçı gösterir. Tekil tepe doğası ve beklenmedik bir alıkonma zamanında Oluşması, Sigöz ardı edilebilir bir kaza geçiş gnature.
her bir geçiş tepenin altındaki alan, tek tek hesaplanır. 767 → 1299 (sığır),. Karışımının gerçek etler oranı ile orantılı Şekil 2 bir gösterir, örneğin, → 1269 752 (ATI) için uygun bir fragmanı, sığır geçiş pik alanları at oranına bağlı sığır, at karışımında at ağırlık için yüzde ağırlığına karşı bu iki geçiş için pik alanı ile olan yüzdesinin grafiğidir. Yüzde geçiş pik alanları etin ağırlığı yüzde ağırlığını maç sonra eğim bu parselde eğim bu geçişler ve CPCP çifti için, geçiş pik alanları nispi miktarları güvenilir bir ölçü vermek olduğunu belirten, 1.03 1'dir karışımdaki iki etler. eğimi, diğer faktörler değişmeden ile numunedeki at eti, sonra sığır olarak miyoglobin iki kat zengin olsaydı Satır birden büyük olacaktır.
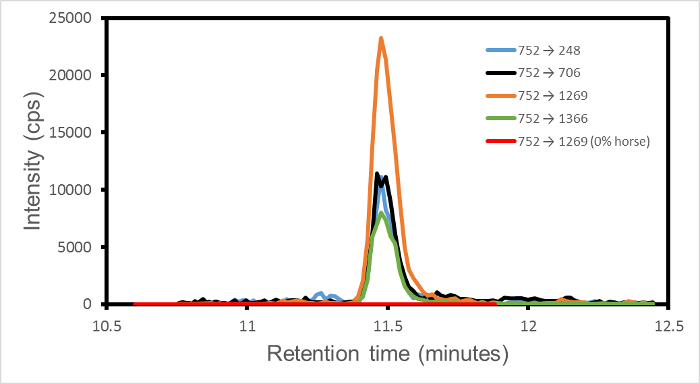
Şekil sığır at a / a% 1 için saklama zamana karşı 1. MRM geçiş yoğunlukları. Geçişler → (1269, 706, 248, 1366) 752 vardır, turuncu, sırasıyla, siyah, mavi ve yeşil gösterilir. işaretleyici peptit HPGDFGADAQGAMTK olup. Dört geçiş fragmanları Y'nin N peptit C-terminal ucunda N amino asitler sayma belirtir, sırasıyla y 13, y 7, Y2 ve 14 Y, ifade edilebilir. Gürültü sinyal 23 ile dört geçişler üzerinde 53 arasında değişmektedir. Ek bir kırmızı çizgi 0% atı, karşılaştırma için% 100 sığır eti için 752 → 1269 geçişi ifade eder. tutma süresi sadece sıfır olmayan bölgesi gösterilir. Bu rakam, Watson ve ark., 3 modifiye edilmiştir.es / ftp_upload / 54420 / 54420fig1large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
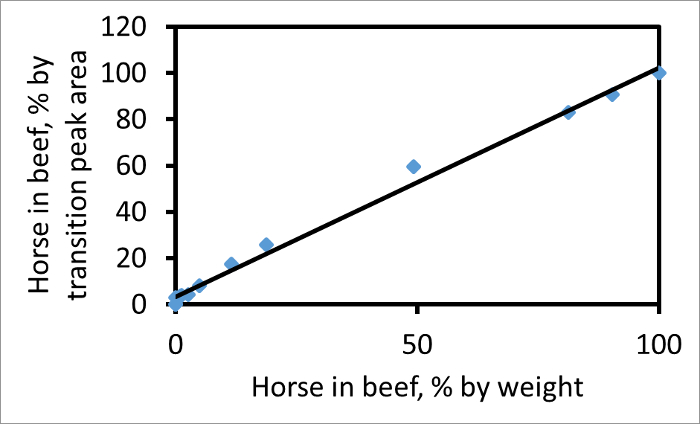
Şekil. Arsa peptidler sığır (767) ve at (752) ve her ikisi için y 13 fragmanı iyon çifti kullanan yüzde geçiş pik alanı olarak sığır atı karşı ağırlık için yüzde ağırlık olarak sığır atı 2. Konu,. Bir pik alanı anlamına gelir, o zaman koordinatı, 100 A, H / (A, H + A B). En uygun hat (R2 = 0.99) eğimi 1.03 olduğunu. Bu rakam Watson ve ark. 3 modifiye edilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Uygun bir hedef proteinin seçimi önemlidir. İyi bir hedef protein ilgi türlerinde gelen formlar, yeterli türe bağımlı dizisi varyasyonu, türlere göre, sahip ve organizmalar içinde erişilebilir miktarlarda bulunması gerekir. işlem görmüş olması karışımları (örneğin, ısı işlemi) belirlenmesi için, bu işlem nispeten bağışıklık bir sekansa sahip bir protein arzu edilir. Miyoglobin pişmiş kırmızı et de dahil olmak üzere kırmızı et, için iyi bir aday olduğunu, ancak tek olasılık değildir. hedef protein karar verildiğinde, protokolün en önemli parçası, protein proteoliz olduğunu. miyoglobin farklı bir protein de alternatif bir proteoliz protokolü talep edebilir.
açıklandığı gibi protokol referansı saflaştırılmış protein dayalı bir segment içerir. Bu tutma süresi pencereler ve uygun bir ön-madde ve fragman iyonu bilgiye amaçlamaktadır. Bu segment çok yararlı ama şart değildir.
, bazen sekans farkı, sindirim profilinde ciddi sonuçlara yol açar durumdur. Örneğin peptit çifti VLGFHG (sığır) ve ELGFQG (at) (gradyan Şekil 2'de daha az bir sürede tezahür) anormal niceleme sonuç verir. İkinci peptid karışımında at seviyesinin düşük tahmin neden nispeten bastırılmış KE bölünme ortaya olmasıdır. Farklı amino asitler ile başlayan tekabül eden peptidler bu nedenle en iyi kaçınılmalıdır. Genellikle iki karşılık gelen peptidler gelen fragmanlar aynı amino asit dizilerine sahip ve iyi davrandım, ama bu her zaman böyle değildir ve yöntem geliştirme sırasında kontrol edilmelidir. Türler kimlik daha az hassas göreceli kantitatif daha bu konular etmektir.protokol dört kırmızı et için ortaya konmuşturs 3. Çok fazla işaretleyici peptidler eş elute eğer geçiş zirve şeklinin kalitesi etkili bir bekleme süresini azaltmak ve sonuçta göreceli kantitatif tahminleri aşağılayıcı, bozulabilir olsa ek et türleri, dahil edilebilir. zaten mevcut gelişmiş enstrümantasyon, bu artıracaktır. Bununla ilgili bir konu değil, tüm etler farklı myoglobins olması. Örneğin, at, eşek ve zebra myoglobins aynıdır ve bu nedenle kesinlikle yöntemi konuşan sığır atı veya eşek ya da zebra tespit edebilen tek olduğunu. Bazı durumlarda, myoglobins denk olmasa da, bazı önemli peptidler olabilir. Örneğin, bazı kuzu miyoglobin türevli markör peptitler de keçi görünür.
Bu ve diğer protein bazlı niceleme yöntemi bakan bir komplikasyonu, protein ya da peptid seviyeleri, bir karışım içinde etler seviyelerine trivially kıyaslamak için ise, protein düzeyi, tüm türler arasında sabit kabul edilebilir olmasıdır. miyoglobin ve dört kırmızı mBu evrensel doğru değildir yiyor. Genel olarak düzeyleri dört düşük seviyede sergileyen domuz bağımlı türler vardır. Buna ek olarak, miyoglobin düzeyi et kesim ve hayvan yaşla birlikte değişir. Geçiş pik alanlarının oranları miyoglobin oranlarına güvenilir bir haritada rağmen Yani, gerçek et oranı haritalama karışımındaki etler muhtemel kaynaklarına ilişkin varsayımlara tahmini resmidir.
Bu çalışmada açıklanan yaklaşım, diğer geçme katkılardan bir dizi yolla farklıdır. Daha tipik yol farklı türleri için işaretler birbirine 8-12,14,19 ile özel ilişkisi sahip bu durumda, çeşitli farklı türe bağımlı markör peptitleri tanımlamak için proteomik yöntemlerinin kullanılmasıdır. Buna karşılık, biz türe bağımlı dizisi 3 varyantları kadar ilgi tüm türlerin ortak proteinleri seçtiniz. Apart bizim göreceli kantitatif stratejisine merkezi olmaktan, bu o örnek avantajı vardırPreparasyon stratejileri optimize edilebilir. Buna ek olarak, bu karşılık gelen proteinler çıkarma ya da pişirme ya da konserve olarak örneklerin, ticari işlem, örneğin, benzer şekilde davranır beklenebilir. Türlere tanımlaması normal tipik haliyle bir ya da iki dizi farklılıkları sahip yakından ilişkili peptitlerin algılama ile CPCP yaklaşımı tür tanımlaması ilerler iken, farklı işaret peptitlerinin algılama yoluyla ilerler. Son olarak, protein kantitasyonu geleneksel ayrıca bilinen standartlara 7,14,15 dayalı olarak her bir protein olarak mutlak nicelendirilmesi ile devam edebilecek başka bir tür olan ağırlıkça yüzde tahmin etmek. Ancak kalibrasyon yöntemi için bir ihtiyaç vardır CPCP yöntemi kullanılarak. Bunun yerine, göreceli seviyelerinin tamamen kesin bir ölçüm aşamasını atlayarak iki türden iki karşılık gelen peptitlerin sinyal güçlerini karşılaştırmak suretiyle tahmin edilmiştir. Nihai hedef ano bir türün ağırlık yüzdesi olduğuther, göreceli kantitatif, sonra CPCP hem daha doğrudan ve iki mutlak kantitatif ölçümleri karşılaştırarak daha basittir. Bu özellikler gıda sahtekarlık algılama alanında hızlı bir gözetim aracı olarak teknik kullanışlı hale rafine protokolleri kullanarak yaklaşık iki saat olması beklendiğinden kısa deneysel kez, çevirmek.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We acknowledge financial support from Institute of Food research BBSRC Core Strategic Grant funds, BBSRC Project BB/J004545/1.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Uniprot database | www.uniprot.org | Freely accessible database of protein sequences | |
| Skyline software | www.skyline.gs.washington.edu | Free software to download that enables the creation of targeted methods for proteomic studies, peptide and fragment prediction | |
| Ammonium bicarbonate | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | O9830 | |
| Methanol, HPLC grade | Fisher Scientific, Loughoborough, UK www. fisher.co.uk | 10674922 | |
| Acetonitrile, HPLC grade | Fisher Scientific, Loughoborough, UK www. fisher.co.uk | 10010010 | |
| Urea | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | U5378 | |
| Trypsin(from bovine pancreas treated with TPCK) | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | T1426 | |
| Formic acid | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | F0507 | |
| Coomassie Plus Protein Assay Reagent | Thermo Fisher Scientific www.thermofisher.com | 1856210 | |
| Protein standard | Sigma-Aldrich Co Ltd, Gillingham, UK www.sigmaaldrich.com | P0914 | |
| Ultra Turrax homogeniser T25 | Fisher Scientific, Loughoborough, UK www. fisher.co.uk | 13190693 | |
| Edmund and Buhler KS10 lab shaker | |||
| Heraeus Fresco 17 Centrifuge | Thermo Fisher Scientific www.thermoscientific.com | 75002420 | |
| Vacuum centrifuge RC 1022 | Jouan | ||
| Plate Reader | |||
| Strata-X 33u polymeric reversed-phase cartridges 60 mg/3 ml tubes | Phenomenex, Macclesfield, UK | 8B-S100-UBJ | |
| 4000 QTrap triple-quadrupole mass spectrometer | AB Sciex, Warrington, UK www.sciex.com | ||
| 1200 rapid resolution LC system | Agilent, Stockport, UK | ||
| XB C18 reversed-phase capillary column (100 mm x 2.1 mm, 2.6 µm particle size) | Phenomenex, Macclesfield, UK www.phenomenex.com | ||
| Analyst 1.6.2 software | AB Sciex, Warrington, UK www.sciex.com | QTrap data acquisition and analysis, including peak area integration | |
| Autosampler vials |
Referanslar
- O'Mahony, P. J. Finding horse meat in beef products-a global problem. QJM-An Int. J. Med. 106, 595-597 (2013).
- Sentandreu, M. A., Sentandreu, E. Authenticity of meat products: Tools against fraud. Food Res. Int. 60, 19-29 (2014).
- Watson, A. D., Gunning, Y., Rigby, N. M., Philo, M., Kemsley, E. K. Meat Authentication via Multiple Reaction Monitoring Mass Spectrometry of Myoglobin Peptides. Anal. Chem. 87, 10315-10322 (2015).
- Food Standards Agency. . Report of the investigation by the Food Standards Agency into incidents of adulteration of comminuted beef products with horse meat and DNA. , (2013).
- Taylor, A. J., Linforth, R., Weir, O., Hutton, T., Green, B. Potential of electrospray mass-spectrometry for meat pigment identification. Meat Science. 33, 75-83 (1993).
- Ponce-Alquicira, E., Taylor, A. J. Extraction and ESI-CID-MS/MS analysis of myoglobins from different meat species. Food Chem. 69, 81-86 (2000).
- Gallien, S., Duriez, E., Domon, B. Selected reaction monitoring applied to proteomics. J. Mass Spectrom. 46, 298-312 (2011).
- Orduna, A. R., Husby, E., Yang, C. T., Ghosh, D., Beaudry, F. Assessment of meat authenticity using bioinformatics, targeted peptide biomarkers and high-resolution mass spectrometry. Food Addit. Contam. Part A-Chem. 32, 1709-1717 (2015).
- Claydon, A. J., Grundy, H. H., Charlton, A. J., Romero, M. R. Identification of novel peptides for horse meat speciation in highly processed foodstuffs. Food Addit. Contam. Part A-Chem. 32, 1718-1729 (2015).
- von Bargen, C., Brockmeyer, J., Humpf, H. U. Meat Authentication: A New HPLC-MS/MS Based Method for the Fast and Sensitive Detection of Horse and Pork in Highly Processed Food. J. Agric. Food Chem. 62, 9428-9435 (2014).
- von Bargen, C., Dojahn, J., Waidelich, D., Humpf, H. U., Brockmeyer, J. New Sensitive High-Performance Liquid Chromatography Tandem Mass Spectrometry Method for the Detection of Horse and Pork in Halal Beef. J. Agric. Food Chem. 61, 11986-11994 (2013).
- Montowska, M., Alexander, M. R., Tucker, G. A., Barrett, D. A. Authentication of processed meat products by peptidomic analysis using rapid ambient mass spectrometry. Food Chem. 187, 297-304 (2015).
- Montowska, M., Alexander, M. R., Tucker, G. A., Barrett, D. A. Rapid detection of Peptide markers for authentication purposes in raw and cooked meat using ambient liquid extraction surface analysis mass spectrometry. Anal. Chem. 86, 10257-10265 (2014).
- Sentandreu, M. A., Fraser, P. D., Halket, J., Patel, R., Bramley, P. M. A Proteomic-Based Approach for Detection of Chicken in Meat Mixes. J. Proteome Res. 9, 3374-3383 (2010).
- Elliott, M. H., Smith, D. S., Parker, C. E., Borchers, C. Current trends in quantitative proteomics. J. Mass Spectrom. 44, 1637-1660 (2009).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26, 966-968 (2010).
- Keeton, J. T., Ellerbeck, S. M., Nunez de Gonzalez, M. T., Devine, C., Dikeman, M. . Encyclopedia of Meat Sciences. 1, 235-243 (2014).
- Montowska, M., Alexander, M. R., Tucker, G. A., Barrett, D. A. Rapid Detection of Peptide Markers for Authentication Purposes in Raw and Cooked Meat Using Ambient Liquid Extraction Surface Analysis Mass Spectrometry. Anal. Chem. 86, 10257-10265 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır