Method Article
Usando respuesta evocada-Touch y la locomoción ensayos para evaluar el rendimiento muscular y la función en el pez cebra
* Estos autores han contribuido por igual
En este artículo
Resumen
Zebrafish are an excellent model to study muscle function and disease. During early embryogenesis zebrafish begin regular muscle contractions producing rhythmic swimming behavior, which is altered when the muscle is disrupted. Here we describe a touch-evoked response and locomotion assay to examine swimming performance as a measure of muscle function.
Resumen
el desarrollo muscular de pez cebra está altamente conservada con sistemas de mamíferos que los hacen un modelo excelente para estudiar la función muscular y la enfermedad. Muchos miopatías que afectan a la función del músculo esquelético se pueden evaluar de forma rápida y fácilmente en el pez cebra en los primeros días de la embriogénesis. Por 24 horas después de la fecundación (HPF), el pez cebra de tipo salvaje contraiga espontáneamente sus músculos de la cola y por 48 HPF, pez cebra controlada exhiben comportamientos de natación. La reducción de la frecuencia de, u otras alteraciones en, estos movimientos pueden indicar una disfunción del músculo esquelético. Para analizar el comportamiento de la natación y evaluar el rendimiento muscular en el desarrollo del pez cebra temprana, utilizamos ambos ensayos de respuesta y la locomoción de escape al tacto evocado.
ensayos de respuesta de escape al tacto evocados se pueden utilizar para evaluar el rendimiento muscular en el movimiento de ráfagas cortas resultantes de la contracción de las fibras musculares de contracción rápida. En respuesta a un estímulo externo, que en este caso es un golpecito enla cabeza, el pez cebra de tipo salvaje a los 2 días después de la fertilización (DPF) muestran típicamente una potente ráfaga de natación, acompañado por las curvas cerradas. Nuestro método cuantifica la función del músculo esquelético mediante la medición de la aceleración máxima durante un movimiento de natación de ráfaga, la aceleración es directamente proporcional a la fuerza producida por la contracción muscular.
En contraste, los ensayos de locomoción durante el desarrollo larvario de pez cebra temprano se utilizan para evaluar el rendimiento muscular durante períodos sostenidos de la actividad muscular. El uso de un sistema de seguimiento para supervisar el comportamiento de natación, se obtiene un cálculo automático de la frecuencia de la actividad y la distancia en 6 días de edad pez cebra, un reflejo de su función del músculo esquelético. Las mediciones de rendimiento de natación son valiosos para la evaluación fenotípica de modelos de enfermedad y cribado de alto rendimiento de mutaciones o tratamientos químicos que afectan la función del músculo esquelético.
Introducción
Durante la última década de pez cebra se han utilizado cada vez más para estudiar la biología de las células musculares y las enfermedades. El desarrollo externo rápido del embrión de pez cebra, junto con su claridad óptica, permite la visualización directa de la formación de músculo, el crecimiento, y la función. El proceso de desarrollo muscular está altamente conservada en el pez cebra y esto ha permitido el modelado con éxito de una serie de enfermedades musculares incluyendo las distrofias musculares y miopatías congénitas 1-8. Información detallada de los modelos de pez cebra no sólo ha proporcionado nuevos conocimientos sobre la biopatología de estas condiciones sino que también proporcionó una plataforma para el ensayo de terapias adecuadas 6,9-13.
El análisis de los modelos de pez cebra de enfermedades musculares se basa en ensayos fiables y reproducibles para medir el rendimiento muscular. Estudios previos han medido correctamente la capacidad de generación de fuerza del músculo del tronco del pez cebra en el pescado entre 3 y 7 dpf porla estimulación eléctrica de la contracción de un pez inmovilizado unido a un sistema de fuerzas de transducción 14. Esto puede proporcionar mediciones detalladas de la fuerza pero no se adaptan perfectamente a los experimentos de mayor rendimiento y hay ventajas para medir el rendimiento muscular durante la natación. A las 2 dpf músculo del pez cebra es totalmente funcional y los peces pueden provocar movimientos de natación de ráfaga en respuesta a los estímulos. El ensayo de respuesta de escape touch-evocar se utiliza para medir la aceleración durante un movimiento de natación de ráfaga, que puede ser utilizado como una medida de la fuerza contráctil.
Una de las medidas más utilizadas de la función muscular en pacientes con miopatía es la prueba de marcha de 6 min, que registra la distancia total recorrida en una superficie plana y dura 15,16. Hemos aplicado una prueba comparable para medir la función muscular en 6 dpf larvas de pez cebra, por lo que controlamos la distancia total nadado, y el número total de movimientos realizados por cada larva en un período de 10 min. Esto se realizautilizando un sistema de seguimiento automatizado, que proporciona mediciones fiables y de alto rendimiento de rendimiento muscular. Ambas pruebas musculares son altamente reproducibles y se han utilizado para cuantificar las diferencias en el rendimiento muscular en modelos miopatía de pez cebra 8.
Protocolo
1. Ensayo de respuesta al tacto evocados
- Preparación de 2 dpf embriones para Ensayo de respuesta al tacto evocados
- Asegúrese de que la hora del día en que se realiza la prueba es consistente entre los experimentos porque la actividad puede variar drásticamente durante todo el día 17,18.
NOTA: El experimento debe realizarse cegado y el orden de los ensayos aleatorizados para minimizar los artefactos experimentales. - Asignar los peces cepas de un número, que es desconocido para el individuo que lleva a cabo el experimento. Después de esto, el uso de herramientas en línea disponibles libremente generan una lista aleatoria que dicta el orden de las pruebas.
- Al menos una hora antes de la prueba, los embriones dechorionate por la rasgadura de un agujero en el corion y tirando suavemente el corion aparte usando un par de pinzas finas. Eliminar los residuos de la placa de Petri antes de regresar a los 28 ° C incubadora.
- Asegúrese de que la hora del día en que se realiza la prueba es consistente entre los experimentos porque la actividad puede variar drásticamente durante todo el día 17,18.
- Realizar un ensayo de respuesta al tacto evocados
- sta calorge a 28 ° C al menos 15 min antes de iniciar la prueba.
NOTA: Esta etapa se controla temperatura y se mantendrá en 28 ° C durante la duración de la prueba. La temperatura afectará la actividad y por lo tanto es importante mantener una temperatura constante. Si se calienta una etapa no está disponible, la temperatura del agua debe ser monitoreada y todos los experimentos debe llevarse a cabo a la misma temperatura. - Colocar una placa de Petri llena de medio de embrión (NaCl 5 mM, 0,17 mm de KCl, 0,33 mM CaCl 2, 0,33 mM MgSO 4 en agua) en una etapa de iluminación y montar la cámara de alta velocidad a través de la placa de Petri.
- Poner en marcha el software de grabación de la cámara de vídeo (como corriente Pix 5, descrito aquí) y en la pestaña "espacio de trabajo" seleccione 1.000 cuadros por segundo (fps 1000) como la velocidad de captura para asegurar que la acción natación rápida de los peces se registra.
- Trabajar con un embrión a la vez, colocar el embrión en el middle de la placa de Petri con el pez cebra claramente visible en el campo de visión.
NOTA: Si el embrión se aleja nadando antes del comienzo del experimento sustituirla por otro, como volver a capturar y posicionamiento del embrión puede dar lugar a que se convierta en insensible a los estímulos y respuestas de ráfaga reiterados puede promover la debilidad muscular en algunos modelos de enfermedad. - Iniciar la grabación haciendo clic en el botón "Grabar" y, a generar el estímulo mecanosensorial al embrión tocando suavemente con una aguja roma en la parte superior de la cabeza.
- Detener la grabación después de que el embrión ha nadado fuera del campo de visión o devueltos al resto.
NOTA: Los picos de aceleración dentro de la primera 0,2 seg de la respuesta de escape estallar siguientes el estímulo mecánico. Por lo tanto, asegurarse de que al menos durante la primera 0,2 seg de la respuesta de escape grabando el pez está en el campo de visión. Usando el software que se describe en el paso 1.2.3, se guardará automáticamente los datoscomo un archivo de vídeo .avi. software de captura de vídeo y otros, como captura de vídeo gratuito o de Softonic, ambos de los cuales son de libre acceso para su descarga, también podría ser utilizado. - Devolver el embrión de una nueva placa de Petri y seleccione otro embrión para la prueba. Realizar pruebas en un mínimo de 15 peces.
- sta calorge a 28 ° C al menos 15 min antes de iniciar la prueba.
- La cuantificación de comportamiento natatorio
- Para cuantificar el comportamiento natatorio, iniciar el software y seleccione la opción "Individual larvas locomoción sin sustracción de fondo" del módulo para abrir el archivo de vídeo guardado .avi.
- Uso de la "mano alzada" o la herramienta "Polígono" de las áreas seleccionadas de la barra de menú de la película que se utilizó para el análisis. Asegúrese de que la región abarca tanto la posición original de los peces y el área que los peces nadan en. Asegúrese de que la sonda se excluye de la zona a analizar. El software automáticamente el seguimiento de la trayectoria de los peces dentro del área deseada.
- Para llevar a cabo tl análisis, haga clic en "experimento" de la barra de menú y seleccionar "ejecutar". Cuando se le solicite guardar el archivo de análisis de datos en bruto (.phr formato) en el lugar deseado. Una vez guardado, haga clic en "Inicio" para comenzar el análisis. Terminar el análisis haciendo clic en "parada" en el "experimento" del menú desplegable. Se mostrará una ventana con los resultados.
- Desplazarse a la derecha para obtener el valor "máxima aceleración". Si se desea, exportar estos datos mediante el cierre de la ventana de resultados y haciendo clic en el botón "Guardar los resultados instantáneos" en los "resultados" del menú desplegable. Seleccione el archivo en bruto apropiada análisis de datos y haga clic en abierto. Un archivo de texto que se puede abrir en un programa de hoja de cálculo se guarda en la carpeta de destino.
- Repita este procedimiento para cada pez y medio para obtener la aceleración máxima media para cada cepa individual (véase la Figura 1).
NOTA: Como alternativa a using el software descrito aquí, paquetes similares, tales como el software ImageJ libremente disponible se puede utilizar para extraer los datos de movimiento pertinentes. El plug-in 3D Particle Tracker puede ser utilizado para realizar un seguimiento de las trayectorias de natación.
2. Ensayo Locomotion - 10 min prueba de natación
- Preparación de 6 dpf Los embriones de Análisis de Natación
- Si es necesario, clasificar embriones para el genotipo requerido, por ejemplo mediante el examen de la expresión de una proteína fluorescente o por fenotipo, y colocar en una placa de Petri independiente (25-30 embriones por placa). Alternativamente, el genotipo puede ser determinada después de la finalización del ensayo de locomoción.
- A las 3 dpf, re-examinar placas de Petri y retire cualquier embrión no eclosionados y escombros. Volver placas de Petri a 28 ° C incubadora hasta 6 dpf.
- Probar el funcionamiento de todas las cepas de entre 9 am y 12 pm, que es el tiempo en el cual larvas de pez cebra son más activos. Aleatorizar el orden de los ensayos y la posición en el ptardía de tipo salvaje y mutante muestras para reducir al mínimo los efectos de las diferencias circadianos y otros sesgo experimental.
NOTA: Es importante que el tiempo de prueba es consistente entre los experimentos porque la actividad puede variar drásticamente durante todo el día. - Al menos 30 min antes de la prueba, el lugar larvas en una placa de 48 pocillos con una larva por pocillo. Después de la transferencia, llenar los pozos de manera que la superficie del agua es justo debajo de la parte superior del pozo, asegurándose de que no hay burbujas. Volver placas a 28 ° C incubadora.
- Tomar placas de la incubadora y aclimatarse a la luz durante cinco minutos antes de la prueba.
- Realización de ensayo de locomoción
- Coloque la placa de 48 pocillos en la cámara de grabación, que está equipado con una cámara digital de infrarrojos, la captura de hasta 60 cuadros / seg, por lo que las larvas se puede detectar en la oscuridad. Compruebe que todos los pozos se colocan dentro de la rejilla circular en el software de la locomoción y que todas las larvas son CLEArly detectable.
- Poner en marcha el software y seleccione el módulo de "seguimiento". En "archivo" haga clic en "generar un nuevo protocolo" y editar el número de pozos utilizados para el experimento. Establecer tanto la duración de la prueba y el periodo de integración de 10 minutos haciendo clic en los "parámetros" del menú desplegable y seleccionar los parámetros del protocolo "" y, posteriormente, en la pestaña "tiempo". En el mismo cuadro de diálogo "parámetros del protocolo" Haga clic en la pestaña "Opciones" y garantizar la casilla de verificación "Numeriscope" se hace clic después de lo cual, el cuadro de diálogo "parámetros de protocolo" se puede cerrar.
- Para establecer las áreas de grabación de relieve toda la red y haga doble clic en uno de los pozos. Haga clic en el botón "dibujar áreas" y dibujar alrededor de la parte superior izquierda, superior derecha, y los pozos inferiores izquierda y haga clic en "construcción", que permite que el software para determinar automáticamente la posición de cada pocillo. También dibujar en una escalabar y haga clic en "aplicar para grupos". Una vez completado, haga clic en el botón "dibujar áreas".
- determinar visualmente el umbral de detección deslizando la barra "umbral de detección" a un nivel en el que sólo los movimientos de los peces se ponen de relieve, sin señales de fondo.
NOTA: El umbral de detección variará entre las cepas y de este modo los umbrales tienen que ser determinado cada vez que se prueba una nueva cepa. En los datos representativos presentan un umbral de detección de 25 mm / seg se usó. - Antes de comenzar las pruebas de introducir umbrales de movimiento para la detección de inactividad, y los movimientos pequeños y grandes.
NOTA: En los datos representativos presentan un umbral de inactividad de 6 mm / seg y un umbral de actividad de ráfaga de 30 mm / seg se utilizó. Los umbrales de determinar el movimiento mínimo que se considera activo y el nivel requerido para ser considerado actividad ráfaga y permitir la clasificación de la actividad en pequeños (activo pero por debajo de activi ráfagaumbrales ty) y movimientos de gran tamaño (mayor que el umbral de actividad de la explosión). Los umbrales se pueden modificar dependiendo de la actividad de las cepas particulares de peces analizados.
NOTA: Aunque el ensayo se puede realizar en cualquiera de las condiciones de luz u oscuras, larvas de pez cebra se ha demostrado ser más activos en la oscuridad 18. - Ajuste la intensidad de la luz dentro de la cámara para estar en el 0% haciendo clic en el botón "Configuración de conducción de luz" en los "parámetros" del menú desplegable. En el cuadro de diálogo resultante, añadir los ajustes de luz requeridas.
NOTA: La intensidad de la luz dentro de la cámara puede ser activado para encender y apagar durante el tiempo de prueba para estimular la actividad de las larvas - Cierre la puerta de la cámara de grabación y empezar la grabación de vídeo.
- La cuantificación de comportamiento natatorio
- Después del experimento se ha completado, haga clic en "parada" en el "experimento" del menú desplegable. Un bo diálogose mostrará x con todos los resultados.
- Para tener acceso a estos resultados en Excel, haga clic en "Abrir la carpeta que contiene" y abrir el archivo de Excel que aparece en la carpeta resultante. Los parámetros importantes son "SMLCT" (pequeño recuento de movimiento) ", larct" (grande recuento de movimiento) ", smldist" (distancia total cubierta por el pescado en pequeños movimientos) y "lardist" (distancia total cubierta por el pescado en grandes movimientos ).
NOTA: Después de la grabación, el software también devuelve dos archivos de salida adicionales en la forma de un archivo .avi (que contiene un video de la grabación 10 min) y un archivo de imagen PNG (que contiene una representación visual de la locomoción durante el 10- experimento min; véase la Figura 2). - Una vez que se calculan los valores de locomoción, reproducir los archivos .avi y .png para revisar si los valores calculados con precisión locomoción representan los movimientos de natación de los peces (véase la figura3).
NOTA: Como una alternativa al uso del software se describe aquí, paquetes tales como el software ImageJ libremente disponibles pueden ser utilizados para rastrear el comportamiento locomotor.
Resultados
Provocado por el tacto ensayo de respuesta se puede utilizar para determinar la velocidad y la aceleración de los movimientos de natación que es una medida proporcional de la fuerza muscular. En respuesta a un estímulo mecánico, tal como un pequeño golpe en la cabeza 2 dpf tipo salvaje exhibición pez cebra una acción de natación rápida. Videos fueron capturados y analizados por dos diferentes modelos de pez cebra miopatía: Tg (ACTA1 D286G EGFP), un modelo de miopatía nemalínica que se ha demostrado que tienen debilidad muscular significativa, y un modelo de la distrofia muscular de Duchenne en los que se han descrito defectos musculares graves a 5 dpf 19,20. Las imágenes de un video de un toque típico evocados ensayo están representados en la figura 1A. Aceleración del pez cebra se examinó y se encontró que el pico dentro de la primera 0,2 seg de la respuesta de natación de ráfaga de escape (Figura 1B). Esta aceleración máxima del pico proporciona una medida que es proporcional a la fuerza generacióndelaire capacidad del músculo esquelético. Los valores máximos de aceleración se promediaron para obtener un valor medio máximo de aceleración (± error estándar de la media) para cada cepa: Tg (ACTA1 D286G EGFP): media = 276,0 ± 28,8 m / s 2, n = 3 experimentos replicados independientes que comprende 15 ejemplares; control de tipo salvaje: media = 500,8 ± 50,28 m / s 2, n = 3 experimentos replicados independientes que comprenden 15 ejemplares; DMD PC2 - / - mutante: media = 249,9 ± 19,1 m / s 2, n = 3 experimentos replicados independientes que comprenden 12-19 ejemplares; DMD pc2 +/- heterocigotos: media = 235,9 ± 8,7 m / s 2, n = 3 experimentos replicados independientes que comprenden 16-27 ejemplares; DMD homocigotos PC2 + / + de tipo salvaje: media = 230,9 ± 8,7 m / s 2, n = 3 experimentos replicados independientes que comprenden 8-27 peces individuales (Figura 1C). Como era de esperar, la Tg (D286 ACTA1Se encontró G-EGFP) pescado tener una disminución significativa en la aceleración máxima que indica la función muscular reducida, lo que es coherente con los modelos de ratón y datos del paciente 8,21,22. El pc2 DMD - / - peces mutantes sin embargo, no mostró diferencia en la máxima aceleración, en 2 dpf, consistente con la detección de defectos musculares de 3 dpf 20 (Figura 1D).
Los ensayos se realizaron a Locomotion 6 dpf para determinar la actividad y la distancia nadado por cepas de pez cebra como una indicación del rendimiento muscular. Después de las pruebas, se generó una representación esquemática de los movimientos de natación durante el período de prueba de diez minutos, con líneas rojas y verdes que representan períodos de movimiento lento y rápido, respectivamente, y las líneas negras que representan los periodos de inactividad (Figura 2). Persona de tipo salvaje pez cebra muestran una alta actividad con relativamente sin períodos de inactividad como Oposed a Tg (ACTA1 D286G EGFP) de pescado, que son menos activos en el período de prueba (Figura 2B).
El comportamiento de natación se cuantificó por el promedio de los valores individuales de la cantidad de movimientos y de la distancia nadada por cada pez (Figura 3). Ambos, Tg (ACTA1 D286G EGFP) peces (Figura 3A y 3B) y DMD PC2 - / - peces mutantes (Figura 3C y 3D) se encontró que tenían una disminución significativa en el número medio de movimientos y la distancia nadado en comparación con sus respectivos controles: Tg (ACTA1 D286G EGFP) peces: número medio de movimientos = 94,3 ± 13,6, distancia media nadado = 112,9 ± 18,4 mm, n = 3 experimentos replicados independientes que comprenden 45 peces; controles de tipo salvaje: El número medio de movimientos = 177,4 ± 14,0, significan distancia nadada = 300,2 ± 22,8 mm, n = 3 r independienteeplicate experimentos que comprenden 45 peces; DMD PC2 - / - mutantes: número medio de movimientos = 163,3 ± 30,0, distancia nadado significa: 298,4 ± 60,37 mm, n = 3 experimentos replicados independientes que comprenden 12-20 peces; DMD PC2 +/- heterocigotos: número medio de movimientos = 362,3 ± 38,8, media distancia nadada: 660,3 ± 86.1mm n = 3 experimentos replicados independientes que comprenden 17-27 peces; DMD homocigotos PC2 + / + de tipo salvaje: El número medio de movimientos = 341,9 ± 91,6, significan distancia nadada = 574,3 ± 170.9mm n = 3 experimentos replicados independientes que comprenden 8-25 peces.
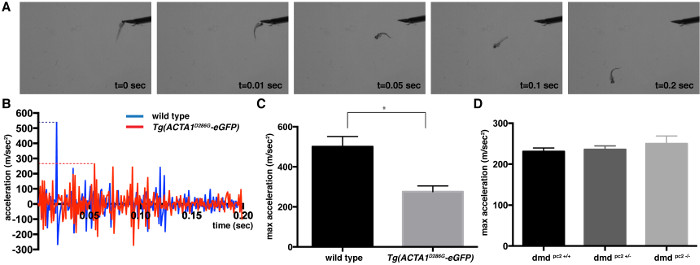
Figura 1:. La cuantificación de tacto evocan ensayo de respuesta de 2 dpf embriones de pez cebra imágenes (A) instantánea de un pez cebra de control durante al tacto evocar ensayos a las 2 dpf. (B) Perfil de aceleración por primera 0,2 seg de unasola Tg (ACTA1 D286G-EGFP) (rojo) y el pez cebra de control único (azul) después de la aplicación del estímulo táctil. La aceleración máxima está representada por las líneas de puntos. (C, D) La cuantificación de la aceleración máxima (m / seg 2) registrados a partir de ensayos de respuesta al tacto evocado de (C) Tg (ACTA1 D286G EGFP) y el pez cebra (D) pc2 DMD - / - peces mutantes en comparación con el control de pez cebra a las 2 dpf. Las barras de error representan ± SEM de 3 experimentos replicados, * p <0,05. Haga clic aquí para ver una versión más grande de esta figura.
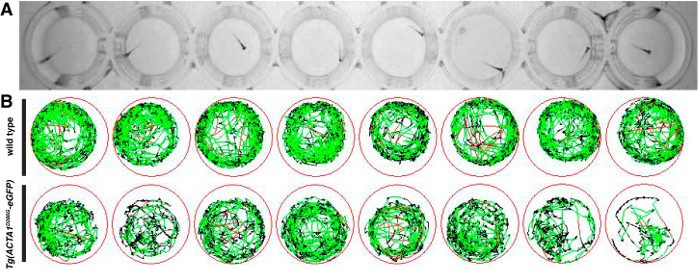
Figura 2:. Representación de los ensayos de locomoción para embriones de pez cebra (A) embriones de pez cebra se colocan en placas de 48 pocillos y la locomoción se registra desde arriba utilizando una cámara digital de infrarrojos. (B) Esquema del movimiento de pez cebra durante el período de pruebas con líneas rojas que representa los movimientos rápidos, líneas verdes representan los movimientos lentos y líneas negras representan la inactividad (según lo determinado por los umbrales de detección introducidas en el software). Haga clic aquí para ver una versión más grande de esta figura.
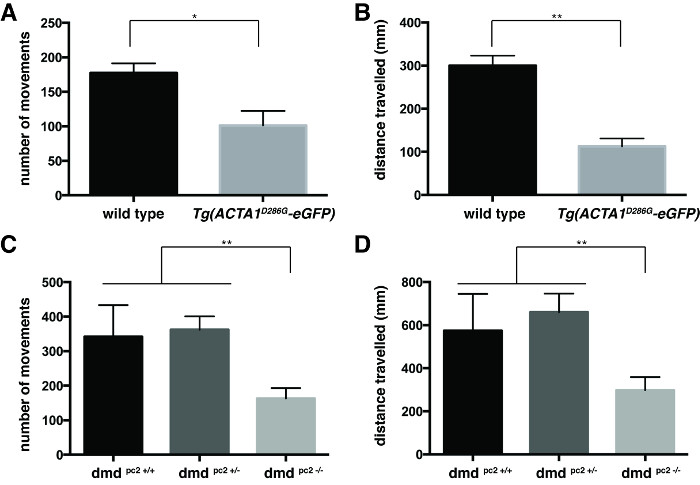
Figura 3:. La cuantificación de los ensayos de locomoción de 6 dpf larvas de pez cebra La cuantificación de la (A) número de movimientos y (B) la distancia recorrida por Tg pez cebra (ACTA1 D286G EGFP) en comparación con el control de pez cebra a las 6 dpf.La cuantificación de la cantidad (C) de los movimientos y (D) la distancia recorrida por el PC2 DMD - / - peces mutantes en comparación con el control de pez cebra a las 6 dpf. Las barras de error representan ± SEM de 3 experimentos replicados, * p <0,05, ** p <0,01. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Muchos diferentes modelos animales, incluyendo ratones, perros, peces cebra, moscas y gusanos han contribuido a nuestra comprensión de las bases genéticas y moleculares de las enfermedades musculares, y con la asistencia en el desarrollo de enfoques terapéuticos para combatirlas. El pez cebra cuenta con varias ventajas para el estudio de la enfermedad muscular. El pez cebra ofrece un sistema genéticamente manipulable para evaluar patrones músculo complejo en un entorno fisiológico adecuado, que no es posible en sistemas de cultivo in vitro. A diferencia de otros modelos animales vertebrados, la gran cantidad de peces producidos, junto con su claridad óptica, facilita la rápida y de alto rendimiento en la industria química y la detección genética in vivo.
A continuación se describe el desarrollo de ensayos de movimiento de pez cebra para proporcionar un alto rendimiento y un método automatizado para evaluar el rendimiento muscular durante la embriogénesis pez cebra. Para ambos ensayos, hay que reconocer que los ritmos circadianos yestímulos ambientales externos afectarán de manera significativa el comportamiento de natación pez cebra 17,18. Pruebas repetidas del mismo pez cebra también conducirá a la habituación causando una disminución en respuesta a la táctil estímulo 23. Por lo tanto, con el fin de obtener resultados reproducibles entre los experimentos cada embrión de pez cebra sólo debe ser probado una vez, el tiempo de las condiciones de iluminación de día y debe ser estandarizado, y la temperatura del agua debe ser estrictamente regulado.
Utilizando el análisis provocado por el tacto en 2 dpf podemos medir directamente la aceleración máxima de una acción de natación de ráfaga, que es proporcional a la fuerza muscular. Las técnicas anteriores en el pez cebra han examinado la fuerza muscular mediante la vinculación de los dos extremos de los embriones a equipo experimental después de lo cual la contracción del músculo es estimulado usando un campo eléctrico y la capacidad de generación de fuerza del músculo 14 se mide. Si bien este método mide la fuerza de la capacidad de generación de tél muscular larval, que no mide la fuerza real generada por el músculo larval durante la natación. Por lo tanto, hemos desarrollado un método para evaluar indirectamente la fuerza generada durante el movimiento normal de la natación de las larvas para proporcionar una medida general de la salud del músculo. El sistema de vídeo de alta velocidad, capaz de registrar los movimientos de pez cebra individuales a una velocidad de 1.000 cuadros / seg se puede utilizar para identificar pequeñas pero significativas diferencias en la función muscular, que no son directamente distinguibles a simple vista. Será interesante ver cómo se informó anteriormente los cambios en la fuerza estimulado eléctricamente generación se correlacionan con los cambios en el rendimiento de natación.
Además, el provocado por el tacto ensayos de respuesta también se pueden utilizar para evaluar la cinemática de natación, tales como la forma y la velocidad de la onda del cuerpo durante el movimiento de natación 24, para dar una medición cuantitativa del comportamiento locomotor.
Debido al movimiento espontáneo de zebrafish larvas después de 3 dpf, no fuimos capaces de realizar los ensayos de evocar al tacto para medir la función muscular. A la inversa, que mide el rendimiento muscular durante un período más largo mediante la determinación de la distancia nadada por las larvas de pez cebra a las 6 dpf. Esta prueba, a pesar de una medida indirecta de la función muscular, se puede utilizar para identificar peces presentan deterioro de rendimiento muscular 8 o la neurodegeneración 25,26. Esta prueba no sólo proporciona una medida análoga a la prueba de marcha de 6 minutos, pero también es adecuado para automatizada de alto rendimiento en las pantallas de drogas o de mutagénesis in vivo.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank Viewpoint for their kind sponsorship of this manuscript. This work was funded by an Australian National Health and Medical Research Council (NHMRC) Project Grant (APP1010110).
Materiales
| Name | Company | Catalog Number | Comments |
| 21 G x 1' Blunt Needle | Terumo/Admiral Medical Supplies | TE2125 | |
| 48-well plates | Sigma | M8937 | |
| 90 mm Petri Dishes | Pacific Laboratory Products PT | S90001 | |
| High Speed Camera | Baumer | HXC20 | |
| http://www.randomization.com | N/A | Steps 1.1.2, 2.1.3 | |
| Incubator | Thermoline Scientific | TEI-43L | |
| Plastic Pipette | VWR | 16001-188 | |
| StreamPix5 | NorPix | Step 1.2.3 | |
| Temperature Control Unit | Viewpoint | ||
| Tweezers, style 8 | ProSciTech | T04-821 | |
| Zebrabox System | Viewpoint | ||
| Zebralab | Viewpoint | Steps 1.3.1, 2.2.1 |
Referencias
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Gupta, V. A., Kawahara, G., et al. A splice site mutation in laminin-α2 results in a severe muscular dystrophy and growth abnormalities in zebrafish. PLoS ONE. 7 (8), e43794 (2012).
- Gupta, V., Kawahara, G., et al. The zebrafish dag1 mutant: a novel genetic model for dystroglycanopathies. Hum Mol Genet. 20 (9), 1712-1725 (2011).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. Proc Natl Acad Sci. 108 (13), 5331-5336 (2011).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model & Mech. 5 (3), 389-396 (2012).
- Ruparelia, A. A., Oorschot, V., Vaz, R., Ramm, G., Bryson-Richardson, R. J. Zebrafish models of BAG3 myofibrillar myopathy suggest a toxic gain of function leading to BAG3 insufficiency. Acta Neuropathol. 128 (6), 821-833 (2014).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum Mol Genet. 21 (21), 4718-4731 (2012).
- Sztal, T. E., Zhao, M., et al. Zebrafish models for nemaline myopathy reveal a spectrum of nemaline bodies contributing to reduced muscle function. Acta Neuropathol. 130 (3), 389-406 (2015).
- Pichler, F. B., Laurenson, S., Williams, L. C., Dodd, A., Copp, B. R., Love, D. R. Chemical discovery and global gene expression analysis in zebrafish. Nat Biotechnol. 21 (8), 879-883 (2003).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nat Biotechnol. 22 (5), 595-599 (2004).
- Kawahara, G., Serafini, P. R., Myers, J. A., Alexander, M. S., Kunkel, L. M. Characterization of zebrafish dysferlin by morpholino knockdown. Biochem Bioph Res Co. 413 (2), 358-363 (2011).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. , (2005).
- Smith, L. L., Beggs, A. H., Gupta, V. A. Analysis of skeletal muscle defects in larval zebrafish by birefringence and touch-evoke escape response assays. J Vis Exp. (82), e50925 (2013).
- Sloboda, D. D., Claflin, D. R., Dowling, J. J., Brooks, S. V. Force measurement during contraction to assess muscle function in zebrafish larvae. J Vis Exp. (77), (2013).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test as a new outcome measure in Duchenne muscular dystrophy. Muscle Nerve. 41 (4), 500-510 (2010).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test and other clinical endpoints in duchenne muscular dystrophy: reliability, concurrent validity, and minimal clinically important differences from a multicenter study. Muscle Nerve. 48 (3), 357-368 (2013).
- Hurd, M. W., Debruyne, J., Straume, M., Cahill, G. M. Circadian rhythms of locomotor activity in zebrafish. Physiol Behav. 65 (3), 465-472 (1998).
- MacPhail, R. C., Brooks, J., Hunter, D. L., Padnos, B., Irons, T. D., Padilla, S. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol. Neurotoxicology. 30 (1), 52-58 (2009).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J Cell Mol Med. 15 (12), 2643-2651 (2011).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Bioph Res Co. 423 (4), 785-788 (2012).
- Ravenscroft, G., Jackaman, C., et al. Mouse models of dominant ACTA1 disease recapitulate human disease and provide insight into therapies. Brain. 134 (4), 1101-1115 (2011).
- Ravenscroft, G., Wilmshurst, J. M., et al. A novel ACTA1 mutation resulting in a severe congenital myopathy with nemaline bodies, intranuclear rods and type I fibre predominance. Neuromuscular Disord. 21 (1), 31-36 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci. 108 (37), 15468-15473 (2011).
- Müller, U. K., van Leeuwen, J. L. Swimming of larval zebrafish: ontogeny of body waves and implications for locomotory development. J Exp Biol. 207 (Pt 5), 853-868 (2004).
- Cheng, W., Tian, J., Burgunder, J. M., Hunziker, W., Eng, H. L. Myotonia congenita-associated mutations in chloride channel-1 affect zebrafish body wave swimming kinematics. PLoS ONE. 9 (8), e103445 (2014).
- Moggio, M., Colombo, I., et al. Mitochondrial disease heterogeneity: a prognostic challenge. Acta Myol. 33 (2), 86-93 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados