Method Article
Utilisation de la réponse tactile évoqué et Locomotion essais pour évaluer la performance de la fonction musculaire et en Zebrafish
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Zebrafish are an excellent model to study muscle function and disease. During early embryogenesis zebrafish begin regular muscle contractions producing rhythmic swimming behavior, which is altered when the muscle is disrupted. Here we describe a touch-evoked response and locomotion assay to examine swimming performance as a measure of muscle function.
Résumé
développement musculaire Zebrafish est hautement conservée avec les systèmes de mammifères qui les rend un excellent modèle pour étudier la fonction musculaire et de la maladie. Beaucoup de myopathies affectant la fonction des muscles squelettiques peuvent être rapidement et facilement évalués dans zebrafish au cours des premiers jours de l'embryogenèse. En 24 heures après la fécondation (HPF), de type sauvage zebrafish contracter spontanément leurs muscles de la queue et de 48 HPF, exposition contrôlée comportements de natation de poisson zèbre. Réduction de la fréquence, ou d'autres altérations, ces mouvements peuvent indiquer un dysfonctionnement du muscle squelettique. Pour analyser le comportement de natation et d'évaluer la performance musculaire dans le développement zebrafish tôt, nous utilisons les deux essais d'intervention et de locomotion échappement tactiles évoqués.
des essais de réponse échappement tactiles évoqués peuvent être utilisés pour évaluer la performance musculaire lors de courts mouvements d'éclatement résultant de la contraction des fibres musculaires à contraction rapide. En réponse à un stimulus externe, qui dans ce cas est un robinetla tête, de type sauvage zebrafish à 2 jours après la fécondation (dpf) présentent généralement un bain d'éclatement puissant, accompagné par des virages serrés. Notre procédé quantifie la fonction du muscle squelettique par la mesure de l'accélération maximale lors d'un mouvement de nage en rafale, l'accélération étant directement proportionnelle à la force produite par la contraction musculaire.
En revanche, les essais de locomotion au cours du développement larvaire zebrafish précoce sont utilisés pour évaluer la performance musculaire pendant les périodes prolongées de l'activité musculaire. En utilisant un système de suivi pour surveiller le comportement de nage, on obtient un calcul automatique de la fréquence de l'activité et la distance en six jours vieux poisson zèbre, le reflet de leur fonction musculaire squelettique. Les mesures de la performance de nage sont utiles pour l'évaluation phénotypique des modèles de maladies et de criblage à haut débit de mutations ou de traitements chimiques qui affectent la fonction du muscle squelettique.
Introduction
Au cours de la dernière décennie zebrafish ont été de plus en plus utilisée pour étudier les muscles de la biologie cellulaire et de la maladie. Le développement rapide externe de l'embryon de poisson zèbre, couplé à sa clarté optique, permet la visualisation directe de la formation des muscles, la croissance et la fonction. Le processus de développement musculaire est fortement conservée chez le poisson zèbre et cela a permis à la modélisation réussie d'une série de maladies musculaires , y compris les dystrophies musculaires et myopathies congénitales 1-8. L' examen détaillé des modèles de poisson zèbre a non seulement fourni des informations nouvelles dans la physiopathologie de ces conditions , mais aussi fourni une plate - forme pour les essais de thérapies appropriées 6,9-13.
L'analyse des modèles de maladies de poisson zèbre musculaires repose sur des analyses fiables et reproductibles pour mesurer la performance musculaire. Des études antérieures ont réussi à mesurer la capacité de génération de force du muscle du tronc zebrafish dans le poisson entre 3 et 7 DPF parstimuler électriquement la contraction d'un poisson immobilisé relié à un système force de transduction 14. Cela peut fournir des mesures détaillées de la force, mais ne sont pas parfaitement adapté à des expériences de débit plus élevé et il y a des avantages à la mesure de la performance musculaire au cours de natation. A 2 dpf musculaire zebrafish est entièrement fonctionnel et les poissons peuvent provoquer des mouvements de natation de rafale en réponse à des stimuli. Le dosage de la réponse tactile échappement évoquer est utilisé pour mesurer l'accélération lors d'un mouvement de nage en rafale, qui peut être utilisé comme une mesure de la force contractile.
L' une des mesures les plus utilisées de la fonction musculaire chez les patients atteints de myopathie est le test de marche de 6 minutes, qui enregistre la distance totale parcourue sur une surface plane et dure 15,16. Nous avons appliqué un test comparable pour mesurer la fonction musculaire dans 6 dpf larves de poisson zèbre, par lequel nous surveillons la distance totale nagé, et le nombre total de mouvements effectués par chaque larve sur une période de 10 min. Cette opération est effectuéeen utilisant un système de suivi automatisé, qui fournit des mesures fiables et à haut débit de la performance musculaire. Les deux essais musculaires sont hautement reproductibles et ont été utilisés pour quantifier les différences dans la performance musculaire dans les modèles 8 myopathie de poisson zèbre.
Protocole
1. Réponse Assay tactile évoquée
- Préparation de 2 dpf Embryons Response Assay tactile évoquée
- Assurez -vous que l'heure de la journée à laquelle le test est effectué est compatible entre les expériences parce que l' activité peut varier considérablement tout au long de la journée 17,18.
NOTE: L'expérience doit être effectuée en aveugle et l'ordre des essais randomisés pour réduire au minimum les artefacts expérimentaux. - Attribuer les poissons souches un nombre qui est inconnu à l'individu de réaliser l'expérience. Suite à cela, en utilisant des outils en ligne disponibles gratuitement génèrent une liste aléatoire qui dicte l'ordre des tests.
- Au moins une heure avant le test, les embryons dechorionate par l'extraction d'un trou dans le chorion et en tirant doucement le chorion en dehors en utilisant une paire de pinces fines. Retirer tous les débris de la boîte de Pétri avant de revenir à 28 ° C incubateur.
- Assurez -vous que l'heure de la journée à laquelle le test est effectué est compatible entre les expériences parce que l' activité peut varier considérablement tout au long de la journée 17,18.
- Exécution Réponse Assay tactile évoquée
- sta thermiquege à 28 ° C d'au moins 15 minutes avant le début du test.
REMARQUE: Cette étape est la température contrôlée et restera à 28 ° C pendant toute la durée du test. La température affectera l'activité et il est donc important de maintenir une température constante. Si une étape chauffée est pas disponible, la température de l'eau doit être surveillée et toutes les expériences devraient être menées à la même température. - Placez une boîte de Pétri remplie de milieu d'embryon (5 mM de NaCl, 0.17mm KCl, 0,33 mM de CaCl2, 0,33 mM MgSO 4 dans l' eau) sur une scène illuminée et monter la caméra à haute vitesse sur la boîte de Pétri.
- Lancez le logiciel d'enregistrement de vidéo caméra (comme flux Pix 5, décrit ici) et sous l'onglet "espace de travail", sélectionnez 1000 images par seconde (1000 fps) que la vitesse de capture pour veiller à ce que l'action de nage rapide du poisson est enregistré.
- Travailler avec un embryon à la fois, placer l'embryon dans le MIDDLe de la boîte de Pétri avec le poisson zèbre clairement visible dans le champ de vision.
NOTE: Si l'embryon nage loin avant le début de l'expérience remplacer par un autre, comme recapturer et le positionnement de l'embryon peut entraîner il devenir désensibilisé au stimulus et les réponses répétées en rafale peut favoriser une faiblesse musculaire dans certains modèles de maladies. - Commencez l'enregistrement en cliquant sur le bouton "enregistrement" et, fournir le stimulus mécanosensorielle à l'embryon en le touchant doucement avec une aiguille émoussée sur le dessus de la tête.
- Arrêtez l'enregistrement après l'embryon a nagé hors du champ de vue ou retourné au repos.
REMARQUE: Les pics d'accélération dans les 0,2 premières secondes de la réaction d'échappement suivant la salve de stimulation mécanique. Par conséquent, veiller à ce qu'au moins pendant la première 0,2 sec de la réponse d'échappement enregistre le poisson est dans le champ de vision. En utilisant le logiciel décrit dans l'étape 1.2.3, les données seront automatiquement sauvegardéescomme un fichier vidéo .avi. logiciel de capture vidéo Alternative tels que Capture ou Softonic Free Video, qui sont tous deux librement disponible pour le téléchargement, pourrait également être utilisé. - Retour l'embryon à une nouvelle boîte de Pétri et sélectionnez un autre embryon pour les tests. Effectuer des tests sur un minimum de 15 poissons.
- sta thermiquege à 28 ° C d'au moins 15 minutes avant le début du test.
- Quantification de Natation Comportement
- Pour quantifier le comportement de natation, lancer le logiciel et sélectionnez le "Single Larves Locomotion sans soustraction de fond" module pour ouvrir le fichier vidéo enregistré .avi.
- Utilisation de la "main levée" ou "polygone" outil de la barre de menu des zones de sélection du film à utiliser pour l'analyse. Assurez-vous que la région englobe à la fois la position d'origine du poisson et de la région que les poissons nagent dans. Assurez-vous que la sonde est exclu de la zone à analyser. Le logiciel va automatiquement suivre la trajectoire du poisson dans la zone souhaitée.
- Pour effectuer til analyse, cliquez sur «expérience» dans la barre de menu et sélectionnez "exécuter". Lorsque vous êtes invité enregistrer le fichier d'analyse des données brutes (.phr format) à l'endroit désiré. Une fois enregistré, cliquez sur "start" pour commencer l'analyse. Mettre fin à l'analyse en cliquant sur "stop" dans le cadre du «expérience» dans le menu déroulant. Une fenêtre contenant les résultats sera affichée.
- Faites défiler vers la droite pour obtenir la valeur "accélération maximale". Si vous le souhaitez, exporter ces données en fermant la fenêtre de résultats et en cliquant sur le bouton "à l'exportation des résultats instantanés" dans les "résultats" dans le menu déroulant. Sélectionnez le fichier d'analyse des données brutes appropriées et cliquez sur Ouvrir. Un fichier texte qui peut être ouvert dans un programme de feuille de calcul sera enregistré dans le dossier de destination.
- Répétez ce processus pour chaque poisson individuel et moyen d'obtenir l'accélération maximale moyenne pour chaque souche (voir Figure 1).
NOTE: Comme alternative à using le logiciel décrit ici, les emballages similaires, tels que le logiciel ImageJ librement disponible peut être utilisée pour extraire les données de déplacement correspondantes. Le plugin 3D Particle Tracker peut être utilisé pour suivre les trajectoires de natation.
2. Locomotion Assay - 10 min Test de natation
- Préparation de 6 dpf Embryons Analyse Piscine
- Si nécessaire, trier les embryons pour le génotype requis, par exemple en examinant l'expression d'une protéine fluorescente ou par le phénotype, et le placer dans une boîte de Pétri séparé (25-30 embryons par boîte). En variante, le génotype peut être déterminé après l'achèvement du test de locomotion.
- A 3 dpf, re-examiner les boîtes de Pétri et supprimer tous les embryons non éclos et les débris. Retour des boîtes de Pétri à 28 ° C incubateur jusqu'à 6 dpf.
- Effectuer des tests de toutes les souches de 9 h et 12 h, ce qui est le moment où les larves de poisson zèbre sont les plus actifs. Randomize l'ordre de test et la position dans la pfin de type sauvage et des échantillons mutants afin de minimiser les effets des différences circadiens et autres biais expérimental.
Remarque: il est important que le temps de test est cohérent entre les expériences, car l'activité peut varier considérablement tout au long de la journée. - Au moins 30 minutes avant le test, le lieu des larves dans une plaque de 48 puits avec une larve par puits. Après le transfert, remplir les puits de sorte que la surface de l'eau est juste en dessous du haut du puits, assurant qu'il n'y a pas de bulles. plaques Retour à 28 ° C incubateur.
- Prendre des plaques de l'incubateur et s'acclimater à la lumière pendant cinq minutes avant le test.
- Exécution Locomotion Assay
- Placer la plaque à 48 puits dans la chambre d'enregistrement, qui est équipé d'une caméra infrarouge numérique, la capture jusqu'à 60 images / seconde, de sorte que les larves peuvent être détectés dans l'obscurité. Vérifiez que tous les puits sont placés à l'intérieur de la grille circulaire sur le logiciel de locomotion et que toutes les larves sont clearly détectable.
- Lancez le logiciel et sélectionnez le module "suivi". Sous "fichier", cliquez sur "générer nouveau protocole" et modifier le nombre de puits utilisés pour l'expérience. Réglez à la fois la durée de l'expérience et de la période d'intégration à 10 min en cliquant sur "Paramètres" dans le menu déroulant et en sélectionnant les "paramètres du protocole" et l'onglet ultérieurement "temps". Sur la même boîte de dialogue "Paramètres de protocole" cliquez sur l'onglet "Options" et assurez-vous la case à cocher "Numeriscope" est cliqué après quoi, la boîte de dialogue "Paramètres de protocole" peut être fermé.
- Pour définir les zones d'enregistrement mettent en évidence l'ensemble du réseau et double cliquez sur l'un des puits. Cliquez sur le bouton "dessiner des zones" et d'en tirer autour du puits en bas à gauche en haut à gauche, en haut à droite, et puis cliquez sur "build", qui permet au logiciel de déterminer automatiquement la position de chaque puits. dessiner également dans une échellebar et cliquez sur "appliquer au groupe". Une fois terminé, cliquez sur le bouton "dessiner les zones".
- Déterminer visuellement le seuil de détection en faisant glisser la barre "seuil de détection" à un niveau auquel seuls les mouvements des poissons sont mis en évidence aucun signal de fond.
REMARQUE: Le seuil de détection varie entre les souches et ainsi les seuils doivent être déterminés à chaque fois qu'une nouvelle souche est testée. Dans les données représentatives présentent un seuil de détection de 25 mm / s est utilisé. - Avant de commencer le test entre les seuils de mouvement pour la détection de l'inactivité, et les petits et les grands mouvements.
NOTE: Dans les données représentatives ont présenté un seuil d'inactivité de 6 mm / sec et un seuil rafale d'activité de 30 mm / sec a été utilisé. Les seuils déterminent le mouvement minimum pour être considéré comme actif et le niveau requis pour être considéré comme une activité d'éclatement et de permettre la classification de l'activité dans un petit (actif mais au-dessous activi burstseuils ty) et les grandes (supérieures au seuil d'activité de salve mouvements). Les seuils peuvent être modifiés en fonction de l'activité des souches particulières de poissons analysés.
NOTE: Bien que le dosage peut être effectué soit dans des conditions claires ou foncées, larves de poisson zèbre ont été montré pour être plus actif dans l'obscurité 18. - Réglez l'intensité de la lumière dans la chambre pour être à 0% en cliquant sur le bouton "Paramètres de conduite de lumière" dans les "paramètres" dans le menu déroulant. Dans la boîte de dialogue résultante, ajouter les paramètres d'éclairage requis.
NOTE: L'intensité lumineuse à l'intérieur de la chambre peut être déclenché pour activer et désactiver pendant le temps d'essai pour stimuler l'activité larvaire - Fermez la porte de la chambre d'enregistrement et commencer l'enregistrement vidéo.
- Quantification de Natation Comportement
- Après l'expérience est terminée, cliquez sur "stop" dans le cadre du «expérience» dans le menu déroulant. Un bo dialoguex avec tous les résultats seront affichés.
- Pour accéder à ces résultats dans Excel, cliquez sur "ouvrir le dossier contenant" et ouvrez le fichier Excel qui apparaît dans le dossier résultant. Les paramètres importants sont "smlct" (petit nombre de mouvements), "larct" (grand nombre de mouvements), "smldist" (distance totale parcourue par le poisson dans de petits mouvements) et "lardist" (distance totale parcourue par les poissons dans de grands mouvements ).
NOTE: Après l'enregistrement, le logiciel renvoie également deux fichiers de sortie supplémentaires sous la forme d'un fichier .avi (contenant une vidéo de l'enregistrement de 10 min) et un fichier d'image .png (contenant une représentation visuelle de la locomotion au cours de la 10 expérience min; voir la figure 2). - Une fois que les valeurs de locomotion sont calculés, relire les fichiers .avi et .png pour examiner si les valeurs de locomotion calculées avec précision représentent les mouvements de nage des poissons (voir Figure3).
NOTE: Comme une alternative à l'utilisation du logiciel décrit ici, les paquets tels que le logiciel ImageJ disponible gratuitement peuvent être utilisés pour suivre le comportement locomoteur.
Résultats
Contact évoqué test de réponse peut être utilisée pour déterminer la vitesse et l'accélération des mouvements de natation qui est une mesure proportionnelle à la force musculaire. En réponse à un stimulus mécanique, comme une petite tape sur la tête 2 dpf type sauvage exposition zebrafish une action de nage rapide. Des vidéos ont été capturés et analysés pour deux modèles différents de poisson zèbre de Myopathie: Tg (ACTA1 D286G -eGFP), un modèle de némaline Myopathie qui a été montré pour avoir significative faiblesse musculaire, et un modèle de dystrophie musculaire de Duchenne , dans lequel de graves anomalies musculaires ont été décrits à 5 dpf 19,20. Images d'une vidéo d'une touche typique évoqués test sont représentés sur la figure 1A. Accélération du poisson zèbre a été examiné et jugé dans le pic de 0,2 premières secondes de la réponse piscine d'éclatement d'échappement (figure 1B). Cette accélération maximale de pointe fournit une mesure qui est proportionnelle à la force generating capacité du muscle squelettique. Les valeurs maximales d'accélération ont été moyennées pour obtenir une valeur moyenne maximale d'accélération (± erreur type de la moyenne) pour chaque souche: Tg (ACTA1 D286G -eGFP): moyenne = 276,0 ± 28,8 m / s 2, n = 3 expériences répétées indépendantes comprenant 15 individus; contrôle de type sauvage: moyenne = 500,8 ± 50,28 m / sec 2, n = 3 expériences répétées indépendantes comprenant 15 individus; dmd pc2 - / - mutant: moyenne = 249,9 ± 19,1 m / s 2, n = 3 expériences répétées indépendantes comprenant 12-19 individus; dmd pc2 +/- hétérozygotes: moyenne = 235,9 ± 8,7 m / s 2, n = 3 expériences répétées indépendantes comprenant 16-27 poissons individuels; dmd pc2 + / +: homozygotes de type sauvage moyenne = 230,9 ± 8,7 m / s 2, n = 3 expériences répétées indépendantes comprenant 8-27 poissons individuels (figure 1C). Comme prévu, la Tg (D286 ACTA1G -eGFP) les poissons ont été trouvés à avoir une diminution significative de l' accélération maximale indiquant la fonction musculaire réduite, ce qui est compatible avec les modèles de souris et les données du patient 8,21,22. PC2 DMD - / - cependant, les poissons mutants n'a montré aucune différence dans l' accélération maximale à 2 dpf, conformément à la détection des défauts musculaires de 3 dpf 20 (figure 1D).
essais de Locomotion ont été réalisées à 6 dpf pour déterminer l'activité et de la distance à la nage par des souches de poisson zèbre comme une indication de la performance musculaire. Après les essais, une représentation schématique des mouvements de natation au cours de la période d'essai de dix minutes a été produite, avec des lignes rouges et vertes représentant des périodes de mouvement lent et rapide respectivement et des lignes noires représentant les périodes d'inactivité (Figure 2). show zebrafish forte activité de type sauvage individuel avec relativement peu de périodes d'inactivité que Opposed à Tg (ACTA1 D286G -eGFP) poissons, qui sont moins actifs au cours de la période d'essai (figure 2B).
Le comportement de nage a été quantifié en calculant la moyenne des valeurs individuelles du nombre de mouvements et la nage à distance par chaque poisson (figure 3). Les deux, Tg (ACTA1 D286G -eGFP) poissons (figure 3A et 3B) et dmd pc2 - / - poisson mutant (figure 3C et 3D) ont été trouvés à avoir une diminution significative du nombre moyen de mouvements et la distance nagées par rapport à leur respective contrôles: Tg (ACTA1 D286G -eGFP) poissons: nombre moyen de mouvements = 94,3 ± 13,6, moyenne nagé à distance = 112,9 ± 18,4 mm, n = 3 expériences répétées indépendantes comprenant 45 poissons; contrôles de type sauvage: nombre de mouvements = 177,4 ± 14,0 moyenne, moyenne nagé à distance = 300,2 ± 22,8 mm, n = 3 r indépendanteexpériences eplicate comprenant 45 poissons; dmd pc2 - / - mutant: nombre de mouvements = 163,3 ± 30,0 moyenne, distance moyenne nagé: 298,4 ± 60,37 mm, n = 3 expériences répétées indépendantes comprenant 12-20 poissons; dmd pc2 +/- hétérozygotes: nombre moyen de mouvements = 362,3 ± 38,8, moyenne nagé à distance: 660,3 ± 86.1mm n = 3 expériences répétées indépendantes comprenant 17-27 poissons; dmd homozygotes pc2 + / + de type sauvage: nombre de mouvements = 341,9 ± 91,6 moyenne, moyenne nagé à distance = 574,3 ± 170.9mm n = 3 expériences répétées indépendantes comprenant 8-25 poissons.
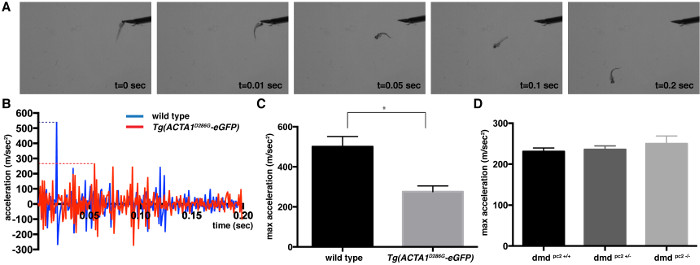
Figure 1:. Quantification du toucher-évoquer test de réponse pour 2 dpf embryons de poisson zèbre images (A) Snapshot d'un zebrafish de commande pendant tactile évoquent des essais à 2 dpf. (B) de profil d'accélération pour le premier 0,2 seconde d'unTg unique (ACTA1 D286G -eGFP) (rouge) et de contrôle unique (bleu) zebrafish après l' application du stimulus tactile. L'accélération maximale est représentée par les lignes en pointillés. (C, D) Quantification de l'accélération maximale (m / sec 2) enregistrés à partir d' essais de réponse au toucher évoqué de (C) Tg (ACTA1 D286G -eGFP) zebrafish et (D) pc2 dmd - / - poisson mutant par rapport à contrôler le poisson zèbre à 2 dpf. Les barres d'erreur représentent ± SEM pour 3 expériences répétées, * p <0,05. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
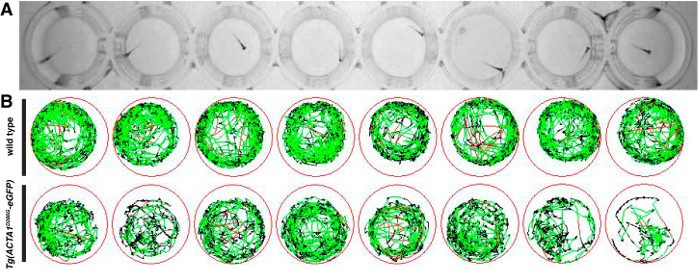
Figure 2:. Représentation des essais de locomotion pour les embryons de poisson zèbre (A) embryons de poisson zèbre sont placées dans des plaques à 48 puits et la locomotion est enregistrée par le dessus à l' aide d' une caméra infrarouge numérique. (B) Schéma de mouvement zebrafish au cours de la période d'essai avec des lignes rouges représentant les mouvements rapides, des lignes vertes représentant des mouvements lents et des lignes noires représentant inactivité (tel que déterminé par les seuils de détection entrés dans le logiciel). S'il vous plaît cliquer ici pour voir une version plus grande cette figure.
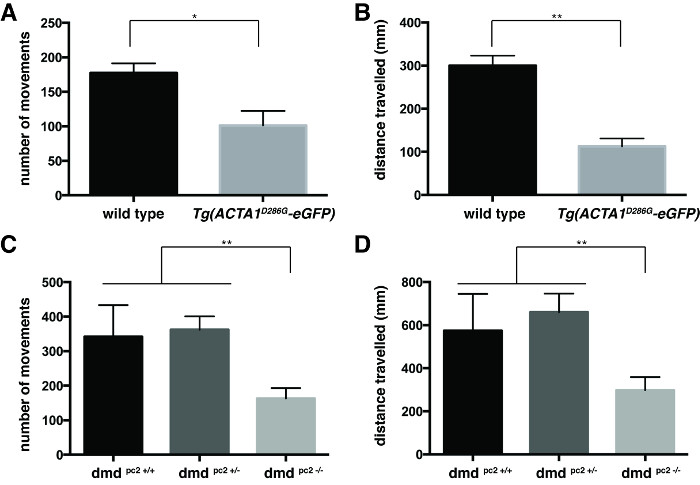
Figure 3:. Quantification des essais de locomotion pour 6 dpf larves de poisson zèbre Quantification de la (A) nombre de mouvements et (B) la distance parcourue par Tg (ACTA1 D286G -eGFP) zebrafish par rapport au témoin zebrafish à 6 dpf.Quantification de la (C) le nombre de mouvements et (D) distance parcourue par dmd pc2 - / - poisson mutant par rapport à contrôler zebrafish à 6 dpf. Les barres d'erreur représentent ± SEM pour 3 expériences répétées, * p <0,05, ** p <0,01. S'il vous plaît , cliquez ici pour voir une version plus grande de cette figure.
Discussion
Beaucoup de différents modèles animaux, y compris les souris, les chiens, le poisson zèbre, les mouches et les vers ont contribué à notre compréhension de la base génétique et moléculaire des maladies musculaires, et a contribué à l'élaboration d'approches thérapeutiques pour les combattre. Le zebrafish dispose de plusieurs avantages pour l'étude des maladies musculaires. Le poisson zèbre fournit un système génétiquement manipulé pour évaluer patterning musculaire complexe dans un environnement physiologique approprié, ce qui est impossible dans les systèmes de culture in vitro. Contrairement à d' autres modèles animaux vertébrés, le grand nombre de poissons produits, ainsi que sa clarté optique, facilite rapide, à haut débit dans l' industrie chimique vivo et le dépistage génétique.
Nous décrivons ici le développement de tests de mouvement de poisson zèbre pour fournir un haut débit et méthode automatisée pour évaluer la performance musculaire pendant l'embryogenèse zebrafish. Pour les deux essais, il faut reconnaître que les rythmes circadiens etstimuli environnementaux externes affectent considérablement le comportement de natation zebrafish 17,18. Des tests répétés du même zebrafish conduira également à habituation provoquant une diminution de la réponse au stimulus tactile 23. Par conséquent, afin d'obtenir des résultats reproductibles entre les expériences de chaque embryon de poisson zèbre ne devrait être testé une fois, le temps des conditions de jour et l'éclairage devrait être normalisée, et la température de l'eau doit être strictement réglementée.
Utilisation de la touche a évoqué l'analyse à 2 dpf nous pouvons mesurer directement l'accélération maximale d'une action de nage en rafale, qui est proportionnelle à la force musculaire. Les techniques précédentes en zebrafish ont examiné la force musculaire en liant les deux extrémités des embryons à des équipements expérimentaux suivants qui contraction musculaire est stimulée en utilisant un champ électrique et la capacité de génération de force du muscle 14 est mesurée. Alors que cette méthode permet de mesurer la force de capacité de production de til muscle larvaire, il ne mesure pas la force réelle générée par le muscle larvaire au cours de natation. Nous avons donc développé une méthode pour évaluer indirectement la force générée pendant le mouvement de la natation larvaire normale pour fournir une mesure globale de la santé des muscles. Le système de vidéo à haute vitesse, capable d'enregistrer les mouvements individuels de poisson zèbre à un taux de 1.000 images de trame / sec peut être utilisé pour identifier les petites mais significatives différences dans la fonction musculaire, qui ne sont pas directement distinguer à l'oeil nu. Il sera intéressant de voir comment précédemment rapporté des changements dans stimulée électriquement de génération de forces corrélation avec l'évolution des performances de la natation.
En outre , le contact a évoqué des tests de réponse peuvent également être utilisés pour évaluer la cinématique de natation, tels que la forme et la vitesse de l'onde du corps pendant le mouvement de natation 24, pour donner une mesure quantitative du comportement locomoteur.
En raison du mouvement spontané de zebraflarves ish après 3 dpf, nous n'étions pas en mesure d'effectuer les tests tactiles évoquent pour mesurer la fonction musculaire. A l'inverse, nous avons mesuré la performance musculaire sur une période plus longue en déterminant la nage à distance par les larves de poisson zèbre à 6 dpf. Ce test, bien que d' une mesure indirecte de la fonction musculaire, peut être utilisé pour identifier des poissons présentant des performances musculaires avec facultés affaiblies 8 ou neurodégénérescence 25,26. Ce test fournit non seulement une mesure analogue au test de marche de 6 minutes , mais est également adapté pour à haut débit automatisé dans les écrans de drogue ou mutagenèse in vivo.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank Viewpoint for their kind sponsorship of this manuscript. This work was funded by an Australian National Health and Medical Research Council (NHMRC) Project Grant (APP1010110).
matériels
| Name | Company | Catalog Number | Comments |
| 21 G x 1' Blunt Needle | Terumo/Admiral Medical Supplies | TE2125 | |
| 48-well plates | Sigma | M8937 | |
| 90 mm Petri Dishes | Pacific Laboratory Products PT | S90001 | |
| High Speed Camera | Baumer | HXC20 | |
| http://www.randomization.com | N/A | Steps 1.1.2, 2.1.3 | |
| Incubator | Thermoline Scientific | TEI-43L | |
| Plastic Pipette | VWR | 16001-188 | |
| StreamPix5 | NorPix | Step 1.2.3 | |
| Temperature Control Unit | Viewpoint | ||
| Tweezers, style 8 | ProSciTech | T04-821 | |
| Zebrabox System | Viewpoint | ||
| Zebralab | Viewpoint | Steps 1.3.1, 2.2.1 |
Références
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Gupta, V. A., Kawahara, G., et al. A splice site mutation in laminin-α2 results in a severe muscular dystrophy and growth abnormalities in zebrafish. PLoS ONE. 7 (8), e43794 (2012).
- Gupta, V., Kawahara, G., et al. The zebrafish dag1 mutant: a novel genetic model for dystroglycanopathies. Hum Mol Genet. 20 (9), 1712-1725 (2011).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. Proc Natl Acad Sci. 108 (13), 5331-5336 (2011).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model & Mech. 5 (3), 389-396 (2012).
- Ruparelia, A. A., Oorschot, V., Vaz, R., Ramm, G., Bryson-Richardson, R. J. Zebrafish models of BAG3 myofibrillar myopathy suggest a toxic gain of function leading to BAG3 insufficiency. Acta Neuropathol. 128 (6), 821-833 (2014).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum Mol Genet. 21 (21), 4718-4731 (2012).
- Sztal, T. E., Zhao, M., et al. Zebrafish models for nemaline myopathy reveal a spectrum of nemaline bodies contributing to reduced muscle function. Acta Neuropathol. 130 (3), 389-406 (2015).
- Pichler, F. B., Laurenson, S., Williams, L. C., Dodd, A., Copp, B. R., Love, D. R. Chemical discovery and global gene expression analysis in zebrafish. Nat Biotechnol. 21 (8), 879-883 (2003).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nat Biotechnol. 22 (5), 595-599 (2004).
- Kawahara, G., Serafini, P. R., Myers, J. A., Alexander, M. S., Kunkel, L. M. Characterization of zebrafish dysferlin by morpholino knockdown. Biochem Bioph Res Co. 413 (2), 358-363 (2011).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. , (2005).
- Smith, L. L., Beggs, A. H., Gupta, V. A. Analysis of skeletal muscle defects in larval zebrafish by birefringence and touch-evoke escape response assays. J Vis Exp. (82), e50925 (2013).
- Sloboda, D. D., Claflin, D. R., Dowling, J. J., Brooks, S. V. Force measurement during contraction to assess muscle function in zebrafish larvae. J Vis Exp. (77), (2013).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test as a new outcome measure in Duchenne muscular dystrophy. Muscle Nerve. 41 (4), 500-510 (2010).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test and other clinical endpoints in duchenne muscular dystrophy: reliability, concurrent validity, and minimal clinically important differences from a multicenter study. Muscle Nerve. 48 (3), 357-368 (2013).
- Hurd, M. W., Debruyne, J., Straume, M., Cahill, G. M. Circadian rhythms of locomotor activity in zebrafish. Physiol Behav. 65 (3), 465-472 (1998).
- MacPhail, R. C., Brooks, J., Hunter, D. L., Padnos, B., Irons, T. D., Padilla, S. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol. Neurotoxicology. 30 (1), 52-58 (2009).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J Cell Mol Med. 15 (12), 2643-2651 (2011).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Bioph Res Co. 423 (4), 785-788 (2012).
- Ravenscroft, G., Jackaman, C., et al. Mouse models of dominant ACTA1 disease recapitulate human disease and provide insight into therapies. Brain. 134 (4), 1101-1115 (2011).
- Ravenscroft, G., Wilmshurst, J. M., et al. A novel ACTA1 mutation resulting in a severe congenital myopathy with nemaline bodies, intranuclear rods and type I fibre predominance. Neuromuscular Disord. 21 (1), 31-36 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci. 108 (37), 15468-15473 (2011).
- Müller, U. K., van Leeuwen, J. L. Swimming of larval zebrafish: ontogeny of body waves and implications for locomotory development. J Exp Biol. 207 (Pt 5), 853-868 (2004).
- Cheng, W., Tian, J., Burgunder, J. M., Hunziker, W., Eng, H. L. Myotonia congenita-associated mutations in chloride channel-1 affect zebrafish body wave swimming kinematics. PLoS ONE. 9 (8), e103445 (2014).
- Moggio, M., Colombo, I., et al. Mitochondrial disease heterogeneity: a prognostic challenge. Acta Myol. 33 (2), 86-93 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon