Method Article
Mit Touch-evozierte Reaktion und Locomotion Assays zur Beurteilung der Muskelleistung und Funktion in Zebrabärbling
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Zebrafish are an excellent model to study muscle function and disease. During early embryogenesis zebrafish begin regular muscle contractions producing rhythmic swimming behavior, which is altered when the muscle is disrupted. Here we describe a touch-evoked response and locomotion assay to examine swimming performance as a measure of muscle function.
Zusammenfassung
Zebrabärbling Muskelentwicklung ist mit Säugetiersystemen hoch konserviert sie ein hervorragendes Modell macht die Muskelfunktion und Krankheit zu untersuchen. Viele Myopathien der Skelettmuskelfunktion beeinträchtigen können schnell und einfach über die ersten paar Tage der Embryonalentwicklung in Zebrabärbling beurteilt werden. Mit dem 24 Stunden nach der Befruchtung (HPF), Wildtyp- Zebrabärbling Vertrag spontan ihre Schwanzmuskeln und um 48 HPF, Zebrabärbling Ausstellung kontrollierten Schwimmverhalten. Verringerung der Häufigkeit von oder andere Veränderungen in, können diese Bewegungen eine Skelettmuskelfunktionsstörung hinweisen. Um Schwimmverhalten zu analysieren und die Muskelleistung in frühen Zebrabärblingentwicklung beurteilen zu können, nutzen wir beide Touch-evozierte Fluchtreaktion und Lokomotion Assays.
Touch-evozierte Fluchtreaktion Assays können verwendet werden, um die Leistungsfähigkeit der Muskulatur während der kurzen Burst Bewegungen beurteilen aus Kontraktion der Fast-Twitch-Muskelfasern. Als Reaktion auf einen externen Stimulus, der in diesem Fall ein Antippender Kopf, Wildtyp- Zebrabärbling bei 2 Tage nach der Befruchtung (dpf) weisen typischerweise eine leistungsstarke Burst schwimmen, durch scharfe Kurven begleitet. Unsere Methode quantifiziert Skelettmuskelfunktion durch die maximale Beschleunigung während einer Burst-Schwimmbewegung zu messen, die Beschleunigung auf die Kraft direkt proportional durch Muskelkontraktion erzeugt.
Im Gegensatz dazu Lokomotion Tests während der frühen Zebrabärbling Larvenentwicklung verwendet werden, um die Leistungsfähigkeit der Muskulatur während anhaltender Perioden der Muskelaktivität zu bewerten. Verwendung eines Verfolgungssystems Schwimmverhalten zu überwachen, wurde eine automatisierte Berechnung der Häufigkeit der Anwendung und Entfernung in 6 Tage alten Zebrafisch, reflektierendes ihrer Skelettmuskelfunktion erhalten. Messungen der Schwimmleistung sind wertvoll für die phänotypischen Bewertung von Krankheitsmodellen und Hochdurchsatz-Screening von Mutationen oder chemischen Behandlungen Skelettmuskelfunktion zu beeinflussen.
Einleitung
Während des letzten Jahrzehnts Zebrabärbling zunehmend verwendet worden, um Muskel Zellbiologie und der Krankheit zu untersuchen. Die rasche Entwicklung der externen Zebrafischembryo, gekoppelt mit seiner optischen Klarheit, ermöglicht die direkte Visualisierung der Muskelbildung, Wachstum und Funktion. Der Prozess der Entwicklung der Muskulatur ist stark in Zebrabärbling konserviert und dies hat die erfolgreiche Modellierung einer Reihe von Muskelerkrankungen einschließlich Muskeldystrophien und angeborenen Myopathien 1-8 erlaubt. Detaillierte Prüfung von Zebrabärbling Modelle hat nicht nur neue Einblicke in die Pathobiologie dieser Bedingungen zur Verfügung gestellt , sondern auch eine Plattform für die Erprobung geeigneter Therapien 6,9-13 zur Verfügung gestellt.
Die Analyse der Zebrabärbling Modelle von Muskelerkrankungen beruht auf zuverlässige und reproduzierbare Tests Muskelleistung zu messen. Frühere Studien haben erfolgreich die Krafterzeugungsfähigkeit des Zebrabärbling Rumpfmuskulatur in Fisch zwischen 3 und 7 dpf gemessenelektrisch stimulieren Kontraktion eines mit einem Kraftübertragungssystem 14 angebracht immobilisiert Fisch. Dies kann detaillierte Messungen von Kraft zur Verfügung stellen, sind jedoch nicht ideal für einen höheren Durchsatz Experimente geeignet und gibt es Vorteile für die Muskelleistung Messung während des Schwimmens. Bei 2 dpf Zebrabärbling Muskel ist voll funktionsfähig und die Fische können platzen Schwimmbewegungen als Reaktion auf Reize hervorzurufen. Die berührungs evozieren Fluchtreaktion-Assay wird verwendet, Beschleunigung zu messen, während eines Bursts Schwimmbewegung, die als Maß für die Kontraktionskraft verwendet werden kann.
Eines der am meisten verwendeten Maßnahmen der Muskelfunktion in Myopathie - Patienten ist die 6 min - Gehtest, die die Gesamtstrecke ging auf einer harten , flachen Oberfläche 15,16 aufzeichnet. Wir haben einen vergleichbaren Test zur Messung der Muskelfunktion in 6 dpf Zebrabärblingembryonen angewandt, wobei wir die gesamte Strecke geschwommen, und die Gesamtzahl der Bewegungen von jeder Larve über einen Zeitraum von 10 Minuten gemacht überwachen. Dies wird durchgeführt,unter Verwendung eines automatischen Verfolgungssystem, das zuverlässig und mit hoher Durchsatzmessungen von Muskelleistung liefert. Beide Muskeltests sind in hohem Maße reproduzierbar und verwendet wurden Unterschiede in der Muskelleistung in Zebrabärbling Myopathie Modelle 8 zu quantifizieren.
Protokoll
1. Berühren-evozierten Reaktion Assay
- Herstellung von 2 dpf Embryonen für Touch-evozierten Reaktion Assay
- Sicherzustellen , dass die Zeit des Tages , an dem der Test durchgeführt wird , konsistent zwischen den Experimenten, weil Aktivität dramatisch ganzen Tag 17,18 variieren.
HINWEIS: Das Experiment ist blind durchgeführt werden, und die Reihenfolge der Tests randomisierten experimentellen Artefakte zu minimieren. - die Fische zuweisen Stämme eine Nummer, die dem einzelnen nicht bekannt ist, das Experiment durchgeführt wird. Im Anschluss daran mit frei verfügbaren Online-Tools, um eine zufällige Liste erzeugen, die die Reihenfolge der Prüfung vorschreibt.
- Mindestens eine Stunde vor der Prüfung dechorionate Embryonen, die durch ein Loch in der Chorion-Ripping und sanft das Chorion Auseinanderziehen einer feinen Pinzette verwenden. Entfernen Sie die Verschmutzungen aus der Petrischale vor ° C Inkubator zum 28 zurückkehrt.
- Sicherzustellen , dass die Zeit des Tages , an dem der Test durchgeführt wird , konsistent zwischen den Experimenten, weil Aktivität dramatisch ganzen Tag 17,18 variieren.
- Performing-Touch-evozierten Reaktion Assay
- wärme~~POS=TRUNC stage bis 28 ° C mindestens 15 min vor dem Test zu beginnen.
HINWEIS: In dieser Phase wird die Temperatur gesteuert und wird bei 28 bleiben ° C für die Dauer des Tests. Temperatur Aktivität beeinflussen und es ist daher wichtig, eine konstante Temperatur zu halten. Wenn ein erwärmtes Stufe nicht verfügbar ist, dann sollte die Temperatur des Wassers überwacht werden, und alle Versuche sollten bei der gleichen Temperatur durchgeführt werden. - Legen Sie eine Petrischale gefüllt mit Embryo Medium (5 mM NaCl, 0,17 mm KCl, 0,33 mM CaCl 2, 0,33 mM MgSO 4 in Wasser) auf einer beleuchteten Bühne und montieren Sie die High-Speed - Kamera über die Petrischale.
- Starten Sie die Videokamera-Aufnahme-Software (wie Stream Pix 5, hier beschrieben) und unter dem "Arbeitsplatz" wählen Sie die Registerkarte 1.000 Bilder pro Sekunde (1000 fps) als die Aufnahmegeschwindigkeit, die eine schnelle Schwimmverhalten der Fische zu gewährleisten, wird aufgezeichnet.
- Arbeiten mit einem Embryo in einer Zeit, legen Sie den Embryo in middle der Petrischale mit der Zebrabärbling deutlich sichtbar in dem Sichtfeld.
HINWEIS: Wenn der Embryo vor schwimmt weg von dem Experiment zu Beginn der Bauarbeiten mit einem anderen zu ersetzen, wie zurückzuerobern und die Positionierung des Embryos führen kann es auf den Reiz desensibilisiert werden und wiederholt Burst Antworten Muskelschwäche in einigen Krankheitsmodellen fördern kann. - Starten Sie die Aufnahme, indem Sie auf den "Record" Button klicken und liefern die mechanosensorischen Reiz auf den Embryo durch sie vorsichtig mit einer stumpfen Nadel auf der Oberseite des Kopfes zu berühren.
- Beenden Sie die Aufnahme, nachdem der Embryo aus dem Sichtfeld oder wieder in Ruhe geschwommen.
HINWEIS: Die Beschleunigungsspitzen innerhalb der ersten 0,2 Sekunden des Burst-Fluchtreaktion im Anschluss an die mechanischen Reiz. Daher sicher, dass zumindest während der ersten 0,2 Sekunden der Fluchtreaktion der Aufnahme die Fische im Blickfeld ist. Verwendung der Software in Schritt 1.2.3 beschrieben, werden die Daten automatisch gespeichert werdenals .avi Videodatei. Alternative Video-Capture-Software wie Free Video Capture oder Softonic, die beide frei zum Download verfügbar sind, können ebenfalls verwendet werden. - Bringen Sie den Embryo in eine neue Petrischale und wählen Sie einen anderen Embryo zum Testen. Führen Sie die Tests auf mindestens 15 Fische.
- wärme~~POS=TRUNC stage bis 28 ° C mindestens 15 min vor dem Test zu beginnen.
- Die Quantifizierung der Schwimmverhalten
- Um das Schwimmverhalten zu quantifizieren, starten Sie die Software und wählen Sie die "Single Larvae Locomotion ohne Untergrundsubtraktion" Modul zu öffnen Sie das gespeicherte Video in .avi - Datei.
- Mit Hilfe der "freihändig" oder "Polygon" Werkzeug aus der Menüleiste wählen Sie Bereiche des Films für die Analyse verwendet werden. Stellen Sie sicher, dass die Region umfasst sowohl die ursprüngliche Position der Fische und die Gegend, dass die Fische schwimmen in wird. Stellen Sie sicher, dass die Sonde aus dem Bereich ausgeschlossen ist, analysiert werden. Die Software wird die Flugbahn des Fisches im gewünschten Bereich automatisch zu verfolgen.
- Zur Durchführung ter Analyse, klicken Sie auf "Experiment" in der Menüleiste und wählen Sie "Ausführen". Wenn aufgefordert , die Rohdaten Analysedatei (.phr Format) in der gewünschten Position zu speichern. Einmal gespeichert, klicken Sie auf "Start", um die Analyse zu beginnen. Beenden Sie die Analyse durch einen Klick auf "Stop" unter dem "Experiment" Drop-Down-Menü. Ein Fenster mit den Ergebnissen wird angezeigt.
- Blättern Sie nach rechts, um die "maximale Beschleunigung" Wert zu erhalten. Falls gewünscht, können diese Daten exportieren, indem Sie das Ergebnisfenster zu schließen und auf den "Export sofortige Ergebnisse" -Knopf unter "Ergebnisse" im Dropdown-Menü klicken. Wählen Sie die entsprechende Rohdaten Analysedatei, und klicken Sie auf Open. Eine Textdatei, die in einem Tabellenkalkulationsprogramm geöffnet werden kann, wird im Zielordner gespeichert werden.
- Wiederholen Sie diesen Vorgang für jeden einzelnen Fisch und durchschnittlich die mittlere maximale Beschleunigung für jeden Stamm zu erhalten (siehe Abbildung 1).
HINWEIS: Als Alternative zu using die hier beschriebene Software, ähnliche Pakete wie die frei verfügbaren ImageJ-Software kann die relevanten Bewegungsdaten zu extrahieren, verwendet werden. Die 3D-Particle Tracker Plugin kann verwendet werden, Schwimmbahnen zu verfolgen.
2. Locomotion Assay - 10 min Schwimmtest
- Herstellung von 6 dpf Embryonen für Schwimmanalyse
- Falls erforderlich, sort Embryonen für die gewünschte Genotyp, beispielsweise durch Expression eines fluoreszierenden Proteins oder durch Phänotyp untersucht, und in einen separaten Petrischale (25-30 Embryonen pro Schale). Alternativ kann der Genotyp nach Beendigung der Fortbewegung Assay bestimmt werden.
- Bei 3 dpf, erneut zu prüfen, Petrischalen und entfernen Sie alle nicht geschlüpften Embryonen und Schutt. Rückpetrischalen auf 28 ° C Inkubator bis 6 dpf.
- Führen Sie die Tests aller Stämme von 9.00 bis 12.00 Uhr, die die Zeit ist, bei der Zebrabärblingembryonen am aktivsten sind. Randomisieren die Reihenfolge des Testens und der Position in der pEnde von Wildtyp und Mutante Proben, die die Auswirkungen der zirkadianen Unterschiede und andere experimentelle Bias zu minimieren.
Hinweis: Es ist wichtig, daß die Testzeit zwischen den Experimenten konsistent ist, weil Aktivität dramatisch während des Tages variieren. - Mindestens 30 Minuten vor der Prüfung statt Larven in einer 48-Well-Platte mit einer Larve pro Vertiefung. Nach der Übertragung füllen die Vertiefungen, so dass die Wasseroberfläche knapp unter dem oberen Ende des Bohrloches ist, um sicherzustellen, gibt es keine Blasen. Rückplatten bis 28 ° C Inkubator.
- im Licht für fünf Minuten vor dem Test nehmen Platten aus dem Inkubator und akklimatisieren.
- Durchführen von Locomotion Assay
- Platzieren Sie die 48-Well-Platte in die Aufzeichnungskammer, die mit einer Infrarot-Kamera ausgestattet ist, die Erfassung von bis zu 60 Bildern / sec, so daß Larven im Dunkeln erkannt werden. Prüfen, ob alle der Vertiefungen im Inneren des kreisförmigen Gitters auf der Lokomotion Software gesetzt und dass alle Larven CLEarly nachweisbar.
- Starten Sie die Software und wählen Sie das "Tracking" Modul. Unter "Datei" klicken Sie auf "generieren neue Protokoll" und die Anzahl der Brunnen für das Experiment verwendet bearbeiten. Stellen Sie sowohl die Versuchsdauer und der Integrationsperiode bis 10 min durch einen Klick auf den "Parameter" Drop-Down-Menü und die Auswahl der "Protokollparameter" und anschließend die "Zeit" aus. Auf der gleichen "Protokollparameter" Dialogfenster klicken Sie auf die Registerkarte "Optionen" und stellen Sie sicher das "Numeriscope", um folgende geklickt wird, das kann der "Protokollparameter" Dialogfeld geschlossen werden.
- So stellen Sie die Aufnahmebereiche das gesamte Raster und klicken Sie doppelt auf einen der Brunnen hervorzuheben. Klicken Sie auf die "ziehen Bereiche" und ziehen um die oben links, oben rechts und unten links Brunnen und klicken Sie auf "Build", das die Software die Position jeder Vertiefung automatisch bestimmen können. zeichnen sich auch in einer SkalaLeiste und klicken Sie auf "gelten Gruppe". Einmal abgeschlossen, klicken Sie auf den "ziehen Bereichen" -Taste.
- bestimmen visuell Detektionsschwelle durch die "Detektionsschwelle" bar auf ein Niveau Gleiten, bei dem nur die Fischbewegungen ohne Hintergrundsignale werden hervorgehoben.
HINWEIS: Die Detektionsschwelle zwischen den Stämmen und somit müssen die Schwellenwerte festgelegt werden, wann immer ein neuer Stamm getestet variieren. In der repräsentativen Daten, die eine Detektionsschwelle von 25 mm vorgestellt / s verwendet wurde. - Vor Beginn der Prüfung eingeben Bewegung Schwellen für die Erkennung von Inaktivität, und kleine und große Bewegungen.
HINWEIS: Bei der repräsentativen Daten, die eine Inaktivitätsschwelle von 6 mm / s und eine Aktivität platzen Schwelle von 30 mm / s verwendet wurde, vorgestellt. Die Schwellenwerte bestimmen die minimale Bewegung aktiv zu berücksichtigen und das Niveau erforderlich ist, um Burst-Aktivität in Betracht gezogen werden und die Klassifizierung der Tätigkeit in kleine (aktiv erlauben aber unter Burst activity Schwellen) und groß (größer als der Schwellenwert Burst-Aktivität) Bewegungen. Die Schwellenwerte können abhängig von der Aktivität der besonderen Fischstämme analysiert verändert werden.
HINWEIS: Obwohl der Test kann in entweder hellen oder dunklen Bedingungen durchgeführt werden, Zebrabärblingembryonen im Dunkeln 18 , aktiver zu sein gezeigt worden sind. - Stellen Sie die Lichtintensität innerhalb der Kammer bei 0% liegen, indem Sie auf die "Lichtfahr Einstellungen" Taste unter dem "Parameter" klicken Dropdown-Menü. Auf dem resultierenden Dialogfeld, fügen Sie die erforderlichen Lichteinstellungen.
HINWEIS: Die Lichtintensität innerhalb der Kammer kann ausgelöst werden, zum Ein- und Ausschalten während der Testzeit Larven Aktivität zu stimulieren - Schließen Sie die Tür des Aufzeichnungskammer und Videoaufnahme zu starten.
- Die Quantifizierung der Schwimmverhalten
- Nachdem das Experiment abgeschlossen ist, klicken Sie auf "Stopp" unter dem "Experiment" Drop-Down-Menü. Ein Dialog box mit allen Ergebnissen wird angezeigt.
- Für den Zugriff auf diese Ergebnisse in Excel, klicken Sie auf "Übergeordneten Ordner öffnen" und öffnen Sie die Excel-Datei, die in dem resultierenden Ordner angezeigt wird. Die wichtigen Parameter sind "smlct" (kleine Bewegung count) "larct" (große Bewegung count) "smldist" (Gesamtstrecke durch die Fische in kleinen Bewegungen abgedeckt) und "lardist" (total durch die Fische zurückgelegte Strecke in große Bewegungen ).
HINWEIS: Nach der Aufnahme, gibt die Software auch zwei zusätzliche Ausgabedateien in Form einer .avi - Datei (ein Video von der 10 min Aufzeichnung enthält) und eine .png Bilddatei (eine visuelle Darstellung der Fortbewegung während der 10 - haltigen min Experiment, siehe Abbildung 2). - Sobald die Bewegungswerte berechnet werden, wiederholen Sie die .avi und PNG - Dateien , ob die Bewegungswerte , um die Schwimmbewegungen des Fisches (siehe Abbildung genau abbilden berechnet Meinung3).
HINWEIS: Als Alternative, die Software zu verwenden hier beschriebenen Pakete wie die frei verfügbaren ImageJ Software verwendet werden, können die Bewegungsverhalten zu verfolgen.
Ergebnisse
Touch evozierten Reaktion Assay verwendet werden, können die Geschwindigkeit und Beschleunigung der Schwimmbewegungen zu bestimmen, die ein proportionales Maß an Muskelkraft. Als Reaktion auf einen mechanischen Reiz, wie ein kleiner Klaps auf den Kopf 2 dpf Wildtyp Zebrabärbling zeigen eine schnelle Schwimmbewegungen. Tg (ACTA1 D286G -eGFP), ein Modell von nemaline Myopathie , die erhebliche Muskelschwäche zu haben, und ein Modell der Duchenne - Muskeldystrophie , bei denen schwere Muskeldefekten hat sich gezeigt , beschrieben wurden: Videos wurden für zwei verschiedene Zebrabärbling Myopathie Modelle erfasst und analysiert bei 5 dpf 19,20. Bilder aus einem Video eines typischen Touch evozierte Assays sind in 1A dargestellt. Beschleunigung der Zebrabärbling wurde innerhalb der ersten 0,2 Sekunden des Bursts swimming Fluchtreaktion (1B) zu Spitze untersucht und festgestellt. Dieser Peak maximaler Beschleunigung liefert ein Maß, das der Kraft proportional ist, generating Kapazität der Skelettmuskulatur. Die maximale Beschleunigungswerte wurden gemittelt , um eine mittlere maximale Beschleunigungswert (± Standardfehler des Mittelwerts) für jeden Stamm zu erhalten: Tg (ACTA1 D286G -eGFP): Mittelwert = 276,0 ± 28,8 m / s 2, n = 3 unabhängigen Wiederholungsversuchen umfassend 15 einzelne Fische; Wildtyp - Steuerung: Mittelwert = 500,8 ± 50,28 m / sec 2, n = 3 unabhängige Wiederholungsversuchen mit 15 einzelnen Fische; DMD PC2 - / - Mutante: mean = 249,9 ± 19,1 m / s 2, n = 3 unabhängige Wiederholungsversuchen umfassend 12-19 einzelne Fische; DMD pc2 +/- heterozygote: Mittelwert = 235,9 ± 8,7 m / s 2, n = 3 unabhängige Wiederholungsversuchen umfassend 16-27 einzelne Fische; DMD PC2 + / + Wildtyp - Homozygoten: Mittelwert = 230,9 ± 8,7 m / s 2, n = 3 unabhängige Wiederholungsversuchen umfassend 8-27 einzelnen Fisch (1C). Wie erwartet, D286 die Tg (ACTA1G -eGFP) Fische wurden eine signifikante Abnahme der maximalen Beschleunigung zu haben , die darauf hindeuteten , reduziert die Muskelfunktion, die mit Maus - Modellen und Patientendaten konsistent ist 8,21,22. Die DMD pc2 - / - Mutante Fische zeigten jedoch keinen Unterschied in der maximalen Beschleunigung, bei 2 dpf, in Übereinstimmung mit der Detektion von Muskeldefekten von 3 dpf 20 (1D).
Locomotion Assays wurden bei 6 dpf geführt, um die Aktivität und die Entfernung von swum Zebrabärbling-Stämme als Hinweis auf Muskelleistung zu bestimmen. Nach der Prüfung, eine schematische Darstellung der Schwimmbewegungen während der Testphase von zehn Minuten erzeugt wurde, mit roten und grünen Linien Perioden von langsamen und schnellen Bewegung repräsentieren jeweils und schwarzen Linien , die Perioden der Inaktivität (Abbildung 2). Einzelne Wildtyp- Zebrabärbling zeigen eine hohe Aktivität mit relativ keine Perioden der Inaktivität als opposed an Tg (ACTA1 D286G -eGFP) Fische, die der Testphase (2B) aktiv sind , weniger über.
Das Schwimmverhalten wurde durch Mittelung der einzelnen Werte der Anzahl der Bewegungen und der Abstand swum von jedem Fisch (Abbildung 3) quantifiziert. Sowohl Tg (ACTA1 D286G -eGFP) Fisch (3A und 3B) und DMD pc2 - / - Mutante Fisch (3C und 3D) wurden eine signifikante Abnahme haben in der mittleren Anzahl von Bewegungen und Entfernung gefunden SWUM im Vergleich zu ihren jeweiligen Kontrollen: Tg (ACTA1 D286G -eGFP) Fisch: mittlere Anzahl der Bewegungen = 94,3 ± 13,6, Abstand geschwommen = 112,9 ± 18,4 mm, n = 3 unabhängigen Wiederholungsversuchen, die 45 Fische bedeuten; Wildtyp-Kontrollen: mittlere Anzahl der Bewegungen = 177,4 ± 14,0, mittlerer Abstand geschwommen = 300,2 ± 22,8 mm, n = 3 unabhängigen replicate Experimente, die 45 Fische; DMD PC2 - / - Mutante die mittlere Anzahl von Bewegungen = 163,3 ± 30,0, Entfernung geschwommen bedeuten: 298,4 ± 60,37 mm, n = 3 unabhängigen Wiederholungsversuchen umfassend 12-20 Fisch; DMD pc2 +/- heterozygote: mittlere Anzahl der Bewegungen = 362,3 ± 38,8, mittlerer Abstand geschwommen: 660,3 ± 86.1mm n = 3 unabhängige Wiederholungsversuchen umfassend 17-27 Fisch; DMD PC2 + / + Wildtyp - Homozygoten die mittlere Anzahl von Bewegungen = 341,9 ± 91,6, mittlerer Abstand geschwommen = 574,3 ± 170.9mm n = 3 unabhängige Wiederholungsversuchen umfassend 8-25 Fisch.
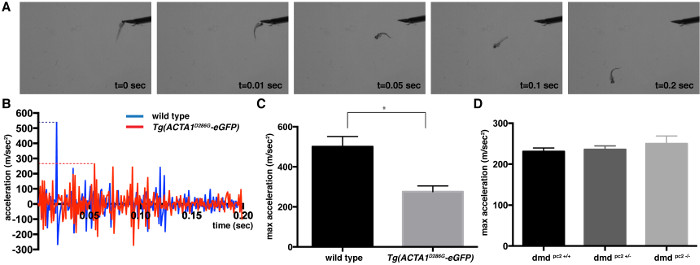
Abb . 1: Die Quantifizierung der berührungs evozieren Antwort Assay für 2 dpf Genaktivität (A) Snapshot Bilder eines Steuer Zebrabärbling während berührungs evozieren Assays bei 2 dpf. (B) Beschleunigungsprofil für den ersten 0,2 Sekunden von aEinzel Tg (ACTA1 D286G -eGFP) (rot) und Einzelkontrolle (blau) Zebrabärbling nach der Anwendung des Berührungsreiz. Die maximale Beschleunigung wird durch die gepunkteten Linien dargestellt. (C, D) Quantifizierung der maximalen Beschleunigung (m / s 2) aufgezeichnet von Touch-evozierten Reaktion Assays von (C) Tg (ACTA1 D286G -eGFP) Zebrabärbling und (D) DMD PC2 - / - Mutant Fisch im Vergleich Zebrabärbling zu steuern , mit 2 dpf. Die Fehlerbalken stellen ± SEM für drei Wiederholungsexperimenten, * p <0.05. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
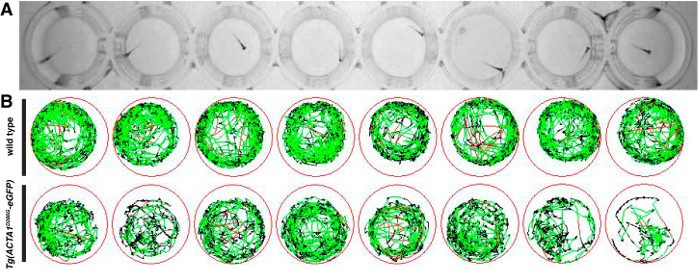
Abbildung 2:. Darstellung der Lokomotion Assays für Genaktivität (A) sind Genaktivität platziert in 48-Well - Platten und Fortbewegung wird von oben mit einem Infrarot - Digitalkamera aufgenommen. (B) Schematische Darstellung der Zebrabärbling Bewegung während der Testperiode mit roten Linien zeigen schnelle Bewegungen, grüne Linien zeigen langsame Bewegungen und schwarzen Linien Inaktivität darstellt (wie eingegeben durch die Erkennungsschwellen bestimmt in der Software). Bitte klicken Sie hier , um eine größere Version diese Figur.
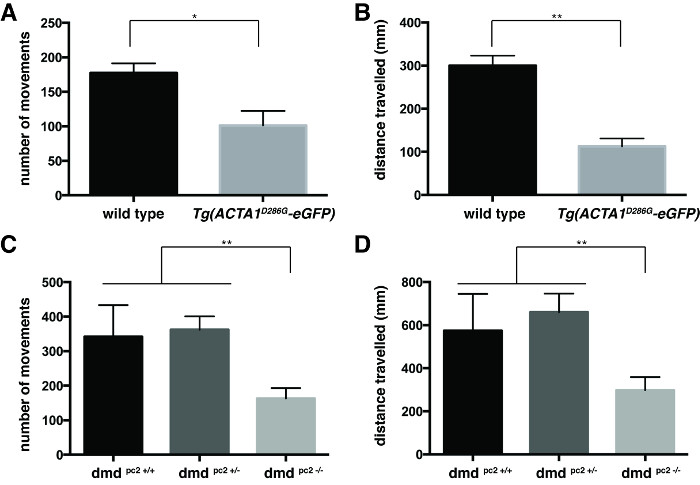
Abbildung 3:. Die Quantifizierung der Lokomotion Assays für 6 dpf Zebrabärblingembryonen Quantifizierung der (A) Anzahl der Bewegungen und (B) Entfernung von Tg (ACTA1 D286G -eGFP) Zebrabärbling reiste im Vergleich Zebrabärbling zu steuern , mit 6 dpf.Die Quantifizierung der (C) Anzahl der Bewegungen und (D) Entfernung von DMD pc2 gereist - / - Mutant Fisch im Vergleich Zebrabärbling zu steuern , mit 6 dpf. Die Fehlerbalken stellen ± SEM für drei Wiederholungsexperimenten, * p <0,05, ** p <0.01. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Viele verschiedene Tiermodelle einschließlich Mäuse, Hunde, Zebrabärbling, Fliegen und Würmer haben zu unserem Verständnis der genetischen und molekularen Grundlagen von Muskelerkrankungen beigetragen und bei der Entwicklung von therapeutischen Ansätzen unterstützt sie zu bekämpfen. Der Zebrafisch bietet mehrere Vorteile für die Untersuchung von Muskelerkrankungen. Der Zebrafisch ein genetisch manipulierbar System komplex Muskelmusterungs in einem geeigneten physiologischen Umgebung zu bewerten, die in in vitro Kultursystemen nicht möglich ist. Im Gegensatz zu anderen Wirbeltiermodellen erzeugt die große Anzahl von Fischen, zusammen mit seiner optischen Klarheit, erleichtert die schnelle Hochdurchsatz in vivo chemische und genetische Screening.
Hier beschreiben wir die Entwicklung von Zebrabärbling Bewegung Assays ein Hochdurchsatz und automatisierte Verfahren zu schaffen, Muskelleistung während Zebrabärbling Embryonalentwicklung zu beurteilen. Für beide Assays festzustellen, dass zirkadiane Rhythmen quittiert undexterne Reize aus der Umwelt deutlich Zebrabärbling Schwimmverhalten 17,18 beeinflussen. Wiederholtes Testen des gleichen Zebrabärbling wird auch Gewöhnung führen eine Abnahme der Reaktion auf den taktilen Reiz verursacht 23. Daher sollten, um reproduzierbare Ergebnisse zwischen den Experimenten jedes Zebrafischembryo zu erreichen nur einmal getestet werden, die Tageszeit und Lichtbedingungen standardisiert werden sollten, und die Wassertemperatur muss streng reguliert werden.
Mit dem Touch-evozierte Analyse bei 2 dpf wir direkt die maximale Beschleunigung eines Bursts Schwimmbewegungen messen können, die zu Muskelkraft proportional ist. Früheren Techniken in Zebrabärbling haben Muskelkraft untersucht , indem beide Enden der Embryonen zu Versuchsanlagen folgenden binden Kontraktion der Muskeln stimuliert wird unter Verwendung eines elektrischen Feldes und die Krafterzeugungsfähigkeit des Muskels 14 gemessen wird . Während dieses Verfahren misst die Kraft Kapazität von t Erzeugungser Larven Muskel, ist es nicht die tatsächliche Kraft messen durch die Larven Muskel erzeugt während des Schwimmens. Wir entwickelten deshalb ein Verfahren, um indirekt die Kraft beurteilen während des normalen Larvenschwimmbewegung erzeugt ein Gesamtmaß der Muskel Gesundheit zu liefern. Die Hochgeschwindigkeits-Videosystem, der fähig ist mit einer Bildrate von 1.000 Frames einzelnen Zebrabärbling Bewegungen Aufzeichnung / sec verwendet werden können kleine, aber signifikante Unterschiede in der Muskelfunktion, die nicht direkt durch unterscheidbare Auge zu identifizieren. Es wird interessant sein zu sehen, wie zuvor Änderungen berichtet in elektrisch stimulierte Kraft-Generation mit Veränderungen in der Schwimmleistung korrelieren.
Darüber hinaus evoziert die Touch - Reaktion Assays können auch eine quantitative Messung des Bewegungsverhaltens zu geben Schwimmkinematik, wie die Form und die Geschwindigkeit der Körperwelle während der Schwimmbewegung 24, zu beurteilen , verwendet werden.
Aufgrund der spontanen Bewegung zebrafish Larven nach 3 dpf, waren wir die berührungs evozieren Tests durchzuführen, um zu messen Muskelfunktion nicht in der Lage. Im Gegensatz dazu messen wir die Muskelleistung über einen längeren Zeitraum, indem der Abstand geschwommen von Zebrabärblingembryonen bei 6 dpf zu bestimmen. Dieser Test, obwohl ein indirektes Maß für die Muskelfunktion, kann verwendet werden , Fisch Anzeige beeinträchtigter Muskelleistung 8 oder Neurodegeneration 25,26 zu identifizieren. Dieser Test liefert nicht nur eine Messung analog zum 6 min - Gehtest , sondern eignet sich auch für die automatisierte Hochdurchsatz - in - vivo - Arzneimittel oder Mutagenese - Bildschirme.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank Viewpoint for their kind sponsorship of this manuscript. This work was funded by an Australian National Health and Medical Research Council (NHMRC) Project Grant (APP1010110).
Materialien
| Name | Company | Catalog Number | Comments |
| 21 G x 1' Blunt Needle | Terumo/Admiral Medical Supplies | TE2125 | |
| 48-well plates | Sigma | M8937 | |
| 90 mm Petri Dishes | Pacific Laboratory Products PT | S90001 | |
| High Speed Camera | Baumer | HXC20 | |
| http://www.randomization.com | N/A | Steps 1.1.2, 2.1.3 | |
| Incubator | Thermoline Scientific | TEI-43L | |
| Plastic Pipette | VWR | 16001-188 | |
| StreamPix5 | NorPix | Step 1.2.3 | |
| Temperature Control Unit | Viewpoint | ||
| Tweezers, style 8 | ProSciTech | T04-821 | |
| Zebrabox System | Viewpoint | ||
| Zebralab | Viewpoint | Steps 1.3.1, 2.2.1 |
Referenzen
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Gupta, V. A., Kawahara, G., et al. A splice site mutation in laminin-α2 results in a severe muscular dystrophy and growth abnormalities in zebrafish. PLoS ONE. 7 (8), e43794 (2012).
- Gupta, V., Kawahara, G., et al. The zebrafish dag1 mutant: a novel genetic model for dystroglycanopathies. Hum Mol Genet. 20 (9), 1712-1725 (2011).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. Proc Natl Acad Sci. 108 (13), 5331-5336 (2011).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model & Mech. 5 (3), 389-396 (2012).
- Ruparelia, A. A., Oorschot, V., Vaz, R., Ramm, G., Bryson-Richardson, R. J. Zebrafish models of BAG3 myofibrillar myopathy suggest a toxic gain of function leading to BAG3 insufficiency. Acta Neuropathol. 128 (6), 821-833 (2014).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum Mol Genet. 21 (21), 4718-4731 (2012).
- Sztal, T. E., Zhao, M., et al. Zebrafish models for nemaline myopathy reveal a spectrum of nemaline bodies contributing to reduced muscle function. Acta Neuropathol. 130 (3), 389-406 (2015).
- Pichler, F. B., Laurenson, S., Williams, L. C., Dodd, A., Copp, B. R., Love, D. R. Chemical discovery and global gene expression analysis in zebrafish. Nat Biotechnol. 21 (8), 879-883 (2003).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nat Biotechnol. 22 (5), 595-599 (2004).
- Kawahara, G., Serafini, P. R., Myers, J. A., Alexander, M. S., Kunkel, L. M. Characterization of zebrafish dysferlin by morpholino knockdown. Biochem Bioph Res Co. 413 (2), 358-363 (2011).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. , (2005).
- Smith, L. L., Beggs, A. H., Gupta, V. A. Analysis of skeletal muscle defects in larval zebrafish by birefringence and touch-evoke escape response assays. J Vis Exp. (82), e50925 (2013).
- Sloboda, D. D., Claflin, D. R., Dowling, J. J., Brooks, S. V. Force measurement during contraction to assess muscle function in zebrafish larvae. J Vis Exp. (77), (2013).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test as a new outcome measure in Duchenne muscular dystrophy. Muscle Nerve. 41 (4), 500-510 (2010).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test and other clinical endpoints in duchenne muscular dystrophy: reliability, concurrent validity, and minimal clinically important differences from a multicenter study. Muscle Nerve. 48 (3), 357-368 (2013).
- Hurd, M. W., Debruyne, J., Straume, M., Cahill, G. M. Circadian rhythms of locomotor activity in zebrafish. Physiol Behav. 65 (3), 465-472 (1998).
- MacPhail, R. C., Brooks, J., Hunter, D. L., Padnos, B., Irons, T. D., Padilla, S. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol. Neurotoxicology. 30 (1), 52-58 (2009).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J Cell Mol Med. 15 (12), 2643-2651 (2011).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Bioph Res Co. 423 (4), 785-788 (2012).
- Ravenscroft, G., Jackaman, C., et al. Mouse models of dominant ACTA1 disease recapitulate human disease and provide insight into therapies. Brain. 134 (4), 1101-1115 (2011).
- Ravenscroft, G., Wilmshurst, J. M., et al. A novel ACTA1 mutation resulting in a severe congenital myopathy with nemaline bodies, intranuclear rods and type I fibre predominance. Neuromuscular Disord. 21 (1), 31-36 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci. 108 (37), 15468-15473 (2011).
- Müller, U. K., van Leeuwen, J. L. Swimming of larval zebrafish: ontogeny of body waves and implications for locomotory development. J Exp Biol. 207 (Pt 5), 853-868 (2004).
- Cheng, W., Tian, J., Burgunder, J. M., Hunziker, W., Eng, H. L. Myotonia congenita-associated mutations in chloride channel-1 affect zebrafish body wave swimming kinematics. PLoS ONE. 9 (8), e103445 (2014).
- Moggio, M., Colombo, I., et al. Mitochondrial disease heterogeneity: a prognostic challenge. Acta Myol. 33 (2), 86-93 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten