Method Article
La medición cuantitativa de los niveles relativos de ácido retinoico en E8.5 embriones y Neurosphere culturas utilizando el ensayo indicador basado en células raras-lacZ F9
En este artículo
Resumen
Methods to accurately measure retinoic acid (RA) levels in small amounts of tissue do not exist. This protocol describes the easy, quantitative measurement of relative RA levels in E8.5 embryos and neurospheres using an RA reporter cell line.
Resumen
Retinoic acid (RA) is an important developmental morphogen that coordinates anteroposterior and dorsoventral axis patterning, somitic differentiation, neurogenesis, patterning of the hindbrain and spinal cord, and the development of multiple organ systems. Due to its chemical nature as a small amphipathic lipid, direct detection and visualization of RA histologically remains technically impossible. Currently, methods used to infer the presence and localization of RA make use of reporter systems that detect the biological activity of RA. Most established reporter systems, both transgenic mice and cell lines, make use of the highly potent RA response element (RARE) upstream of the RAR-beta gene to drive RA-inducible expression of reporter genes, such as beta-galactosidase or luciferase. The transgenic RARE-LacZ mouse is useful in visualizing spatiotemporal changes in RA signaling especially during embryonic development. However, it does not directly measure overall RA levels. As a reporter system, the F9 RARE-LacZ cell line can be used in a variety of ways, from simple detection of RA to quantitative measurements of RA levels in tissue explants. Here we describe the quantitative determination of relative RA levels generated in embryos and neurosphere cultures using the F9 RARE-LacZ reporter cell line.
Introducción
El ácido retinoico (RA) es un derivado de metabolito de retinol o vitamina A y se produce a través de la actividad secuencial de varias deshidrogenasas celulares 1. Debido a su naturaleza química anfipático, que atraviesa fácilmente las membranas de lípidos y puede actuar como un factor morfogenético soluble 1. Es una molécula esencial que regula numerosos procesos celulares de desarrollo y adultas, al actuar como un ligando para los receptores de retinoides nucleares y la activación de la expresión génica 2-10. Sin RA, estos receptores con AR (RAR) RARE se unen en el ADN y actúan como represores; RA unión a estos receptores los convierte en activadores de la transcripción resulta en la expresión de genes objetivo 1,5,6.
Aunque la vía de señalización RA está bien caracterizada, el pequeño tamaño (~ 300 Da) y la naturaleza anfipática de RA hace que la visualización directa histológico y la medición de la AR actualmente técnicamente inviable 11. El único método para direct medición de los niveles de AR es a través del aislamiento de la AR a partir de muestras de tejido utilizando cromatografía líquida de alta resolución (HPLC) 11. Este método requiere normalmente grandes cantidades de tejido, facilitado por la puesta en común de diferentes muestras 12. Por lo tanto, esta técnica es poco adecuado para la medición de los niveles de RA en los embriones individuales o pequeñas cantidades de muestra / tejido.
Con el fin de investigar la función celular de RA, varios métodos han sido desarrollados para inferir indirectamente la presencia de RA. Estos métodos hacen uso de los sistemas de indicador que contiene la gran capacidad de respuesta RAR-beta RARE conducir la expresión de beta-galactosidasa o luciferasa 11,13,14. El ratón transgénico reportero RARE-LacZ generada por Rossant et al. 13 es un sistema ideal para la visualización de regiones espacio-temporales de la señalización de RA in situ 11,13,15,16 pero no es adecuado para mediciones cuantitativas. La línea celular RARO-LacZ F9 14, en tque otra parte, es útil para la detección de la AR y mediciones cuantitativas de los niveles de RA en explantes de tejido 11,12,14,17,18.
Células de teratocarcinoma F9 expresan alfa endógeno, beta, y los receptores del ácido retinoico gamma-19, e inician la diferenciación en endodermo parietal después de la exposición a la AR 19-21. células F9 mucho tiempo se ha establecido como un modelo para la diferenciación celular inducida por RA, por lo que fue elegido como una línea celular ideal para un ensayo indicador de la AR. La línea celular reportera Sil-15 RA F9 derivados generada por Wagner et al. 14 contiene una E. coli'LacZ gen aguas abajo de una copia del elemento de respuesta al ácido retinoico de 64 pb (RARE) del gen del receptor de ácido retinoico beta-humana (RAR-beta). Con el fin de seleccionar y mantener clones estables, el constructo también contiene el gen aminoglucósido fosfotransferasa (NEO r) como un marcador de selección en presencia de G418. Esta construcción confers expresión inducible de b-galactosidasa en presencia de RA, que se puede visualizar a través de la tinción de LacZ y esta respuesta puede ser posteriormente cuantificado usando métodos colorimétricos 11,12,14,18.
Esta línea celular reportera extremadamente versátil ha sido ampliamente utilizado en la detección de la producción endógena RA a través de co-cultivo de las muestras de tejido con las células indicadoras, tales como cocleares 17 y embrionarias explantes placa de suelo 14. Además, esta línea reportero se ha utilizado para la cuantificación de los niveles de RA en la médula espinal en desarrollo mediante el cultivo de secciones agrupados de la médula espinal embrionarias por separado y la adición de medio acondicionado a partir de estos cultivos a células RARE-lacZ F9 18. La cuantificación se realizó después de la tinción de LacZ través de la lectura colorimétrica usando un lector de placas de ELISA convencional 11,12,18. Por último, esta línea celular reportero se ha utilizado en la detección de la presencia de enzimas metabólicas RA por monitoring cambios en los niveles de AR 12,18.
Aquí mostramos que la sensibilidad de este reportero línea celular también permite la medición de los niveles de AR generados a partir de co-cultivaron embriones E8.5 individuales. Esto permite la comparación entre embriones individuales de diferentes genotipos. Como ejemplo específico, Gpr161 es un GPCR huérfano que regula el tubo neural, en parte, a través de la vía de señalización de la AR 22, y se reporta el uso de esta línea celular reportero para investigar el efecto de una mutación recesiva en Gpr161 (Gpr161 VL) en los niveles globales de RA en el embrión. Además de esto, la versatilidad y facilidad de uso de este sistema reportero permite la libertad para medir y comparar los niveles de RA en diferentes muestras de tejido, incluso en cultivos de neuroesferas obtenidos a partir de células madre de la médula espinal del adulto. Aquí se describe la determinación cuantitativa de los niveles relativos de RA en embriones y cultivos de neuroesferas a través de co-cultivo directo con el F9 RARO-LacZ representante de la ARlínea celular Orter.
Protocolo
Todo el trabajo de los animales se realizó de acuerdo con los métodos de Rutgers-RWJMS aprobado IACUC.
1. Solución y Preparación de Medios
- Preparar soluciones madre y de amortiguamiento según la Tabla 1. Preparar soluciones de trabajo de acuerdo con la Tabla 2.
2. Cultura y mantenimiento de células raras-LacZ F9
- Las células congeladas descongelación
- Preparar medio de cultivo celular F9 RARE-LacZ como se detalla en la Tabla 2.
- Coat 10 cm placas de cultivo (cultivo de células tratadas) con 10 ml de 0,2% de gelatina (se refieren a la Tabla 2) durante 30 min a TA. Lavar el exceso de gelatina con dos enjuagues de 10 ml de agua destilada. Inmediatamente añadir 9 ml de medio de cultivo de células F9 RARE-LacZ en el matraz para prevenir la gelatina de secado.
- Descongelar un vial de células RARO-LacZ F9 14 en un baño de agua de 37 ° durante 2 - 3 minutos. Células de la placa (alrededor de 1 x 10 6 células / ml) en el plato recubierto containing 9 ml de medio de cultivo. Cultivo a 37 ° C, 5% de CO 2. Cambiar el medio al día siguiente.
- Mantenimiento de células raras F9-LacZ
- Mantener un paso regular de cada 2 - 3 días en una proporción de 01:10.
Nota: No permita que las células crecen en la confluencia ya que esto dará lugar a su diferenciación. - Dividir los cultivos a una confluencia del 80-90%. Retire el medio y se lavan las células con 10 ml de 1x tampón fosfato salino (PBS). Retire el PBS y añadir 1 ml de tripsina, se incuba durante 5 min. Añadir 9 ml de medio de cultivo, las células de la pipeta hacia arriba y abajo y de división 1:10 para el paso.
- Mantener un paso regular de cada 2 - 3 días en una proporción de 01:10.
- La congelación raras células F9-LacZ
- Tripsinizar un plato de 10 cm que contiene células RARE-lacZ F9 en 80-90% de confluencia, como se detalla en el paso 2.2.2. Transferencia de las células disociadas en un tubo de centrífuga de 15 ml y centrifugado a 200 xg durante 5 min.
- Eliminar el sobrenadante y resuspender el sedimento celular en 10 ml de F9 RARE-LacZ freezing medio (véase la Tabla 2). Alícuota de 1 ml en crioviales etiquetados y viales de transferencia en recipientes de congelación. Coloque la congelación recipiente en -80 ° C congelador O / N y de transferencia de viales a tanques de nitrógeno líquido al día siguiente.
3. La disección de embriones E8.5
- El apareamiento de la jaula Instalación y tapón de revisión
- Puesta en marcha de una jaula de acoplamiento que contiene un par de apareamiento. A la mañana del día siguiente, la verificación de la presencia de un tapón vaginal y designar el día un enchufe se encuentra como el día 23 de 0,5. En E8.5 días, los embriones de cosecha.
- La disección de embriones
- Sacrificar la presa a través dislocación cervical y rociar la zona abdominal con etanol al 70% (ver Tabla 2). Hacer un corte transversal en la piel por encima del abdomen usando tijeras quirúrgicas y tire de las dos aletas separadas (anterior y posterior) para exponer el área abdominal. Hacer un corte similaren el peritoneo para exponer el abdomen.
- Localizar los úteros y liberar úteros de los oviductos y mesometrium usando un par de tijeras 23. Coloque los úteros en una placa de 6 cm (cultivo de células no tratadas) con 10 ml de PBS 1x para lavar el exceso de grasa y la sangre. Transferir a otra placa de 6 cm que contenía 10 ml frescas 1x PBS.
- Separada de un útero que contiene un embrión cortándolo con tijeras quirúrgicas. Retire el útero y decidua y liberar el saco vitelino de embriones que contienen el uso de dos pares de no. 5 fórceps 23.
- Separar el saco vitelino del embrión, y transferir el saco vitelino a un tubo de microcentrífuga de 1,5 ml para la extracción de ADN genómico para ser utilizado para el genotipado. Utilizar una pipeta P20 con una punta de gran calibre, transferir todo el embrión en un tubo de microcentrífuga de 1,5 ml que contiene 10 l de tripsina. Se coloca el tubo en hielo.
- Repita los pasos 3.2.3 - 3.2.4 hasta que todos los embriones han sido disecados.
- La disociación de embriones
- Incubar los tubos de 1,5 ml que contienen embriones en tripsina a 37 ° C durante 5 min para facilitar la disociación enzimática.
- Se tritura suavemente utilizando una pipeta P20 para la disociación mecánica del embrión, y la placa de todo el volumen 10 l que contiene un embrión disociada más de un pocillo de células RARE-lacZ F9 en una placa de 96 pocillos (véase el paso 5.1 para el recubrimiento de las células F9 RARE-lacZ en una placa de 96 pocillos). Cultura O / N a 37 ° C y 5% de CO2.
- Incubar los tubos de 1,5 ml que contienen embriones en tripsina a 37 ° C durante 5 min para facilitar la disociación enzimática.
4. Cable de laminectomía, Disección de Adultos de la columna lumbar y Neurosphere Cultura
- laminectomía
- Sacrificar un ratón adulto (P60) a través de la dislocación cervical.
- Pulverizar el lado dorsal con 70% de etanol y haga un corte transversal utilizando tijeras quirúrgicas. Retirar los dos solapas (anterior y posterior), aparte de exponer la espalda y la columna vertebral.
- Con unas tijeras quirúrgicas, recorte los músculos que cubren la columna vertebral.Ubicar la región lumbar de la médula espinal, debajo de las costillas. Utilizando las tijeras, hacer un corte profundo para cortar la columna vertebral en este punto para exponer la médula espinal.
- Tire hacia arriba de la región lumbar de la columna vertebral con el núm. 5 fórceps manera que la sección transversal expuesta de la médula espinal se enfrenta el experimentador. El uso de las puntas de unas tijeras finas, cortar las vértebras y los músculos en las posiciones de las 3 y las 9 en punto de la parte expuesta. Agarre la aleta dorsal de la vértebra corte con unas pinzas. Continuar estos recortes caudalmente hasta que se expone la longitud de la médula espinal lumbar.
- Liberar la médula espinal de la vértebra sin usar. 5, así como unas pinzas de punta roma. La transferencia de la médula espinal a un tubo de 15 ml que contiene 3 ml de medio / cultivo F12 DMEM. Mantener en hielo hasta que se han aislado todas las médulas espinales lumbares.
- La disección de la médula espinal
- Verter el medio de cultivo con la médula espinal en una placa de 6 cm (cultura no de células tratadas).
- Bajo un microscopio estereoscópico, quitar los ganglios de la raíz dorsal y los vasos sanguíneos alrededor del segmento de la médula espinal agarrando los ganglios y vasos sanguíneos utilizando dos pares de ninguna. 5 fórceps y suavemente tirando de ellos fuera de la médula espinal. Transferir el segmento de la médula espinal a una placa de 6 cm con ningún medio y picar finamente el tejido utilizando una hoja de bisturí.
- Transferencia picada tejido al tubo 15 ml que contiene 1 ml de medio de neuroesferas de disociación (ver Tabla 2). Colocar el tubo en hielo y repita los pasos 4.2.1 - 4.2.2 hasta que todas las médulas espinales han sido procesados.
- Incubar los tubos que contienen tejido picado en medio de disociación a 37 ° C durante 10 min, chasquear el tubo en el lado de mezclar y luego se incuba a 37 ° C durante otros 10 min. Después de la digestión enzimática, se tritura con pipetas pulidas al fuego de diámetros decrecientes para la disociación mecánica.
Nota: Preparar pipetas pulidas al fuego de diámetros decrecientes antes de realizar los experimentos. Tome un vaso Pasteurpipeta y conecte el extremo ancho con algodón limpio. El uso de una lámpara de alcohol, esmalte de fuego las puntas de las pipetas en la llama para crear diferentes diámetros: "regular", "bien", y "extra fino". Para pipetas pulido "normales", girar el extremo de la pipeta en la llama a ronda de los bordes sin disminuir el diámetro (~ 1 mm). Gire el extremo de la pipeta en la llama durante períodos más largos para crear un poco "fino" (~> 1 mm y> 5 mm de diámetro) y "extra fino" (~ 0,5 mm) pipetas pulidos. No utilizar pipetas con un diámetro inferior a 0,5 mm.
- neurosphere Cultura
- Centrifugar los tubos que contienen abajo disociadas del tejido de la médula espinal a 200 xg durante 10 min. Eliminar el sobrenadante y resuspender el sedimento celular en 1 ml de medios de cultivo de neuroesferas (véase la Tabla 2). Se tritura con una pipeta P1,000 seguido de una pipeta P200 para facilitar la disociación.
Nota: Evitar la introducción de burbujas,lo que disminuiría la viabilidad celular. - Transferencia de 10 l de células disociadas en un hemocitómetro y obtener un recuento de células. Células de la placa a una densidad de 1x10 5/10 ml en un matraz T25 con 10 ml de medios de cultivo de neuroesferas. Se incuba a 37 ° C y 5% de CO2 durante 7 días hasta que aparecen neuroesferas 24.
- Centrifugar los tubos que contienen abajo disociadas del tejido de la médula espinal a 200 xg durante 10 min. Eliminar el sobrenadante y resuspender el sedimento celular en 1 ml de medios de cultivo de neuroesferas (véase la Tabla 2). Se tritura con una pipeta P1,000 seguido de una pipeta P200 para facilitar la disociación.
- La disociación neurosphere
- Recoger la cultura neurosphere y transferir a tubos de 15 ml. Girar a 200 xg durante 10 min. Eliminar la mayor parte del sobrenadante dejando 1 ml atrás. Se tritura con una pipeta P1,000 para volver a suspender el sedimento celular y disociar neuroesferas en células individuales. Transferencia de 10 l de células disociadas en un hemocitómetro y obtener un recuento de células.
- Placa 1 x 10 5 células disociadas neurosphere más de un pocillo de F9 RARO-LacZ en una placa de 96 pocillos (ver sección 5.1 para chapado F9 RARO-lacZ en placas de 96 pocillos). Placa 3 pozos como repeticiones. Cultura O / N a 37 ° C y 5% de CO2.
5. RA Ensayo de embriones E8.5 y la médula espinal neuroesferas
- Plating F9 RARO-lacZ en placas de 96 pocillos
- Un día antes de embriones E8.5 cosecha o disociación de neuroesferas, recubrir una placa de 96 pocillos con 100 l de 0,2% de gelatina por pocillo durante 30 min a TA. Aspirar la gelatina y enjuague dos veces con 200 l de agua destilada.
- células RARO-LacZ trypsinize F9 mantuvieron en placas de 10 cm como se detalla en el paso 2.2.2. Placa 1 x 10 5 células / pocillo de células F9-LacZ raro, pero esta vez utilizando medio de cultivo sin G418.
- Preparar suficientes pocillos para co-cultivo de embriones (~ 12-20, dependiendo del tamaño de la camada), neuroesferas (3 pocillos / genotipo), así como para una curva estándar por triplicado (27 pozos).
- Co-cultivo de F9 RARO-LacZ y E8.5 embriones o de la médula espinal neuroesferas
- embriones de cosecha, como se detalla en la sección 3.2 y la placa en la parte superior de F9RARE-lacZ en la placa de 96 pocillos de la sección 5.1. De una manera similar, disociar neuroesferas y la placa en la parte superior de F9 RARE-lacZ en la placa de 96 pocillos como se detalla en el paso 4.4. Cultura O / N a 37 ° C y 5% de CO2.
- Generación de una curva estándar
- Para generar una curva estándar, preparar todo-trans RA (en-RA) soluciones con las siguientes concentraciones: 100 nM, 10 nM, 1 nM, 100 pM, 10 pM, 1 pM, 100 fM, por dilución en serie de la AT- RA de valores (véase la Tabla 1) con medio de cultivo RARO-LacZ F9.
- Añadir 100 l de estos diferentes al-RA concentraciones a las células RARO-LacZ F9 de la sección 5.1. Asignar los pozos que contienen células RARO-LacZ F9 sin tratar como control negativo. Preparar triplicados de cada concentración de RA y pocillos de control negativo. Cultura O / N a 37 ° C y 5% de CO2.
Nota: Las celdas RARO-LacZ F9 responden de manera lineal dependiente de la dosis a diferentes concentraciones de RA todo-trans.
- Ensayo de la AR
- Después del cultivo O / N de la placa de 96 pocillos que contiene las curvas de nivel y co-cultivos, extraiga el soporte y fijar las culturas mediante la adición de 100 l de glutaraldehído al 2,5% (ver Tabla 2) durante 15 min, RT. Retire el fijador y lavar dos veces con 200 l de PBS 1x, 10 minutos por lavado.
- Quitar PBS y se lava tres veces con 200 l de la solución de lavado LacZ (véase la Tabla 2), 10 min por lavado. Durante el tercer lavado, preparar la solución de tinción X-gal en un tubo de 15 ml envuelto en papel de aluminio (ver Tabla 2). Calcular la cantidad de solución de tinción que se necesita y preparar la cantidad adecuada (200 l / pocillo).
Nota: La solución de tinción X-gal es sensible a la luz. Utilice la solución de tinción en los 15 minutos después de su preparación. - Preparar una cámara húmeda mediante la colocación de una toalla de papel humedecido con agua destilada en un recipiente de plástico suficientemente grande para contener una placa de 96 pocillos. Añadir 200 l de la Xsolución de tinción gal por pocillo de la placa de 96 pocillos y colocar la placa en una cámara humidificada.
- Incubar cámara humidificada que contiene la placa de 96 pocillos a 37 ° C para permitir el desarrollo de un precipitado de color azul. Para los embriones E8.5, se incuba la placa de O / N (12 - 16 h). Para neurosphere culturas, incubar la placa durante 4 - 8 horas.
- La lectura de la absorbancia a OD 610 y Imaging
- Después de la reacción de color, eliminar la solución de tinción de LacZ y reemplazar con 200 l de PBS 1x. Medir la absorbancia a 610 nm usando un lector de placas estándar ELISA para cuantificar la respuesta reportero a la AR. Image pocillos individuales usando un estereomicroscopio estándar equipado con una cámara.
6. La subclonación de células raras F9-LacZ
- Comprobación F9 RARO-LacZ rResponse a la AR
- Antes de empezar cualquier experimento, probar la respuesta de las células RARO-LacZ F9 para la AR. Placa F9 RARO-LacZ cells en placas de 96 pocillos (ver sección 5.1), y se añade 1 nM todo-trans del ácido retinoico (véase el paso 5.3). Incubar en una cámara húmeda a 37 ° CO / N.
- Visualizar el desarrollo de un precipitado de color azul usando un microscopio. Si el desarrollo del color no es uniforme en las células en el pozo (véase la figura 1B, a la izquierda), lleve a cabo la subclonación se detalla a continuación.
- Subclonación de células raras F9-LacZ
- Dividir las células RARO-LacZ F9 cultivadas en placas de 10 cm como se detalla en el paso 2.2.2. En lugar de una relación de 01:10, la placa una densidad de siembra de baja de 1 x 10 5 células / 10 ml en una placa de 10 cm para permitir el crecimiento de colonias aisladas de tal manera que cada colonia surge de una célula RARE-LacZ solo F9.
- Después de dos días, capa una placa de 24 pocillos con 500 l de 0,2% de gelatina por pocillo durante 30 min. Retire la solución de gelatina y enjuague pocillos dos veces con 500 l de agua destilada. Reemplazar el agua con 500 l de medio de cultivo de células F9 RARO-LacZ.
- Escoja una colonia con una punta de pipeta estéril P10 y la transferencia en un pocillo; hacer esto 24 veces para obtener 24 colonias individuales. Cultivo a 37 ° C, 5% de CO2 durante 3 - 4 días.
- Dividir las colonias individuales en dos placas de 24 pocillos. Después de 2 días de cultivo, añadir 1 nM de la AR a cada pocillo de una placa y cultivo de 24 pocillos O / N. Realizar tinción de LacZ como se detalla en la sección 5.4 para la prueba de alta respuesta. Visualizar reacción de color de cada pocillo bajo un microscopio para determinar la respuesta fuerte y uniforme.
- Una vez que se determina una fuerte respuesta subclón, expandir el cultivo correspondiente de la otra placa de 24 pocillos. ampliar aún más esa colonia en una placa de 10 cm, el congelamiento hasta varios viales como se detalla en la sección 2.3, y desechar todas las otras colonias.
Nota: Sólo alrededor de una cuarta parte de las colonias originales resultar en altos respondedores. Típicamente, la primera ronda de la subclonación no da como resultado la tinción de LacZ uniforme y una ronda posterior de la subclonación se necesita hacer paralograr respondedores fuertes uniformes.
Resultados
El reportero RARE-LacZ F9 es una línea celular de carcinoma embrionario adherente crecido en la superficie recubierta con gelatina. El constructo reportero permite que las células responden cuantitativamente a RA con una inducción proporcional de beta-galactosidasa. 11,12,14,18. Estas células muestran una morfología epitelial (Figura 1A). Debido a su alta tasa de duplicación, se recomienda que estas células pueden dividir cada 2 - 3 días en una proporción de 1:10. Durante nuestro trabajo con esta línea celular reportero, se ha observado que incluso con la adición de G418 al medio de cultivo, la respuesta de estas células a RA se debilita después de varios pasajes (Figura 1B, izquierda), y esto puede afectar la capacidad reportero de esta línea celular. Esta pérdida de la capacidad de respuesta puede ser debido a la pérdida parcial del transgén en pasajes posteriores. A medida que ello sea necesario, subclonación periódica para asegurar que responden fuerte y uniforme a la AR (Figura1B, derecha).
Si bien varios usos de esta línea celular ha sido publicado previamente 12,14-18, se informó aquí es el uso de esta línea celular para medir los niveles de AR endógenos a partir de embriones E8.5 individuales con diferentes genotipos. Los resultados Gpr161 vl / vl de mutación en disminuyeron embrionario de señalización 22 RA. Como se muestra por co-cultivo de embriones con células disociadas RARE-lacZ F9, estos Gpr161 vl / vl embriones han reducido endógeno RA en comparación con compañeros de camada de tipo silvestre (Figura 2A). Debido a la versatilidad de esta línea celular reportero, también informado aquí es un nuevo uso de estas células para detectar los niveles de RA producidos por cultivos de neuroesferas obtenidos de adulto Gpr161 ratones peso / peso (Figura 2B). Esta línea celular reportera fue capaz de demostrar que los cultivos de neuroesferas de células madre adultas de la médula espinal producen AR endógeno. La gran diffrencia en la intensidad de la tinción indica una mayor respuesta de células reportero de neuroesferas de la médula espinal en comparación con los embriones E8.5. Esto puede ser debido a niveles mucho mayores RA generadas por las neuroesferas con el tiempo en comparación con los embriones E8.5, que podría ser debido al hecho de que neuroesferas culturas son más homogéneos que los embriones E8.5 y por lo tanto contienen más células RA-productores.
La adición de diferentes concentraciones de los resultados a-RA en una respuesta lineal dependiente de la dosis de las células indicadoras. Esta respuesta se puede medir colorimétricamente mediante la lectura de la absorbancia a 610 nm. La curva patrón generada se puede usar para cuantificar los niveles de RA en las muestras, tales como en cultivos de tipo salvaje de neuroesferas (Figura 3A) o embriones E8.5 (Figura 3B).
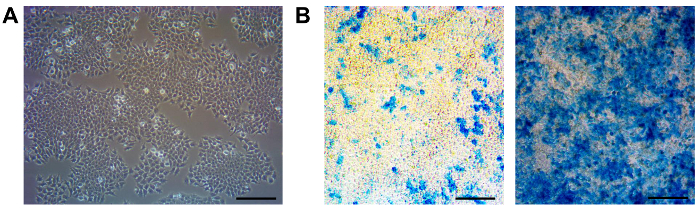
Figura 1. Maintenance y Subclonación de células raras-LacZ F9. (A) Se muestra una imagen de contraste de fase de células raras-LacZ F9. Estas células tienen un tiempo de duplicación de ~ 10 hr y se deben pasar cada 3 días. (Aproximadamente 70-80% de confluencia) en una relación 01:10 (B) un control periódico de los cultivos con la adición de 1 nM a-RA y posterior LacZ La tinción se debe hacer para garantizar culturas permanecen respondedores fuertes y uniformes para la AR (derecha). En caso de respuesta deficiente y no uniforme (izquierda), subclonación debe ser realizada. Escala de barras de 100 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
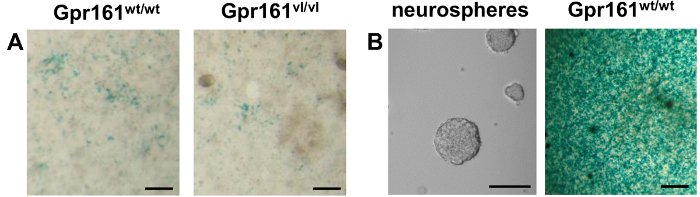
Las muestras Figura 2. La tinción de LacZ co-cultivadas (disociada E8.5 embriones / neuroesferas) y F9 células raras-LacZ. (A) de embriones de ratón E8.5 s de varios genotipos se disocia y se sembró en la parte superior de las células RARO-LacZ F9. Tinción de LacZ 24 horas más tarde permite la visualización de la respuesta de las células F9 RARO-LacZ a endógenos producidos por RA muestras co-cultivadas. El Gpr161 vl mutación da lugar a la disminución de la AR endógeno tal como puede verse por la disminución de la respuesta de las células reportero. (B) a la izquierda. Se muestra una imagen de contraste de fase de neuroesferas cultivadas a partir de células madre neurales adultas de la médula espinal. Derecha. Neuroesferas derivadas de la médula espinal adulta Gpr161 peso / peso se disocian y se colocaron en la parte superior de las células RARO-LacZ F9. La presencia de precipitado azul después de la tinción de LacZ indica la presencia de RA endógeno en estas neuroesferas. La diferencia en la intensidad de la tinción entre neurosphere y de los embriones E8.5 co-cultivos indican mayores niveles de RA presentes en neuroesferas que los embriones E8.5. Escala de barras de 100 micras.target = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Curva estándar y colorimétrico cuantificación de los niveles de AR. La respuesta de la línea celular reportera F9 RARE-LacZ se pueden medir colorimétricamente a 610 nm utilizando un lector de placas ELISA estándar. (A) curva estándar representativo utilizado para cuantificar los niveles relativos de RA de tipo salvaje neurosphere cultura s. (B) Cuantificación de los niveles relativos de RA co-cultivaron embriones E8.5. N = 3; * P <0,05, prueba t de Student. Las barras de error de SEM. Haga clic aquí para ver una versión más grande de esta figura.
| stoSeparadores ck / Soluciones | componentes | Condiciones de almacenaje |
| 10% de monohidrato de desoxicolato de sodio (C 24 H 39 NaO 4 · H 2 O) | 10 ml en 100 ml dH2O | 4 ºC |
| Cloruro de magnesio 1 M (MgCl 2) | RT | |
| 100x ferrocianuro de potasio (K 4 [Fe (CN) 6] · 3H 6 O) | 2,12 g en dH 10 ml 2 O | TA en la oscuridad |
| 100x ferricianuro de potasio (K 3 [Fe (CN) 6]) | 1,64 g en dH 10 ml 2 O | TA en la oscuridad |
| 20 mg / ml de X-gal (5-bromo-4-cloro-3-indolil-β-D-galactopiranósido) | añadir 5 ml de dimetilformamida para hacer 20 mg solución madre / ml | -20 ºC |
| 10 mM (3 mg / ml) todo-trans ácido retinoico | Disolver 50 mg de 16,67 ml de etanol absoluto. Preparar alícuotas de 1 ml. | -80 ºC en la oscuridad, en tubos de 1,5 ml de color ámbar de microcentrífuga |
| Papaína | disolver un vial de 7 ml de HBSS | 4 ºC |
Tabla 1. Los tampones y composiciones en solución.
| Trabajando Separadores / Soluciones | componentes | Condiciones de almacenaje |
| medio de cultivo de células F9 RARO-LacZ | 50 ml de suero bovino fetal (FBS) (concentración final 10%) | Filtrar a esterilizar. |
| 5 ml 100x penicilina estreptomicina (Final conc 1X) | Almacenar a 4 ° C. | |
| 4ml 50 mg / ml G418 (Final conc 0,4 mg / ml) | ||
| a 500 ml de DMEM / F-12 (con L-glutamina y HEPES) | ||
| 0,2% de gelatina | 25 ml 2,0% de gelatina | Almacenar a 4 ° C. |
| 80 ml de agua destilada | ||
| Mezclar bien | ||
| 70% de etanol | 30 ml 95% de etanol | Colocar en botella de spray. |
| 70 ml de agua destilada | Almacenar a temperatura ambiente | |
| medio de disociación Neurosphere | 1 ml 20U papaína | preparar fresca cada vez |
| 100 l 13 mg / ml de tripsina | ||
| 100 l 7 mg de ácido hialurónico / ml | ||
| 28 l 10 mg / ml DNaseI | ||
| 50 l 4 mg / ml de ácido quinurénico | ||
| medio de cultivo de neuroesferas | DMEM / F-12 (con L-glutamina y HEPES) | preparar fresca cada vez |
| 2% de suplemento B-27 | ||
| 20 factor de ng / ml de crecimiento de fibroblastos (FGF) | ||
| 20 ng del factor de crecimiento epidérmico (EGF) | ||
| 2,5% de glutaraldehído | 250 l 50% de glutaraldehído | preparar fresca cada vez |
| 4750 l de 1x PBS | ||
| solución de lavado LacZ | 0,5 ml 10% de desoxicolato (concentración final 0,1%) | Almacenar a 4 ° C. |
| 1,0 ml 100% NP-40 (final de conc 0,2%) | ||
| 50 ml de 10X PBS | ||
| agua destilada a 500 ml | ||
| solución de tinción X-gal | ferrocianuro de potasio 1x | preparar fresca cada vez |
| ferricianuro de potasio 1x | ||
| 1 mg / ml de X-gal | ||
| al volumen apropiado el uso de solución de lavado LacZ | ||
| F9 medio de congelación RARO-LacZ | F9 medio de cultivo RARO-lacZ + 5% de DMSO | preparar fresca cada vez |
Tabla 2. buffer de trabajo y composiciones en solución.
Discusión
La línea celular RARE-LacZ F9 14 es un potente sistema que se puede utilizar para la detección de la AR producido por explantes de tejido 12,14,17,18. Es sensible a concentraciones tan bajas como RA 100 fM, sin respuesta no específica detectada en las células no tratadas con RA 12,14,18. Además, las células reportero responden a todo-trans RA de una manera lineal dentro de un rango específico de concentración, permitiendo así que la reacción de LacZ a cuantificarse y utilizarse para determinar la magnitud de los niveles de AR 12,14,18. El ensayo de indicador RA rápido y fácil que aquí se presenta utiliza la línea de células F9 reportero lacZ-RARE para la visualización (Figura 2) y la medición cuantitativa relativa (Figura 3) de los embriones y células madre neurales adultas cultivadas. Este sistema reportero permite la comparación de los niveles de AR endógenos entre las muestras individuales, como se muestra en la Figura 2. Es lo suficientemente sensible para ser capaz de detectar RAgenerada por embriones individuales E8.5 (Figura 2A), así como RA producidos por neuroesferas cultivadas (Figura 2B). La respuesta dependiente de la dosis de esta línea celular a concentraciones variables de RA permite la cuantificación de los niveles de RA (figura 3A) en las muestras así como la comparación de los niveles de AR relativa entre las muestras (Figura 3B). Es importante tener en cuenta que la línea celular reportera RARE F9 mide la cantidad total de la AR generada por las muestras de tejido durante el tiempo de incubación. Esto es equivalente al saldo neto de la síntesis de la AR y el catabolismo.
Si bien el sistema reportero de células raras-LacZ F9 es altamente sensible y versátil, hay varios pasos de solución de problemas críticos que hemos incorporado a fin de garantizar la fiabilidad de este sistema. En primer lugar, como se muestra en la Figura 1, es importante para mantener la salud de estas células por pasajes regulares sin dejar que gremar hasta la confluencia. En segundo lugar, hemos observado después pasajes tienden a resultar en respuestas RA inconsistentes, incluso si los cultivos se mantienen constantemente bajo selección con G418. Para solucionar este problema, se recomienda descartar los cultivos después de 20 pasajes y descongelar un nuevo vial. Además, los controles regulares deben llevarse a cabo para asegurar que las células reportero siguen siendo fuertes en responder a la presencia de la AR en los medios de comunicación. En tercer lugar, si los primeros pasajes muestran respuesta pobre o no uniforme a la AR (Figura 1B, a la izquierda), una o varias rondas de subclonación puede ser necesario hasta respondedores fuertes se obtienen (Figura 1B, t righ). Por último, antes de co-cultivo, se recomienda que las muestras de tejido, tales como embriones y neuroesferas se disocian a las células individuales. Hemos observado que la disociación de las muestras los resultados en mediciones colorimétricas más consistentes. Esto puede ser debido a una distribución más uniforme de la AR en los pocillos de cultivo, ya que las células disociadas son en uniformulario de contacto con las células indicadoras.
También se hicieron varias modificaciones al protocolo original 14. En primer lugar, la respuesta de las células RA RARO-LacZ F9 se cuantificaron mediante la fijación directa de las células y midiendo la absorbancia a 610 nm en lugar de recoger las células y el análisis de lisado para la actividad b-galactosidasa 14. Otra modificación es el co-cultivo directo de las muestras disociadas con F9 RARO-LacZ antes de la cuantificación de la respuesta de la AR. Los métodos anteriores informaron cultivo de las muestras por separado y añadiendo solamente los medios de comunicación de estos cultivos a F9 RARO-LacZ 16,18.
A pesar de ser un sistema de gran alcance, el ensayo reportero lacZ RARO-F9 tiene varias limitaciones. Una limitación de esta línea celular reportera es que a pesar de que responde fuertemente a la presencia de todo-trans RA, sino que también responde a otros isómeros de ácido retinoico, incluyendo 9-cis-RA y 13-cis-RA; sin embargo, son 100 veces más sensible a todo-trans RA comparojo para los otros isómeros 18. Otra limitación de este sistema es que la respuesta dependiente de la dosis lineal solamente cae entre 10 -13 M a 10 -7 M en-RA 14,18; Por lo tanto, si la comparación de los niveles de AR fuera de estos límites, puede ser necesario realizar una dilución en serie de la muestra hasta que las mediciones caen dentro del rango lineal. Por último, ya que éste es principalmente un ensayo colorimétrico, el punto final de desarrollo del color puede variar entre muestras y experimentos. Por lo tanto, es importante que una curva estándar siempre ser plateado en paralelo para cada experimento con el fin de utilizarlo para la cuantificación de la respuesta de células reportero.
En conclusión, se ha informado del uso de la línea celular reportero lacZ RARO-RA F9 para medir los niveles de AR cuantitativamente en embriones E8.5 y, no declarada previamente, en neuroesferas. La versatilidad de este sistema reportero puede permitir la cuantificación de los niveles de RA en prácticamente cualquier tipo de célula o tejido, y may como resultado el desarrollo de diversas aplicaciones en el futuro.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We would like to acknowledge Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) for providing us with the F9 RARE-LacZ cells and technical support. This study is funded by the New Jersey Commission on Spinal Cord Research (NJCSCR) (Grantnumber:10-3092-SCR-E-0) and the New Jersey Commission on Brain Injury Research (NJCBIR) (Grant number: CBIR13FEL006).
Materiales
| Name | Company | Catalog Number | Comments |
| C3H/HeSn-Gpr161vl/J mouse strain | Jackson Laboratory | 000316 | |
| F9 RARE-LacZ reporter cell line | from Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) | ||
| DMEM/F-12 (with L-glutamine and HEPES) | ThermoFisher Scientific | 11330-057 | |
| Fetal Bovine Serum (FBS), qualified | ThermoFisher Scientific | 26140-079 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; warm in 37 °C for media preparation |
| Penicillin/Streptomycin | ThermoFisher Scientific | 15140-122 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; light-sensitive |
| G418 | ThermoFisher Scientific | 10131-027 | Store at 4 °C; light-sensitive |
| 2% Gelatin | Sigma Aldrich | G1393 | Store at 4 °C |
| B-27 supplement (2 % stock solution) | ThermoFisher Scientific | 17504-044 | Store at -20 °C in 1-ml aliquots to avoid repeated freeze-thaw; warm at room temperature for media preparation |
| Murine Epidermal Growth Factor (EGF) | PeproTech | 315-09 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1xPBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| Murine Fibroblast Growth Factor (FGF)-basic | PeproTech | 450-33 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1x PBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| 50% glutaraldehyde | Amresco | M155 | Store at 4 °C |
| Sodium deoxycholate monohydrate (C24H39NaO4 · H2O) | Sigma Aldrich | D5670 | Store at RT |
| X-gal (5-bromo-4-chloro-3-indolyl-β-d-galactopyranoside) | Promega | V3941 | Store stock at -20 °C |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | 41639 | Store at RT |
| all-trans Retinoic Acid (at-RA) | Sigma Aldrich | R-2625 | Store 1 ml aliquots of stock in -80 °C; extremely sensitive to light |
| TrypLE Express | ThermoFisher Scientific | 12605-010 | Store at RT |
| 0.25% trypsin-EDTA | ThermoFisher Scientific | 25200-056 | alternative to TrypLE Express; aliquot and store at -20 °C |
| Hank's Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14170-112 | Store at 4 °C |
| 10x phosphate buffered solution (PBS) | ThermoFisher Scientific | 10010-023 | Store at 4 °C |
| Papain | Worthington | LK003176 | Store at 4 °C. |
| Trypsin | Worthington | LS003703 | Store in 1 ml aliquots at -20 °C. |
| Hyaluronic acid | Calbiochem | 385908 | Store 200 μl aliquots at -20 °C. |
| DNaseI | Worthington | LS002139 | Store in 200 μl aliquots at -20 °C |
| Kynurenic acid | Sigma Aldrich | K3375 | Store in 200 μl aliquots at -20 °C |
| 95% ethanol | |||
| Mr. Frosty Freezing container | ThermoFisher Scientific | 5100-0001 | |
| 10 cm culture dish (non-cell culture treated) | |||
| 10 cm culture dish (cell culture treated) | |||
| 6 cm culture dish (non-cell culture treated) | |||
| 96-well cell culture plates | |||
| 1.5 ml microcentrifuge tubes | |||
| 1.5 ml amber microcentrifuge tubes | |||
| 1.5 ml cryovials | |||
| 37 °C water bath | |||
| surgical scissors | |||
| fine surgical scissors | |||
| no. 5 forceps | |||
| blunt-ended forceps | |||
| scalpel blade | |||
| glass pasteur pipettes | |||
| cotton | |||
| alcohol lamp | |||
| ELISA plate reader | |||
| stereomicroscope |
Referencias
- Vilhais-Neto, G. C., Pourquie, O. Retinoic acid. Curr Biol. 18 (5), R191-R192 (2008).
- Drager, U. C. Retinoic acid signaling in the functioning brain. Science Signalling. 324, 1-3 (2006).
- Lane, M. A., Bailey, S. J. Role of retinoid signalling in the adult brain. Prog Neurobiol. 75 (4), 275-293 (2005).
- Maden, M. Retinoid signalling in the development of the central nervous system. Nat Rev Neurosci. 3 (11), 843-853 (2002).
- Maden, M. Retinoids and spinal cord development. J Neurobiol. 66 (7), 726-738 (2006).
- Rhinn, M., Dolle, P. Retinoic acid signalling during development. Development. 139 (5), 843-858 (2012).
- Ang, H. L., Deltour, L., Hayamizu, T. F., Zgombic-Knight, M., Duester, G. Retinoic acid synthesis in mouse embryos during gastrulation and craniofacial development linked to class IV alcohol dehydrogenase gene expression. J Biol Chem. 271 (16), 9526-9534 (1996).
- Ang, H. L., Duester, G. Stimulation of premature retinoic acid synthesis in Xenopus embryos following premature expression of aldehyde dehydrogenase ALDH1. Eur J Biochem. 260, 227-234 (1999).
- Bastien, J., Rochette-Egly, C. Nuclear retinoid receptors and the transcription of retinoid-target genes. Gene. 328, 1-16 (2004).
- Chatzi, C., Cunningham, T. J., Duester, G. Investigation of retinoic acid function during embryonic brain development using retinaldehyde-rescued Rdh10 knockout mice. Dev Dyn. 242 (9), 1056-1065 (2013).
- Sakai, Y., Drager, U. C. Detection of retinoic acid catabolism with reporter systems and by in situ hybridization for CYP26 enzymes. Methods Mol Biol. 652, 277-294 (2010).
- Yamamoto, M., Drager, U. C., McCaffery, P. A novel assay for retinoic acid catabolic enzymes shows high expression in the developing hindbrain. Dev Biol Res. 107, 103-111 (1998).
- Rossant, J., Zirngibl, R., Cado, D., Shago, M., Giguere, V. Expression of a retinoic acid response element-hsplacZ transgene defines specific domains of transcriptional activity during mouse embryogenesis. Genes & Dev. 5, 1333-1344 (1991).
- Wagner, M., Han, B., Jessel, T. M. Regional differences in retinoid release from embryonic neural tissue detected by an in vitro reporter assay. Development. 116, 55-66 (1992).
- Luo, T., Wagner, E., Crandall, J. E., Drager, U. C. A retinoic-acid critical period in the early postnatal mouse brain. Biol Psychiatry. 56 (12), 971-980 (2004).
- Luo, T., Wagner, E., Grun, F., Drager, U. C. Retinoic acid signaling in the brain marks formation of optic projections, maturation of the dorsal telencephalon, and function of limbic sites. J Comp Neurol. 470 (3), 297-316 (2004).
- Kelley, M. W., Xu, X. M., Wagner, M. A., Warchol, M. E., Corwin, J. T. The developing organ of Corti contains retinoic acid and forms supernumerary hair cells in response to exogenous retinoic acid in culture. Development. 119, 1041-1053 (1993).
- McCaffery, P., Drager, U. C. Hot spots of retinoic acid synthesis in the developing spinal cord. Proc Natl Acad Sci. 91, 7194-7197 (1994).
- Hu, L., Gudas, L. J. Cyclic AMP analogs and retinoic acid influence the expression of retinoic acid receptor alpha, beta, and gamma mRNAs in F9 teratocarcinoma cells. Mol Cell Biol. 10 (1), 391-396 (1990).
- Martin, G. R. Teratocarcinomas and mammalian embryogenesis. Science. 209 (4458), 768-776 (1980).
- Strickland, S., Mahdavi, V. The induction of differentiation in teratocarcinoma stem cells by retinoic acid. Cell. 15 (2), 393-403 (1978).
- Li, B. I., et al. The orphan GPCR, Gpr161, regulates the retinoic acid and canonical Wnt pathways during neurulation. Dev Biol. 402 (1), 17-31 (2015).
- Hogan, B., Constantini, F., Lacy, E. Manipulating the Mouse Embryo: A Laboratory Manual. , 1st, Cold Spring Harbor Laboratory. (1986).
- Deleyrolle, L. P., Reynolds, B. A. Isolation, expansion, and differentiation of adult Mammalian neural stem and progenitor cells using the neurosphere assay. Methods Mol Biol. 549, 91-101 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados