Method Article
Misurazione quantitativa dei livelli relativi dell'acido retinoico nelle E8.5 embrioni e neurosfere Culture Utilizzando il F9 RARE-LacZ cellulare a base di Reporter Assay
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Methods to accurately measure retinoic acid (RA) levels in small amounts of tissue do not exist. This protocol describes the easy, quantitative measurement of relative RA levels in E8.5 embryos and neurospheres using an RA reporter cell line.
Abstract
Retinoic acid (RA) is an important developmental morphogen that coordinates anteroposterior and dorsoventral axis patterning, somitic differentiation, neurogenesis, patterning of the hindbrain and spinal cord, and the development of multiple organ systems. Due to its chemical nature as a small amphipathic lipid, direct detection and visualization of RA histologically remains technically impossible. Currently, methods used to infer the presence and localization of RA make use of reporter systems that detect the biological activity of RA. Most established reporter systems, both transgenic mice and cell lines, make use of the highly potent RA response element (RARE) upstream of the RAR-beta gene to drive RA-inducible expression of reporter genes, such as beta-galactosidase or luciferase. The transgenic RARE-LacZ mouse is useful in visualizing spatiotemporal changes in RA signaling especially during embryonic development. However, it does not directly measure overall RA levels. As a reporter system, the F9 RARE-LacZ cell line can be used in a variety of ways, from simple detection of RA to quantitative measurements of RA levels in tissue explants. Here we describe the quantitative determination of relative RA levels generated in embryos and neurosphere cultures using the F9 RARE-LacZ reporter cell line.
Introduzione
L'acido retinoico (RA) è un derivato metabolita di retinolo o vitamina A ed è prodotto attraverso l'attività sequenziali di diversi deidrogenasi cellulari 1. A causa della sua natura chimica amphiphatic, attraversa facilmente le membrane lipidiche e può agire come fattore morfogenetico solubile 1. E 'una molecola essenziale che regola numerosi processi cellulari sviluppo e adulti agendo come ligando per i recettori nucleari dei retinoidi e attivazione genica 2-10. Senza RA, questi recettori RA (RAR) RARE legano a DNA e ad agire come repressori; RA legandosi a questi recettori li trasforma in attivatori trascrizionali conseguente obiettivo di espressione genica 1,5,6.
Anche se il percorso di segnalazione RA è ben caratterizzato, le piccole dimensioni (~ 300 Da) e la natura amphipathic di RA rende la visualizzazione diretta istologico e la misurazione di RA attualmente tecnicamente irrealizzabile 11. L'unico metodo per direct misurazione dei livelli di Ra è attraverso l'isolamento di RA da campioni di tessuto mediante cromatografia liquida ad alte prestazioni (HPLC) 11. Questo metodo richiede tipicamente grandi quantità di tessuto, facilitato mettendo in comune diversi campioni 12. Così, questa tecnica è poco adatta per la misurazione dei livelli di RA nei singoli embrioni o piccole quantità di campione / tessuto.
Per studiare la funzione cellulare di RA, vari metodi sono stati sviluppati per inferire indirettamente la presenza di RA. Questi metodi fanno uso di sistemi giornalista che contengono il altamente reattivo RAR-beta RARE guida l'espressione di beta-galattosidasi o luciferasi 11,13,14. Il topo transgenico giornalista RARE-LacZ generato da Rossant et al. 13 è un sistema ideale per la visualizzazione regioni spazio-temporali di segnalazione RA in situ 11,13,15,16, ma non è adatto per misurazioni quantitative. La linea cellulare RARE-LacZ F9 14, su tlui, invece, è utile per il rilevamento di RA e misurazioni quantitative dei livelli di RA in espianti di tessuto 11,12,14,17,18.
Cellule teratocarcinoma F9 esprimono alfa endogena, beta, e acido gamma-retinoico recettori 19, e avviare la differenziazione in parietale endoderma dopo l'esposizione al RA 19-21. cellule F9 sono stati da tempo stabilito come modello per la differenziazione cellulare indotta dal RA, è per questo che è stato scelto come una linea cellulare ideale per un test RA giornalista. La linea cellulare giornalista F9-derivato Sil-15 RA generato da Wagner et al. 14 contiene una E. coli'LacZ gene a valle di una copia del retinoico elemento di risposta acido 64-bp (RARE) del gene del recettore beta dell'acido retinoico umano (RAR-beta). Al fine di selezionare e mantenere cloni stabili, il costrutto contiene inoltre il gene aminoglicoside fosfotransferasi (r NEO) come marcatore selezionabile in presenza di G418. Questo costrutto confers espressione inducibile di b-galattosidasi in presenza di RA, che può essere visualizzato mediante colorazione LacZ e questa risposta può essere successivamente quantificata utilizzando metodi colorimetrici 11,12,14,18.
Questa linea cellulare giornalista estremamente versatile è stato ampiamente utilizzato nella rilevazione della produzione RA endogena tramite co-coltura di campioni di tessuto con le cellule giornalista, come cocleari 17 e embrionali espianti piatto piano 14. Inoltre, questa linea giornalista è stato utilizzato per la quantificazione dei livelli di RA in via di sviluppo midollo spinale coltivando sezioni pool di midolli spinali embrionali separatamente e l'aggiunta di mezzi condizionati da queste culture a cellule rare-LacZ F9 18. La quantificazione è stata eseguita dopo LacZ colorazione attraverso la lettura colorimetrica utilizzando un lettore di piastre ELISA standard 11,12,18. Infine, questa linea cellulare giornalista è stato utilizzato nella rilevazione della presenza di RA enzimi metabolici monitoring cambiamenti nei livelli di RA 12,18.
Qui riportiamo che la sensibilità di questa linea cellulare giornalista consente anche per la misurazione dei livelli di RA generati dai singoli embrioni E8.5 co-coltura. Ciò permette il confronto tra i singoli embrioni di diversi genotipi. Come esempio specifico, Gpr161 è un GPCR orfano che regola neurulazione in parte attraverso il percorso di segnalazione RA 22, e riportiamo utilizzare questa linea cellulare giornalista per indagare l'effetto di una mutazione recessiva in Gpr161 (Gpr161 vl) sui livelli di RA complessivi del embrione. In aggiunta a questo, la versatilità e la facilità d'uso di questo sistema reporter permette la libertà di misurare e confrontare i livelli di RA in diversi campioni di tessuto, anche in colture di neurosfere ottenute da cellule staminali adulte del midollo spinale. Qui si descrive la determinazione quantitativa dei livelli relativi RA negli embrioni e culture neurosfere attraverso co-coltura diretto con il F9 RARE-LacZ RA replinea cellulare Orter.
Protocollo
Tutto il lavoro animale è stato fatto secondo i metodi Rutgers-RWJMS IACUC approvati.
1. Soluzione e Media Preparazione
- Preparare soluzioni tampone e come da Tabella 1. Preparare le soluzioni di lavoro come da Tabella 2.
2. Cultura e manutenzione di cellule rare F9-LacZ
- Cellule congelate scongelamento
- Preparare F9 mezzo di coltura cellulare RARE-LacZ come indicato nella tabella 2.
- Coat 10 cm piatti di coltura (coltura di cellule trattati) con 10 ml di 0,2% di gelatina (vedi tabella 2) per 30 minuti a temperatura ambiente. Lavare l'eccesso di gelatina con due risciacqui di 10 ml di acqua distillata. Immediatamente aggiungere 9 ml di mezzo di coltura cellulare F9 RARE-LacZ nel pallone per impedire la gelatina da essiccazione.
- Scongelare una fiala di cellule rare-LacZ F9 14 in un bagno d'acqua a 37 ° per 2 - 3 min. Cellule piastra (circa 1 x 10 6 cellule / ml) nel piatto rivestito containing 9 ml di terreno di coltura. Cultura a 37 ° C, 5% di CO 2. Cambiare la media il giorno successivo.
- Manutenzione di F9 cellule rare-LacZ
- Mantenere un regolare passaggio ogni 2 - 3 giorni in un rapporto di 1:10.
Nota: Non lasciate che le cellule crescono in confluenza come questo si tradurrà in loro differenziazione. - Dividere le culture ad una confluenza del 80-90%. Rimuovere il supporto e lavare le cellule con 10 ml di 1x tampone fosfato salino (PBS). Rimuovere il PBS e aggiungere 1 ml di tripsina, incubare per 5 min. Aggiungere 9 ml di terreno di coltura, pipetta su e giù e dividere le celle 01:10 per il passaggio.
- Mantenere un regolare passaggio ogni 2 - 3 giorni in un rapporto di 1:10.
- Congelamento F9 cellule rare-LacZ
- Trypsinize un piatto di 10 centimetri contenente cellule rare-LacZ F9 a 80 - 90% confluenza come descritto al punto 2.2.2. Trasferire le cellule dissociate in un 15 ml provetta da centrifuga e far girare a 200 xg per 5 min.
- Rimuovere il surnatante e risospendere pellet cellulare in 10 ml di F9 RARE-LacZ freezing media (vedi tabella 2). Aliquota 1 ml in cryovials etichettati e fiale di trasferimento in contenitori di congelamento. Posizionare il congelamento contenitore -80 ° C congelatore O / N e di trasferimento fiale di serbatoi di azoto liquido il giorno successivo.
3. La dissezione di E8.5 embrioni
- Accoppiamento Cage Set-up e tappo di controllo
- Set-up una gabbia di accoppiamento contenente una coppia di accoppiamento. La mattina del giorno successivo, verificare la presenza di un tappo vaginale e designare il giorno una spina si trova come giorno 0.5 23. Al giorno E8.5, gli embrioni di raccolta.
- Dissezione di embrioni
- Sacrificio della diga attraverso dislocazione cervicale e spruzzare la zona addominale con il 70% di etanolo (vedi tabella 2). Fare un taglio trasversale sulla pelle sopra l'addome con le forbici chirurgiche e tirare i due lembi a parte (anteriore e posteriore) per esporre la zona addominale. Fare un taglio similesul peritoneo per esporre l'addome.
- Individuare il uteri e rilasciare uteri dagli ovidotti e mesometrio utilizzando un paio di forbici 23. Posizionare il uteri in un piatto di 6 centimetri (cultura non-cellule trattate) con 10 ml di PBS 1x per lavare via il grasso in eccesso e sangue. Trasferimento ad un altro 6 centimetri piatto contenente freschi 10 ml di PBS 1X.
- Separare una utero un embrione contenente tagliando fuori con le forbici chirurgiche. Rimuovere l'utero e decidua e rilasciare il sacco vitellino che contengono l'embrione con due coppie di no. 5 pinze 23.
- Separare il sacco vitellino dall'embrione, e trasferire il sacco vitellino di una provetta da 1,5 ml per l'estrazione del DNA genomico da utilizzare per la genotipizzazione. Utilizzare una pipetta P20 con una punta ampio tunnel, trasferire l'intero embrione in una provetta da 1,5 ml microcentrifuga contenente 10 ml di tripsina. Posizionare la provetta in ghiaccio.
- Ripetere i punti 3.2.3 - 3.2.4 fino a quando tutti gli embrioni sono stati sezionati.
- Embryo dissociazione
- Incubare le provette 1,5 ml contenenti embrioni in tripsina a 37 ° C per 5 min per facilitare dissociazione enzimatica.
- Triturare delicatamente con una pipetta P20 per la dissociazione meccanica dell'embrione, e la piastra tutto il volume 10 ml contenente un embrione dissociato più di un pozzo di cellule rare-LacZ F9 in una piastra a 96 pozzetti (vedi punto 5.1 per la placcatura cellule F9 RARE-LacZ in una piastra a 96 pozzetti). Culture O / N a 37 ° C e 5% CO 2.
- Incubare le provette 1,5 ml contenenti embrioni in tripsina a 37 ° C per 5 min per facilitare dissociazione enzimatica.
Cord 4. laminectomia, dissezione adulti vertebrale lombare e della cultura neurosfere
- laminectomia
- Sacrifica un (P60) topo adulto attraverso dislocazione cervicale.
- Spruzzare il lato dorsale con il 70% di etanolo e fare un taglio trasversale con le forbici chirurgiche. Tirare entrambe le alette (anteriore e posteriore) a parte per esporre la schiena e la colonna vertebrale.
- Utilizzando le forbici chirurgiche, tagliare i muscoli che coprono la colonna vertebrale.Individuare regione lombare della colonna vertebrale, sotto le costole. Utilizzando le forbici, fare un taglio profondo per recidere la colonna vertebrale a questo punto per esporre il midollo spinale.
- Sollevare la regione lombare della colonna vertebrale senza. 5 pinza in modo che la sezione trasversale esposta del midollo spinale si trova ad affrontare lo sperimentatore. Utilizzando la punta delle forbici sottili, tagliare la vertebra e del muscolo nelle posizioni ore 3 e ore 9 del estremità esposta. Afferrare l'aletta dorsale della vertebra taglio con una pinza. Continuare questi tagli caudalmente fino riceva la lunghezza del midollo spinale lombare.
- Rilasciare il midollo spinale dalle vertebre tramite no. 5 così come forcipe smussato-ended. Trasferire il midollo spinale ad una provetta da 15 ml contenente 3 ml di terreno / coltura DMEM F12. Tenere in ghiaccio fino a quando tutti midollo spinale lombare sono stati isolati.
- Dissezione del midollo spinale
- Versare il terreno di coltura con il midollo spinale in un piatto 6 cm (coltura non-cellule trattate).
- Sotto uno stereomicroscopio, rimuovere il gangli spinali e vasi sanguigni in tutto il segmento del midollo spinale afferrando i vasi sanguigni e gangli utilizzando due coppie di no. 5 pinze e delicatamente tirando via dal midollo spinale. Trasferire il segmento del midollo spinale di un piatto di 6 centimetri, senza media e tritare finemente il tessuto utilizzando un bisturi.
- Trasferimento tritato tessuto a tubo da 15 ml contenente 1 ml di mezzi neurosfere di dissociazione (vedi tabella 2). Mettere la provetta in ghiaccio e ripetere i passaggi 4.2.1 - 4.2.2 fino a quando tutti i midolli spinali sono stati elaborati.
- Incubare le provette contenenti tessuto macinate in medium di dissociazione a 37 ° C per 10 min, flick tubo sul lato di mescolare e incubare a 37 ° C per altri 10 min. Dopo la digestione enzimatica, triturare con pipette Sfaccettate di diametri decrescenti per la dissociazione meccanica.
Nota: Preparare pipette ribruciate di diminuire diametri prima di eseguire esperimenti. Prendete un bicchiere Pasteurpipetta e inserire l'estremità larga con cotone pulito. Utilizzando una lampada ad alcool, il fuoco lucidare le punte delle pipette in fiamme per creare diversi diametri: "regolare", "fine" e "extra fine". Per "normali" pipette lucidato, roteare l'estremità della pipetta nella fiamma per arrotondare i bordi senza diminuire il diametro (~ 1 mm). Ruotare l'estremità della pipetta nella fiamma per un periodo leggermente più lungo per creare "fine" (~> 1 mm e> 5 mm di diametro) e "extra fine" (~ 0.5 mm) pipette lucidate. Non utilizzare pipette con diametro inferiore a 0,5 mm.
- cultura neurosfere
- Spin down provette contenenti dissociate tessuto del midollo spinale a 200 xg per 10 min. Rimuovere il surnatante e pellet cellulare risospendere in 1 ml di terreni di coltura neurosfere (vedi tabella 2). Triturare con una pipetta P 1.000 seguito da una pipetta P200 per facilitare la dissociazione.
Nota: evitare le bolle che introducono,che sarebbe diminuire la vitalità cellulare. - Trasferire 10 ml di cellule dissociate in un emocitometro e ottenere una conta cellulare. Cellule piastra ad una densità di 1x10 5/10 ml in un pallone T25 con 10 ml di terreni di coltura neurosfere. Incubare a 37 ° C e 5% CO 2 per 7 giorni fino neurospheres appaiono 24.
- Spin down provette contenenti dissociate tessuto del midollo spinale a 200 xg per 10 min. Rimuovere il surnatante e pellet cellulare risospendere in 1 ml di terreni di coltura neurosfere (vedi tabella 2). Triturare con una pipetta P 1.000 seguito da una pipetta P200 per facilitare la dissociazione.
- neurosfere dissociazione
- Raccogliere la cultura neurosfere e trasferire a 15 mL. Spin a 200 xg per 10 min. Rimuovere la maggior parte del surnatante lasciando 1 ml. Triturare con una pipetta P 1.000 per risospendere il pellet cellulare e dissociare neurosfere in singole cellule. Trasferimento 10 ml di cellule dissociate in un emocitometro e ottenere un numero di celle.
- Piastra 1 x 10 5 cellule dissociate neurosfere più di un pozzo di F9 RARE-LacZ in una piastra a 96 pozzetti (vedere paragrafo 5.1 per la placcatura F9 RARE-LacZ in piastra da 96 pozzetti). Piastra 3 pozzi come repliche. Culture O / N a 37 ° C e 5% CO 2.
5. RA Assay di E8.5 embrioni e midollo spinale Neurosfere
- Placcatura F9 RARE-LacZ in piastra a 96 pozzetti
- Un giorno prima di embrioni E8.5 raccolta o la dissociazione di neurosfere, cappotto una piastra a 96 pozzetti con 100 ml di 0,2% di gelatina per pozzetto per 30 minuti a temperatura ambiente. Aspirare la gelatina e lavare due volte con 200 ml di acqua distillata.
- cellule rare-LacZ Trypsinize F9 mantenuti in piatti di 10 cm come descritto al punto 2.2.2. Piastra 1 x 10 5 cellule / pozzetto di cellule LacZ F9-rare, ma questa volta utilizzando terreno di coltura senza G418.
- Preparare sufficienti pozzetti per co-coltura di embrioni (~ 12 - 20, a seconda delle dimensioni lettiera), neurosfere (3 pozzi / genotipo) così come per una curva standard in triplice copia (27 pozzetti).
- Co-cultura F9 RARE-LacZ e E8.5 embrioni o del midollo spinale Neurosfere
- embrioni Harvest come dettagliato nella sezione 3.2 e la piastra in cima F9RARE-LacZ nella piastra a 96 pozzetti dal paragrafo 5.1. In modo simile, dissociare neurosfere e piatto sopra F9 RARE-LacZ nella piastra a 96 pozzetti come dettagliato nel passo 4.4. Culture O / N a 37 ° C e 5% CO 2.
- Generazione di una curva standard
- Per generare una curva standard, prepararsi all-trans RA (at-RA) soluzioni con le seguenti concentrazioni: 100 nm, 10 nm, 1 nm, 100 pM, 22:00, 13:00, 100 fm, per diluizione seriale del at- RA magazzino (vedi Tabella 1) con terreno di coltura RARE-LacZ F9.
- Aggiungere 100 ml di questi diversi at-RA concentrazioni di cellule rare-LacZ F9 dalla sezione 5.1. Assegnare pozzetti contenenti F9 non trattata cellule rare-LacZ come controllo negativo. Preparare triplicato di ogni concentrazione RA e pozzetti di controllo negativo. Culture O / N a 37 ° C e 5% CO 2.
Nota: le cellule RARE-LacZ F9 rispondono in modo lineare dose-dipendente a diverse concentrazioni di RA all trans.
- RA Assay
- Dopo cultura O / N della piastra a 96 pozzetti contenente le curve standard e co-culture, rimuovere il supporto e fissare le culture con l'aggiunta di 100 ml di 2,5% glutaraldeide (vedi tabella 2) per 15 minuti, RT. Rimuovere il fissativo e lavare due volte con 200 microlitri 1x PBS, 10 minuti a lavaggio.
- Rimuovere PBS e lavare tre volte con 200 ml di soluzione di lavaggio LacZ (vedi Tabella 2), 10 minuti a lavaggio. Durante il terzo lavaggio, preparare la soluzione colorante X-gal in una provetta da 15 ml avvolta in foglio (vedi Tabella 2). Calcolate quanto soluzione colorante è necessario e preparare la giusta quantità (200 pl / pozzetto).
Nota: la soluzione X-gal colorazione è sensibile alla luce. Utilizzare la soluzione colorante entro 15 minuti dopo la preparazione. - Preparare una camera umidificata mettendo un tovagliolo di carta inumidito con acqua distillata in un contenitore di plastica abbastanza grande da contenere una piastra a 96 pozzetti. Aggiungere 200 microlitri della Xsoluzione colorante -Gal per pozzetto della piastra a 96 pozzetti e posizionare la piastra in una camera umidificata.
- Incubare camera umidificata contenente la piastra a 96 pozzetti a 37 ° C per consentire lo sviluppo di precipitato di colore blu. Per gli embrioni E8.5, incubare la piastra di O / N (12 - 16 ore). Per neurosfere culture, incubare la piastra per 4-8 ore.
- Leggere ad assorbanza di OD 610 e Imaging
- Dopo la reazione di colore, rimuovere la soluzione LacZ colorazione e sostituire con 200 microlitri 1x PBS. Misurare l'assorbanza a 610 nm usando un lettore standard di piastra ELISA per quantificare la risposta reporter di RA. Immagine singoli pozzi utilizzando uno stereomicroscopio di serie dotato di una fotocamera.
6. Subclonaggio di F9 cellule rare-LacZ
- Controllo F9 RARE-LacZ rResponse per RA
- Prima di iniziare gli esperimenti, testare la risposta delle cellule RARE-LacZ F9 per RA. Piastra F9 RARE-LacZ cells a 96 pozzetti (vedere paragrafo 5.1), e aggiungere 1 nM all-trans retinoico (vedi punto 5.3). Incubare in una camera umidificata a 37 ° CO / N.
- Visualizza sviluppo di precipitato di colore blu utilizzando un microscopio. Se lo sviluppo colore non è uniforme attraverso le cellule nel pozzo (vedere Figura 1B, sinistra), eseguire subcloning seguito dettagliato.
- Subcloning di F9 cellule rare-LacZ
- Dividere le celle RARE-LacZ F9 coltivate in 10 piatti cm come descritto al punto 2.2.2. Invece di un rapporto 1:10, piastra una bassa densità di semina di 1 x 10 5 cellule / 10 ml in un piatto 10 cm per consentire la crescita di colonie isolate tale che ogni colonia deriva da una singola cella F9 RARE-LacZ.
- Dopo due giorni, il cappotto di un 24-pozzetti con 500 ml di 0,2% di gelatina per pozzetto per 30 min. Rimuovere la soluzione di gelatina e risciacquare pozzi due volte con 500 microlitri di acqua distillata. Sostituire l'acqua con 500 ml di F9 mezzo di coltura cellulare RARE-LacZ.
- Scegliere una colonia con una sterile punta P10 pipetta e trasferire in un pozzo; fare questo 24 volte per ottenere 24 colonie individuali. Coltura a 37 ° C, 5% CO 2 per 3 - 4 giorni.
- Dividere le singole colonie in due piastre da 24 pozzetti. Dopo 2 giorni di coltura, aggiungere 1nM di RA in ciascun pozzetto di una piastra da 24 pozzetti e cultura O / N. Eseguire LacZ colorazione come descritto nella sezione 5.4 di prova per alte responder. Visualizza reazione cromatica di ogni pozzetto sotto un microscopio per determinare responder forti e uniformi.
- Una volta che un forte responder subclone è determinato, espandere la cultura corrispondente dall'altro 24 pozzetti. Espandere ulteriormente quella colonia in un piatto 10 cm e congelare giù parecchie fiale come descritto nella sezione 2.3, e scartare tutte le altre colonie.
Nota: solo circa un quarto delle colonie originali comporta alti responder. Tipicamente, il primo round di subcloning non si traduca in colorazione LacZ uniforme e un successivo giro di subcloning deve essere fatto araggiungere responder forti uniformi.
Risultati
Il F9 RARE-LacZ giornalista è una linea di cellule di carcinoma embrionale aderenti cresciuto sulla superficie di gelatina rivestita. Il costrutto giornalista permette alle cellule di rispondere quantitativamente RA con una induzione proporzionale di beta-galattosidasi. 11,12,14,18. Queste cellule mostrano una morfologia epiteliale (Figura 1A). A causa del loro alto tasso raddoppio, si raccomanda che queste cellule essere suddivisi ogni 2 - 3 giorni in un rapporto di 1:10. Durante il lavoro con questa linea cellulare giornalista, abbiamo osservato che anche con l'aggiunta di G418 nel terreno di coltura, la risposta di queste cellule a RA indebolisce dopo vari passaggi (Figura 1B, sinistra), e questo può influenzare la capacità giornalista di questa linea cellulare. Questa perdita di reattività può essere dovuto alla perdita parziale del transgene in passaggi successivi. Come tale, subcloning periodica è necessaria per garantire responder forti e uniformi al RA (Figura1B, a destra).
Mentre vari usi di questa linea cellulare è stato precedentemente pubblicato 12,14-18, qui riportato è l'uso di questa linea cellulare per misurare i livelli endogeni RA dai singoli embrioni E8.5 con differenti genotipi. I risultati Gpr161 vl / vl mutazione in diminuzione RA embrionale segnalazione 22. Come dimostrato dalla co-coltura di embrioni dissociate con cellule rare-LacZ F9, questi embrioni Gpr161 VL / VL hanno ridotto endogena RA rispetto al wild-type cucciolata (Figura 2A). A causa della versatilità di questa linea cellulare giornalista, riportato anche qui è un nuovo uso di queste cellule per rilevare i livelli RA prodotti da colture di neurosfere ottenute da adulto Gpr161 topi WT / WT (Figura 2B). Questa linea cellulare giornalista è stato in grado di dimostrare che le culture neurosfere da cellule staminali adulte del midollo spinale produrre RA endogeno. Il grande differenza in intensità di colorazione indica una maggiore risposta delle cellule reporter di neurosfere del midollo spinale, rispetto agli embrioni E8.5. Ciò può essere dovuto a molto maggiori livelli di RA generati dalle neurosfere nel tempo rispetto agli embrioni E8.5, che potrebbe essere dovuto al fatto che neurosfere culture sono più omogenei di embrioni E8.5 e quindi contengono più cellule RA-produttori.
L'aggiunta di diverse concentrazioni di risultati a-RA in una risposta lineare dose-dipendente delle cellule del reporter. Questa risposta può essere misurata colorimetricamente leggendo l'assorbanza a 610 nm. La curva standard generata può quindi essere utilizzato per quantificare i livelli di RA nei campioni, come ad esempio nel wild-type culture neurosfere (Figura 3a) o embrioni E8.5 (figura 3b).
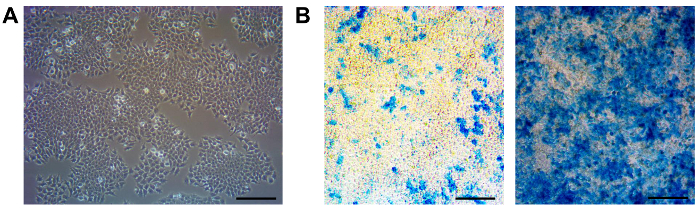
Figura 1. Maintenance e Subclonaggio di F9 cellule rare-LacZ. (A) viene ammonito immagine a contrasto di fase di cellule rare-LacZ F9. Queste cellule hanno un tempo di raddoppio di ~ 10 ore e devono essere trasmessi ogni 3 giorni. (Circa 70 - 80% di confluenza) in un rapporto 1:10 (B) Controllo periodico delle culture con aggiunta di 1 nM a-RA e successiva LacZ colorazione deve essere fatto per garantire le culture rimangono responder forti e uniformi per la RA (a destra). In caso di poor responders e non uniformi (a sinistra), subcloning deve essere eseguita. Scala bar 100 micron. Clicca qui per vedere una versione più grande di questa figura.
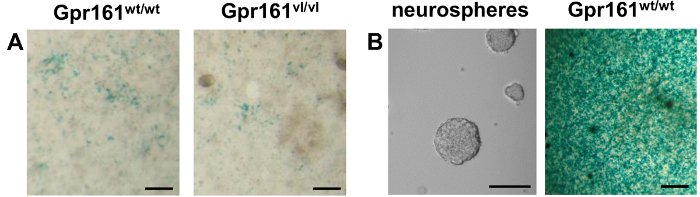
I campioni Figura 2. LacZ colorazione di co-coltura (dissociato E8.5 Embrioni / Neurosfere) e F9 cellule rare-LacZ. (A) embrione di topo E8.5 s di vari genotipi sono stati dissociato e placcato in cima cellule RARE-LacZ F9. LacZ colorazione 24 ore più tardi permette la visualizzazione della risposta delle cellule F9 RARE-LacZ a endogena RA prodotte da campioni di co-coltura. Il Gpr161 vl mutazione risultati in RA endogeno diminuito come visualizzato dalla ridotta risposta delle cellule giornalista. (B) a sinistra. Viene mostrato un immagine a contrasto di fase di neurosfere in coltura da cellule staminali neurali adulte del midollo spinale. Destra. Neurosfere derivate da adulto Gpr161 midollo spinale peso / peso sono state dissociate e placcati in cima cellule RARE-LacZ F9. La presenza di precipitato blu dopo colorazione LacZ indica la presenza di endogena RA in queste neurosfere. La differenza di colorazione di intensità tra le neurosfere e E8.5 embrioni co-colture indicano maggiori livelli di RA presente in neurosfere di embrioni E8.5. Scala bar 100 micron.target = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.

Figura 3. curva standard e colorimetrica quantificazione dei livelli di RA. La risposta della linea cellulare giornalista F9 RARE-LacZ possono essere misurati colorimetria a 610 nm usando un lettore standard di piastra ELISA. (A) curva standard rappresentativa utilizzata per quantificare livelli relativi RA di wild-type neurosfere cultura s. (B) Quantificazione dei livelli relativi RA da embrioni E8.5 co-coltura. N = 3; * P <0.05, test t. Le barre di errore SEM. Cliccate qui per vedere una versione più grande di questa figura.
| StoBuffer ck / Soluzioni | componenti | Condizioni di archiviazione |
| 10% sodio desossicolato monoidrato (C 24 H 39 NaO 4 · H 2 O) | 10 ml a 100 ml dH 2 O | 4 ° C |
| 1 M di cloruro di magnesio (MgCl 2) | RT | |
| Ferrocianuro di potassio 100x (K 4 [Fe (CN) 6] · 3 H 6 O) | 2,12 g in 10 ml dH 2 O | RT al buio |
| Ferricianuro di potassio 100x (K 3 [Fe (CN) 6]) | 1,64 g in 10 ml dH 2 O | RT al buio |
| 20 mg / ml di X-gal (5-bromo-4-cloro-3-indolil-β-D-galattopiranoside) | aggiungere 5 ml dimetil formammide per fare 20 mg / ml di soluzione | -20 ° C |
| 10 mM (3 mg / ml) all-trans acido retinoico | Sciogliere 50 mg a 16,67 ml di etanolo assoluto. Preparare 1 ml aliquote. | -80 ° C al buio, in provette da 1,5 ml microcentrifuga ambra |
| papaina | sciogliere un flaconcino di 7 ml HBSS | 4 ° C |
Tabella 1. Tamponi e soluzione composizioni.
| Lavorando Buffer / Soluzioni | componenti | Condizioni di archiviazione |
| F9 mezzo di coltura cellulare RARE-LacZ | 50 ml di siero fetale bovino (FBS) (concentrazione finale 10%) | Filtro-sterilizzare. |
| 5 ml 100x penicillina streptomicina (finale conc 1X) | Conservare a 4 ° C. | |
| 4ml 50 mg / ml di G418 (finale conc 0,4 mg / ml) | ||
| 500 ml DMEM / F-12 (con L-glutammina e HEPES) | ||
| 0,2% di gelatina | 25 ml 2,0% di gelatina | Conservare a 4 ° C. |
| 80 ml di acqua distillata | ||
| Mescolare bene | ||
| 70% di etanolo | 30 ml di etanolo 95% | Mettere in flacone spray. |
| 70 ml di acqua distillata | Conservare a temperatura ambiente | |
| medio di dissociazione neurosfere | 1 ml 20U papaina | preparare fresca ogni volta |
| 100 microlitri 13 mg / ml di tripsina | ||
| 100 microlitri 7 mg / ml di acido ialuronico | ||
| 28 microlitri 10 mg / ml DNasiI | ||
| 50 ml 4mg / acido kinurenico ml | ||
| terreno di coltura neurosfere | DMEM / F-12 (con L-glutammina e HEPES) | preparare fresca ogni volta |
| 2% supplemento B-27 | ||
| 20 ml fattore ng / crescita dei fibroblasti (FGF) | ||
| 20ng fattore di crescita epidermico (EGF) | ||
| 2,5% glutaraldeide | 250 microlitri 50% glutaraldeide | preparare fresca ogni volta |
| 4750 ml PBS 1x | ||
| soluzione di lavaggio LacZ | 0,5 ml 10% desossicolato (conc finale 0,1%) | Conservare a 4 ° C. |
| 1,0 ml 100% NP-40 (finale conc 0,2%) | ||
| 50 ml di PBS 10X | ||
| acqua distillata a 500 ml | ||
| soluzione colorante X-gal | ferrocianuro di potassio 1x | preparare fresca ogni volta |
| ferricianuro di potassio 1x | ||
| 1 mg / ml di X-gal | ||
| a volume appropriato utilizzando la soluzione di lavaggio LacZ | ||
| F9 RARE-LacZ medio congelamento | F9 cultura RARE-LacZ media + 5% DMSO | preparare fresca ogni volta |
Tabella 2. buffer di lavoro e la soluzione di composizioni.
Discussione
La linea cellulare F9 RARE-LacZ 14 è un potente sistema che può essere utilizzato per il rilevamento di RA prodotto da espianti tissutali 12,14,17,18. E 'sensibile a concentrazioni RA a partire da 100 Fm, con nessuna risposta non specifica rilevata in cellule non trattate con RA 12,14,18. Inoltre, le cellule giornalista rispondono a tutto-trans RA in modo lineare in un intervallo specifico di concentrazione, permettendo così la reazione LacZ da quantificare e utilizzato per determinare l'entità di livelli RA 12,14,18. Il test rapido e facile RA giornalista qui presentata utilizza la linea cellulare giornalista F9 RARE-LacZ per la visualizzazione (Figura 2) e la misurazione quantitativa relativa (Figura 3) di embrioni e cellule staminali neurali in coltura per adulti. Questo sistema reporter permette confronto dei livelli endogeni RA tra singoli campioni, come mostrato in Figura 2. È abbastanza sensibile da poter rilevare RAgenerato dai singoli embrioni E8.5 (Figura 2A) e RA prodotti da neurospheres coltura (Figura 2B). La risposta dose-dipendente di questa linea cellulare di concentrazioni variabili di RA consente la quantificazione dei livelli RA (Figura 3A) nei campioni così come il confronto dei livelli relativi RA tra i campioni (Figura 3B). E 'importante notare che la linea cellulare giornalista RARE F9 misura la quantità complessiva di RA generato dai campioni di tessuto nel tempo di incubazione. Questo è equivalente al saldo netto della sintesi RA e catabolismo.
Mentre il F9 sistema reporter cellule RARE-LacZ è altamente sensibile e versatile, ci sono diversi passaggi di risoluzione dei problemi critici che abbiamo incorporato per garantire l'affidabilità del sistema. In primo luogo, come mostrato nella Figura 1, è importante mantenere la salute di queste cellule di passaggi regolari senza farli gremare a confluenza. Secondo, abbiamo osservato dopo passaggi tendono a provocare risposte RA inconsistenti, anche se le culture sono costantemente mantenuti in selezione con G418. Per risolvere questo, si consiglia di scartare culture dopo 20 passaggi e scongelare un nuovo flacone. Inoltre, i controlli periodici devono essere eseguiti per garantire che le cellule giornalista ancora forti responder alla presenza di RA nei media. In terzo luogo, se i primi passaggi mostrano scarsa risposta o non uniforme di RA (Figura 1B, a sinistra), uno o più giri di subcloning possono essere necessarie fino a quando responder forti sono ottenuti (Figura 1B, a de stra). Infine, prima della co-coltura, si raccomanda che i campioni di tessuto come embrioni e neurosfere sono dissociati per singole cellule. Abbiamo osservato che la dissociazione dei campioni risultati delle misurazioni colorimetriche più coerenti. Ciò può essere dovuto ad una distribuzione più uniforme delle RA nei pozzetti di coltura, le cellule dissociate sono in uniFormulario di contatto con le cellule Reporter.
Diverse modifiche sono state apportate anche al protocollo originale 14. In primo luogo, la risposta RA delle cellule RARE-LacZ F9 sono stati quantificati fissando direttamente le cellule e misurare l'assorbanza a 610 nm, invece di raccogliere le cellule e l'analisi di lisato per l'attività b-galattosidasi 14. Un'altra modifica è la co-coltura diretta di campioni dissociate con F9 RARE-LacZ prima quantificazione della risposta RA. I metodi precedenti hanno riportato la coltura di campioni separatamente e aggiungendo solo il supporto da queste culture a F9 RARE-LacZ 16,18.
Nonostante il suo essere un sistema potente, il saggio giornalista RARE-LacZ F9 ha diversi limiti. Una limitazione di questa linea cellulare giornalista è che anche se risponde fortemente alla presenza di tutto-trans RA, risponde anche ad altri isomeri dell'acido retinoico cui 9-cis-RA e 13-cis-RA; tuttavia, sono 100 volte più sensibili a tutto-trans compa RArosso per gli altri isomeri 18. Un altro limite di questo sistema è che la risposta lineare dose-dipendente cade tra il 10 -13 M a 10 -7 M at-RA 14,18; pertanto, se si confrontano i livelli RA fuori di questi limiti, potrebbe essere necessario eseguire una diluizione seriale del campione fino a quando le misurazioni rientrano nel range lineare. Infine, poiché questo è soprattutto un saggio colorimetrico, il punto finale di sviluppo del colore può variare tra i campioni ed esperimenti. Pertanto, è importante che una curva standard sempre essere placcato in parallelo per ogni singolo esperimento per usarlo per la quantificazione della risposta cellulare giornalista.
In conclusione, abbiamo riportato l'utilizzo della linea cellulare giornalista RARE-LacZ RA F9 per misurare i livelli di RA quantitativamente negli embrioni E8.5 e, in precedenza non dichiarata, in neurosfere. La versatilità di questo sistema reporter può consentire la quantificazione dei livelli di RA praticamente in qualsiasi tipo di cellula o tessuto, e may portare allo sviluppo di varie applicazioni in futuro.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We would like to acknowledge Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) for providing us with the F9 RARE-LacZ cells and technical support. This study is funded by the New Jersey Commission on Spinal Cord Research (NJCSCR) (Grantnumber:10-3092-SCR-E-0) and the New Jersey Commission on Brain Injury Research (NJCBIR) (Grant number: CBIR13FEL006).
Materiali
| Name | Company | Catalog Number | Comments |
| C3H/HeSn-Gpr161vl/J mouse strain | Jackson Laboratory | 000316 | |
| F9 RARE-LacZ reporter cell line | from Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) | ||
| DMEM/F-12 (with L-glutamine and HEPES) | ThermoFisher Scientific | 11330-057 | |
| Fetal Bovine Serum (FBS), qualified | ThermoFisher Scientific | 26140-079 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; warm in 37 °C for media preparation |
| Penicillin/Streptomycin | ThermoFisher Scientific | 15140-122 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; light-sensitive |
| G418 | ThermoFisher Scientific | 10131-027 | Store at 4 °C; light-sensitive |
| 2% Gelatin | Sigma Aldrich | G1393 | Store at 4 °C |
| B-27 supplement (2 % stock solution) | ThermoFisher Scientific | 17504-044 | Store at -20 °C in 1-ml aliquots to avoid repeated freeze-thaw; warm at room temperature for media preparation |
| Murine Epidermal Growth Factor (EGF) | PeproTech | 315-09 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1xPBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| Murine Fibroblast Growth Factor (FGF)-basic | PeproTech | 450-33 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1x PBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| 50% glutaraldehyde | Amresco | M155 | Store at 4 °C |
| Sodium deoxycholate monohydrate (C24H39NaO4 · H2O) | Sigma Aldrich | D5670 | Store at RT |
| X-gal (5-bromo-4-chloro-3-indolyl-β-d-galactopyranoside) | Promega | V3941 | Store stock at -20 °C |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | 41639 | Store at RT |
| all-trans Retinoic Acid (at-RA) | Sigma Aldrich | R-2625 | Store 1 ml aliquots of stock in -80 °C; extremely sensitive to light |
| TrypLE Express | ThermoFisher Scientific | 12605-010 | Store at RT |
| 0.25% trypsin-EDTA | ThermoFisher Scientific | 25200-056 | alternative to TrypLE Express; aliquot and store at -20 °C |
| Hank's Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14170-112 | Store at 4 °C |
| 10x phosphate buffered solution (PBS) | ThermoFisher Scientific | 10010-023 | Store at 4 °C |
| Papain | Worthington | LK003176 | Store at 4 °C. |
| Trypsin | Worthington | LS003703 | Store in 1 ml aliquots at -20 °C. |
| Hyaluronic acid | Calbiochem | 385908 | Store 200 μl aliquots at -20 °C. |
| DNaseI | Worthington | LS002139 | Store in 200 μl aliquots at -20 °C |
| Kynurenic acid | Sigma Aldrich | K3375 | Store in 200 μl aliquots at -20 °C |
| 95% ethanol | |||
| Mr. Frosty Freezing container | ThermoFisher Scientific | 5100-0001 | |
| 10 cm culture dish (non-cell culture treated) | |||
| 10 cm culture dish (cell culture treated) | |||
| 6 cm culture dish (non-cell culture treated) | |||
| 96-well cell culture plates | |||
| 1.5 ml microcentrifuge tubes | |||
| 1.5 ml amber microcentrifuge tubes | |||
| 1.5 ml cryovials | |||
| 37 °C water bath | |||
| surgical scissors | |||
| fine surgical scissors | |||
| no. 5 forceps | |||
| blunt-ended forceps | |||
| scalpel blade | |||
| glass pasteur pipettes | |||
| cotton | |||
| alcohol lamp | |||
| ELISA plate reader | |||
| stereomicroscope |
Riferimenti
- Vilhais-Neto, G. C., Pourquie, O. Retinoic acid. Curr Biol. 18 (5), R191-R192 (2008).
- Drager, U. C. Retinoic acid signaling in the functioning brain. Science Signalling. 324, 1-3 (2006).
- Lane, M. A., Bailey, S. J. Role of retinoid signalling in the adult brain. Prog Neurobiol. 75 (4), 275-293 (2005).
- Maden, M. Retinoid signalling in the development of the central nervous system. Nat Rev Neurosci. 3 (11), 843-853 (2002).
- Maden, M. Retinoids and spinal cord development. J Neurobiol. 66 (7), 726-738 (2006).
- Rhinn, M., Dolle, P. Retinoic acid signalling during development. Development. 139 (5), 843-858 (2012).
- Ang, H. L., Deltour, L., Hayamizu, T. F., Zgombic-Knight, M., Duester, G. Retinoic acid synthesis in mouse embryos during gastrulation and craniofacial development linked to class IV alcohol dehydrogenase gene expression. J Biol Chem. 271 (16), 9526-9534 (1996).
- Ang, H. L., Duester, G. Stimulation of premature retinoic acid synthesis in Xenopus embryos following premature expression of aldehyde dehydrogenase ALDH1. Eur J Biochem. 260, 227-234 (1999).
- Bastien, J., Rochette-Egly, C. Nuclear retinoid receptors and the transcription of retinoid-target genes. Gene. 328, 1-16 (2004).
- Chatzi, C., Cunningham, T. J., Duester, G. Investigation of retinoic acid function during embryonic brain development using retinaldehyde-rescued Rdh10 knockout mice. Dev Dyn. 242 (9), 1056-1065 (2013).
- Sakai, Y., Drager, U. C. Detection of retinoic acid catabolism with reporter systems and by in situ hybridization for CYP26 enzymes. Methods Mol Biol. 652, 277-294 (2010).
- Yamamoto, M., Drager, U. C., McCaffery, P. A novel assay for retinoic acid catabolic enzymes shows high expression in the developing hindbrain. Dev Biol Res. 107, 103-111 (1998).
- Rossant, J., Zirngibl, R., Cado, D., Shago, M., Giguere, V. Expression of a retinoic acid response element-hsplacZ transgene defines specific domains of transcriptional activity during mouse embryogenesis. Genes & Dev. 5, 1333-1344 (1991).
- Wagner, M., Han, B., Jessel, T. M. Regional differences in retinoid release from embryonic neural tissue detected by an in vitro reporter assay. Development. 116, 55-66 (1992).
- Luo, T., Wagner, E., Crandall, J. E., Drager, U. C. A retinoic-acid critical period in the early postnatal mouse brain. Biol Psychiatry. 56 (12), 971-980 (2004).
- Luo, T., Wagner, E., Grun, F., Drager, U. C. Retinoic acid signaling in the brain marks formation of optic projections, maturation of the dorsal telencephalon, and function of limbic sites. J Comp Neurol. 470 (3), 297-316 (2004).
- Kelley, M. W., Xu, X. M., Wagner, M. A., Warchol, M. E., Corwin, J. T. The developing organ of Corti contains retinoic acid and forms supernumerary hair cells in response to exogenous retinoic acid in culture. Development. 119, 1041-1053 (1993).
- McCaffery, P., Drager, U. C. Hot spots of retinoic acid synthesis in the developing spinal cord. Proc Natl Acad Sci. 91, 7194-7197 (1994).
- Hu, L., Gudas, L. J. Cyclic AMP analogs and retinoic acid influence the expression of retinoic acid receptor alpha, beta, and gamma mRNAs in F9 teratocarcinoma cells. Mol Cell Biol. 10 (1), 391-396 (1990).
- Martin, G. R. Teratocarcinomas and mammalian embryogenesis. Science. 209 (4458), 768-776 (1980).
- Strickland, S., Mahdavi, V. The induction of differentiation in teratocarcinoma stem cells by retinoic acid. Cell. 15 (2), 393-403 (1978).
- Li, B. I., et al. The orphan GPCR, Gpr161, regulates the retinoic acid and canonical Wnt pathways during neurulation. Dev Biol. 402 (1), 17-31 (2015).
- Hogan, B., Constantini, F., Lacy, E. Manipulating the Mouse Embryo: A Laboratory Manual. , 1st, Cold Spring Harbor Laboratory. (1986).
- Deleyrolle, L. P., Reynolds, B. A. Isolation, expansion, and differentiation of adult Mammalian neural stem and progenitor cells using the neurosphere assay. Methods Mol Biol. 549, 91-101 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon