Method Article
Medição quantitativa de níveis relativos ácido retinóico em E8.5 embriões e neurosphere culturas Usando a F9 RARE-Lacz baseado em células de Ensaio Reporter
Neste Artigo
Resumo
Methods to accurately measure retinoic acid (RA) levels in small amounts of tissue do not exist. This protocol describes the easy, quantitative measurement of relative RA levels in E8.5 embryos and neurospheres using an RA reporter cell line.
Resumo
Retinoic acid (RA) is an important developmental morphogen that coordinates anteroposterior and dorsoventral axis patterning, somitic differentiation, neurogenesis, patterning of the hindbrain and spinal cord, and the development of multiple organ systems. Due to its chemical nature as a small amphipathic lipid, direct detection and visualization of RA histologically remains technically impossible. Currently, methods used to infer the presence and localization of RA make use of reporter systems that detect the biological activity of RA. Most established reporter systems, both transgenic mice and cell lines, make use of the highly potent RA response element (RARE) upstream of the RAR-beta gene to drive RA-inducible expression of reporter genes, such as beta-galactosidase or luciferase. The transgenic RARE-LacZ mouse is useful in visualizing spatiotemporal changes in RA signaling especially during embryonic development. However, it does not directly measure overall RA levels. As a reporter system, the F9 RARE-LacZ cell line can be used in a variety of ways, from simple detection of RA to quantitative measurements of RA levels in tissue explants. Here we describe the quantitative determination of relative RA levels generated in embryos and neurosphere cultures using the F9 RARE-LacZ reporter cell line.
Introdução
O ácido retinóico (RA) é um derivado metabolito de retinol ou vitamina A e é produzida através da actividade sequencial de várias desidrogenases celulares 1. Devido à sua natureza química anfifático, que atravessa facilmente membranas lipídicas e podem actuar como um factor morfogenético de 1 solúvel. É uma molécula essencial que regula numerosos processos celulares de desenvolvimento e adultos, actuando como um ligando para os receptores de retinóide nuclear e activação da expressão do gene de 10/02. Sem RA, estes receptores de AR (RAR) Rares ligamento no DNA e atuam como repressores; RA se ligar a esses receptores os transforma em activadores transcricionais, resultando na expressão do gene alvo 1,5,6.
Embora a via de sinalização RA está bem caracterizado, o tamanho pequeno (~ 300 Da) e da natureza anfipática da AR faz a visualização histológica direta e medição de RA atualmente tecnicamente inviável 11. O único método para direct medição de níveis de AR é através do isolamento de AR a partir de amostras de tecido, utilizando cromatografia líquida de alta eficiência (HPLC) 11. Este método normalmente requer grandes quantidades de tecido, facilitados através da partilha de amostras diferentes 12. Assim, esta técnica é pouco adequado para a medição de níveis de AR em embriões individuais ou pequenas quantidades de amostra / tecido.
A fim de investigar a função celular de RA, vários métodos têm sido desenvolvidos para inferir indirectamente a presença de RA. Esses métodos fazem uso de sistemas repórter contendo o RAR-beta altamente responsivo RARO dirigir a expressão da beta-galactosidase ou luciferase 11,13,14. O ratinho transgénico repórter LacZ-RARA gerado por Rossant et ai. 13 é um sistema ideal para a visualização de regiões espaço-temporais da sinalização de AR in situ 11,13,15,16, mas não é adequada para medições quantitativas. A linha F9 celular RARE-LacZ 14, em tele outro lado, é útil para a detecção de RA e medições quantitativas dos níveis de RA em explantes de tecido 11,12,14,17,18.
Células de teratocarcinoma F9 expressam alfa endógeno, beta-, e gama-ácido retinóico receptores 19, e iniciar a diferenciação em endoderme parietal após exposição a RA 19-21. células F9 foram há muito estabelecida como um modelo para a diferenciação celular induzida por RA, o que é por isso que foi escolhido como uma linha celular ideal para um ensaio de repórter de RA. A linhagem de células repórter Sil-15 RA-F9 derivado gerado por Wagner et ai. 14 contém uma E. coli'LacZ gene a jusante de uma cópia do elemento retinóico 64-pb resposta ácido (raro) do gene (RAR-beta) beta-receptor do ácido retinóico humano. A fim de seleccionar e manter os clones estáveis, o construto também contém o gene de aminoglicósido fosfotransferase (neor) como um marcador seleccionável na presença de G418. Esta co construtonfers expressão indutível de b-galactosidase na presença de RA, o que pode ser visualizado por meio de coloração LacZ e esta resposta pode ser subsequentemente quantificado utilizando métodos colorimétricos 11,12,14,18.
Esta linha de células relatora extremamente versátil, tem sido amplamente utilizado na detecção da produção endógena de RA por meio de co-cultura de amostras de tecido com as células repórter, tais como a cóclea e 17 embrionárias explantes placa de fundo 14. Além disso, esta linha repórter foi utilizada para a quantificação dos níveis de RA na medula espinal em desenvolvimento, a cultura de secções de dados agregados de medulas espinais embrionários separadamente e adicionando meio condicionado a partir destas culturas de células F9 RARO-LacZ 18. A quantificação foi realizada após coloração LacZ através da leitura colorimétrica utilizando um leitor de placas ELISA padrão 11,12,18. Por último, esta linha de células relatora foi usado na detecção da presença de enzimas metabólicas RA por monitoring muda em níveis RA 12,18.
Aqui mostramos que a sensibilidade desta linhagem de células repórter também permite a medição dos níveis de RA gerada a partir de embriões E8.5 co-cultivadas individuais. Isto permite a comparação entre os embriões individuais de diferentes genótipos. Como um exemplo específico, Gpr161 é um GPCR órfãos que regula neurulação em parte, através da via de sinalização RA 22, e que relatam o uso desta linha de células relatora para investigar o efeito de uma mutação recessiva no Gpr161 (Gpr161 VL) sobre os níveis globais de RA no embrião. Além disso, a versatilidade e a facilidade de utilização deste sistema repórter permite a liberdade para medir e comparar os níveis de RA em amostras de tecido diferentes, mesmo em culturas de neuroesferas obtidos a partir de células estaminais de medula espinal adulta. Aqui descrevemos a determinação quantitativa dos níveis de AR relativas em embriões e culturas de neuroesferas através de co-cultura directa com o RA representante LacZ-RARE F9linha de células orter.
Protocolo
Todo o trabalho animal foi feito de acordo com métodos Rutgers-RWJMS IACUC aprovados.
1. Solução e Mídia Preparação
- Prepare ações e tampão soluções conforme a Tabela 1. Preparar as soluções de trabalho de acordo com a Tabela 2.
2. Cultura e Manutenção de células RARE-LacZ F9
- As células congeladas descongelamento
- Preparar o meio de cultura de células F9 RARO-LacZ como detalhado na Tabela 2.
- O revestimento 10 cm placas de cultura (cultura de células tratadas) com 10 ml de 0,2% de gelatina (consulte a Tabela 2) durante 30 min à TA. Lavar o excesso de gelatina com duas lavagens de 10 ml de água destilada. Imediatamente adicionar 9 ml de meio de cultura de células raras-LacZ F9 para o balão para evitar que a gelatina seque.
- Descongelar uma ampola de células F9 RARO-LacZ 14 num banho de água a 37 ° C durante 2-3 min. Células da placa (cerca de 1 x 10 6 culas / ml) para a placa revestida containing 9 ml de meio de cultura. Cultura a 37 ° C, 5% de CO 2. Mudar o meio do dia seguinte.
- Manutenção da F9 raras células-LacZ
- Manter uma passagem regular, a cada 2 - 3 dias a uma razão de 1:10.
Nota: Não deixe que as células crescem em confluência, pois isso irá resultar em sua diferenciação. - Dividir as culturas a uma confluência de 80-90%. Remover os meios e lava-se as células com 10 ml de solução salina tamponada 1x com fosfato (PBS). Remover o PBS e adicionar 1 ml de tripsina, incubar por 5 min. Adicionar 9 ml de meio de cultura, pipeta cima e para baixo e dividir células 01:10 para a passagem.
- Manter uma passagem regular, a cada 2 - 3 dias a uma razão de 1:10.
- Congelamento F9 raras células-LacZ
- Tripsinizar um prato de 10 centímetros contendo raras células F9-lacZ a 80 - 90% de confluência como detalhado no passo 2.2.2. Transferir as células dissociadas num tubo de centrifugação de 15 mL e centrifugação a 200 xg durante 5 min.
- Remover o sobrenadante e ressuspender pellet celular em 10 ml de F9 RARE-LacZ freezing médio (ver Tabela 2). Aliquota de 1 ml em criotubos e frascos rotulados transferir para recipientes de congelamento. Coloque recipiente de congelamento em O N e transferência de frascos de -80 ° C congelador / para tanques de nitrogênio líquido no dia seguinte.
3. Dissecção da E8.5 embriões
- Acasalamento gaiola Set-up e bujão de verificação
- Set-up uma gaiola de acasalamento contendo um par de acasalamento. Na manhã do dia seguinte, para verificar a presença de um plug vaginal e designar o dia um plug é encontrado como o dia 0,5 23. No dia E8.5, embriões colheita.
- Dissecação de embriões
- Sacrificar a barragem por deslocamento cervical e pulverizar a área abdominal com etanol 70% (ver Tabela 2). Adicione um corte transversal sobre a pele acima do abdómen usando tesouras cirúrgicas e puxar as duas abas à parte (anterior e posterior) para expor a região abdominal. Faça um corte semelhanteno peritoneu para expor o abdómen.
- Localize os úteros e solte úteros das tubas uterinas e mesométrio usando um par de tesouras 23. Colocar os úteros em um (cultura de células não-tratadas) disco de 6 cm com 10 ml de PBS 1x para lavar o excesso de gordura e o sangue. Transferir para um outro prato de 6 centímetros contendo frescos 10 ml de 1x PBS.
- Separe um útero que contém um embrião, cortando-a com uma tesoura cirúrgica. Remover o útero e decídua e libertar o saco vitelino, contendo o embrião usando dois pares de NO. 5 fórceps 23.
- Separa-se o saco vitelino a partir do embrião, e transferir o saco vitelino para um tubo de microcentrífuga de 1,5 ml, durante a extracção do ADN genómico para ser usado para determinação do genótipo. Usar uma pipeta P20 com uma ponta grande calibre, transferir todo o embrião para um tubo de microcentrífuga de 1,5 ml contendo 10 ul de tripsina. Colocar o tubo em gelo.
- Repita os passos 3.2.3 - 3.2.4 até que todos os embriões foram dissecados.
- A dissociação embrião
- Incubar os tubos de 1,5 ml contendo embriões em tripsina a 37 ° C durante 5 min para facilitar a dissociação enzimática.
- Tritura-se suavemente com uma pipeta de P20 para a dissociação mecânica do embrião, e a placa do volume de 10 ul total contendo um embrião dissociado sobre um poço de células RARO-LacZ F9 em uma placa de 96 poços (ver passo 5.1 para o plaqueamento de células F9 RARO-LacZ numa placa de 96 poços). Cultura O / N a 37 ° C e 5% de CO 2.
- Incubar os tubos de 1,5 ml contendo embriões em tripsina a 37 ° C durante 5 min para facilitar a dissociação enzimática.
4. Laminectomy, Dissecção do Adulto lombar Spinal Cord e Cultura Neurosphere
- laminectomia
- Sacrificar um rato (P60) adulto por deslocamento cervical.
- Spray de lado dorsal com 70% de etanol e fazer um corte transversal usando uma tesoura cirúrgica. Puxar ambas as abas (anterior e posterior) afastados para expor a parte de trás e da coluna vertebral.
- Usando uma tesoura cirúrgica, aparar os músculos que cobrem a espinha.Localizar a região lombar da medula espinal, abaixo das costelas. Usando a tesoura, fazer um corte profundo para cortar a coluna vertebral nesse ponto para expor a medula espinhal.
- Puxar para cima a região lombar da coluna vertebral sem. 5 fórceps de modo a que a secção transversal exposta da medula espinal está de frente para o experimentador. Usando as pontas de uma tesoura fina, cortar a vértebra e músculo nas posições 3 e 9 horas da extremidade exposta. Segure a retalho dorsal da vértebra corte com uma pinça. Continuar estas cortes caudalmente até que o comprimento da medula espinal lombar está exposta.
- Libertar a medula espinal a partir das vértebras usando nenhuma. 5, bem como uma pinça de extremidades rombas. Transferir a medula espinal para um tubo de 15 ml contendo 3 ml de meio / cultura de DMEM F12. Manter em gelo até que todas as medulas espinhais lombares foram isolados.
- Dissecção da medula espinhal
- Verter o meio de cultura com a medula espinal em um disco de 6 cm (não-tratado de cultura de células).
- Sob um microscópio estereoscópico, remover os gânglios da raiz dorsal e dos vasos sanguíneos em torno do segmento da espinal medula, agarrando os vasos sanguíneos e dos gânglios utilizando dois pares de NO. 5 pinças e puxando-os para longe da medula espinhal. Transferir o segmento da medula espinhal para um disco de 6 cm com nenhum meio e pique finamente o tecido usando uma lâmina de bisturi.
- Transferência tecido moído para tubo de 15 ml contendo 1 ml de meio de dissociação neuroesfera (ver Tabela 2). Colocar o tubo em gelo e repita os passos 4.2.1 - 4.2.2 até que todas as medulas espinhais foram processadas.
- Incubar os tubos contendo tecido picada em meio de dissociação a 37 ° C durante 10 min, passe rapidamente o tubo no lado de misturar e, em seguida, incuba-se a 37 ° C durante mais 10 min. Após a digestão enzimática, triturar com pipetas polido-fogo de diminuir diâmetros para a dissociação mecânica.
Nota: Preparar pipetas fogo-polido de diminuir diâmetros antes de realizar experimentos. Tome um copo Pasteurpipeta e ligue a grande final com algodão limpo. Usando uma lâmpada de álcool, fogo polonês as pontas das pipetas na chama para criar diferentes diâmetros: "regular", "fino" e "extra fino". Para pipetas polidas "regulares", girar a extremidade da pipeta na chama de volta das bordas sem diminuir o diâmetro (~ 1 mm). Gire a extremidade da pipeta na chama por períodos um pouco mais para criar "fino" (~> 1 mm e> 5 mm de diâmetro) e "extra fino" (~ 0,5 mm) pipetas polidas. Não utilizar pipetas com diâmetros inferiores a 0,5 mm.
- Cultura neurosphere
- Spin down tubos contendo dissociada tecido da medula espinhal a 200 xg durante 10 min. Remover o sobrenadante e ressuspender o sedimento de células em 1 ml de meio de cultura neuroesfera (ver Tabela 2). Tritura-se com uma pipeta P1,000 seguido por uma pipeta P200 para facilitar a dissociação.
Nota: Evite bolhas de introdução,que iria diminuir a viabilidade celular. - Transferir 10 uL de células dissociadas num hemocitómetro e obter uma contagem de células. As células em placas a uma densidade de 1x10 5/10 ml num frasco T25 com 10 ml de meio de cultura neuroesfera. Incubar a 37 ° C e 5% de CO 2 durante 7 dias, até aparecer 24 neuroesferas.
- Spin down tubos contendo dissociada tecido da medula espinhal a 200 xg durante 10 min. Remover o sobrenadante e ressuspender o sedimento de células em 1 ml de meio de cultura neuroesfera (ver Tabela 2). Tritura-se com uma pipeta P1,000 seguido por uma pipeta P200 para facilitar a dissociação.
- neurosphere dissociação
- Recolha cultura neurosphere e transferir para tubos de 15 ml. Girar a 200 xg durante 10 min. Remover a maior parte do sobrenadante deixando atrás de 1 ml. Tritura-se com uma pipeta P1,000 para ressuspender o sedimento celular e dissociar neuroesferas em células individuais. Transferir 10 uL de células dissociadas num hemocitómetro e obter uma contagem de células.
- Placa 1 x 10 5 células dissociadas neuroesferas sobre um poço de F9 RARO-LacZ em uma placa de 96 poços (ver secção 5.1 para plaqueamento F9 RARO-LacZ na placa de 96 poços). Placa 3 poços como repetições. Cultura O / N a 37 ° C e 5% de CO 2.
5. RA Ensaio de E8.5 embriões e Medula Espinhal neuroesferas
- Chapeamento F9 RARE-LacZ na placa de 96 poços
- Um dia antes da colheita de embriões E8.5 ou dissociação de neuroesferas, revestimento de uma placa de 96 poços com 100 ul de 0,2% de gelatina por poço, durante 30 min à temperatura ambiente. Aspirar a gelatina e lavar duas vezes com 200 ul de água destilada.
- Trypsinize F9 raras células-LacZ mantidas em placas de 10 cm, conforme detalhado na etapa 2.2.2. Placa 1 x 10 5 células / poço de células LacZ F9-raras, mas desta vez usando meio de cultura sem G418.
- Prepare o suficiente para poços de co-cultura de embriões (~ 12-20, dependendo do tamanho da ninhada), neuroesferas (3 poços / genótipo), bem como para uma curva padrão em triplicado (27 poços).
- Co-cultura de F9 RARE-LacZ e E8.5 embriões ou da medula espinhal neuroesferas
- embriões de colheita, conforme detalhado na seção 3.2 e placa em cima da F9Rare-LacZ na placa de 96 poços de secção 5.1. De um modo semelhante, se dissociam neuroesferas e placa no topo de F9 RARO-LacZ na placa de 96 poços como detalhado no passo 4.4. Cultura O / N a 37 ° C e 5% de CO 2.
- Gerando uma curva padrão
- Para gerar uma curva padrão, preparar todo-trans retinóico (AR-em) soluções com as seguintes concentrações: 100 nM, 10 nM, 1 nM, 100 pM, 10 pM, 1 pM, 100 fM, por diluição em série da em- estoque RA (ver Tabela 1) com meio de cultura RARE-LacZ F9.
- Adicione 100 ml de estes diferentes at-RA concentrações de raras células-LacZ F9 da secção 5.1. Atribuir poços contendo F9 não tratada células RARE-LacZ como controle negativo. Prepare triplicados de cada concentração de AR e poços de controlo negativo. Cultura O / N a 37 ° C e 5% de CO 2.
Nota: raras células F9-LacZ responder de uma forma linear dependente da dose, a concentrações variáveis de RA todo-trans.
- Ensaio RA
- Após a cultura D / N da placa de 96 cavidades contendo a curva padrão e co-culturas, remova o material e corrigir as culturas por adição de 100 ul de glutaraldeído a 2,5% (ver Tabela 2) durante 15 min, TA. Remover o fixador e lava-se duas vezes com 200 ul de 1x PBS, 10 min por lavagem.
- Remover PBS e lavar três vezes com 200 ul da solução de lavagem de LacZ (ver Tabela 2), 10 min por lavagem. Durante a terceira lavagem, preparar a solução de coloração com X-gal em um tubo de 15 ml envolvido em folha (ver Tabela 2). Calcular a quantidade de solução de coloração é necessário preparar e a quantidade apropriada (200 ul / poço).
Nota: solução de coloração X-gal é sensível à luz. Use a solução de coloração dentro de 15 minutos após a preparação. - Prepara-se uma câmara humidificada, colocando uma toalha de papel humedecido com água destilada para um recipiente de plástico grande o suficiente para segurar uma placa de 96 poços. Adicionar 200 uL de Xsolução de coloração -gal por poço da placa de 96 poços e colocar a placa numa câmara humidificada.
- Incubar câmara humidificada contendo a placa de 96 poços a 37 ° C para permitir o desenvolvimento de um precipitado de cor azul. Para os embriões E8.5, incubar a placa de O / N (12 - 16 horas). Para culturas de neuroesferas, incubar a placa durante 4-8 horas.
- Leitura da absorvância a 610 OD e imagem
- Após a reação de cor, remova a solução de coloração LacZ e substituir com 200 ul 1x PBS. Medir a absorvância a 610 nm utilizando um leitor de placas ELISA padrão para quantificar a resposta repórter para RA. Imagem poços individuais usando um microscópio estereoscópico padrão equipado com uma câmera.
6. Subclonagem de F9 raras células-LacZ
- Verificando F9 RARE-LacZ rResponse à AR
- Antes de iniciar quaisquer experiências, testar a resposta das células RARE-LacZ F9 para RA. Placa F9 RARE-LacZ cells em placas de 96 poços (ver secção 5.1), e adicione 1 nM all-trans ácido retinóico (veja o passo 5.3). Incubar numa câmara humidificada a 37 ° CO / N.
- Visualize desenvolvimento de precipitado de cor azul usando um microscópio. Se o desenvolvimento de cor não é uniforme por todas as células no poço (ver Figura 1B, à esquerda), efectuar a subclonagem detalhado abaixo.
- Subclonagem de F9 raras células-LacZ
- Dividir as células RARE-LacZ F9 cultivadas em placas de 10 cm, conforme detalhado na etapa 2.2.2. Em vez de uma razão de 1:10, chapear uma baixa densidade de semeadura de 1 x 10 5 células / 10 ml numa placa de 10 cm para permitir o crescimento de colónias isoladas de tal modo que cada colónia surge a partir de uma célula RARO-LacZ único F9.
- Após dois dias, revestimento de uma placa de 24 poços com 500 ul de 0,2% de gelatina por poço, durante 30 min. Remoção da solução de gelatina e lavar os poços duas vezes com 500 mL de água destilada. Substituir a água com 500 mL de meio de cultura celular RARE-LacZ F9.
- Escolha uma colónia utilizando uma ponta de pipeta estéril P10 ea transferência para um poço; fazer isso 24 vezes para obter 24 colónias individuais. Cultura a 37 ° C, 5% de CO 2 durante 3 - 4 dias.
- Dividir as colónias individuais em duas placas de 24 poços. Após 2 dias em cultura, adicionar 1 nM de RA para cada poço de uma placa de 24 poços e cultura D / N. Execute coloração LacZ, conforme detalhado na seção 5.4 para testar altos respondedores. Visualizar reacção de cor de cada poço sob um microscópio para determinar respondedores fortes e uniformes.
- Uma vez que uma resposta forte do subclone é determinada, expandir a cultura correspondente de outra placa de 24 poços. Expandir ainda mais que a colônia em uma placa de 10 cm, congelar-se vários frascos conforme detalhado na seção 2.3, e descartar todas as outras colônias.
Nota: Apenas cerca de um quarto das colônias originais resultar em altos respondedores. Normalmente, a primeira rodada de subclonagem não resulta em coloração LacZ uniforme e uma rodada subseqüente de subclonagem precisa ser feito paraalcançar respondedores fortes uniformes.
Resultados
O LacZ-RARA F9 repórter é uma linha de células de carcinoma embrionário aderentes cultivadas na superfície revestida de gelatina. A construção repórter permite que as células respondam quantitativamente a RA com uma indução proporcional de beta-galactosidase. 11,12,14,18. Estas células exibem uma morfologia epitelial (Figura 1A). Devido à sua elevada taxa de duplicação, recomenda-se que estas células sejam divididas a cada 2 - 3 dias a uma razão de 1:10. Durante o nosso trabalho com esta linha de células relatora, observou-se que mesmo com a adição de G418 no meio de cultura, a resposta destas células a RA enfraquece depois de várias passagens (Figura 1B, à esquerda), e isso pode afectar a capacidade de repórter de esta linha de células. Esta perda de capacidade de resposta pode ser devida à perda parcial do transgene em passagens posteriores. Como tal, a subclonagem periódica é necessária para assegurar respondedores fortes e uniformes de RA (Figura1B, à direita).
Embora várias utilizações desta linha celular foi publicado anteriormente 12,14-18, aqui relatado é o uso desta linha de células para medir os níveis endógenos de AR a partir de embriões E8.5 individuais com diferentes genótipos. Os resultados Gpr161 VL / VL mutação no diminuiu RA embrionário de sinalização 22. Tal como mostrado por co-cultura de embriões dissociadas com raras células F9-LacZ, estes Gpr161 VL / VL embriões reduziram endógena RA em comparação com crias da mesma ninhada de tipo selvagem (Figura 2A). Devido à versatilidade desta linha de células relatora, também aqui relatado é uma nova utilização dessas células para detectar níveis RA produzidos por culturas de neuroesferas obtidos a partir de ratinhos adultos Gpr161 wt / wt (Figura 2B). Esta linha de células repórter foi capaz de demonstrar que as culturas de neuroesferas de células-tronco da medula espinhal adultos produzir RA endógeno. A grande diffrência na intensidade de coloração indica uma resposta de células repórter maior para neurospheres da medula espinhal, em comparação com embriões E8.5. Isto pode ser devido aos níveis muito mais elevados de AR gerados pelos neuroesferas ao longo do tempo em comparação com os embriões E8.5, o que pode ser devido ao facto de neuroesferas culturas são mais homogéneo do que os embriões E8.5 e, assim, conter mais células RA-produtoras.
A adição de diferentes concentrações de resultados a-AR em uma resposta linear dependente da dose das células repórter. Esta resposta pode ser medida colorimetricamente por leitura da absorvância a 610 nm. A curva padrão gerada pode então ser utilizada para quantificar os níveis de AR em amostras, tal como em culturas de tipo selvagem neuroesferas (Figura 3A) ou de embriões E8.5 (Figura 3B).
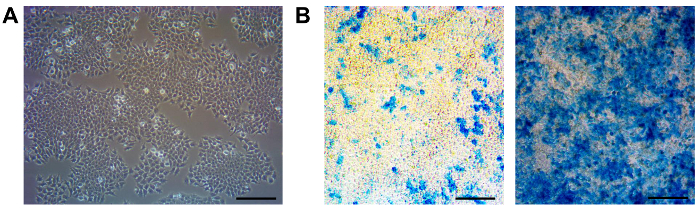
Figura 1. Manutenance e Subclonagem de raras células-LacZ F9. (A) Uma imagem de contraste de fase de células RARE-LacZ F9 é mostrado. Estas células têm um tempo de duplicação de 10 h ~ e tem de ser transmitido a cada 3 dias. (Aproximadamente 70 - 80% de confluência) com uma razão de 01:10 (B) controlo periódico de culturas com a adição de 1 nm a-AR e LacZ subsequente coloração deve ser feito para garantir culturas permanecem respondedores fortes e uniformes de RA (direita). Em caso de maus respondedores e não-uniformes (esquerda), deve ser realizada subclonagem. Escala de barras 100 mm. Por favor clique aqui para ver uma versão maior desta figura.
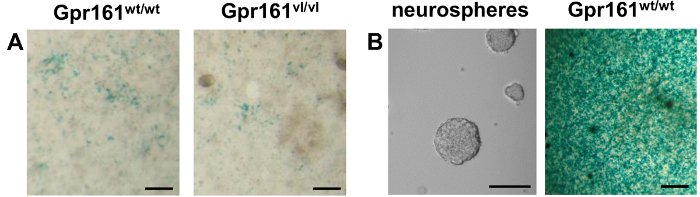
Amostras Figura 2. LacZ Coloração de Co-cultura (dissociado E8.5 Embriões / neuroesferas) e F9 raras células-LacZ. (A) embrião de rato E8.5 s de vários genótipos foram dissociadas e semeadas em cima de raras células-LacZ F9. LacZ coloração 24 horas mais tarde permite a visualização de resposta das células F9 RARE-LacZ a RA endógena produzidos por amostras co-cultivadas. O Gpr161 vl mutação resulta na diminuição da RA endógena como visualizadas pela resposta reduzida das células repórter. (B) Esquerda. Uma imagem de contraste de fase de neuroesferas cultivadas a partir da medula espinhal células-tronco neurais adultas é mostrado. Certo. Neurospheres derivados de adulto Gpr161 medula espinhal p / p foram dissociadas e semeadas em cima de raras células-LacZ F9. A presença de precipitado azul após coloração LacZ indicar a presença de RA endógena nestes neuroesferas. A diferença na intensidade de coloração entre neuroesferas e embriões E8.5 co-culturas indicam maiores níveis de RA presente em neurospheres do que embriões E8.5. Escala das barras 100 um.target = "_ blank"> Clique aqui para ver uma versão maior desta figura.

Figura 3. Curva padrão e Colorimétrico quantificação dos níveis de RA. A resposta da linhagem de células repórter F9 RARO-LacZ pode ser medido colorimetricamente a 610 nm utilizando um leitor de placas ELISA padrão. (A) Curva padrão representativo, utilizado para quantificar os níveis relativos de RA tipo selvagem neurosphere cultura s. (B) Quantificação dos níveis relativos de AR a partir de embriões E8.5 co-cultivadas. N = 3; * P <0,05, teste t de estudante. As barras de erro SEM. Por favor clique aqui para ver uma versão maior desta figura.
| StoBuffers ck / Soluções | componentes | Condições de armazenamento |
| 10% de desoxicolato de sódio mono-hidratado (C 24 H 39 NaO 4 · H2O) | 10 ml em 100 ml de dH2O | 4 ºC |
| Cloreto de magnésio 1 M (MgCl2) | RT | |
| 100x ferrocianeto de potássio (K 4 [Fe (CN) 6] · 3 H 6 O) | 2,12 g em 10 ml de dH2O | RT no escuro |
| 100x ferricianeto de potássio (K 3 [Fe (CN) 6]) | 1,64 g em 10 ml de dH2O | RT no escuro |
| 20 mg / ml de X-gal (5-bromo-4-cloro-3-indolil-β-d-galactopiranósido) | adicionar 5 ml de dimetil formamida para fazer 20 mg solução estoque / ml | -20 ºC |
| 10 mM de (3 mg / ml), todos os trans ácido retinóico | Dissolve-se 50 mg em 16,67 ml de etanol absoluto. Prepare a aliquotas de 1 mL. | -80 ºC no escuro, em tubos de 1,5 ml âmbar microcentrífuga |
| papaína | dissolver um frasco em 7 ml de HBSS | 4 ºC |
Tabela 1. Tampões e Soluções composições.
| Trabalhando Buffers / Soluções | componentes | Condições de armazenamento |
| meio de cultura de células F9 RARE-LacZ | 50 mL de soro bovino fetal (FBS) (concentração final 10%) | Filtrar-esterilizar. |
| 5 ml de 100 x penicilina estreptomicina (final de 1X conc) | Armazenar a 4 ºC. | |
| 4ml 50 mg / ml de G418 (final de conc 0,4 mg / ml) | ||
| para 500 ml de DMEM / F-12 (com L-glutamina e HEPES) | ||
| 0,2% de gelatina | 25 ml de 2,0% de gelatina | Armazenar a 4 ºC. |
| 80 ml de água destilada | ||
| Misture bem | ||
| 70% de etanol | 30 ml de etanol a 95% | Coloque no frasco de spray. |
| 70 ml de água destilada | Armazenar a RT | |
| meio de dissociação Neurosphere | 1 ml 20U papaína | preparar, de fresco cada vez |
| 100 ul 13 mg / ml de tripsina | ||
| 100 ul de 7 mg de ácido hialurónico / ml | ||
| 28 ul de 10 mg / ml de ADNasel | ||
| 50 ul de 4 mg / ml de ácido quinur�ico | ||
| meio de cultura Neurosphere | DMEM / F-12 (com L-glutamina e HEPES) | preparar, de fresco cada vez |
| 2% suplemento B-27 | ||
| 20 factor de ng / mL de crescimento de fibroblastos (FGF) | ||
| factor de crescimento epidermal 20 ng (EGF) | ||
| 2,5% de glutaraldeído | 250 ul 50% de glutaraldeído | preparar, de fresco cada vez |
| 4750 ul de 1x PBS | ||
| solução de lavagem LacZ | 0,5 ml de 10% de desoxicolato (concentração final 0,1%) | Armazenar a 4 ºC. |
| 1,0 ml de 100% de NP-40 (concentrado final de 0,2%) | ||
| 50 ml de PBS 10X | ||
| água destilada para 500 ml | ||
| solução de coloração X-gal | ferrocianeto de potássio 1x | preparar, de fresco cada vez |
| ferricianeto de potássio 1x | ||
| 1 mg / ml de X-gal | ||
| ao volume apropriado usando solução de lavagem LacZ | ||
| F9 LacZ RARO de médio congelamento | F9 meio de cultura RARE-LacZ + 5% de DMSO | preparar, de fresco cada vez |
Tabela 2. Os tampões de Trabalho e Solution composições.
Discussão
A linha de células F9 RARO-LacZ 14 é um poderoso sistema que pode ser usado para a detecção de RA produzido por explantes de tecido 12,14,17,18. É sensível a concentrações de RA tão baixas como 100 fM, sem resposta não específica detectada em células não tratadas com RA 12,14,18. Além disso, as células repórter responder aos RA todo-trans de uma forma linear dentro de um intervalo específico de concentração, permitindo assim que a reacção de LacZ a ser quantificado e utilizado para determinar a magnitude de níveis RA 12,14,18. O ensaio de repórter RA rápido e fácil aqui apresentado utiliza a linha F9 de células repórteres RARE-LacZ para visualização (Figura 2) e medição quantitativa relativa (Figura 3) de embriões e adultos cultivadas células-tronco neurais. Este sistema repórter permite a comparação dos níveis endógenos de AR entre amostras individuais, como mostrado na Figura 2. É sensível o suficiente para ser capaz de detectar RAgerado por embriões E8.5 individuais (Figura 2A), bem como RA produzidos por neuroesferas cultivadas (Figura 2B). A resposta dose-dependente desta linha de células em diferentes concentrações de RA permite a quantificação dos níveis de RA (Figura 3A) nas amostras, bem como a comparação dos níveis relativos entre as amostras de RA (Figura 3B). É importante observar que a linhagem de células repórter RARO F9 mede a quantidade total de RA gerado pelas amostras de tecido ao longo do tempo de incubação. Isto é equivalente ao saldo líquido de síntese de RA e catabolismo.
Enquanto o sistema repórter de células F9 RARE-LacZ é altamente sensível e versátil, existem várias etapas críticas de solução de problemas que temos incorporadas a fim de garantir a fiabilidade deste sistema. Em primeiro lugar, como se mostra na Figura 1, é importante para manter a saúde destas células através de passagens regulares sem que elas glinha até à confluência. Em segundo lugar, temos observado mais tarde passagens tendem a resultar em respostas RA inconsistentes, mesmo se as culturas são constantemente mantidos sob selecção com G418. Para solucionar isso, recomenda-se a descartar culturas após 20 passagens e descongelar um novo frasco. Além disso, os controlos regulares devem ser realizados para assegurar que as células repórter ainda apresentam uma resposta forte para a presença de RA nos meios de comunicação. Em terceiro lugar, se as primeiras passagens exibir fraca resposta ou não-uniforme para RA (Figura 1B, à esquerda), uma ou várias rondas de subclonagem podem ser necessários até respondedores fortes são obtidos (Figura 1B, righ t). Finalmente, antes da co-cultura, recomenda-se que as amostras de tecidos, tais como embriões e neuroesferas dissociadas são para células individuais. Temos observado que a dissociação das amostras Resultados das medições colorimétricas mais consistentes. Isto pode ser devido a uma distribuição mais uniforme da AR em poços de cultura, tal como as células dissociadas são em uniformulário de contato com as células repórter.
Várias modificações também foram feitas para o protocolo original de 14. Em primeiro lugar, a resposta RA das células F9 RARO-LacZ foram quantificadas directamente através da fixação das células e a medição da absorvência a 610 nm em vez de células de recolha e análise de lisado para a actividade de b-galactosidase 14. Outra modificação é a co-cultura directa de amostras dissociadas com F9 RARO-LacZ antes da quantificação da resposta RA. Métodos anteriores relataram a cultura de amostras separado e adicionando apenas a mídia a partir destas culturas a F9 RARE-LacZ 16,18.
Apesar de ser um sistema poderoso, o ensaio repórter RARE-LacZ F9 tem várias limitações. Uma limitação desta linha celular repórter é que, embora ele responde fortemente para a presença de todo-trans RA, que também responde a outros isómeros do ácido retinóico, incluindo 9-cis-RA e 13-cis-RA; no entanto, eles são 100 vezes mais sensíveis à all-trans-RA compavermelho para os outros isómeros 18. Uma outra limitação deste sistema é que a resposta dependente da dose linear só cai entre 10 -13 M a 10 -7 M a RA-14,18; Assim, se a comparação dos níveis de RA fora destes limites, pode ser necessário efectuar uma diluição de série da amostra até que as medições estão dentro do intervalo linear. Por último, uma vez que este é essencialmente um ensaio colorimétrico, o ponto final do desenvolvimento da cor pode variar entre amostras e experimentos. Assim, é importante que uma curva padrão estar sempre banhado em paralelo para cada experiência de forma a utilizá-lo para a quantificação da resposta das células repórter.
Em conclusão, nós relataram o uso da linha celular repórter RARE-LacZ RA F9 para medir os níveis de AR quantitativamente em embriões E8.5 e, anteriormente não declarada, em neurospheres. A versatilidade deste sistema repórter pode permitir que a quantificação dos níveis de RA em virtualmente qualquer tipo de célula ou tecido, e may resultar no desenvolvimento de aplicações variadas no futuro.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We would like to acknowledge Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) for providing us with the F9 RARE-LacZ cells and technical support. This study is funded by the New Jersey Commission on Spinal Cord Research (NJCSCR) (Grantnumber:10-3092-SCR-E-0) and the New Jersey Commission on Brain Injury Research (NJCBIR) (Grant number: CBIR13FEL006).
Materiais
| Name | Company | Catalog Number | Comments |
| C3H/HeSn-Gpr161vl/J mouse strain | Jackson Laboratory | 000316 | |
| F9 RARE-LacZ reporter cell line | from Dr. Michael Wagner (SUNY Downstate Medical Center) and Ben Thiede (Dr. Jeff Corwin lab, University of Virginia) | ||
| DMEM/F-12 (with L-glutamine and HEPES) | ThermoFisher Scientific | 11330-057 | |
| Fetal Bovine Serum (FBS), qualified | ThermoFisher Scientific | 26140-079 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; warm in 37 °C for media preparation |
| Penicillin/Streptomycin | ThermoFisher Scientific | 15140-122 | Store at -20 °C in 10-ml aliquots to avoid repeated freeze-thaw; light-sensitive |
| G418 | ThermoFisher Scientific | 10131-027 | Store at 4 °C; light-sensitive |
| 2% Gelatin | Sigma Aldrich | G1393 | Store at 4 °C |
| B-27 supplement (2 % stock solution) | ThermoFisher Scientific | 17504-044 | Store at -20 °C in 1-ml aliquots to avoid repeated freeze-thaw; warm at room temperature for media preparation |
| Murine Epidermal Growth Factor (EGF) | PeproTech | 315-09 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1xPBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| Murine Fibroblast Growth Factor (FGF)-basic | PeproTech | 450-33 | Prepare 100 μg/ml stock solution in 0.1% bovine serum albumin (BSA) in 1x PBS; prepare working concentrations by diluting with 1x PBS; store at -20 °C |
| 50% glutaraldehyde | Amresco | M155 | Store at 4 °C |
| Sodium deoxycholate monohydrate (C24H39NaO4 · H2O) | Sigma Aldrich | D5670 | Store at RT |
| X-gal (5-bromo-4-chloro-3-indolyl-β-d-galactopyranoside) | Promega | V3941 | Store stock at -20 °C |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | 41639 | Store at RT |
| all-trans Retinoic Acid (at-RA) | Sigma Aldrich | R-2625 | Store 1 ml aliquots of stock in -80 °C; extremely sensitive to light |
| TrypLE Express | ThermoFisher Scientific | 12605-010 | Store at RT |
| 0.25% trypsin-EDTA | ThermoFisher Scientific | 25200-056 | alternative to TrypLE Express; aliquot and store at -20 °C |
| Hank's Balanced Salt Solution (HBSS) | ThermoFisher Scientific | 14170-112 | Store at 4 °C |
| 10x phosphate buffered solution (PBS) | ThermoFisher Scientific | 10010-023 | Store at 4 °C |
| Papain | Worthington | LK003176 | Store at 4 °C. |
| Trypsin | Worthington | LS003703 | Store in 1 ml aliquots at -20 °C. |
| Hyaluronic acid | Calbiochem | 385908 | Store 200 μl aliquots at -20 °C. |
| DNaseI | Worthington | LS002139 | Store in 200 μl aliquots at -20 °C |
| Kynurenic acid | Sigma Aldrich | K3375 | Store in 200 μl aliquots at -20 °C |
| 95% ethanol | |||
| Mr. Frosty Freezing container | ThermoFisher Scientific | 5100-0001 | |
| 10 cm culture dish (non-cell culture treated) | |||
| 10 cm culture dish (cell culture treated) | |||
| 6 cm culture dish (non-cell culture treated) | |||
| 96-well cell culture plates | |||
| 1.5 ml microcentrifuge tubes | |||
| 1.5 ml amber microcentrifuge tubes | |||
| 1.5 ml cryovials | |||
| 37 °C water bath | |||
| surgical scissors | |||
| fine surgical scissors | |||
| no. 5 forceps | |||
| blunt-ended forceps | |||
| scalpel blade | |||
| glass pasteur pipettes | |||
| cotton | |||
| alcohol lamp | |||
| ELISA plate reader | |||
| stereomicroscope |
Referências
- Vilhais-Neto, G. C., Pourquie, O. Retinoic acid. Curr Biol. 18 (5), R191-R192 (2008).
- Drager, U. C. Retinoic acid signaling in the functioning brain. Science Signalling. 324, 1-3 (2006).
- Lane, M. A., Bailey, S. J. Role of retinoid signalling in the adult brain. Prog Neurobiol. 75 (4), 275-293 (2005).
- Maden, M. Retinoid signalling in the development of the central nervous system. Nat Rev Neurosci. 3 (11), 843-853 (2002).
- Maden, M. Retinoids and spinal cord development. J Neurobiol. 66 (7), 726-738 (2006).
- Rhinn, M., Dolle, P. Retinoic acid signalling during development. Development. 139 (5), 843-858 (2012).
- Ang, H. L., Deltour, L., Hayamizu, T. F., Zgombic-Knight, M., Duester, G. Retinoic acid synthesis in mouse embryos during gastrulation and craniofacial development linked to class IV alcohol dehydrogenase gene expression. J Biol Chem. 271 (16), 9526-9534 (1996).
- Ang, H. L., Duester, G. Stimulation of premature retinoic acid synthesis in Xenopus embryos following premature expression of aldehyde dehydrogenase ALDH1. Eur J Biochem. 260, 227-234 (1999).
- Bastien, J., Rochette-Egly, C. Nuclear retinoid receptors and the transcription of retinoid-target genes. Gene. 328, 1-16 (2004).
- Chatzi, C., Cunningham, T. J., Duester, G. Investigation of retinoic acid function during embryonic brain development using retinaldehyde-rescued Rdh10 knockout mice. Dev Dyn. 242 (9), 1056-1065 (2013).
- Sakai, Y., Drager, U. C. Detection of retinoic acid catabolism with reporter systems and by in situ hybridization for CYP26 enzymes. Methods Mol Biol. 652, 277-294 (2010).
- Yamamoto, M., Drager, U. C., McCaffery, P. A novel assay for retinoic acid catabolic enzymes shows high expression in the developing hindbrain. Dev Biol Res. 107, 103-111 (1998).
- Rossant, J., Zirngibl, R., Cado, D., Shago, M., Giguere, V. Expression of a retinoic acid response element-hsplacZ transgene defines specific domains of transcriptional activity during mouse embryogenesis. Genes & Dev. 5, 1333-1344 (1991).
- Wagner, M., Han, B., Jessel, T. M. Regional differences in retinoid release from embryonic neural tissue detected by an in vitro reporter assay. Development. 116, 55-66 (1992).
- Luo, T., Wagner, E., Crandall, J. E., Drager, U. C. A retinoic-acid critical period in the early postnatal mouse brain. Biol Psychiatry. 56 (12), 971-980 (2004).
- Luo, T., Wagner, E., Grun, F., Drager, U. C. Retinoic acid signaling in the brain marks formation of optic projections, maturation of the dorsal telencephalon, and function of limbic sites. J Comp Neurol. 470 (3), 297-316 (2004).
- Kelley, M. W., Xu, X. M., Wagner, M. A., Warchol, M. E., Corwin, J. T. The developing organ of Corti contains retinoic acid and forms supernumerary hair cells in response to exogenous retinoic acid in culture. Development. 119, 1041-1053 (1993).
- McCaffery, P., Drager, U. C. Hot spots of retinoic acid synthesis in the developing spinal cord. Proc Natl Acad Sci. 91, 7194-7197 (1994).
- Hu, L., Gudas, L. J. Cyclic AMP analogs and retinoic acid influence the expression of retinoic acid receptor alpha, beta, and gamma mRNAs in F9 teratocarcinoma cells. Mol Cell Biol. 10 (1), 391-396 (1990).
- Martin, G. R. Teratocarcinomas and mammalian embryogenesis. Science. 209 (4458), 768-776 (1980).
- Strickland, S., Mahdavi, V. The induction of differentiation in teratocarcinoma stem cells by retinoic acid. Cell. 15 (2), 393-403 (1978).
- Li, B. I., et al. The orphan GPCR, Gpr161, regulates the retinoic acid and canonical Wnt pathways during neurulation. Dev Biol. 402 (1), 17-31 (2015).
- Hogan, B., Constantini, F., Lacy, E. Manipulating the Mouse Embryo: A Laboratory Manual. , 1st, Cold Spring Harbor Laboratory. (1986).
- Deleyrolle, L. P., Reynolds, B. A. Isolation, expansion, and differentiation of adult Mammalian neural stem and progenitor cells using the neurosphere assay. Methods Mol Biol. 549, 91-101 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados