Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La electroforesis capilar para supervisar Péptido injerto sobre quitosano películas en tiempo real
En este artículo
Resumen
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Resumen
electroforesis capilar-solución libre (CE) separa los analitos, compuestos generalmente practicados en solución a través de la aplicación de un campo eléctrico. En comparación con otras técnicas de separación analíticas, tales como cromatografía, CE es barato, robusto y eficaz no requiere la preparación de muestras (para una serie de matrices naturales complejos o muestras poliméricas). CE es rápido y se puede utilizar para seguir la evolución de las mezclas en tiempo real (por ejemplo, cinética de la reacción química), ya que las señales observadas para los compuestos separados son directamente proporcionales a su cantidad en solución.
Aquí, la eficiencia de la CE se demuestra para el seguimiento del injerto covalente de los péptidos en las películas de quitosano para aplicaciones biomédicas posteriores. propiedades antimicrobianas y biocompatibles de quitosano lo convierten en un material atractivo para aplicaciones biomédicas tales como sustratos para el crecimiento celular. Covalentemente injerto de los RGDS de péptidos (arginina - glicina -ácido aspártico - serina) sobre la superficie de películas de quitosan tiene por objeto mejorar la unión celular. Históricamente, cromatografía y análisis de aminoácidos han sido utilizados para proporcionar una medición directa de la cantidad de péptido injertado. Sin embargo, la separación rápida y la ausencia de preparación de la muestra proporcionada por CE permite el monitoreo en tiempo real igualmente precisa todavía de el proceso de injerto de péptidos. CE es capaz de separar y cuantificar los diferentes componentes de la mezcla de reacción: la (no injertado) péptido y los agentes de acoplamiento químico. De esta manera el uso de CE resulta en películas mejoradas para aplicaciones de aguas abajo.
Las películas de quitosano se caracterizaron mediante espectroscopía de RMN de estado sólido (resonancia magnética nuclear). Esta técnica es más tiempo y no se puede aplicar en tiempo real, pero da una medición directa del péptido y por lo tanto valida la técnica de la CE.
Introducción
Electroforesis capilar solución libre (CE) es una técnica que separa compuestos en soluciones basadas en su relación de 1,2-carga a la fricción. Relación de carga de tamaño se menciona a menudo en la literatura, pero esta simplificación no se aplica a los polielectrolitos, incluyendo polipéptidos en este trabajo, y también se demuestra que no es apropiado para pequeñas moléculas orgánicas 3. CE se diferencia de otras técnicas de separación en que no tiene una fase estacionaria, solamente un electrolito de fondo (generalmente un tampón). Esto permite que la técnica sea robusto en su capacidad para analizar una amplia gama de muestras con matrices complejas 4 tales como fibras vegetales 5, cervezas de fermentación de 6 injerto sobre polímeros sintéticos 7, muestras de alimentos 8, y péptidos difícilmente solubles 9 sin preparación de la muestra tedioso y purificación. Esto es especialmente significativo para polielectrolitos complejos que tienen problemas de disolución (sUCH como quitosano 10 y gellan goma 11) y por lo tanto existe como agregado o precipitado en la solución y se han analizado con éxito sin la filtración de la muestra. Además, el análisis de azúcares en los cereales para el desayuno implicado la inyección de muestras con partículas de muestras de cereales para el desayuno precipitado en agua 8. Esto también se extiende al análisis de polielectrolitos o copolímeros 12,13 ramificados. Mucho trabajo también se ha completado en el desarrollo de técnicas de CE específicamente para el análisis de proteínas para la proteómica 14, la separación quiral de los péptidos naturales o sintéticos 15 y separaciones de microchips de proteínas y péptidos 16. Dado que la separación y análisis se llevan a cabo en un capilar, solamente pequeños volúmenes de muestra y los disolventes se utilizan que permite CE tener un coste de funcionamiento inferior a otras técnicas de separación incluyendo cromatografía 5,6,17. Dado que la separación por CE es rápido, permite que el monitoanillo de la cinética de reacción. Esto se demostró en el caso de los injertos de los péptidos en las películas de quitosano para mejorar la adhesión de las células 18.
El quitosano es un polisacárido derivado de la -deacetylation N de la quitina. Películas de quitosan se pueden utilizar para diversas aplicaciones biomédicas tales como bioadhesivos 19 y sustratos de crecimiento celular 18,20, debido a la biocompatibilidad de quitosano 21. La unión celular a las proteínas de la matriz extracelular específicas, tales como fibronectina, colágenos y laminina, está directamente relacionada con la supervivencia de las células 22. Notablemente, diferentes tipos de células a menudo requieren fijación a diferentes proteínas de la matriz extracelular para la supervivencia y la función apropiada. La unión celular a las películas de quitosano ha demostrado ser mejorado mediante el injerto de fibronectina 23; Sin embargo, la preparación, la purificación y el injerto de tales proteínas grandes no es económicamente viable. Alternativamente una serie de pequeños péptidos VHAe ha demostrado que es capaz de imitar las propiedades de las grandes proteínas de la matriz extracelular. Por ejemplo, los péptidos tales como los RGD miméticos fibronectina (arginina - glicina - ácido aspártico) y RGDS (arginina - glicina - ácido aspártico - serina) se han utilizado para facilitar y aumentar la unión celular 24. Covalente injerto de MFG sobre pelıculas de quitosano dio lugar a la unión celular mejorada para las células conocidas para unir a la fibronectina in vivo 18. La sustitución de proteínas más grandes le gusta la fibronectina con péptidos más pequeños que tienen la misma funcionalidad proporciona una importante reducción de costes.
Aquí, se realizó péptido injerto de quitosano como publicado previamente 18. Como se ha demostrado anteriormente, este enfoque proporciona injerto simple y eficiente mediante el uso de los agentes de acoplamiento EDC-HCl (1-etil-3- (3-dimetilaminopropil) carbodiimida) y NHS (N -hidroxisuccinimida) para funcionalizar el ácido carboxílico de los RGDS ser injertado en lapelícula de quitosano. Dos ventajas de este método de injerto son que no requiere ninguna modificación del quitosano o del péptido, y se llevaron a cabo en medio acuoso para maximizar la compatibilidad con futuras aplicaciones de cultivo celular 18,20. Como los agentes de acoplamiento y el péptido pueden ser cargadas, CE es un método adecuado para el análisis de la cinética de reacción. Es importante destacar que, el análisis de la cinética de reacción a través de CE permite la supervisión en tiempo real de la reacción de injerto, y por lo tanto permite tanto la optimización y cuantificar el grado de injerto.
Si bien no es habitualmente necesario, los resultados del análisis CE se pueden validar fuera de línea por una medición directa del péptido injerto sobre las películas de quitosan mediante RMN en estado sólido (resonancia magnética nuclear) espectroscopia de 25,26 para demostrar el injerto covalente del péptido sobre la película 18. Sin embargo, en comparación con la espectroscopía de RMN en estado sólido, el análisis en tiempo real proporcionada porCE permite la cuantificación de la consumo de péptido en tiempo real y por lo tanto la capacidad de evaluar la cinética de la reacción.
El método mencionado anteriormente es simple y permite el análisis en tiempo real de péptido injerto sobre películas de quitosan con cuantificación indirecta de la extensión de la de injerto. El método demostrado se puede extender a la evaluación cuantitativa en tiempo real de las diferentes reacciones químicas, siempre que los reactivos o los productos a ser analizados se puede cargar.
Protocolo
1. Preparación de quitosano Films
- Pesar 2 g de ácido acético glacial, completa a 100 ml con agua ultrapura.
- Pesar 1,7 g de polvo de quitosano, añadir 100 ml de la solución al 2% m / m de ácido acético acuoso. Se agita durante 5 días con barra de agitación y placa de agitación magnética a temperatura ambiente, ya sea cubierto con papel de aluminio o en la oscuridad.
- Se centrifuga la dispersión de quitosano a 1.076 xg, a 23 ° C durante 1 hora. Recoger el sobrenadante con una jeringa y desechar el precipitado.
- Para cada película, alícuota de 10 ml de la suspensión de quitosano en un plato de plástico de 9 cm de Petri a temperatura ambiente. Deje las películas cubiertas secar durante al menos 7 días.
- Con unas tijeras cortan las películas secas en 1 x 1 cm cuadrados. Nota: El experimento se puede detener en esta etapa.
2. Preparación de solución salina tamponada con fosfato (PBS)
- Pesar 8 g de cloruro de sodio, 0,2 g de cloruro de potasio, 1,44 g de hidrógeno disódico phosfosfato y 0,24 g de fosfato de dihidrógeno de potasio.
- Disolver estos productos químicos pesaron en 800 ml de agua ultrapura y se valora la solución con ácido clorhídrico concentrado a pH 7,4.
Nota: El experimento se puede detener en esta etapa.
3. Preparación de 75 mM borato de sodio tampón a pH 9,2
- Pesar 3,0915 g de ácido bórico. Disolver en 75 ml de agua ultrapura.
- Valorar la solución de ácido bórico a un pH de 9,2 con una solución de hidróxido de sodio a una concentración de 10 M o superior.
Precaución: Concentrado soluciones de hidróxido sódico son corrosivos y deben ser manejados con guantes. - Completar con agua ultrapura para obtener 100 ml de solución. Esto produce un tampón de borato de sodio 500 mM a pH 9,2.
- Diluir el tampón de borato de sodio 500 mM con agua ultrapura a un tampón de borato de sodio 75 mM. Nota: El experimento se puede detener en esta etapa.
4. Preparación de Chitosan FiLMS para la reacción de injerto
- Enjuague 10 películas de quitosano cuadrados (1 x 1 cm) en 5 ml de PBS durante 2 horas en una placa de Petri a temperatura ambiente.
- Durante este tiempo, preparar y validar el instrumento de electroforesis capilar (paso 5).
5. Preparación y Validación de la Electroforesis Capilar Instrumento
- Preparar un capilar de sílice fundida de 43,5 cm desnudo con un diámetro interno de 50 mm (43,5 cm es la longitud total, la longitud efectiva de la ventana de detección es típicamente 35 cm) por el debilitamiento de la capa exterior de polímero del capilar a la longitud de conjunto con una objeto sin punta luego de tomar la capilaridad.
- Crear una ventana para el capilar mediante el uso de un encendedor para quemar el revestimiento de polímero a 8,5 cm de la entrada y después de enfriarse limpie con etanol. Grabar el recubrimiento del capilar en cada extremo por unos pocos milímetros con un encendedor, y después de que se enfríe limpie con etanol.
- INSI capilar lugarventana de detección e instalarlo en el casete capilar colocándolo en longitudes iguales en la entrada y la salida y enrollándolo alrededor de los ejes de la casete. A continuación, instalar el casete en el instrumento de electroforesis capilar.
- Establecer los parámetros del método para cada separación. En el menú del software seleccione "método" y luego "editar el método completo". Ajustar la temperatura, el tiempo, la tensión, y los viales utilizados para la separación (por ejemplo 25 ° C, 10 min, 30 kV).
- En la sección de pre-acondicionado, establecer los rubores consecutivos: 10 min con hidróxido sódico 1 M (en agua), 5 min con hidróxido de sodio 0,1 M (en agua), 5 min con agua ultrapura y 5 min con tampón de borato de sodio 75 mM a pH 9,2 para el primer método de una serie de análisis.
- Para los métodos siguientes, establecer el conjunto de los sofocos consecutivos en la sección de pre-acondicionamiento: 1 min con hidróxido de sodio 1 M (en agua), 5 min con tampón de borato de sodio 75 mM a pH 9.2.
- En la sección de inyección, establecer los parámetros para una inyección hidrodinámica con una presión de 30 mbar durante 10 seg para todos los métodos. En la sección de separación, establecer las condiciones de separación a 30 kV a 25 ° C durante 9 min para todos los métodos.
NOTA: Consulte el manual de usuario del instrumento CE específico como procedimiento para el funcionamiento del instrumento CE puede variar entre los fabricantes. Preparar la solución de hidróxido de sodio 1 M en el día.
- Inyectar y separar un estándar interno neutral (10 l de 10% v / v sulfóxido de dimetilo (DMSO), en agua diluida en 450 l de tampón de borato de sodio 75 mM). A continuación, inyectar y separar de la misma manera un estándar oligoacrylate (disuelto en agua ultrapura a 10 g ∙ L-1; ver Lista de Materiales) para comprobar la validez del capilar. Una pausa en la secuencia de aquí hasta que la reacción de injerto está listo para comenzar.
6. El injerto de MFG Onto quitosano Cine
- Se pesa el péptido (1 mg MFG)y los agentes de acoplamiento (3 mg EDC-HCl y 2 mg de NHS).
- 2 hr después del inicio de la película de quitosan remojo en PBS, se disuelve el péptido y los agentes de acoplamiento en 5 ml de PBS.
- Tomar una alícuota de 50 l de esta solución. Añadir 2 l de 10% v / v de DMSO en agua como un estándar neutral interna a la parte alícuota. Analizar la alícuota con el CE (véase el paso 7).
- Eliminar los 5 ml de PBS usan para enjuagar las películas de quitosano de la placa de Petri. Añadir la solución de 5 ml de los agentes peptídicos y de acoplamiento a la placa de Petri que contiene las películas de quitosano.
- Cubrir la placa de Petri con una película de parafina y colocarlo en un agitador orbital a temperatura ambiente. Tomar 50 ml de alícuotas de medios de reacción a horas fijas.
NOTA: El tiempo total de análisis con el CE es de 15 minutos, por lo que una parte alícuota se puede tomar cada 15 minutos (o cada 30 minutos si dos reacciones se controlan en paralelo, etc.).- Añadir 2 l de 10% v / v de DMSO en agua como un estándar interno neutral a cada aliquot.
NOTA: Las alícuotas deben ser analizados con el CE en cuanto se toman (véase el paso 7).
- Añadir 2 l de 10% v / v de DMSO en agua como un estándar interno neutral a cada aliquot.
- Después de 4 horas de agitación y remoción alícuota, retire la placa de Petri desde el agitador. Retire el medio de reacción de la placa de Petri. Añadir 5 ml de PBS para enjuagar las películas de quitosano.
- Retire la PBS de la placa de Petri, enjuague la película de quitosano con agua ultrapura y dejar que se sequen durante la noche. Eliminar el agua ultrapura y almacenar las películas a -20 ° C en una placa Petri de plástico.
7. Seguimiento de reacción de injerto Utilizando CE
- Inyectar y alícuotas separadas del medio de reacción inmediatamente después de la retirada de la placa de Petri utilizando las condiciones de análisis que en el apartado 5.2.
- Al término de las separaciones enjuagar el capilar con agua ultrapura para 10 min. Secar a través de una escalera con un vial vacío (aire) durante 10 min.
NOTA: El experimento se puede detener en esta etapa.
8. Los datos Trea tamento para CE
- Comprobar la validez de cada separación, comprobando que tanto la corriente durante la separación y el tiempo de migración del marcador de la movilidad electroosmótico (DMSO en este caso) son similares a los observados para el oligoacrylate separación estándar.
NOTA: Hasta 10-15% variación es aceptable desde el valor actual esperado de unos 50 mu y el valor de tiempo de migración de 1,3 min (valores de movilidad electroforética se deben utilizar en lugar de los tiempos de migración si se requiere una repetibilidad superior). - Para cada separación exitosa, exportar los datos en bruto procedentes del software de electroforesis capilar mediante la selección de un conjunto de datos específico, haciendo clic derecho en la exportación y la selección de una señal apropiada.
- Convertir los datos en bruto registrados por el CE (presentada como absorbancia UV como una función del tiempo de migración). Convertir el eje X (migración tiempo t m) en una μ movilidad electroforética siguiente Ecuación 1:
n 1 "src =" / files / ftp_upload / 54549 / 54549eq1.jpg "/> (1)
donde L es la longitud d al detector, L t es la longitud total del capilar, V es la tensión, y t eo es el tiempo de migración de una especie neutra (el patrón interno DMSO en este caso) 27.
Convertir el eje Y de los datos en bruto (absorbancia en au) a una distribución de movilidades electroforéticas W (μ) siguiente Ecuación 2: 28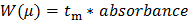 (2)
(2)
9. Caracterización adicional de las películas 18 péptido injertado
- Insertar películas de quitosano péptido injertado, enrollados alrededor de sí mismos, en un rotor de estado sólido RMN 4 mm. Llene el rotor con solución salina tamponada con fosfato a engrosar las películas, y cerrar el rotor. Espere durante unas horas.
- Analizar la película con 13 </ sup> espectroscopia de RMN de C 18.
Resultados
CE es muy adecuado para el control de la injerto de péptidos (por ejemplo, RGDS) sobre películas de quitosano. Agentes de acoplamiento adecuados incluyen EDC-HCl y NHS que activan el péptido debe injertarse en el quitosán (Figura 1). CE es capaz de separar las diferentes moléculas de interés a partir del medio de reacción. Para asignar los picos en el electroferograma, MFG puros, EDC-HCl y se disolvieron NHS, inyectados y se separaron por separado. Despu?...
Discusión
La simplicidad del protocolo descrito aquí lo hace ideal para una amplia aplicación. Sin embargo, especial atención debe prestarse a los siguientes pasos clave.
La preparación del instrumento adecuado CE
Es importante separar un estándar conocido inmediatamente antes de la separación de muestras desconocidas (así como al final de una serie de separaciones) para comprobar la validez del capilar y el instrumento en el día. Esta norma puede ...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
Materiales
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
Referencias
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados