Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Electrophorèse Capillaire pour surveiller Peptide greffant sur chitosan Films en temps réel
Dans cet article
Résumé
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Résumé
capillaire libre solution électrophorèse (CE) sépare analytes, composés généralement pratiqués en solution par l'application d'un champ électrique. Par rapport à d'autres techniques de séparation analytiques, telles que la chromatographie, C'est pas cher, robuste et ne nécessite aucune préparation de l'échantillon (pour un certain nombre de matrices naturelles complexes ou des échantillons polymères) de manière efficace. C'est rapide et peut être utilisé pour suivre l'évolution des mélanges en temps réel (par exemple, la cinétique de réaction chimique), les signaux observés pour les composés séparés sont directement proportionnels à leur quantité dans la solution.
Ici, l'efficacité de la C'est mise en évidence pour la surveillance du greffage covalent de peptides sur des films de chitosane pour des applications biomédicales ultérieures. propriétés anti-microbiennes et biocompatibles de chitosan en font un matériau intéressant pour des applications biomédicales telles que les substrats de croissance cellulaire. greffage covalence les MFG peptidiques (arginine - glycine -l'acide aspartique - serine) sur la surface des films de chitosane vise à améliorer la fixation des cellules. Historiquement, la Chromatographie et l'analyse des acides aminés ont été utilisées pour fournir une mesure directe de la quantité de peptide greffé. Cependant, la séparation rapide et absence de préparation de l'échantillon fourni par CE permet la surveillance en temps réel aussi précise encore du procédé de greffage des peptides. C'est capable de séparer et quantifier les différents composants du mélange réactionnel: (non greffé), des peptides et des agents de couplage chimique. De cette manière, l'utilisation de CE conduit à des films améliorés pour les applications en aval.
Les films de chitosane ont été caractérisés par RMN du solide (résonance magnétique nucléaire) spectroscopie. Cette technique est plus chronophage et ne peut être appliqué en temps réel, mais on obtient une mesure directe du peptide et donc valide la technique de la CE.
Introduction
Capillaire solution gratuite électrophorèse (CE) est une technique qui sépare les composés dans des solutions basées sur leur ratio 1,2 charge-friction. Ratio-Charge à la taille est souvent mentionné dans la littérature, mais cette simplification ne concerne pas les polyélectrolytes, y compris des polypeptides dans ce travail, et a également été montré ne pas être approprié pour les petites molécules organiques 3. CE diffère d'autres techniques de séparation en ce qu 'il n'a pas une phase stationnaire, seul un électrolyte de fond (généralement un tampon). Cela permet à la technique pour être robuste dans sa capacité à analyser une large gamme d'échantillons avec des matrices complexes 4 telles que les fibres végétales 5, fermentation brassins 6 greffage sur des polymères synthétiques 7, des échantillons de produits alimentaires 8 et peptides difficilement solubles 9 sans préparation de l' échantillon fastidieux et purification. Ceci est particulièrement significatif pour les polyélectrolytes complexes, qui ont des problèmes de dissolution (Such comme chitosane 10 et la gomme gellane 11) et donc exister sous forme agrégée ou précipité en solution et ont été analysés avec succès sans filtration de l' échantillon. En outre, l'analyse des sucres dans céréales de petit déjeuner impliqué injectant des échantillons avec des particules d'échantillons de céréales de petit déjeuner précipité dans l' eau 8. Cela va également à l'analyse des polyélectrolytes ou des copolymères ramifiés 12,13. Un travail considérable a également été accompli dans le développement de techniques CE spécifiquement pour l'analyse des protéines pour la protéomique 14, séparation chirale des peptides naturels ou synthétiques 15 et les séparations des micropuces de protéines et de peptides 16. Depuis la séparation et l' analyse ont lieu dans un capillaire, seulement de petits volumes d'échantillon et les solvants sont utilisés , ce qui permet CE d'avoir un coût de fonctionnement inférieur à d' autres techniques de séparation , y compris la chromatographie 5,6,17. Depuis la séparation par C'est rapide, il permet à l'monitoanneau de la cinétique de réaction. Cela a été démontré dans le cas du greffage de peptides sur des films de chitosane pour une meilleure adhérence des cellules 18.
Le chitosan est un polysaccharide dérivé du N -deacetylation de la chitine. Des films de chitosan peuvent être utilisées pour diverses applications biomédicales telles que 19 bioadhésifs et des substrats de croissance cellulaire 18,20, en raison de la biocompatibilité du 21 chitosane. La fixation des cellules aux protéines de la matrice extracellulaire spécifiques, telles que la fibronectine, la laminine et les collagènes, est directement liée à la survie des cellules 22. En particulier, différents types de cellules nécessitent souvent la fixation de différentes protéines de la matrice extracellulaire pour la survie et le bon fonctionnement. La fixation des cellules à des films de chitosane a été montré être amélioré par le greffage de 23 fibronectine; Cependant, la préparation, la purification et le greffage de ces grandes protéines ne sont pas économiquement viables. Alternativement une gamme de petits peptides VHAe sont révélés être capables d'imiter les propriétés des grandes protéines de la matrice extracellulaire. Par exemple, des peptides tels que les mimétiques de fibronectine RGD (arginine - glycine - acide aspartique) et MFG (arginine - glycine - acide aspartique - sérine) ont été utilisées pour faciliter et accroître l' attachement des cellules 24. Covalent greffage de MFG sur des films chitosane a permis d'améliorer la fixation des cellules pour les cellules connues pour attacher à la fibronectine in vivo 18. Substituer plus grandes protéines fibronectine aime avec de plus petits peptides qui ont la même fonctionnalité fournit une réduction significative des coûts.
Ici, peptide greffage chitosane a été réalisée comme précédemment publié 18. Comme cela est démontré plus haut, cette approche fournit un greffage simple et efficace en utilisant les agents de couplage EDC-HCl (1-éthyl-3- (3-diméthylaminopropyl) carbodiimide) et du NHS (N - hydroxysuccinimide) fonctionnaliser l'acide carboxylique de MFG être greffé sur lefilm de chitosane. Deux avantages de ce procédé de greffage est qu'il ne nécessite aucune modification du chitosane ou du peptide, et il est utilisé en milieu aqueux afin de maximiser la compatibilité avec les futures applications de culture cellulaire 18,20. Étant donné que les agents de couplage et le peptide peuvent être chargés, C'est un procédé approprié pour l'analyse de la cinétique de la réaction. Fait important, l'analyse de la cinétique de réaction par l'intermédiaire de la CE permet la surveillance en temps réel de la réaction de greffage et permet ainsi à la fois l'optimisation et la quantification du taux de greffage.
Bien qu'il soit pas systématiquement nécessaire, les résultats de l'analyse de la CE peuvent être validées hors ligne par une mesure directe du peptide greffage sur les films de chitosane en utilisant l' état solide RMN (résonance magnétique nucléaire) spectroscopie 25,26 pour démontrer le greffage covalent du peptide sur le film 18. Cependant, par rapport à la spectroscopie RMN à l'état solide, l'analyse en temps réel fourni parCE permet la quantification de la consommation de peptides en temps réel, et donc la capacité d'évaluer la cinétique de la réaction.
Le procédé mentionné ci-dessus est simple et permet l'analyse en temps réel du peptide greffage sur des films de chitosane avec une quantification indirecte de la mesure de la greffe. La méthode illustrée peut être étendue à l'évaluation quantitative en temps réel des réactions chimiques différentes tant que les réactifs ou les produits à analyser peuvent être chargés.
Protocole
1. Préparation de chitosane Films
- Peser 2 g d'acide acétique glacial, on complète à 100 ml avec de l'eau ultrapure.
- Peser 1,7 g de poudre de chitosane, ajouter 100 ml de 2% m / m acétique solution aqueuse d'acide. Agiter pendant 5 jours avec un barreau d'agitation et de plaque d'agitation magnétique à température ambiante soit recouverte d'une feuille d'aluminium ou dans l'obscurité.
- Centrifuger la dispersion de chitosane à 1076 xg à 23 ° C pendant 1 heure. Recueillir le surnageant avec une seringue et jeter le précipité.
- Pour chaque film, aliquote de 10 ml de la suspension de chitosane en une matière plastique plat de 9 cm de Petri à température ambiante. Laissez les films couverts à sécher pendant au moins 7 jours.
- Utilisation de ciseaux couper les films secs dans 1 x 1 cm carrés. Remarque: L'expérience peut être interrompue à ce stade.
2. Préparation de la solution saline tamponnée au phosphate (PBS)
- Peser 8 g de chlorure de sodium, 0,2 g de chlorure de potassium, 1,44 g disodique phosphate et 0,24 g de dihydrogénophosphate de potassium.
- Dissoudre ces produits pesés dans 800 ml d'eau ultra-pure et titrer la solution avec de l'acide chlorhydrique concentré jusqu'à pH 7,4.
Remarque: L'expérience peut être interrompue à ce stade.
3. Préparation de mM borate de sodium tampon 75 à pH 9,2
- Peser 3,0915 g d'acide borique. Le dissoudre dans 75 ml d'eau ultrapure.
- Titrer la solution d'acide borique à un pH de 9,2 avec une solution d'hydroxyde de sodium à une concentration de 10 M ou plus.
Attention: les solutions d'hydroxyde de sodium concentré sont corrosifs et doivent être manipulés avec des gants. - Avec de l'eau ultra-pure pour obtenir 100 ml de solution. On obtient ainsi un tampon au borate de sodium 500 mM à pH 9,2.
- On dilue le tampon borate de sodium 500 mM avec de l'eau ultra-pure à un tampon de borate de sodium 75 mM. Remarque: L'expérience peut être interrompue à ce stade.
4. Préparation de chitosane Films pour la réaction de greffage
- Rinçage 10 films chitosan carrés (1 x 1 cm) dans 5 ml de PBS pendant 2 h dans une boîte de Petri à température ambiante.
- Pendant ce temps, préparer et valider l'instrument d'électrophorèse capillaire (étape 5).
5. Préparation et validation de l'électrophorèse capillaire Instrument
- Préparer un tube capillaire en silice fondue de 43,5 cm à nu d'un diamètre intérieur de 50 um (43,5 cm est la longueur totale, la longueur effective de la fenêtre de détection est typiquement 35 cm), en affaiblissant le revêtement extérieur polymère du capillaire à la longueur d'ensemble d'une ustensile contondant claquer ensuite le capillaire.
- Créer une fenêtre pour le tube capillaire à l'aide d'un briquet pour brûler le revêtement de polymère à 8,5 cm de l'entrée et après qu'il refroidit l'essuyer avec de l'éthanol. Graver le revêtement du capillaire à chaque extrémité pour quelques millimètres avec un briquet, et après avoir refroidi l'essuyer avec de l'éthanol.
- Lieu capillaire insila fenêtre de détection et de l'installer dans la cassette capillaire en le plaçant à des longueurs égales dans l'entrée et la sortie et l'enrouler autour des broches de la cassette. Ensuite, installez la cassette dans l'appareil d'électrophorèse capillaire.
- Définir les paramètres du procédé pour chaque séparation. Dans le menu du logiciel sélectionnez "méthode", puis "modifier la méthode entière". Réglez la température, le temps, la tension, et les flacons utilisés pour la séparation (par exemple 25 ° C, 10 min, 30 kV).
- Dans la section de pré-conditionnement, régler les bouffées consécutives: 10 min avec 1 M d'hydroxyde de sodium (dans l'eau), 5 min avec de l'hydroxyde de sodium 0,1 M (dans l'eau), 5 min avec de l'eau ultrapure et 5 min avec un tampon de borate de sodium 75 mM à un pH de 9,2 pour le premier procédé d'une série d'analyses.
- Pour les méthodes suivantes, définissez l'ensemble des bouffées consécutives dans la section de pré-conditionnement: 1 min avec 1 M d'hydroxyde de sodium (dans l'eau), 5 min avec un tampon de borate de sodium 75 mM à pH 9.2.
- Dans la section d'injection, de définir des paramètres pour une injection hydrodynamique avec une pression de 30 mbar pendant 10 secondes pour toutes les méthodes. Dans la section de séparation, fixer les conditions de séparation à 30 kV à 25 ° C pendant 9 min pour toutes les méthodes.
REMARQUE: Consultez le mode d'emploi de l'instrument CE spécifique que la procédure pour faire fonctionner l'instrument de la CE peut varier entre les fabricants. Préparer la solution d'hydroxyde de sodium 1 M le jour.
- Injecter et séparer un étalon interne neutre (10 ul de 10% v / v de diméthylsulfoxyde (DMSO), dans de l'eau diluée dans 450 ul de tampon de borate de sodium 75 mM). Puis injecter et séparer de la même manière une norme oligoacrylate (dissous dans de l' eau ultrapure à 10 g ∙ L -1; voir la liste des matériaux) pour vérifier la validité du capillaire. Pause la séquence ici jusqu'à ce que la réaction de greffage est prêt à démarrer.
6. Intensification des MFG SUR DES Chitosan Film
- Peser le peptide (1 mg MFG)et les agents de couplage (3 mg d'EDC-HCl et de 2 mg de NHS).
- 2 heures après le début du trempage du film de chitosane dans du PBS, on dissout le peptide et les agents de couplage dans 5 ml de PBS.
- Prenez une aliquote de 50 pi de cette solution. Ajouter 2 ul de 10% v / v de DMSO dans l'eau comme étalon interne neutre à l'aliquote. Analyser l'aliquote avec CE (voir l'étape 7).
- Retirer les 5 ml de PBS utilisés pour rincer les films chitosane de la boîte de Pétri. Ajouter la solution 5 ml de peptides et agents de couplage à la boîte de Pétri contenant les films de chitosane.
- Couvrir la boîte de Pétri avec un film de paraffine et le placer sur un agitateur orbital à température ambiante. Prendre 50 aliquotes ul de milieu de réaction à des moments.
REMARQUE: La durée totale de l' analyse par C'est de 15 min, donc une aliquote peut être pris toutes les 15 minutes (ou toutes les 30 minutes si les deux réactions sont surveillées en parallèle, etc.).- Ajouter 2 ul de 10% v / v de DMSO dans l'eau comme étalon interne neutre à chaque alIQUOT.
NOTE: Des aliquotes devraient être analysées avec CE dès qu'ils sont prises (voir l'étape 7).
- Ajouter 2 ul de 10% v / v de DMSO dans l'eau comme étalon interne neutre à chaque alIQUOT.
- Après 4 heures d'agitation et l'enlèvement aliquote, retirer la boîte de Pétri de l'agitateur. Retirer le milieu réactionnel à partir de la boîte de Petri. Ajouter 5 ml de PBS pour rincer les films chitosane.
- Retirez le PBS de la boîte de Pétri, rincer le film chitosane avec de l'eau ultrapure et laissez-les sécher pendant la nuit. Retirer l'eau ultrapure et de stocker les films à -20 ° C dans une boîte de Pétri en plastique.
7. Suivi de Réaction de greffage utilisant CE
- Injecter et aliquotes séparées des milieux de réaction immédiatement après le retrait de la boîte de Pétri en utilisant les conditions d'analyse comme dans la section 5.2.
- A l'issue des séparations de rinçage capillaire avec de l'eau ultra pure pendant 10 minutes. Sécher à travers une chasse d'eau avec un flacon vide (air) pendant 10 min.
NOTE: L'expérience peut être interrompue à ce stade.
8. Données Trea VICE pour CE
- Vérifiez la validité de chaque séparation, en vérifiant que les deux le courant lors de la séparation et le temps de migration du marqueur de la mobilité électroosmotique (DMSO dans ce cas) sont similaires à ceux observés pour la oligoacrylate séparation standard.
NOTE: Jusqu'à 10-15% de variation est acceptable de la valeur actuelle attendue d'environ 50 uA et migration valeur temps de 1,3 min (valeurs de mobilité électrophorétique doivent être utilisés à la place des temps de migration si une répétabilité élevée est requise). - Pour chaque séparation réussie, exporter les données brutes à partir du logiciel d'électrophorèse capillaire en sélectionnant un ensemble de données spécifiques, en cliquant à droite sur l'exportation et la sélection d'un signal approprié.
- Convertir les données brutes enregistrées par le CE (présentée en tant que l'absorbance UV en fonction du temps de migration). Convertir l'axe des X (migration temps t m) dans un μ de mobilité électrophorétique suivant l' équation 1:
n 1 "src =" / files / ftp_upload / 54549 / 54549eq1.jpg "/> (1)
où L d est la longueur du détecteur, L t est la longueur totale du capillaire, V est la tension, et t eo est le temps de migration d'une espèce neutre (le standard interne DMSO dans ce cas) 27.
Convertir l'axe Y des données brutes (absorbance en UA) pour une répartition des mobilités électrophorétiques W (μ) suivant l' équation 2: 28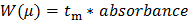 (2)
(2)
9. Caractérisation supplémentaire du film __gVirt_NP_NN_NNPS<__ peptidiques greffé 18
- Insérez des films de chitosane peptidiques greffé, roulées autour d'eux, dans un 4 mm à l'état solide RMN rotor. Remplissez le rotor avec une solution saline tamponnée au phosphate à gonfler les films, et fermer le rotor. Attendez quelques heures.
- Analyser le film avec 13 </ sup> C spectroscopie RMN 18.
Résultats
C'est bien adapté à la surveillance du greffage des peptides (par exemple, RGDS) sur des films de chitosane. Des agents de couplage appropriés comprennent l' EDC-HCl et du NHS qui activent le peptide se greffer sur le chitosan (figure 1). C'est capable de séparer les différentes molécules d'intérêt à partir du milieu réactionnel. Pour attribuer les pics sur l'électrophérogramme, MFG purs, EDC-HCl et NHS ont été dissous, injecté...
Discussion
La simplicité du protocole décrit ici, il est parfaitement adapté à une application à grande échelle. Cependant, une attention particulière doit être accordée à des étapes clés suivantes.
Préparation des instruments de la CE Proper
Il est important de séparer une norme connue immédiatement avant la séparation des échantillons inconnus (ainsi qu'à la fin d'une série de séparations) pour vérifier la val...
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
matériels
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
Références
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon