È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Elettroforesi capillare per monitorare Peptide innesto su Chitosano film in tempo reale
In questo articolo
Riepilogo
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Abstract
Free-soluzione elettroforesi capillare (CE) separa analiti, composti generalmente praticati in soluzione mediante l'applicazione di un campo elettrico. Rispetto ad altre tecniche di separazione analitiche quali la cromatografia, CE è economico, robusto e non richiede alcuna preparazione del campione (per un numero di matrici naturali complesse o campioni polimerici) effettivamente. CE è veloce e può essere utilizzata per seguire l'evoluzione delle miscele in tempo reale (per esempio, cinetica di reazione chimica), i segnali osservati per i composti separati sono direttamente proporzionali alla loro quantità in soluzione.
Qui, l'efficienza della CE è dimostrata per monitorare l'innesto covalente di peptidi su film chitosano per successive applicazioni biomediche. proprietà antimicrobiche e biocompatibili di Chitosano rendono un materiale interessante per applicazioni biomediche come substrati di crescita cellulare. Covalente innestando le RGDS peptide (arginina - glicina -acido aspartico - serina) sulla superficie del film chitosano mira a migliorare l'adesione cellulare. Storicamente, cromatografia e analisi amminoacidica sono stati utilizzati per fornire una misura diretta della quantità di peptide innestato. Tuttavia, la separazione rapida e assenza di preparazione del campione è fornito da CE permette il monitoraggio in tempo reale altrettanto precisa ancora del processo di innesto peptide. CE è in grado di separare e quantificare le diverse componenti della miscela di reazione: la (non innestate) peptide e gli agenti di accoppiamento chimici. In questo modo l'uso di CE traduce in film perfezionati per applicazioni a valle.
I film chitosano sono stati caratterizzati mediante spettroscopia NMR allo stato solido (risonanza magnetica nucleare). Questa tecnica è più tempo e non può essere applicato in tempo reale, ma produce una misura diretta del peptide e quindi convalida la tecnica CE.
Introduzione
Soluzione libero elettroforesi capillare (CE) è una tecnica che separa composti in soluzioni basate sulla loro carica-attrito rapporto di 1,2. Rapporto Charge-to-size è spesso menzionato nella letteratura, ma questa semplificazione non si applica a polielettroliti, tra cui polipeptidi in questo lavoro, ed è stato anche dimostrato di non essere adatto per piccole molecole organiche 3. CE differisce da altre tecniche di separazione in quanto non hanno una fase stazionaria, solo uno sfondo elettrolita (di solito un buffer). Questo permette la tecnica per essere resistente nella sua capacità di analizzare una vasta gamma di campioni con matrici complesse 4 come fibre vegetali 5, infusi fermentazione 6 innesto su polimeri sintetici 7, campioni alimentari 8, e peptidi difficilmente solubili 9 senza preparazione del campione noioso e purificazione. Ciò è particolarmente significativo per polielettroliti complessi che hanno problemi di dissoluzione (iuch come chitosano 10 e gellano 11) e quindi esiste come aggregato o precipitato in soluzione e sono stati analizzati con successo senza filtrazione campione. Inoltre, l'analisi degli zuccheri in cereali per la colazione coinvolto l'iniezione di campioni con particelle di campioni di cereali per la colazione precipitato in acqua 8. Questo si estende anche all'analisi dei polielettroliti o copolimeri 12,13 ramificati. Un'ampia attività è stata completata nello sviluppo di tecniche CE specificamente per l'analisi di proteine per proteomica 14, separazione chirale di peptidi naturali o sintetici 15 e separazioni microchip di proteine e peptidi 16. Poiché la separazione e l'analisi avvengono in un capillare, solo piccoli volumi di campione e vengono utilizzati solventi che permette CE di avere un costo di esercizio inferiore rispetto ad altre tecniche di separazione compresa cromatografia 5,6,17. Poiché la separazione da CE è veloce, permette il monitoAnello di cinetica di reazione. Questo è stato dimostrato nel caso di innesto di peptidi su film chitosano per una migliore adesione cellulare 18.
Il chitosano è un polisaccaride derivato dal -deacetylation N di chitina. Film chitosano possono essere utilizzati per diverse applicazioni biomediche come bioadesivi 19 e substrati di crescita cellulare 18,20, a causa della biocompatibilità del chitosano 21. Attaccamento cellulare di specifiche proteine della matrice extracellulare, come fibronectina, collagene e laminina, è direttamente legata alla sopravvivenza delle cellule 22. In particolare, differenti tipi cellulari richiedono spesso attaccamento alle diverse proteine della matrice extracellulare per la sopravvivenza e il corretto funzionamento. Adesione cellulare ai film di chitosano ha dimostrato di essere migliorata attraverso l'innesto di fibronectina 23; tuttavia, la preparazione, la purificazione e l'innesto di tali proteine di grandi dimensioni non è economicamente sostenibile. In alternativa una serie di piccoli peptidi have stato dimostrato di essere in grado di imitare le proprietà di grandi proteine della matrice extracellulare. Ad esempio, i peptidi come i RGD mimetici fibronectina (arginina - glicina - acido aspartico) e RGDS (arginina - glicina - acido aspartico - serina) sono stati utilizzati per facilitare e rafforzare il legame delle cellule 24. Covalent innesto di RGDS Onto film chitosano ha migliorato l'adesione delle cellule per cellule conosciute da allegare alla fibronectina in vivo 18. Sostituendo le proteine più grandi piace fibronectina con peptidi più piccoli che hanno la stessa funzionalità fornisce una significativa riduzione dei costi.
Qui, peptide innesto di chitosano è stato eseguito come precedentemente pubblicato 18. Come precedentemente dimostrato, questo approccio fornisce innesto semplice ed efficace utilizzando agenti di accoppiamento EDC-HCl (1-etil-3 (3- dimetilaminopropil) carbodiimide ) e NHS (N -hydroxysuccinimide) per funzionalizzare l'acido carbossilico dei RGDS essere innestato sullapellicola chitosano. Due vantaggi di questo metodo sono innesto che non richiede alcuna modifica del chitosano o del peptide, e sono realizzati nel mezzo acquoso per massimizzare la compatibilità con le future applicazioni di coltura cellulare 18,20. Mentre gli agenti di accoppiamento e il peptide può essere caricata, CE è un metodo adatto per l'analisi delle cinetiche di reazione. È importante sottolineare che l'analisi delle cinetiche di reazione tramite CE consente il monitoraggio in tempo reale della reazione di innesto, e quindi permette sia ottimizzando e quantificare il grado di innesto.
Mentre non è normalmente necessaria, i risultati dell'analisi CE possono essere convalidati off-line da una misura diretta del peptide innesto su film chitosano utilizzando allo stato solido NMR (risonanza magnetica nucleare) spettroscopia 25,26 per dimostrare l'innesto covalente del peptide sulla pellicola 18. Tuttavia, rispetto a stato solido spettroscopia NMR, l'analisi in tempo reale fornito daCE consente la quantificazione del consumo peptide in tempo reale e quindi la capacità di valutare la cinetica di reazione.
Il suddetto metodo è semplice e consente l'analisi in tempo reale di peptide innesto su film chitosano con quantificazione indiretta del grado dell'innesto. Il metodo illustrato può essere esteso alla valutazione quantitativa in tempo reale di diverse reazioni chimiche purché i reagenti oi prodotti da analizzare può essere caricato.
Protocollo
1. Preparazione di chitosano Films
- Pesare 2 g di acido acetico glaciale, completa a 100 ml con acqua ultrapura.
- Pesare 1,7 g di polvere di chitosano, aggiungere 100 ml di soluzione di acido 2% m / m acetico acquoso. Mescolare per 5 giorni con ancoretta e piatto agitazione magnetica a temperatura ambiente sia coperto con un foglio di alluminio o al buio.
- Centrifugare la dispersione chitosano a 1.076 xg a 23 ° C per 1 ora. Raccogliere il surnatante con una siringa ed eliminare il precipitato.
- Per ogni film, un'aliquota da 10 ml della sospensione chitosano in a 9 cm In plastica Petri a temperatura ambiente. Lasciare i film coperti ad asciugare per almeno 7 giorni.
- forbici Uso tagliare i film secchi in 1 x 1 cm quadrati. Nota: L'esperimento può essere messo in pausa in questa fase.
2. Preparazione di PBS (PBS)
- Pesare 8 g di cloruro di sodio, cloruro di potassio 0,2 g, 1,44 g di disodio idrogeno fosfatophate e 0,24 g potassio fosfato monobasico.
- Sciogliere questi prodotti chimici pesati in 800 ml di acqua ultrapura e titolare la soluzione con acido cloridrico concentrato fino a pH 7,4.
Nota: L'esperimento può essere messo in pausa in questa fase.
3. Preparazione di 75 mM Sodio borato Tampone a pH 9.2
- Pesare 3,0915 g di acido borico. Sciogliere in 75 ml di acqua ultrapura.
- Titolare la soluzione di acido borico a pH 9,2 con una soluzione di idrossido di sodio ad una concentrazione di 10 M o superiore.
Attenzione: concentrato soluzioni d'idrossido di sodio sono corrosivi e devono essere maneggiati con i guanti. - Completa di acqua ultrapura per ottenere 100 ml di soluzione. Ciò produce un tampone borato di sodio 500 mM a pH 9.2.
- Diluire il tampone borato di sodio da 500 mm con acqua ultrapura a 75 mm tampone borato di sodio. Nota: L'esperimento può essere messo in pausa in questa fase.
4. Preparazione di Chitosan FiLMS per la reazione di innesto
- Risciacquare 10 film chitosano quadrati (1 x 1 cm) in 5 ml di PBS per 2 ore in una piastra di Petri a temperatura ambiente.
- Durante questo tempo, preparare e validare lo strumento elettroforesi capillare (fase 5).
5. Preparazione e validazione dello strumento di elettroforesi capillare
- Preparare un capillare di silice fusa 43,5 cm nudo con un diametro interno di 50 micron (43,5 centimetri è la lunghezza totale, la lunghezza efficace per la finestra di rilevamento è tipicamente 35 cm) indebolendo il rivestimento esterno in polimero del capillare alla lunghezza impostata con un utensile smussato quindi scattare il capillare.
- Creare una finestra per il capillare usando un accendino per bruciare il rivestimento polimerico a 8,5 cm dal ingresso e dopo si raffredda pulirla con etanolo. Bruciare il rivestimento del capillare a ciascuna estremità per qualche millimetro con un accendino, e dopo si raffredda pulirla con etanolo.
- Luogo capillare insiFinestra di rilevamento e installarlo nel cassetto capillare mettendolo a lunghezze uguali in ingresso e uscita e avvolgerlo attorno ai mandrini della cassetta. Quindi installare la cassetta nello strumento elettroforesi capillare.
- Impostare i parametri del metodo per ogni separazione. Nel menu del software selezionare "metodo" e poi "modificare l'intero metodo". Impostare la temperatura, il tempo, la tensione e fiale utilizzati per la separazione (ad esempio 25 ° C, 10 min, 30 kV).
- Nella sezione di pre-condizionamento, impostare le vampate consecutive: 10 min con 1 M di idrossido di sodio (in acqua), 5 min con 0,1 M di idrossido di sodio (in acqua), 5 min con acqua ultrapura e 5 min con 75 mM di tampone borato di sodio a pH 9.2 per il primo metodo di una serie di analisi.
- Per i metodi successivi, impostare il set le vampate consecutivi nella sezione precondizionamento: 1 min con 1 M di idrossido di sodio (in acqua), 5 min con 75 mM di tampone borato di sodio a pH 9.2.
- Nella sezione di iniezione, parametri impostati per un'iniezione idrodinamico con pressione 30 mbar per 10 sec per tutti i metodi. Nella sezione di separazione, impostare le condizioni di separazione a 30 kV a 25 ° C per 9 minuti per tutti i metodi.
NOTA: consultare il manuale di specifici dello strumento CE come procedura per il funzionamento dello strumento CE può variare tra i costruttori. Preparare la soluzione di idrossido di sodio 1 M il giorno.
- Iniettare e separare standard interno neutra (10 ml di 10% v / v dimetilsolfossido (DMSO), in acqua diluita in 450 ml di 75 mM tampone borato di sodio). Poi iniettare e separare nello stesso modo uno standard oligoacrylate (disciolto in acqua ultrapura a 10 g ∙ L -1; vedere Elenco dei materiali) per verificare la validità del capillare. Mettere in pausa la sequenza di qui fino a quando la reazione di innesto è pronto per iniziare.
6. Accrescimento di RGDS Onto chitosano Film
- Pesare il peptide (1 mg RGDS)e gli agenti di accoppiamento (3 mg EDC-HCl e 2 mg NHS).
- 2 ore dopo l'inizio della ammollo pellicola chitosano in PBS, sciogliere il peptide e gli agenti di accoppiamento in 5 ml di PBS.
- Dai un'aliquota 50 ml di questa soluzione. Aggiungere 2 ml di 10% v / v DMSO in acqua come standard neutro interno per aliquota. Analizzare l'aliquota con CE (vedi punto 7).
- Rimuovere i 5 ml di PBS utilizzati per lavare i film chitosano dalla capsula di Petri. Aggiungere la soluzione di agenti peptidici e accoppiamento 5 ml al piatto Petri contenente i film chitosano.
- Coprire la piastra di Petri con la pellicola di paraffina e posizionarlo su un agitatore orbitale a temperatura ambiente. Prendere 50 microlitri aliquote di mezzi di reazione ad orari prestabiliti.
NOTA: Il tempo di analisi totale con CE è di 15 minuti, quindi una aliquota può essere assunto ogni 15 min (o ogni 30 min se due reazioni sono monitorati in parallelo, etc.).- Aggiungere 2 ml di 10% v / v DMSO in acqua come standard neutro interno ad ogni alIQUOT.
NOTA: Aliquote dovrebbero essere analizzati con CE non appena si sono presi (vedi punto 7).
- Aggiungere 2 ml di 10% v / v DMSO in acqua come standard neutro interno ad ogni alIQUOT.
- Dopo 4 ore di agitazione e la rimozione aliquote, rimuovere la piastra di Petri da shaker. Rimuovere il mezzo di reazione dalla piastra di Petri. Aggiungere 5 ml di PBS per risciacquare i film chitosano.
- Rimuovere la PBS dalla capsula di Petri, lavare il film chitosano con acqua ultrapura e lasciare asciugare durante la notte. Rimuovere l'acqua ultrapura e memorizzare i film a -20 ° C in una plastica Petri.
7. Monitoraggio di innesto di reazione Usando CE
- Iniettare e aliquote separate di mezzi di reazione subito dopo la rimozione dalla piastra di Petri con le condizioni di analisi, come nella sezione 5.2.
- Al termine delle separazioni risciacquare il capillare con acqua ultrapura per 10 min. Essiccare attraverso un filo con un flacone vuoto (aria) per 10 min.
NOTA: L'esperimento può essere messo in pausa in questa fase.
8. Trea dati tment per CE
- Controllare la validità di ogni separazione, verificando che sia la corrente durante la separazione e il tempo di migrazione del marcatore mobilità elettroosmotico (DMSO in questo caso) sono simili a quelli osservati per la separazione standard di oligoacrylate.
NOTA: fino al 10-15% variazione è accettabile dal valore attuale atteso di circa 50 μA e valore temporale migrazione di 1.3 min (valori mobilità elettroforetica dovrebbero essere utilizzati al posto dei tempi di migrazione, se è richiesta una ripetibilità superiore). - Per ogni separazione di successo, esportare i dati grezzi dal software elettroforesi capillare selezionando un insieme di dati specifici, a destra cliccando su esportazioni e selezionando un segnale appropriato.
- Convertire i dati grezzi registrati dal CE (presentata come assorbanza UV in funzione del tempo di migrazione). Convertire l'asse X (migrazione tempo t m) in un μ mobilità elettroforetica seguente Equazione 1:
n 1 "src =" / files / ftp_upload / 54549 / 54549eq1.jpg "/> (1)
dove L d è la lunghezza al rivelatore, L t è la lunghezza totale del capillare, V è la tensione, e t eo è il tempo di migrazione di una specie neutra (standard interno DMSO in questo caso) 27.
Convertire l'asse Y dei dati grezzi (assorbanza in au) per una distribuzione di mobilità elettroforetica W (μ) seguente Equazione 2: 28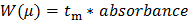 (2)
(2)
9. Altre caratterizzazione di film Peptide-innestato 18
- Inserire film chitosano peptide-innestate, laminati intorno a sé, in uno stato solido NMR rotore 4 mm. Riempire il rotore con PBS a ingrossare le pellicole, e chiudere il rotore. Attendere un paio d'ore.
- Analizzare il film con 13 </ sup> C spettroscopia NMR 18.
Risultati
CE è adatto a monitorare l'innesto di peptidi (ad esempio, rgds) sul film chitosano. Agenti di accoppiamento adatti comprendono EDC-HCl e NHS che attivano il peptide ad essere innestati su chitosano (figura 1). CE è in grado di separare le diverse molecole di interesse dal mezzo di reazione. Per assegnare i picchi sul elettroferogramma, RGDS puri, EDC-HCl e NHS sono stati sciolti, iniettati e separati separatamente. Dopo l'assegnazione dei picchi, il m...
Discussione
La semplicità del protocollo qui descritto rende ideale per applicazione diffusa. Tuttavia, particolare attenzione deve essere prestata ai seguenti passaggi chiave.
Preparazione strumento adeguato CE
È importante separare uno standard noto immediatamente prima della separazione di campioni sconosciuti (così come al termine di una serie di separazioni) per verificare la validità del capillare e strumento il giorno. Questo standard può essere ...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
Materiali
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
Riferimenti
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon