Method Article
Termoestabilización, Expresión, purificación y cristalización del transportador de serotonina humano enlazado a
En este artículo
Resumen
Este manuscrito describe cómo la pantalla para termoestabilizante mutaciones, purificar el transportador de serotonina humano, generar anticuerpos de alta afinidad, y cristalizar el complejo transportador de serotonina-anticuerpo unido a la antidepresivo fármaco S citalopram. Este protocolo puede ser adaptado para el estudio de otros transportadores desafiantes de membrana, receptores y canales.
Resumen
El transportador de la serotonina es un transportador de sodio y cloruro de acoplamiento de que "bombea" serotonina extracelular en las células. S citalopram es un fármaco utilizado para tratar la depresión y la ansiedad mediante la unión al transportador de serotonina con alta afinidad, el bloqueo de la recaptación de serotonina. Aquí mostramos un procedimiento eficaz y un conjunto de herramientas para estabilizar, expreso, purificar y cristalizar complejos transportador de serotonina-anticuerpo unidos a S citalopram y otros antidepresivos. Las mutaciones que estabilizan el transportador de serotonina se identificaron utilizando un ensayo de unión citalopram S. Transportador de la serotonina expresada en baculovirus transducidas HEK293s GnTI - células, se reconstituyó en proteoliposomas y se utiliza para generar anticuerpos de alta afinidad. Hemos desarrollado una estrategia para descubrir anticuerpos que son útiles para estudios estructurales. También se ha establecido un enfoque directo para la expresión de fragmentos de anticuerpos en células Sf9.Transporter complejos de anticuerpos purificados mediante este procedimiento se comportan bien y fácilmente cristalizan, la producción de complejos con S citalopram que difractan los rayos X para 3-4 Å de resolución. Las estrategias desarrolladas aquí pueden ser utilizados para determinar la estructura de otras proteínas de membrana desafiantes.
Introducción
El transportador de serotonina (SERT) es una proteína integral de membrana que facilita el transporte de la serotonina a través de membranas celulares 1. SERT pertenece a una familia de neurotransmisor de sodio symporters (ENA), que también incluye la dopamina y la norepinefrina 2 transportadores. SERT es la diana molecular de los fármacos antidepresivos y contra la ansiedad ampliamente prescritos que actúan para inhibir competitivamente transporte de serotonina 3. SERT explota el cotransporte energéticamente favorable de sodio para eliminar el neurotransmisor de la hendidura sináptica. Amplia caracterización del sistema serotoninérgico ha demostrado que los cambios en el metabolismo de la serotonina parecen influir en prácticamente todos los procesos neurológicos, incluyendo el estado de ánimo, el sueño, el dolor, la cognición y la agresión comportamientos 4. Función de SERT puede modificarse mediante el uso de antidepresivos y los inhibidores de la recaptación selectiva de serotonina (ISRS) como citalopram S, así como por psychostimulaNTS y drogas adictivas como la anfetamina y -methylamphetamine 3,4-methylenedioxy- N o "éxtasis" 1,2.
ISRS son tremendamente importante para el tratamiento de los trastornos del estado de ánimo, sin embargo, precisamente la base estructural para su acción no se entiende bien. WT SERT es inestable en micelas de detergente, impidiendo así el progreso hacia una estructura tridimensional (3D) de SERT 5,6. Recientemente, hemos desarrollado variantes de SERT que son robustamente estable en una amplia gama de detergentes y retienen la actividad de unión a 6 SSRI. Estas variantes de SERT termoestables fueron seleccionados utilizando un ensayo de termoestabilidad basado en proximidad de centelleo. Aquí se describe un procedimiento para la generación de anticuerpos de alta afinidad que pueden unirse SERT, y la purificación y cristalización de SERT termoestable, en el complejo con anticuerpo y S citalopram.
Este protocolo supone que el SERT y 8B6 genes han sido exitosoy se clonó en los vectores de BacMam 7 e insecto de expresión, respectivamente. Para generar anticuerpos, ADNc que codifican los residuos 73-616 de WT SERT se clonó en el vector BacMam con una etiqueta C-terminal Strep II (SERT IC). Para la pantalla termoestabilidad, se utilizaron residuos de SERT 73-616 con GFP C-terminal, Strep II, y 10-His (TC SERT). Mutaciones puntuales individuales se generaron en el fondo SERT TC. Para el protocolo de cristalización, la proteína de fusión SERT-GFP se utiliza con Twin-Strep [TrpSerHisProGlnPheGluLys (GlyGlyGlySer) 2 GlyGlySerAlaTrpSerHisProGlnPheGluLys] y 10 Sus etiquetas, llevando los mutantes termoestables, Y110A, I291A, y T439S y mutaciones de cisteínas superficie C554A, C580A y C622A (CC SERT). Secuencias de escisión de trombina (LVPRGS) también se insertaron en el CC SERT después de Q76 y T618 para permitir la retirada de los extremos N- y C-terminales. El plásmido que codifica el Fab 8B6 fue diseñado para expresar tanto la cadena pesada y ligeracadenas del anticuerpo con secuencias de secreción de gp67 bajo el control de dos promotores de polihedrina separadas. El C-terminal de la cadena pesada del anticuerpo 8B6 fue etiquetado con un 8-His tag y se insertó un sitio de escisión de trombina entre la cadena pesada y la etiqueta.
Protocolo
1. Transfección de adherente HEK293s GnTI - Las células para la pantalla termoestabilidad
- Prepare poli-D-lisina (PDL) presenta el revestimiento placas de 96 pocillos. Realizar todo el trabajo en una campana de flujo laminar estéril.
- Filtrar una solución de 25 mg / ml de (PDL), el peso molecular 70,000-150,000 Da, utilizando un filtro estéril de 0,2 micras. Añadir 50 l de PDL a cada pocillo de una placa de 96 pocillos de cultivo de tejidos (TC), asegurando la parte inferior se recubre de manera uniforme, y se incuba a TA durante 30 min.
- Aspirar solución PDL y lavar con 200 l de agua estéril.
- Permitir que la placa se seque al aire durante 2 h antes de su almacenamiento a 4 ° C. placas recubiertas de PDL se pueden almacenar a 4 ° C durante varias semanas.
- La tripsinización de células HEK293s adherentes.
- Crecer HEK293s a 80% de confluencia en una placa de 10 cm mantenida a 37 ° C con 8% de CO 2. Un plato individual de 10 cm debe tener aproximadamente 10 millones de células HEK293s. No utilice las células después de 30 pasajes!
- medios Aspirar y lavar con 5 ml de solución salina tamponada con fosfato (PBS). Añadir 1 ml de solución de tripsina-EDTA (0,25% de tripsina, 0,02% de EDTA) a las células y se incuba durante 2 min a 37 ° C.
- Añadir 10 ml de de Eagle modificado por Dulbecco (DMEM) suplementado con 10% suero bovino fetal (FBS) y volver a suspender las células pipeteando repetidamente hacia arriba y abajo con una pipeta serológica.
- Pipeta de 10 l de células y mezclar con 10 l de solución de azul tripán (0,4%). Determinar la densidad de células usando un hemocitómetro y un microscopio de luz. No contar las células que están teñidas de azul, ya que están muertos. Asegúrese de que la viabilidad celular está por encima de 90%.
- A fondo resuspender tripsinizaron HEK293s GnTI - células en DMEM suplementado con 10% FBS a una densidad de 0,5 x 10 6 células / ml en un depósito de pipeta desechable. Se necesitarán aproximadamente 5 millones de células HEK293s para cada plato. Un total de 24 constructos se puede transfectar en cada placa utilizando este protocol.
- Usando una pipeta multicanal, añadir 100 l de células a cada pocillo de una placa de PDL revestido. Resuspender las células en el depósito después del llenado de la pipeta cada placa para asegurar una distribución uniforme de las células. Se incuban las células en una incubadora a 37 ° con 8% de CO 2. Después de 24 h, las células deben alcanzar aproximadamente el 80% de confluencia.
- 1 h antes de la transfección en lugar de los medios de comunicación. Preparar complejos de reactivo de transfección de ADN para la transfección.
- Para cada construcción en el fondo SERT TC de ser controlados, mezclar 450 ng de ADN con 45 l de DMEM libre de suero y mezclar. Añadir 1,6 l de reactivo de transfección a 45 l de DMEM libre de suero y mezclar.
- Inmediatamente añadir solución de reactivo de transfección diluido a la solución de ADN y mezclar. No mezcle soluciones en el orden inverso. Espere de 10 - 15 min y añadir 20 l de transfección mezcla de reactivos / ADN de 4 pozos.
- Una vez que todos los pozos han sido transfectadas, placa de mezclar suavemente meciéndose hacia unand vuelta y volver a la incubadora a 37ºC.
- Después de 16 - 24 h a sustituir los soportes con DMEM que contenía suero y butirato sódico 10 mM.
- Aproximadamente 48 horas después de la transfección eliminar los medios de comunicación y, o bien inmediatamente proceder con termoestabilidad pantalla o congelar las células a -80 ° C para su uso posterior. Las células se pueden almacenar a -80 ° C durante varias semanas.
Screen termoestabilidad basado en proximidad de centelleo 2. con S citalopram
- Se incuban las células con citalopram 200 nM S en 25 l de TBS (Tris-Buffered Saline - Tris 20 mM, pH 8, NaCl 100 mM) durante 5 min a TA.
- Solubilizar las células mediante la adición de 25 l de 8 mM n-dodecil-β-D-maltopiranósido (C12M), 1 mM de colesterilo hemmisuccinate (CHS), cóctel inhibidor de proteasa (2 mM fluoruro de fenilmetanosulfonilo (PMSF), 0,1 mg / ml de aprotinina, 4 g / ml de pepstatina a, y 4 mg / ml de leupeptina) en TBS, e incubando durante 1 h a TA.
- Añadir 50 l de TBS wiTH 20 nM de [3H] citalopram (81,7 Ci / mmol), 0,1% de albúmina de suero bovino, y 2 mg de ensayo / mL His-tag de afinidad de proximidad de centelleo (SPA) perlas a tres pocillos para cada constructo. Para el último pocillo añadir la misma solución de la lista, pero complementar con sertralina 100 mM para determinar la unión no específica. Asegúrese de que la afinidad de His-tag perlas de SPA se mezclan a fondo cuando se añade a la placa de 96 pocillos.
- Medir [3 H] citalopram unión usando un contador de centelleo de 96 pocillos a temperatura ambiente con un tiempo de recuento de 1 min por pocillo. Continuar placas de conteo hasta que los recuentos totales meseta (aproximadamente después de 36 h).
- placas de calor durante 15 minutos en un bloque de calentamiento con una tapa calentada a 33 ° C. Medir [3 H] citalopram unión de nuevo después del calentamiento como se describe en 2.4.
- Repita el paso 2.4 hasta 2.5 y cambiar la etapa de calentamiento a 36 ° C, 39 ° C, 45 ° C, 48 ° C y 51 ° C. Ajuste temperaturas de calentamiento en función de la temperatura aparente de fusión (Tm)de la proteína diana y la termoestabilidad de la construcción más estable. Continuar calentando las placas hasta que todas las construcciones tienen bajos recuentos específicos.
- Analizar los datos para determinar los valores de Tm.
- Determinar las cuentas totales promedio por minuto (CPM) de cada construcción de pozos que no contienen sertralina promediando los 3 pocillos replicados. Determinar el CPM no específico al promediar las CPM de cada pocillo que contiene sertralina en una sola placa.
- Calcula CPM específica restando la CPM no específico del CPM total.
- Calcular la Tm mediante un ajuste no lineal a una función sigmoidal Boltzmann. Construcciones con bajo CPM específica a la temperatura ambiente (<10% de WT) en general no tienen valores precisos de Tm. Las mutaciones de las construcciones de la mayoría de los termoestables pueden combinarse entre sí y se seleccionan de aditivos aumentos en la termoestabilidad.
3. Expresión del transportador de serotonina humano en HEK293s GnTI - Células
- Transformar células DH10Bac químicamente competentes con 1 ng de plásmido.
- Añadir plásmido a 50 l de células DH10Bac y se incuba en hielo durante 30 min.
- células DH10Bac choque térmico a 42 ° C durante 30 seg. Añadir 200 l de medio SOC y se incuba a 37 ° C durante 4 horas con agitación.
- Plate todas las bacterias en una placa de Luria Broth (LB) que contiene 50 mg / ml de kanamicina, 7 mg / ml de gentamicina, 10 mg / ml de tetraciclina, 100 mg / ml 5-bromo-3-indolil β-D-galactopiranósido, y 40 g / ml isopropil β-D-1-tiogalactopiranósido (IPTG).
- Aislar lacZ - colonias (colonias blancas) obtenidas a 37 ° C durante 2 días en placas de agar LB.
- Crecer varias colonias O / N a 37 ° C en 5 ml de LB que contienen antibióticos y aislar ADN bácmido.
- Centrifugar bacterias a 1.000 xg en una centrífuga durante 5 min. sobrenadante de descarte. bacterias Resuspender con 200 l de miniprep resuspension tampón.
- Lyse bacterias mediante la adición de 200 l de tampón de lisis miniprep e invirtiendo el tubo suavemente 10 veces. Añadir 200 l de tampón de neutralización.
- Retirar la fracción insoluble por centrifugación a 14.000 xg durante 10 min en una centrífuga. Añadir 1 ml de isopropanol al sobrenadante y el enfriamiento a -20 ° C durante 20 minutos para precipitar el ADN.
- Girar a 14.000 xg durante 15 minutos en una centrífuga y desechar el sobrenadante.
- DNA Wash de pellets con 70% de EtOH y girar de nuevo a 14.000 xg durante 15 min. sobrenadante de descarte. ADN secar al aire hasta que todo se haya evaporado EtOH y se vuelve a suspender en 50 l de agua.
NOTA: DNA de Bacmid debe transfectarse en células Sf9 de inmediato para los mejores resultados, pero también puede ser almacenado a -20 ° C durante varias semanas.
- Transfectar bácmido ADN en 1x10 6 células de Sf9 cultivadas adherente en una cámara humidificada a 27 ° C en una placa de 6 pocillos. Realizar todas las manipulaciones de cultivo de células en una campana de flujo laminar estéril.
- Retire el medio de las células y añadir 2 ml de medio fresco Sf9. Añadir 5 g de ADN bácmido a 100 l de los medios de comunicación Sf9 (Solución A).
- Añadir 8 l de un reactivo de transfección Sf9 catiónico-lípido a 100 l de los medios de comunicación Sf9 (Solución B). Incubar tubo que contiene la solución B durante 5 min.
- Mezclar tubo que contiene la solución A con la solución B y se incuba a TA durante 30 min y añadir toda la solución a las células Sf9.
- Después de 96 h, el sobrenadante de la cosecha (virus P1) pasando a través de un filtro de 0,2 micras. El virus P1 se puede almacenar durante varios meses a 4 ° C en la oscuridad y se reutiliza para hacer virus P2 según sea necesario.
- Añadir 100 l de virus P1 a 1 L de células Sf9 a una densidad de 1 x 10 6 células / ml en medio Sf9. Infectar las células durante 96 h, que crece a 27 ° C en un agitador a 100 rpm.
- Centrifugar las células en una centrífuga a 4000 xg durante 15 min y el sobrenadante de filtro que contiene las partículas de virus a través de un filtro de 0,2 micras. Desechar sedimento celular. determdensidad viral ine usando un ensayo de placa viral o un contador de virus. La densidad de virus debe ser partículas> 1 x 10 8 de virus por mililitro. virus P2 se puede almacenar a 4 ° C en la oscuridad y se utiliza para varios meses.
- Infect 10 L de HEK293s GnTI - células 7 que crecen en suspensión a 37 ° C con 8% de CO2 y 85% de humedad en un agitador a 130 rpm en 293 medios de expresión suplementado con 2% de FBS a una multiplicidad de infección (MOI) de 2 y una densidad de 3 x 10 6 células / ml, típicamente 30 - 50 ml de virus P2 por 800 ml de células en un 2 L desconcertado matraz.
NOTA: No se recomienda el uso de más de 80 ml de virus P2 desde la HEK293s GnTI - células crecerán lentamente y puede llegar a ser inviable debido a un cambio en el pH. Sf9 medios de comunicación es más ácido que los medios de comunicación 293 expresión. - 12 a 16 h post-infección, añadir butirato sódico a una concentración de 10 mM a partir de un stock 1 M. 48 - 60 horas después de la infección, las células por centrifugación a cosecha4.000 xg durante 15 min. Eliminar el sobrenadante.
- Resuspender las células en 150 ml de TBS, otros inhibidores SERT 2 M S citalopram o y se almacena a -80 ° C hasta que esté listo para la purificación.
4. Purificación por Afinidad del transportador de serotonina de Inmunización y cristalización
- Descongelar las células de 10 l de cultivo en agua caliente (aproximadamente 30 ° C) y resuspender haciendo pasar rápidamente a través de una pipeta de 10 ml hasta homogeneidad.
- Preparar la solución de detergente para la solubilización (150 ml): 80 mM Tris, pH 8, NaCl 150 mM que contiene C12M mM 40, CHS 5 mM, y cóctel inhibidor de la proteasa.
- Añadir todas las células a un vaso de precipitados con una barra de agitación y añadir toda la solución de detergente a las células mientras se agitaba. Solubilizar a 4 ° C durante 1 h con agitación.
- Girar lisado a 8.000 xg durante 15 min a 4 ° C. Desechar pellet y sobrenadante se decanta en tubos de ultracentrífuga limpias. Girar a 100.000 xg durante 1 h en una ultracentrifuge. Desechar sedimento y sobrenadante de filtro a través de un filtro de 0,2 micras.
- Pase lisado durante 10 resina de afinidad Strep ml de embalado en una columna utilizando una bomba peristáltica equilibrada en tampón de lavado: C12M mM 1, CHS 0,2 mM, 5% de glicerol, 25 mM de lípidos (1-palmitoil-2-oleoil- sn -glycero- 3-fosfocolina, 1-palmitoil-2-oleoil- sn -glicero-3-fosfoetanolamina, y 1-palmitoil-2-oleoil- sn -glicero-3-fosfoglicerol en una relación molar de 1: 1: 1), y 1 citalopram M S o SSRI en TBS.
- Conectar columna de afinidad Strep a un sistema Fast Protein Liquid Chromatography (FPLC) y se lava la columna a 2 ml / min con 66 ml (volúmenes de columna) 6,6 de tampón de lavado. Eluir la proteína purificada en mismo tampón suplementado con 5 mM de destiobiotina en 0,5 ml / min usando 33 ml (volúmenes de columna 3.3) de tampón. Recoger fracciones de 1 ml; las fracciones de los picos serán ~ 10 ml. La proteína purificada se puede almacenar a 4 ° C durante 2 - 3 d si se desea.
NOTA: El rendimiento total será de 3 -4 mg de SERT CC y 1 mg de SERT IC. Una absorbancia de 2 AU a 280 nm es igual a 1 mg / mL SERT.
5. La reconstitución del Transportador en liposomas para la inmunización
- Preparar liposomas que contienen asolectina: colesterol: lípido A: cerebro polar de lípidos (relación molar 60: 17: 3: 20). Disolver lípidos en 1 ml de cloroformo y añadir 40 mg de lípido total a un 100 ml de vidrio matraz de fondo redondo en la relación molar indicada.
- Evaporar el cloroformo durante al menos 1 h a vacío con el matraz de fondo redondo y giratorio en agua caliente, aproximadamente 30 ° C.
- Rehidratar los lípidos mediante la adición de 10 ml de TBS. Incubar en tampón durante 10 min.
- Congelar el lípido colocando el matraz en líquido N 2.
- Deshielo. Sumergir fondo esférico del matraz en un vaso de precipitados lleno de agua caliente, aproximadamente 30 ° C. Someter a ultrasonidos en un baño de ultrasonidos durante 5 minutos.
- Vortex y repita los pasos 5.1.3 - 5.1.4 10 veces o hasta que el lípidoestá completamente resuspendido de la parte inferior y forma una suspensión turbia.
- Extruir toda la mezcla de lípidos dos veces a través de filtros de 200 nm. El lípido aparecerá como una suspensión lechosa antes de la extrusión; después será translúcido. No añadir toda la mezcla de lípidos a la extrusora a la vez, ya que puede llegar a obstruirse, lo que resulta en la pérdida de muestra.
- Girar lípidos a 100.000 xg durante 20 min y se resuspenden en 0,5 a 1 ml de TBS a una concentración de 40 mg / mL.
- Concéntrese purificada SERT IC 250 - 500 l utilizando un concentrador de proteína 100 kDa MWCO centrífuga a 2 - 4 mg / ml y saturar liposomas con C12M 5 mM. Añadir SERT purificada para el detergente: mezcla de lípidos en 1 ml de volumen final.
- Eliminar C12M por 3 adiciones sucesivas de 80 mg / resina de absorción hidrofóbica mL. Durante los 2 primeros adiciones, incubar con la resina con rotación durante 2 horas a 4 ° C. Eliminar la resina mediante el paso a través de lana de vidrio. Realizar la incubación final con resinadurante la noche.
- Concéntrese proteoliposomas por centrifugación a 100.000 xg durante 20 min. Desechar de pellets sobrenadante y resuspender en 250 - 500 l de TBS.
- Añadir 10 M de concentración final de S citalopram a la proteína reconstituida después de la eliminación definitiva de resina.
- Solubilizar 2,5 l de los proteoliposomas en tampón de SDS-PAGE de carga (Tris 62,5 mM, pH 6,8, 10% de glicerol, 2% SDS, 0,01% de azul de bromofenol, DTT 100 mM) y se ejecutan en un gel de SDS-PAGE a 200 V durante 1 h para asegurar que SERT se ha reconstituido con éxito. Los proteoliposomas se pueden almacenar a -80 ° C en alícuotas para almacenamiento a largo plazo y se descongelaron en hielo antes de cada inmunización.
6. La detección de anticuerpos que reconocen epítopos 3D
- Pantalla líneas celulares de hibridoma por Western blot. Los anticuerpos que reconocen SERT por Western blot probable que se unen epítopos lineales y posiblemente no sea útil para estudios estructurales.
- Mezclar 1 g de purified SERT IC o SERT CC y ejecutar en un 4 - gel SDS-PAGE 15% a 200 V durante 1 h.
- Transferencia a una membrana de nitrocelulosa a 200 mA durante 30 minutos usando tampón de Towbin (Tris 25 mM, glicina 192 mM, 20% (v / v) de metanol, 0,1% SDS). La membrana se puede secar y almacenar indefinidamente a temperatura ambiente.
- membrana de rehumectación con 10% de metanol, y se lava con PBS (fosfato 10 mM, pH 7,4, NaCl 137 mM, KCl 2,7 mM).
- Bloquear con leche en polvo 5% en PBS durante 30 min a TA.
- Lavar con PBS y se incuban con 1 mg / ml de anticuerpo en PBS con 0,1% de leche.
- Lavar exhaustivamente con PBS que contiene 0,1% de Tween-20.
- Incubar con anticuerpo de cabra anti-ratón conjugado con un colorante IR se diluyeron 1: 10.000 en PBS con 0,1% de Tween 20 y 0,1% de leche.
- Lavar extensamente y escanear con un sistema de imagen.
- Mezclar sobrenadante de hibridoma que contiene anticuerpos negativos occidentales con 100 nM de proteína SERT CC utilizando una relación molar de 1: 2 (SERT: MAB) en 200 l de TBS con C12M 1 mM, CHS 0,2 mM y 1 M S citalopram. Centrifugar a 100.000 xg durante 20 min. Analizar sobrenadante que contiene complejos de SERT-MAB y analizar la detección por fluorescencia de cromatografía de exclusión por tamaños (FSEC) 8. Se desecha el precipitado.
- Ejecutar 100 l de sobrenadante en una columna de exclusión por tamaño en 0,5 ml / min usando un sistema de cromatografía líquida de alta resolución (HPLC) equipado con un detector de fluorescencia (excitación: 480 nm, emisión: 510 nm) utilizando un tampón de desarrollo que contenía TBS, 0,4 mM lauril neopentilglicol maltosa, y 1 M S citalopram. Los anticuerpos que se forman complejos harán que la proteína GFP-fusión para eluir antes que el transportador libre de la columna de exclusión por tamaño.
- Diluir complejos a 10, 1, 0,1 nM en 200 l de TBS con C12M 1 mM, CHS 0,2 mM y 1 M S citalopram y vuelva a ejecutar FSEC. Los anticuerpos que todavía pueden cambiar el pico transportador a bajas concentraciones nanomolares soncarpetas de alta afinidad y buenos candidatos para estudios estructurales.
- Vuelva a probar de unión por FSEC en presencia de serotonina 1 mM. Los anticuerpos que reconocen específicamente la conformación SSRI unido no se unirán en presencia del sustrato. Los anticuerpos que reconocen un epítopo en 3D que no cambia como resultado de la conformación se unen independientemente del ligando presente.
- Mezclar diferentes combinaciones de pares de anticuerpos y poner a prueba la unión por FSEC. Los anticuerpos que reconocen epítopos distintos causarán SERT para eluir antes, cuando se combinan juntos en comparación con la unión de un único anticuerpo.
- Para los estudios estructurales iniciales, seleccionar los anticuerpos de afinidad más alta que reconocen epítopos en 3D.
7. La expresión de fragmento de anticuerpo en células Sf9
- dominios variables y constantes clon del Fab por PCR en el sistema de expresión de insecto para la expresión en células Sf9 utilizando protocolos estándar.
- Transfectar 1 x 10 6 células Sf9 con 5 g de ADN bácmido que codifican las cadenas ligeras y pesadas de la 8-His etiquetado 8B6 Fab con una secuencia de secreción de GP67 (indicada en la sección 3.4).
- Cosecha P1 virus 96 h después de la transfección y añadir 500 l de virus P1 a 1 L de células Sf9 a una densidad de células / ml 1 x 10 6 en un matraz de 2 L para hacer virus P2. Infectar las células durante 96 horas a 27 ° C.
- Cosecha de virus P2 (como se indica en la sección 3.6).
- Infect 6 L de células Sf9 a una densidad de 2 - 3 x 10 6 células / ml con una MOI de 2 con virus P2, típicamente 40 - 50 ml por matraz con 1 L de células Sf9 en cada matraz de 2 L.
- Las células de la cosecha de aproximadamente 96 h después de la infección. Añadir 50 ml de tampón de fosfato, pH 8 a una concentración final de 50 mM a las células y centrifugado a 4000 xg durante 20 min. Desechar el sedimento celular y el sobrenadante filtro a través de una celda de flujo tangencial 0,2 micras filtro. Recoger el sobrenadante y se almacena a 4 ° C durante 2 - 3 días si se desea.
8. Purificación de fragmentos de anticuerpos de Sf9 sobrenadante
- Concéntrese sobrenadante Sf9 usando un 30 kDa de peso molecular de corte (MWCO) celda de flujo tangencial a unos 400 - 800 ml.
- Añadir imidazol, pH 8 a una concentración final de 10 mM y 10 ml de resina de afinidad de His-tag. Se agita en un vaso de precipitados durante 1 hora a 4 ° C.
- Recoger His-tag resina de afinidad por centrifugación a 2000 xg durante 5 min. sobrenadante de descarte.
- Paquete de resina de afinidad de His-tag en una columna y conectarse a una FPLC.
- Lavar cola de His resina de afinidad a 2 ml / min con 66 ml (6,6 volúmenes de columna) de fosfato 50 mM pH 8, NaCl 150 mM, imidazol 25 mM.
- Eluir 8B6 Fab en 33 ml de 50 mM de fosfato de pH 8, NaCl 150 mM, imidazol 250 mM. Recoger fracciones de 1 ml.
- Diluir Fab purificado por afinidad con un volumen de 10 veces de acetato 20 mM enfriado con hielo, pH 5.
- Enlazar Fab a una columna de intercambio catiónico 1 ml usando una bomba peristáltica a 1 ml / min.
- Independiente Fab usando una 30 ml lingradiente de oreja de NaCl (0 - 500 mM) en 20 mM de acetato de pH 5,5 usando un FPLC. Fab se eluye como un solo pico a NaCl 300 ~ mM.
- Analizar en un gel de SDS-PAGE 12,5% usando tampón de muestra que contenía DTT 100 mM. Las cadenas pesada y ligera de la 8B6 Fab se ejecutarán a 27 y 25 kDa, respectivamente, en un gel de SDS-PAGE reductor.
- Las fracciones que contenían Fab piscina y se concentran a por lo menos 10 - 15 mg / ml usando un concentrador kDa MWCO de 30 proteínas en una cubeta oscilante centrifugar a 3.000 x g.
- Ajustar a pH 8 mediante la adición de 1 M Tris pH 8 a una concentración final de 50 mM y almacenar purificado Fab para el largo plazo a 4 ° C. El rendimiento total será de 25 - 30 mg. Una absorbancia de 1,4 AU a 280 nm es igual a 1 mg / mL de 8B6 Fab.
9. Formación de Complejos y Separación Transporter-anticuerpo mediante cromatografía de exclusión molecular
- Para la cristalización, purificar el CC SERT mediante cromatografía de afinidad Strep en C12M como se ha descrito anteriormente (sección 4).
- Digesto con trombina para eliminar las etiquetas (1: 100 w / w) y EndoH (01:10 w / w) O / N a TA. Se concentra hasta 250 hasta 300 l usando una kDa MWCO concentrador 100 proteína centrífuga a una concentración de proteína de 10 mg / mL.
- Mezclar SERT concentrado con Fab en una relación molar de 1: 1,2 en un volumen de menos de 500 l. Centrifugar a 100.000 xga 4 ° C durante 20 min. Recoger el líquido sobrenadante que contiene el complejo SERT-Fab. pellets de descarte.
- Separada por cromatografía de exclusión por tamaño (SEC) usando un FPLC en una columna de exclusión de tamaño equilibrada en TBS suplementado con 40 mM n-octil-β-D-maltósido (C8M), CHS 0,5 mM, 5% de glicerol, 25 mM de lípidos (igual que en el paso 4.5) y 1 M S citalopram en 0,5 mL / min.
- Recoger fracciones de 0,5 ml y analizar el 4 - 15% de geles de SDS-PAGE, así como por fluorescencia de triptófano por la SEC. GFP etiquetada SERT funcionará a aproximadamente 80 kDa en un gel de SDS-PAGE. Después de la eliminación de los extremos y los azúcares unidos a N se ejecutará como una proteína de 45 kDa.
- determine qué fracciones combinar mediante la agrupación de sólo las fracciones que son monodispersas como se juzga por el análisis de las fracciones por fluorescencia de triptófano SEC (Excitación: 280, emisión: 335 nm).
- Tienda purifica complejo SERT-8B6 a 4 ° C hasta por 1 semana.
10. La cristalización de complejos anticuerpo-Transporter de gota colgante
- Antes de la cristalización, el concentrado de fracciones de los picos de la separación del complejo SEC SERT-8B6 a 2 mg / ml usando un concentrador kDa MWCO 100 proteína centrífuga. Una absorbancia de 2 AU a 280 nm es igual a 1 mg / mL.
- Añadir Fab adicional en una proporción de 1: 0.05 complejo: libre de Fab. Añadir 10 M S libre citalopram.
- Centrifugar a 100.000 xga 4 ° C durante 20 min. Recoger el líquido sobrenadante que contiene el complejo SERT-Fab. pellets de descarte.
- Configurar una gota colgante pantalla de 24 pocillos a 4 ° C de acuerdo con la Tabla 1. Crecer cristales de calidad difracción en soluciones de yacimientoque contiene 100 mM de Tris-NaOH, pH 8,5, 25 - KCl 125 mM, 32,5 a 34% de PEG 400, y 0,5% de ácido 6-aminohexanoico.
NOTA: Use Tris ajustado con NaOH a pH 8,5 como tampón. No utilice Tris base ajustada con HCl. La pantalla puede ser preparado en 2 tubos mL y se utiliza hasta que termine. Tenga cuidado de la pipeta con precisión PEG 400 utilizando una pipeta de desplazamiento positivo, ya que es extremadamente viscosa!- Pipetear 500 l de cada solución de reserva en un perfil bajo placa de 24 pocillos con sellador aplicado a cada pocillo. Pipetear 1,5, 1,75 y 2 l de la compleja SERT-8B6 sobre una cubierta de vidrio siliconado de deslizamiento 18 mm. Pipetear 1 l de solución de reserva en la parte superior de la muestra de proteína.
NOTA: La placa fue comprado con sellador ya aplicada al borde de los pozos. - Aplicar tapa deslizante a la de 24 pocillos con las gotas que se enfrenta la solución de depósito y sellar inmediatamente presionando hoja de la cubierta en el sellador aplicado previamente a cada pocillo.
- Continúe hasta que todos los 24 pozos se han establecido.
- Deja la placa terminada en una habitación bien aislada a 4 ° C. No molestar placas durante al menos 3 días
NOTA: Los cristales simples aparecerán dentro de aproximadamente 3 días y hacer crecer a 100-175 micras después de 14 días.
- Pipetear 500 l de cada solución de reserva en un perfil bajo placa de 24 pocillos con sellador aplicado a cada pocillo. Pipetear 1,5, 1,75 y 2 l de la compleja SERT-8B6 sobre una cubierta de vidrio siliconado de deslizamiento 18 mm. Pipetear 1 l de solución de reserva en la parte superior de la muestra de proteína.
- Cristales de la cosecha en cryoloops y directamente parpadear-fresco en N2 líquido antes de la recolección de datos de difracción de rayos-X.
- Si es necesario, encontrar las condiciones de cristalización adicionales por medio de imaginología amplio con gotas colgantes. Use tres gotas con proteína: relaciones de precipitantes de 2: 1, 1,5: 1, 1: 1. Si un robot está disponible, a continuación, establecer 100-150 nL gotas más de 70 l de solución de reserva en una placa de 96 pocillos. 3D cristales más grandes pueden ser cultivadas en 24 pozos.
- Puntuación basado en la aparición de la gota: 0, claro; 1, el polvo; 2, precipitado granular; 3, la separación de fases; 4, microcristalina; 5, agujas; 6, las placas; 7, cristales 3D.
- Configurar la cristalización en la horca métodos de caída en 24 pocillos como se describió anteriormente en torno cond recientemente identificadositions.
Resultados
Una biblioteca de mutantes de un solo punto en el fondo SERT TC se ha creado para la detección de mutaciones termoestabilizante. mutantes individuales se generaron utilizando mutagénesis estándar. El protocolo de selección utiliza células HEK293s y una pantalla de termoestabilidad basado en proximidad de centelleo transfectadas transitoriamente para rápidamente identidad mutaciones útiles para la cristalización como se describe en la Figura 1A. Los valores de trazado Tm frente unido [3 H] citalopram a TA revela construcciones con altos niveles de termoestabilidad y de expresión adecuados para la purificación de proteínas (Figura 1B). Tres mutantes (Y110A, I291A, y T439S) se combinaron para generar una construcción muy estable (Figura 1C). Termoestabilidad también se correlaciona con aumento de la estabilidad en los detergentes de cadena corta necesarios para la cristalización del complejo SERT-Fab.
La expresión a gran escala de SERT humano utilizando baculovirus-transduced HEK293s GnTI - células puede tomar menos de 2 semanas y puede producir cantidades de miligramos, como se ilustra en la Figura 2A. Uso de la proteína SERT CC GFP-etiquetado permite SERT para ser convenientemente seguida durante la expresión y la purificación por fluorescencia (Figura 2B). Nuestra estrategia de purificación implicó 1) solubilización de SERT unido a S citalopram de HEK293s GnTI - células en C12M en presencia de CHS como un lípido estabilizador; 2) unión de SERT a una matriz de afinidad Strep; 3) eliminación de las proteínas contaminantes por lavado extenso; y 4) la elución de la SERT funcional con tampón que contenía destiobiotina (Figura 2C). La proteína eluida es en gran parte libre de otras proteínas detectables por tinción con azul de Coomassie y monodisperso como se juzga por FSEC (Figura 2D, E).
Una estrategia similar fue llevado a purificar SERT con una etiqueta Strep II que se utilizó para reconstitution y la inmunización (Figura 3A, B). Incorporación de SERT en proteoliposomas aumenta la vida media en suero y la estabilidad de SERT y mejora la probabilidad de aislamiento de anticuerpos de alta afinidad. Además, la inclusión de lípido A, un componente de la pared celular bacteriana, sirve como un potente adyuvante 9. Los liposomas multilamelares se prepararon mediante la adición de tampón a una mezcla de lípidos secos en tubos de vidrio y se resuspendieron en tampón. La extrusión de los liposomas a través de filtros de tamaño de poro de 200 nm produce suspensiones de liposomas unilamelares monodispersas. Los liposomas se saturan entonces con un detergente, seguido de la adición de SERT purificada en detergente. Finalmente, el detergente se elimina por adición de resina de absorción hidrófobo para el lípido: mezcla de detergente. ligando adicional debe ser añadido a la muestra reconstituida para seleccionar anticuerpos que reconocen la conformación unida antidepresivo. La presencia de SERT en los proteoliposomas debe ser confirmado porsolubilización de una pequeña muestra con el tinte SDS-PAGE de carga o C12M y en ejecución en SDS-PAGE y FSEC (Figura 3C, D).
líneas celulares de hibridoma que expresan anticuerpos de SERT pueden ser examinados para la alta afinidad de unión que reconocen epítopos en 3D. Estas propiedades son cruciales para el éxito final de la cristalización, como el anticuerpo debe permanecer firmemente unido a una zona estructurada para promover el empaquetamiento cristalino de dominios homogéneos, bien ordenadas. En el primer paso, se identifican los anticuerpos que reconocen regiones no estructurados. SERT se desnaturaliza y se transfirió sobre una membrana de nitrocelulosa; anticuerpos que se unen SERT desnaturalizada deberán ser occidental-positivo y es probable que reconocen epítopos lineales. En la figura 4A, se muestra 2 ejemplos de anticuerpos que son positivos occidental y probablemente no es útil para promover crystallogenesis. En la Figura 4B, los restantes anticuerpos western-negativas se incubaron con 100 nM SERT-GFP y se separaron porFSEC. Los anticuerpos que se unen SERT se desplazará el pico GFP-positivas a una posición anterior. Los complejos de SERT-anticuerpo pueden diluirse adicionalmente en detergente para determinar si pueden unirse con afinidad nanomolar seguido de análisis por FSEC. La adición de los resultados de serotonina en los cambios conformacionales en el transportador y por tanto los anticuerpos pueden ser controlados de nuevo para determinar si pueden reconocer específicamente la conformación unida a SSRI. En la Figura 4C, los anticuerpos se muestra de obligar a SERT, en presencia de serotonina, lo que demuestra que el epítopo (s) no cambian de la ISRS al sustrato estado ligado. Finalmente, en la Figura 4D combinaciones de anticuerpos se ensayaron para determinar su capacidad de unirse a distintos epítopos, lo que resulta en un desplazamiento hacia la izquierda más allá. Aquí el 15B8 o 8A11 anticuerpos reconocen un epítopo que es diferente de 8B6.
El anticuerpo 8B6 se eligió para su posterior análisis estructural basado en el cribado preliminar con cristal trea papaínaTed Fab. Los genes de la 8B6 Fab se clonaron en un vector de expresión de células de insecto. Fab puede ser expresado y secretado a partir de células Sf9 que crecen en suspensión. El 8B6 Fab se puede purificar a partir del sobrenadante de células Sf9 por His-tag de afinidad (Figura 5A, B) y cromatografía de intercambio catiónico (Figura 5C, D), resultando en la proteína que aparece libre de contaminantes en geles de SDS-PAGE. En la Figura 5E, el recombinante 8B6 Fab se muestra para unirse SERT y se utiliza en experimentos bioquímicos y biofísicos posteriores.
La afinidad purificado SERT CC es digerido con trombina y EndoH y se mezcla con 8B6 Fab para formar un complejo en presencia de S citalopram. El complejo transportador-anticuerpo se separa entonces por SEC en C8M (Figura 6A) y las fracciones pico contiene tanto SERT y Fab tal como se muestra por SDS-PAGE (Figura 6B). El uso de C8M es crucial para la formación de cristales probablemente porqueel detergente de cadena corta permite un mejor empaquetamiento entre las moléculas en la red cristalina. FSEC se emplea para determinar qué fracciones se reunirán para la cristalización (Figura 6C); fracciones que no son monodispersas y / o que contienen grandes cantidades de SERT libre o Fab no se deben combinar.
Prisma en forma de cristales de SERT-anticuerpo pueden ser cultivadas en presencia de S citalopram usando este protocolo en la horca difusión del vapor de gota (Figura 7A). Los cristales resultantes se difractan los rayos X a una resolución de 3,15 Å 10 (Figura 7B).
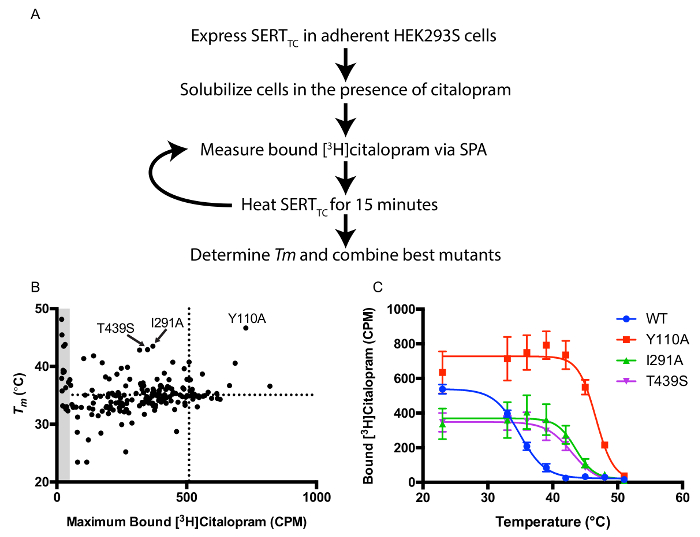
Figura 1: centelleo por proximidad basada en la termoestabilidad de ensayo A.. Descripción general de protocolo para la detección de termoestabilidad en la presencia de [3H] citalopram. B. Máximo consolidado [3 H] citalopram frente a la temperatura de fusión aparente (Tm). Las líneas de puntos representan los valores para el transportador de WT. Los 3 mutantes más termoestables están etiquetados. Área gris representa mutantes que tienen menos del 10% de citalopram [3H] en relación con valores de Tm por lo tanto inexactas WT y vinculante debido a una baja relación señal-ruido. C. Curvas de termoestabilidad para WT SERT TC y los 3 primeros mutantes. Las barras de error representan la desviación estándar (DE). Por favor, haga clic aquí para ver una versión más grande de esta figura.
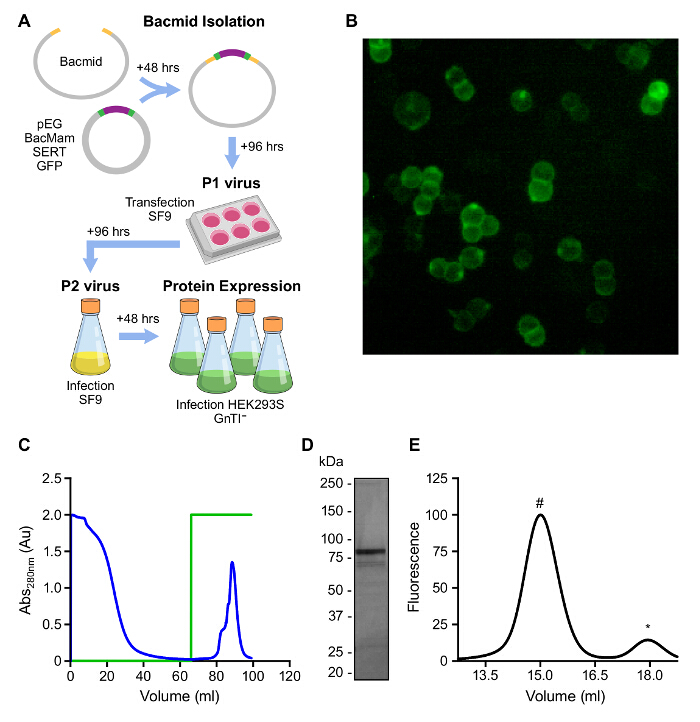
Figura 2: Visión general de mamífero heterólogos Expresión de proteínas A.. Resumen esquematizado de la generación de virus BacMam y expresión de SERT en HEK293s GnTI -. Células B. ÉLK293S GnTI - células que expresan el SERT CC (fluorescencia GFP) C.. Perfil de elución de SERT CC en resina de afinidad Strep. Rastro verde representa la concentración de destiobiotina, 0 - 100% (0 - 5 mM) D.. Análisis de afinidad purificado CC SERT en un 4 - gel 15% SDS-PAGE E.. FSEC de afinidad CC SERT purificada detectada por fluorescencia de GFP (excitación: 480 nm; Emisión: 510 nm). El pico que eluyó a 15 ml es SERT (#) y 18 ml de GFP es gratuita (*). Por favor, haga clic aquí para ver una versión más grande de esta figura.
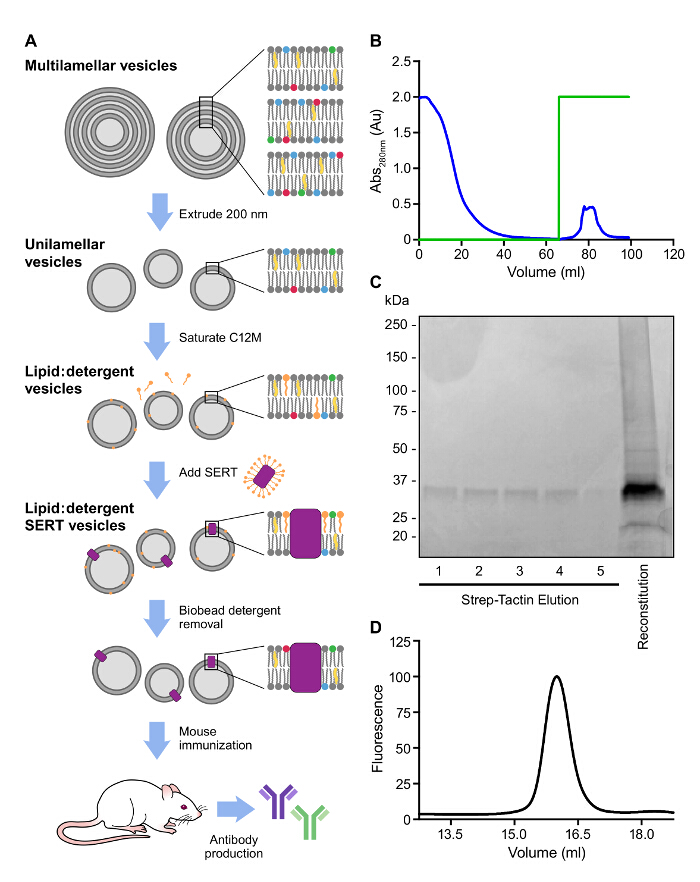
Figura 3: Representante de afinidad purificación y reconstitución del SERT IC A.. visión general esquemática de la generación de anticuerpos. B. Perfil de elución observó a 280 nm de la purificación por afinidad de SERT IC en resina de afinidad Strep. Rastro verde representa la concentración de destiobiotina, 0 - 100%. (0 - 5 mM) C. Análisis de afinidad purificado y reconstituido SERT en un 4 - gel 15% SDS-PAGE D.. FSEC de SERT solubilizado después de la reconstitución. Se utilizó la fluorescencia del triptófano residuos para detectar SERT (Excitación: 280 nm; Emisión: 335 nm). Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4:. Análisis de anticuerpos representativos de SERT A. Cribado de anticuerpos a través de Western blot. Aproximadamente 1 g de SERT CC con o sin GFP se aplicó a un 4-15% SDSgel PAGE y se transfirieron a una membrana de nitrocelulosa. La unión se detectó utilizando un anticuerpo de cabra anti-ratón conjugado con IR Dye. 2G4 y 10F2 son occidentales positivo. B. La unión de anticuerpos a 100 nm SERT GFP-etiquetado y detección por FSEC detectó utilizando fluorescencia de GFP. C. La unión de los Fab seleccionados a 100 nM SERT GFP-etiquetados en presencia de 1 mM de serotonina. D. La unión de los Fab 8A11 o 15B8 de SERT-8B6 Fab. Picos menores que eluyó a 18 ml GFP son gratis. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Purificación Representante de la 8B6 Fab a partir de células Sf9 A.. Perfil de elución observó a 280 nm de la purificación de la 8B6 Fab por His-tag chromatograp afinidad HY. Rastro verde representa la concentración de imidazol, 0 - 50% (0-250 mM) B.. No reductoras y reductoras en gel SDS-PAGE después de la purificación por afinidad de His-tag. La proteína que se extiende cerca de 50 kDa es Fab no reducido (#) y especies menores a 25 kDa se reduce Fab (*). C. Perfil de elución observó a 280 nm de la purificación de la 8B6 Fab mediante intercambio catiónico presentan un único pico simétrico que eluye bajo un gradiente lineal de cloruro sódico. Rastro verde representa la concentración de NaCl, 0 - 100%. (0 - 500 mM) D. Análisis de la 8B6 Fab en un gel de SDS-PAGE al 12,5% después de la purificación por intercambio catiónico. E. La unión del Fab 8B6 a 10 nM SERT GFP-etiquetados, detectado mediante fluorescencia de GFP. Por favor, haga clic aquí para ver una versión más grande de esta figura.
e 6 "src =" / files / ftp_upload / 54792 / 54792fig6.jpg "/>
Figura 6: Representante de filtración en gel La cromatografía del Complejo SERT-8B6 en la Presencia de citalopram S A.. Gel perfil de filtración en la elución del complejo de SERT-8B6 purificado. pico principal que eluyó a 11,5 ml es el complejo SERT-8B6. Pico a 15 - 17 ml contiene GFP y Fab B.. Análisis del complejo SERT-8B6 se purificó en una 4 - gel SDS-PAGE 15%. Las posiciones de SERT y las cadenas pesada y ligera del Fab se muestran por un guión. C. FSEC de las fracciones de tamaño separados. complejos SERT-8B6 se detectaron utilizando fluorescencia de triptófano. Fracción 17 contiene una mayor cantidad de SERT que no lo hizo complejo con Fab. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: La cristalización del complejo SERT-8B6 Bound to S citalopram A.. Microscopía de luz de los cristales de forma de paralelepípedo del complejo SERT-8B6 después de 2 semanas de crecimiento. La barra de escala es igual a 200 micras. B. cristales SERT-8B6 difractan los rayos X a 3,15 Å. anillo azul representa un 3,15 Å. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1:. Una pantalla de cristalización para el Complejo SERT-8B6 Bound to S citalopram Por favor, haga clic aquí para descargar la tabla.
Discusión
Determinación de la estructura de la proteína de membrana mediante técnicas biofísicas sigue siendo una tarea de enormes proporciones para muchos transportadores médicamente significativos, receptores y canales 11. Aquí compartimos conocimientos detallados desarrollado para la determinación de la estructura del transportador de serotonina humana unida a S citalopram. Anticipamos que estos métodos serán útiles para determinar estructuras de SERT en otros estados conformacionales, así como estructuras de otras proteínas de la membrana difíciles. Además, las técnicas bioquímicas descritas aquí también se pueden utilizar para la función de SERT purificada en detergente y un entorno de lípidos casi nativo estudiar.
SERT cristalización con bisagras en el desarrollo de varios instrumentos y técnicas. En primer lugar, la mejora de la termoestabilidad transportador producen variantes de SERT que se comportan bien en varias micelas de detergente después de la extracción del transportador de las membranas 6. En segundo lugar, el usode la alta afinidad de ligando S citalopram a lo largo de la purificación y cristalización mejora adicionalmente la estabilidad y la reducción de la heterogeneidad conformacional. En tercer lugar, el desarrollo del sistema de expresión BacMam 7 permitido para la producción de grandes cantidades de SERT en un corto período de 2 semanas, lo que facilita tanto la inmunización y cristalización. Por último, el desarrollo de estrategias para seleccionar los anticuerpos de alta afinidad que reconocen epítopos 3D permitidos para el descubrimiento del anticuerpo 8B6 que promueve el embalaje bien ordenada de los complejos de SERT-anticuerpo en cristales.
Hay una serie de pasos críticos y los reactivos, así como problemas comunes que a menudo se producen en todo el protocolo. En primer lugar, la generación de alto título de virus SERT P2 puede ser problemático. La adición de bajas concentraciones de virus P1 para generar virus P2 como se describe en este protocolo por lo general mitiga este problema, y en casos en que el título de virus P2 es baja, virus P3 se puede hacer usinG del virus a una MOI de 0,0001. Los virus con un título de menos de 1 x 10 8 partículas de virus / mL no se deben utilizar y casi siempre como resultado rendimientos de proteínas bajas. Para la expresión, HEK293s GnTI - se eligieron las células ya que carecen de N -acetylglucosaminyltransferase I actividad y por lo tanto no pueden sintetizar complejos -glycans N, en lugar produciendo sólo de alta manosa N -glycans. Escinde EndoH N -ligada glicosilación de alta manosa glicanos en dos sitios en bucle extracelular 2 (EL2), dejando un acetilglucosamina N unido a asparagina. La digestión de N -vinculada azúcares reduce la entropía superficie de EL2 que probablemente importante para la cristalización. Para la generación de anticuerpos, el SERT IC se debe utilizar para la inmunización. GFP es altamente inmunogénica 12 y no debe ser utilizado como un marcador de fusión para generar anticuerpos, ya que es difícil eliminar completamente por SEC. también El N- flexible y C-terminal de SERT no eranincluido en el constructo con el fin de evitar los anticuerpos contra estas regiones. Los ratones pueden inmunizarse con 30 g de proteína reconstituida; continuar ratones inmunizantes hasta altas concentraciones en suero de anticuerpos se pueden detectar y producir células de hibridoma como se describe 13. Una construcción termoestabilizada suele ser la mejor opción para la inmunización; si el transportista se comporta bien y retiene la actividad biológica después de la purificación, esto es a menudo suficiente para generar anticuerpos. El anticuerpo 8B6 se planteó en contra WT SERT. Para la cristalización, sólo las fracciones de los picos de SEC que contienen complejo monodisperso como se juzga por FSEC deben ser combinados y se concentraron. cristales SERT-8B6 crecen en un estrecho rango de condiciones y hay una serie de pasos que se deben tomar para solucionar problemas relacionados específicamente con el crecimiento de cristales SERT. Tris base ajustado con HCl no se debe utilizar en la solución de depósito, ya que este tampón no soporta el crecimiento de cristales; por lo que es critical para usar en lugar Tris ajustado con NaOH. cristales de SERT crecen en un estrecho rango de concentraciones de PEG 400, por lo que si los cristales no crecen o si se observan muchos cristales pequeños, se aconseja incluso un pequeño aumento o disminución en la concentración de PEG 400. Además, también se utilizó el ácido aditivo 6-aminohexanoico en la pantalla optimizado para mejorar la nucleación. La relación gota de proteínas: solución bien es también un factor determinante para el crecimiento de los cristales. Caída de proporciones de 1,5 a 2: 1 se recomienda, con relaciones de gota más cerca de 2: 1 típicamente apoyar el crecimiento de cristales de 3 dimensiones más grandes. Finalmente, el uso de perfil bajo placas de 24 pocillos también es crucial para el crecimiento de cristales, presumiblemente debido a la modificación de la velocidad de difusión de vapor.
Un enfoque alternativo para el método de SPA ha sido desarrollado para la detección de mutantes que estabilizan el transportador de serotonina de rata en una conformación de cocaína unida usando un filtro de ensayo 5 de unión. Por el contrario, los BA SPAensayo sed permite etapas de calentamiento secuenciales siguientes mediante la determinación de la fracción de SERT que permanece unida a ligando. Por lo tanto, esto permite la determinación rápida de la temperatura de fusión de un pequeño número de muestras. El método de SPA se basa en la disponibilidad de un ligando de alta afinidad radiomarcado y si no se conocen ligandos que se unen con afinidad submicromolar entonces será necesario un enfoque alternativo. Muchos otros métodos se utilizan comúnmente para medir la estabilidad de proteínas tal como la unión de colorantes fluorescentes y calorimetría 14 pero son de bajo rendimiento y son incapaces de medir directamente la función o requerir grandes cantidades de proteína. Si no se puede utilizar el método de SPA, un enfoque de alto rendimiento alternativa es un ensayo basado en FSEC termoestabilidad 15 (FSEC-TS), donde la muestra se calienta seguido de separación de la fracción de transportador restante. FSEC-TS es un enfoque útil para acceder comportamiento cromatográfico y el estado oligomérico y es apowerful herramienta complementaria que puede ser utilizado junto con el método de SPA.
También se encontró una comparación de diversos sistemas de expresión de proteínas comunes a favorecer el uso de células de mamífero para la expresión SERT 16 y como era de esperar este es probablemente el caso de muchas proteínas de origen mamífero. Los métodos que hemos utilizado para la expresión se han adaptado para SERT pero es probable fácilmente adaptable. Las condiciones que favorecen altos niveles de expresión deben ser cuidadosamente identificados por la variación del tiempo de la expresión, la temperatura, la concentración de virus, y la presencia de inhibidores de la histona desacetilasa tales como butirato de sodio.
Por lo general, a favor de la purificación por afinidad en un detergente de cadena larga suave tal como C12M junto con CHS antes de la reconstitución para retener de unión a ligando de alta afinidad. La reconstitución usando absorción hidrófobo es una técnica suave que hemos encontrado para ser eficaz para varios otros transportadores y receptores. Si estono tiene éxito, la eliminación de los detergentes con altas concentraciones micelares críticas mediante diálisis, dilución, o SEC se puede emplear 17 proporcionan el antígeno es suficientemente estable en tales detergentes. En los casos en que no se detectan anticuerpos adecuados, nos encontramos casi siempre el problema es debido a la pérdida de la función o desnaturalización del antígeno y en tales casos se realizó con éxito nuevas vacunas prestando especial atención a la bioquímica de proteínas. Finalmente, ligandos y anticuerpos que se unen con alta afinidad deben constituir la base para un experimento de cristalización racionalmente planificada y mediante el aprovechamiento de una variante termoestable, se puede seleccionar una gama más amplia de condiciones mediante la variación de las propiedades de diferentes detergentes. Además, la cristalización en una mesofase lipídica 18 o el uso de bicelas 19 siempre deben ser considerados como una alternativa a la cristalización en micelas.
Estos principios y métodos se pueden utilizar con un poco de modificación para muchas otras proteínas transmembrana que son difíciles de expresar y purificar a partir de otros huéspedes de expresión, y que será particularmente útil para la determinación de la estructura de los objetivos de los medicamentos de alta afinidad.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We thank D. Cawley for generating monoclonal antibodies. We thank A. Penmatsa and K. Wang for sharing ideas and expertise developed from the dopamine transporter. L. Vaskalis for assistance with figures, H. Owen for help with manuscript preparation and other Gouaux laboratory members for helpful discussions. J.A.C. has support from a Banting postdoctoral fellowship from the Canadian Institutes of Health Research. E.M.G. is supported by the National Science Foundation Graduate Research Fellowship. We are particularly grateful to Bernie and Jennifer LaCroute for their generous support, as well as for funding from the NIH (5R37MH070039). E.G. is an investigator of the Howard Hughes Medical Institute.
Materiales
| Name | Company | Catalog Number | Comments |
| DH10Bac | Invitrogen | 10361-012 | |
| Kanamycin | Fisher | BP906-5 | |
| Gentamicin | Fisher | BP918-1 | |
| Tetracycline | Sigma | T-7660 | |
| Bluo-gal | Invitrogen | 15519-028 | 5-Bromo-3-indolyl β-D-galactopyranoside |
| Isopropyl beta-D-1-thiogalactopyranoside | Anatrace | I1003 | IPTG |
| Miniprep kit | Qiagen | 27106 | |
| Cellfectin II | Invitrogen | 10362-100 | Sf9 transfection reagent |
| Sf9 | ATCC | CRL-1711 | |
| Sf-900 III SFM media | Life Technologies | 12658-027 | |
| HEK-293S GnTI- | ATCC | CRL-3022 | |
| Freestyle 293 media | Life Technologies | 12338-018 | 293 expression media |
| Fetal Bovine Serum (FBS) | Life Technologies | 0984018DJ | |
| Sodium butyrate | Sigma | 303410 | |
| S-citalopram | Sigma | E4786 | Anagrade |
| n-Dodecyl-beta-D-Maltopyranoside | Anatrace | D310 | |
| Cholesteryl hemmisuccinate | Sigma | C6013 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850457P | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar Lipids | 850757P | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoglycerol | Avanti Polar Lipids | 840457P | |
| Leupeptin | Sigma | L2884 | |
| Pepstatin A | Sigma | P5318 | |
| Aprotinin | Sigma | A1153 | |
| PMSF | Sigma | P7626 | |
| Desthiobiotin | Iba Life Sciences | 2-1000-05 | |
| Asolectin | Sigma | 11145 | |
| Cholesterol | Sigma | C-8667 | |
| Lipid A | Sigma | L5399 | |
| Brain polar lipid | Avanti Polar Lipids | 141101C | |
| Biobeads | Biorad | 152-3920 | Hydrophobic absorption resin |
| Goat anti-mouse IRDye 680RD | Odyssey | 926-68070 | Used as secondary antibody for western blotting |
| Lauryl maltose neopentyl glycol | Anatrace | NG310 | Anagrade |
| Serotonin | Sigma | H9523 | |
| pFastBac 8B6 | Available from authors | ||
| pEG Bacmam SERT Strep II | SERTIC, Available from authors | ||
| pEG Bacmam SERT GFP twin Strep His | SERTTC, Available from authors | ||
| pEG Bacmam SERT ts3 GFP twin Strep His | SERTCC, Available from authors | ||
| Imidazole | Sigma | 56749 | |
| n-Octyl β-D-maltoside | Anatrace | O310 | Anagrade |
| Thrombin | Haematologic Technologies | HCT-0020 | |
| EndoH | New England Biolabs | P0702 | |
| Trizma-HCl | Sigma | T5941 | Tris is used for preparation of crystallization reservoirs |
| PEG 400 | Sigma | 91893 | |
| 6-aminohexanoic acid | Sigma | 7260 | |
| Trypsin-EDTA | Fisher | MT25052CV | |
| Isoplate-96 TC | PerkinElmer | 6005070 | |
| PolyJet | SignaGen | SL100688 | Polymer transfection reagent for mamalian cells |
| Copper HIS-Tag YSI SPA Beads | PerkinElmer | RPNQ0096 | His-tag affinity SPA beads |
| Citalopram, [N-Methyl-3H] | PerkinElmer | NET1039250UC | |
| ThermoMixer C | Eppendorf | 5382000023 | heating block for thermostability assay |
| ThermoTop | Eppendorf | 5308000003 | |
| SmartBlock PCR 96, thermoblock for PCR plates | Eppendorf | 5306000006 | |
| 0.2 µm syringe filter | Olympus Plastics | 25-243 | |
| 1 L filter system | Corning | 430517 | |
| 2 L flat bottom tissue culture flask | Genemate | F-5909-2000 | |
| 2 L baffled tissue culture flask | Genemate | F-5909-2000B | |
| CO2 incubator | Thermo Scientific | 3950 | |
| Forma Orbital Shaker | Thermo Scientific | 416 | |
| Strep-Tactin resin | Iba Life Sciences | 2-1208-025 | Strep affinity resin |
| Extruder | Northern Lipids | ||
| Li-Cor imaging system | Odyssey | western blot imaging system | |
| XK16 column | GE Healthcare | 28-9889-37 | column used for Strep-Tactin and Talon purificaiton |
| 100 kDa MWCO protein concentrator | Millipore | UFC910096 | |
| 30 kDa MWCO protein concentrator | Millipore | UFC903024 | |
| Äkta FPLC | GE Healthcare | UPC-900 | |
| HPLC | Shimadzu | 51476 | |
| Superose 6 (10/300) column | GE Healthcare | 17-5172-01 | Used for FSEC |
| Tangential flow apparatus | Pall Filtron | ||
| 0.2 µm filter tangential flow cell | Pall Filtron | PSM20C11 | |
| 30 kDa MWCO tangential flow concentrator | Pall Filtron | OS030T12 | |
| Talon resin | Clonetech | 635504 | His-tag affinity resin used for Fab purification |
| 1 mL HiTrap SP column | GE Healthcare | 17115101 | Cation exchanger used for Fab purification |
| Superdex 200 10/300 GL column | GE Healthcare | 17-5175-01 | Used for SEC separation of SERT-8B6 |
| 24-well VDXm plate | Hampton Research | HR3-306 | |
| 18 mm coverslips | Hampton Research | HR3-239 | |
| Virocyt virus counter | Virocyt | 2100 | |
| MicroBeta Trilux | PerkinElmer | 1450 | 96-well scintillation counter |
| HiTrap SP column | GE Healthcare | 17115101 | |
| Sertraline | Sigma | S6319 |
Referencias
- Kristensen, A. S., et al. SLC6 neurotransmitter transporters: structure, function, and regulation. Pharmacol Rev. 63 (3), 585-640 (2011).
- Broer, S., Gether, U. The solute carrier 6 family of transporters. Br J Pharmacol. 167 (2), 256-278 (2012).
- Andersen, J., Kristensen, A. S., Bang-Andersen, B., Stromgaard, K. Recent advances in the understanding of the interaction of antidepressant drugs with serotonin and norepinephrine transporters. Chem Commun (Camb). 25 (25), 3677-3692 (2009).
- Hahn, M. K., Blakely, R. D. The functional impact of SLC6 transporter genetic variation. Annu Rev Pharmacol Toxicol. 47, 401-441 (2007).
- Abdul-Hussein, S., Andrell, J., Tate, C. G. Thermostabilisation of the serotonin transporter in a cocaine-bound conformation. J Mol Biol. 425 (12), 2198-2207 (2013).
- Green, E. M., Coleman, J. A., Gouaux, E. Thermostabilization of the human serotonin transporter in an antidepressant-Bound Conformation. Plos One. 10 (12), e0145688 (2015).
- Goehring, A., et al. Screening and large-scale expression of membrane proteins in mammalian cells for structural studies. Nat Protoc. 9 (11), 2574-2585 (2014).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- De Becker, G., et al. The adjuvant monophosphoryl lipid A increases the function of antigen-presenting cells. Int Immunol. 12 (6), 807-815 (2000).
- Coleman, J. A., Green, E. M., Gouaux, E. X-ray structures and mechanism of the human serotonin transporter. Nature. , (2016).
- White, S. H. The progress of membrane protein structure determination. Protein Sci. 13 (7), 1948-1949 (2004).
- Gambotto, A., et al. Immunogenicity of enhanced green fluorescent protein (EGFP) in BALB/c mice: identification of an H2-Kd-restricted CTL epitope. Gene Ther. 7 (23), 2036-2040 (2000).
- Galfre, G., Howe, S. C., Milstein, C., Butcher, G. W., Howard, J. C. Antibodies to major histocompatibility antigens produced by hybrid cell lines. Nature. 266 (5602), 550-552 (1977).
- Deller, M. C., Kong, L., Rupp, B. Protein stability: a crystallographer's perspective. Acta Crystallogr F Struct Biol Commun. 72, 72-95 (2016).
- Hattori, M., Hibbs, R. E., Gouaux, E. A fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Tate, C. G., et al. Comparison of seven different heterologous protein expression systems for the production of the serotonin transporter. Biochim Biophys Acta. 1610 (1), 141-153 (2003).
- Rigaud, J. L., Levy, D. Reconstitution of membrane proteins into liposomes. Methods Enzymol. 372, 65-86 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat Protoc. 4 (5), 706-731 (2009).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J Mol Biol. 316 (1), 1-6 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados