Method Article
Thermostabilization, Expression, Reinigung und Kristallisation des menschlichen Serotonin-Transporter-Bound
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt , wie für thermostabilisierende Mutationen zu screenen, die menschliche Serotonintransporter reinigen, Antikörper mit hoher Affinität zu erzeugen, und der Serotonin - Transporter-Antikörper - Komplex mit dem Antidepressivum S -Citalopram gebunden kristallisieren. Dieses Protokoll kann auf die Untersuchung von anderen schwierigen Membrantransportern, Rezeptoren und Kanälen angepasst werden.
Zusammenfassung
Der Serotonintransporter ist ein Natrium und Chlorid-gekoppelten Transporter dass "pumpt" extrazelluläre Serotonin in die Zellen. S -Citalopram ein Medikament verwendet , Depression und Angst zu behandeln , indem auf den Serotonin - Transporter mit hoher Affinität bindet, Serotonin - Wiederaufnahme blockiert. Hier berichten wir über ein effizientes Verfahren und eine Reihe von Werkzeugen zur Stabilisierung, Express, zu reinigen und Serotonin - Transporter-Antikörper - Komplexe zu S -Citalopram und anderen Antidepressiva gebunden kristallisieren. Mutationen , die den Serotonin - Transporter wurden stabilisieren identifiziert einen S -Citalopram Bindungsassay unter Verwendung. Serotonin - Transporter in Baculovirus-transduzierten HEK293s GnTI- - Zellen exprimiert, wurde in Proteo wiederhergestellt und verwendet hochaffinen Antikörpern zu erhöhen. Wir haben eine Strategie entwickelt, Antikörper zu entdecken, die für strukturelle Untersuchungen nützlich sind. Ein einfacher Ansatz für die Expression von Antikörperfragmenten in Sf9 Zellen wurde ebenfalls festgestellt.Transporter-Antikörper - Komplexe mit diesem Verfahren gereinigt sind gut erzogene und leicht kristallisieren, Komplexe mit S -Citalopram produzieren , die Röntgenstrahlen auf 3-4 Å Auflösung beugen. Die Strategien entwickelt hier können die Struktur anderer anspruchsMembranProteine zu bestimmen, verwendet werden.
Einleitung
Der Serotonintransporter (SERT) ist ein integrales Membranprotein, das den Transport von Serotonin durch Zellmembranen 1 erleichtert. SERT gehört zu einer Familie von Neurotransmitter Sodium Symporter (NSS) , die auch die 2 Dopamin und Noradrenalin - Transporter umfasst. SERT ist das molekulare Ziel von häufig verschriebenen Antidepressiva und Anti-Angst - Medikamente , die kompetitiv wirken , um Serotonin - Transport 3 hemmen. SERT nutzt die energetisch günstige cotransport Natrium Neurotransmitter aus dem synaptischen Spalt zu entfernen. Umfangreiche Charakterisierung des serotonergen Systems hat gezeigt , dass Veränderungen in der Serotonin - Stoffwechsel praktisch alle neurologischen Prozesse einschließlich Stimmung zu beeinflussen scheinen, Schlaf, Schmerz, Kognition und Aggression Verhaltensweisen 4. SERT - Funktion kann durch den Einsatz von Antidepressiva und selektive Serotonin - Wiederaufnahmehemmer (SSRI) wie S -Citalopram modifiziert werden, sowie durch psychostimulants und Drogen Sucht wie Amphetamin und 3,4-methylenedioxy- N -methylamphetamine oder "Ecstasy" 1,2.
SSRIs sind für die Behandlung von Stimmungsstörungen enorm wichtig, doch die genaue strukturelle Basis für ihre Tätigkeit ist nicht gut verstanden. WT SERT ist in Detergens - Mizellen instabil, wodurch Fortschritt behindert zu einer dreidimensionalen (3D) Struktur SERT 5,6. Kürzlich entwickelten wir Varianten von SERT , die in einer breiten Palette von Detergentien robust stabil sind und zu halten SSRI Bindungsaktivität 6. Diese thermo SERT-Varianten wurden unter Verwendung eines Scintillation-Proximity-basierten Thermo Assay ausgewählt. Hier beschreiben wir ein Verfahren zur Erzeugung von hochaffinen Antikörpern , die SERT binden kann, und die Reinigung und Kristallisation von thermo SERT, im Komplex mit Antikörper und S -Citalopram.
Dieses Protokoll geht davon aus, dass die SERT und 8B6 Gene erfolgreich geweseny geklont in die BacMam 7 und Insekten - Expressionsvektoren sind. Antikörper, cDNA kodierend Reste 73-616 von WT SERT erzeugt wurde mit einem C-terminalen Strep - Tag II (SERT IC) in den BacMam Vektor kloniert. Für die thermische Stabilität Bildschirm SERT Reste 73-616 mit C-terminalen GFP, Strep II und 10-His - Tags (SERT TC) verwendet. Einzelpunktmutationen wurden in der SERT TC Hintergrund erzeugt. Für die Kristallisation Protokoll wurde das SERT-GFP - Fusionsprotein mit Twin-Strep [TrpSerHisProGlnPheGluLys (GlyGlyGlySer) 2 GlyGlySerAlaTrpSerHisProGlnPheGluLys] und 10-His - Tags verwendet, die thermo Mutanten Y110A, I291A und T439S und Mutationen der Oberflächen Cysteine C554A, C580A Trage und C622A (SERT CC). Thrombin - Spaltsequenzen (LVPRGS) wurden ebenfalls in den SERT CC nach Q76 und T618 zu ermöglichen Entfernung der N- und C-Termini eingesetzt. Das Plasmid, das das 8B6 Fab kodiert, wurde entwickelt, sowohl die schwere und leichte auszudrückenKetten des Antikörpers mit GP67 Sekretion Sequenzen unter der Kontrolle von zwei getrennten Polyhedrin-Promotoren. Der C-Terminus der schweren Kette des 8B6-Antikörper wurde mit einem 8-His-Tag und eine Thrombin-Spaltstelle wurde zwischen der schweren Kette und der Tag eingefügt markiert.
Protokoll
1. Transfektion von adhärenten HEK293s GnTI- - Zellen für die Thermostabilität Bildschirm
- Bereiten Poly-D-Lysine (PDL) -beschichteten Platten mit 96 Vertiefungen. Alle Arbeiten in einer sterilen Laminar-Flow-Haube.
- Filtern, um eine 25 & mgr; g / ml Lösung von (PDL), Molekulargewicht 70,000-150,000 Da, einen 0,2 um Sterilfilter. In 50 ul PDL zu jeder Vertiefung einer 96-Well-Gewebekultur (TC) Platte, um sicherzustellen, der Boden gleichmäßig beschichtet ist, und Inkubation für 30 min bei RT.
- Absaugen PDL-Lösung und Waschen mit 200 & mgr; l sterilem Wasser.
- Erlauben Platte an der Luft trocknen für 2 h vor der Lagerung bei 4 ° C. PDL beschichteten Platten können bei 4 ° C für mehrere Wochen gelagert werden.
- Trypsinisierung von adhärenten HEK293s Zellen.
- Wachsen HEK293s zu 80% Konfluenz in einer 10 cm Schale bei 37 ° C mit 8% CO 2 gehalten. Eine einzelne 10 cm-Schale sollte etwa 10 Millionen HEK293s Zellen haben. Verwenden Sie keine Zellen nach 30 Passagen!
- Aspirat Medien und wasche mit 5 ml Phosphat-gepufferter Saline (PBS). 1 ml Trypsin-EDTA-Lösung (0,25% Trypsin, 0,02% EDTA) zu den Zellen und Inkubation für 2 min bei 37 ° C.
- In 10 ml Dulbecco-modifiziertem Eagle-Medium (DMEM), ergänzt mit 10% fötalem Rinderserum (FBS) und resuspendieren Zellen durch mehrmaliges Auf- und Abpipettieren eine serologische Pipette.
- Je 10 ul der Zellen und mit 10 & mgr; l Trypanblau-Lösung (0,4%). Bestimmen Zelldichte einer Zählkammer und mit einem Lichtmikroskop. Zählen Sie nicht Zellen, die blau gefärbt werden, wie sie tot sind. Stellen Sie sicher, dass die Lebensfähigkeit der Zellen über 90% liegt.
- Gründlich resuspendieren HEK293s GnTI- trypsiniert - Zellen in DMEM mit 10% FBS auf eine Dichte ergänzt von 0,5 x 10 6 Zellen / mL in einem Einweg - Pipettenreservoir. Etwa 5 Millionen HEK293s Zellen werden für jede Platte benötigt werden. Insgesamt 24 Konstrukte können auf jeder Platte mit dieser pr transfiziert werdenotocol.
- Mit Hilfe einer Mehrkanalpipette, 100 & mgr; l Zellen zu jeder Vertiefung einer PDL beschichteten Platte. Die Zellen in der Pipettenbehälter nach jeder Platte füllt eine gleichmäßige Verteilung der Zellen zu gewährleisten. Inkubiere Zellen in einem 37 ° C Inkubator mit 8% CO 2. Nach 24 h sollte die Zellen etwa 80% Konfluenz erreichen.
- 1 h vor der Transfektion ersetzt Medien. Bereiten DNA-Transfektionsreagenz Komplexe für die Transfektion.
- Für jede in der SERT TC Hintergrund konstruieren abgeschirmt werden, mischen 450 ng DNA mit 45 & mgr; l Serum-freiem DMEM und mischen. Hinzufügen 1,6 uL des Transfektionsreagenz bis 45 & mgr; l serumfreiem DMEM und mischen.
- Sofort im verdünnten Transfektionsreagenz Lösung DNA-Lösung und mischen. Sie keine Lösungen in der umgekehrten Reihenfolge mischen. Warten Sie 10 bis 15 Minuten und fügen Sie 20 ul Transfektionsreagenz / DNA-Gemisch zu 4 Vertiefungen.
- Sobald alle Vertiefungen transfiziert wurden, Platte mischen eine durch sanft schaukelnden Rückennd her und zurück zum 37 ° C Inkubator.
- Nach 16 - 24 h ersetzen Medium mit DMEM, das Serum und 10 mM Natriumbutyrat.
- Etwa 48 h nach der Transfektion entfernen Medien und entweder sofort mit Thermostabilität Bildschirm oder Gefrierzellen bei -80 ° C ablaufen zu später verwendet werden. Zellen können bei -80 ° C für mehrere Wochen gelagert werden.
2. Scintillation Proximity-basierten Thermostabilität Bildschirm mit S -Citalopram
- Inkubiere die Zellen mit 200 nM S -Citalopram in 25 & mgr; l TBS (Tris-gepufferte Kochsalzlösung - 20 mM Tris, pH 8, 100 mM NaCl) für 5 min bei RT.
- Solubilisieren Zellen durch Zugabe von 25 ul 8 mM n-Dodecyl-β-D-maltopyranosid (C12M), 1 mM Cholesteryl hemmisuccinate (CHS), Protease-Inhibitor-Cocktail (2 mM Phenylmethansulfonylfluorid (PMSF), 0,1 mg / ml Aprotinin, 4 g / ml Pepstatin A, und 4 ug / ml Leupeptin) in TBS und 1 h bei RT inkubiert.
- In 50 ul TBS with 20 nM [3 H] Citalopram (81,7 Ci / mmol), 0,1% Rinderserumalbumin und 2 mg / mL His-tag Affinität Scintillation Proximity Assay (SPA) -Kügelchen zu drei Vertiefungen für jedes Konstrukt. Für die letzte Vertiefung für die gleiche Lösung aufgelistet, sondern ergänzen mit 100 & mgr; M Sertralin nicht-spezifische Bindung zu bestimmen. Stellen Sie sicher, dass His-Tag Affinität SPA-Kügelchen gründlich gemischt sind, wenn sie auf die 96-Well-Platte hinzugefügt wird.
- Messen Sie [3 H] Citalopram Bindung unter Verwendung eines 96-Well - Szintillationszähler bei RT mit einer 1 min Zählzeit pro Vertiefung. Weiter zählen Platten bis Gesamtzählungen Plateau (ca. nach 36 h).
- Wärmeplatten für 15 min in einem Heizblock mit einem beheizten Deckel bei 33 ° C. Messen Sie [3 H] Citalopram Bindung wieder nach dem Erhitzen wie in 2.4 beschrieben.
- Wiederholen Sie Schritt 2,4 bis 2,5 und die Erhitzungsstufe auf 36 ° C, 39 ° C, 45 ° C, 48 ° C und 51 ° C ändern. Einstellen Heiztemperaturen in Abhängigkeit von der scheinbaren Schmelztemperatur (Tm)des Zielproteins und der Thermostabilität des stabilsten Konstrukts. Weiter Platten zu erhitzen, bis alle Konstrukte niedrige spezifische Zählungen haben.
- Analysieren Daten Tm - Werte zu bestimmen.
- Bestimmen Sie die durchschnittliche Gesamt Zählungen pro Minute (CPM) jeder für Brunnen bauen, die Sertralin nicht enthalten, die durch die drei Wiederholungsvertiefungen im Durchschnitt. Bestimmen Sie die nicht-spezifische CPM durch die CPM jeder Vertiefung mit Sertralin in einer einzigen Platte gemittelt werden.
- Berechnen spezifischen CPM durch die unspezifische CPM von der gesamten CPM subtrahiert wird.
- Berechnen der Tm durch eine nichtlineare Anpassung an eine Boltzmann Sigmoidfunktion. Konstrukten mit niedrigem spezifischen CPM bei RT (<10% der WT) im allgemeinen keine exakten Tm - Werte. Mutationen aus den thermo Konstrukte können zusammen und für die additive Erhöhung der Thermostabilität gescreent kombiniert werden.
3. Expression des Human-Serotonin-Transporter in HEK293s GnTI- - Zellen
- Trans chemisch kompetente DH10Bac Zellen mit 1 ng Plasmid.
- Hinzufügen Plasmid zu 50 & mgr; l DH10Bac-Zellen und Inkubieren auf Eis für 30 min.
- Hitzeschock-DH10Bac-Zellen bei 42 ° C für 30 sec. In 200 ul SOC-Medium und Inkubation bei 37 ° C für 4 h unter Schütteln.
- Platte alle Bakterien auf einem Luria Broth (LB) Platte, die 50 ug / ml Kanamycin, 7 & mgr; g / ml Gentamycin, 10 ug / ml Tetracyclin, 100 ug / ml 5-Brom-3-indolyl β-D-galactopyranosid, und 40 ug / ml Isopropyl β-D-1-thiogalactopyranosid (IPTG).
- Isolieren lacZ - Kolonien (weiße Kolonien) für 2 d bei 37 ° C gewachsen auf LB - Agar - Platten.
- Wachsen mehrere Kolonien O / N bei 37 ° C in 5 ml LB-Antibiotika enthalten und zu isolieren Bacmid DNA.
- Spin down Bakterien bei 1000 × g in einer Zentrifuge für 5 min. Überstand verwerfen. Resuspendieren Bakterien mit 200 & mgr; l Miniprep-resuspension Puffer.
- Lysieren Bakterien durch Zugabe von 200 & mgr; l Miniprep-Lysepuffer und Umdrehen des Röhrchens sanft 10mal. In 200 ul Neutralisierungspuffer.
- Entfernen unlöslichen Fraktion von in einer Zentrifuge bei 14.000 xg für 10 min dreht. 1 ml Isopropanol zum Überstand und Kälte bei -20 ° C für 20 min DNA auszufällen.
- Spin bei 14.000 × g für 15 min in einer Zentrifuge und Überstand verwerfen.
- Wasch DNA-Pellet mit 70% EtOH und Spin erneut bei 14000 × g für 15 min. Überstand verwerfen. Luft trocknen lassen, bis alle DNA EtOH wurde verdampft und resuspendieren in 50 & mgr; l Wasser.
HINWEIS: Die Bacmid-DNA in Sf9-Zellen, für die besten Ergebnisse sofort transfiziert werden sollten, sondern kann auch für mehrere Wochen bei -20 ° C gelagert werden.
- Transfizieren Bacmid - DNA in 1x10 6 Zellen von adhärenten Sf9 in einer befeuchteten Kammer bei 27 ° C in einer Schale mit 6 Vertiefungen gezüchtet. Führen Sie alle Zellkulturmanipulationen in einer sterilen Laminar-Flow-Haube.
- Entfernen Sie das Medium aus Zellen und mit 2 ml frischem Sf9 Medien. Zugabe von 5 & mgr; g Bacmid-DNA auf 100 & mgr; l von Sf9 Medien (Lösung A).
- Aus 8 & mgr; l eines kationischen Lipid-Sf9 Transfektionsreagenz auf 100 & mgr; l von Sf9 Medien (Lösung B). Inkubieren Rohr Lösung B für 5 min enthält.
- Mischungsrohr enthaltende Lösung A mit Lösung B und Inkubation bei RT für 30 min und fügen die gesamte Lösung zu den Sf9-Zellen.
- Nach 96 h, Ernteüberstand (P1-Virus) durch durch ein 0,2 um Filter geleitet. Der P1-Virus kann mehrere Monate lang bei 4 ° C im Dunkeln und wiederverwendet gespeichert P2-Virus zu machen, wie benötigt.
- Füge 100 & mgr; l P1 Virus zu 1 l Sf9 Zellen bei einer Dichte von 1 x 10 6 Zellen / mL in Sf9 Medien. Infect Zellen für 96 h, bei 27 ° C auf einem Schüttler bei 100 Upm wachsen.
- Spin-down Zellen in einer Zentrifuge bei 4000 × g für 15 min und Filterüberstand, der Viruspartikel durch ein 0,2 um-Filter. Entsorgen Zellpellet. determine virale Dichte eines viralen Plaque-Test oder einen Virus Zähler verwendet wird. Die Dichte Virus sollte> 1 x 10 8 Viruspartikel pro Milliliter. P2 Virus kann für mehrere Monate bei 4 ° C im Dunkeln gespeichert und verwendet werden.
- 10 l HEK293s GnTI- Infect - Zellen 7 in Suspension bei 37 ° C mit 8% CO 2 und 85% Luftfeuchtigkeit auf einem Schüttler bei 130 rpm in 293 Expressionsmedien , supplementiert mit 2% FBS bei einer Multiplizität der Infektion (MOI) von 2 wächst und einer Dichte von 3 x 10 6 Zellen / ml, typischerweise 30 - 50 ml P2 - Virus pro 800 ml Zellen in einem 2 - L Schikanekolben.
HINWEIS: Es wird nicht mehr als 80 ml P2 - Virus seit dem HEK293s GnTI- empfohlen zu verwenden - Zellen langsam wachsen und kann in pH unrentabel werden aufgrund einer Änderung. Sf9 Medien ist saurer als die 293 Expression Media. - 12 bis 16 h nach der Infektion, Natriumbutyrat in einer Konzentration von 10 mM aus einer 1 M Stammlösung hinzuzufügen. 48 - 60 h nach der Infektion Ernte Zellen durch Zentrifugation bei4.000 xg für 15 min. Entfernen Sie den Überstand.
- Die Zellen in 150 ml TBS, 2 uM S -Citalopram oder andere SERT - Inhibitoren und bei -80 ° C bis sie bereit zur Reinigung.
4. Affinitätsreinigung des Serotonin-Transporter für Immunisierung und Kristallisation
- Auftauen Zellen aus 10 l Kultur in warmem Wasser (ca. 30 ° C) und Resuspendieren von schnell bis zur Homogenität durch eine 10 ml-Pipette vorbei.
- Bereiten Reinigungslösung zur Solubilisierung (150 ml): 80 mM Tris, pH 8, 150 mM NaCl, enthaltend 40 mM C12M, 5 mM CHS und Protease-Inhibitor-Cocktail.
- Fügen alle Zellen in ein Becherglas mit einem Rührstäbchen und fügen alle der Waschmittellösung zu den Zellen unter Rühren. bei 4 ° C solubilisiert unter Rühren für 1 h.
- Spin-Lysat bei 8000 xg für 15 min bei 4 ° C. Entsorgen Pellet und umfüllen Überstand in saubere Ultrazentrifuge Rohre. Spin bei 100.000 × g für 1 h in einem ultracentrifuge. Pellet verwerfen und Filterüberstand durch ein 0,2 um-Filter.
- Passieren Lysat über 10 ml Strep Affinitätsharz in eine Säule gepackt eine peristaltische Pumpe in Waschpuffer äquilibriert: 1 mM C12M, 0,2 mM CHS, 5% Glycerol, 25 uM Lipid (1-Palmitoyl-2-oleoyl- sn - glycero 3-phosphocholin, 1-Palmitoyl-2-oleoyl- sn - glycero-3-phosphoethanolamin und 1-Palmitoyl-2-oleoyl- sn - glycero-3-phosphoglycerin bei einem molaren Verhältnis von 1: 1: 1) und 1 uM S -Citalopram oder SSRI in TBS.
- Verbinden Strep-Affinitätssäule mit einem Fast Protein Liquid Chromatography (FPLC) -System und Waschkolonne mit 2 ml / min mit 66 ml (6,6 Säulenvolumina) Waschpuffer. Elute gereinigtes Protein in demselben Puffer mit 5 mM Desthiobiotin ergänzt mit 0,5 ml / min unter Verwendung von 33 ml (3,3 Säulenvolumen) des Puffers. Sammeln Sie 1-ml-Fraktionen; Die Peakfraktionen werden ~ 10 ml sein. Gereinigtes Protein kann für 2 bei 4 ° C gelagert werden - 3 d, falls gewünscht.
HINWEIS: Die Gesamtausbeute wird 3 sein -4 mg SERT CC und 1 mg SERT IC. Eine Extinktion von 2 AU bei 280 nm ist auf 1 mg / mL SERT gleich.
5. Rekonstitution der Transporter in Liposome für Immunization
- Bereiten Sie Liposomen, die Asolectin: Cholesterin: Lipid A: Gehirn polare Lipid (Mol-Verhältnis 60: 17: 3, 20). Auflösen Lipiden in 1 ml Chloroform und werden 40 mg Gesamtlipid in einen 100 ml-Glasrundkolben, bei dem angegebenen Molverhältnis.
- Verdunsten Chloroform mindestens 1 h im Vakuum mit dem Rundkolben in warmem Wasser drehen, etwa 30 ° C.
- Rehydrieren Lipiden durch 10 ml TBS hinzugefügt wird. Inkubieren in Puffer für 10 min.
- Frieren Sie das Lipid , indem der Kolben in flüssigem N 2.
- Auftauen. Tauchen kugelförmigen Boden des Kolbens in einen Becher mit warmem Wasser gefüllt ist, etwa 30 ° C. Beschallen in einem Ultraschallbad für 5 min.
- Vortex und wiederholen Schritte 5.1.3 - 5.1.4 10-mal oder bis zum Lipidvollständig von dem Boden resuspendiert und bildet eine trübe Suspension.
- Extrudieren die gesamte Lipidmischung zweimal durch 200 nm-Filter. Das Lipid wird als milchige Suspension vor der Extrusion erscheinen; danach wird es durchscheinend sein. Sie nicht auf einmal die gesamte Lipid-Mischung in den Extruder hinzufügen, wie es verstopft werden kann, was zu einem Verlust der Probe.
- Spin Lipiden bei 100.000 xg für 20 min und resuspendieren in 0,5 bis 1 ml TBS mit einer Konzentration von 40 mg / mL.
- Konzentrat gereinigter SERT IC 250-500 & mgr; l unter Verwendung eines 100 kDa MWCO Zentrifugen Protein Konzentrator auf 2 - 4 mg / mL und sättigen Liposomen mit 5 mM C12M. Hinzufügen gereinigter SERT dem Waschmittel: Lipidgemisch in 1 ml Endvolumen.
- Entfernen C12M von 3 aufeinanderfolgenden Zugaben von 80 mg / ml hydrophobes Absorptionsharz. Für die ersten 2 Additionen, mit Harz unter Rotation für 2 h bei 4 ° C inkubieren. Entfernen Harz, indem sie durch Glaswolle. Führen Sie die abschließenden Inkubation mit Harzüber Nacht.
- Konzentrat Proteo durch Zentrifugation bei 100.000 × g für 20 min. Überstand verwerfen und Pellet in 250-500 ul von TBS.
- Zugabe von 10 & mgr; M Endkonzentration von S -Citalopram zu dem rekonstituierten Protein nach der endgültigen Entfernung des Harzes.
- Solubilisieren 2,5 ul der Proteoliposomen in SDS-PAGE Beladungspuffer (62,5 mM Tris, pH 6,8, 10% Glycerin, 2% SDS, 0,01% Bromphenolblau, 100 mM DTT) und auf einem SDS-PAGE-Gel bei 200 V für 1 h, dass SERT, um sicherzustellen, wurde erfolgreich wiederhergestellt. Proteoliposomen können jeder Immunisierung vor bei -80 ° C in Aliquots für die Langzeitlagerung und aufgetaut auf Eis gelagert werden.
6. Screening für Antikörper 3D-Epitope erkennen
- Bildschirm Hybridomzellinien durch Western-Blot. Antikörper, die SERT erkennen durch Western-Blot binden wahrscheinlich lineare Epitope und wird wahrscheinlich nicht für strukturelle Untersuchungen nützlich sein.
- Mix 1 ug purified SERT IC oder SERT CC und auf einem 4-15% SDS-PAGE - Gel bei 200 V für 1 h.
- Transfer auf eine Nitrocellulose Membran bei 200 mA für 30 min unter Verwendung von Towbin-Puffer (25 mM Tris, 192 mM Glycin, 20% (v / v) Methanol, 0,1% SDS). Die Membran kann getrocknet und bei Raumtemperatur unbegrenzt gelagert werden.
- Rewet-Membran mit 10% Methanol und Waschen mit PBS (10 mM Phosphat, pH 7,4, 137 mM NaCl, 2,7 mM KCl).
- Blockieren mit 5% Milchpulver in PBS für 30 min bei RT.
- Waschen mit PBS und Inkubation mit 1 & mgr; g / ml Antikörper in PBS mit 0,1% Milch.
- Waschen ausgiebig mit PBS 0,1% Tween-20 enthält.
- Inkubieren mit Ziegen-Antikörper anti-Maus an einen IR-Farbstoff konjugiert verdünnt 1: 10.000 in PBS mit 0,1% Tween 20 und 0,1% Milch.
- Waschen Sie ausgiebig und scannen, ein Abbildungssystem verwendet wird.
- Mischungs Hybridomüberstand western negativen Antikörper mit 100 nM SERT CC Protein enthält , mit einem Molverhältnis von 1: 2 (SERT: mAb) in 200 & mgr; l TBS mit 1 mM C12M, 0,2 mM CHS und 1 uM S -Citalopram. Zentrifuge bei 100.000 xg für 20 min. Analysieren Überstand, der SERT-mAb - Komplexe und Analyse durch Fluoreszenz-Detektions Grßenausschlußchromatographie (FSEC) 8. Entsorgen Sie das Pellet.
- Auflagen 100 & mgr; l Überstand auf einer Größenausschlusssäule mit 0,5 ml / min eine High Performance Liquid Chromatography (HPLC) -System mit einem Fluoreszenz-Detektor ausgestattet war (Excitation: 480 nm, Emission: 510 nm) Laufpuffer enthält, TBS, 0,4 mM Lauryl- Maltose Neopentylglykol und 1 uM S -Citalopram. Antikörper, die Komplexe bilden, führt dazu, dass das GFP-Fusionsprotein zu eluieren früher als der freie transporter aus der Größenausschluss-Säule.
- Verdünnen Komplexe bis 10, 1, 0,1 nM in 200 ul TBS mit 1 mM C12M, 0,2 mM CHS und 1 uM S -Citalopram und Rerun FSEC. Antikörper, die den Transporter Spitze bei niedrigen nanomolaren Konzentrationen noch verschieben können, sindhohe Affinität Bindemittel und gute Kandidaten für Strukturuntersuchungen.
- Retest Bindung durch FSEC in Gegenwart von 1 mM Serotonin. Antikörper, die spezifisch die SSRI gebundene Konformation erkennen wird nicht in Gegenwart des Substrats binden. Antikörper, die ein 3D-Epitop erkennen, das als Ergebnis der Konformation nicht ändert binden, unabhängig von der vorhandenen Liganden.
- Mischen Sie paarweise verschiedene Kombinationen von Antikörpern und testen Bindung von FSEC. Antikörper, die verschiedene Epitope erkennen verursacht SERT früher zu eluieren, wenn miteinander kombiniert im Vergleich zu einer einzelnen Antikörperbindung.
- Für die erste Strukturstudien, wählen Sie die höchste Affinität Antikörper, die 3D-Epitope erkennen.
7. Expression von Antikörperfragment in Sf9-Zellen
- Clone variablen und konstanten Domänen des Fab durch PCR in den Insekten-Expressionssystem für die Expression in Sf9-Zellen unter Verwendung von Standardprotokollen.
- Transfizieren 1 x 10 6 Sf9 - Zellen mit 5 ug Bacmid DNA , die die leichten und schweren Ketten des 8-His - markierten 8B6 Fab mit einer GP67 Sekret - Sequenz , die (gemäß Abschnitt 3.4).
- Ernte P1 Virus 96 Stunden nach der Transfektion und füge 500 ul P1 Virus auf 1 l Sf9 Zellen bei einer Dichte von 1 x 10 6 Zellen / ml in einer 2 l - Kolben zu P2 - Virus zu machen. Infect Zellen für 96 h bei 27 ° C.
- Ernte-P2-Virus (gemäß Abschnitt 3.6).
- Infect 6 L von Sf9 Zellen bei einer Dichte von 2 - 3 x 10 6 Zellen / ml mit einer MOI von 2 mit P2 - Virus, in der Regel 40 - 50 ml pro Kolben mit 1 l Sf9 - Zellen in je 2 l - Kolben.
- Ernten Sie die Zellen etwa 96 h nach Infektion. 50 ml Phosphatpuffer, pH 8 bei einer Endkonzentration von 50 mM zu den Zellen und Schleudern bei 4.000 xg für 20 min. Entsorgen Sie das Zellpellet und Filterüberstand durch ein 0,2 um Filter tangentialen Strömungszelle. Sammeln Sie den Überstand und lagern bei 4 ° C für 2 - 3 Tage, falls gewünscht.
8. Reinigung von Antikörperfragmenten aus Sf9 Supernatant
- Konzentrat Sf9-Überstand eine 30 kDa Molekulargewicht Cut Off (MWCO) tangentiale Strömungszelle auf etwa 400 unter Verwendung von - 800 mL.
- Hinzufügen Imidazol, pH 8 bei einer Endkonzentration von 10 mM und 10 ml His-Tag-Affinitätsharz. Rühren Sie in einem Becher für 1 h bei 4 ° C.
- Sammeln His-tag-Affinitätsharz durch Zentrifugation bei 2.000 xg für 5 min. Überstand verwerfen.
- Packen His-Tag-Affinitätsharz in eine Säule und eine Verbindung zu einem FPLC.
- His-tag-Affinitätsharz mit 2 ml / min mit 66 ml Wasch (6,6 Säulenvolumen) von 50 mM Phosphat, pH 8, 150 mM NaCl, 25 mM Imidazol.
- Elute 8B6 Fab in 33 ml 50 mM Phosphat, pH 8, 150 mM NaCl, 250 mM Imidazol. Sammeln Sie 1-ml-Fraktionen.
- Verdünnte affinitätsgereinigtem Fab mit einem 10-fachen Volumen eiskaltem 20 mM Acetat, pH 5.
- Binden Fab zu einer 1 ml-Kationenaustauschsäule eine peristaltische Pumpe bei 1 ml / min verwendet wird.
- Separate Fab unter Verwendung einer 30 ml linear Gradienten von NaCl (0-500 mM) in 20 mM Acetat pH 5,5 eine FPLC unter Verwendung. Fab wird bei ~ 300 mM NaCl als einzelner Peak eluieren.
- Analyse auf einem 12,5% SDS-PAGE-Gel unter Verwendung von Probenpuffer, enthaltend 100 mM DTT. Die schweren und leichten Ketten des 8B6 Fab wird bei 27 und 25 kDa laufen, die jeweils auf einem reduzierenden SDS-PAGE-Gel.
- Pool Fab enthaltenden Fraktionen und konzentriere, um mindestens 10 bis 15 mg / ml eine 30 kDa MWCO Protein Konzentrator in einer Schwingbecherzentrifuge bei 3.000 x g verwendet.
- Einstellen auf pH 8 durch Zugabe von 1 M Tris pH 8 bis zu einer Endkonzentration von 50 mM und speichern gereinigt Fab für Langzeit bei 4 ° C. 30 mg - Die Gesamtausbeute beträgt 25 sein. Eine Absorption von 1,4 AU bei 280 nm ist auf 1 mg / ml 8B6 Fab gleich.
9. Bildung von Transporter-Antikörper-Komplexe und Trennung durch Grßenausschlußchromatographie
- Zur Kristallisation reinigen die SERT CC durch Streptokokken Affinitätschromatographie in C12M , wie zuvor beschrieben (Abschnitt 4).
- Digest mit Thrombin zu entfernen Tags (1: 100 w / w) und EndoH (1:10 w / w) O / N bei RT. Konzentrat auf 250-300 & mgr; l unter Verwendung eines 100 kDa MWCO Zentrifugen Protein Konzentrator auf eine Proteinkonzentration von 10 mg / mL.
- Mischungs konzentrierter SERT mit Fab bei einem molaren Verhältnis von 1: 1,2 in einem Volumen von weniger als 500 & mgr; l. Zentrifuge bei 100.000 × g bei 4 ° C für 20 min. Sammeln Überstand SERT-Fab-Komplex enthält. Verwerfen Pellet.
- Separate durch Size Exclusion Chromatography (SEC) eine FPLC auf einer Größenausschluss-Säule, äquilibriert in TBS unter Verwendung supplementiert mit 40 mM n-Octyl-β-D-maltosid (C8M), 0,5 mM CHS, 5% Glycerol, 25 uM Lipid (wie in Schritt 4.5) und 1 uM S -Citalopram bei 0,5 mL / min.
- Sammeln 0,5-ml-Fraktionen und zu analysieren, auf 4-15% SDS-PAGE-Gelen sowie durch Tryptophan-Fluoreszenz durch SEC. GFP markiert SERT bei etwa 80 kDa auf einem SDS-PAGE-Gel laufen gelassen wird. Nach dem Entfernen des Termini und N-gebundene Zucker werden sie als 45-kDa-Protein ausgeführt.
- Determine die Fraktionen durch die Zusammenlegung nur die Fraktionen zu kombinieren, die wie durch Analyse der Fraktionen durch Tryptophan-Fluoreszenz SEC beurteilt monodispers (Anregung: 280, Emission: 335 nm).
- Store gereinigt SERT-8B6-Komplex bei 4 ° C für bis zu 1 Woche.
10. Kristallisation von Transporter-Antikörper-Komplexe durch Tropfen Hanging
- Vor der Kristallisation konzentriert Peakfraktionen aus der SEC Trennung des SERT-8B6-Komplex zu 2 mg / ml eine 100 kDa MWCO Zentrifugen Protein Konzentrator verwendet wird. Eine Extinktion von 2 AU bei 280 nm gleich 1 mg / mL.
- Fügen Sie zusätzliche Fab in einem Verhältnis von 1: 0,05 Komplex: frei Fab. In 10 uM frei S -Citalopram.
- Zentrifuge bei 100.000 × g bei 4 ° C für 20 min. Sammeln Überstand mit dem SERT-Fab-Komplex enthält. Verwerfen Pellet.
- Richten Sie bei 4 ° C , um einen hängenden Tropfen 24-Well - Bildschirm gemäß Tabelle 1. Beugungs Qualität Kristalle über Reservoir Lösungen wachsenenthaltend 100 mM Tris-NaOH, pH 8,5, 25 bis 125 mM KCl, 32,5 bis 34% PEG 400 und 0,5% 6-Aminohexansäure.
HINWEIS: Die Verwendung Tris eingestellt mit NaOH auf pH 8,5 als Puffer. verwenden Tris-Base nicht mit HCl eingestellt. Der Bildschirm kann in 2 ml-Röhrchen hergestellt und verwendet werden, bis Sie fertig sind. Achten Sie darauf, genau zu pipettieren PEG 400 eine positive Verdrängungspipette, da es extrem zähflüssig ist!- Pipette 500 ul jeder Vorratslösung in einem niedrigen Profil von 24-Well-Platte mit einem Dichtmittel in jede Vertiefung aufgetragen. Pipette 1,5, 1,75 und 2 ul der SERT-8B6-Komplex auf einem 18 mm silikonisierten Deckglas. Pipette 1 ul Vorratslösung auf der Proteinprobe.
HINWEIS: Die Platte mit Dichtmittel bereits aufgebracht Rand der Vertiefungen erworben wurde. - Bewerben Schieber auf dem 24-Loch mit den Tropfen der Reservoirlösung zugewandt und sofort verschließen durch Drücken Deckglas auf Dichtmittel auf jede Vertiefung vorge angewendet.
- Weiter, bis alle 24 Brunnen wurden eingerichtet.
- Lassen Sie die fertige Platte in einem gut isolierten Raum bei 4 ° C. mindestens 3 Tage nicht stören Platten für
HINWEIS: Einkristalle innerhalb von ca. 3 Tage und wachsen zu 100-175 & mgr; m nach 14 Tagen erscheinen wird.
- Pipette 500 ul jeder Vorratslösung in einem niedrigen Profil von 24-Well-Platte mit einem Dichtmittel in jede Vertiefung aufgetragen. Pipette 1,5, 1,75 und 2 ul der SERT-8B6-Komplex auf einem 18 mm silikonisierten Deckglas. Pipette 1 ul Vorratslösung auf der Proteinprobe.
- Ernte - Kristalle in Kryoschleifen und direkt Flash-cool in flüssigem N 2 vor der Röntgenbeugungsdatenerfassung.
- Bei Bedarf finden zusätzliche Kristallisationsbedingungen durch breites Screening mit hängenden Tropfen. Drei Tropfen mit Protein: Fällmittel Verhältnisse von 2: 1, 1,5: 1, 1: 1. Wenn ein Roboter zur Verfügung steht, dann gründen 100-150 nL Tropfen über 70 & mgr; l Reservoirlösung in einer 96-Well-Platte. Größere 3D-Kristalle können in 24-Mulden gezüchtet werden.
- Ergebnis basierend auf dem Aussehen des Tropfens: 0, klar; 1, Staub; 2, körniger Niederschlag; 3, Phasentrennung; 4, mikrokristallin; 5, Nadeln; 6, Platten; 7, 3D-Kristalle.
- Richten Sie die Kristallisation durch Tropfen hängen Methoden in 24-Vertiefungen wie um neu identifizierte cond oben beschriebenitions.
Ergebnisse
Eine Bibliothek von Einzelpunktmutationen im SERT TC Hintergrund wurde für thermostabilisierende Mutationen Bildschirm erstellt. Einzelne Mutanten wurden unter Verwendung von Standard-Mutagenese erzeugt. Das Screening - Protokoll verwendet transient HEK293s Zellen und einer Scintillation - Proximity-basierten Thermo Bildschirm schnell Identität nützliche Mutationen zur Kristallisation transfiziert , wie in 1A dargestellt. Plotting Tm - Werte im Vergleich zu gebundenen [3 H] Citalopram bei RT zeigt Konstrukte mit hoher Thermostabilität und Expressionsniveaus geeignet zur Proteinreinigung (1B). Drei Mutanten (Y110A, I291A und T439S) wurden kombiniert , um eine hochstabile Konstrukt (Abbildung 1C) zu erzeugen. Thermostabilität ist auch mit einer erhöhten Stabilität in kurzkettigen Detergentien, die für die Kristallisation des SERT-Fab-Komplex korreliert.
Das groß angelegte Expression von humanen SERT unter Verwendung von Baculovirus-transduced HEK293s GnTI- - Zellen können weniger als 2 Wochen dauern und Milligramm - Mengen produzieren kann, wie in 2A dargestellt. Verwendung des GFP-markiertes SERT CC Protein ermöglicht SERT bequem während der Expression und Reinigung durch Fluoreszenz (2B) folgen. Unsere Reinigungsstrategie einbezogen 1) Solubilisierung von SERT gebunden S -Citalopram aus HEK293s GnTI- - Zellen in C12M in Gegenwart von CHS als stabilisierendes Lipid; 2) Bindung von SERT an einer Streptokokken-Affinitätsmatrix; 3) Entfernung von verunreinigenden Proteinen durch ausgiebiges Waschen; und 4) Eluieren des funktionellen SERT mit Puffer , enthaltend Desthiobiotin (Abbildung 2C). Das eluierte Protein ist im Wesentlichen frei von anderen nachweisbaren Proteine durch Coomassie - Blau - Färbung und monodisperse wie durch FSEC (2D, E) beurteilt.
Es wurde eine ähnliche Strategie SERT mit einem Strep-II-Tag zu reinigen genommen, die für reconstitutio verwendet wurde,n und Immunisierung (3A, B). Einbau von SERT in Proteo erhöht die Serumhalbwertszeit und Stabilität der SERT und verbessert die Wahrscheinlichkeit der Isolierung von hochaffinen Antikörpern. Weiterhin Aufnahme von Lipid A, eine Komponente der Bakterienzellwand, dient als ein potentes Adjuvans 9. Multilamellaren Liposomen wurden durch Zugabe von Puffer zu einem getrockneten Lipidmischung in Glasröhrchen und resuspendiert in Puffer hergestellt. Extrusion der Liposomen durch 200 nm Porengröße Filter erzeugt monodisperse unilamellare liposomale Suspensionen. Die Liposome werden dann mit einem Detergens durch Zugabe von gereinigtem SERT in Detergens gefolgt gesättigt. Detergensmischung: Schließlich Waschmittel wird durch Zugabe von hydrophoben Absorptionsharzes zu dem Lipid entfernt. Zusätzliche Liganden sollte die rekonstituierte Probe hinzugefügt werden, um Antikörper zu selektieren, die das Antidepressivum gebundenen Konformation erkennen. Die Anwesenheit von SERT in den Proteo sollte bestätigt werdenSolubilisieren einer kleinen Probe mit SDS-PAGE - Beladungsfarbstoff oder C12M und läuft auf SDS-PAGE und FSEC (3C, D).
Hybridomzelllinien SERT Antikörper exprimieren, können für hochaffine Bindemittel abgeschirmt werden, die 3D-Epitope erkennen. Diese Eigenschaften sind entscheidend für den späteren Erfolg der Kristallisation, wie der Antikörper muss fest mit einem strukturierten Bereich gebunden bleiben Kristallpackung von homogenen, gut geordneten Domänen zu fördern. Im ersten Schritt, Antikörper, die unstrukturierte Bereiche erkennen, werden identifiziert. SERT denaturiert aufgetrennt und auf eine Nitrocellulosemembran; Antikörper, die denaturierte SERT binden Western-positiv sein und wahrscheinlich lineare Epitope erkennen. In 4A zeigen wir zwei Beispiele von Antikörpern , die Western-positiv sind und nützlich wahrscheinlich nicht Kristallogenese zu fördern. In 4B werden die verbleibenden western negativen Antikörper werden mit 100 nM SERT-GFP inkubiert und getrennt durchFSEC. Antikörper, die SERT binden die GFP-positiven Spitze zu einer früheren Position verschieben. Die SERT-Antikörper-Komplexe können weiter in Detergens verdünnt werden, um zu bestimmen, ob sie mit nanomolarer Affinität gefolgt von Analyse durch FSEC binden kann. Zugabe von Serotonin führt zu Konformationsänderungen in dem Transporter und somit können die Antikörper gescreent werden, um zu bestimmen, ob sie spezifisch die SSRI-gebundene Konformation erkennen kann. In 4C werden die Antikörper gezeigt SERT in Gegenwart von Serotonin zu binden, was zeigt , dass das Epitop (e) nicht von der SSRI ändern gebundenen Zustand auf das Substrat. Schließlich sind in Figur 4D Kombinationen von Antikörpern auf ihre Fähigkeit getestet verschiedene Epitope zu binden, in einer weiteren Linksverschiebung führt. Hier ist der 15B8 8A11 oder Antikörper erkennen ein Epitop, das von 8B6 unterscheidet.
Die 8B6-Antikörper wurde auf Basis vorläufiger Kristall-Screening mit Papain trea für weitere Strukturanalyse ausgewähltted Fab. Die Gene der 8B6 Fab wurden in einen Insektenzellen-Expressionsvektor kloniert. Fab kann von Sf9-Zellen exprimiert und sezerniert werden, wachsen in Suspension. Die 8B6 Fab kann durch His-Tag - Affinität (5A, B) und Kationenaustausch - Chromatographie (5C, D) , die sich in Protein , das aus Sf9 - Zellüberstand gereinigt werden , die auf SDS-PAGE - Gelen frei von Verunreinigungen erscheint. In 5E wird das rekombinante 8B6 Fab gezeigt SERT zu binden und wird in anschließenden biochemischen und biophysikalischen Experimenten verwendet.
Die affinitätsgereinigten SERT CC ist mit Thrombin und EndoH und mit 8B6 Fab verdaut , wobei ein Komplex in Gegenwart von S -Citalopram zu bilden. Der Transporter-Antikörper - Komplex wird dann durch SEC in C8M (6A) getrennt und die Peakfraktionen sowohl SERT und Fab enthalten , wie durch SDS-PAGE (Figur 6B) gezeigt. Die Verwendung von C8M ist von entscheidender Bedeutung für die Kristallbildung wahrscheinlich, weildie kurzkettigen Waschmittel ermöglicht zwischen den Molekülen in dem Kristallgitter bessere Verpackung. FSEC eingesetzt wird , die Fraktionen zu bestimmen , sollte zur Kristallisation (6C) vereinigt werden; Fraktionen, die kombiniert werden sollten nicht monodisperse und / oder enthalten große Mengen an freien SERT oder Fab nicht.
Prismenförmigen SERT-Antikörper - Kristalle können durch hängenden Tropfen Dampfdiffusion (7A) in Gegenwart von S -Citalopram Verwendung dieses Protokoll gezüchtet werden. Die resultierenden Kristalle beugen Röntgenstrahlen bis zu einer Auflösung von 3,15 Å 10 (7B).
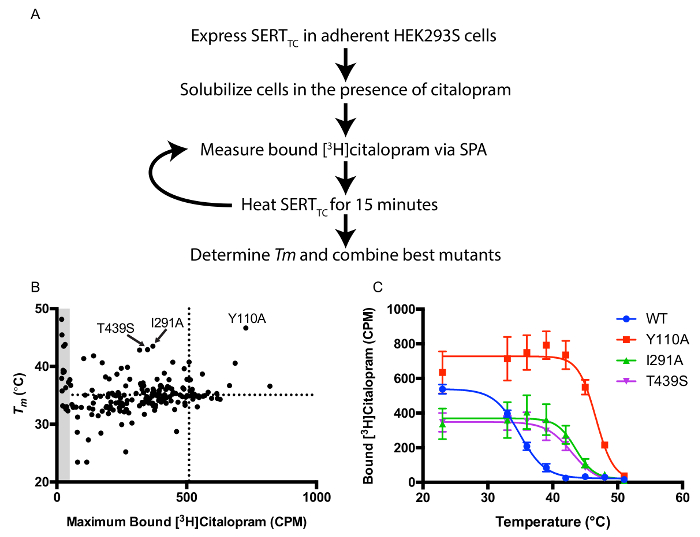
Abbildung 1: Scintillation Proximity-basierten Thermostabilität Assay A.. Überblick über Protokoll zum Screenen Thermostabilität in Gegenwart von [3 H] Citalopram. B. Maximale gebunden [3 H] Citalopram gegen die scheinbare Schmelztemperatur (Tm). Die gepunkteten Linien stellen Werte dar, für den WT-Transporter. Die drei am meisten thermo Mutanten sind markiert. Grauzone darstellt Mutanten, die weniger als 10% von [3 H] Citalopram an WT und damit ungenau Tm - Werte aufgrund eines niedrigen Signal-zu-Rauschen. C Bindung relativ. Thermische Stabilität Kurven für WT SERT TC und den Top - 3 - Mutanten. Fehlerbalken stellen die Standardabweichung (SD). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
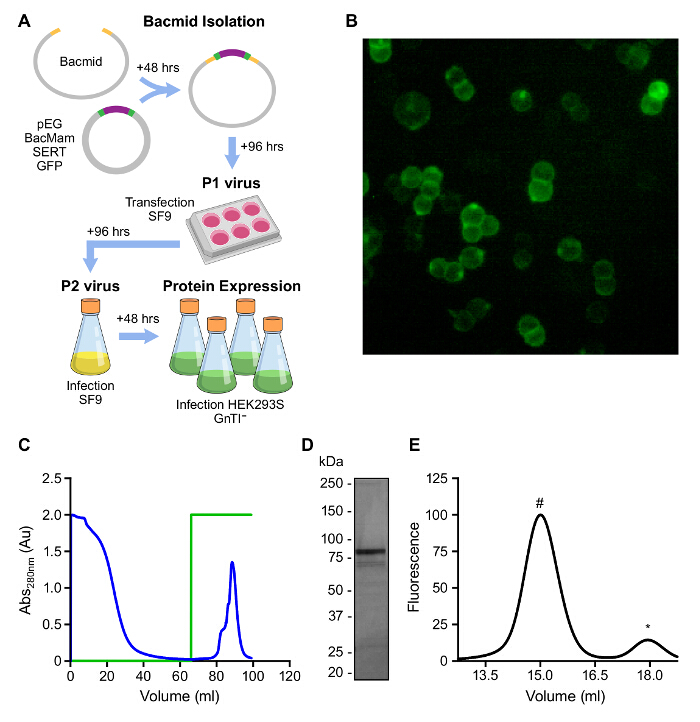
Abbildung 2: Übersicht der Mammalian Heterologe Proteinexpression A.. Schematisierte Übersicht über BacMam Virus Generation und die Expression von SERT in HEK293s GnTI- -. Zellen B. ERK293S GnTI- - Zellen, die SERT CC (GFP - Fluoreszenz) C.. Elutionsprofil von SERT CC auf Strep Affinitätsharz. Grüne Spur stellt die Konzentration von Desthiobiotin, 0 - 100% (0 - 5 aus mM) D.. Analyse der affinitätsgereinigten SERT CC auf einem 4-15% SDS-PAGE Gel - E.. FSEC der Affinität CC gereinigte SERT durch GFP - Fluoreszenz detektiert (Anregung: 480 nm; Emission: 510 nm). Der Peak bei 15 ml eluierenden ist SERT (#) und 18 ml ist frei GFP (*). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
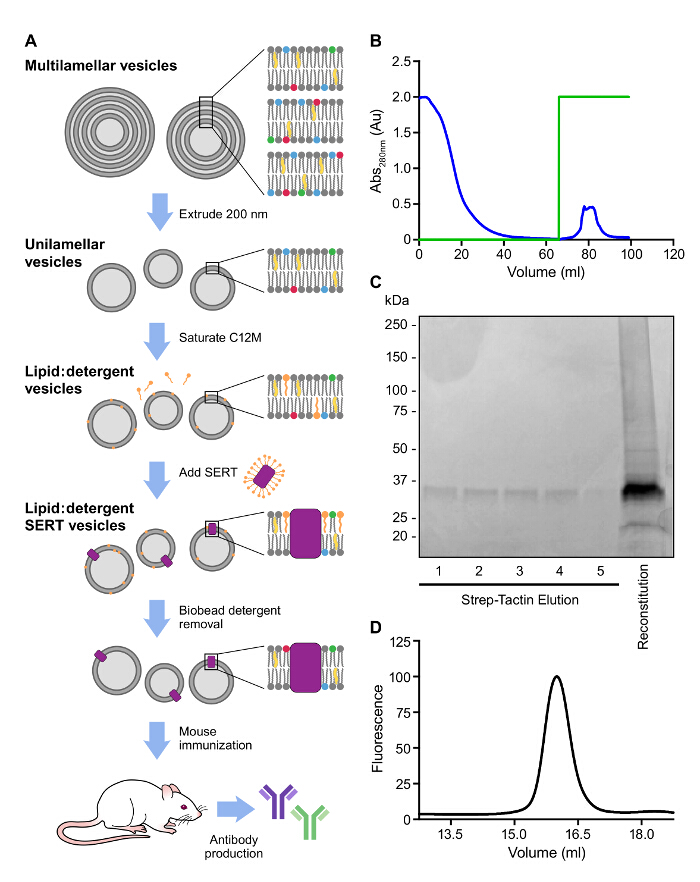
Abbildung 3: Repräsentative Affinitätsreinigung und Rekonstitution des SERT IC A.. Schematische Darstellung der Antikörper-Generierung. B. Elutionsprofil bei 280 nm der Affinitätsreinigung von Strep SERT IC auf Affinitätsharz beobachtet. Grüne Spur stellt die Konzentration von Desthiobiotin, 0 - 100%. (0 - 5 aus mM) C. Analyse der affinitätsgereinigten und rekonstituiert SERT auf einem 4-15% SDS-PAGE Gel - D.. FSEC von gelöstem SERT nach der Rekonstitution. Die Fluoreszenz von Tryptophanresten verwendet wurde SERT zu erkennen (Anregung: 280 nm; Emission: 335 nm). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 4:. Die Analyse von repräsentativen SERT Antikörper A. Screening von Antikörpern durch Western-Blot. Ungefähr 1 ug SERT CC mit oder ohne GFP wurde aufgebracht auf einen 4-15% SDS-PAGE-Gel und auf eine Nitrocellulosemembran geblottet. Die Bindung wurde unter Verwendung eines Ziege-Antikörper Anti-Maus, konjugiert an IR-Farbstoff. 2G4 und 10F2 sind westliche positiv. B. Bindung von Antikörpern an 100 nM GFP-markiertes SERT und Detektion von FSEC detektiert GFP - Fluoreszenz verwendet wird . C. Bindung von ausgewählten Fabs zu 100 nM GFP-markiertes SERT in Gegenwart von 1 mM Serotonin. D. Die Bindung von 8A11 oder 15B8 Fabs zu SERT-8B6 Fab. Kleinere Peaks bei 18 ml eluierenden sind frei GFP. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 5: Repräsentative Reinigung des 8B6 - Fab aus Sf9 Zellen A.. Elutionsprofil bei 280 nm von der Reinigung des 8B6-Fab von His-Tag Affinität chromatograp beobachtet hy. Grüne Spur stellt die Konzentration von Imidazol, 0 - 50% (0-250 mM) B.. Nicht-reduzierenden und SDS-PAGE-Gel nach His-Tag-Affinitätsreinigung reduziert wird. Protein , das in der Nähe von 50 kDa läuft , ist nicht reduzierten Fab (#) und kleinere Spezies bei 25 kDa reduziert wird Fab (*). C. Elutionsprofil bei 280 nm von der Reinigung der 8B6 Fab durch Kationenaustausch beobachtet einen einzigen symmetrischen Peak anzeigt, die unter einem linearen Natriumchlorid-Gradienten eluiert. Grüne Spur stellt die Konzentration von NaCl, 0 - 100%. (0 - 500 mM) D. Analyse der 8B6 Fab auf einem 12,5% SDS-PAGE - Gel nach der Reinigung durch Kationenaustausch. E. Die Bindung des 8B6 Fab 10 nM GFP-markierten SERT, mittels Fluoreszenz von GFP nachgewiesen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
e 6 "src =" / files / ftp_upload / 54792 / 54792fig6.jpg "/>
Abbildung 6: Repräsentative Gelfiltrationschromatographie des SERT-8B6 - Komplex in Gegenwart von S -Citalopram A.. Gelfiltrationseluierungsmuster Profil von gereinigtem SERT-8B6-Komplex. Hauptpeak bei 11,5 ml eluierenden ist die SERT-8B6-Komplex. Peak bei 15 - 17 ml enthält GFP und Fab B.. Analyse des gereinigten SERT-8B6-Komplex auf einem 4-15% SDS-PAGE-Gel. Die Positionen von SERT und der schweren und leichten Ketten des Fab sind durch einen Bindestrich. C gezeigt. FSEC der Größe getrennten Fraktionen. SERT-8B6-Komplexe wurden unter Verwendung von Tryptophan-Fluoreszenz detektiert. Fraktion 17 enthält eine größere Menge an SERT die mit Fab nicht komplex war. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 7: Die Kristallisation des SERT-8B6 Komplex gebunden zu S -Citalopram A.. Lichtmikroskopie von quaderförmigen Kristalle des SERT-8B6-Komplex nach 2 Wochen Wachstum. Maßstabsbalken entspricht 200 um. B. SERT-8B6 Kristalle beugen Röntgenstrahlen bis 3,15 Å. Blauer Ring darstellt 3,15 Å. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Tabelle 1:. Ein Kristallisations Bildschirm für die SERT-8B6 Complex S -Citalopram Bound Bitte hier klicken , um diese Tabelle zu laden.
Diskussion
Bestimmung der Membranproteinstruktur durch biophysikalische Techniken wie vor eine schwierige Organismus für viele medizinisch signifikante Transporter, Rezeptoren und Kanälen 11. Hier haben wir detaillierte Know - how für die Strukturbestimmung des menschlichen Serotonintransporter zu S -Citalopram gebunden entwickelt teilen. Wir gehen davon aus, dass diese Methoden nützlich sein werden Strukturen von SERT in anderen Konformationen sowie Strukturen anderer schwer Membranproteine zu bestimmen. Darüber hinaus hier beschriebenen biochemischen Techniken können auch in Wasch- und einer nahezu nativen Lipidumgebung zu studieren Funktion von gereinigtem SERT verwendet werden.
SERT Kristallisation angelenkt auf der Entwicklung verschiedener Werkzeuge und Techniken. Erste Verbesserungen der Transporter thermische Stabilität erzeugt SERT - Varianten , die in verschiedenen Detergensmicellen nach der Extraktion des Transporters aus Membranen 6 gut erzogene wurden. Zweitens ist die Verwendungdes hochaffinen Liganden S -Citalopram gesamten Reinigung und Kristallisation weiter verbesserte Stabilität und verringerte Konformationsheterogenität. Drittens, die Entwicklung des BacMam Expressionssystem 7 für die Produktion von großen Mengen an SERT in einem kurzen Zeitraum von 2 Wochen erlaubt, sowohl die Immunisierung und die Kristallisation zu erleichtern. Schließlich wählen die Entwicklung von Strategien für die hochaffine Antikörper, die für die Entdeckung des 8B6-Antikörpers erlaubt 3D-Epitope erkennen, die gut geordnete Packung von SERT-Antikörper-Komplexe in Kristalle fördert.
Es gibt eine Reihe von kritischen Schritte und Reagenzien sowie gemeinsame Probleme, die häufig während des gesamten Protokolls auftreten. Erstens kann die Erzeugung hoher Titer SERT P2 Virus problematisch sein. Zugabe von niedrigen Konzentrationen von P1 P2 Virus Virus zu erzeugen, wie in diesem Protokoll beschrieben mildert dieses Problem normalerweise, und in Fällen, in denen der P2 Virustiter niedrig ist, kann P3 Virus usin gemacht werdeng-Virus bei einer MOI von 0,0001. Viren mit einem Titer von weniger als 1 x 10 8 Viruspartikel / ml verwendet werden soll und in geringen Proteinausbeuten fast immer führen wird. Für die Expression HEK293s GnTI- - wurden die Zellen , da sie N -Acetylglucosaminyltransferaseaktivität I - Aktivität fehlt gewählt und somit nicht komplexe N - Glycane synthetisieren kann, statt nur eine hohe Mannose N - Glycane produzieren. EndoH spaltet N -verknüpftem Glykosylierung von hoher Mannose Glykane an zwei Standorten in extrazellulären Schleife 2 (EL2), ein N Acetylglucosamin an Asparagin gebunden zu verlassen. Die Verdauung von N -verknüpftem Zucker Oberfläche Entropie von EL2 reduziert , die für die Kristallisation wahrscheinlich wichtig ist. Für die Erzeugung von Antikörpern sollte die SERT IC für die Immunisierung verwendet werden. GFP ist in hohem Maße immunogen 12 und sollte nicht als Fusions - Tag verwendet werden , um Antikörper zu erzeugen , da es schwierig ist, vollständig durch SEC entfernen. Die flexible N- und C-Terminus von SERT waren auch nichtin dem Konstrukt enthalten, um Antikörper gegen diese Regionen zu vermeiden. Mäuse mit 30 ug rekonstituierten Protein immunisiert werden; weiterhin Mäuse bis hohe Serumkonzentrationen von Antikörpern erkannt werden können und erzeugen Hybridomzellen , wie 13 immunisieren. Ein thermostabilized Konstrukt ist in der Regel die beste Wahl für die Immunisierung; wenn der Transport gut erzogene und behält die biologische Aktivität nach der Reinigung, das ist oft ausreichend, um Antikörper zu erzeugen. Die 8B6-Antikörper wurde gegen WT SERT erhöht. Zur Kristallisation monodisperse Komplex nur die Spitzenfraktionen von SEC enthält, wie durch FSEC beurteilt sollte vereinigt und eingeengt werden. SERT-8B6 Kristalle wachsen in einem engen Bereich von Bedingungen und es gibt eine Reihe von Schritten, die ergriffen werden sollten, Probleme speziell auf SERT Kristallwachstum im Zusammenhang zu beheben. Tris-Base mit HCl eingestellt, sollte nicht in der Reservoirlösung verwendet werden, da dieser Puffer nicht das Kristallwachstum nicht unterstützt; es ist somit critischen anstelle Tris mit NaOH verwenden. SERT Kristalle wachsen in einem engen Konzentrationsbereich von PEG 400, so dass, wenn Kristalle wachsen nicht, oder wenn viele kleine Kristalle beobachtet werden, sogar eine kleine Zunahme oder Abnahme in der PEG 400-Konzentration würde beraten. Weiterhin wurde die additive 6-Aminohexansäure auch im optimierten Bildschirm verwendet Nukleation zu verbessern. Die Drop-Verhältnis von Protein: gut Lösung ist auch ein wichtiger Faktor für das Kristallwachstum zu bestimmen. Drop-Verhältnisse von 1,5 bis 2: 1 empfohlen, mit Drop-Verhältnisse näher an 2: 1 normalerweise das Wachstum größerer 3-dimensional Kristalle unterstützen. Schließlich ist die Verwendung von Low-Profile-24-Well-Platten auch entscheidend zu Kristallwachstum, was vermutlich auf Modifizierung der Rate der Dampfdiffusion.
Ein alternativer Ansatz für die SPA - Verfahren wurde für Mutanten Bildschirm entwickelt , die die Ratten - Serotonin - Transporter in einer Kokain-gebundene Konformation unter Verwendung eines Filterbindungstest 5 stabilisieren. Dagegen sind die SPA baSed Assay ermöglicht sequenziellen Schritte Erhitzen durch Bestimmung des Anteils an SERT folgenden die an Liganden gebunden bleibt. Somit ermöglicht dies für die schnelle Bestimmung der Schmelztemperatur von einer kleinen Anzahl von Proben. Das SPA-Verfahren beruht auf der Verfügbarkeit eines radioaktiv markierten hochaffinen Liganden und wenn keine Liganden bekannt sind, die mit submikromolare Affinität binden dann ein alternativer Ansatz notwendig sein wird. Viele andere Methoden werden häufig zur Messung der Proteinstabilität wie Bindung von Fluoreszenzfarbstoffen und Kalorimetrie 14 , sondern sind mit niedrigem Durchsatz und sind entweder nicht in der Lage, direkt zu messen Funktion oder benötigen große Mengen an Protein eingesetzt. Wenn der SPA - Verfahren nicht verwendet werden kann, eine alternative Hochdurchsatz - Ansatz ist ein FSEC basierte Thermostabilität Assay 15 (FSEC-TS), wobei die Probe durch Abtrennen der Fraktion , gefolgt erhitzt wird transporter verbleibt. FSEC-TS ist ein nützlicher Ansatz für den Zugriff auf chromatographische Verhalten und oligomere Zustand und ist apowerful ergänzendes Instrument, das neben dem SPA-Verfahren verwendet werden können.
Ein Vergleich der verschiedenen gemeinsamen Proteinexpressionssysteme wurde auch begünstigt die Verwendung von Säugetierzellen für SERT Ausdruck 16 und wenig überraschend ist dies wahrscheinlich der Fall für viele Proteine von Säugetieren gefunden. Die Methoden, die wir für die Expression verwendet wurden, für SERT zugeschnitten sind aber wahrscheinlich leicht anpassbar. Bedingungen, die hohe Expressionsniveaus begünstigen sollte sorgfältig durch Variieren der Zeit des Ausdrucks, der Temperatur, Viruskonzentration und das Vorhandensein von Histon-Deacetylase-Inhibitoren wie Natriumbutyrat identifiziert werden.
Wir bevorzugen im Allgemeinen Affinitätsreinigung in einer milden Reinigungs langkettigen wie C12M zusammen mit CHS vor der Zubereitung Bindung hochaffinen Liganden zu binden. Die Rekonstitution hydrophobe Absorption unter Verwendung ist eine milde Technik, die wir gefunden haben, wirksam für mehrere andere Transporter und Rezeptoren zu sein. Ob dasnicht erfolgreich ist, kann die Entfernung von Detergenzien mit einer hohen kritischen Micellbildungskonzentrationen durch Dialyse, Verdünnung, oder SEC 17 das Antigen in solchen Waschmitteln eingesetzt ausreichend stabil bereitgestellt werden soll. In den Fällen, in denen keine geeigneten Antikörper gefunden werden, finden wir fast immer die Frage zu einem Verlust der Funktion oder Denaturierung des Antigens ist und in solchen Fällen führten wir erfolgreich neue Immunisierungen mit besonderem Augenmerk auf die Proteinbiochemie. Schließlich Liganden und Antikörper, die mit hoher Affinität binden sollte für eine rational geplante Kristallisationsexperiment bilden die Basis und durch die Ausnutzung einer thermostabilen Variante nehmen, kann man ein breiteres Spektrum von Bedingungen Bildschirm durch die Eigenschaften der verschiedenen Reinigungsmittel variiert. Weiterhin Kristallisation in einem lipiden Mesophasen 18 oder Verwendung Bicellen 19 sollte stets als Alternative zur Kristallisation in Mizellen betrachtet werden.
Diese Prinzipien und Methoden können mit einigen modifi verwendet werdenKation für viele andere Transmembranproteine, die nur schwer von anderen Ausdruck Wirten zu exprimieren und zu reinigen, und besonders nützlich für die Strukturbestimmung von Zielen von hochaffinen Drogen sein.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank D. Cawley for generating monoclonal antibodies. We thank A. Penmatsa and K. Wang for sharing ideas and expertise developed from the dopamine transporter. L. Vaskalis for assistance with figures, H. Owen for help with manuscript preparation and other Gouaux laboratory members for helpful discussions. J.A.C. has support from a Banting postdoctoral fellowship from the Canadian Institutes of Health Research. E.M.G. is supported by the National Science Foundation Graduate Research Fellowship. We are particularly grateful to Bernie and Jennifer LaCroute for their generous support, as well as for funding from the NIH (5R37MH070039). E.G. is an investigator of the Howard Hughes Medical Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| DH10Bac | Invitrogen | 10361-012 | |
| Kanamycin | Fisher | BP906-5 | |
| Gentamicin | Fisher | BP918-1 | |
| Tetracycline | Sigma | T-7660 | |
| Bluo-gal | Invitrogen | 15519-028 | 5-Bromo-3-indolyl β-D-galactopyranoside |
| Isopropyl beta-D-1-thiogalactopyranoside | Anatrace | I1003 | IPTG |
| Miniprep kit | Qiagen | 27106 | |
| Cellfectin II | Invitrogen | 10362-100 | Sf9 transfection reagent |
| Sf9 | ATCC | CRL-1711 | |
| Sf-900 III SFM media | Life Technologies | 12658-027 | |
| HEK-293S GnTI- | ATCC | CRL-3022 | |
| Freestyle 293 media | Life Technologies | 12338-018 | 293 expression media |
| Fetal Bovine Serum (FBS) | Life Technologies | 0984018DJ | |
| Sodium butyrate | Sigma | 303410 | |
| S-citalopram | Sigma | E4786 | Anagrade |
| n-Dodecyl-beta-D-Maltopyranoside | Anatrace | D310 | |
| Cholesteryl hemmisuccinate | Sigma | C6013 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850457P | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar Lipids | 850757P | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoglycerol | Avanti Polar Lipids | 840457P | |
| Leupeptin | Sigma | L2884 | |
| Pepstatin A | Sigma | P5318 | |
| Aprotinin | Sigma | A1153 | |
| PMSF | Sigma | P7626 | |
| Desthiobiotin | Iba Life Sciences | 2-1000-05 | |
| Asolectin | Sigma | 11145 | |
| Cholesterol | Sigma | C-8667 | |
| Lipid A | Sigma | L5399 | |
| Brain polar lipid | Avanti Polar Lipids | 141101C | |
| Biobeads | Biorad | 152-3920 | Hydrophobic absorption resin |
| Goat anti-mouse IRDye 680RD | Odyssey | 926-68070 | Used as secondary antibody for western blotting |
| Lauryl maltose neopentyl glycol | Anatrace | NG310 | Anagrade |
| Serotonin | Sigma | H9523 | |
| pFastBac 8B6 | Available from authors | ||
| pEG Bacmam SERT Strep II | SERTIC, Available from authors | ||
| pEG Bacmam SERT GFP twin Strep His | SERTTC, Available from authors | ||
| pEG Bacmam SERT ts3 GFP twin Strep His | SERTCC, Available from authors | ||
| Imidazole | Sigma | 56749 | |
| n-Octyl β-D-maltoside | Anatrace | O310 | Anagrade |
| Thrombin | Haematologic Technologies | HCT-0020 | |
| EndoH | New England Biolabs | P0702 | |
| Trizma-HCl | Sigma | T5941 | Tris is used for preparation of crystallization reservoirs |
| PEG 400 | Sigma | 91893 | |
| 6-aminohexanoic acid | Sigma | 7260 | |
| Trypsin-EDTA | Fisher | MT25052CV | |
| Isoplate-96 TC | PerkinElmer | 6005070 | |
| PolyJet | SignaGen | SL100688 | Polymer transfection reagent for mamalian cells |
| Copper HIS-Tag YSI SPA Beads | PerkinElmer | RPNQ0096 | His-tag affinity SPA beads |
| Citalopram, [N-Methyl-3H] | PerkinElmer | NET1039250UC | |
| ThermoMixer C | Eppendorf | 5382000023 | heating block for thermostability assay |
| ThermoTop | Eppendorf | 5308000003 | |
| SmartBlock PCR 96, thermoblock for PCR plates | Eppendorf | 5306000006 | |
| 0.2 µm syringe filter | Olympus Plastics | 25-243 | |
| 1 L filter system | Corning | 430517 | |
| 2 L flat bottom tissue culture flask | Genemate | F-5909-2000 | |
| 2 L baffled tissue culture flask | Genemate | F-5909-2000B | |
| CO2 incubator | Thermo Scientific | 3950 | |
| Forma Orbital Shaker | Thermo Scientific | 416 | |
| Strep-Tactin resin | Iba Life Sciences | 2-1208-025 | Strep affinity resin |
| Extruder | Northern Lipids | ||
| Li-Cor imaging system | Odyssey | western blot imaging system | |
| XK16 column | GE Healthcare | 28-9889-37 | column used for Strep-Tactin and Talon purificaiton |
| 100 kDa MWCO protein concentrator | Millipore | UFC910096 | |
| 30 kDa MWCO protein concentrator | Millipore | UFC903024 | |
| Äkta FPLC | GE Healthcare | UPC-900 | |
| HPLC | Shimadzu | 51476 | |
| Superose 6 (10/300) column | GE Healthcare | 17-5172-01 | Used for FSEC |
| Tangential flow apparatus | Pall Filtron | ||
| 0.2 µm filter tangential flow cell | Pall Filtron | PSM20C11 | |
| 30 kDa MWCO tangential flow concentrator | Pall Filtron | OS030T12 | |
| Talon resin | Clonetech | 635504 | His-tag affinity resin used for Fab purification |
| 1 mL HiTrap SP column | GE Healthcare | 17115101 | Cation exchanger used for Fab purification |
| Superdex 200 10/300 GL column | GE Healthcare | 17-5175-01 | Used for SEC separation of SERT-8B6 |
| 24-well VDXm plate | Hampton Research | HR3-306 | |
| 18 mm coverslips | Hampton Research | HR3-239 | |
| Virocyt virus counter | Virocyt | 2100 | |
| MicroBeta Trilux | PerkinElmer | 1450 | 96-well scintillation counter |
| HiTrap SP column | GE Healthcare | 17115101 | |
| Sertraline | Sigma | S6319 |
Referenzen
- Kristensen, A. S., et al. SLC6 neurotransmitter transporters: structure, function, and regulation. Pharmacol Rev. 63 (3), 585-640 (2011).
- Broer, S., Gether, U. The solute carrier 6 family of transporters. Br J Pharmacol. 167 (2), 256-278 (2012).
- Andersen, J., Kristensen, A. S., Bang-Andersen, B., Stromgaard, K. Recent advances in the understanding of the interaction of antidepressant drugs with serotonin and norepinephrine transporters. Chem Commun (Camb). 25 (25), 3677-3692 (2009).
- Hahn, M. K., Blakely, R. D. The functional impact of SLC6 transporter genetic variation. Annu Rev Pharmacol Toxicol. 47, 401-441 (2007).
- Abdul-Hussein, S., Andrell, J., Tate, C. G. Thermostabilisation of the serotonin transporter in a cocaine-bound conformation. J Mol Biol. 425 (12), 2198-2207 (2013).
- Green, E. M., Coleman, J. A., Gouaux, E. Thermostabilization of the human serotonin transporter in an antidepressant-Bound Conformation. Plos One. 10 (12), e0145688 (2015).
- Goehring, A., et al. Screening and large-scale expression of membrane proteins in mammalian cells for structural studies. Nat Protoc. 9 (11), 2574-2585 (2014).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- De Becker, G., et al. The adjuvant monophosphoryl lipid A increases the function of antigen-presenting cells. Int Immunol. 12 (6), 807-815 (2000).
- Coleman, J. A., Green, E. M., Gouaux, E. X-ray structures and mechanism of the human serotonin transporter. Nature. , (2016).
- White, S. H. The progress of membrane protein structure determination. Protein Sci. 13 (7), 1948-1949 (2004).
- Gambotto, A., et al. Immunogenicity of enhanced green fluorescent protein (EGFP) in BALB/c mice: identification of an H2-Kd-restricted CTL epitope. Gene Ther. 7 (23), 2036-2040 (2000).
- Galfre, G., Howe, S. C., Milstein, C., Butcher, G. W., Howard, J. C. Antibodies to major histocompatibility antigens produced by hybrid cell lines. Nature. 266 (5602), 550-552 (1977).
- Deller, M. C., Kong, L., Rupp, B. Protein stability: a crystallographer's perspective. Acta Crystallogr F Struct Biol Commun. 72, 72-95 (2016).
- Hattori, M., Hibbs, R. E., Gouaux, E. A fluorescence-detection size-exclusion chromatography-based thermostability assay for membrane protein precrystallization screening. Structure. 20 (8), 1293-1299 (2012).
- Tate, C. G., et al. Comparison of seven different heterologous protein expression systems for the production of the serotonin transporter. Biochim Biophys Acta. 1610 (1), 141-153 (2003).
- Rigaud, J. L., Levy, D. Reconstitution of membrane proteins into liposomes. Methods Enzymol. 372, 65-86 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat Protoc. 4 (5), 706-731 (2009).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J Mol Biol. 316 (1), 1-6 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten