Method Article
Definido y escalable Generación de células hepatocitos como las de las células madre pluripotentes
En este artículo
Resumen
El método presentado aquí describe un sistema de diferenciación -ready prácticas de fabricación escalable y bueno (GMP) para generar células hepatocitos como las humanas a partir de células madre pluripotentes. Sirve como un sistema rentable y estandarizado para generar células hepatocitos humanos para la investigación, como el hígado humano básico y aplicado.
Resumen
Las células madre pluripotentes humanas (hPSCs) poseen un gran valor para la investigación biomédica. hPSCs se pueden escalar y diferenciada a todos los tipos de células encontradas en el cuerpo humano. La diferenciación de las células humanas hPSCs a hepatocitos como las (HLC) ha sido ampliamente estudiada, y se han establecido protocolos de diferenciación eficientes. La combinación de la matriz extracelular y los estímulos biológicos, incluyendo factores de crecimiento, citoquinas y moléculas pequeñas, han hecho posible la generación de HLC que se asemejan a hepatocitos humanos primarios. Sin embargo, la mayoría de los procedimientos todavía emplean componentes no definidos, dando lugar a la variación de lote a lote. Esto sirve como una barrera importante para la aplicación de la tecnología. Para abordar esta cuestión, hemos desarrollado un sistema definido para la diferenciación de hepatocitos humanos recombinantes utilizando laminina como matrices extracelulares en combinación con un proceso de diferenciación exento de suero. Fácilmente se logró la especificación de hepatocitos eficiente, con Demonstrated mejoras tanto en la función HLC y el fenotipo. Es importante destacar que este sistema es fácil de ampliar el uso de investigación y GMP-grado líneas HPSC avances prometedores en el modelado y terapias basadas en células.
Introducción
tejidos humanos primarios y los tipos de células derivados se utilizan regularmente, tanto para el cribado basado en células y en la clínica. Sin embargo, el acceso a estas células es muy limitada debido a la insuficiencia de la donación de órganos y la pérdida de fenotipos de células post-aislamiento 1. hPSCs representan una alternativa prometedora a los tejidos primarios y facilitar la generación de células somáticas humanas genéticamente definidos y renovables. células hepatocitos como las (HLC) derivados de hPSCs ya han demostrado ser prometedores en este campo. HLC asemejan a hepatocitos humanos primarios en diversos aspectos, incluyendo la morfología celular, la expresión génica de los hepatocitos, la función metabólica, y la sensibilidad a los medicamentos y virus 2, 3, 4, 5, 6, 7, 8. Además, la proliferación ilimitada ycapacidad de auto-renovación de las dos hPSCs investigadores y GMP-grado facilita su aplicación 9, 10.
Más de una década de investigación ha producido una serie de procedimientos de diferenciación de hepatocitos eficiente 2, 3, 5, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20. Sin embargo, la mayoría de estos sistemas utilizan componentes no definidos y / o transducción viral para conducir especificación hepatocelular. Para mejorar la fiabilidad de la tecnología a escala, es importante desarrollar una sólida diferenciación de hepatocitossistema que está realmente definido, libre de xeno, y compatible con GMP.
Lamininas (LNS) son importantes proteínas de matriz extracelular que pueden influir en la adhesión celular, la proliferación, migración y diferenciación. Lamininas son glicoproteínas heterotriméricas compuestas de una α, β uno, y una cadena γ. Recientemente, lamininas humanos recombinantes se han producido y utilizado en la biología celular. LN-511 se ha demostrado para apoyar el mantenimiento de hPSCs 21, mientras que una mezcla de LN-521 y E-cadherina permite derivación clonal y la expansión de células madre embrionarias humanas 22. LN-111, por otra parte, con el mantenimiento de las células hepatoblastos-como derivados de hPSCs 23. Sin embargo, antes de que nuestro informe, laminina 521 y 111 no se habían utilizado para generar HLC con características maduras a partir de 10 hPSCs.
En este sentido, detallan los procedimientos para el cultivo de hPSCs en LN-521y diferenciarlas en cualquiera de LN-521 o una mezcla de LN-521 y LN-111 (LN-521 / LN-111). Hemos optimizado el protocolo de diferenciación mediante la siembra de una sola célula para generar una monocapa altamente reproducible y homogénea de HLC en muchos formatos 14. Creemos que nuestro sistema de diferenciación definido representa un método sencillo y rentable para la fabricación de HLC activos para su aplicación, lo que representa un importante paso adelante en el campo.
Protocolo
NOTA: La información del proveedor para todos los reactivos utilizados en este protocolo ha sido incluido en la Tabla 1. Todos los medios de comunicación / placas deben ser estériles y por lo menos a temperatura ambiente cuando las células han de tener contacto directo con ellos.
1. pases pluripotentes células madre (hPSCs) sobre laminina 521
NOTA: El procedimiento de pases de células se describe a continuación se basa en las células individuales y es ideal para la derivación de una población homogénea de células hepatocitos como las de hPSCs. Chapado Colonia también es aplicable y se ha descrito previamente 24.
- Preparar placas recubiertas con laminina, según sea necesario.
- Descongelar los 100 mg / ml de solución madre de laminina 521 recombinante (LN-521) a 4 ° C.
- Se diluye la descongelado LN-521 en helado de 1x DPBS (con Ca2 + / Mg2 +) para hacer una solución de 5 mg / ml.
- Añadir 1 ml de 5 mg / ml LN-521 solución para recubrir un pocillo de una placa de 6 pocillosy la roca para distribuirla uniformemente en el pozo.
- Incubar las placas en un 37 ° C / 5% de CO 2 incubadora de cultivo celular durante 2 - 4 h para uso de urgencia o en un 4 ° C refrigerador durante la noche.
- Almacenar las placas recubiertas con laminina en un refrigerador 4 ° C según sea necesario. Mantener las placas sobre una superficie plana y sellarlos para evitar la evaporación y la contaminación.
NOTA: Nunca deje que los pocillos recubiertos se secan; rematarlos con DPBS adicional 1x (con Ca2 + / Mg2 +) si es necesario. Utilice las placas dentro de 2 semanas.
- Deje que el número requerido de placas pre-recubierto alcance la temperatura ambiente antes de usar o incubar las placas a 37 ° C durante 0,5 - 1 h.
- aspirar cuidadosamente la solución de revestimiento LN-521 sin dañar la superficie recubierta. Nota: Es muy importante no dañar la superficie recubierta antes de la siembra de células sobre el mismo.
- Inmediatamente añadir 1 ml de pre-calentado mTeSR1-medio suplementado con Rho-quinasa asociada 10 mM (ROCK) Y2 inhibidor7632 a un pocillo de una placa de 6 pocillos. Deja la placa en la incubadora de cultivo celular para recibir células.
NOTA: No permita que los pocillos recubiertas con laminina se sequen. - Aspirar el medio de hPSCs bien mantenidos a alrededor de 75% a 85% de confluencia. Lavar las células de un pocillo de una placa de 6 pocillos una vez con 1 ml de 1x a temperatura ambiente DPBS (sin Ca 2 + / Mg2 +).
- Añadir 0,5 ml de 1x Accutase a las células y se incuba a 37 ° C durante 6-8 min para disociar las células.
NOTA: Para comprobar si la digestión es el tiempo suficiente o no, golpear suavemente la placa y comprobar si las células pueden desprenderse con facilidad. Si es así, entonces es el momento para detener la reacción enzimática; si no es así, extender la digestión de un extra de 1 - 2 min. - Terminar la disociación por la adición de 2 ml de medio fresco suplementado con mTeSR1 10 M Y27632 a las células. Pipeta hacia arriba y abajo con una punta de P1000 varias veces para hacer una suspensión de una sola célula.
- Contar las células viables utilizando un hemocitómetro.Utilizar azul de tripano a las manchas y excluir las células muertas 14
- Calcular el número total de células necesarias. Por rutina pases HPSC, semilla de 4 x 10 5 a 5 x 10 5 células por pocillo de una placa de 6 pocillos (es decir, 4,21 x 10 4-5,26 x 10 4 por cm 2). Para pases hPSCs para la diferenciación de los hepatocitos, la semilla de 6,5 x 10 5 a 7,5 x 10 5 (es decir, 6,84 x 10 4 a 7,89 x 10 4 por cm 2) células por pocillo de una placa de 6 pocillos.
NOTA: La densidad de siembra para cada línea celular podría necesitar optimización de menor importancia sobre la base de la densidad empírica dada aquí para la diferenciación hepática. - Transferir la suspensión celular necesaria en un 15 ml estéril o 50 ml tubo de centrífuga y se centrifuga a 115 xg durante 3 min a temperatura ambiente.
- Aspirar el sobrenadante lentamente y luego volver a suspender el sedimento celular en medio fresco, cálido mTeSR1 complementado con Rho-quinasa asociada 10 M inhibito (ROCK)r Y27632, utilizando un medio adecuado para hacer que la densidad celular deseada.
NOTA: El uso de un inhibidor de roca es muy recomendable con el fin de mejorar la fijación de las células y la tasa de supervivencia. - Sembrar las células a las placas preparadas y oscile hacia adelante y atrás y de lado a lado para distribuir uniformemente las células.
NOTA: Es fundamental para asegurar que las células se distribuyen de manera uniforme en los pozos de la placa si es para el cultivo celular de rutina o la experimentación diferenciación de hepatocitos. - Colocar las placas en el incubador de células y mantener las células a 37 ° C / 5% de CO2 durante 24 h para permitir que se adhieren y se recuperan.
- Se examinan las células al día siguiente y retirar inhibidor ROCA si se ha establecido contacto célula-célula. Mantener las células en medio de cultivo de rutina para mTeSR1 o cambiar a medio de diferenciación, según sea necesario.
NOTA: Si las células se sembraron con la densidad mencionado, la confluencia debe ser ideal para el mantenimiento rutinario o differentiatio hepatocitosnorte.
2. Diferenciación de células hPSCs hepatocitos como las recombinantes en lamininas
- Preparar medio de diferenciación.
- Hacer solución madre activina A humana: disolver la activina A humana en polvo para hacer un / ml solución madre de 100 mg de albúmina de suero bovino al 0,2% estéril (BSA) / DPBS. Hacer pequeñas alícuotas y almacenar a -20 ° C. Utilizar a escala 1: 1.000.
- Hacer ratón Wnt solución 3a existencia: disolver ratón Wnt en polvo 3a hacer un / ml solución madre de 10 mg en estéril de 0,2% de BSA / DPBS. Hacer pequeñas alícuotas y almacenar a -20 ° C. Use a 1: 200.
- Hacer el factor de crecimiento de hepatocitos humanos (HGF) solución madre: disolver en polvo HGF humano para hacer un / ml solución madre de 10 mg en estéril de 0,2% de BSA / DPBS. Hacer pequeñas alícuotas y almacenar a -20 ° C. Utilizar a escala 1: 1.000.
- Hacer oncostatina M (OSM) solución madre: disolver la oncostatina M (OSM) en polvo para hacer un / ml solución madre de 20 mg en estéril de 0,2% de BSA / DPBS. Hacer pequeñas alícuotas y slos rompió a -20 ° C. Utilizar a escala 1: 1.000.
- Hacer 500 ml de endodermo-cebado de la media: 2% de suplemento B27 (50x, menos vitamina A) y 1% de penicilina / estreptomicina (concentraciones finales en 100 IU / ml y 100 mg / ml, respectivamente); Completar hasta 500 ml utilizando Roswell Park Memorial Institute 1640 (RPMI 1640) medio basal. NOTA: Guarde el archivo a 4 ° C y utilizar dentro de dos semanas. Alícuota medio de la acción y añadir frescas (concentraciones finales en 100 ng / mL y 50 ng / ml, respectivamente) activina A y Wnt 3a en cada cambio de medio.
- Hacer 500 ml de medio / DMSO diferenciación KSR: 80% knockout DMEM (KO-DMEM), 20% de sustitución de suero knockout (KSR), 0,5% GlutaMAX, 1% de aminoácidos no esenciales (NEAA), 0,1 mM beta-mercaptoetanol, 1% de DMSO, y 1% de penicilina / estreptomicina (concentraciones finales en 100 IU / ml y 100 mg / ml, respectivamente). Filtrado al vacío. Almacenar a 4 ° C y utilizar dentro de dos semanas.
- Hacer 500 ml del medio de maduración HepatoZYME: 1% GlutaMAX, 10 mM de hidrocortisona sal 21-hemisuccinato de sodio (HCC), y 1% de penicilina / estreptomicina (concentraciones finales en 100 IU / ml y 100 mg / ml, respectivamente); Completar hasta 500 ml utilizando medio basal HepatoZYME. NOTA: Guarde el archivo a 4 ° C y utilizar dentro de dos semanas. Alícuota medio de la acción y añadir HGF fresco y OSM (concentraciones finales en 10 ng / ml y 20 ng / ml, respectivamente) para cada cambio de medio.
- hPSCs de semillas para la diferenciación de hepatocitos en LN-521, como se describe en la sección 1. Si LN-521 / LN-111 se va a usar como el sustrato, capa de las placas con LN-521 y LN-111 (relación 1: 3) en la concentración de laminina final de 5 mg / ml; el tratamiento resto debe ser el mismo que placas recubiertas con LN-521 puros.
NOTA: LN-521 / LN-111 no es ideal para el cultivo rutinario de hPSCs; sólo se utiliza para los experimentos de diferenciación. - Compruebe la confluencia celular 24 h después de la siembra. Iniciar la diferenciación celular una vez que la confluencia de células llega a alrededor de 40%. Rquítelo el medio mTeSR1 gastado y se añade medio de endodermo-cebado fresco suplementado con 100 ng / ml de activina A y 50 ng / mL Wnt 3a. Llame a esta diferenciación día 1.
NOTA: Se recomienda iniciar la diferenciación del día después de la siembra de las células. - Cambiar el medio endodermo-cebado cada 24 h durante 3 días para las células madre embrionarias humanas (hESCs). En cuanto a las células madre pluripotentes inducidas humanas (hiPSCs), extender esta etapa durante 2 días más para cebar las células a las células del endodermo como definitivos, pero utilizar el medio endodermo-cebado complementado solamente con 100 ng / ml activina A para estos dos días 12 .
NOTA: Para garantizar la especificación endodermo éxito, se puede examinar la expresión de marcadores del endodermo, tales como FOXA2 y SOX17. De acuerdo con la tinción de inmunofluorescencia, más del 80% de las células derivadas son positivos para ambos marcadores en nuestro laboratorio. - Cambiar a KSR / DMSO medio de diferenciación en el día 4 (por hESCs) / día 6 (para hiPSCs). Cambiar el medio dAily para los 3 primeros días y luego en el quinto día de esta etapa de diferenciación.
NOTA: No se necesita alimentación en el cuarto día de esta etapa de diferenciación. Usar sin suplementar KO-DMEM para lavar las células una vez antes de cambiar el medio si hay muchas células muertas. Para comprobar si la diferenciación para esta etapa es exitosa o no, se puede probar la expresión de marcadores de células progenitoras hepáticas, tales como AFP, CK19, y HNF4A. Casi el 90% de las células será positivo para estos marcadores basados en nuestra experiencia. - Después de 5 días de la etapa de diferenciación KSR / DMSO, cambiar a la etapa de maduración HepatoZYME. Se lavan las células una vez con medio basal normal HepatoZYME después de retirar el medio KSR / DMSO. Añadir HepatoZYME maduración medio suplementado con 10 ng / ml de HGF y 20 ng / ml de OSM.
- Cambiar el medio cada 48 h durante 7 - 10 días, momento en el que las células están listas para la caracterización estándar o uso adicional.
NOTA: hepatocitos exámenes de expresión de marcador, metabólicasLas pruebas de función (por ejemplo, la actividad del citocromo P450), urea y pruebas de secreción de albúmina, pruebas de almacenamiento de glucógeno, y las pruebas de captación de indocianina verde (ICG) son métodos típicos de caracterización.
NOTA: La línea de tiempo del protocolo de diferenciación se muestra en la Figura 5. En nuestro laboratorio, realizar la comprobación rutinaria específico de hepatocitos niveles HLCS los derivados », la expresión de marcadores de secreción de albúmina y del citocromo P450 3A (CYP) 1A2 y actividad.
Resultados
La diferenciación de hPSCs hepatocelular
Una de las líneas de células madre embrionarias humanas, H9, y una línea de células madre pluripotentes inducidas por el hombre, 33D6, se utilizaron para la diferenciación de hepatocitos. Los resultados en las figuras 1-3 son a partir de células H9, mientras que los de la figura 4 son de células 33D6. Las células individuales sembradas sobre laminina establecieron contacto célula-célula después de 24 h. Después de que las células alcanzaron alrededor de 40% de confluencia, el proceso de diferenciación se inició (Figura 1A y la Figura 4A). En lamininas (tanto LN-521 y LN-521 / LN-111), estas células fueron a través de cambios morfológicos secuenciales y dieron lugar a HLC polarizadas (Figura 1 y Figura 4A).
Caracterización de la célula hepatocitos como las
day 18 HLC fueron recogidos y evaluados para la expresión de marcadores de hepatocitos, representante HNF4A y ALB (Figura 2A). La inmunotinción del día 18 HLC mostró que casi el 90% de las células expresó HNF4α (Figura 2B). Estas células polarizadas en laminina y exhibieron una apariencia poligonal, como está marcado por E-cadherina y F-actina expresión (Figura 2B).
También se evaluó la actividad de P450 (CYP) citocromo. Los CYP450s llevan a cabo una importante función metabólica de los hepatocitos. Día 18 HLC derivados de una mezcla de proteína gelatinosa, como Matrigel, LN-521 o LN-521 / LN-111, se ensayaron para determinar la actividad de CYP3A. HLC demostró significativamente mayor actividad CYP3A en sustratos de laminina que en matrigel (Figura 3). Es importante destacar que, en comparación con hepatocitos humanos primarios comerciales (HU1339) re-chapada en estos sustratos, HLC tienen casi 10 veces más altos nivelesde la actividad de CYP3A 10.
La diferenciación de hiPSCs fue similar a la de hESCs. Las células mostraron cambios secuenciales en la apariencia (Figura 4A). HLC derivados expresan un factor de transcripción clave de hepatocitos, HNF4α (Figura 4B), y poseían la actividad de CYP3A y albúmina secretada (Figura 4 C y D). Notablemente, HLC derivados de 33D6 muestra reducida de CYP3A en comparación con células H9 derivadas HLC (Figura 3), pero todavía era comparable a los hepatocitos primarios humanos 10. Sin embargo, la secreción de albúmina de estos HLC era mucho menor que en hepatocitos primarios 10.
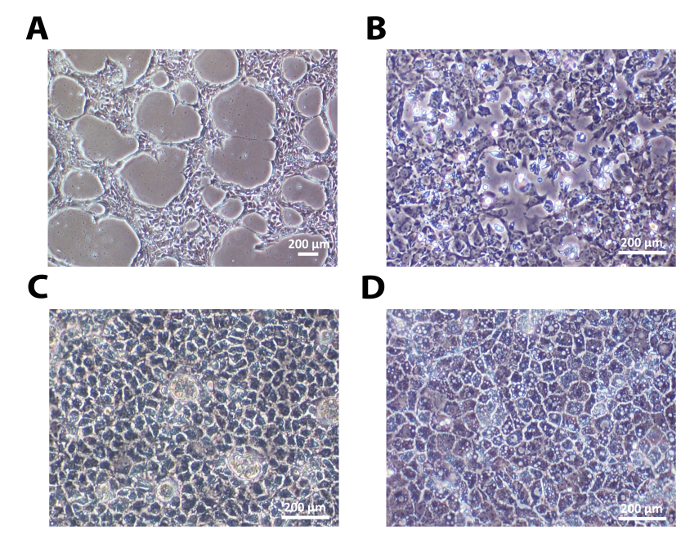
Figura 1: Los cambios morfológicos secuenciales durante la diferenciación hepática. </ strong> (A) hESCs indiferenciadas sembraron como células individuales alcanzaron alrededor del 40% de confluencia 24 h después de la siembra. (B) Después de cebar, las células mostraron la morfología típica endodérmico en el día 4. (C) Al llegar a la etapa hepatoblast similar, que mostraron una clara forma poligonal en el día 9. (D) Después de la etapa de maduración, HLC polarizadas estaban listos para caracterización adicional se muestra aquí en el día 18. La barra de escala = 200 micras. Haga clic aquí para ver una versión más grande de esta figura.
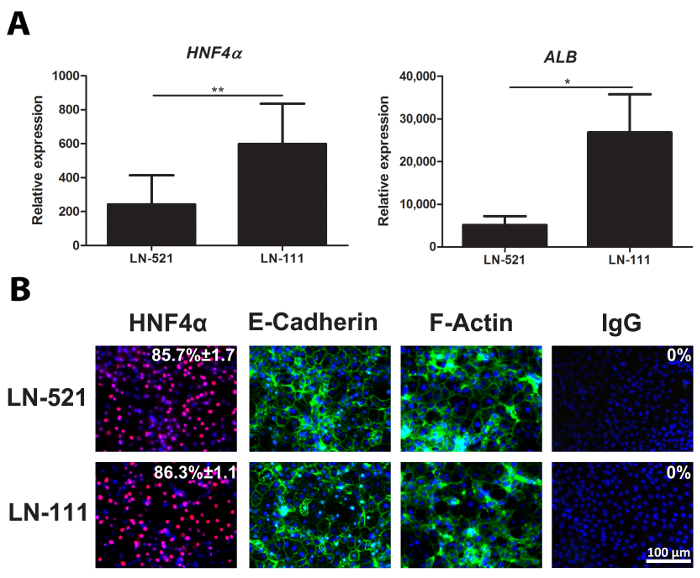
Figura 2: Caracterización de HLC. (A) La expresión de genes de marcadores específico de hepatocitos, HNF4A (izquierda) y ALB (derecha). El nivel de expresión se analizó utilizando el día 18 HLC derivadosde hESCs tanto en LN-521 y LN-521 / LN-111, y se normalizó a la limpieza gen GAPDH y se expresó en relación con hESCs. Los resultados representan tres réplicas biológicas, y las barras de error representan la desviación estándar (DE). * P <0,05, ** p <0,01; no apareado t-test. Expresión (B) de la proteína de un marcador clave hepática, HNF4α, y los marcadores de polarización, E-cadherina y F-actina. Día 18 HLC en LN-521 y LN-521 / LN-111 se tiñeron para los marcadores arriba y contrastados con Hoechst 33342. Un control negativo se realizó con la inmunoglobulina correspondiente G (IgG). Se muestra el porcentaje de células positivas HNF4α y el SD. Esto se calculó a partir de cuatro campos al azar de vista. Las imágenes fueron tomadas a 20 aumentos. Barra de escala = 100 micras. Haga clic aquí para ver una versión más grande de esta figura.
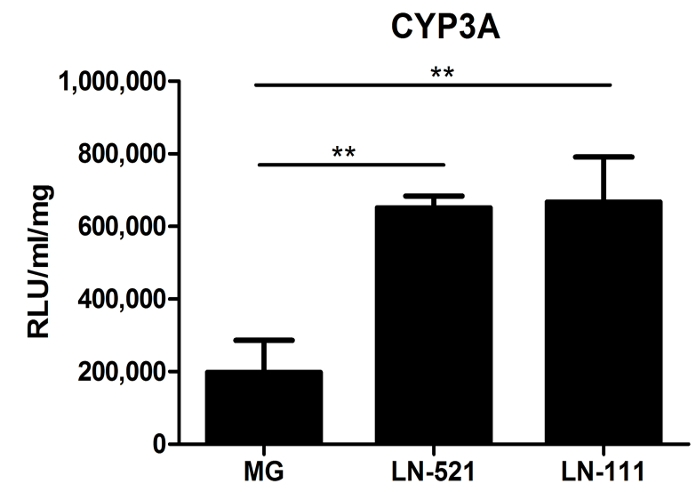
Figura 3: Función metabólica Caracterización de HLC. la actividad del citocromo P450 CYP3A de las células cultivadas en Matrigel (MG), LN-521 o LN-521 / LN-111 se puso a prueba. Los datos representan tres réplicas biológicas, y las barras de error representan SD. ** P <0,01; ANOVA de una vía con la prueba post-hoc de Tukey. Haga clic aquí para ver una versión más grande de esta figura.
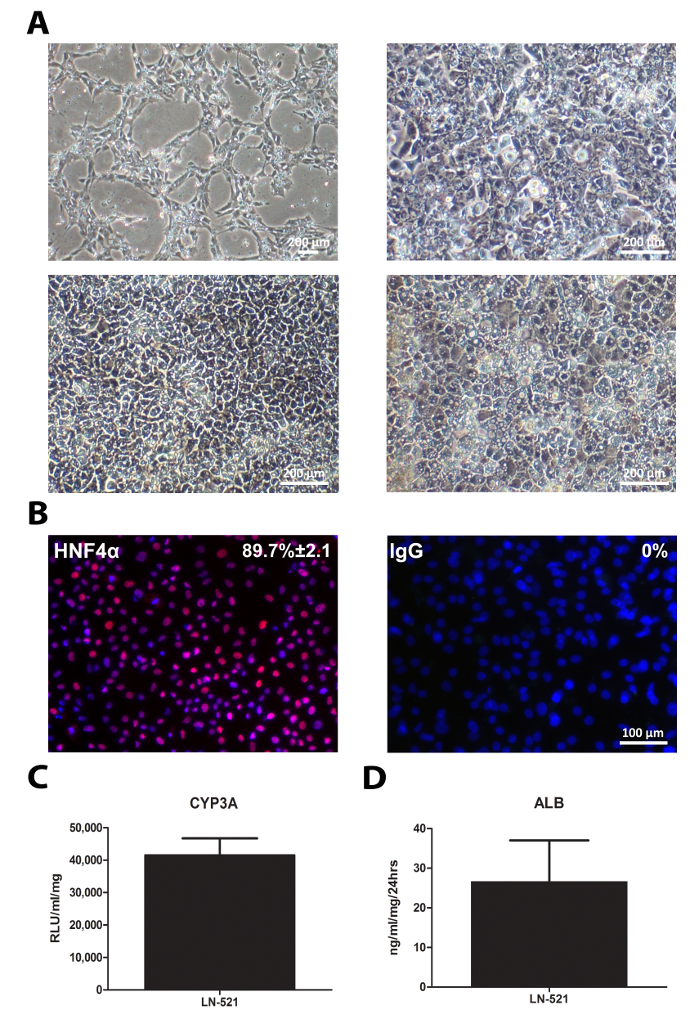
Figura 4: Caracterización Estándar de HLC. hiPSCs cultivadas en LN-521 se diferenciaron en HLC. pruebas generales de caracterización se realizaron el día 17 HLC. (A) La morfología secuencial de las células durante la diferenciación hepática; el r puntos de tiempo se muestra células epresent en los días 1, 4, 9, y 17. (B) La inmunotinción de expresión HNF4α. El porcentaje de células positivas y el SD se muestra basado en cuatro campos al azar de vista. Las imágenes fueron tomadas a 20 aumentos. Barra de escala = 100 micras. (C) la actividad de CYP3A en el día 17 HLC. Los datos representan seis repeticiones biológica, y la barra de error representa la desviación estándar. La secreción de (D) de albúmina de HLC derivados de más de 24 h en cultivo. Los datos representan cuatro repeticiones biológica, y la barra de error representa SD. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Cronología esquemática del protocolo de diferenciación.t = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Para avanzar en la investigación humana de células madre pluripotentes y la medicina traslacional, sistemas libres de xeno que cumplen con las directrices se requieren buenas prácticas de fabricación actuales. Clave para cualquier proceso de diferenciación es la matriz extracelular (ECM). El ECM no sólo es compatible con la unión celular, sino que también proporciona acceso a los factores de señalización clave, que influyen en la determinación de células y el fenotipo 25, 26.
Laminina son proteínas de la matriz extracelular in vivo multifuncionales. En el hígado, la secreción de la laminina es crucial para la regeneración del hígado después de una hepatectomía parcial 27 y es necesario para el mantenimiento de células progenitoras hepáticas 28. La importancia de laminina en el mantenimiento y la regeneración del hígado fue la base para las pruebas disponibles comercialmente laminina humana recombinante en nuestro sistema de diferenciación de hepatocitos.
Superior élla diferenciación patocyte se logró el LN-521 y LN-521 / LN-111 sustratos, en comparación con Matrigel. HLC derivados fueron claramente polarizados y organizados en el plato, y su función celular se mejoró significativamente en comparación con sus homólogos de mezcla de proteínas gelatinosas. Detrás de estas mejoras fue la regulación a la baja de contaminar Colon-, fibroblast- y el vástago genes asociados a células en las lamininas, así como una disminución en la proliferación celular y la expresión génica asociada a la migración 10.
En conclusión, el protocolo descrito aquí genera células hepatocitos como las que están más cerca de la naturaleza de los hepatocitos humanos adultos. El proceso es reproducible, susceptibles de automatización, y se pueden ampliar para su aplicación de manera rentable. Es importante destacar que, la variación de lote a lote se ha disminuido de manera significativa en comparación con las técnicas que utilizan Matrigel, resultando en un sistema de diferenciación mejorado para los investigadores en este campo.
Divulgaciones
El Dr. David C. Hay es un co-fundador y director de Stemnovate Limited.
Agradecimientos
Este trabajo fue apoyado con premios de la Medicina Regenerativa Plataforma Reino Unido (MRC MR / L022974 / 1 y MR / K026666 / 1) y una beca de China.
Materiales
| Name | Company | Catalog Number | Comments |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Recombinant Laminin 111 | BioLamina | LN111-02 | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| Human Activin A | Peprotech | 120-14E | |
| Human Hepatocyte Growth Factor | Peprotech | 100-39 | |
| Human Oncostatin M | Peprotech | 300-10 | |
| Rho-associated kinase (ROCK) inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H4881 | |
| DMSO | Sigma-Aldrich | D5879 | |
| mTeSR1 medium | STEMCELL Technologies | 05850 | |
| RPMI 1640 | Life Technologies | 21875 | |
| Knockout DMEM | Life Technologies | 10829 | |
| HepatoZYME | Life Technologies | 17705 | |
| B27 supplement | Life Technologies | 12587-010 | |
| Knockout Serum Replacement | Life Technologies | 10828 | |
| GlutaMax | Life Technologies | 35050 | |
| Non-essential amino acids | Life Technologies | 11140 | |
| 2-mercaptoethanol | Life Technologies | 31350 | |
| Accutase | Millipore | SCR005 | |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 |
Referencias
- Forbes, S. J., Gupta, S., Dhawan, A. Cell therapy for liver disease: From liver transplantation to cell factory. J Hepatol. 62 (1 Suppl), S157-S169 (2015).
- Hay, D. C., et al. Highly efficient differentiation of hESCs to functional hepatic endoderm requires ActivinA and Wnt3a signaling. Proc Natl Acad Sci U S A. 105 (34), 12301-12306 (2008).
- Hay, D. C., et al. Direct differentiation of human embryonic stem cells to hepatocyte-like cells exhibiting functional activities. Cloning Stem Cells. 9 (1), 51-62 (2007).
- Medine, C. N., et al. Developing high-fidelity hepatotoxicity models from pluripotent stem cells. Stem Cells Transl Med. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Transl Med. 3 (2), 141-148 (2014).
- Zhou, X., et al. Modulating innate immunity improves hepatitis C virus infection and replication in stem cell-derived hepatocytes. Stem Cell Reports. 3 (1), 204-214 (2014).
- Rashidi, H., Alhaque, S., Szkolnicka, D., Flint, O., Hay, D. C. Fluid shear stress modulation of hepatocyte-like cell function. Arch Toxicol. 90 (7), 1757-1761 (2016).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Transl Med. 5 (6), 764-772 (2016).
- Wang, Y., Hay, D. C. Mass production of stem cell derived human hepatocytes for experimental medicine. Expert Rev Gastroenterol Hepatol. 10 (7), 769-771 (2016).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Cai, J., et al. Directed differentiation of human embryonic stem cells into functional hepatic cells. Hepatology. 45 (5), 1229-1239 (2007).
- Sullivan, G. J., et al. Generation of functional human hepatic endoderm from human induced pluripotent stem cells. Hepatology. 51 (1), 329-335 (2010).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Curr Protoc Stem Cell Biol. 30, 1-12 (2014).
- Rashid, S. T., et al. Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells. J Clin Invest. 120 (9), 3127-3136 (2010).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Touboul, T., et al. Generation of functional hepatocytes from human embryonic stem cells under chemically defined conditions that recapitulate liver development. Hepatology. 51 (5), 1754-1765 (2010).
- Touboul, T., et al. Stage-specific regulation of the WNT/beta-catenin pathway enhances differentiation of hESCs into hepatocytes. J Hepatol. 64 (6), 1315-1326 (2016).
- Mathapati, S., et al. Small-Molecule-Directed Hepatocyte-Like Cell Differentiation of Human Pluripotent Stem Cells. Curr Protoc Stem Cell Biol. 38, 1-1 (2016).
- Takayama, K., et al. Efficient generation of functional hepatocytes from human embryonic stem cells and induced pluripotent stem cells by HNF4alpha transduction. Mol Ther. 20 (1), 127-137 (2012).
- Rodin, S., et al. Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511. Nat Biotechnol. 28 (6), 611-615 (2010).
- Rodin, S., et al. Clonal culturing of human embryonic stem cells on laminin-521/E-cadherin matrix in defined and xeno-free environment. Nat Commun. 5, 3195 (2014).
- Takayama, K., et al. Long-term self-renewal of human ES/iPS-derived hepatoblast-like cells on human laminin 111-coated dishes. Stem Cell Reports. 1 (4), 322-335 (2013).
- Medine, C. N., Lucendo-Villarin, B., Zhou, W., West, C. C., Hay, D. C. Robust generation of hepatocyte-like cells from human embryonic stem cell populations. J Vis Exp. (56), e2969 (2011).
- Sales, V. L., et al. Transforming growth factor-beta1 modulates extracellular matrix production, proliferation, and apoptosis of endothelial progenitor cells in tissue-engineering scaffolds. Circulation. 114 (1 Suppl), I193-I199 (2006).
- Taylor-Weiner, H., Schwarzbauer, J. E., Engler, A. J. Defined extracellular matrix components are necessary for definitive endoderm induction. Stem Cells. 31 (10), 2084-2094 (2013).
- Martinez-Hernandez, A., Delgado, F. M., Amenta, P. S. The extracellular matrix in hepatic regeneration. Localization of collagen types I, III, IV, laminin, and fibronectin. Lab Invest. 64 (2), 157-166 (1991).
- Lorenzini, S., et al. Characterisation of a stereotypical cellular and extracellular adult liver progenitor cell niche in rodents and diseased human liver. Gut. 59 (5), 645-654 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados