Method Article
Definierte und Scalable Generierung von Leber-ähnlichen Zellen aus humanen pluripotenten Stammzellen
In diesem Artikel
Zusammenfassung
Die hier vorgestellte Methode beschreibt eine skalierbare und gute Herstellungspraxis (GMP) -fähigen Differenzierungssystem menschlichen Hepatozyten-ähnliche Zellen aus pluripotenten Stammzellen zu erzeugen. Es dient als eine kostengünstige und standardisiertes System humanen Hepatocyten-artigen Zellen für Grundlagen- und angewandten Forschung der menschlichen Leber zu erzeugen.
Zusammenfassung
Humanen pluripotenten Stammzellen (hPSCs) besitzen großen Wert für die biomedizinische Forschung. hPSCs können im menschlichen Körper zu allen Zelltypen skaliert und differenziert werden. Die Differenzierung der hPSCs für die menschliche Hepatozyten-ähnliche Zellen (HLCs) wurde eingehend untersucht und effiziente Differenzierungsprotokolle etabliert. Die Kombination der extrazellulären Matrix und biologische Reize, einschließlich Wachstumsfaktoren, Zytokine und kleine Moleküle, haben es möglich gemacht HLCs zu erzeugen, die primären humanen Hepatozyten ähneln. Allerdings beschäftigen die Mehrheit der Verfahren noch nicht definierte Komponenten, was zu Charge zu Charge Variation. Dies dient als wesentliches Hindernis für die Anwendung der Technologie. Um dieses Problem zu bewältigen, haben wir ein definiertes System für Hepatozyten Differenzierung unter Verwendung von humanen rekombinanten Laminin als extrazelluläre Matrix in Kombination mit einem Serum-freien Differenzierungsprozess. Hocheffiziente Hepatozyten-Spezifikation wurde mit de erreicht,monstrated Verbesserungen sowohl HLC Funktion und Phänotyp. Wichtig ist, dass dieses System leicht HPSC Forschung und GMP-grade Linien viel versprechende Fortschritte in der zellbasierten Modellierung und Therapien, Scale-up verwenden.
Einleitung
Primäre menschliche Gewebe und die abgeleiteten Zelltypen werden regelmäßig sowohl für zellbasierte Screening und in der Klinik eingesetzt. Allerdings ist der Zugang zu diesen Zellen stark aufgrund unzureichender Organspende und Verlust der Zell Phänotypen beschränkt post-Isolierung 1. hPSCs stellen eine vielversprechende Alternative zu Primärgewebe und erleichtern die Erzeugung von genetisch definierten und erneuerbare menschlichen Körperzellen. Hepatozyten-ähnliche Zellen (HLCs) aus hPSCs abgeleitet haben bereits Versprechen in diesem Feld angezeigt. HLCs ähneln primären humanen Hepatozyten in verschiedenen Aspekten, einschließlich der Zellmorphologie, Genexpression Hepatozyten, Stoffwechselfunktion und Empfindlichkeit gegenüber Medikamenten und Viren 2, 3, 4, 5, 6, 7, 8. Darüber hinaus ist die unbegrenzte Proliferation undSelbsterneuerungsfähigkeit der beiden forschungs- und GMP-Grade hPSCs erleichtert ihre Anwendung 9, 10.
Über einem Jahrzehnt der Forschung hat eine Reihe von Hepatozyten effizienter Differenzierungsverfahren hergestellt 2, 3, 5, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20. die meisten dieser Systeme verwenden jedoch undefinierte Komponenten und / oder viralen Transduktion hepatozellulären Spezifikation zu treiben. Um die Zuverlässigkeit der Technik in großem Umfang zu verbessern, ist es wichtig, eine robuste Hepatozyten-Differenzierung zu entwickelnSystem, das wirklich definiert, Xeno-frei, und GMP-kompatibel ist.
Laminine (LNS) sind wichtige extrazelluläre Matrixproteine, die Zelladhäsion zu beeinflussen, Proliferation, Migration und Differenzierung. Laminin sind heterotrimerer Glykoproteine aus einem α zusammengesetzt, ein β und eine γ-Kette. In jüngster Zeit wurden rekombinante humane Laminine wurden in der Zellbiologie hergestellt und verwendet. LN-511 wurde 22 die Aufrechterhaltung der hPSCs 21, während eine Mischung von LN-521 und E-Cadherin können klonale Ableitung und die Expansion von humanen embryonalen Stammzellen zu unterstützen gezeigt. LN-111, andererseits unterstützt die Aufrechterhaltung der hepatoblast artig von hPSCs 23 abgeleiteten Zellen. Doch bevor unser Bericht, Laminin 521 und 111 nicht HLCs mit reifen Eigenschaften verwendet worden von hPSCs 10 zu erzeugen.
Hier stellen wir Detail Verfahren zur Züchtung von hPSCs auf LN-521und Differenzieren sie entweder auf LN-521 oder eine Mischung von LN-521 und LN-111 (LN-521 / LN-111). Wir optimieren die Differenzierung Protokoll Single-Cell - Seeding unter Verwendung einer hoch reproduzierbare und homogene Monoschicht von HLCs in 14 verschiedenen Formaten zu erzeugen. Wir glauben, dass unsere definierten Differenzierungssystem eine einfache und kostengünstige Methode dar aktive HLCs für die Anwendung in der Herstellung, einen bedeutenden Schritt nach vorn auf dem Gebiet darstellt.
Protokoll
HINWEIS: Lieferanteninformationen für alle in diesem Protokoll verwendeten Reagenzien ist in Tabelle 1 aufgeführt. Alle Medien / Platten sollten steril und zumindest bei Raumtemperatur sein, wenn die Zellen sind mit ihnen den direkten Kontakt zu haben.
1. Passagierung humanen pluripotenten Stammzellen (hPSCs) auf Laminin 521
HINWEIS: Das nachfolgende Verfahren ist an einzelnen Zellen beschrieben Zelle Passagierbarkeit basiert und ist ideal für die Ableitung einer homogenen Population von Hepatozyten-ähnliche Zellen aus hPSCs. Colony Überzug ist auch anwendbar und wurde zuvor 24 beschrieben.
- Bereiten Laminin beschichteten Platten nach Bedarf.
- Auftauen 100 ug / ml Stamm rekombinanter Laminin 521 (LN-521) bei 4 ° C.
- Verdünnen Sie die aufgetauten LN-521 in eiskaltem 1x DPBS (mit Ca 2+ / Mg 2+) mit einer 5 ug / ml - Lösung zu machen.
- 1 ml von 5 & mgr; g / mL LN-521-Lösung zu beschichten, eine Vertiefung einer Platte mit 6 Vertiefungenund Rock zu verbreiten sie gleichmäßig in den Brunnen.
- Die Inkubation in einem 37 ° C / 5% CO 2 Zellkultur - Inkubator für 2 - 4 h für dringende Gebrauch oder in einem 4 ° C Kühlschrank über Nacht.
- Speichern der Laminin-beschichteten Platten in einem 4 ° C Kühlschrank nach Bedarf. Halten Sie die Platten auf einer ebenen Fläche und versiegeln sie die Verdunstung und Kontamination zu vermeiden.
HINWEIS: Niemals die beschichteten Wells austrocknen lassen; top sie , wenn sie mit zusätzlichen 1x DPBS (mit Ca 2+ / Mg 2+) erforderlich werden. Verwenden Sie die Platten innerhalb von 2 Wochen.
- Lassen Sie die erforderliche Anzahl von Pre-beschichteten Platten Raumtemperatur vor der Verwendung zu erreichen oder die Platten bei 37 ° C inkubieren 0,5-1 h.
- aspirieren vorsichtig die Beschichtung LN-521-Lösung ohne die beschichtete Oberfläche zu beschädigen. Hinweis: Es ist wichtig, nicht die beschichtete Oberfläche zu beschädigen, bevor Zellen auf das Impfen.
- Unmittelbar 1 mL vorgewärmtes-mTeSR1 Medium, das mit 10 & mgr; M Rho-assoziierte Kinase (ROCK) -Inhibitor Y27632 zu einer Vertiefung einer 6-Well-Platte. Lassen Sie die Platte in der Zellkultur-Inkubator an Zellen erhalten.
HINWEIS: Niemals die Laminin-beschichteten Vertiefungen trocknen lassen. - Saugen Sie das Medium aus gepflegten hPSCs bei etwa 75% bis 85% Konfluenz. Waschen Sie die Zellen , die aus einer Vertiefung einer 6-Well - Platte einmal mit 1 ml Raumtemperatur 1x DPBS (ohne Ca 2+ / Mg 2+).
- Mit 0,5 ml 1x Accutase zu den Zellen und inkubiere bei 37 ° C für 6 bis 8 min, um die Zellen zu dissoziieren.
HINWEIS: Um zu überprüfen, ob die Verdauung lang genug ist oder nicht, vorsichtig auf die Platte klopfen und prüfen Sie, ob die Zellen leicht lösen kann. Wenn ja, dann ist es Zeit, um die enzymatische Reaktion zu stoppen; wenn nicht, verlängern die Verdauung für eine zusätzliche 1 bis 2 min. - Beenden der Dissoziation durch Zugabe von 2 ml frischem mTeSR1 Medium, ergänzt mit 10 & mgr; M zu den Zellen Y27632. Pipette nach oben und unten ein P1000 Spitze mehrmals mit einer Einzelzellsuspension zu machen.
- Zählen Sie die lebenden Zellen mit einer Zählkammer.Verwenden Sie Trypan Blau - Färbung und ausschließen toten Zellen 14
- Berechne die Gesamtzahl der Zellen benötigt werden. Für die Routine HPSC Passagierung seed 4 x 10 & sup5 ; bis 5 x 10 5 Zellen pro Well einer 6-Well - Platte (dh, 4,21 x 10 4 bis 5,26 x 10 4 pro cm 2). Für hPSCs für Hepatozyten Differenzierung Passagierung Saatgut 6,5 x 10 5 bis 7,5 x 10 5 (dh, 6,84 x 10 4 bis 7,89 x 10 4 pro cm 2) Zellen pro Well einer 6-Well - Platte.
HINWEIS: Die Dichte der Aussaat für jede Zelllinie könnte kleinere Optimierungsbedarf auf der Grundlage der empirischen Dichte hier für hepatische Differenzierung gegeben. - Übertragen, um die benötigte Zellsuspension in ein steriles 15-ml oder 50 ml-Zentrifugenröhrchen und Zentrifuge bei 115 × g für 3 min bei Raumtemperatur.
- Saugen Sie das langsam Überstand und dann Zellpellet in frischem, warmen mTeSR1 Medium mit 10 & mgr; M Rho-assoziierte Kinase (ROCK) inhibito ergänztr Y27632, adäquate Medium mit der gewünschten Zelldichte zu machen.
HINWEIS: Die Verwendung von ROCK-Inhibitor wird dringend empfohlen, um die Zellhaftung und die Überlebensrate zu verbessern. - Seed die Zellen auf die vorbereiteten Platten und Rock sie hin und her und von Seite zu Seite zu gleichmäßig um die Zellen zu verteilen.
HINWEIS: Es ist entscheidend, um sicherzustellen, dass die Zellen gleichmäßig in den Vertiefungen verteilt werden, ob die Platte für die Routinezellkultur oder Hepatozyten Differenzierung Experimente. - Legen Sie die Platten in den Zellinkubator und aufrechtzuerhalten , die Zellen bei 37 ° C / 5% CO 2 für 24 h zu erlauben , um sie zu befestigen und zu gewinnen.
- Untersuchen Sie die Zellen am nächsten Tag und ROCK-Inhibitor zurücktreten, wenn Zell-Zell-Kontakt hergestellt wurde. Pflegen Sie die Zellen in mTeSR1 Medium für die Routinekultur oder wechseln Sie zu Differenzierungsmedium nach Bedarf.
HINWEIS: Wenn die Zellen mit dem erwähnten Dichte ausgesät wurden, sollte die Konfluenz für die regelmäßige Wartung oder Hepatozyten differentiatio idealn.
2. Differenziert hPSCs zu Hepatozyten-ähnliche Zellen, die auf rekombinanten Laminine
- Bereiten Sie Differenzierungsmedium.
- Machen menschliche Activin A-Stammlösung: Man löst humanem Activin A-Pulver mit einer 100 ug / ml Stammlösung in sterilem 0,2% Rinderserumalbumin (BSA) / DPBS zu machen. Machen Sie kleine Aliquots und lagern Sie sie bei -20 ° C. Verwenden Sie bei 1: 1.000.
- Machen Maus Wnt 3a Stammlösung: Man löst Maus Wnt 3a-Pulver mit einer 10 ug / ml Stammlösung in sterilem 0,2% BSA / DPBS zu machen. Machen Sie kleine Aliquots und lagern Sie sie bei -20 ° C. Verwenden Sie bei 1: 200.
- Machen menschlichen Hepatozyten-Wachstumsfaktor (HGF) Stammlösung: Man löst Human-HGF-Pulver mit einer 10 ug / ml Stammlösung in sterilem 0,2% BSA / DPBS zu machen. Machen Sie kleine Aliquots und lagern Sie sie bei -20 ° C. Verwenden Sie bei 1: 1.000.
- Machen Sie Oncostatin M (OSM) Stammlösung: Man löst Oncostatin M (OSM) Pulver mit einer 20 ug / ml Stammlösung in sterilem 0,2% BSA / DPBS zu machen. Machen Sie kleine Teilmengen und srissen sie bei -20 ° C. Verwenden Sie bei 1: 1.000.
- Machen Sie 500 ml endoderm-Priming Lager Medium: 2% B27 Supplement (50x, minus Vitamin A) und 1% Penicillin / Streptomycin (Endkonzentrationen bei 100 IU / ml und 100 ug / ml jeweils); oben bis zu 500 ml mit Roswell Park Memorial Institute 1640 (RPMI 1640) Grundmedium. HINWEIS: Bewahren Sie die Lager bei 4 ° C und innerhalb von zwei Wochen. Aliquot Medium aus dem Lager und fügen Sie frische Activin A und Wnt 3a (Endkonzentrationen bei 100 ng / ml und 50 ng / ml, jeweils) bei jedem Mediumwechsel.
- Machen Sie 500 ml KSR / DMSO Differenzierungsmedium: 80% Knockout DMEM (KO-DMEM), 20% KO-Serumersatz (KSR), 0,5% GlutaMAX, 1% nicht-essentielle Aminosäuren (NEAA), 0,1 mM beta-Mercaptoethanol, 1% DMSO und 1% Penicillin / Streptomycin (Endkonzentrationen bei 100 IU / ml und 100 ug / ml, jeweils). Filter unter Vakuum. Lagerung bei 4 ° C und innerhalb von zwei Wochen.
- Machen Sie 500 ml HepatoZYME Reifungsmedium: 1% GlutaMAX, 10 & mgr; M Hydrocortison-21-Hemisuccinat-Natriumsalz (HCC) und 1% Penicillin / Streptomycin (Endkonzentrationen bei 100 IU / ml und 100 ug / ml, jeweils); oben bis zu 500 ml HepatoZYME Basismedium verwendet wird. HINWEIS: Bewahren Sie die Lager bei 4 ° C und innerhalb von zwei Wochen. Aliquot Medium aus dem Lager und fügen Sie frische HGF und OSM (Endkonzentrationen bei 10 ng / ml und 20 ng / ml, jeweils) für jedes Medium ändern.
- Seed hPSCs für Hepatozyten Differenzierung LN-521, wie in Abschnitt 1. Wenn LN-521 / LN-111 als Substrat verwendet werden, beschichten die Platten mit LN-521 und LN-111 (1: 3-Verhältnis) bei die endgültige Laminin Konzentration von 5 & mgr; g / ml; der Rest Behandlung sollte die gleiche wie reines LN-521 beschichteten Platten sein.
HINWEIS: LN-521 / LN-111 ist nicht ideal für die Routinekultur hPSCs; Es ist nur für Differenzierungsexperimente verwendet. - Überprüfen Sie die Zelle Konfluenz 24 h nach dem Aussäen. Initiieren Zelldifferenzierung, sobald die Zellkonfluenz etwa 40% erreicht. ReMove das verbrauchte mTeSR1 Medium und fügen Sie frische endoderm-Priming-Medium, ergänzt mit 100 ng / ml Activin A und 50 ng / mL Wnt 3a. Rufen Sie diese Differenzierung Tag 1.
HINWEIS: Es wird dringend die Differenzierung der Tag empfohlen, einzuleiten, nachdem die Zellen der Aussaat. - Ändern Sie den endoderm-Priming Medium alle 24 Stunden für 3 Tage mit humanen embryonalen Stammzellen (hES-Zellen). Pluripotente Stammzellen (hiPSCs), erweitern diese Stufe für 2 weitere Tage zu grundieren , die Zellen zu definitiven Endoderm-ähnlichen Zellen, sondern verwenden Sie die endoderm-Priming - Medium nur mit 100 ng / ml Activin A für diese beiden Tage als für den menschlichen induzierten 12 .
HINWEIS: Um eine erfolgreiche endoderm Spezifikation zu gewährleisten, kann man den Ausdruck von endodermaler Marker, wie FOXA2 und SOX17 untersuchen. Gemäß Immunofluoreszenzfärbung, über 80% der abgeleiteten Zellen sind positiv für beide Marker in unserem Labor. - Wechseln Sie in den KSR / DMSO Differenzierungsmedium an Tag 4 (für hES) / Tag 6 (für hiPSCs). Ändern Sie das Medium daily für die ersten 3 Tage und dann am fünften Tag der Differenzierung der Bühne.
HINWEIS: keine Fütterung am vierten Tag dieser Differenzierungsstadium benötigt wird. Verwenden Sie unsupplementierten KO-DMEM um die Zellen zu waschen einmal vor dem Mediumwechsel, wenn es viele tote Zellen sind. Um zu überprüfen, ob die Differenzierung für diese Phase erfolgreich ist oder nicht, kann man die Expression von Lebervorläuferzellmarker zu testen, wie AFP, CK19 und HNF4A. Fast 90% der Zellen wird für diese Marker positiv auf Basis unserer Erfahrungen. - Nach 5 Tagen der Differenzierungsstadium KSR / DMSO, wechseln Sie auf die HepatoZYME Reifestadium. Waschen Sie die Zellen einmal mit normalem HepatoZYME Basalmedium nach dem KSR / DMSO-Medium zu entfernen. Hinzufügen HepatoZYME Reifungsmedium mit 10 ng / ml HGF und 20 ng / ml OSM.
- Ändern Sie den Medium alle 48 h für 7 - 10 Tagen, an welcher Stelle die Zellen sind bereit für Standard Charakterisierung oder zur weiteren Verwendung.
HINWEIS: Hepatozyten-Marker-Expressionsuntersuchungen, metabolischeFunktionstests (wie Cytochrom P450-Aktivität), Harnstoff und Albumin-Sekretion Tests, Glykogenspeicherung Tests und Indocyaningrün (ICG) Aufnahme-Tests sind typische Charakterisierungsmethoden.
HINWEIS: Die Zeitleiste des Differenzierungsprotokolls ist in Abbildung 5 dargestellt. In unserem Labor überprüfen wir regelmäßig die Hepatozyten-spezifischen "abgeleitet HLCs Marker Expressionsniveaus, Albumin-Sekretion und Cytochrom P450 (CYP) 3A und 1A2-Aktivität.
Ergebnisse
Das hepatozelluläre Differenzierung von hPSCs
Eine humane embryonale Stammzelllinie, H9 und eine menschliche induzierte pluripotente Stammzelllinie, 33D6, wurden für die Hepatozyten-Differenzierung verwendet. Die Ergebnisse in den Figuren 1-3 sind von H9 - Zellen, während die in Figur 4 von 33D6 - Zellen sind. Einzelne Zellen ausgesät auf Laminin etablierte Zell-Zell-Kontakt nach 24 h. Nachdem die Zellen etwa 40% Konfluenz erreichte, wurde der Differenzierungsprozess eingeleitet (1A und 4A). Auf Laminine (beide LN-521 und LN-521 / LN-111), ging diese Zellen durch sequentielle morphologischen Veränderungen und führte zu polarisiertem HLCs (1 und 4A).
Hepatozyten-ähnliche Zellcharakterisierung
day 18 HLCs wurden auf die Expression von repräsentativen Hepatozyten - Marker, HNF4A und ALB (2A) gesammelt und bewertet. Immunfärbung von Tag 18 HLCs zeigten , dass fast 90% der Zellen HNF4α (2B) ausgedrückt. Diese Zellen polarisiert auf Laminine und zeigte eine polygonale Aussehen, wie gekennzeichnet durch E-Cadherin und F-Actin - Expression (2B).
Cytochrom P450 (CYP) Aktivität wurde ebenfalls bewertet. Die CYP450 führen eine wichtige metabolische Funktion von Hepatozyten. Tag 18 HLCs auf einem gelatinösen Proteingemisch abgeleitet sind, wie Matrigel, LN-521 oder LN-521 / LN-111, wurden für CYP3A Aktivität getestet. HLCs zeigte deutlich höhere Aktivität auf CYP3A Laminin Substrate als auf Matrigel (Abbildung 3). Wichtig ist, dass im Vergleich zu kommerziellen humanen primären Hepatozyten (HU1339) re-plattiert auf diesen Substraten weisen HLCs fast 10-mal höherevon CYP3A - Aktivität 10.
Die Differenzierung der hiPSCs war ähnlich der hESCs. Die Zellen sequentiellen Veränderungen im Aussehen (4A) gezeigt. Abgeleitet HLCs ausgedrückt einen Schlüssel Hepatozyten Transkriptionsfaktor, HNF4α (4B), und besaß CYP3A Aktivität und sezerniert Albumin (4C und D). Bemerkenswert ist , von 33D6 abgeleitet HLCs CYP3A im Vergleich zu H9 - Zellen abgeleitet HLCs (Figur 3) angezeigt reduziert, aber es war immer noch vergleichbar mit humanen primären Hepatozyten 10. Jedoch war die Albuminsekretion dieser HLCs viel niedriger als in primären Hepatozyten 10.
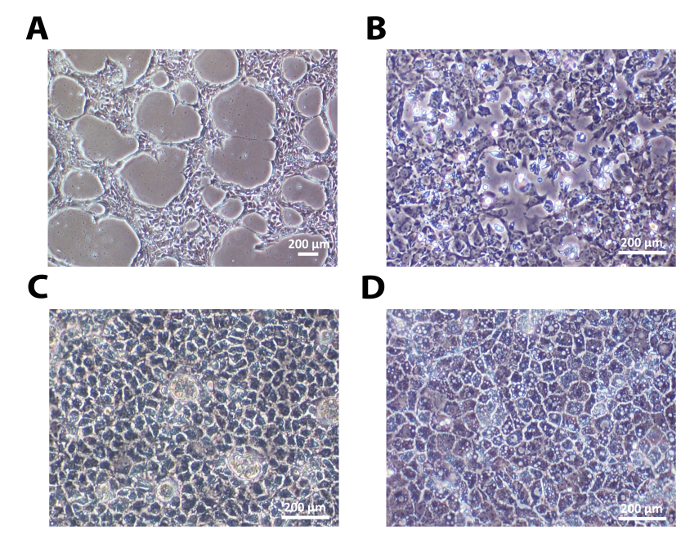
Abbildung 1: Die sequenzielle Morphologische Veränderungen im hepatischen Differenzierung. </ strong> (A) ausgesät undifferenzierte hES als einzelne Zellen etwa 40% Konfluenz 24 h nach dem Aussäen erreicht. (B) Nach der Grundierung Zellen zeigten die typische endodermaler Morphologie am Tag 4. (C) bei der hepatoblast artigen Bühne erreicht, sie zeigten eine deutliche polygonale Form an Tag 9 (D) Nach der Reifestufe, waren polarisiert HLCs bereit hier bei Tag eine weitere Charakterisierung 18. Maßstabsbalken gezeigt = 200 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
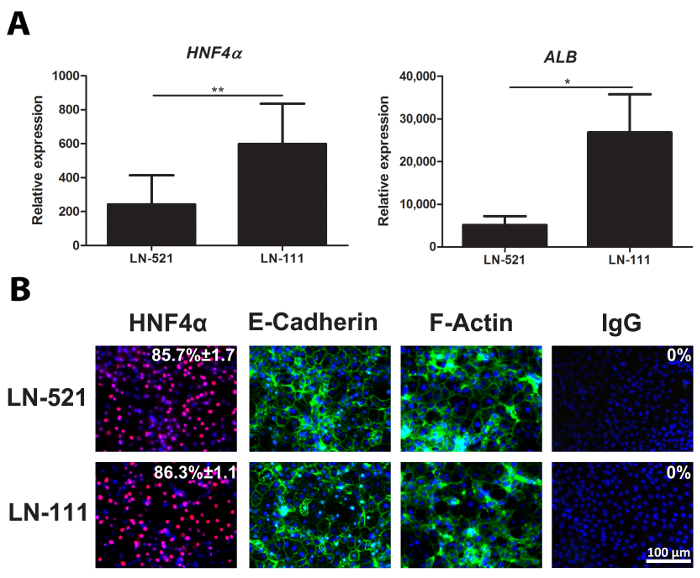
Abbildung 2: Charakterisierung von HLCs. (A) Die Genexpression von Hepatozyten-spezifischen Markern, HNF4A (links) und ALB (rechts). Das Expressionsniveau wurde mit Tag 18 HLCs analysiert abgeleitetvon hES - Zellen sowohl auf LN-521 und LN-521 / LN-111, und es war an der Housekeeping - Gen GAPDH normalisiert und exprimiert hESCs relativ. Die Ergebnisse stellen drei biologischen Replikate, und die Fehlerbalken stellen die Standardabweichung (SD). * P <0,05, ** p <0,01; ungepaarten t-Test. (B) Proteinexpression eines Schlüsselleber Marker, HNF4α und Polarisationsmarkierungen, E-Cadherin und F-Actin. Tag 18 HLCs auf LN-521 und LN-521 / LN-111 wurden für die oben genannten Marker gefärbt und mit Hoechst 33342 Eine Negativkontrolle wurde mit dem entsprechenden Immunglobulin G (IgG) durchgeführt. Der Anteil der HNF4α-positiven Zellen und der SD gezeigt. Dieser wurde aus vier zufälligen Sichtfeldern berechnet. Die Bilder wurden bei 20facher Vergrößerung. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
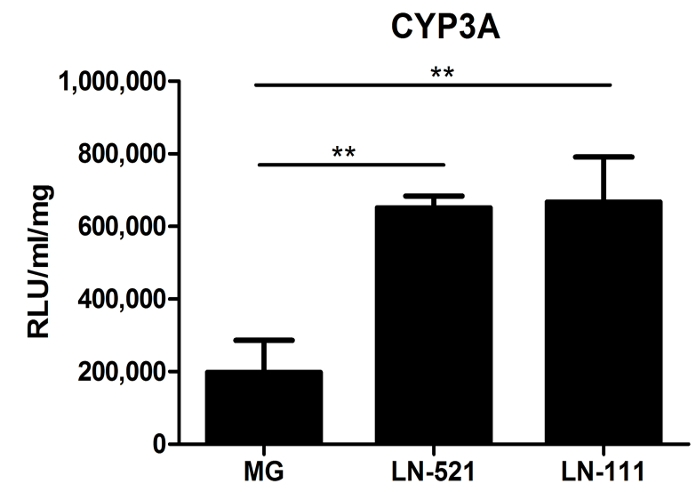
Abbildung 3: Metabolische Funktion Charakterisierung von HLCs. Cytochrom P450 Aktivität von CYP3A von kultivierten Zellen auf Matrigel (MG), LN-521 oder LN-521 / LN-111 getestet. Die Daten repräsentieren drei biologischen Replikaten, und die Fehlerbalken stellen SD. ** P <0.01; one-way ANOVA mit Tukey-post-hoc-Test. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
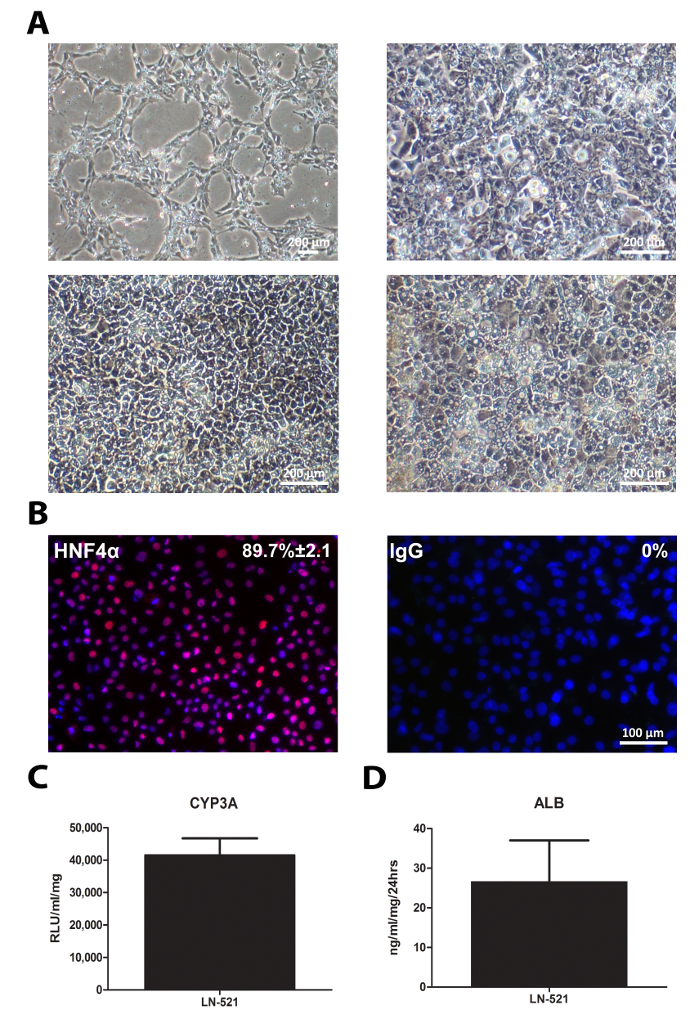
Abbildung 4: Standard Charakterisierung von HLCs. hiPSCs kultiviert auf LN-521 wurden in HLCs unterschieden. Standardverfahren wurden am Tag 17 HLCs durchgeführt. (A) Die sequentielle Morphologie der Zellen während der Leber Differenzierung; die Zeitpunkte gezeigt r epresent Zellen an den Tagen 1, 4, 9 und 17 (B) Immunfärbung von HNF4α Expression. Der Prozentsatz der positiven Zellen und die SD basiert auf vier zufälligen Sichtfeldern gezeigt. Die Bilder wurden bei 20facher Vergrößerung. Maßstabsbalken = 100 & mgr; m. (C) CYP3A - Aktivität am Tag 17 HLCs. Die Daten repräsentieren sechs biologischen Replikate, und die Fehlerbalken stellt die SD. (D) Albumin - Sekretion von abgeleiteten HLCs über 24 h in Kultur. Die Daten repräsentieren vier biologischen Replikate, und die Fehlerbalken stellt SD. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 5: Schematische Zeitleiste des Differenzierungsprotokolls.t = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
humanen pluripotenten Stammzellforschung und der translationalen Medizin, Xeno-freien Systemen voranzubringen, die mit den aktuellen guten Herstellungspraxis Richtlinien entsprechen müssen. Schlüssel zu jeder Differenzierungsprozesses ist die extrazelluläre Matrix (ECM). Das ECM unterstützt nicht nur die Zellhaftung, sondern bietet auch Zugang zu den wichtigsten Signalfaktoren, Beeinflussung der Zellbestimmung und Phänotyp 25, 26.
Laminine sind multifunktional extrazelluläre Matrixproteine in vivo. In der Leber ist Laminin Sekretion von entscheidender Bedeutung für die Leberregeneration nach einer partiellen Hepatektomie 27 und ist für die hepatische Progenitorzellen Wartungs 28 erforderlich. Die Bedeutung von Lamininen in Leber Erhaltung und Regeneration war die Grundlage für die Prüfung im Handel erhältlichen rekombinanten humanen Laminine in unserem Hepatozyten Differenzierungssystem.
Superior-erpatocyte Differenzierung wurde auf LN-521 und LN-521 / LN-111 Substrate erreicht, wenn auf Matrigel verglichen. Abgeleitet HLCs wurden deutlich polarisiert und in der Schale organisiert, und ihre zelluläre Funktion deutlich verbessert im Vergleich zu ihrer gallertartig Proteinmischung Pendants. Diese Verbesserungen zugrunde liegenden war die Herunterregulation Dickdarm- kontaminierender, fibroblast- und zellassoziierte Gene auf den Laminine, sowie eine Abnahme der Zellproliferation und -migration assoziierte Genexpression 10 stammen.
Abschließend beschrieben das Protokoll hier erzeugt Hepatozyten-ähnliche Zellen, die näher in der Natur zu erwachsenen humanen Hepatozyten sind. Das Verfahren ist reproduzierbar, zugänglich Automatisierung und können für die Anwendung kostengünstiger skaliert werden. Wichtig ist, Batch-to-Batch-Variante im Vergleich zu Techniken signifikant verringert, die Matrigel verwenden ist, in diesem Bereich für die Forscher in einer verbesserten Differenzierungssystem resultiert.
Offenlegungen
Dr. David C. Hay ist Mitbegründer und Direktor von Stemnovate Limited.
Danksagungen
Diese Arbeit wurde mit Auszeichnungen aus dem Vereinigten Königreich Regenerative Medizin Platform (MRC MR / L022974 / 1 und MR / K026666 / 1) und einem China-Stipendium unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Recombinant Laminin 111 | BioLamina | LN111-02 | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| Human Activin A | Peprotech | 120-14E | |
| Human Hepatocyte Growth Factor | Peprotech | 100-39 | |
| Human Oncostatin M | Peprotech | 300-10 | |
| Rho-associated kinase (ROCK) inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H4881 | |
| DMSO | Sigma-Aldrich | D5879 | |
| mTeSR1 medium | STEMCELL Technologies | 05850 | |
| RPMI 1640 | Life Technologies | 21875 | |
| Knockout DMEM | Life Technologies | 10829 | |
| HepatoZYME | Life Technologies | 17705 | |
| B27 supplement | Life Technologies | 12587-010 | |
| Knockout Serum Replacement | Life Technologies | 10828 | |
| GlutaMax | Life Technologies | 35050 | |
| Non-essential amino acids | Life Technologies | 11140 | |
| 2-mercaptoethanol | Life Technologies | 31350 | |
| Accutase | Millipore | SCR005 | |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 |
Referenzen
- Forbes, S. J., Gupta, S., Dhawan, A. Cell therapy for liver disease: From liver transplantation to cell factory. J Hepatol. 62 (1 Suppl), S157-S169 (2015).
- Hay, D. C., et al. Highly efficient differentiation of hESCs to functional hepatic endoderm requires ActivinA and Wnt3a signaling. Proc Natl Acad Sci U S A. 105 (34), 12301-12306 (2008).
- Hay, D. C., et al. Direct differentiation of human embryonic stem cells to hepatocyte-like cells exhibiting functional activities. Cloning Stem Cells. 9 (1), 51-62 (2007).
- Medine, C. N., et al. Developing high-fidelity hepatotoxicity models from pluripotent stem cells. Stem Cells Transl Med. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Transl Med. 3 (2), 141-148 (2014).
- Zhou, X., et al. Modulating innate immunity improves hepatitis C virus infection and replication in stem cell-derived hepatocytes. Stem Cell Reports. 3 (1), 204-214 (2014).
- Rashidi, H., Alhaque, S., Szkolnicka, D., Flint, O., Hay, D. C. Fluid shear stress modulation of hepatocyte-like cell function. Arch Toxicol. 90 (7), 1757-1761 (2016).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Transl Med. 5 (6), 764-772 (2016).
- Wang, Y., Hay, D. C. Mass production of stem cell derived human hepatocytes for experimental medicine. Expert Rev Gastroenterol Hepatol. 10 (7), 769-771 (2016).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Cai, J., et al. Directed differentiation of human embryonic stem cells into functional hepatic cells. Hepatology. 45 (5), 1229-1239 (2007).
- Sullivan, G. J., et al. Generation of functional human hepatic endoderm from human induced pluripotent stem cells. Hepatology. 51 (1), 329-335 (2010).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Curr Protoc Stem Cell Biol. 30, 1-12 (2014).
- Rashid, S. T., et al. Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells. J Clin Invest. 120 (9), 3127-3136 (2010).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Touboul, T., et al. Generation of functional hepatocytes from human embryonic stem cells under chemically defined conditions that recapitulate liver development. Hepatology. 51 (5), 1754-1765 (2010).
- Touboul, T., et al. Stage-specific regulation of the WNT/beta-catenin pathway enhances differentiation of hESCs into hepatocytes. J Hepatol. 64 (6), 1315-1326 (2016).
- Mathapati, S., et al. Small-Molecule-Directed Hepatocyte-Like Cell Differentiation of Human Pluripotent Stem Cells. Curr Protoc Stem Cell Biol. 38, 1-1 (2016).
- Takayama, K., et al. Efficient generation of functional hepatocytes from human embryonic stem cells and induced pluripotent stem cells by HNF4alpha transduction. Mol Ther. 20 (1), 127-137 (2012).
- Rodin, S., et al. Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511. Nat Biotechnol. 28 (6), 611-615 (2010).
- Rodin, S., et al. Clonal culturing of human embryonic stem cells on laminin-521/E-cadherin matrix in defined and xeno-free environment. Nat Commun. 5, 3195 (2014).
- Takayama, K., et al. Long-term self-renewal of human ES/iPS-derived hepatoblast-like cells on human laminin 111-coated dishes. Stem Cell Reports. 1 (4), 322-335 (2013).
- Medine, C. N., Lucendo-Villarin, B., Zhou, W., West, C. C., Hay, D. C. Robust generation of hepatocyte-like cells from human embryonic stem cell populations. J Vis Exp. (56), e2969 (2011).
- Sales, V. L., et al. Transforming growth factor-beta1 modulates extracellular matrix production, proliferation, and apoptosis of endothelial progenitor cells in tissue-engineering scaffolds. Circulation. 114 (1 Suppl), I193-I199 (2006).
- Taylor-Weiner, H., Schwarzbauer, J. E., Engler, A. J. Defined extracellular matrix components are necessary for definitive endoderm induction. Stem Cells. 31 (10), 2084-2094 (2013).
- Martinez-Hernandez, A., Delgado, F. M., Amenta, P. S. The extracellular matrix in hepatic regeneration. Localization of collagen types I, III, IV, laminin, and fibronectin. Lab Invest. 64 (2), 157-166 (1991).
- Lorenzini, S., et al. Characterisation of a stereotypical cellular and extracellular adult liver progenitor cell niche in rodents and diseased human liver. Gut. 59 (5), 645-654 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten