Method Article
Definito e Generazione scalabile di cellule epatociti-come da cellule staminali umane pluripotenti
In questo articolo
Riepilogo
Il metodo presentato qui descrive una soluzione scalabile e buone pratiche di fabbricazione (GMP) sistema di differenziazione -ready per generare cellule epatociti-come l'essere umano da cellule staminali pluripotenti. Serve come un sistema economico e standardizzato per generare cellule epatociti-come l'essere umano per la ricerca di base e applicata fegato umano.
Abstract
Le cellule staminali pluripotenti umane (hPSCs) possiedono un grande valore per la ricerca biomedico. hPSCs possono essere scalati e differenziato a tutti i tipi di cellule presenti nel corpo umano. La differenziazione delle cellule umane hPSCs a epatociti-come (hlcs) è stato ampiamente studiato, e protocolli di differenziazione efficienti sono state stabilite. La combinazione di matrice extracellulare e stimoli biologici, compresi fattori di crescita, citochine, e piccole molecole, hanno permesso di generare HLCs che assomigliano epatociti umani primari. Tuttavia, la maggior parte delle procedure ancora impiegano componenti non definiti, dando luogo a lotto a lotto variazione. Questo serve come una barriera significativa l'applicazione della tecnologia. Per affrontare questo problema, abbiamo sviluppato un sistema definito per la differenziazione degli epatociti utilizzando laminine ricombinanti umani come matrici extracellulari in combinazione con un processo di differenziazione senza siero. Altamente specifica degli epatociti efficiente è stato raggiunto, con demonstrated miglioramenti sia la funzione HLC e fenotipo. È importante sottolineare che questo sistema è facile da scalare con la ricerca e GMP-grade linee HPSC progressi promettenti nella modellazione e le terapie a base di cellule.
Introduzione
tessuti umani primaria e tipi di cellule derivati sono regolarmente utilizzati, sia per lo screening cell-based e nella clinica. Tuttavia, l'accesso a queste cellule è fortemente limitato a causa della donazione di organi insufficienti e la perdita di fenotipi cellulari post-isolamento 1. hPSCs rappresentano una promettente alternativa al tessuto primario e facilitano la generazione di cellule somatiche umane geneticamente definiti e rinnovabili. cellule epatociti-like (hlcs) derivati da hPSCs hanno già mostrato risultati promettenti in questo campo. HLCs assomigliano epatociti umani primari in vari aspetti, tra cui la morfologia cellulare, l'espressione genica degli epatociti, la funzione metabolica, e la sensibilità ai farmaci e virus 2, 3, 4, 5, 6, 7, 8. Inoltre, la proliferazione illimitato ecapacità di auto-rinnovamento sia hPSCs ricercatori e GMP-grade facilita la loro applicazione 9, 10.
Oltre un decennio di ricerche ha prodotto una serie di procedure di differenziazione efficiente epatociti 2, 3, 5, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20. Tuttavia, la maggior parte di questi sistemi utilizzano componenti non definiti e / o trasduzione virale per guidare specifica epatocellulare. Per migliorare l'affidabilità della tecnologia a scala, è importante sviluppare un robusto differenziazione degli epatocitisistema che è veramente definito, senza xeno, e GMP-compatibili.
Laminine (LNS) sono importanti proteine della matrice extracellulare che possono influenzare l'adesione cellulare, la proliferazione, la migrazione e la differenziazione. Laminine sono glicoproteine eterotrimeriche composto da un α, β uno, e uno a catena γ. Recentemente, ricombinanti laminine umani sono stati prodotti e utilizzati in biologia cellulare. LN-511 è stato dimostrato per sostenere il mantenimento di hPSCs 21, mentre una miscela di LN-521 ed E-caderina permette derivazione clonale e l'espansione di cellule staminali embrionali umane 22. LN-111, d'altra parte, supporta il mantenimento delle cellule hepatoblast come derivati da hPSCs 23. Tuttavia, prima che il nostro rapporto, laminine 521 e 111 non era stato utilizzato per generare HLCs con caratteristiche maturi da hPSCs 10.
Qui, le procedure di dettaglio per la coltura hPSCs sul LN-521e differenziandole su entrambi LN-521 o una miscela di LN-521 e LN-111 (LN-521 / LN-111). Abbiamo ottimizzato il protocollo di differenziazione mediante semina cella singola per generare un monostrato altamente riproducibile e omogenea delle HLCs in molti formati 14. Noi crediamo che il nostro sistema di differenziazione definito rappresenta un metodo semplice ed economico per la produzione HLCs attivi per l'applicazione, che rappresenta un significativo passo in avanti nel campo.
Protocollo
NOTA: le informazioni del fornitore per tutti i reagenti utilizzati in questo protocollo è stata inserita nella tabella 1. Tutti i media / piastre devono essere sterili e almeno a temperatura ambiente quando le cellule sono di avere un contatto diretto con loro.
1. Passaging cellule staminali umane pluripotenti (hPSCs) sui laminina 521
NOTA: La procedura descritta di seguito passaging cellulare si basa su singole cellule ed è ideale per la derivazione di una popolazione omogenea di cellule epatociti-come da hPSCs. Colony placcatura è anche applicabile ed è stato descritto in precedenza 24.
- Preparare piatti laminina rivestite in base alle esigenze.
- Scongelare il / ml di 100 mg di laminina ricombinante 521 (LN-521) a 4 ° C.
- Diluire il scongelati LN-521 in ghiacciata 1x DPBS (con Ca 2+ / Mg 2+) per ottenere una soluzione 5 mg / ml.
- Aggiungere 1 ml di 5 mg / ml LN-521 soluzione per rivestire un pozzetto di un 6-pozzettie rock per diffondere uniformemente nel pozzo.
- Incubare le piastre a 37 ° C / 5% di CO 2 incubatore cultura cellulare per 2 - 4 ore per l'uso urgente o in C frigorifero a 4 ° durante la notte.
- Conservare le piastre laminina rivestite in C frigorifero 4 ° come richiesto. Conservare le piastre su una superficie piana e sigillarli per evitare l'evaporazione e la contaminazione.
NOTA: Non lasciare mai i pozzi rivestiti asciugare; li rabboccare con olio extra 1x DPBS (con Ca 2+ / Mg 2+) se necessario. Utilizzare le piastre entro 2 settimane.
- Lasciare il numero richiesto di piastre pre-rivestito a temperatura ambiente prima dell'uso o incubare le piastre a 37 ° C per 0,5 - 1 he.
- Con attenzione aspirare il rivestimento soluzione LN-521 senza danneggiare la superficie rivestita. Nota: è fondamentale non danneggiare la superficie rivestita prima della semina cellule su di esso.
- Aggiungere immediatamente 1 ml di pre-riscaldato-mTeSR1 media integrato con chinasi 10 micron Rho-associata (ROCK) Y2 inibitore7632 ad un pozzetto di un 6-pozzetti. Lasciare la piastra nell'incubatore coltura cellulare per ricevere le cellule.
NOTA: Non permettere mai i pozzi laminina rivestite ad asciugare. - Aspirare il medium da hPSCs ben curati a circa il 75% al 85% di confluenza. Lavare le cellule da un pozzetto di un 6-pozzetti una volta con 1 ml di temperatura ambiente 1x DPBS (senza Ca 2+ / Mg 2+).
- Aggiungere 0,5 ml di 1x Accutase alle cellule e incubare a 37 ° C per 6 - 8 min dissociare le cellule.
NOTA: Per verificare se la digestione è abbastanza lungo o no, battere leggermente la piastra e verificare se le cellule possono staccarsi facilmente. Se sì, allora è il momento di fermare la reazione enzimatica; se non, estendere la digestione per un extra 1 - 2 min. - Terminare la dissociazione aggiungendo 2 mL di terreno mTeSR1 fresco supplementato con 10 mM Y27632 alle cellule. Pipetta su e giù con una punta P1000 più volte per fare una cella singola sospensione.
- Contare le cellule vitali mediante un emocitometro.Utilizzare Trypan Blue a macchia ed escludere le cellule morte 14
- Calcolare il numero totale di cellule necessarie. Per di routine passaging HPSC, semi di 4 x 10 5 a 5 x 10 5 cellule per pozzetto di un 6-pozzetti (ad esempio, 4.21 x 10 4-5,26 x 10 4 per cm 2). Per passaging hPSCs per la differenziazione degli epatociti, semi di 6,5 x 10 5 a 7,5 x 10 5 (vale a dire, 6.84 x 10 4 a 7,89 x 10 4 per cm 2) cellule per pozzetto di un 6-pozzetti.
NOTA: La densità di semina per ciascuna linea cellulare potrebbe avere bisogno di ottimizzazione minore sulla base della densità empirica qui dato per la differenziazione epatica. - Trasferire la sospensione cellulare necessaria in una sterile 15 mL o 50 mL provetta da centrifuga e centrifugare a 115 xg per 3 min a temperatura ambiente.
- Aspirare il surnatante lentamente e poi risospendere il pellet cellulare in acqua dolce medio, caldo mTeSR1 integrato con chinasi 10 micron Rho-associata (ROCK) inhibitor Y27632, utilizzando mezzo adeguato per rendere la densità cellulare desiderato.
NOTA: L'uso di inibitori ROCK è altamente raccomandato al fine di migliorare l'adesione delle cellule e il tasso di sopravvivenza. - Seme le cellule alle piastre preparate e li oscillare avanti e indietro e un lato all'altro per distribuire uniformemente le cellule.
NOTA: E 'fondamentale per garantire che le cellule sono distribuite in modo uniforme nei pozzetti tratti di una targa per la coltura cellulare di routine o di sperimentazione differenziazione degli epatociti. - Posizionare le piastre nell'incubatore cellule e mantenere le cellule a 37 ° C / 5% di CO 2 per 24 ore per permettere loro di fissare e recuperare.
- Esaminare le cellule del giorno successivo e prelevare inibitore ROCK se è stato stabilito il contatto cellula-cellula. Mantenere le cellule in terreno mTeSR1 per la cultura di routine o passare a medio differenziazione a seconda delle necessità.
NOTA: Se le cellule sono state seminate con la densità menzionato, la confluenza dovrebbe essere ideale per la manutenzione ordinaria o epatociti differentiation.
2. Differenziare hPSCs alle celle epatociti-come su ricombinanti Laminine
- Preparare mezzo di differenziazione.
- Fai la soluzione di riserva Activin Un essere umano: sciogliere Activin umana Una polvere per ottenere una soluzione stock / mL 100 mg in sterile 0,2% di albumina sierica bovina (BSA) / DPBS. Fare piccole aliquote e conservare a -20 ° C. Utilizzare a 1: 1.000.
- Fai la 3a soluzione stock del mouse Wnt: sciogliere il mouse Wnt polvere 3a per ottenere una soluzione stock / ml 10 mg in sterili 0,2% BSA / DPBS. Fare piccole aliquote e conservare a -20 ° C. Utilizzare a 1: 200.
- Fare fattore di crescita degli epatociti umani (HGF) soluzione madre: sciogliere la polvere HGF umano per ottenere una soluzione stock / ml 10 mg in sterili 0,2% BSA / DPBS. Fare piccole aliquote e conservare a -20 ° C. Utilizzare a 1: 1.000.
- Fare oncostatina M (OSM) soluzione madre: sciogliere oncostatina M (OSM) in polvere per ottenere una soluzione stock / ml 20 mg in sterile 0,2% BSA / DPBS. Fare piccole aliquote e sli strappò a -20 ° C. Utilizzare a 1: 1.000.
- Fare 500 ml di endoderma-adescamento magazzino media: supplemento B27 2% (50x, meno vitamina A) e l'1% di penicillina / streptomicina (concentrazioni finali a 100 UI / ml e 100 mg / ml, rispettivamente); alto fino a 500 ml con Roswell Park Memorial Institute 1640 (RPMI 1640) terreno di base. NOTA: Conservare il magazzino a 4 ° C ed utilizzare entro due settimane. media un'aliquota dal magazzino e aggiungere freschi Activin A e Wnt 3a (concentrazioni finali a 100 ng / ml e 50 ng / ml, rispettivamente) ad ogni cambio medio.
- Rendere 500 ml di terreno / differenziazione DMSO KSR: 80% knockout DMEM (KO-DMEM), 20% sostituzione knockout siero (KSR), 0,5% Glutamax, 1% aminoacidi non essenziali (NEAA), 0.1 mM beta-mercaptoetanolo, 1% DMSO, e 1% di penicillina / streptomicina (concentrazioni finali a 100 IU / ml e 100 mg / ml, rispettivamente). Filtrare sotto vuoto. Conservare a 4 ° C ed utilizzare entro due settimane.
- Fare 500 ml di terreno di maturazione HepatoZYME: 1% GlutaMAX, 10 micron idrocortisone 21-emisuccinato sale sodico (HCC), e l'1% di penicillina / streptomicina (concentrazioni finali a 100 UI / ml e 100 mg / ml, rispettivamente); alto fino a 500 ml con HepatoZYME terreno di base. NOTA: Conservare il magazzino a 4 ° C ed utilizzare entro due settimane. media un'aliquota dal magazzino e aggiungere HGF fresco e OSM (concentrazioni finali a 10 ng / ml e 20 ng / ml, rispettivamente) per ogni cambio di media.
- hPSCs seme per la differenziazione degli epatociti on LN-521, come descritto nella sezione 1. Se LN-521 / LN-111 deve essere utilizzato come substrato, coprire le piastre con LN-521 e LN-111 (rapporto 1: 3) a la concentrazione laminina finale di 5 mg / mL; il trattamento resto dovrebbe essere uguale piastre LN-521-rivestite puri.
NOTA: LN-521 / LN-111 non è l'ideale per la coltura di routine di hPSCs; viene utilizzato solo per esperimenti di differenziazione. - Controllare la confluenza cella 24 ore dopo la semina. Iniziare la differenziazione cellulare una volta che la confluenza delle cellule raggiunge circa il 40%. Rimuovere il medium mTeSR1 esaurito e aggiungere fresco medio endoderma-priming integrato con 100 ng / mL Activin A e 50 ng / mL Wnt 3a. Chiamare questa differenziazione giorno 1.
NOTA: Si consiglia di avviare la differenziazione il giorno dopo la semina delle cellule. - Cambiare il medio endoderma-priming ogni 24 ore per 3 giorni per le cellule staminali embrionali umane (hESC). Per quanto riguarda le cellule staminali pluripotenti indotte umane (hiPSCs), estendere questa fase per più di 2 giorni per innescare le cellule a cellule endoderma come definitivi, ma utilizzare il mezzo endoderma-priming completate soltanto con 100 ng / mL Activin A per questi due giorni 12 .
NOTA: per garantire le specifiche endoderma di successo, si può esaminare l'espressione di marcatori endodermico, come Foxa2 e SOX17. Secondo immunofluorescenza, oltre l'80% delle cellule derivate sono positivi per entrambi i marcatori nel nostro laboratorio. - Passa a medio KSR / DMSO differenziazione il giorno 4 (per hESC) / giorno 6 (per hiPSCs). Cambiare il medio dAily per i primi 3 giorni e poi il quinto giorno di questa fase di differenziazione.
NOTA: Non alimentazione è necessaria per il quarto giorno di questa fase di differenziazione. Utilizzare senza supplementi KO-DMEM per lavare le cellule una volta prima di medie cambiamento, se ci sono molte cellule morte. Per controllare se la differenziazione per questa fase è successo o meno, si può testare l'espressione di marcatori di cellule progenitrici epatiche, come l'AFP, CK19, e HNF4A. Quasi il 90% delle cellule sarà positivo per questi marcatori sulla base della nostra esperienza. - Dopo 5 giorni della fase di differenziazione KSR / DMSO, passare alla fase di maturazione HepatoZYME. Lavare le cellule una volta con pianura HepatoZYME medio basale dopo la rimozione del mezzo KSR / DMSO. Aggiungere HepatoZYME maturazione medio supplementato con 10 ng / mL HGF e 20 ng / mL OSM.
- Cambiare la media ogni 48 h per 7 - 10 giorni, a quel punto le cellule sono pronte per la caratterizzazione standard o ulteriore utilizzo.
NOTA: epatociti esami di espressione marcatore, metabolichetest di funzionalità (come l'attività del citocromo P450), urea e test di secrezione di albumina, i test da accumulo di glicogeno, e le prove di assorbimento verde indocianina (ICG) sono metodi tipici di caratterizzazione.
NOTA: La linea temporale del protocollo differenziazione è mostrato in Figura 5. Nel nostro laboratorio, abbiamo quotidianamente a controllare i livelli dei derivati »hlcs specifici epatociti espressione marcatore, la secrezione di albumina, e il citocromo P450 3A (CYP) 1A2 e attività.
Risultati
Differenziazione epatocellulare da hPSCs
Una linea umana di cellule staminali embrionali, H9, ed una linea di cellule staminali pluripotenti indotte umane, 33D6, sono stati utilizzati per la differenziazione degli epatociti. I risultati in figure 1-3 sono da cellule H9, mentre quelli in Figura 4 sono da cellule 33D6. Singole cellule seminate su laminine stabilito il contatto cellula-cellula dopo 24 ore. Dopo che le cellule hanno raggiunto circa il 40% di confluenza, il processo di differenziamento è stato avviato (Figura 1A e la figura 4A). Su laminine (sia LN-521 e LN-521 / LN-111), queste cellule ha attraversato cambiamenti morfologici sequenziali, dando luogo alla HLCs polarizzati (Figura 1 e Figura 4A).
Epatociti-come cellulare Caratterizzazione
day 18 HLCs sono stati raccolti e valutati per l'espressione di marcatori epatociti rappresentante, HNF4A e ALB (Figura 2A). Immunostaining del giorno 18 HLCs mostrato che quasi il 90% delle cellule espresso HNF4α (Figura 2B). Queste cellule polarizzate laminine ed esposte un aspetto poligonale, come indicato da E-caderina e F-actina espressione (Figura 2B).
Citocromo P450 (CYP) attività è stata anche valutata. I CYP450 conducono una importante funzione metabolica degli epatociti. Giorno 18 HLCs derivati su una miscela proteica gelatinosa, come Matrigel, LN-521 o LN-521 / LN-111, sono stati testati per l'attività CYP3A. HLCs dimostrato attività CYP3A significativamente maggiore su substrati laminina che su matrigel (Figura 3). È importante sottolineare che, rispetto al epatociti primari umani commerciali (HU1339) Re-plated su questi substrati, HLCs hanno quasi 10 volte più alti livellidi attività CYP3A 10.
La differenziazione delle hiPSCs era simile a quello di hESC. Le cellule esposte cambiamenti sequenziali di aspetto (Figura 4A). HLCs derivati hanno espresso un fattore di trascrizione epatociti chiave, HNF4α (figura 4B), e possedevano attività CYP3A e l'albumina secreto (Figura 4C e D). In particolare, HLCs derivati da 33D6 visualizzata ridotti CYP3A in confronto alle cellule H9 derivate HLCs (Figura 3), ma era ancora paragonabile epatociti primari umani 10. Tuttavia, la secrezione di albumina di questi HLCs era molto inferiore in epatociti primari 10.
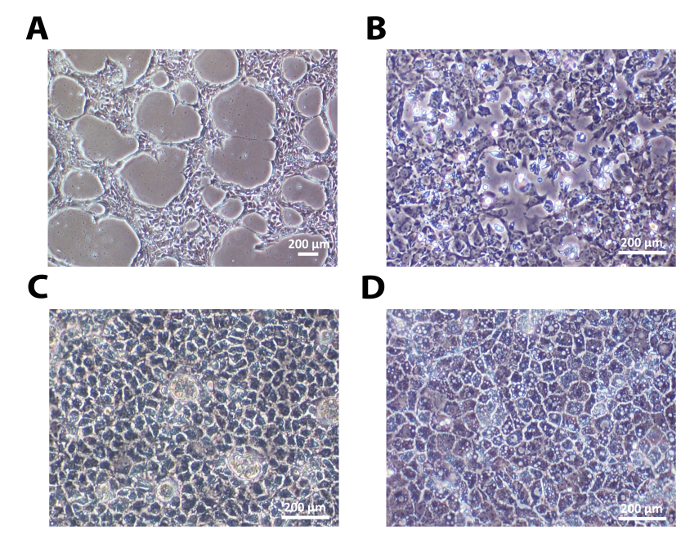
Figura 1: I sequenziali morfologici Le variazioni intervenute epatica differenziazione. </ strong> (A) hESC indifferenziate seminati come singole cellule hanno raggiunto circa il 40% di confluenza 24 ore dopo la semina. (B) dopo aver riempito, le cellule hanno mostrato la tipica morfologia endodermico il giorno 4. (C) Una volta raggiunta la fase hepatoblast-like, hanno mostrato una chiara forma poligonale il giorno 9. (D) Dopo la fase di maturazione, HLCs polarizzati erano pronti per ulteriore caratterizzazione mostrato qui a giorno 18. Scala bar = 200 micron. Clicca qui per vedere una versione più grande di questa figura.
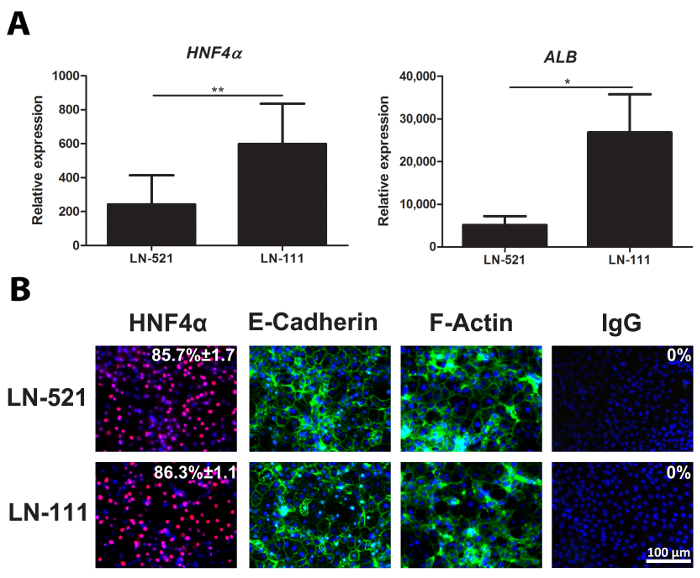
Figura 2: Caratterizzazione dei HLCs. (A) L'espressione genica di marcatori specifici epatociti, HNF4A (a sinistra) e ALB (a destra). Il livello di espressione è stato analizzato utilizzando giorno 18 HLCs derivatida hESC su entrambi LN-521 e LN-521 / LN-111, ed è stato normalizzato per la GAPDH gene housekeeping e ha espresso rispetto al hESC. I risultati rappresentano tre repliche biologiche, e le barre di errore rappresentano la deviazione standard (SD). * P <0.05, ** p <0.01; spaiato t-test. Espressione (B) Le proteine di un indicatore chiave epatica, HNF4α, e gli indicatori di polarizzazione, E-caderina e F-actina. Giorno 18 HLCs su LN-521 e LN-521 / LN-111 sono stati colorati per i marcatori di cui sopra e di contrasto con Hoechst 33342. Un controllo negativo è stata eseguita con il corrispondente immunoglobuline G (IgG). è mostrata la percentuale di cellule HNF4α-positivi e SD. Questo è stato calcolato da quattro campi casuali di vista. Le immagini sono state prese a 20X di ingrandimento. Barra di scala = 100 micron. Clicca qui per vedere una versione più grande di questa figura.
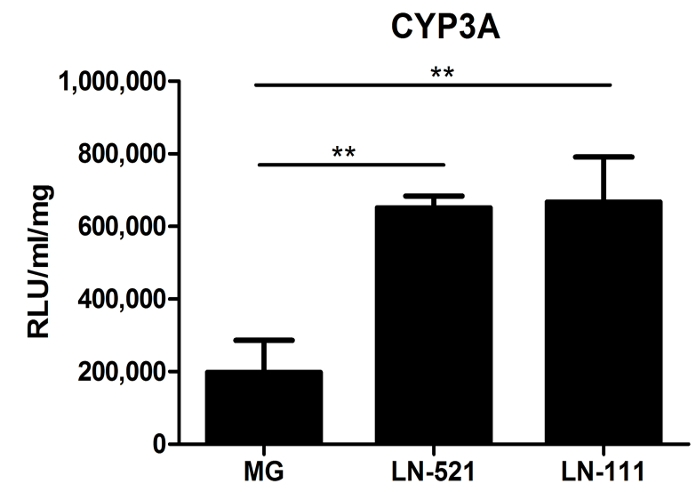
Figura 3: Metabolic Funzione Caratterizzazione di HLCs. Citocromo P450 l'attività del CYP3A di cellule in coltura su Matrigel (MG), LN-521, o LN-521 / LN-111 è stato testato. I dati rappresentano tre repliche biologiche, e le barre di errore rappresentano SD. ** P <0.01; ANOVA con test post-hoc di Tukey. Clicca qui per vedere una versione più grande di questa figura.
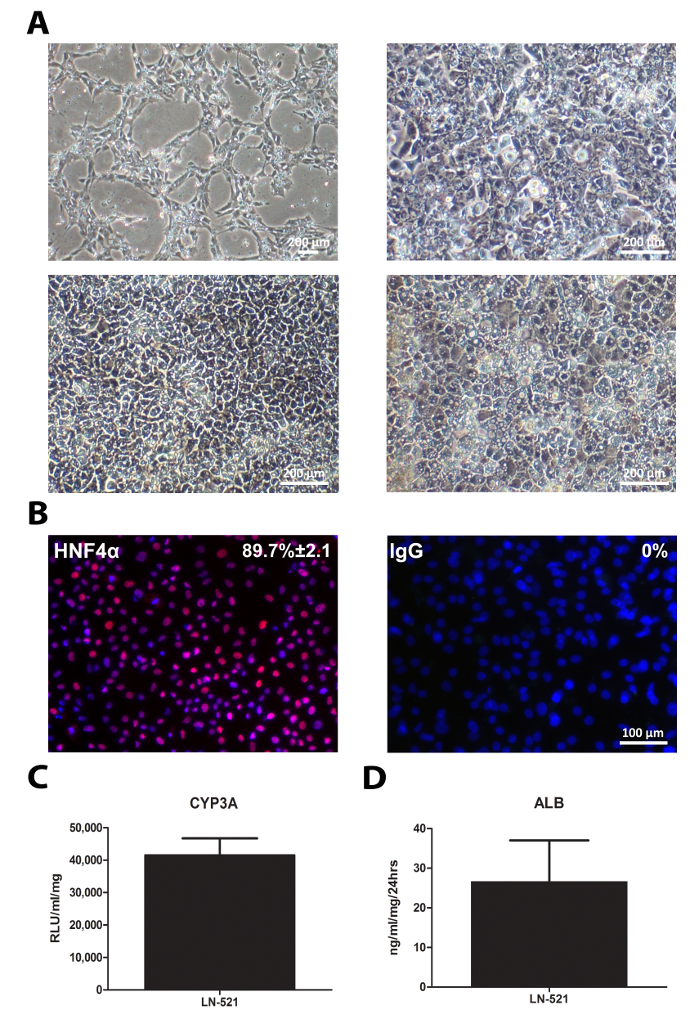
Figura 4: Caratterizzazione standard di HLCs. hiPSCs coltivati su LN-521 sono stati differenziati in HLCs. analisi di caratterizzazione sono stati eseguiti il giorno 17 HLCs. (A) La morfologia sequenziale delle cellule durante la differenziazione epatica; r punti di tempo indicato cellule epresent nei giorni 1, 4, 9 e 17. (B) immunocolorazione di espressione HNF4α. La percentuale di cellule positive e SD è indicata basato su quattro campi casuali di vista. Le immagini sono state prese a 20X di ingrandimento. Barra di scala = 100 micron. (C) l'attività del CYP3A il giorno 17 HLCs. I dati rappresentano sei repliche biologiche, e la barra di errore rappresenta la SD. (D) Albumina secrezione di HLCs derivati oltre 24 ore in coltura. I dati rappresentano quattro repliche biologiche, e la barra di errore rappresenta SD. Clicca qui per vedere una versione più grande di questa figura.

Figura 5: Timeline schematica del protocollo di differenziazione.t = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.
Discussione
Per progredire la ricerca umana pluripotenti cellule staminali e la medicina traslazionale, i sistemi privi di xeno che rispettano sono richieste attuali linee guida di buone prassi di fabbricazione. Legenda qualsiasi processo di differenziazione è la matrice extracellulare (ECM). L'ECM non solo supporta l'adesione cellulare, ma fornisce anche l'accesso ai fattori di segnalazione chiave, che influenzano la determinazione delle cellule e fenotipo 25, 26.
Laminine sono multifunzionali proteine della matrice extracellulare in vivo. Nel fegato, la secrezione di laminina è fondamentale per la rigenerazione epatica dopo epatectomia parziale un 27 ed è necessario per progenitrici epatiche manutenzione cella 28. L'importanza di laminine nella manutenzione del fegato e la rigenerazione è stata la base per testare disponibili in commercio laminine umane ricombinanti nel nostro sistema di differenziazione degli epatociti.
Superior luidifferenziazione patocyte è stato raggiunto sul LN-521 e LN-521 / LN-111 substrati rispetto al Matrigel. HLCs derivati erano chiaramente polarizzati e organizzati nel piatto, e la loro funzione cellulare è stata significativamente migliorata rispetto alle loro controparti miscela proteica gelatinosi. Alla base di questi miglioramenti è stato il down-regulation di contaminare Colon-, fibroblast- e stelo geni delle cellule associate sui laminine, così come una diminuzione della proliferazione cellulare e l'espressione genica di migrazione associate 10.
In conclusione, il protocollo descritto qui genera cellule epatociti-like che sono più vicini in natura per epatociti umani adulti. Il processo è riproducibile, suscettibile di automazione, e può essere conveniente in scala per l'applicazione. Importante, lotto a lotto variazione è stata significativamente ridotta rispetto alle tecniche che utilizzano Matrigel, risultante in un sistema perfezionato per la differenziazione ricercatori in questo campo.
Divulgazioni
Dr. David C. Hay è una co-fondatore e direttore di Stemnovate Limited.
Riconoscimenti
Questo lavoro è stato sostenuto con premi dal medicina rigenerativa piattaforma Regno Unito (MRC MR / L022974 / 1 e MR / K026666 / 1) e una borsa di studio in Cina.
Materiali
| Name | Company | Catalog Number | Comments |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Recombinant Laminin 111 | BioLamina | LN111-02 | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| Human Activin A | Peprotech | 120-14E | |
| Human Hepatocyte Growth Factor | Peprotech | 100-39 | |
| Human Oncostatin M | Peprotech | 300-10 | |
| Rho-associated kinase (ROCK) inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H4881 | |
| DMSO | Sigma-Aldrich | D5879 | |
| mTeSR1 medium | STEMCELL Technologies | 05850 | |
| RPMI 1640 | Life Technologies | 21875 | |
| Knockout DMEM | Life Technologies | 10829 | |
| HepatoZYME | Life Technologies | 17705 | |
| B27 supplement | Life Technologies | 12587-010 | |
| Knockout Serum Replacement | Life Technologies | 10828 | |
| GlutaMax | Life Technologies | 35050 | |
| Non-essential amino acids | Life Technologies | 11140 | |
| 2-mercaptoethanol | Life Technologies | 31350 | |
| Accutase | Millipore | SCR005 | |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 |
Riferimenti
- Forbes, S. J., Gupta, S., Dhawan, A. Cell therapy for liver disease: From liver transplantation to cell factory. J Hepatol. 62 (1 Suppl), S157-S169 (2015).
- Hay, D. C., et al. Highly efficient differentiation of hESCs to functional hepatic endoderm requires ActivinA and Wnt3a signaling. Proc Natl Acad Sci U S A. 105 (34), 12301-12306 (2008).
- Hay, D. C., et al. Direct differentiation of human embryonic stem cells to hepatocyte-like cells exhibiting functional activities. Cloning Stem Cells. 9 (1), 51-62 (2007).
- Medine, C. N., et al. Developing high-fidelity hepatotoxicity models from pluripotent stem cells. Stem Cells Transl Med. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Transl Med. 3 (2), 141-148 (2014).
- Zhou, X., et al. Modulating innate immunity improves hepatitis C virus infection and replication in stem cell-derived hepatocytes. Stem Cell Reports. 3 (1), 204-214 (2014).
- Rashidi, H., Alhaque, S., Szkolnicka, D., Flint, O., Hay, D. C. Fluid shear stress modulation of hepatocyte-like cell function. Arch Toxicol. 90 (7), 1757-1761 (2016).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Transl Med. 5 (6), 764-772 (2016).
- Wang, Y., Hay, D. C. Mass production of stem cell derived human hepatocytes for experimental medicine. Expert Rev Gastroenterol Hepatol. 10 (7), 769-771 (2016).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Cai, J., et al. Directed differentiation of human embryonic stem cells into functional hepatic cells. Hepatology. 45 (5), 1229-1239 (2007).
- Sullivan, G. J., et al. Generation of functional human hepatic endoderm from human induced pluripotent stem cells. Hepatology. 51 (1), 329-335 (2010).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Szkolnicka, D., Farnworth, S. L., Lucendo-Villarin, B., Hay, D. C. Deriving functional hepatocytes from pluripotent stem cells. Curr Protoc Stem Cell Biol. 30, 1-12 (2014).
- Rashid, S. T., et al. Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells. J Clin Invest. 120 (9), 3127-3136 (2010).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Touboul, T., et al. Generation of functional hepatocytes from human embryonic stem cells under chemically defined conditions that recapitulate liver development. Hepatology. 51 (5), 1754-1765 (2010).
- Touboul, T., et al. Stage-specific regulation of the WNT/beta-catenin pathway enhances differentiation of hESCs into hepatocytes. J Hepatol. 64 (6), 1315-1326 (2016).
- Mathapati, S., et al. Small-Molecule-Directed Hepatocyte-Like Cell Differentiation of Human Pluripotent Stem Cells. Curr Protoc Stem Cell Biol. 38, 1-1 (2016).
- Takayama, K., et al. Efficient generation of functional hepatocytes from human embryonic stem cells and induced pluripotent stem cells by HNF4alpha transduction. Mol Ther. 20 (1), 127-137 (2012).
- Rodin, S., et al. Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511. Nat Biotechnol. 28 (6), 611-615 (2010).
- Rodin, S., et al. Clonal culturing of human embryonic stem cells on laminin-521/E-cadherin matrix in defined and xeno-free environment. Nat Commun. 5, 3195 (2014).
- Takayama, K., et al. Long-term self-renewal of human ES/iPS-derived hepatoblast-like cells on human laminin 111-coated dishes. Stem Cell Reports. 1 (4), 322-335 (2013).
- Medine, C. N., Lucendo-Villarin, B., Zhou, W., West, C. C., Hay, D. C. Robust generation of hepatocyte-like cells from human embryonic stem cell populations. J Vis Exp. (56), e2969 (2011).
- Sales, V. L., et al. Transforming growth factor-beta1 modulates extracellular matrix production, proliferation, and apoptosis of endothelial progenitor cells in tissue-engineering scaffolds. Circulation. 114 (1 Suppl), I193-I199 (2006).
- Taylor-Weiner, H., Schwarzbauer, J. E., Engler, A. J. Defined extracellular matrix components are necessary for definitive endoderm induction. Stem Cells. 31 (10), 2084-2094 (2013).
- Martinez-Hernandez, A., Delgado, F. M., Amenta, P. S. The extracellular matrix in hepatic regeneration. Localization of collagen types I, III, IV, laminin, and fibronectin. Lab Invest. 64 (2), 157-166 (1991).
- Lorenzini, S., et al. Characterisation of a stereotypical cellular and extracellular adult liver progenitor cell niche in rodents and diseased human liver. Gut. 59 (5), 645-654 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon