Method Article
Sistema de cultivo de órganos de grasa corporal en Aedes Aegypti, Vector del Virus Zika
En este artículo
Resumen
La grasa corporal es el órgano metabólico central en insectos. Presentamos un sistema de cultivo de órgano vivo que permite al usuario estudiar las respuestas del tejido corporal de grasa aislados a varios estímulos.
Resumen
El insecto grasa corporal desempeña un papel central en el metabolismo de insectos y almacenamiento de nutrientes, reflejo de las funciones del hígado y del tejido graso en los vertebrados. Insectos cuerpo grasa tejido generalmente se distribuye en todo el cuerpo del insecto. Sin embargo, a menudo es concentrada en el abdomen y atado a la pared abdominal del cuerpo.
El mosquito grasa corporal es la única fuente de proteínas de la yema de huevo, que son críticos para la producción de huevo. Por lo tanto, el cultivo en vitro de los tejidos de grasa corporal de mosquito representa un sistema importante para el estudio de la fisiología del mosquito, metabolismo y, en última instancia, la producción de huevos. El proceso de cultura de la grasa corporal comienza con la preparación de soluciones y reactivos, incluyendo soluciones del aminoácido, Aedes suero fisiológico solución stock (APS), solución madre de calcio y grasa corporal medio de cultivo. El proceso continúa con la disección de la grasa corporal, seguida de un tratamiento experimental. Después del tratamiento, puede realizarse una variedad de diferentes análisis, incluyendo RNA (RNA-Seq) de la secuencia, qPCR, Western Blot, proteómica y metabolómica.
En nuestro experimento ejemplo, demostramos el protocolo a través de la supresión y la cultura de cuerpos grasos del mosquito de la fiebre amarilla, Aedes aegypti, principal vector de arbovirus incluyendo Zika, dengue y chikungunya. ARN de cuerpos grasos cultivadas bajo una condición fisiológica conocida a proteínas de yema de huevo alza versus el control fueron sometidos a análisis de RNA-Seq para demostrar la potencial utilidad de este procedimiento para las investigaciones de la expresión génica.
Introducción
Los mosquitos son vectores de enfermedades humanas devastadoras, incluyendo la malaria, dengue, Fiebre chikungunya y Zika1,2,3. A pesar de intensos esfuerzos internacionales para frenar estas enfermedades y para controlar las poblaciones de mosquitos transmisores de enfermedades, brotes epidémicos de enfermedades transmitidas por el mosquito son aún campo común, especialmente en los países en desarrollo. Vacunas efectivas contra muchas de estas enfermedades son de carácter o de eficacia limitada4,5. La forma más efectiva para prevenir brotes es controlar las poblaciones de mosquitos, principalmente mediante el uso de tratamientos insecticidas. Sin embargo, la resistencia a los insecticidas ha desarrollado en muchas poblaciones de mosquitos y convertido en un problema común en el mundo6,7,8. El estudio de la fisiología del mosquito es esencial para el desarrollo de nuevas herramientas y estrategias para el control de la enfermedad.
El mosquito grasa corporal desempeña un papel central en el almacenamiento de nutrientes, la homeostasis metabólica, reproducción y xenobióticos catabolismo9,10,11,12. Es el órgano de almacenamiento principal para triglicéridos, glucógeno y aminoácidos en forma de proteínas de almacenamiento de información. También funciona como lugar de síntesis para la mayoría de las proteínas de la hemolinfa y metabolitos. En los mosquitos, la grasa corporal es la única fuente de producción de proteínas de yema de huevo que se produce en las mujeres después de que una comida de sangre13,14.
El tipo de célula principal de la grasa corporal es la trophocyte grande, poliploide o adipocito3,9,10,12. Tejido de la grasa corporal se organiza en lóbulos o vainas y puede encontrarse en todas partes del cuerpo del mosquito, con la porción más grande situada en el abdomen, donde grandes lóbulos de grasa corporal se adhieren a la pared abdominal del cuerpo.
El sistema de cultivo de mosquitos grasa corporal presentado aquí fue desarrollado en los años 70 y sigue siendo una poderosa herramienta para el estudio de grasa corporal fisiología10, especialmente en combinación con las tecnologías actuales de análisis. El fundamento de esta técnica se basa en el aislamiento de las paredes abdominales del cuerpo y el tejido de grasa corporal asociada. La naturaleza hidrofóbica de la cutícula abdominal hace que flote en la superficie del medio de cultivo, con los lóbulos conectados de abdominal grasa corporal sumergido. Los espiráculos y la estructura tracheolar se mantienen, asegurando la oxigenación de los tejidos cultivados. En adelante, nos referiremos a estas preparaciones como "cuerpos grasos". Cuerpos aislados de grasa permanecen viables durante más de 12 horas cuando se incuban en medio apropiado (resultados no publicados). Cultura de la grasa corporal es una herramienta valiosa que ha abordado una variedad de preguntas sobre grasa corporal Endocrinología y fisiología9,10,12,15,16, 17.
Cuerpos grasos cultivados puede someterse a varios experimentales y control de tratamientos, el momento en que puede ser decidido por el investigador. Al final de la incubación, los órganos de grasa puede recabados y tratados para los análisis posteriores, incluyendo qPCR16,17,18,19, Western Blot18 ,20,21de la proteómica o metabolómica22. Experimentos pueden realizarse en diferentes escalas, desde cuerpos de grasa individuales a grupos de cientos que pueden ser cultivadas juntas.
Los resultados representativos incluidos aquí fueron derivados de cuerpos grasos, cultivados en presencia de los aminoácidos y la ecdisona 20-hidroxi de la hormona esteroide para simular la activación de la harina de sangre de vitelogénesis16,17, 23,24. Había analizado y había comparado la expresión génica diferencial de no activado versus activados cuerpos grasos mediante análisis de secuenciación de próxima generación.
Protocolo
1. preparación de las soluciones y reactivos
- solución madre de ácido Amino
- preparar 4 X aminoácidos solución 23 , 24 por peso y agregar los 20 aminoácidos diferentes a un matraz de Erlenmeyer según las concentraciones dadas en la tabla 1.
Nota: En algunos casos, amino acid(s) puede ser excluido de la solución y sustituido por cantidades molares iguales de manitol para mantener una concentración igual de osmolitos. - Añadir la cantidad apropiada de ddH 2 O para producir el volumen deseado de solución.
- Para asegurarse de que los aminoácidos han disuelto completamente, calentar suavemente agitando continuamente hasta que el líquido quede totalmente claro, tendrá un leve tono amarillo.
Nota: Puede ser necesario reducir el pH a 6 mediante la adición de ácido clorhídrico para permitir que algunos de los aminoácidos más hidrofóbicos para disolver. - Alicuotar la solución y filtro estéril usando un filtro de jeringa con un 0.2 μm tamaño de poro.
- Almacén en un envase sellado a-20 ° C hasta por 6 meses.
- preparar 4 X aminoácidos solución 23 , 24 por peso y agregar los 20 aminoácidos diferentes a un matraz de Erlenmeyer según las concentraciones dadas en la tabla 1.
- APS
Nota: ver 25.- Para el 20 X sal solución, combinar las sales enumeradas en la tabla 2 en 50 mL de agua. Mezclar hasta que se haya disuelto por completo.
Nota: Puede ser necesario calentar ligeramente la solución para disolver completamente las sales. - Filtro estéril usando un filtro de jeringa con un 0.2 μm tamaño de poro y guarde la solución en un tubo de 50 mL a -20 ° C.
- Para el 20 X sal solución, combinar las sales enumeradas en la tabla 2 en 50 mL de agua. Mezclar hasta que se haya disuelto por completo.
- Solución calcio
- para 50 X solución calcio, añadir a 100 mL de agua (tabla 3) 0,90 g de cloruro de calcio, mezclar hasta que se disuelva completamente.
- Utilizando una jeringa estéril-filtro filtro con un tamaño de poro de 0.2 μm, alícuota de la solución en tubos de 50 mL y almacenar a -20 ° C.
- Buffer Tris (pH 7.4)
- para el Tris almacenador intermediario, combinar las soluciones enumeradas en la tabla 4 y sal y añadir ddH 2 O hasta 100 mL.
- Utilizando una jeringa estéril-filtro filtro con un tamaño de poro de 0,2 μm y una parte alícuota de la solución en tubos de 50 mL, almacenar a temperatura ambiente.
- Grasa corporal medio de cultivo
- para preparar el medio de cultivo de la grasa corporal, preparar todas las soluciones mencionadas.
- Combinar según los volúmenes en la tabla 5 para hacer 200 mL de medio de cultivo de la grasa corporal.
- Ajustar el pH a 7.2 con NaOH o HCl.
- Filtro estéril la solución utilizando un filtro de jeringa con un tamaño de poro de 0.2 μm.
- Dividir la solución en alícuotas de 15 mL y almacenar a-20 ° C hasta por 6 meses.
2. Preparación para la disección
- preparar un estereomicroscopio (aumento de x 10-20) con la iluminación y colocar dos pinzas muy finas y un par de tijeras de disección micro.
- Preparar todas las soluciones necesarias para el experimento. Descongelar el medio de cultivo de la grasa corporal a temperatura ambiente.
Nota: Los precipitados pueden disolver calentando suavemente la solución a no superior a 30 ° C. - Con un aspirador, recoger los mosquitos hembras adultos (3-7 días después de la emergencia) y anestesiarlos usando dióxido de carbono o hielo.
Nota: Una vez anestesiados, los mosquitos deben guardarse bajo CO 2 para el menor tiempo posibles, no superior a 20 minutos o bien, los mosquitos pueden ser anestesiados en hielo y durante aproximadamente 30 minutos - Prepare una placa de la pozo de 6 con 3 mL de APS por bien.
3. Disección de la grasa corporal
- enfocar la disección Estereomicroscopio y ajustar la silla a una altura cómoda.
- Colocar un portaobjetos cóncavo en la superficie de microscopio y añadir dos gotas de APS para el centro.
- Recoger un mosquito por una pierna usando un fórceps y transferirla a la superficie de la APS en el portaobjetos.
- Cuidadosamente y agarre el mosquito por el tórax, con las pinzas en la mano izquierda y gire el mosquito para que el lado ventral hacia arriba.
- Sosteniendo el cuerpo constante por el tórax, sujete los dos últimos segmentos abdominales, con las pinzas en la mano derecha y tire suavemente de.
Nota: Los dos últimos segmentos abdominales va a separar del abdomen y los ovarios adjuntos, Malpighi túbulos, hindgut y midgut; a veces el cultivo se deslizará fuera del abdomen. Si no han sido removidos, inserte las puntas cerradas de las pinzas en el pequeño orificio creado y remover el tejido restante. - Apartar la pinza derecha y coger las tijeras de la primavera. Deslice una hoja en el orificio en el abdomen hasta el segmento a continuación del tórax. Suavemente y rápidamente cortar el abdomen longitudinalmente.
Nota: Una vez realizado el corte, el abdomen debe comenzar a expandirse hacia el exterior, aunque esto puede no ocurrir inmediatamente. - Proceder a realizar el segundo corte, que será un corte lateral por debajo del tórax y ligeramente por debajo de donde terminó el primer corte.
Nota: El abdomen debe abrir y disociar el tórax, con la cutícula hacia arriba y los órganos de grasa lado inmerso dentro de la APS. Este cuerpo de la pared abdominal es la preparación de la grasa corporal en vitro cultura. - Levante los cuerpos grasos de la solución APS con la punta de un par de pinzas y transferirlas desde la solución a la placa de 6 pozos con APS a temperatura ambiente. Permitir que el tejido reposar aproximadamente 0,5 h antes de avanzar a la cultura de la grasa corporal.
4. Grasa corporal cultura
- incubar los cuerpos grasos en APS a temperatura ambiente durante por lo menos 0.5 h a que se equilibren los.
- Transferir los órganos de grasa utilizando la punta de las pinzas y con cuidado saque la solución APS. Bajar la punta en el medio de cultivo de grasa corporal.
Nota: La grasa corporal debe abrir en la superficie del medio y flotar libremente. La cultura de la grasa corporal se realiza generalmente en placas de 96 pocillos, con 150-200 μL de medio en cada pozo. Uno bien puede caber hasta tres cuerpos individuales de la grasa, y son viables por más de 12 h (no publicados resultados personales). - Después de la incubación, transferir los órganos de grasa del medio en tubos de centrífuga de 1,5 mL que contienen los reactivos adecuados para el procesamiento de abajo.
Nota: Los análisis típicos incluyen qPCR 16 , 17 , 18 , 19, Western Blot 18 , 20, 26 de la transcriptómica, proteómica 21 o metabolómica 22.
Resultados
Como ejemplo, realizamos un experimento de cultivo de la grasa corporal y estimulados cuerpos aislados de grasa por la incubación en una solución que contiene una mezcla equilibrada de los veinte aminoácidos que ocurren naturalmente y la ecdisona 20-hidroxi de insectos hormona esteroide (10 μm) durante 6 h . Como control, cuerpos grasos se incubaron en APS para la misma cantidad de tiempo.
Después de la incubación, el RNA total fue aislado usando un tri-reactivo27 siguiendo las instrucciones del fabricante. La calidad y cantidad de muestras de RNA extraídas se evaluaron utilizando un espectrofotómetro, cuantificación fluorométrica y electroforesis en gel de agarosa. Las bibliotecas de la secuencia de RNA se generaron usando 4 μg de ARN total y se cuantificaron usando dos técnicas diferentes. Posteriormente, las bibliotecas fueron enviadas a un proveedor comercial de secuenciación del extremo apareado.
Los resultados de este experimento se muestran en la tabla 6. Genes que muestran la más fuerte respuesta transcripcional a aminoácidos y 20-hydroxyecdysone fueron principalmente yema proteína los genes, que está de acuerdo con anteriores resultados11.
La figura 1 muestra un mapa que indica los niveles de expresión de gene de 1.256 diferencialmente expresados genes de cuerpos grasos cultivados después de dos tratamientos diferentes.
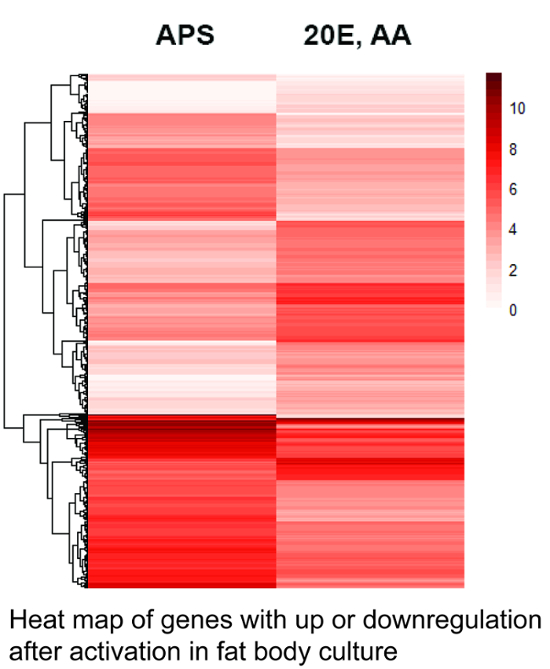
Figura 1 . Mapa de genes expresados en la cultura de la grasa corporal. El mapa de calor se calculó con base en el número de las transcripciones específicas para cada gen en las diferentes bibliotecas con el mapa de calor paquete28 que es parte del entorno de software de R. La sombra más oscura representa la mayor expresión de genes. 1.256 genes con variación estadísticamente significativa en la expresión (valores de Q < 0.05) se muestran. Los genes se ordenan según su nivel de expresión promedio, indicada por el dendrograma de la izquierda (no según sus relaciones filogenéticas). Tenga en cuenta el elevado número de genes con expresión regulada hacia arriba o abajo después del estímulo con aminoácidos (AA) y 20-hydroxyecdysone (20E). APS = Aedes fisiológico. Ver archivo suplementario 1 para una lista de genes y su expresión relativa. Haga clic aquí para ver una versión más grande de esta figura.
| Del aminoácido | Peso molecular g/mol | m concentración | mg por litro | mg de volumen 300 mL |
| Alanina | 89.1 | 26.68 | 2377.19 | 713.16 |
| Arginina | 174.2 | 26.68 | 4647.66 | 1394.3 |
| Asparragina | 150.1 | 26.68 | 4004.67 | 1201.4 |
| Ácido aspártico | 133 | 26.68 | 3548.44 | 1064.53 |
| Cisteína | 121.16 | 10.68 | 1293.99 | 388.2 |
| Ácido glutámico | 147.1 | 26.68 | 3924.63 | 1177.39 |
| Glutamina | 146 | 26.68 | 3895.28 | 1168.58 |
| Glicina | 75 | 53.32 | 3999 | 1199.7 |
| Histidina | 155.16 | 80 | 12412.8 | 3723.84 |
| Isoleucina | 131 | 10.68 | 1399.08 | 419.72 |
| Lycine | 183 | 26.68 | 4882.44 | 1464.73 |
| Leucina | 131 | 26.68 | 3495.08 | 1048.52 |
| Fenilalanina | 165 | 10.68 | 1762.2 | 528.66 |
| Prolina | 115 | 26.68 | 3068.2 | 920.46 |
| Serina | 105 | 53.32 | 5598.6 | 1679.58 |
| Treonina | 119 | 10.68 | 1270.92 | 381.28 |
| Triptófano | 204 | 10.68 | 2178.72 | 653.62 |
| Tirosina | 181 | 5.32 | 962.92 | 288.88 |
| Valina | 117 | 10.68 | 1249.56 | 374.87 |
| Metionina | 149 | 10.68 | 1591.32 | 477.4 |
Tabla 1. 4 solución madre de ácido Amino.
| Componente | Peso en gramos a 50 ml ddH2O |
| NaCl | 8.0 g |
| KCl | g 0,074 |
| MgCl2-6 H2O | 0,120 g |
| NaHCO3 | 0,0250 g |
Tabla 2. 20 X sal solución.
| Componente | Peso en gramos agregados a 100 ml ddH2O |
| CaCl2-2 H2O | g 0,90 |
g > tabla 3. 50 x solución calcio.
| Componente | Concentración de la solución madre | Valores de volumen de 100 ml de tampón |
| PH8.0 Tris | 1 M | 5 mL |
| EDTA | 0.25 M | 2 mL |
| NaCl | NA | 0.3 g |
| ddH2O | NA | a 100 mL (~ 93 mL) |
Cuadro 4. Tampón Tris.
| Componente | Valores de volumen de 200 ml |
| Solución madre de ácido amino | 150 mL |
| Solución de sal común | 10 mL |
| Calcio solución | 4 mL |
| TES Buffer | 10 mL |
| ddH2O | 26 mL |
Tabla 5. Medio de cultivo de la grasa corporal.
| Anotación | Descripción gene | Doble cambio | Valor de P |
| AAEL006138 | Vitelogenina-B | 3443 | 2.52E-112 |
| AAEL006126 | Vitelogenina-C | 2795 | 8.64E-91 |
| AAEL006563 | Carboxipeptidasa vitelogénicos | 1002 | 2.17E-119 |
| AAEL010434 | Vitelogenina-A | 220 | 1.14E-27 |
| AAEL006542 | Carboxipeptidasa vitelogénicos | 185 | 2.14E-65 |
| AAEL012678 | AAEL003006-PA [Aedes aegypti](65%) | 96 | 4.00E-70 |
| AAEL000080 | proteína hipotética | 82 | 6.69E-188 |
| AAEL015312 | Vitelógenas catepsina B | 77 | 1.27E-15 |
| AAEL009588 | receptor nuclear 3 | 75 | 4.58E-56 |
| AAEL010529 | proteína hipotética | 66 | 1.32E-29 |
Tabla 6. Experimentales resultados.
Archivo suplementario 1. Haga clic aquí para descargar este archivo.
Discusión
Cultivo insectos se utiliza ampliamente para el estudio de Endocrinología de insectos, el desarrollo y metabolismo, así como a investigar la interacción entre órganos específicos y simbiontes bacterianos29,30,31, 32,33,34. Cultivo in vitro grasa corporal se utilizó específicamente para estudiar el transporte de aminoácidos y la regulación de la producción de proteínas de yema de huevo en los mosquitos y otros dípteros16,17,35 , 36. durante el proceso de vitelogénesis, el mosquito grasa corporal utiliza una gran variedad de transportadores de aminoácidos de alta especificidad para importar los aminoácidos derivados de la harina de sangre de la hemolinfa para sintetizar grandes cantidades de proteínas de yema de huevo12 ,19,35,36. Grasa corporal cultura contribuyó a la determinación de los requerimientos nutricionales de la grasa corporal en este contexto18.
La calidad del material de partida, los mosquitos hembra, es fundamental para el éxito de estos experimentos. Larvas de mosquitos criados en condiciones de hacinamiento bajo y alimentados con dietas altas en nutrientes generalmente producen los mejores resultados. Existen algunas variables importantes a tener en cuenta al establecer las condiciones de cultivo de mosquitos grasa corporal en el laboratorio en cuanto al diseño experimental. Hemos mostrado en estudios anteriores que la expresión de genes de la grasa corporal varía significativamente dependiendo de la historia de la vida individual y el estado nutricional de los mosquitos11,22. Las condiciones de cultivo del mosquito deben ser uniformes y para reducir la variabilidad en el tamaño y las reservas nutricionales de los mosquitos experimentales. Además, personal que realiza las disecciones debería ser entrenado para disecciones rápidas y exactas con resultados consistentes. Viabilidad celular en cuerpos aislados de grasa puede ser comprobado utilizando de37,de métodos de tinción diferentes38.
El diseño experimental de un experimento de cultivo de grasa corporal debe tener en cuenta el número de disecciones posible en un determinado período de tiempo. Cuando grandes cantidades de cuerpos grasos son necesarias, pueden ser necesarios varias sesiones de disección o disectores múltiples. Hay una amplia gama de aplicaciones futuras en vitro cultura de grasa corporal de los mosquitos y otros insectos. Será especialmente útil para probar posibles candidatos de medicamentos para control de insectos. El uso de técnicas transgénicas en insectos para expresar proteínas específicas reportero en trophocytes grasa corporal abrirá nuevos métodos para el desarrollo de pruebas biológicas de gran alcance para el estudio de la fisiología de la grasa corporal.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Esta investigación fue apoyada por subvenciones de NIH #SC1AI109055, el 2014 NMSU HHMI grant #52008103 y PGR NSF grant #1238731. Agradecemos a los participantes de la clase de NMSU primavera 2015 BIOL302 Molecular métodos y Lavesh Bhatia por su apoyo técnico con los experimentos de la cultura de la grasa corporal.
Materiales
| Name | Company | Catalog Number | Comments |
| Scissors | Fiskars | 83872 | |
| Fly pad | Genesee Scientific | 789060 | |
| Battery-powered aspirator w/ collection vial | Hausherrs Machine Works, Inc. | 3740-01-210-2368 | |
| Fine tip forceps | World Precision Instruments, Inc. | 500085 | |
| Light microscope | Leica Microsystems | ||
| 96 well plate | Sigma | CL S3383 | |
| Sucrose | Sigma | S9378 | |
| Alanine | Sigma | A7627 | |
| Arginine | Sigma | A5006 | |
| Asparagine | Sigma | A0884 | |
| Aspartic Acid | Sigma | A9256 | |
| Cysteine | Sigma | W326305 | |
| Glutamic Acid | Sigma | G1251 | |
| Glutamine | Sigma | G3126 | |
| Glycine | Sigma | G2879 | |
| Histidine | Sigma | H6034 | |
| Isoleucine | Sigma | I2752 | |
| Lysine | Sigma | L5501 | |
| Leucine | Sigma | L8000 | |
| Phenylalanine | Sigma | P2126 | |
| Proline | Sigma | P0380 | |
| Serine | Sigma | S4500 | |
| Threonine | Sigma | T8625 | |
| Tryptophan | Sigma | T0254 | |
| Tyrosine | Sigma | T3754 | |
| Valine | Sigma | V0500 | |
| Methionine | Sigma | M9625 | |
| NaCl | Sigma | S7653 | |
| KCl | Sigma | P9333 | |
| MgCl2-6H2O | Sigma | M2670 | |
| NaHCO3 | Sigma | S5761 | |
| CaCl2-2H2O | Sigma | C8106 | |
| Tris pH8.0 | Sigma | T1503 | |
| EDTA | Sigma | E6758 | |
| ddH2O | Sigma | W4502 |
Referencias
- Benelli, G., Mehlhorn, H. Declining malaria, rising of dengue and Zika virus: insights for mosquito vector control. Parasitol Res. 115 (5), 1747-1754 (2016).
- Newby, G., et al. The path to eradication: a progress report on the malaria-eliminating countries. Lancet. 387 (10029), 1775-1784 (2016).
- Clements, A. N. . The Biology of Mosquitoes. 2, (1992).
- Long, C. A., Zavala, F. Malaria vaccines and human immune responses. Curr Opin Microbiol. 32, 96-102 (2016).
- Mendis, K. N., David, P. H., Carter, R. Human immune responses against sexual stages of malaria parasites: considerations for malaria vaccines. Int J Parasitol. 20 (4), 497-502 (1990).
- Frings, S., Lindemann, B. Odorant response of isolated olfactory receptor cells is blocked by amiloride. J Membr Biol. 105 (3), 233-243 (1988).
- Froese, A., Szyszka, P., Menzel, R. Effect of GABAergic inhibition on odorant concentration coding in mushroom body intrinsic neurons of the honeybee. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 183-195 (2014).
- Yewhalaw, D., et al. Multiple insecticide resistance: an impediment to insecticide-based malaria vector control program. PLoS One. 6 (1), e16066 (2011).
- Arrese, E. L., Soulages, J. L. Insect fat body: energy, metabolism, and regulation. Annu Rev Entomol. 55, 207-225 (2010).
- Raikhel, A. S., Deitsch, K. W., Sappington, T. W., Crampton, J. M., Beard, C. B., Louis, C. . The Molecular Biology of Insect Disease Vectors: A Methods Manual. , 507-522 (1997).
- Price, D. P., et al. The fat body transcriptomes of the yellow fever mosquito Aedes aegypti, pre- and post- blood meal. PLoS One. 6 (7), e22573 (2011).
- Hansen, I. A., Attardo, G. M., Rodriguez, S. D., Drake, L. L. Four-way regulation of mosquito yolk protein precursor genes by juvenile hormone-, ecdysone-, nutrient-, and insulin-like peptide signaling pathways. Front Physiol. 5, 103 (2014).
- Raikhel, A. S., Dhadialla, T. S. Accumulation of yolk proteins in insect oocytes. Annu Rev Entomol. 37, 217-251 (1992).
- Raikhel, A. S., et al. Molecular biology of mosquito vitellogenesis: from basic studies to genetic engineering of antipathogen immunity. Insect Biochem Mol Biol. 32 (10), 1275-1286 (2002).
- Hansen, I. A., Attardo, G. M., Chandrasekar, R. Ch. 6. Short Views on Insect Molecular Biology. , (2009).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proc Natl Acad Sci USA. 101 (29), 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. J Biol Chem. 280 (21), 20565-20572 (2005).
- Attardo, G. M., Hansen, I. A., Shiao, S. H., Raikhel, A. S. Identification of two cationic amino acid transporters required for nutritional signaling during mosquito reproduction. J Exp Biol. 209 (Pt 16), 3071-3078 (2006).
- Carpenter, V. K., et al. SLC7 amino acid transporters of the yellow fever mosquito Aedes aegypti and their role in fat body TOR signaling and reproduction. J Insect Physiol. 58 (4), 513-522 (2012).
- Attardo, G. M., Higgs, S., Klingler, K. A., Vanlandingham, D. L., Raikhel, A. S. RNA interference-mediated knockdown of a GATA factor reveals a link to anautogeny in the mosquito Aedes aegypti. Proc Natl Acad Sci USA. 100 (23), 13374-13379 (2003).
- Hugo, L. E., et al. Proteomic biomarkers for ageing the mosquito Aedes aegypti to determine risk of pathogen transmission. PLoS One. 8 (3), e58656 (2013).
- Price, D. P., Schilkey, F. D., Ulanov, A., Hansen, I. A. Small mosquitoes, large implications: crowding and starvation affects gene expression and nutrient accumulation in Aedes aegypti. Parasit Vectors. 8, 252 (2015).
- Uchida, K., et al. Induction of oogenesis in mosquitoes (Diptera: Culicidae) by infusion of the hemocoel with amino acids. J Med Entomol. 38 (4), 572-575 (2001).
- Uchida, K., Ohmori, D., Yamakura, F., Suzuki, K. Changes in free amino acid concentration in the hemolymph of the female Culex pipiens pallens (Diptera: Culicidae), after a blood meal. J Med Entomol. 27 (3), 302-308 (1990).
- Hayes, E. Determination of a physiological saline solution for Aedes aegypti .(L). J Econ Entomol. 46 (4), 624-627 (1953).
- Price, D. P., et al. The Fat Body Transcriptomes of the Yellow Fever Mosquito Aedes aegypti, Pre- and Post Blood Meal. Plos One. 6 (7), e22573 (2011).
- Chomczynski, P., Mackey, K. Short technical reports. Modification of the TRI reagent procedure for isolation of RNA from polysaccharide-and proteoglycan-rich sources. Biotechniques. 19 (6), 942-945 (1995).
- Fujiwara, T., Kazawa, T., Haupt, S. S., Kanzaki, R. Postsynaptic odorant concentration dependent inhibition controls temporal properties of spike responses of projection neurons in the moth antennal lobe. PLoS One. 9 (2), e89132 (2014).
- Larsen, W. P. Growth in an insect organ culture. J Insect Physiol. 13 (4), 613-619 (1967).
- Judy, K. J., et al. Isolation, Structure, and Absolute Configuration of a New Natural Insect Juvenile Hormone from Manduca sexta. Proc Natl Acad Sci USA. 70 (5), 1509-1513 (1973).
- Marks, E. P. The action of hormones in insect cell and organ cultures. Gen Comp Endocrinol. 15 (2), 289-302 (1970).
- Hughes, G. L., Pike, A. D., Xue, P., Rasgon, J. L. Invasion of Wolbachia into Anopheles and Other Insect Germlines in an Ex vivo Organ Culture System. PLoS One. 7 (4), e36277 (2012).
- Postlethwait, J. H., Handler, A. M. Roles of Juvenile-Hormone and 20-Hydroxy-Ecdysone during Vitellogenesis in Isolated Abdomens of Drosophila melanogaster. J Insect Physiol. 25 (5), 455-460 (1979).
- Spielman, A., Gwadz, R. W., Anderson, W. A. Ecdysone-initiated ovarian development in mosquitoes. J Insect Physiol. 17 (10), 1807-1814 (1971).
- Boudko, D. Y., et al. Substrate specificity and transport mechanism of amino-acid transceptor Slimfast from Aedes aegypti. Nat Commun. 6, 8546 (2015).
- Fleischer, J., Bumbalo, R., Bautze, V., Strotmann, J., Breer, H. Expression of odorant receptor Olfr78 in enteroendocrine cells of the colon. Cell Tissue Res. 361 (3), 697-710 (2015).
- Jones, K. H., Senft, J. A. An improved method to determine cell viability by simultaneous staining with fluorescein diacetate-propidium iodide. J Histochem Cytochem. 33 (1), 77-79 (1985).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. A3B, (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados