Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo de hemaglutinación optimizado inhibición (HI) para cuantificar los títulos de anticuerpos específicos de la gripe
* Estos autores han contribuido por igual
En este artículo
Resumen
Los protocolos presentados describen cómo realizar un ensayo de inhibición de hemaglutinación para cuantificar los títulos de anticuerpos específicos de la gripe de las muestras de suero de los receptores de la vacuna de influenza. El primer ensayo determina las concentraciones óptimas de antígeno viral por hemaglutinación. El segundo ensayo cuantifica los títulos de anticuerpos específicos de la gripe por inhibición de la hemaglutinación.
Resumen
Títulos de anticuerpos se utilizan como marcadores sustitutos para protección serológica contra la gripe y otros gérmenes patógenos. Conocimiento detallado de la producción de anticuerpos pre y post vacunación es necesaria para comprender la inmunidad inducida por la vacuna. Este artículo describe un protocolo confiable de punto por punto para determinar títulos de anticuerpos específicos de la gripe. El primer protocolo describe un método para especificar la cantidad de antígeno necesaria para hemaglutinación, que normaliza las concentraciones para su uso posterior en el segundo protocolo (análisis de hemoaglutinación, prueba HA). El segundo protocolo describe la cuantificación de los títulos de anticuerpos específicos de la gripe frente a diferentes cepas virales mediante el uso de una dilución seriada de humano del suero o la célula cultura sobrenadantes (ensayo de inhibición de hemaglutinación, ensayo de HI).
Aplicada por ejemplo, se muestra la respuesta de anticuerpos de un grupo sano, que recibió una vacuna antigripal inactivada trivalente. Además, se muestra la reactividad cruzada entre el virus de la gripe diferentes y se explican métodos para minimizar la reactividad cruzada usando diferentes tipos de animales células de sangre rojas (RBCs). La discusión destaca ventajas y desventajas de los ensayos presentados y cómo la determinación de títulos de anticuerpos específicos de la gripe puede mejorar la comprensión de la inmunidad relacionada con la vacuna.
Introducción
Infección con el virus de la influenza se asocia con considerable morbilidad, mortalidad y altos costos de cuidado de la salud1,2,3,4. En particular, ancianos, recién nacidos, mujeres embarazadas y pacientes con enfermedad crónica están en riesgo para los resultados clínicos más severos. Por lo tanto, la vacunación contra cepas de virus de gripe que circula es la medida principal para reducir la carga de enfermedad en estas poblaciones de alto riesgo. El aumento de la respuesta inmune individual después de la vacunación, por ejemplo, anticuerpos específicos para la gripe encima de un umbral de protección, reduce el riesgo individual de infección y en general la posibilidad de transmisión viral dentro de una población 5. una comprensión detallada de la inducida por la vacuna la respuesta inmune humoral en diferentes poblaciones y en diferentes grupos de edad es un elemento clave para responder a importantes preguntas clínicas6,7,8 , 9, tales como: ¿por qué algunos pacientes ancianos tienen infecciones a pesar de la vacunación anterior? ¿Qué es una "buena" y "suficiente" protección inducida por la vacuna? ¿Con qué frecuencia se debe aplicar una vacuna a un paciente immunosuppressed a títulos protectores? ¿Cuál es la dosis más efectiva? ¿Cuál es el impacto de un nuevo adyuvante en los títulos de anticuerpos tras la vacunación? La medición de la producción de anticuerpos específicos de la vacuna puede ayudar a responder estas preguntas importantes y mejorar los resultados de la vacunación.
La cuantificación de los títulos de anticuerpos específicos del virus puede realizarse con diferentes métodos inmunológicos. Esto incluye fase sólida10 o grano-ELISA11 ensayos, HI ensayo12y neutralizante de análisis13. Métodos basados en ELISA permiten la proyección de cantidades relativamente grandes de muestras de suero contra antígenos diferentes. También, inmunoglobulina (Ig) M e IgG específicos del patógeno pueden ser exploradas por separado. Aunque las características de un antígeno, por ejemplo, la secuencia lineal de aminoácidos o virus-como partícula pueden influir en la Unión de anticuerpos, el espectro de posibles epítopes es muy amplio y no proporciona información sobre si un anticuerpo respuesta tiene relevancia funcional.
En cambio, el ensayo de neutralización determina el potencial de los anticuerpos para funcionalmente inhiben la infección de las células y por lo tanto refleja el potencial de neutralización. Sin embargo, este método es muy laborioso, requiere de cultivo específicas de líneas celulares y virus en vivo, y por lo tanto, es lento, caro y requiere equipo especial.
Este artículo describe un paso a paso el protocolo HI basada en la Organización Mundial de la salud OMS12 para cuantificar los títulos de anticuerpos específicos de la gripe. Hemoaglutinación es un efecto característico de algunos virus que lleva a la aglutinación de los eritrocitos. La inhibición de este efecto con suero del paciente permite la medición de las concentraciones de anticuerpo inhibitorio, que refleja un efecto neutralizante.
Hemos modificado el flujo de trabajo del WHO-protocolo para permitir un manejo más eficiente de varias muestras al mismo tiempo y reduciendo el tiempo requerido. El primer protocolo describe la determinación del potencial de un antígeno de influenza particularmente aglutinación. De esta manera, para el segundo protocolo se determina la concentración de antígeno de influenza correcto. Esta parte debe repetirse con cada nuevo antígeno viral, así como cada lote de sangre.
El segundo protocolo describe la determinación de títulos de anticuerpos específicos de la gripe. Los protocolos presentados están optimizados para la investigación del virus de la influenza y las muestras de suero humano sin embargo, también puede ser aplicado para las muestras de suero de ratón o sobrenadante de cultivo celular de células inmunes estimuladas, por ejemplo, virus-específica de células B. Resultados se pueden determinar como títulos absolutos de medida. En muchos estudios de la vacuna, se muestran los títulos de media geométrica y el intervalo de confianza de 95% para cada población en particular. Para la interpretación, seroprotección o seroconversión se utilizan a menudo para describir la susceptibilidad de una población a un determinado virus. Seroprotección se define como un título de ≥1:40 y la seroconversión como un título más de 4 veces aumenta con el logro de títulos de seroprotective entre dos puntos del tiempo (la mayoría comúnmente se utilizan la vacunación previa y 30 días post-vacunación).
Ambos protocolos son fáciles de usar y puede ser adaptados a una amplia gama de preguntas de investigación. En particular, pueden ser utilizados para determinar confiablemente y rápidamente los títulos de anticuerpos contra varios otros virus con la capacidad de hemaglutinación, tales como sarampión, polyomaviruses, paperas o rubéola14,15,16 .
Protocolo
Los protocolos de estudio fueron aprobados por la Junta de revisión ética local (www.EKNZ.ch) y se obtuvo consentimiento informado de todos los participantes.
1. suero colección
- Recoger las muestras de suero de seres humanos en momentos de interés. Para este estudio, se colectaron sueros a los días 0 (tiempo de vacunación contra la influenza), + 7, + 30, + 60 y + 180 después de la vacunación.
- Para obtener el suero, centrifugar los tubos de muestra a 1.200 x g durante 10 min a temperatura ambiente (20-25 ° C).
Nota: Las muestras de sangre centrifugada no deben almacenarse a 4 ° C y durante no más de 24 h. - Alícuota del suero en tubos diferentes (cryo-viales) y congelar a-80 ° C hasta su uso.
- Realizar los ensayos posteriores batch-wise, incluyendo todos los puntos de tiempo de una persona para reducir la variabilidad dentro de un paciente.
2. preparación de los antígenos de
PRECAUCIÓN: Se utilizan cinco antígenos diferentes (véase Tabla de materiales). Preparación de antígenos en un laboratorio de bioseguridad nivel 2 (BSL-2).
- Según las instrucciones del fabricante, reconstituir todo el contenido de una ampolla de liofilizado influenza antígeno con 1,0 mL de agua destilada y deje que el antígeno disuelto reposar un mínimo de 5 min a temperatura ambiente antes de proceder.
- Alícuota la solución de antígeno para 1,5 mL tubos y congelar a-80 ° C hasta su uso posterior.
3. preparación del filtrado de cólera
Nota: Filtrado de cólera se utiliza como receptor de destruir la enzima (RDE) según el WHO protocolo12. Esto elimina los inhibidores de la innatos del suero que pueden interferir con el ensayo17.
- Reconstituir el liofilizado RDE según las instrucciones del fabricante.
- Almacenar la solución RDE en un tubo de 15 mL a 4 ° C hasta su uso posterior.
4. HA ensayo
Nota: Para asegurarse de que los ensayos de HI son comparables entre varios platos, la misma cantidad de partículas del virus debe usarse para cada placa. El ensayo HA (también llamado titulación HA) se realiza para cuantificar las partículas de virus necesarias para hemaglutinación y se registra en unidades HA. Una "unidad" de la hemoaglutinación es una unidad operativa dependiente del método utilizado para la valoración de HA y no es una medida de una cantidad absoluta de virus. Así, una unidad HA se define como la cantidad de virus necesaria para aglutinar un volumen igual de una suspensión estandarizada de RBC. Según la OMS, la cantidad estándar que se utiliza para el ensayo de HI es de 4 unidades HA por 25 μl. Para una ilustración del principio de la prueba HA ver figura 1.

Figura 1 : Principio de hemaglutinación e inhibición de hemaglutinación. No hay hemoaglutinación ocurre en una situación de control negativo sin virus y anticuerpos (columna izquierda) y eritrocitos hemagglutinate sólo en la presencia de virus de la influenza (columna media). Sin embargo, cuando la hemaglutinina del virus de la influenza está bloqueada por anticuerpos específicos del virus y luego no hay hemoaglutinación puede ocurrir (columna derecha). Haga clic aquí para ver una versión más grande de esta figura.
Nota: Los hematíes utilizados dependen del tipo de virus de la influenza en el ensayo (tabla 1). Además, varios tipos de placas de 96 pocillos micro título, el tiempo de incubación, así como la aparición de las células no aglutinadas son diferentes (tabla 2).
| Antígeno de influenza | A/California/7/09 (H1N1) | A Suiza / / 9715293/2013 (H3N2) | A/Texas/50/2012 (H3N2) | B/Brisbane/60/08 | B/Massachusetts/02/2012 | ||
| Especie de RBC | Pollo | Conejillo de Indias | Conejillo de Indias | Turquía | Turquía | ||
Tabla 1: especies correspondientes de glóbulos rojos y antígenos de la gripe. Según las instrucciones del fabricante (NIBSC).
| Especie de RBC | Pollo | Turquía | Conejillo de Indias | Tipo humano O |
| Concentración de glóbulos rojos (v/v) | 0,75% | 0,75% | 1% | 1% |
| Tipo de placa de microtitulación | Parte inferior de la V | Parte inferior de la V | Parte inferior U | Parte inferior U |
| Tiempo de incubación, RT | 30 min | 30 min | 1 hora | 1 hora |
| Aparición de células no aglutinadas | Botón * | Botón * | Halo | Halo |
Tabla 2: análisis condiciones con diferentes especies de gr. Según el protocolo de WHO. (* fluye cuando inclinado).
-
Preparación de la suspensión de glóbulos rojos
- Diluir la suspensión stock de RBC (10%, v/v; excepto tipo humano O) (véase Tabla de materiales) con el fosfato tampón salino (PBS) para hacer las concentraciones adecuadas de glóbulos rojos aves y mamíferos de 0.75% y 1%, respectivamente.

Figura 2 : Placa de diseño del ensayo HA. La valoración HA se realiza por duplicado. No antígeno fue agregado a las filas del control. También vea la figura 4 para la determinación de la mejor concentración de antígeno. Haga clic aquí para ver una versión más grande de esta figura.
-
Preparación de la placa de 96 pocillos Micro titulación
Nota: Véase la figura 2 para tener una visión general del diseño de la placa.- Añadir 25 μl de PBS a pozos 1 a 12 de cada fila utiliza una placa de 96 pocillos micro titulación usando una pipeta multicanal (figura 2). Utilizar la placa de titulación micro en forma de V cuando se trabaja con glóbulos rojos aves, como pollo y pavo. Utilizar la placa de titulación micro en forma de U cuando se trabaja con mamíferos los glóbulos rojos, como conejillo de Indias y el tipo humano O (tabla 2).
- Añada 25 μl de antígeno de influenza en el primer pozo de las filas de antígeno, que se arreglan en duplicados. No antígeno se agrega a las filas del control. Las filas de control no deben mostrar un efecto de hemaglutinación y sirven como controles negativos (figura 2).
- Realizar una dilución seriada 2 veces al transferir 25 μl del primer pozo de las filas de antígeno a sucesivos pozos utilizando una pipeta multicanal. Cada paso de dilución de la mezcla mediante pipeteo y bajar suavemente 10 veces.
- Deseche el final 25 μl de los últimos pozos.
- Añadir 25 μl de PBS a pozos de 1 a 12 de cada fila usado utilizando una pipeta multicanal, con el fin de alcanzar un volumen total de 50 μL por pocillo.
- Añadir 50 μl de la suspensión de RBC a cada uno utilizar bien por medio de una pipeta multicanal.
- Toque la placa con cuidado 10 veces en los cuatro lados para mezclar.
- Cubra la placa con tapa e incubar a temperatura ambiente para la cantidad apropiada de tiempo según el RBC especies utilizado (véase tabla 2). No mueva la placa durante la incubación.
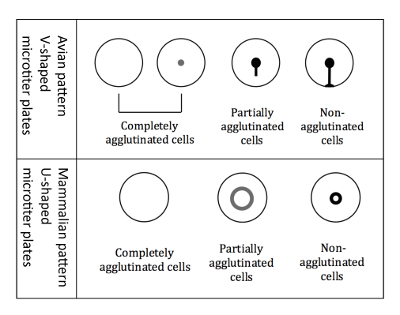
Figura 3 : Patrones de aglutinación de glóbulos rojos aves y mamíferos. Placas de título micro en forma de V se utilizan cuando se trabaja con glóbulos rojos aviares. La lectura se realiza en una posición inclinada de la placa, y glóbulos rojos aglutinados no empiezan a correr hacia abajo formando una forma de lágrima. Las placas de microtitulación en forma de U se utilizan cuando se trabaja con glóbulos rojos mamíferos. La lectura se realiza en una posición no inclinada y hematíes no aglutinados forman un halo pequeño. Haga clic aquí para ver una versión más grande de esta figura.
-
Leyendo la placa de
Nota: La lectura es algo diferente al usar glóbulos rojos aviares frente a glóbulos rojos mamíferos, debido a los pozos de diferente título micro forma (figura 3).- Lectura de glóbulos rojos aviares
- Incline la placa 90° 25 s.
Nota: Inclinación de la placa es crucial para la diferenciación de patrones de aviares, porque los tres tipos diferentes de patrones de aglutinación (totalmente aglutinados, parcialmente aglutinados y no aglutinados) aparecen como un botón cuando no se inclina. - Marcar los resultados inmediatamente, mientras la placa está en posición inclinada, en un esquema impreso de la placa de 96 pocillos. Los patrones de aglutinación de los hematíes aviares se muestran en la figura 3.
- Incline la placa 90° 25 s.
- Lectura de glóbulos rojos mamíferos
- Marcar los resultados en un esquema impreso de la placa de 96 pocillos, sin inclinación de la placa (posición horizontal en el Banco).
Nota: Cuando se produce hemaglutinación, las células aglutinadas no se instalan en la parte inferior, mientras que las células no aglutinadas como un halo en la parte inferior del pozo. El halo de las células parcialmente aglutinadas es menos intenso y tiene un diámetro mayor (figura 3).
- Marcar los resultados en un esquema impreso de la placa de 96 pocillos, sin inclinación de la placa (posición horizontal en el Banco).
- Determinación de 4 unidades HA.
Nota: El punto de final de titulación HA es el último pozo donde se produce la hemoaglutinación completa. También contiene 1 unidad HA del virus. Debido a las diluciones 2 veces del antígeno, dos pozos por delante el punto final de titulación HA es el pozo que contiene 4 unidades HA del virus (figura 4).
- Lectura de glóbulos rojos aviares

Figura 4 : Lectura de la valoración HA con aviares glóbulos rojos para determinar su titulación de 4 unidades HA. La cantidad de antígeno óptima requerida para hemaglutinación se mide por el ensayo de hemaglutinación (ensayo de titulación de antígeno). El último donde se produce hemaglutinación completa es el punto final de titulación HA y contiene 1 unidad HA. Debido a las diluciones 2 veces del antígeno, dos pozos por delante del punto final de titulación HA, el título corresponde a 4 unidades HA. Haga clic aquí para ver una versión más grande de esta figura.
5. ensayo de HI
Nota: El flujo de trabajo del protocolo ha sido optimizado para permitir un manejo más eficiente de varias muestras al mismo tiempo, mediante el uso de PCR tubo de rayas y un thermo cycler (véase abajo).
-
Preparación de las muestras de suero
Nota: Preparar las muestras de suero en un laboratorio BSL-2.- Descongelar las muestras de suero congeladas de cada momento de cada persona (ver paso 1.2) a temperatura ambiente.
- Añadir una alícuota de 10 μl de cada muestra de suero descongelado a un tubo de una tira de tubo PCR (10 tubos en una tira).
Nota: La gran ventaja de usar tiras de tubo PCR es que se puede utilizar una pipeta multicanal para los siguientes pasos en el análisis de HI; Esto ahorra mucho tiempo cuando una gran cantidad de muestras de suero de prueba y realizar medidas de las mismas muestras repetidas para los títulos de anticuerpos contra cepas de virus diferentes. - Almacenar las muestras de suero de alícuotas en las tiras de tubo PCR a-80 ° C hasta su uso.
- Un día antes de que se realice el ensayo de HI, descongelar las alícuotas de la muestra de suero de interés a temperatura ambiente.
- Añadir 10 μl del anti-suero correspondiente a un tubo vacío de PCR.
Nota: Para servir como un control positivo, el antisuero contra un virus específico debe coincidir con el virus usado. El control positivo permite estandarización del desempeño de la placa sobre múltiples placas. - Añadir 30 μl de la solución de filtrado de cólera a cada alícuota de suero y el suero (3 volúmenes de filtrado de cólera a 1 volumen de suero) utilizando una pipeta multicanal.
- Mantener los tubos PCR en un rack de PCR de 96 pocillos o una caja vacía de punta y vortex por 5 s.
- Incubar las muestras durante la noche a 37 ° C utilizando a un thermo cycler.
- Incubar las muestras a 56 ° C durante 30 min para inactivar el filtrado de cólera con un thermo cycler.
Nota: Dependiendo de la thermo cycler, este paso puede ser programado para automatizar aún más el proceso. - Mantener los tubos PCR en un rack de PCR de 96 pocillos o una caja vacía de punta y vortex por 5 s.
- Almacenar las muestras a 4 ° C en la nevera hasta su uso para el análisis de HI.

Figura 5 : Placa de diseño y flujo de trabajo de la prueba de HI. Cinco puntos de tiempo de dos personas se pueden medir en una placa. El título de HI va desde 8 hasta 1.024. Un suero del antígeno utilizado sirve como control positivo y una valoración posterior fue realizada para comprobar si la dilución de antígeno es igual a 4 unidades HA. La dilución seriada de la muestra de suero se muestra para los receptores de vacuna individual 2. Haga clic aquí para ver una versión más grande de esta figura.
-
Hola ensayo
Nota: Para una ilustración del principio de la prueba de HI vea la figura 1. Dependiendo del virus, diferentes especies de glóbulos rojos se utilizan para el análisis (tabla 1). Las diferentes especies de glóbulos rojos se utilizan en diversos tipos de placas de 96 pocillos, y el tiempo de incubación, así como la aparición de las células no aglutinadas diferencia (tabla 2). Para el análisis de HI, 4 unidades HA de virus o antígeno se agregan a la serie 2 veces de la dilución de las muestras.-
Preparación de la solución de antígeno
- Calcular el volumen de solución antigénica necesaria según el número de placas de 96 pocillos que utiliza (25 antígeno μl por bien el antígeno x 96 = 2.400 μL por placa de 96 pocillos; añada 100 μl por placa extra debido al uso de reservorio para pipeta multicanal; un total de 2,5 mL de antige n por placa).
Nota: por ejemplo, si 100 sueros de medición entonces 10 placas son necesarias (10 muestras por placa): 2,5 mL x 10 = 25 mL de solución de antígeno necesario en total. - Prepare la dilución apropiada de 4 unidades HA para el volumen calculado usando PBS.
Nota: 4 unidades HA se determinan para el ensayo HA. Para la apropiada cantidad de antígeno, divida el volumen calculado por el título correspondiente a 4 unidades HA. Por ejemplo, 4 unidades HA corresponden a una dilución de 1/64, y necesitábamos 15.000 μl de solución antigénica se necesitan: 15.000/64 = 234.4 μL del antígeno de influenza liofilizado disuelto se agregan.
- Calcular el volumen de solución antigénica necesaria según el número de placas de 96 pocillos que utiliza (25 antígeno μl por bien el antígeno x 96 = 2.400 μL por placa de 96 pocillos; añada 100 μl por placa extra debido al uso de reservorio para pipeta multicanal; un total de 2,5 mL de antige n por placa).
-
Preparación de la suspensión de la RBC
- Calcular el volumen de suspensión RBC necesario según el número de placas de 96 pocillos micro título utilizado (suspensión RBC de 50 μL por pozo × 96 = 4.800 suspensión RBC de μl por placa de 96 pocillos; añada 200 μL por placa extra debido al uso de reservorio para pipeta multicanal) .
- Diluir la suspensión stock de RBC (normalmente 10%, v/v; excepto tipo humano O) con PBS para hacer las concentraciones adecuadas de glóbulos rojos aves y mamíferos de 0.75% y 1%, respectivamente.
-
Preparación de la placa de 96 pocillos micro titulación
- Etiqueta de las placas de 96 pocillos micro titulación (ID de muestra, control positivo y posterior titulación). Compruebe cuidadosamente la orientación de la placa en la figura 5 .
- Añadir 25 μl de PBS a cada pozo excepto para el primer pozo de la fila de "titulación de nuevo" (figura 5, 12th fila) con pipeta multicanal.
Nota: Se realizó una valoración posterior para comprobar si la dilución del antígeno usado es igual a 4 unidades HA. Un título de 4 unidades HA de antígeno está indicado si la hemoaglutinación ocurre en los tres primeros pozos de la fila de "titulación de regreso", pero no en el cuarto bien. - Añadir 50 μl de la solución de antígeno preparado (descrita en 5.2.1) en el primer pocillo de la fila de "titulación de nuevo" (12th fila).
- Añadir 25 μl de los sueros tratados con RDE a los primeros pozos de filas 1 a 10 en cada plato, con la pipeta multicanal.
- Añada 25 μl del anti-suero apropiado en el primer pocillo de la fila 11 demayo como control positivo.
- Realizar diluciones seriadas 2 veces al transferir 25 μl del primer pozo de cada fila (1-12) a sucesivos pozos utilizando una pipeta multicanal. Mezclar mediante pipeteo arriba y abajo 10 - 15 veces para cada paso de dilución. Las puntas de la misma pueden utilizarse para cada paso de dilución por muestra.
- Deseche el final 25 μl de los últimos pozos.
- Añadir 25 μl de la solución de antígeno con una pipeta multicanal en cada pocillo de las filas 1 a 11 (las muestras de suero y suero). Las puntas de la misma pueden usarse si no tocan los pozos.
- Añada 25 μl de PBS en lugar de antígeno a cada pocillo de la fila de "titulación de nuevo" (12th fila).
- Toque la placa con cuidado 10 veces en los cuatro lados para mezclar.
- Cubra la placa con tapa e incubar a temperatura ambiente durante 30 minutos. No mueva la placa durante la incubación.
- Añadir 50 μl de la suspensión de RBC a cada pocillo.
- Toque la placa con cuidado 10 veces en los 4 lados para mezclar.
- Cubra la placa con tapa e incubar a temperatura ambiente para la cantidad apropiada de tiempo según el RBC especies utilizado (véase tabla 2). No mueva la placa durante la incubación.
-
Leyendo la placa de
Nota: La concentración de HI es el recíproco de la última dilución de la (anti) suero que inhibe completamente la hemaglutinación. Es importante considerar que los sueros tratados con RDE ya se diluyeron 1:4 y después del paso de dilución seriada, los sueros en los primeros pozos son diluidas 1:8, que corresponde a un título de HI 8.- Lectura de glóbulos rojos aviares
- Incline la placa 90° 25 s.
Nota: Inclinación de la placa es crucial para la diferenciación de patrones de aviares, porque los tres tipos diferentes de patrones de aglutinación (totalmente aglutinados, parcialmente aglutinados y no aglutinados) aparecen como un botón cuando no se inclina. - Marcar los resultados inmediatamente, mientras la placa está en posición inclinada, en un esquema impreso de la placa de 96 pocillos. Los patrones de aglutinación de RBCs aviares se muestran en la figura 3.
- Incline la placa 90° 25 s.
- Lectura de glóbulos rojos mamíferos
- Marcar los resultados en un esquema impreso de la placa de 96 pocillos, sin inclinación de la placa.
Nota: Cuando se produce hemaglutinación, las células aglutinadas no colocar abajo mientras que las células no aglutinadas como un halo en la parte inferior del pozo. El halo de las células parcialmente aglutinadas es menos intenso y tiene un diámetro mayor (figura 3). - Determinar la altura de cada muestra y transferir a una tabla basada en computadora (figura 6)
- Nota: Parcialmente aglutinadas pozos se determinaron como un título inferior. Por ejemplo, si una muestra de suero totalmente inhibe la hemaglutinación hasta el pozo 4 (dilución 1: 64) y la 5th bien parcialmente es aglutinada (dilución 1: 128), entonces el título de HI se establece en el título inferior 64 para el análisis final (figura 6, 4th fila).
- Marcar los resultados en un esquema impreso de la placa de 96 pocillos, sin inclinación de la placa.
- Lectura de glóbulos rojos aviares
-
Preparación de la solución de antígeno

Figura 6 : Lectura de la prueba de HI con aviar gr. Pre y post vacunación indujeron gripe respuesta de anticuerpos específicos se determina por análisis de HI. En este ejemplo, persona, uno tiene títulos más altos de HI que persona dos. Ambas personas muestran una respuesta de anticuerpos después de la vacunación; 180 días después de la vacunación los títulos de anticuerpos de ambas personas se disminuyen otra vez. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Respuesta de anticuerpos inducido pre- y post-vacunación contra la Influenza A H3N2
La respuesta de anticuerpos inducida por la vacuna se evaluó en 26 voluntarios sanos que recibieron una vacuna contra la gripe trivalente inactivada de la subunidad que contiene gripe A/H1N1/California/2009, A/H3N2/Texas/2012 y B/Massachusetts/02/2012 antes del 2014 / temporada de influenza de 2015. La figura 6 muestra un ejemplo representativo de los rec...
Discusión
Cuantificación de los títulos de anticuerpos específicos pre y post vacunación influenza virus es una importante herramienta necesaria para los estudios de la vacuna. Basado en las medidas de sustituto de la protección contra la infección por virus, tales como de seroprotección (> 1:40) o seroconversión (aumento de 4 veces del título), la vacunación pueden ser estrategias optimizadas9. Utilizando los protocolos proporcionados puede determinar: (i) el potencial de hemaglutinación de un v...
Divulgaciones
A.E. fue apoyado por las becas de una investigación del programa "FNS Ambizione Score" (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" Universidad de Basilea y Basilea Stiftungsinfektionskrankheiten Bangeter Rhyner Stiftung. L.K. fue apoyado por una beca de la Universidad de Graz, Austria técnico. J.L. reconoce apoyo de una beca de la iPhD de la iniciativa de SystemsX.ch en el programa de Biología de sistemas (9th call).
Agradecimientos
ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
Referencias
- . Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. f. G. S. V., Values, M. . The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042 (2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282 (2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940 (2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420 (2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614 (2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados