Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine optimierte Hämagglutination Inhibition (HI) Assay, Influenza-spezifischen Antikörper-Titer zu quantifizieren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die vorgestellten Protokolle wird beschrieben, wie einen Hämagglutination Inhibition Assay Quantifizierung des Influenza-spezifischen Antikörper-Titer von Serumproben von Grippe-Impfstoff Empfängern durchführen. Der erste Test bestimmt optimale virale Antigen-Konzentrationen durch Hämagglutination. Die zweite Probe quantifiziert Influenza-spezifischen Antikörper-Titer Hämagglutination Inhibition.
Zusammenfassung
Antikörpertiter dienen häufig als Surrogat-Marker für serologische Schutz gegen Grippe und andere Krankheitserreger. Detaillierte Kenntnisse der Antikörper-Produktion vor und nach der Impfung ist erforderlich, um die Impfstoff-induzierte Immunität zu verstehen. Dieser Artikel beschreibt ein zuverlässiger Punkt für Punkt-Protokoll zur Grippe-spezifischen Antikörper-Titer zu bestimmen. Das erste Protokoll beschreibt eine Methode, um die erforderlichen für Hämagglutination, die die Konzentrationen für die spätere Verwendung im zweiten Protokoll (Hämagglutination Assay, HA-Assay) standardisiert Antigen-Beträge angeben. Das zweite Protokoll beschreibt die Quantifizierung des Influenza-spezifischen Antikörper-Titer gegen verschiedene Virenstämme mithilfe einer serielle Verdünnung von menschlichen Serum oder Zelle Kultur Überstände (Hämagglutination Inhibition Assay, HI-Assay).
Als angewandte Beispiel zeigen wir die Antikörper-Reaktion einer gesunden Kohorte, die einen dreiwertigen inaktivierten Influenza-Impfstoff erhalten. Darüber hinaus die Kreuzreaktivität zwischen den verschiedenen Influenza-Viren gezeigt und Methoden zur Kreuzreaktivität zu minimieren, indem Sie mit verschiedenen Arten von tierischen roten Blutkörperchen (Erythrozyten) erläutert. Die Diskussion zeigt vor- und Nachteile der vorgestellten Assays und wie die Bestimmung des Influenza-spezifischen Antikörper-Titer das Verständnis der Impfstoff-bezogene Immunität verbessern kann.
Einleitung
Infektion mit Influenza-Virus ist mit erheblicher Morbidität, Mortalität und hohen Gesundheitskosten1,2,3,4. Insbesondere sind ältere Menschen, Neugeborene, Schwangere und Patienten mit chronischen Erkrankungen mit einem Risiko für schwere klinische Ergebnisse. Impfung gegen Influenza-Virus-Stämme in Umlauf ist demzufolge die primäre Maßnahme die Krankheitslast in dieser risikoreichen Bevölkerungen zu verringern. Die Erhöhung der individuellen Immunantwort nach Impfung, z.B., Grippe-spezifische Antikörper über eine schützende Schwellenwert, verringert dem individuellen Risiko einer Infektion und im Allgemeinen die Wahrscheinlichkeit von viralen Übertragung innerhalb einer Population 5. ein detailliertes Verständnis der Impfstoff-induzierten humoralen Immunantwort in verschiedenen Populationen und in verschiedenen Altersgruppen ist ein Schlüsselelement zur Beantwortung wichtige klinische Fragen6,7,8 , 9, wie: Warum haben einige älteren Patienten Infektionen trotz vorangegangenen Impfung? Was ist ein "gut" und "ausreichend" Impfstoff-induzierte Schutz? Wie oft sollte ein Impfstoff auf einen immunsupprimierten Patienten zu schützende Titer werden angewendet? Was ist die effektivste Dosierung? Wie wirkt sich ein neuartiges Adjuvans auf nach der Impfung Antikörpertiter? Die Messung der Impfstoff-spezifische Antikörper-Produktion kann helfen, diese wichtigen Fragen zu beantworten und bessere Ergebnisse für die Impfung.
Die Quantifizierung der Virus-spezifischen Antikörper-Titer kann mit verschiedenen immunologischen Methoden durchgeführt werden. Dazu gehören Festphasen-10 oder Wulst-basierte ELISA11 Assays, die HI-Assay12und neutralisierende Assays13. ELISA-basierten Methoden ermöglichen die Überprüfung der relativ große Mengen an Serumproben gegen verschiedene Antigene. Erreger-spezifischen Immunglobulin (Ig) M und IgG kann auch separat erkundet werden. Obwohl die Merkmale der Antigene, z.B., lineare Aminosäure-Sequenz oder virusähnliche Partikel die Bindung von Antikörpern beeinflussen können, das Spektrum der möglichen Epitope ist sehr breit und liefert keine Informationen an, ob ein Antikörper als Reaktion hat funktionelle Relevanz.
Im Gegensatz dazu die Neutralisation Assay bestimmt das Potenzial von Antikörpern, funktional die Infektion von Zellen hemmen und entspricht daher mögliche Neutralisierung. Aber diese Methode ist sehr arbeitsintensiv, erfordert Kultivierung bestimmter Zellinien und Viren zu leben, und daher, es ist zeitaufwendig, teuer und erfordert spezielle Ausrüstung.
Dieser Artikel beschreibt die Weltgesundheitsorganisation WHO-basierte HI Protokoll12 Quantifizierung des Influenza-spezifischen Antikörper-Titer eine Schritt für Schritt. Hämagglutination ist eine charakteristische Wirkung einiger Viren, die Agglutination der Erythrozyten führt. Die Hemmung dieses Effektes mit Patientenserum ermöglicht die Messung von hemmende Antikörper-Konzentrationen, die eine neutralisierende Wirkung widerspiegelt.
Wir haben den Workflow des WHO-Protokolls erlauben einen effizienteren Umgang mit mehrere Proben gleichzeitig und wodurch sich der Zeitaufwand angepasst. Das erste Protokoll beschreibt die Bestimmung der Agglutination Potenzial eines bestimmten Influenza-Antigens. Auf diese Weise wird die richtige Grippe Antigenkonzentration für das zweite Protokoll bestimmt. Dieser Teil sollte mit jeder neuen viralen Antigens sowie jede Charge des Blutes wiederholt werden.
Das zweite Protokoll beschreibt die Bestimmung der Influenza-spezifischen Antikörper-Titer. Die vorgestellten Protokolle sind für die Untersuchung des Influenza-Virus und humanem Serumproben jedoch optimiert, es kann auch für Maus Serumproben oder Zellkultur Überstände von stimulierte Immunzellen, z.B.Virus-spezifische B-Zellen angewendet werden. Ergebnisse können als absolute gemessenen Titer bestimmt werden. In vielen Impfstoff-Studien sind die geometrischen Mittelwert-Titer und das 95 %-Konfidenzintervall für jeden bestimmten Bevölkerung gezeigt. Für Auslegung, dies oder Serokonversion sind oft verwendet, um die Anfälligkeit der Bevölkerung zu einem bestimmten Virus zu beschreiben. Dies wird als ein Titer von ≥1:40 und Serokonversion definiert, wie ein mehr als 4-fold Titer zu erhöhen, durch erreichen der Seroprotective Titer zwischen zwei Zeitpunkten (am häufigsten vor der Impfung und 30 Tage nach der Impfung verwendet werden).
Beide Protokolle sind einfach zu bedienen und sie können an den unterschiedlichsten Fragestellungen angepasst werden. Insbesondere, sie lässt sich schnell und zuverlässig bestimmen die Antikörpertiter gegen verschiedene andere Viren mit einer Kapazität für Hämagglutination, z. B. Polyomaviren, Masern, Mumps oder Röteln14,15,16 .
Protokoll
Die Studienprotokolle genehmigt durch das lokale ethische Review Board (www.EKNZ.ch) und schriftliche Einwilligung wurde von allen Teilnehmern.
(1) Serum-Sammlung
- Sammeln Sie Serumproben von Menschen zu Zeitpunkten von Interesse. Für diese Studie sammelten wir Sera 0 (Zeit der Influenza-Impfung), + 7, + 30, 60 und 180 Tage nach der Impfung.
- Um das Serum zu erhalten, Zentrifugieren der Probenröhrchen bei 1.200 x g für 10 min bei Raumtemperatur (20-25 ° C).
Hinweis: Nicht zentrifugiert Blutproben sollten bei 4 ° C und nicht länger als 24 h gespeichert werden. - Aliquoten das Serum in verschiedenen Tuben (Cryo-Röhrchen) und bei-80 ° C bis zum Gebrauch einfrieren.
- Führen Sie die nachfolgenden Assays chargenweise, einschließlich allen Zeitpunkten von einer Person zur Variabilität innerhalb eines Patienten zu reduzieren.
2. Vorbereitung der Antigene
Achtung: Fünf verschiedene Antigene dienen (siehe Tabelle der Materialien). Bereiten Sie Antigene in einem Labor Biosafety Level 2 (BSL-2).
- Gemäß den Anweisungen des Herstellers rekonstruieren Sie den Gesamt Inhalt einer lyophilisierten Influenza-Antigen-Ampulle mit 1,0 mL destilliertem Wasser und lassen Sie die gelöste Antigen stehen für ein Minimum von 5 min bei Raumtemperatur, bevor Sie fortfahren.
- Aliquoten die Antigen-Lösung für 1,5 mL Röhrchen und bei-80 ° C bis zur weiteren Verwendung einfrieren.
3. Vorbereitung der Cholera Filtrat
Hinweis: Cholera Filtrat dient als Rezeptor Enzym (RDE) gemäß der WHO-Protokoll12zu zerstören. Dies entfernt angeborene Inhibitoren aus dem Serum die Assay17stören würde.
- Bereiten Sie die lyophilisierte RDE gemäß den Anweisungen des Herstellers.
- Speichern Sie die RDE-Lösung in eine 15 mL-Tube bei 4 ° C bis zur weiteren Verwendung.
4. HA Assay
Hinweis: Um sicherzustellen, dass die HI-Assays zwischen mehreren Platten vergleichbar sind, muss die gleiche Menge an Viruspartikel für jede Platte verwendet werden. Die HA-Assay (auch genannt HA Titration) wird durchgeführt, um die Viruspartikel notwendig für Hämagglutination zu quantifizieren und in HA Einheiten aufgezeichnet. Eine "Einheit" der Hämagglutination ist eine operative Einheit abhängig von der Methode für die HA-Titration verwendet und ist kein Maß für einen absoluten Betrag des Virus. So ist eine HA-Einheit definiert als die Menge des Virus benötigt, um ein gleiches Volumen einer standardisierten RBC-Suspension zu verbinden. Nach Angaben der WHO ist die Freigepäckmenge für die HI-Assay verwendet 4 HA Einheiten pro 25 µL. Zur Veranschaulichung des Prinzips der HA-Test siehe Abbildung 1.

Abbildung 1 : Prinzip der Hämagglutination und Hämagglutination Inhibition. Keine Hämagglutination tritt in eine Negativkontrolle Situation ohne Viren und Antikörper (linke Spalte) und Erythrozyten hemagglutinate nur in Anwesenheit von Influenza-Virus (mittlere Spalte). Jedoch entstehen wenn das Hämagglutinin des Influenza-Virus durch Virus-spezifischen Antikörper dann keine Hämagglutination blockiert ist (rechte Spalte). Bitte klicken Sie hier für eine größere Version dieser Figur.
Hinweis: Die Erythrozyten verwendet werden abhängig von der Art des Influenza-Virus in der Probe (Tabelle 1). Weiter, unterscheiden sich für verschiedene Arten von 96-Well micro Titer-Platten, die Inkubationszeit sowie das Aussehen der Zellen nicht agglutiniert (Tabelle 2).
| Influenza-antigen | A/California/7/09 (H1N1) | A/Schweiz/9715293/2013 (H3N2) | A/Texas/50/2012 (H3N2) | B/Brisbane/60/08 | B/Massachusetts/02/2012 | ||
| RBC-Arten | Huhn | Guinea Pig | Guinea Pig | Turkei | Turkei | ||
Tabelle 1: Influenza-Antigene und entsprechenden Arten von Erythrozyten. Nach den Anweisungen des Herstellers (NIBSC).
| RBC-Arten | Huhn | Turkei | Guinea pig | Menschlichen Typ O |
| Konzentration der Erythrozyten (V/V) | 0,75 % | 0,75 % | 1 % | 1 % |
| Art der Mikrotiterplatte | V-Boden | V-Boden | U unten | U unten |
| Inkubationszeit, RT | 30 min | 30 min | 1 Stunde | 1 Stunde |
| Darstellung von nicht agglutiniert Zellen | Taste * | Taste * | Halo | Halo |
Tabelle 2: Assay Bedingungen mit verschiedenen Arten von RBCs. Nach dem WHO-Protokoll. (* fließt, wenn es gekippt).
-
Vorbereitung der RBC-Suspension
- Die RBC Lager Aussetzung zu verdünnen (10 %, V/V; außer menschlichen Typ O) (siehe Tabelle der Materialien) mit Phosphat gepufferte Kochsalzlösung (PBS) bzw. zu den richtigen Konzentrationen für Vögel und Säugetiere RBCs von 0,75 % und 1 %.

Abbildung 2 : Platte Design des HA-Assays. Die HA-Titration erfolgt in Duplikate. Kein Antigen wurde die Kontrolle Zeilen hinzugefügt. Auch siehe Abbildung 4 zur Bestimmung der besten Antigenkonzentration. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Vorbereitung der 96-Well Micro Titer Platte
Hinweis: Siehe Abbildung 2 eine Übersicht über das Plattendesign.- 25 µL PBS Brunnen 1 bis 12 der einzelnen verwendeten Zeilen einer 96-Well micro Titer-Platte mit Hinzufügen einer Mehrkanal-Pipette (Abbildung 2). Verwenden Sie die v-förmige Mikro-Titer-Platte, beim Arbeiten mit aviären RBCs, wie Huhn und Pute. Verwenden Sie die u-förmige Mikro-Titer-Platte bei der Arbeit mit Säugetieren RBCs, wie Meerschweinchen und menschlichen Typ O (Tabelle 2).
- Die erste Bohrung der Antigen-Zeilen, die in Duplikate angeordnet sind fügen Sie 25 µL der Influenza Antigen hinzu. Kein Antigen wird die Kontrolle Zeilen hinzugefügt. Die Kontrolle Zeilen sollten nicht zeigen eine Hämagglutination Wirkung und dienen als Negativkontrollen (Abbildung 2).
- Führen Sie eine serielle 2-fold Verdünnung durch die Übertragung von 25 µL aus dem ersten Brunnen der Antigen-Zeilen in aufeinander folgenden Vertiefungen mithilfe einer Mehrkanal-Pipette. Mischen Sie jedem Verdünnungsschritt durch nach oben und unten leicht 10mal pipettieren.
- Die letzten 25 µL der letzten Brunnen zu verwerfen.
- 25 µL PBS Brunnen 1 bis 12 der einzelnen verwendeten Zeilen mit Hinzufügen einer Mehrkanal-Pipette, um ein Gesamtvolumen von 50 µL pro Bohrloch zu erreichen.
- Fügen Sie 50 µL der RBC Suspension zueinander auch mithilfe einer Mehrkanal-Pipette verwendet.
- Tippen Sie auf die Platte vorsichtig 10 Mal an allen vier Seiten zu mischen.
- Decken Sie die Platte mit einem Deckel ab und bei Raumtemperatur inkubieren Sie die entsprechende Menge an Zeit in Abhängigkeit von der RBC Arten verwendet (siehe Tabelle 2). Bewegen Sie die Platte nicht während der Inkubation.
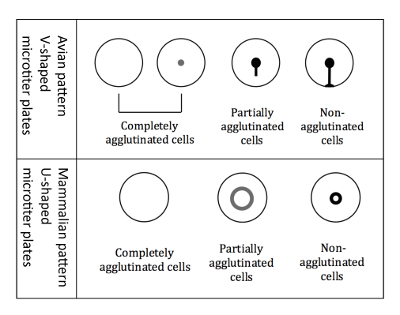
Abbildung 3 : Agglutination Muster der Vögel und Säugetieren RBCs. V-förmige Mikro-Titer-Platten sind beim Arbeiten mit aviären RBCs verwendet. Das Auslesen erfolgt in eine geneigte Platte Position und nicht agglutiniert Erythrozyten beginnen, bilden eine Träne-ähnliche Form heruntergekommen. U-förmigen Mikrotiterplatten sind beim Arbeiten mit Säugetieren RBCs verwendet. Das Auslesen erfolgt dann in der Lage sind nicht geneigt, und nicht agglutiniert RBCs bilden einen kleinen Heiligenschein. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Lesen Sie die Platte
Hinweis: Die Anzeige unterscheidet sich geringfügig bei Vogelgrippe Erythrozyten im Vergleich zu Säugetieren RBCs, aufgrund der verschiedenen geformten micro Titer Brunnen (Abbildung 3).- Auslesen der Vogelgrippe Erythrozyten
- Kippen Sie die Platte 90° für 25 s.
Hinweis: Die Platte kippen entscheidend für die Differenzierung von Vogelgrippe Muster ist, da alle drei verschiedene Arten von Agglutination Muster (völlig erschöpft, teilweise verklumpte und nicht agglutiniert) als Schaltfläche wenn nicht gekippt erscheinen. - Markieren Sie die Ergebnisse sofort, während die Platte noch in einer gekippten Position auf einer gedruckten Schema der 96-Well-Platte ist. Die Agglutination Muster der Vogelgrippe Erythrozyten sind in Abbildung 3dargestellt.
- Kippen Sie die Platte 90° für 25 s.
- Auslesen der Säugetier-Erythrozyten
- Markieren Sie die Ergebnisse auf einer gedruckten Schema der 96-Well-Platte ohne Kippen der Platte (horizontale Position auf der Bank).
Hinweis: Tritt Hämagglutination agglutinierten Zellen nicht nach unten, begnügen Sie sich nicht agglutiniert Zellen als Halo an der Unterseite des Brunnens erscheint. Der Heiligenschein der teilweise verklumpte Zellen ist weniger intensiv und hat einen größeren Durchmesser (Abbildung 3).
- Markieren Sie die Ergebnisse auf einer gedruckten Schema der 96-Well-Platte ohne Kippen der Platte (horizontale Position auf der Bank).
- Bestimmung von 4 HA Einheiten.
Hinweis: Der HA-Titration-Endpunkt ist der letzte Brunnen wo komplette Hämagglutination auftritt. Gut enthält 1 HA-Einheit des Virus. Wegen der 2-fold Verdünnungen des Antigens zwei Brunnen vor der HA-Titration-Endpunkt ist der Brunnen, der 4 HA Einheiten des Virus (Abbildung 4) enthält.
- Auslesen der Vogelgrippe Erythrozyten

Abbildung 4 : Auslesen der HA-Titration mit aviären RBCs der Titer von 4 HA Einheiten bestimmen. Die optimale Antigen-Füllmenge für Hämagglutination wird durch die Hämagglutination Assay (Antigen Titration Assay) gemessen. Die letzten gut wo komplette Hämagglutination auftritt ist der HA-Titration-Endpunkt und 1 HA-Einheit enthält. Wegen der 2-fold Verdünnungen des Antigens, zwei Brunnen vor der HA-Titration-Endpunkt entspricht der Titer 4 HA Einheiten. Bitte klicken Sie hier für eine größere Version dieser Figur.
(5) HI-Assay
Hinweis: Der Arbeitsablauf des Protokolls wurde optimiert, erlauben einen effizienteren Umgang mit mehrere Proben gleichzeitig, mittels PCR tube-Streifen und einem Thermocycler (siehe unten).
-
Vorbereitung der Serumproben
Hinweis: Serumproben in einem Labor BSL-2 vorbereiten.- Tauen die gefrorenen Serumproben von jeden Zeitpunkt eines jeden Menschen (siehe Schritt 1.2) bei Raumtemperatur.
- Fügen Sie eine Aliquote von 10 µL jeder aufgetauten Serum-Probe zu einem Schlauch eines PCR-Rohr-Strips (10-Röhren in einem Streifen).
Hinweis: Der große Vorteil der Verwendung von PCR-Röhrchen Streifen ist, dass eine Mehrkanal-Pipette für die folgenden Schritte in der HI-Assay verwendet werden kann; Das spart eine Menge Zeit, wenn eine große Menge an Serumproben Prüfung und Durchführung von Maßnahmen der gleichen Proben für Antikörpertiter gegen verschiedene Virusstämme wiederholt. - Die regelmÄÑig Serumproben in die PCR-Rohr-Streifen bei-80 ° C bis zur Verwendung aufbewahren.
- Tauen Sie einen Tag vor der HI-Test durchgeführt wird, das Serum Probe Aliquote von Interesse bei Raumtemperatur.
- 10 µL der entsprechenden Anti-Serum zu einem Leerrohr PCR hinzufügen.
Hinweis: Um als Positivkontrolle dienen, muss das Antiserum gegen einen bestimmten Virus der verwendeten Virus übereinstimmen. Die positive Kontrolle ermöglicht Standardisierung der Platte Leistung über mehrere Platten. - Fügen Sie 30 µL Cholera Filtrat Lösung zu jedem Serum aliquoten und das Anti-Serum (3 Bände der Cholera Filtrat zu 1 Volumen Serum) mithilfe einer Mehrkanal-Pipette.
- Halten Sie die PCR-Röhrchen in eine PCR 96-Well-Rack oder eine leere Tipp-Box und Vortex für 5 s.
- Inkubieren Sie die Proben über Nacht bei 37 ° C mit einem Thermocycler.
- Inkubieren Sie die Proben bei 56 ° C für 30 min, die Cholera Filtrat mit einem Thermocycler zu inaktivieren.
Hinweis: Abhängig von der Thermocycler, kann dieser Schritt programmiert werden um den Prozess zu automatisieren. - Halten Sie die PCR-Röhrchen in eine PCR 96-Well-Rack oder eine leere Tipp-Box und Vortex für 5 s.
- Bewahren Sie die Proben bei 4 ° C im Kühlschrank auf, bis zum Gebrauch für die HI-Assay.

Abbildung 5 : Platte Design und Workflow des HI-Assays. Fünf Mal Punkte von zwei Personen können auf einer Platte gemessen werden. Die HI-Titer reicht von 8 bis 1.024. Ein Anti-Serum des verwendeten Antigens als positive Kontrolle diente und eine hintere Titrierung wurde durchgeführt, um überprüfen, ob die Antigen-Verdünnung 4 HA Einheiten entspricht. Die serielle Verdünnung der Serumprobe für 2 individuelle Impfstoff Empfänger angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
-
Hallo Assay
Hinweis: Zur Veranschaulichung des Prinzips der HI-Test siehe Abbildung 1. Abhängig von dem Virus werden verschiedene Arten von RBCs Assay (Tabelle 1). Die verschiedenen Arten von Erythrozyten sind in verschiedenen Arten von 96-Well Platten verwendet und die Inkubationszeit sowie das Aussehen der Zellen nicht agglutiniert unterscheidet (Tabelle 2). Für die HI-Assay werden 4 HA Einheiten des Virus oder Antigen Baureihe 2-fold Verdünnung der Proben hinzugefügt.-
Vorbereitung der Antigen-Lösung
- Berechnen Sie das Volumen der Antigen-Lösung benötigt nach der Anzahl der verwendeten 96-Well-Platten (25 µL Antigen pro gut × 96 = 2.400 µL Antigen pro 96-Well-Platte; hinzufügen 100 µL pro Platte zusätzlich durch die Verwendung eines Reservoirs für die Mehrkanal-Pipette; insgesamt 2,5 mL Antige n pro Platte).
Hinweis: Wenn 100 Serumproben messen dann 10 Platten sind beispielsweise benötigte (10 Proben pro Teller): 2,5 mL x 10 = 25 mL Antigen-Lösung benötigt insgesamt. - Bereiten Sie die richtige Verdünnung von 4 HA Einheiten für das berechnete Volumen mit PBS.
Hinweis: 4 HA Einheiten sind für die HA-Assay bestimmt. Teilen Sie für die entsprechende Menge an Antigen das berechnete Volumen durch die Titer, 4 HA Einheiten entspricht. Zum Beispiel 4 HA Einheiten entspricht einer Verdünnung von 1/64, und wir brauchten 15.000 µL Antigen-Lösung benötigt: 15.000/64 = 234,4 µL der gelösten lyophilisierter Influenza-Antigen hinzugefügt.
- Berechnen Sie das Volumen der Antigen-Lösung benötigt nach der Anzahl der verwendeten 96-Well-Platten (25 µL Antigen pro gut × 96 = 2.400 µL Antigen pro 96-Well-Platte; hinzufügen 100 µL pro Platte zusätzlich durch die Verwendung eines Reservoirs für die Mehrkanal-Pipette; insgesamt 2,5 mL Antige n pro Platte).
-
Vorbereitung der RBC-suspension
- Berechnen Sie das Volumen des RBC Federung benötigt nach der Anzahl der 96-Well micro Titer-Platten verwendet (50 µL RBC Aufhängung pro gut 96 = 4.800 × µL RBC Aufhängung pro 96-Well-Platte; fügen Sie 200 µL pro Platte zusätzlich durch die Verwendung eines Reservoirs für die Mehrkanal-Pipette) .
- Die RBC Lager Aussetzung zu verdünnen (normalerweise 10 %, V/V; außer menschlichen Typ O) mit PBS die richtige Konzentrationen für Vögel und Säugetiere RBCs von 0,75 % und 1 % bzw. zu machen.
-
Vorbereitung der 96-Well micro Titer Platte
- Beschriften Sie die 96-Well micro Titer Platten (Proben-ID, Positivkontrolle und hinteren Titration). Bitte prüfen Sie sorgfältig die Platte Ausrichtung in Abbildung 5 .
- Geben Sie 25 µL PBS in jeder außer zu dem ersten Brunnen der "zurück-Titration" Zeile (Abbildung 5, 12ten Zeile) mit Mehrkanal-Pipette.
Hinweis: Eine zurück Titrierung wurde durchgeführt, um zu überprüfen ob die verwendete Antigen-Verdünnung 4 HA Einheiten entspricht. Ein Antigen-Titer von 4 HA Einheiten angegeben wenn Hämagglutination gut in den ersten drei Vertiefungen der Zeile "Titration zurück", aber nicht in der vierten auftritt. - Geben Sie 50 µL der vorbereiteten Antigen-Lösung (siehe 5.2.1) in die erste der "zurück-Titration" Zeile (Zeile 12th ).
- Die ersten Brunnen der Zeilen 1 bis 10 auf jeder Platte, mit der Mehrkanal-Pipette fügen Sie 25 µL der RDE-behandelten Serumproben hinzu.
- Die erste Bohrung 11ten Zeile 25 µL der entsprechenden Anti-Serum als Positivkontrolle hinzufügen.
- Führen Sie 2-fold Verdünnungsreihen durch die Übertragung von 25 µL aus dem ersten Brunnen jeder Zeile (1-12) in aufeinander folgenden Vertiefungen mithilfe einer Mehrkanal-Pipette. Mischen von oben und unten 10 - 15 Mal für jeden Verdünnungsschritt pipettieren. Die gleichen Tipps können für jeden Verdünnungsschritt pro Probe verwendet werden.
- Die letzten 25 µL der letzten Brunnen zu verwerfen.
- Fügen Sie 25 µL der Antigen-Lösung mithilfe einer Mehrkanal-Pipette in jede Vertiefung der Zeilen 1 bis 11 (Serumproben und Anti-Serum hinzu). Die gleichen Tipps können verwendet werden, wenn sie die Brunnen nicht berühren.
- Fügen Sie 25 µL PBS statt Antigen in jede Vertiefung der "zurück-Titration" Zeile (Zeile 12th ).
- Tippen Sie auf die Platte vorsichtig 10 Mal an allen vier Seiten zu mischen.
- Die Platte mit einem Deckel abdecken und bei Zimmertemperatur 30 min inkubieren. Bewegen Sie die Platte nicht während der Inkubation.
- Geben Sie in jedes 50 µL der RBC-Suspension.
- Tippen Sie auf die Platte vorsichtig 10 Mal auf allen 4 Seiten zu mischen.
- Decken Sie die Platte mit einem Deckel ab und bei Raumtemperatur inkubieren Sie die entsprechende Menge an Zeit in Abhängigkeit von der RBC Arten verwendet (siehe Tabelle 2). Bewegen Sie die Platte nicht während der Inkubation.
-
Lesen Sie die Platte
Hinweis: Die HI-Titer ist der Kehrwert der letzten Verdünnung des (Anti-) Serum, das völlig Hämagglutination hemmt. Es ist wichtig zu bedenken, dass die RDE-behandelten Sera wurden bereits verdünnt 1:4 und nach dem Verdünnungsschritt serielle, die Sera in den ersten Brunnen sind verdünnt 1:8, das entspricht einem HI-Titer von 8.- Auslesen der Vogelgrippe Erythrozyten
- Kippen Sie die Platte 90° für 25 s.
Hinweis: Die Platte kippen entscheidend für die Differenzierung von Vogelgrippe Muster ist, da alle drei verschiedene Arten von Agglutination Muster (völlig erschöpft, teilweise verklumpte und nicht agglutiniert) als Schaltfläche wenn nicht gekippt erscheinen. - Markieren Sie die Ergebnisse sofort, während die Platte noch in einer gekippten Position auf einer gedruckten Schema der 96-Well-Platte ist. Die Agglutination Muster der Vogelgrippe Erythrozyten sind in Abbildung 3dargestellt.
- Kippen Sie die Platte 90° für 25 s.
- Auslesen der Säugetier-Erythrozyten
- Markieren Sie die Ergebnisse auf einer gedruckten Schema der 96-Well-Platte ohne die Platte kippen.
Hinweis: Tritt Hämagglutination, die agglutinierten Zellen nicht niederlassen während nicht agglutiniert Zellen als Halo an der Unterseite des Brunnens erscheinen. Der Heiligenschein der teilweise verklumpte Zellen ist weniger intensiv und hat einen größeren Durchmesser (Abbildung 3). - HI jeder Probe zu bestimmen und überträgt es auf einer Computer-basierten Tabelle (Abbildung 6)
- Hinweis: Teilweise agglutinierten Brunnen wurden als ein niedriger Titer bestimmt. Zum Beispiel wenn eine Serumprobe komplett Hämagglutination bis 4. gut (Verdünnung 1: 64) und der 5th gut hemmt (Verdünnung 1: 128) ist teilweise agglutiniert, dann HI-Titer wird voraussichtlich niedriger Titer 64 für die endgültige Analyse (Abbildung 6, 4th -Reihe).
- Markieren Sie die Ergebnisse auf einer gedruckten Schema der 96-Well-Platte ohne die Platte kippen.
- Auslesen der Vogelgrippe Erythrozyten
-
Vorbereitung der Antigen-Lösung

Abbildung 6 : Auslesen des HI-Assays mit aviären RBCs. Die vor- und nach der Impfung induzierten Influenza, die spezifische Antikörper-Reaktion durch HI-Assay bestimmt wird. In diesem Beispiel hat die Person eine höhere HI-Titer als Person zwei. Beide Personen zeigen eine Antikörper-Reaktion nach der Impfung; 180 Tage nach der Impfung sind die Antikörpertiter beider Personen wieder verringert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergebnisse
Vor und nach der Impfung induzierten Antikörper-Reaktion gegen Influenza A H3N2
Die Impfstoff-induzierte Antikörper-Reaktion wurde in 26 gesunden Probanden, die einen inaktivierten dreiwertigen Untereinheit Influenza-Impfstoff mit Influenza A/H1N1/California/2009, A/H3N2/Texas/2012 und B/Massachusetts/02/2012 vor der 2014 erhalten bewertet / 2015 Grippesaison. Abbildung 6 zeigt ein repräsentatives Beispiel für 2 Impfstoff Empfänger. I...
Diskussion
Quantifizierung der vor- und nach der Impfung Influenza Virus spezifische Antikörper-Titer ist ein wichtiges Instrument für Impfstoff-Studien notwendig. Basierend auf der Leihmutter Maßnahmen zum Schutz gegen Virus-Infektion, wie dies (> 01:40) oder Serokonversion (4-fold Titer Anstieg), Impfung Strategien kann9optimiert. Mit den bereitgestellten Protokollen bestimmen kann: (i) die Hämagglutination Potenzial eines bestimmten Virus, und (Ii) die Antikörpertiter für einen Virus von Interesse.<...
Offenlegungen
A.e. wurde unterstützt durch eine Forschung Zuschüsse aus dem Programm "SNF Ambizione Score" (PZ00P3_154709), "Forschungsfond, Förderung Strategischer Projekte" Universität Basel, Stiftungsinfektionskrankheiten Basel und Bangeter-Rhyner-Stiftung. L.k. unterstützt wurde durch einen Zuschuss von der technischen Universität Graz, Österreich. J.l. räumt Unterstützung durch eine iPhD Fellowship der SystemsX.ch Initiative Systeme Biologie-Programm (9th Anruf).
Danksagungen
keine.
Materialien
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
Referenzen
- . Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. f. G. S. V., Values, M. . The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042 (2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282 (2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940 (2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420 (2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614 (2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten