È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un'analisi di inibizione (HI) ottimizzato emagglutinazione per quantificare i titoli dell'anticorpo specifico dell'Influenza
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I protocolli presentati viene descritto come eseguire un'analisi di inibizione di emagglutinazione per quantificare i titoli dell'anticorpo specifico dell'influenza da campioni di siero dei destinatari del vaccino di riossidazione. Il primo test determina concentrazioni di antigene virale ottimale di emagglutinazione. Il secondo test quantifica i titoli dell'anticorpo specifico dell'influenza di inibizione di emagglutinazione.
Abstract
I titoli dell'anticorpo sono comunemente usati come markers surrogati per sierologica protezione contro l'influenza e altri agenti patogeni. Per capire l'immunità indotta dal vaccino è necessaria una conoscenza dettagliata di produzione dell'anticorpo pre- e post-vaccinazione. Questo articolo descrive un protocollo affidabile punto per punto per determinare i titoli dell'anticorpo specifico dell'influenza. Il primo protocollo descrive un metodo per specificare la quantità di antigene necessarie per emagglutinazione, che standardizza le concentrazioni per successivo utilizzo nel secondo protocollo (analisi di emagglutinazione, HA dosaggio). Il secondo protocollo descrive la quantificazione dei titoli dell'anticorpo specifico dell'influenza contro diversi ceppi virali utilizzando una diluizione seriale di umana del siero o cella surnatanti (analisi di inibizione di emagglutinazione, test HI).
Come un esempio applicato, vi indichiamo la risposta dell'anticorpo di una coorte di sana, che ha ricevuto un vaccino dell'influenza trivalente inattivato. Inoltre, la cross-reattività tra il virus influenzali diversi è mostrata e metodi per minimizzare la reattività crociata utilizzando diversi tipi di animali globuli rossi (RBCs) sono spiegati. La discussione evidenzia vantaggi e svantaggi dei saggi presentati e come la determinazione dei titoli dell'anticorpo specifico dell'influenza può migliorare la comprensione dell'immunità correlate al vaccino.
Introduzione
Infezione con virus dell'influenza è associata con considerevole morbosità, mortalità e costi sanitari elevati1,2,3,4. In particolare, anziani, neonati, donne incinte e pazienti con malattia cronica sono a rischio per i risultati clinici più gravi. Pertanto, la vaccinazione contro ceppi di virus influenzali in circolazione è la misura primaria per diminuire il carico di malattia in queste popolazioni ad alto rischio. L'aumento della risposta immunitaria individuale dopo vaccinazione, ad es., anticorpi specifici per l'influenza sopra una soglia protettiva, riduce il rischio individuale di infezione e in generale la probabilità di trasmissione virale all'interno di una popolazione 5. una conoscenza dettagliata del vaccino-indotta risposta immunitaria umorale in diverse popolazioni e tra vari gruppi di età è un elemento chiave per rispondere a quesiti clinici importanti6,7,8 , 9, come: perché alcuni pazienti anziani hanno infezioni malgrado la vaccinazione precedente? Che cosa è una "buona" e "sufficiente" protezione indotta dal vaccino? Quante volte un vaccino deve essere applicato a un paziente immunosuppressed per raggiungere i titoli protettivi? Qual è il dosaggio più efficace? Qual è l'impatto di un romanzo ausiliario su titoli dell'anticorpo dopo la vaccinazione? La misurazione della produzione dell'anticorpo specifico vaccino può aiutare a rispondere a queste domande importanti e migliorare i risultati di vaccinazione.
La quantificazione dei titoli dell'anticorpo del virus-specifici possa essere eseguita con vari metodi immunologici. Questo include fase solida10 o basati su tallone i dosaggi ELISA11 , HI test12e neutralizzante saggi13. Metodi basati su ELISA permettono lo screening di relativamente grandi quantità di campioni di siero contro vari antigeni. Inoltre, patogeno-specifiche dell'immunoglobulina (Ig) M e IgG possono essere esplorati separatamente. Anche se le caratteristiche di un antigene, per esempio, la sequenza lineare degli aminoacidi o delle particelle virus-simili possono influenzare il legame degli anticorpi, lo spettro di potenziali epitopi è molto ampio e non fornisce informazioni su se un anticorpo risposta ha rilevanza funzionale.
Al contrario, l'analisi di neutralizzazione determina il potenziale di anticorpi funzionalmente inibire l'infezione delle cellule e quindi riflette il potenziale di neutralizzazione. Tuttavia, questo metodo è molto laborioso, richiede la messa in coltura di specifiche linee cellulari e vivere virus, e pertanto, è che richiede tempo, costosa e richiede attrezzature speciali.
Questo articolo viene descritto un passo-passo la World Health Organization WHO-based HI protocollo12 per quantificare i titoli dell'anticorpo specifico dell'influenza. Emoagglutinazione è un effetto caratteristico di alcuni virus che porta l'agglutinazione degli eritrociti. L'inibizione di questo effetto con i sieri dei pazienti permette la misura delle concentrazioni di anticorpi inibitori, che riflette un effetto neutralizzante.
Abbiamo modificato il flusso di lavoro del WHO-protocollo per consentire una gestione più efficiente dei campioni multipli allo stesso tempo e riducendo il tempo necessario. Il primo protocollo descrive la determinazione del potenziale di un antigene particolare dell'influenza dell'agglutinazione. In tal modo, la concentrazione di antigene dell'influenza corretta è determinata per il secondo protocollo. Questa parte dovrebbe essere ripetuta con ogni nuovo antigene virale, come pure ogni batch di sangue.
Il secondo protocollo descrive la determinazione dei titoli dell'anticorpo specifico dell'influenza. I protocolli presentati sono ottimizzati per l'indagine del virus dell'influenza e campioni di siero umano tuttavia, può anche essere applicato per i campioni di siero del mouse o surnatanti di coltura cellulare da cellule immuni stimolate, per esempio, B-cellule virus-specifiche. Risultati possono essere determinati come assoluti misurati titoli. In molti studi di vaccino, i titoli di media geometrica e l'intervallo di confidenza del 95% sono indicati per ogni particolare popolazione. Per interpretazione, sieroprotezione o sieroconversione sono spesso utilizzati per descrivere la suscettibilità di una popolazione per un certo virus. Sieroprotezione è definita come un titolo di ≥ 1: 40 e sieroconversione come un titolo più di 4 volte aumentare con conseguimento di titoli di sieroprotettivi tra due intervalli di tempo (più comunemente utilizzati pre-vaccinazione e 30 giorni dopo la vaccinazione).
Entrambi i protocolli sono facili da usare e possono essere adattati ad una vasta gamma di domande di ricerca. In particolare, può essere utilizzati per determinare rapidamente e in modo affidabile i titoli dell'anticorpo contro vari altri virus con la capacità di emoagglutinazione, quali morbillo, polyomaviruses, parotite o rosolia14,15,16 .
Protocollo
I protocolli di studio sono stati approvati attraverso il Comitato di revisione etica locale (www.EKNZ.ch) e il consenso informato è stato ottenuto da tutti i partecipanti.
1. il siero collezione
- Raccogliere i campioni di siero da esseri umani a intervalli di tempo di interesse. Per questo studio, abbiamo raccolto sieri ai giorni 0 (tempo di vaccinazione contro l'influenza), + 7, + 30, + 60 e + 180 dopo la vaccinazione.
- Per ottenere il siero, centrifugare le provette a 1.200 x g per 10 min a temperatura ambiente (20-25 ° C).
Nota: I campioni di sangue centrifugato Non devono essere conservati a 4 ° C e per non più di 24 h. - Aliquota del siero in tubi diversi (cryo-fiale) e congelare a-80 ° C fino all'utilizzo.
- Eseguire le analisi successive per singoli batch, inclusi tutti i punti di tempo di una persona per ridurre la variabilità all'interno di un paziente.
2. preparazione degli antigeni
Attenzione: Cinque diversi antigeni sono utilizzati (Vedi Tabella materiali). Preparare gli antigeni in un laboratorio di biosicurezza di livello 2 (BSL-2).
- Secondo le istruzioni del produttore, ricostituire il contenuto totale di una fiala di antigene dell'influenza liofilizzato con 1,0 mL di acqua distillata e consentire l'antigene disciolto riposare per un minimo di 5 min a temperatura ambiente prima di procedere.
- Aliquotare la soluzione dell'antigene a 1,5 mL tubi e congelare a-80 ° C fino al successivo utilizzo.
3. preparazione del colera filtrato
Nota: Filtrato di colera è utilizzato come un recettore distruggendo enzima (RDE) secondo il protocollo WHO12. Questa operazione rimuove innati inibitori dal siero che avrebbe interferito con il test17.
- Ricostituire il liofilizzato RDE secondo le istruzioni del produttore.
- Conservare la soluzione RDE in una provetta da 15 mL a 4 ° C fino all'utilizzo ulteriore.
4. HA dosaggio
Nota: Per garantire che i saggi di HI siano comparabili tra i diversi piatti, la stessa quantità di particelle di virus deve essere utilizzata per ciascuna lastra. Il dosaggio HA (anche chiamato HA titolazione) viene eseguito per quantificare le particelle di virus necessarie per emagglutinazione ed è registrato in unità HA. Una «unità» di emagglutinazione è un'unità operativa dipenda dal metodo utilizzato per la titolazione di HA e non è una misura di un importo assoluto di virus. Così, un'unità HA è definita come la quantità di virus necessaria per agglutinare un volume uguale di una sospensione di RBC standardizzato. Secondo l'OMS, la quantità standard utilizzata per i test di HI è 4 HA unità per 25 µ l. Per un'illustrazione del principio del dosaggio HA vedere la Figura 1.

Figura 1 : Principio di emagglutinazione e inibizione di emagglutinazione. Nessun emagglutinazione si verifica in una situazione di controllo negativo senza virus e anticorpi (colonna sinistra), e gli eritrociti hemagglutinate solo in presenza di virus dell'influenza (colonna centrale). Tuttavia, quando l'emagglutinina del virus dell'influenza è bloccata da anticorpi virus-specifici quindi nessun emagglutinazione può verificarsi (colonna destra). Clicca qui per visualizzare una versione più grande di questa figura.
Nota: I globuli rossi utilizzati sono dipendente dal tipo di virus influenzale nell'analisi (tabella 1). Ulteriormente, per vari tipi di piastre a 96 pozzetti micro titolo, il tempo di incubazione, nonché l'aspetto delle celle non agglutinate differiscono (tabella 2).
| Antigene dell'influenza | A/California/7/09 (H1N1) | A/Svizzera/9715293/2013 (H3N2) | A/Texas/50/2012 (H3N2) | B/Brisbane/60/08 | B/Massachusetts/02/2012 | ||
| Specie di RBC | Pollo | Guinea Pig | Guinea Pig | Turchia | Turchia | ||
Tabella 1: gli antigeni dell'Influenza e della corrispondente specie di RBCs. Secondo le istruzioni del produttore (NIBSC).
| Specie di RBC | Pollo | Turchia | Guinea pig | Tipo umano O |
| Concentrazione di globuli rossi (v/v) | 0,75% | 0,75% | 1% | 1% |
| Tipo di piastra per microtitolazione | Fondo V | Fondo V | Fondo U | Fondo U |
| Tempo di incubazione, RT | 30 min | 30 min | 1 ora | 1 ora |
| Aspetto alle emazie non agglutinate | Tasto * | Tasto * | Halo | Halo |
Tabella 2: analisi condizioni con diverse specie di RBCs. Secondo il protocollo WHO. (* scorre quando inclinato).
-
Preparazione della sospensione RBC
- Diluire la sospensione di stock di RBC (10%, v/v; tranne tipo umano O) (Vedi Tabella materiali) con fosfato tampone salino (PBS) per rendere le concentrazioni adeguate per uccelli e mammiferi RBCs di 0,75% e l'1%, rispettivamente.

Figura 2 : Placca design del dosaggio HA. La titolazione HA viene eseguita in duplicati. Nessun antigene è stato aggiunto per le righe di controllo. Vedere anche Figura 4 per la determinazione della concentrazione di antigene migliore. Clicca qui per visualizzare una versione più grande di questa figura.
-
Preparazione della piastra 96 pozzetti Micro
Nota: Vedere la Figura 2 per una panoramica del design piatto.- Aggiungere 25 µ l di PBS pozzetti 1 a 12 di ogni riga di una piastra 96 pozzetti micro utilizzando una pipetta multicanale (Figura 2). Utilizzare la piastra a forma di V micro quando si lavora con RBCs aviaria, come pollo e tacchino. Utilizzare la piastra a forma di U micro quando si lavora con RBCs dei mammiferi, come cavia e umano di tipo O (tabella 2).
- Aggiungere 25 µ l di antigene dell'influenza al primo pozzo di antigene-righe, che sono disposti in duplicati. Nessun antigene viene aggiunto per le righe di controllo. Le righe di controllo non dovrebbero mostrare un effetto di emagglutinazione e fungere da controlli negativi (Figura 2).
- Eseguire una diluizione seriale 2 volte con il trasferimento di 25 µ l dal primo pozzo di antigene-righe nei pozzetti successivi utilizzando una pipetta multicanale. Mescolare ogni passaggio di diluizione pipettando su e giù delicatamente 10 volte.
- Scartare il finale 25 µ l di pozzetti ultimi.
- Aggiungere 25 µ l di PBS pozzetti 1 a 12 di ogni riga utilizzando una pipetta multicanale, al fine di raggiungere un volume totale di 50 µ l per pozzetto.
- Aggiungere 50 µ l della sospensione RBC a ciascuno utilizzato bene utilizzando una pipetta multicanale.
- Toccare la piastra con attenzione 10 volte su tutti e quattro i lati per mescolare.
- Coprire la piastra con un coperchio e incubare a temperatura ambiente per la giusta quantità di tempo a seconda della specie di RBC usato (Vedi tabella 2). Non spostare la piastra durante l'incubazione.
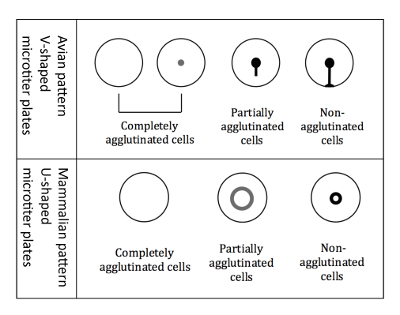
Figura 3 : Agglutinazione dei globuli rossi di uccelli e mammiferi. Piastre a forma di V micro titolo vengono utilizzati quando si lavora con RBCs aviaria. La lettura viene eseguita in posizione inclinata piastra e non agglutinati globuli rossi iniziano a correre verso il basso formando una forma a lacrima. Piastre microtiter a forma di U sono utilizzati quando si lavora con globuli rossi dei mammiferi. La lettura avviene quindi in una posizione non inclinato, e non agglutinati globuli rossi formano un piccolo alone. Clicca qui per visualizzare una versione più grande di questa figura.
-
La piastra di lettura
Nota: La lettura è leggermente diversa quando si utilizza aviaria RBCs rispetto ai globuli rossi dei mammiferi, a causa dei pozzi di diversa forma micro titolo (Figura 3).- Lettura di RBCs aviaria
- Inclinare il piatto 90° per 25 s.
Nota: Inclinando la piastra è cruciale per la differenziazione dei modelli di aviaria, perché tutti i tre diversi tipi di agglutinazione (completamente agglutinate, parzialmente agglutinate e non agglutinate) vengono visualizzati come un pulsante quando non inclinato. - Contrassegnare i risultati immediatamente, mentre la piastra è ancora in posizione inclinata, su uno schema stampato della piastra 96 pozzetti. L'agglutinazione dei globuli rossi aviaria sono mostrati nella Figura 3.
- Inclinare il piatto 90° per 25 s.
- Lettura di globuli rossi dei mammiferi
- Contrassegnare i risultati su uno schema stampato della piastra 96 pozzetti, senza inclinare il piatto (posizione orizzontale sulla panchina).
Nota: In caso di emoagglutinazione, le cellule agglutinate non depositano alla parte inferiore, mentre alle emazie non agglutinate appaiono come un alone nella parte inferiore del pozzo. L'aureola delle cellule parzialmente agglutinate è meno intenso e ha un diametro maggiore (Figura 3).
- Contrassegnare i risultati su uno schema stampato della piastra 96 pozzetti, senza inclinare il piatto (posizione orizzontale sulla panchina).
- Determinazione di 4 HA unità.
Nota: Il punto finale di titolazione HA è il bene ultimo dove emagglutinazione completa si verifica. Questo contiene anche 1 HA unità di virus. A causa delle diluizioni 2 volte dell'antigene, due pozzi davanti l'endpoint di titolazione HA è il pozzo che contiene 4 HA unità di virus (Figura 4).
- Lettura di RBCs aviaria

Figura 4 : Lettura della titolazione HA con RBCs aviaria per determinarne il titolo di 4 unità di HA. La quantità di antigene ottimale necessaria per emagglutinazione è misurata dall'analisi di emagglutinazione (dosaggio di titolazione dell'antigene). L'ultimo pozzo dove emagglutinazione completa si verifica è l'endpoint di titolazione HA e contiene 1 HA unità. A causa delle diluizioni 2 volte dell'antigene, due pozzi davanti l'endpoint di titolazione HA, il titolo corrisponde a 4 HA unità. Clicca qui per visualizzare una versione più grande di questa figura.
5. test HI
Nota: Il flusso di lavoro del protocollo è stato ottimizzato per consentire una gestione più efficiente dei campioni multipli allo stesso tempo, mediante PCR tube strisce e un cycler termico (Vedi sotto).
-
Preparazione dei campioni di siero
Nota: Preparare i campioni di siero in un laboratorio BSL-2.- Scongelare i campioni congelati del siero di ciascun punto di tempo di ogni persona (Vedi punto 1.2) a temperatura ambiente.
- Aggiungere un'aliquota di 10 µ l di ciascun campione di siero scongelati ad un tubo di una striscia di tubo PCR (10-tubi in una striscia).
Nota: Il grande vantaggio di utilizzare strisce di tubo PCR è una pipetta multicanale può essere utilizzata per le seguenti operazioni nell'analisi della HI; Questo consente di risparmiare un sacco di tempo quando si verifica una grande quantità di campioni di siero e quando esecuzione ripetuta misure di stessi campioni per i titoli dell'anticorpo contro i ceppi di virus diversi. - Conservare i campioni di siero aliquotati nelle strisce di tubo PCR a-80 ° C fino all'utilizzo.
- Un giorno prima di eseguire il test di HI, scongelare le aliquote del campione di siero di interesse a temperatura ambiente.
- Aggiungere 10 µ l di anti-siero appropriato a una provetta vuota di PCR.
Nota: Per servire come controllo positivo, il anti-siero contro un virus specifico deve corrispondere il virus usato. Il controllo positivo permette per la standardizzazione delle prestazioni piastra sopra piastre multiple. - Aggiungere 30 µ l di soluzione di filtrato di colera ad ogni aliquota di siero e anti-siero (3 volumi di colera filtrato a 1 volume di siero) utilizzando una pipetta multicanale.
- Mantenere le provette PCR in un rack di PCR 96 pozzetti o un suggerimento-scatola vuota e vortexare per 5 s.
- Incubare i campioni durante la notte a 37 ° C, utilizzando un cycler termico.
- Incubare i campioni a 56 ° C per 30 minuti inattivare il filtrato di colera usando un cycler termico.
Nota: A seconda il ciclatore thermo, questo passaggio può essere programmato per automatizzare ulteriormente il processo. - Mantenere le provette PCR in un rack di PCR 96 pozzetti o un suggerimento-scatola vuota e vortexare per 5 s.
- Conservare i campioni a 4 ° C in frigorifero fino all'uso per il dosaggio di HI.

Figura 5 : Piastra design e flusso di lavoro del test HI. Cinque punti di tempo di due persone possono essere misurati su una piastra. Il titolo di HI varia da 8 a 1.024. Un anti-siero dell'antigene usato servito come controllo positivo e una titolazione di ritorno è stata effettuata per verificare se la diluizione di antigene è uguale a 4 unità di HA. La diluizione seriale nel campione di siero viene mostrata per 2 singoli vaccinati. Clicca qui per visualizzare una versione più grande di questa figura.
-
Ciao dosaggio
Nota: Per un'illustrazione del principio del dosaggio HI vedere la Figura 1. A seconda del virus, diverse specie di globuli rossi vengono utilizzati per l'analisi (tabella 1). Le diverse specie di RBCs sono utilizzate in vari tipi di piastre da 96 pozzetti, e il tempo di incubazione, nonché l'aspetto delle celle non agglutinate differisce (tabella 2). Per il dosaggio di HI, 4 HA unità di virus o dell'antigene vengono aggiunti alla serie 2-Fold diluizione dei campioni.-
Preparazione della soluzione dell'antigene
- Calcolare il volume di soluzione dell'antigene necessario a seconda del numero di piastre da 96 pozzetti utilizzati (antigene di 25 µ l per ben × 96 = 2.400 antigene µ l per piastra a 96 pozzetti; aggiungere 100 µ l per piastra supplementare grazie all'uso di un serbatoio per la pipetta multicanale; un totale di 2,5 mL di antige n per piastra).
Nota: ad esempio, se 100 campioni di misura quindi 10 piastre sono necessari (10 campioni per piastra): 2,5 mL x 10 = 25 mL di soluzione dell'antigene necessario in totale. - Preparare la corretta diluizione di 4 HA unità per il volume calcolato utilizzando PBS.
Nota: 4 unità di HA sono determinati per il dosaggio HA. Per la giusta quantità di antigene, dividere il volume calcolato per il titolo corrispondente a 4 HA unità. Ad esempio, 4 HA unità corrispondono a una diluizione di 1/64, e avevamo bisogno di 15.000 µ l di soluzione dell'antigene sono necessari: 15.000/64 = 234,4 µ l dell'antigene dell'influenza liofilizzato disciolto sono aggiunti.
- Calcolare il volume di soluzione dell'antigene necessario a seconda del numero di piastre da 96 pozzetti utilizzati (antigene di 25 µ l per ben × 96 = 2.400 antigene µ l per piastra a 96 pozzetti; aggiungere 100 µ l per piastra supplementare grazie all'uso di un serbatoio per la pipetta multicanale; un totale di 2,5 mL di antige n per piastra).
-
Preparazione della sospensione RBC
- Calcolare il volume di sospensione di RBC necessari in base al numero di titolo 96 pozzetti micro piastre used (sospensione di RBC 50 µ l a ben × 96 = 4.800 sospensione di RBC µ l per piastra a 96 pozzetti; aggiungere 200 µ l per piastra supplementare grazie all'uso di un serbatoio per la pipetta multicanale) .
- Diluire la sospensione di stock di RBC (normalmente 10%, v/v; tranne tipo umano O) con PBS per rendere le concentrazioni adeguate per uccelli e mammiferi RBCs di 0,75% e l'1%, rispettivamente.
-
Preparazione della piastra 96 pozzetti micro
- Etichettare le piastre 96 pozzetti micro titolo (ID campione, controllo positivo e titolazione di ritorno). Si prega di controllare attentamente l'orientamento della piastra nella Figura 5 .
- Aggiungere 25 µ l di PBS in ogni pozzetto tranne per il primo pozzo della riga "titolazione di ritorno" (Figura 5, 12esima riga) usando la pipetta multicanale.
Nota: Una titolazione di ritorno è stata effettuata per verificare se la diluizione di antigene utilizzato è uguale a 4 unità di HA. Un titolo di antigene di 4 unità di HA è indicato se emagglutinazione si verifica nei primi tre pozzetti della riga "titolazione di ritorno", ma non nel quarto bene. - Aggiungere 50 µ l della soluzione dell'antigene preparato (descritta in 5.2.1) prima della riga "titolazione di ritorno" (12° fila).
- Aggiungere 25 µ l dei campioni del siero RDE-trattati prima dei pozzetti di righe da 1 a 10 su ogni piatto, usando la pipetta multicanale.
- Aggiungere 25 µ l di anti-siero appropriato per il primo pozzo della riga 11th come controllo positivo.
- Effettuare diluizioni seriali 2 volte con il trasferimento di 25 µ l dal pozzo primo di ogni riga (1-12) nei pozzetti successivi utilizzando una pipetta multicanale. Mescolare pipettando su e giù 10 - 15 volte per ogni passaggio di diluizione. Gli stessi suggerimenti possono essere utilizzati per ogni passaggio di diluizione per campione.
- Scartare il finale 25 µ l di pozzetti ultimi.
- Aggiungere 25 µ l della soluzione dell'antigene utilizzando una pipetta multicanale in ciascun pozzetto di righe 1 a 11 (campioni di siero e anti-siero). Gli stessi suggerimenti possono essere utilizzati se non toccano i pozzi.
- Aggiungere 25 µ l di PBS invece di antigene in ciascun pozzetto della riga "titolazione di ritorno" (12° fila).
- Toccare la piastra con attenzione 10 volte su tutti e quattro i lati per mescolare.
- Coprire la piastra con un coperchio e incubare a temperatura ambiente per 30 min. Non spostare la piastra durante l'incubazione.
- Aggiungere 50 µ l della sospensione RBC ad ogni pozzetto.
- Toccare la piastra con attenzione 10 volte su 4 lati per mescolare.
- Coprire la piastra con un coperchio e incubare a temperatura ambiente per la giusta quantità di tempo a seconda della specie di RBC usato (Vedi tabella 2). Non spostare la piastra durante l'incubazione.
-
La piastra di lettura
Nota: Il titolo di HI è il reciproco della diluizione ultimo del siero (anti-) che inibisce completamente emagglutinazione. È importante considerare che i sieri RDE-trattati erano già diluiti 1:4 e dopo la fase di diluizione seriale, i sieri nei pozzetti primi vengono diluiti 1:8, che corrisponde ad un titolo di HI di 8.- Lettura di RBCs aviaria
- Inclinare il piatto 90° per 25 s.
Nota: Inclinando la piastra è cruciale per la differenziazione dei modelli di aviaria, perché tutti i tre diversi tipi di agglutinazione (completamente agglutinate, parzialmente agglutinate e non agglutinate) vengono visualizzati come un pulsante quando non inclinato. - Contrassegnare i risultati immediatamente, mentre la piastra è ancora in posizione inclinata, su uno schema stampato della piastra 96 pozzetti. L'agglutinazione dei globuli rossi aviaria sono mostrati nella Figura 3.
- Inclinare il piatto 90° per 25 s.
- Lettura di globuli rossi dei mammiferi
- Contrassegnare i risultati su uno schema stampato della piastra 96 pozzetti, senza inclinare il piatto.
Nota: In caso di emoagglutinazione, le cellule agglutinate non stabilirsi considerando che alle emazie non agglutinate appaiono come un alone nella parte inferiore del pozzo. L'aureola delle cellule parzialmente agglutinate è meno intenso e ha un diametro maggiore (Figura 3). - Determinare l'HI di ogni campione e trasferirlo in una tabella basata su computer (Figura 6)
- Nota: Parzialmente agglutinate pozzi sono stati determinati come un titolo inferiore. Ad esempio, se un campione di siero inibisce completamente emagglutinazione fino a ben 4 (diluizione 1: 64) e il 5th bene (diluizione 1: 128) è parzialmente agglutinati, quindi il titolo di HI è impostato al titolo inferiore 64 per l'analisi finale (Figura 6, 4° fila).
- Contrassegnare i risultati su uno schema stampato della piastra 96 pozzetti, senza inclinare il piatto.
- Lettura di RBCs aviaria
-
Preparazione della soluzione dell'antigene

Figura 6 : Lettura del test HI con aviaria RBCs. Pre- e post-vaccinazione influenza indotta risposta anticorpale specifica è determinata dal test HI. In questo esempio, persona uno ha più alti titoli di HI di persona due. Entrambe le persone mostrano una risposta dell'anticorpo dopo la vaccinazione; 180 giorni dopo la vaccinazione i titoli dell'anticorpo di entrambe le persone sono in diminuzione ancora. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Risposta dell'anticorpo indotto pre- e post-vaccinazione contro l'Influenza A H3N2
La risposta anticorpale indotta dal vaccino è stata valutata in 26 volontari sani che hanno ricevuto un vaccino influenzale inattivato trivalente subunità contenenti l'Influenza A/H1N1/California/2009, A/H3N2/Texas/2012 e B/Massachusetts/02/2012 prima del 2014 / 2015 stagione influenzale. Figura 6 Mostra un esempio rappresentativo di 2 destinatari del vacc...
Discussione
Quantificazione dei titoli di anticorpo specifico del virus dell'influenza di pre- e post-vaccinazione è uno strumento importante e necessario per gli studi di vaccino. Sulla base delle misure di surrogato di protezione contro l'infezione del virus, ad esempio di sieroprotezione (> 01:40) o sieroconversione (aumento di 4 volte del titolo), vaccinazione strategie possono essere ottimizzato9. Utilizzando i protocolli forniti può determinare: (i) il potenziale di emagglutinazione di un particolare ...
Divulgazioni
A.E. è stato sostenuto da borse di studio una ricerca dal programma "FNS Ambizione Score" (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" Università di Basilea, Basilea Stiftungsinfektionskrankheiten e Bangeter Rhyner Stiftung. La rosa è stata sostenuta da una sovvenzione della Technical University di Graz, Austria. J.L. riconosce il sostegno di una borsa di studio iPhD dell'iniziativa SystemsX.ch nel programma di biologia di sistemi (9th chiamata).
Riconoscimenti
nessuno.
Materiali
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
Riferimenti
- . Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. f. G. S. V., Values, M. . The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042 (2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282 (2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940 (2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420 (2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614 (2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon