A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Assay עיכוב (איץ ' אי) Hemagglutination אופטימיזציה לכמת נוגדן ספציפי שפעת Titers
* These authors contributed equally
In This Article
Summary
הפרוטוקולים הציג מתארים כיצד לבצע וזמינותו עיכוב hemagglutination לכמת נוגדן ספציפי שפעת titers מן הדוגמאות סרום מקבלי החיסון נגד שפעת. הבדיקה הראשונה קובע ריכוזים מיטביים אנטיגן ויראלי על-ידי hemagglutination. הבדיקה השניה מכמתת נוגדן ספציפי שפעת titers על ידי עיכוב hemagglutination.
Abstract
נוגדנים titers משמשים כסמני הפונדקאית להגנה סרולוגית נגד שפעת, פתוגנים אחרים. מידע מפורט על ייצור נוגדנים מראש, שלאחר חיסון נדרש להבין חסינות חיסון-induced. מאמר זה מתאר פרוטוקול נקודה-מאת-נקודת אמין לקביעת נוגדן ספציפי שפעת titers. הפרוטוקול הראשון מתאר שיטה כדי לציין הכמויות אנטיגן הדרושים עבור hemagglutination, דיפרנצילי המשקלל הריכוזים לשימוש עוקבות בפרוטוקול השני (hemagglutination assay, HA assay). פרוטוקול השני מתאר כימות של נוגדנים ספציפיים שפעת titers נגד זנים ויראלי באמצעות טורי לדילול האדם סרום או תא תרבות supernatants (hemagglutination עיכוב assay, HI assay).
כדוגמה יישומית, אנו מראים את התגובה נוגדן של עמית בריאים, אשר קיבל חיסון שפעת מוחלש. בנוסף, אשיג בין וירוסים שפעת שונים מוצג, שיטות כדי למזער אשיג באמצעות סוגים שונים של תאי דם אדומים בעלי חיים (RBCs) מוסברים. הדיון מדגיש את היתרונות ואת החסרונות של מבחני הציג איך הקביעה של נוגדנים ספציפיים שפעת titers יכול לשפר את ההבנה של חסינות הקשורות החיסון.
Introduction
זיהום בנגיף שפעת מזוהה עם ניכר תחלואה, תמותה גבוהה עלויות הבריאות1,2,3,4. בפרט, קשישים, תינוקות, נשים בהריון, חולים עם מחלה כרונית נמצאים בסיכון לתוצאות קליניות חמורות יותר. לכן, חיסון נגד במחזור זני וירוס שפעת היא המדד העיקרי להפחתת הנטל של המחלה בקרב אוכלוסיות בסיכון גבוה אלה. העלייה של התגובה החיסונית בודדים לאחר החיסון, למשל, נוגדנים ספציפיים שפעת מעל סף מגן, מפחיתה את הסיכון בודדים של זיהום ובאופן כללי את הסבירות של שידור ויראלי בתוך אוכלוסיה 5. הבנה מפורטת של חיסון-induced ההורמונאלית התגובה החיסונית באוכלוסיות שונות ועל -פני בקבוצות גיל שונות הוא רכיב מפתח כדי לענות על שאלות קליניות חשובות-6,-7,-8 , 9, כגון: למה יש חלק מהחולים הקשישים זיהומים למרות החיסון הקודם? מהו "טוב" ו- "מספיק" חיסון-induced להגנה? באיזו תדירות צריך חיסון להיות מוחל על חולים immunosuppressed להגיע titers מגן? מהו המינון היעיל ביותר? מהי ההשפעה של אדג'וונט הרומן על חיסון שלאחר נוגדן titers? המדד של ייצור נוגדנים ספציפיים חיסון עשוי לעזור לענות על שאלות חשובות אלה ולשפר את תוצאות חיסון.
כימות של נוגדנים ספציפיים וירוס titers יכול להתבצע עם שיטות חיסוניות שונות. זה כולל מוצק-שלב10 או מבוסס-חרוז אליסה11 מבחני HI assay12, מבחני נטרול13. שיטות מבוססות-אליסה לאפשר ההקרנה של כמויות גדולות יחסית של הדוגמאות סרום נגד אנטיגנים שונים. כמו כן, אימונוגלובולינים (Ig) M ו- IgG ספציפי פתוגן ניתן בנפרד לסייר. למרות המאפיינים של אנטיגן, למשל, רצף ליניארי חומצת אמינו או חלקיקים דמויי וירוס עשוי להשפיע על הכריכה של נוגדנים, הספקטרום של epitopes פוטנציאלי רחב מאוד, ואינו מספק מידע על אם נוגדן התגובה יש רלוונטיות פונקציונלי.
לעומת זאת, וזמינותו ניטרול קובע את הפוטנציאל של נוגדנים באופן פונקציונלי לעכב את הזיהום של תאים, לכן ומשקף הניטרול פוטנציאליים. עם זאת, שיטה זו היא עבודה מאוד אינטנסיבית, דורש culturing של ספציפי תא קווים ולחיות וירוסים, לכן, זה זמן רב, יקר, והוא דורש ציוד מיוחד.
מאמר זה מתאר שלב אחר שלב פרוטוקול מבוסס-ארגון הבריאות העולמי WHO HI12 לכמת נוגדן ספציפי שפעת titers. Hemagglutination היא תופעת האופיינית של וירוסים מסוימים שמוביל התלכדות של אריתרוציטים. עיכוב של האפקט הזה עם המטופל סרה מאפשר מדידת ריכוז נוגדן מעכבות, אשר משקף השפעה ניטרלית.
יש לשנות את זרימת העבודה של הפרוטוקול-המי כדי לאפשר טיפול יעיל יותר של דוגמאות מרובות במקביל, ובכך מקצר את הזמן הנדרש. הפרוטוקול הראשון מתאר את הקביעה של הפוטנציאל התלכדות של אנטיגן מסוים שפעת. בעשותו כן, נקבע ריכוז אנטיגן שפעת הנכון עבור פרוטוקול השני. החלק הזה יש לחזור עם כל אנטיגן ויראלי חדש, כמו גם כל אצווה של דם.
פרוטוקול השני מתאר את הקביעה של נוגדנים ספציפיים שפעת titers. הפרוטוקולים הציג ממוטבים עבור החקירה של וירוס שפעת ודוגמאות בנסיוב אדם לעומת זאת, אותה ניתן להחיל גם הדוגמאות סרום העכבר או תרבית תאים supernatants מ מגורה תאים חיסוניים, למשל, תאי-B וירוסים ספציפיים. תוצאות יכול להיקבע כמו titers נמדד מוחלטת. במחקרים רבים חיסון, את titers הגיאומטרי ועל סמך 95% מוצגים עבור כל אוכלוסייה מסוימת. פרשנות, seroprotection או seroconversion משמשים לעתים קרובות כדי לתאר את הרגישות של אוכלוסיה לוירוס מסוימים. Seroprotection מוגדרת כייל של ≥1:40, seroconversion כמו כייל נוגדנים 4-fold יותר מ להגביר עם הישג של seroprotective titers בין שתי נקודות זמן (הנפוץ ביותר לפני מתן החיסון, חיסון שלאחר 30 יום משמשים).
פרוטוקולים קל לשימוש, הם ניתן להתאים למגוון רחב של שאלות המחקר. בפרט, הם יכולים לשמש כדי לקבוע באופן אמין ובמהירות titers נוגדנים נגד וירוסים שונים אחרים עם יכולת hemagglutination, כגון חצבת, polyomaviruses, חזרת או אדמת14,15,16 .
Protocol
הפרוטוקולים המחקר אושרו דרך ועדת הבדיקה האתית מקומי (www.EKNZ.ch), ממנו כל המשתתפים הושג בכתב הסכמה מדעת.
1. סרום אוסף
- איסוף הדוגמאות סרום מבני זמן נקודות עניין. במחקר זה, אספנו sera ב ימים 0 (זמן של חיסון שפעת) +7, +30, +60, +180 לאחר החיסון.
- כדי להשיג את הנסיוב, centrifuge צינורות מדגם ב g 1,200 x 10 דקות בטמפרטורת החדר (20-25 ° C).
הערה: דגימות דם שאינו centrifuged לאחסן ב 4 ° C, לא יותר מ- 24 שעות ביממה. - Aliquot הנסיוב לתוך צינורות שונים (הקפאה-בקבוקונים), הקפאת ב-80 מעלות צלזיוס עד השימוש.
- לבצע את מבחני הבאים batch-wise, כולל כל הזמן-הנקודות של אדם אחד כדי להפחית את השתנות בתוך המטופל.
2. הכנת אנטיגנים
התראה: חמש אנטיגנים שונים משמשים (ראה טבלה של חומרים). להכין אנטיגנים במעבדה אבטחה ברמה 2 (BSL-2).
- על פי הוראות היצרן, לשקם את תוכן הכולל אחד האמפולה אנטיגן שפעת lyophilized עם 1.0 מ ל מים מזוקקים ולאפשר אנטיגן מומס לעמוד למשך תקופה מינימלית של 5 דקות בטמפרטורת החדר לפני שתמשיך.
- Aliquot הפתרון אנטיגן 1.5 מ ל צינורות ומקפיאים ב-80 מעלות צלזיוס עד שימוש נוסף.
3. הכנת פילטרט של כולרה
הערה: פילטרט של כולרה משמש קולטן השמדת האנזים (RDE) על פי פרוטוקול אשר12. פעולה זו מסירה את מעכבי מולדת של הסרום אשר יפריע assay ה-17.
- לשקם את RDE lyophilized על פי הוראות היצרן.
- לאחסן את הפתרון RDE בשפופרת 15 מ"ל ב 4 ° C עד שימוש נוסף.
4. חה Assay
הערה: כדי להבטיח כי מבחני HI השוואה בין מספר לוחות, כמות זהה של חלקיקי וירוס יש להשתמש עבור כל צלחת. וזמינותו HA (נקרא גם טיטור HA) מבוצע כדי לכמת את חלקיקי וירוס הכרחי עבור hemagglutination, מתועדים HA יחידות. "יחידה" של hemagglutination הוא יחידה מבצעית תלויים השיטה שבה נעשה שימוש עבור טיטור HA, והוא לא מדידה של סכום מוחלט של וירוס. לפיכך, יחידת HA מוגדר הכמות של וירוס צריך agglutinate אמצעי שווה של השעיה RBC סטנדרטית. לפי מי, הסכום הרגיל המשמש עבור וזמינותו HI הוא 4 יחידות HA 25 µL. ראו איור של עקרון וזמינותו HA איור 1.

איור 1 : עקרון hemagglutination וניגוד hemagglutination. Hemagglutination לא מתרחש במצב שליטה שלילי ללא נוגדנים (עמודה שמאלית) ווירוסים, אריתרוציטים hemagglutinate רק בנוכחות שנגיף שפעת (העמודה האמצעית). עם זאת, כאשר hemagglutinin של נגיף שפעת חסומה על ידי נוגדנים ספציפיים וירוס ואז לא hemagglutination יכול להתרחש (בעמודה הימנית). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
הערה: RBCs בשימוש תלויות בסוג של נגיף שפעת וזמינותו (טבלה 1). יתר על כן, עבור סוגים שונים של צלחות כייל מיקרו 96-ובכן, זמן הדגירה, כמו גם את המראה של התאים שאינם מאוגדים שונים (טבלה 2).
| שפעת אנטיגן | A/קליפורניה/7/09 (H1N1) | A/שוויץ/9715293/2013 (H3N2) | A/טקסס/50/2012 (H3N2) | B/בריסביין/60/08 | B/מסצ'וסטס/02/2012 | ||
| RBC מינים | עוף | קביה | קביה | טורקיה | טורקיה | ||
טבלה 1: שפעת אנטיגנים וסוגי המתאימים RBCs. על פי הוראות היצרן (לסטנדרטיזציה).
| RBC מינים | עוף | טורקיה | קביה | האדם סוג O |
| ריכוז RBCs (v/v) | 0.75% | 0.75% | 1% | 1% |
| סוג של microtiter צלחת | V התחתון | V התחתון | U התחתון | U התחתון |
| זמן הדגירה, RT | 30 דקות | 30 דקות | 1 שעה | 1 שעה |
| המראה של תאים שאינם מאוגדים | לחצן * | לחצן * | הילה | הילה |
בטבלה 2: Assay תנאים עם מינים שונים של RBCs. על פי הפרוטוקול WHO. (* זורם כאשר מטים את המדבקה).
-
הכנה של RBC ההשעיה
- לדלל את המתלים מניות של RBC (10%, וי/v; מלבד האדם סוג O) (ראה טבלה של חומרים) עם פוספט buffered תמיסת מלח (PBS) כדי להפוך ריכוז נאות עבור RBCs העופות, בתרבית של 0.75%, 1%, בהתאמה.

איור 2 : צלחת העיצוב של וזמינותו HA- טיטרציה HA מתבצע שבו כפילויות. אין אנטיגן נוספה על השורות שליטה. ראה גם באיור 4 לקביעת ריכוז אנטיגן הטוב ביותר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
-
הכנת צלחת מיקרו 96-ובכן כייל נוגדנים
הערה: ראה איור 2 סקירה כללית של העיצוב צלחת.- להוסיף µL 25 ל- PBS בארות 1 עד 12 של כל שורה בשימוש של צלחת מיקרו 96-ובכן כייל נוגדנים באמצעות פיפטה רב-ערוצי (איור 2). שימוש לצלחת בצורת V כייל מיקרו בעת עבודה עם RBCs העופות, כמו עוף, הודו. שימוש לצלחת בצורת U כייל מיקרו בעת עבודה עם יונקים RBCs, כמו שפן וסוג האנושי O (טבלה 2).
- להוסיף 25 µL של שפעת אנטיגן הבאר הראשונה של אנטיגן-השורות, המסודרות בשורות כפילויות. אין אנטיגן נוסף על השורות שליטה. השורות שליטה עליו לא הראה אפקט hemagglutination, לשמש כפקדי שלילי (איור 2).
- מבצע לדילול 2-fold טורי על-ידי העברת 25 µL מהבאר הראשונה של אנטיגן-השורות רצופות בארות באמצעות פיפטה רב-ערוצי. לערבב כל שלב דילול על ידי pipetting למעלה ולמטה בעדינות 10 פעמים.
- למחוק את µL 25 הסופי הבארות האחרון.
- להוסיף µL 25 ל- PBS בארות 1 עד 12 של כל שורה בשימוש באמצעות פיפטה רב-ערוצי, על מנת להגיע הנפח הכולל של 50 µL לכל טוב.
- להוסיף אחד המשמש גם באמצעות פיפטה רב-ערוצי µL 50 של RBC ההשעיה.
- הקש על הצלחת בזהירות 10 פעמים בכל ארבעת הצדדים לערבב.
- מכסה את הצלחת עם מכסה, תקופת דגירה בטמפרטורת החדר של הכמות המתאימה של הזמן, בהתאם RBC מינים בשימוש (ראה טבלה 2). אל תזיז את הצלחת בעת המקננת.
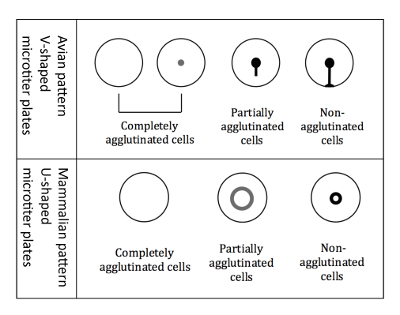
איור 3 : התלכדות דפוסי RBCs העופות, יונקים. בצורת V כייל מיקרו צלחות נעשה שימוש בעת עבודה עם RBCs העופות. המדידה מתבצעת בעמדה צלחת מוטה, ולהתחיל RBCs שאינם מאוגדים לדרוס ויוצרים צורה דמוית דמעה. צלחות בצורת U microtiter משמשים בעת עבודה עם RBCs יונקים. המדידה מבוצעת אז בעמדה שאינה מוטה, ויוצרים שאינם מאוגדים RBCs הילה קטן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
-
לקרוא את הצלחת
הערה: המדידה שונה במקצת בעת שימוש RBCs העופות לעומת יונקים RBCs, בגלל הבארות שונים בצורת כייל מיקרו (איור 3).- Readout RBCs העופות
- להטות את הצלחת 90° עבור 25 s.
הערה: הטיית הלוח הוא קריטי עבור הבידול של דפוסי העופות, מכיוון כל שלושה סוגים שונים של תבניות התלכדות (לחלוטין מאוגדים חלקית מאוגדים, לא מאוגדים) מופיע כלחצן כאשר לא מוטה. - סמן את התוצאות באופן מיידי, בעוד שלוחית עדיין נמצא במיקום אחורי, על ערכה המודפס של צלחת 96-ובכן. דפוסי התלכדות העופות RBCs מוצגים באיור3.
- להטות את הצלחת 90° עבור 25 s.
- Readout RBCs יונקים
- סמן את התוצאות על ערכה המודפס של צלחת 96-ובכן, ללא הטיית הלוח (מיקום אופקי על הספסל).
הערה: כאשר hemagglutination, התאים מאוגדים אל תתפשר לתחתית, ואילו תאים שאינם מאוגדים להופיע כהילה בתחתית הבאר. ההילה של התאים מאוגדים באופן חלקי הוא פחות אינטנסיבי ובעל קוטר גדול יותר (איור 3).
- סמן את התוצאות על ערכה המודפס של צלחת 96-ובכן, ללא הטיית הלוח (מיקום אופקי על הספסל).
- קביעת 4 יחידות HA.
הערה: נקודת הקצה של טיטור HA היא הבאר האחרון שבו מתרחשת hemagglutination מלאה. זה טוב מכיל 1 יחידה HA של וירוס. בשל דילולים 2-fold של אנטיגן, שתי בארות לקראת הקצה טיטור HA היא הבאר המכיל 4 יחידות HA של וירוס (איור 4).
- Readout RBCs העופות

איור 4 : Readout טיטרציה HA עם העופות RBCs כדי לקבוע את כייל של 4 יחידות HA- הסכום אנטיגן האופטימלי הנדרש hemagglutination נמדד על ידי וזמינותו hemagglutination (הנוגדנים טיטור). הבאר האחרון שבו hemagglutination מלאה מתרחשת נקודת הקצה טיטור HA ומכיל 1 יחידה HA. בגלל דילולים 2-fold של אנטיגן, שתי בארות לקראת הקצה טיטור HA, כייל מקביל 4 יחידות HA. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
5. היי Assay
הערה: זרימת העבודה של הפרוטוקול מוטבה כדי לאפשר טיפול יעיל יותר של דגימות מרובים בו זמנית, באמצעות PCR צינור, בעל פסים של הצנטרפוגה תרמו (ראו להלן).
-
הכנת הדוגמאות סרום
הערה: להכין את הדוגמאות סרום במעבדה BSL-2.- להפשיר את הדוגמאות סרום קפוא של כל נקודת הזמן של כל אדם (ראה שלב 1.2) בטמפרטורת החדר.
- להוסיף על aliquot של µL 10 של כל מדגם סרום המופשרים שפופרת של רצועת צינור ה-PCR (10-צינורות ברצועת אחד).
הערה: היתרון הגדול של שימוש פסים התחתית PCR היא כי פיפטה רב-ערוצי יכול לשמש את הפעולות הבאות וזמינותו HI; פעולה זו חוסכת זמן רב בעת בדיקת כמות גדולה של הדוגמאות סרום ובעת ביצוע חוזר על עצמו באמצעים של הדגימות באותו עבור titers נוגדנים נגד זנים וירוסים שונים. - אחסן את הדוגמאות סרום aliquoted רצועות צינור PCR ב-80 מעלות צלזיוס עד השימוש.
- יום אחד לפני ביצוע וזמינותו HI, להפשיר את aliquots דגימת נסיוב עניין בטמפרטורת החדר.
- להוסיף 10 µL של הנסיוב נגד המתאים שפופרת ריק ה-PCR.
הערה: כדי לשמש פקד חיובית, סרום אנטי נגד נגיף מסוים חייב להתאים הווירוס בשימוש. הפקד חיובית מאפשרת סטנדרטיזציה של צלחת ביצועים על הצלחות מרובות. - להוסיף 30 µL של כולירה פילטרט של פתרון לכל aliquot סרום, סרום אנטי (שלושה כרכים של פילטרט של כולרה לנפח 1 של סרום) באמצעות פיפטה רב-ערוצי.
- לשמור את המבחנות על מתלה ה-PCR 96-ובכן או טיפ-תיבה ריקה, מערבולת עבור 5 s.
- דגירה הדגימות בן לילה ב 37 ° C באמצעות של הצנטרפוגה תרמו.
- דגירה הדגימות ב 56 מעלות צלזיוס למשך 30 דקות להשבית את פילטרט של הכולרה שימוש של הצנטרפוגה תרמו.
הערה: בהתאם הצנטרפוגה תרמו, שלב זה ניתן לתכנת התהליך לאוטומטי עוד יותר. - לשמור את המבחנות על מתלה ה-PCR 96-ובכן או טיפ-תיבה ריקה, מערבולת עבור 5 s.
- לאחסן את הדגימות ב 4 ° C במקרר עד לשימוש וזמינותו HI.

איור 5 : צלחת עיצוב של זרימת העבודה של וזמינותו HI- חמש נקודות זמן של שני אנשים ניתן למדוד בצלחת. כייל היי נעה בין 8 ל 1,024. סרום אנטי של אנטיגן בשימוש שימש פקד חיובי ובוצע טיטור האחורי כדי לבדוק אם דילול אנטיגן שווה ל 4 יחידות HA. דילול טורי של דגימת נסיוב מוצג עבור נמענים חיסון הפרט 2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
-
היי assay
הערה: עבור איור של עקרון וזמינותו HI ראה איור 1. בהתאם הווירוס, מינים שונים של RBCs משמשים וזמינותו (טבלה 1). מינים שונים של RBCs נמצאים בשימוש סוגים שונים של צלחות 96-ובכן, זמן הדגירה, כמו גם את המראה של התאים שאינם מאוגדים שונה (טבלה 2). עבור HI וזמינותו, 4 יחידות HA של וירוס או אנטיגן יתווספו הסדרה דילול 2-fold של הדגימות.-
הכנה של הפתרון אנטיגן
- לחשב את עוצמת הקול של אנטיגן הפתרון הדרוש לפי מספר צלחות 96-ובכן בשימוש (אנטיגן µL 25 לכל טוב × 96 = 2,400 אנטיגן µL לכל צלחת 96-ובכן; להוסיף µL 100 לכל צלחת נוספת עקב השימוש של מאגר עבור פיפטה רב-ערוצי; סה כ 2.5 מ ל antige n לכל צלחת).
הערה: לדוגמה, אם מדידת הדוגמאות סרום 100 אז 10 צלחות הם הצורך (10 דוגמאות לכל צלחת): 2.5 מ ל x 10 = 25 מ של אנטיגן פתרון צריך בסך הכל. - להכין את הדילול נאותה של 4 יחידות HA האחסון מחושב באמצעות PBS.
הערה: 4 יחידות HA נקבעים עבור וזמינותו HA. עבור הכמות המתאימה של אנטיגן, מתחלק האחסון מחושב כייל נוגדנים המתאימים 4 יחידות HA. לדוגמה, 4 יחידות HA שיתאימו לדילול 1/64, ונזקקנו 15,000 µL של אנטיגן פתרון נדרשים: 15,000/64 = 234.4 µL של אנטיגן מומס שפעת lyophilized נוספים.
- לחשב את עוצמת הקול של אנטיגן הפתרון הדרוש לפי מספר צלחות 96-ובכן בשימוש (אנטיגן µL 25 לכל טוב × 96 = 2,400 אנטיגן µL לכל צלחת 96-ובכן; להוסיף µL 100 לכל צלחת נוספת עקב השימוש של מאגר עבור פיפטה רב-ערוצי; סה כ 2.5 מ ל antige n לכל צלחת).
-
הכנה של RBC ההשעיה
- לחשב את עוצמת הקול של RBC השעיה לפי מספר צלחות כייל מיקרו 96-ובכן בשימוש (50 ההשעיה RBC µL לכל טוב × 96 = 4,800 µL RBC ההשעיה לכל צלחת 96-ובכן; הוסף µL 200 לכל צלחת נוספת עקב השימוש של מאגר עבור פיפטה רב-ערוצי) .
- לדלל את המתלים מניות של RBC (בדרך כלל 10%, וי/v; מלבד האדם סוג O) עם PBS כדי להפוך ריכוז נאות עבור RBCs העופות, בתרבית של 0.75%, 1%, בהתאמה.
-
הכנת צלחת מיקרו 96-ובכן כייל נוגדנים
- תווית הלוחות כייל 96-ובכן מיקרו (לדוגמה מזהה, בקרה חיובית ו טיטור האחורי). אנא בדקו בקפידה את כיוון צלחת באיור 5.
- להוסיף µL 25 ל- PBS כל טוב למעט הבאר הראשונה של השורה "חזרה טיטור" (איור 5, שורה 12th ) באמצעות פיפטה של רב-ערוצי.
הערה: טיטור האחורי בוצעה כדי לבדוק אם דילול אנטיגן בשימוש שווה ל 4 יחידות HA. כייל נוגדנים אנטיגן של 4 יחידות HA מסומן אם hemagglutination מתרחשת הבארות הראשונים של השורה "חזרה טיטור", אך לא הרביעי היטב. - להוסיף 50 µL של הפתרון אנטיגן מוכן (שמתואר 5.2.1) הבאר הראשונה של השורה "חזרה טיטור" (שורהה 12).
- להוסיף 25 µL של הדגימות שטופלו RDE סרום הבארות הראשונים של שורות 1-10 על כל צלחת, באמצעות פיפטה רב-ערוצי.
- להוסיף 25 µL של הנסיוב נגד המתאים הבאר הראשונה של השורהה 11 כפקד חיובי.
- ביצוע דילולים 2-fold טורי על-ידי העברת 25 µL מהבאר הראשונה של כל שורה (1-12) וולס רצופים באמצעות פיפטה רב-ערוצי. מערבבים על-ידי pipetting למעלה ולמטה 10 - 15 פעמים עבור כל שלב דילול. הטיפים אותו יכול לשמש עבור כל שלב דילול לדגימה.
- למחוק את µL 25 הסופי הבארות האחרון.
- להוסיף 25 µL של הפתרון אנטיגן באמצעות פיפטה רב-ערוצי עם כל טוב של שורות 1 עד 11 (הדוגמאות סרום ו אנטי סרום). הטיפים אותו יכול לשמש אם שלא יגעו הבארות.
- להוסיף µL 25 ל- PBS במקום אנטיגן כל טוב של השורה "חזרה טיטור" (שורהה 12).
- הקש על הצלחת בזהירות 10 פעמים בכל ארבעת הצדדים לערבב.
- מכסה את הצלחת עם מכסה, דגירה בטמפרטורת החדר למשך 30 דקות. אל תזיז את הצלחת בעת המקננת.
- להוסיף 50 µL של ההשעיה RBC בכל טוב.
- הקש את הצלחת בזהירות 10 פעמים על כל 4 הצדדים לערבב.
- מכסה את הצלחת עם מכסה, תקופת דגירה בטמפרטורת החדר של הכמות המתאימה של הזמן, בהתאם RBC מינים בשימוש (ראה טבלה 2). אל תזיז את הצלחת בעת המקננת.
-
לקרוא את הצלחת
הערה: כייל HI הוא הערך של דילול האחרון (אנטי-) בסרום המעכב לחלוטין hemagglutination. חשוב לקחת בחשבון כי sera שטופלו RDE היו כבר מדולל 1:4, ואחרי השלב דילול טורי, שרה ב הבארות הראשונים הם 1 מדולל: 8, המתאים כייל HI 8.- Readout RBCs העופות
- להטות את הצלחת 90° עבור 25 s.
הערה: הטיית הלוח הוא קריטי עבור הבידול של דפוסי העופות, מכיוון כל שלושה סוגים שונים של תבניות התלכדות (לחלוטין מאוגדים חלקית מאוגדים, לא מאוגדים) מופיע כלחצן כאשר לא מוטה. - סמן את התוצאות באופן מיידי, בעוד שלוחית עדיין נמצא במיקום אחורי, על ערכה המודפס של צלחת 96-ובכן. הדפוסים התלכדות של העופות RBCs מוצגים באיור3.
- להטות את הצלחת 90° עבור 25 s.
- Readout RBCs יונקים
- סמן את התוצאות על ערכה המודפס של צלחת 96-ובכן, ללא הטיית הלוח.
הערה: כאשר hemagglutination, התאים מאוגדים ושבחיים לא אשתקע ואילו תאים שאינם מאוגדים להופיע כהילה בתחתית הבאר. ההילה של התאים מאוגדים באופן חלקי הוא פחות אינטנסיבי ובעל קוטר גדול יותר (איור 3). - לקבוע את HI של כל מדגם ולהעביר אותה טבלה המבוססת על מחשב (איור 6)
- הערה: בארות מאוגדים חלקית היו נחושים כמו כייל נמוך יותר. לדוגמה, דגימת נסיוב לחלוטין מעכב hemagglutination עד ה-4 טוב (דילול 1:64) 5 אתתאנון היטב (דילול 1:128) היא חלקית מאוגדים, אם כייל HI מוגדר כייל נמוך 64 לניתוח הסופי (איור 6, 4th שורה).
- סמן את התוצאות על ערכה המודפס של צלחת 96-ובכן, ללא הטיית הלוח.
- Readout RBCs העופות
-
הכנה של הפתרון אנטיגן

איור 6 : Readout וזמינותו HI עם העופות RBCs. טרום ואת שלאחר החיסון המושרה שפעת תגובת נוגדנים ספציפיים נקבעת על-ידי HI וזמינותו. בדוגמה זו, לאדם אחד יש titers HI גבוה יותר מאשר אדם שני. שני אנשים להציג מענה נוגדן לאחר החיסון; 180 ימים אחרי החיסון נוגדן titers של שני אנשים הם ירד שוב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
תוצאות
תגובת נוגדנים מושרה מראש, שלאחר חיסון נגד שפעת A H3N2
תגובת חיסון-induced נוגדן נאמד ב- 26 מתנדבים בריאים אשר קיבלו חיסון שפעת יחידת משנה כ מוחלש המכיל שפעת A/H1N1/קליפורניה/2009 A/H3N2/טקסס/2012, B/מסצ'וסטס/02/2012 לפני 2014 / עונת שפעת 2015. איור 6 מראה דוגמה נציג מקבלי הח...
Discussion
כימות של קדם, פוסט-חיסון שפעת וירוס נוגדן ספציפי titers היא כלי חשוב הכרחי ללימודי חיסון. בהתבסס על האמצעים הפונדקאית של הגנה מפני הידבקות בווירוסים, כגון seroprotection (> 1:40) או seroconversion (כייל נוגדנים 4-fold עלייה), חיסון אסטרטגיות יכול להיות מותאם9. באמצעות פרוטוקולים שסופקו ניתן לקבוע: (i) ?...
Disclosures
Æ נתמכה על ידי מחקר מעניקה מתוך התוכנית "SNSF Ambizione ציון" (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" אוניברסיטת בזל, שוויץ Stiftungsinfektionskrankheiten, Bangeter Rhyner Stiftung. L.K. נתמך על ידי מענק האוניברסיטה של גראץ, אוסטריה טכני. J.L. מאשר תמיכה על ידי אחוות iPhD יוזמת SystemsX.ch תוכנית ביולוגיה של מערכות (קריאתה 9).
Acknowledgements
. לא-
Materials
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
References
- . Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. f. G. S. V., Values, M. . The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042 (2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282 (2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940 (2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420 (2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614 (2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved