É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio de inibição (HI) de hemaglutinação otimizado para quantificar os anticorpos específicos de gripe
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os protocolos apresentados descrevem como realizar um ensaio de inibição de hemaglutinação para quantificar os anticorpos específicos de gripe de amostras de soro de destinatários de vacina contra gripe. O primeiro ensaio determina as concentrações de antígeno viral ideal por hemaglutinação. O segundo ensaio quantifica anticorpos específicos da gripe através da inibição da hemaglutinação.
Resumo
Anticorpos são comumente usados como marcadores de substituto para serológica proteção contra gripe e outros patógenos. Conhecimento detalhado da produção de anticorpos pré- e pós-vacinação é necessária para entender a imunidade induzida pela vacina. Este artigo descreve um protocolo ponto-a-ponto fiável para determinar anticorpos específicos de gripe. O primeiro protocolo descreve um método para especificar os montantes de antigénio necessários para hemaglutinação, que padroniza as concentrações para uso posterior no segundo protocolo (ensaio de hemaglutinação, ensaio HA). O segundo protocolo descreve a quantificação de anticorpos específicos de gripe contra diferentes cepas virais usando uma diluição serial de humana soro ou célula sobrenadantes de cultura (ensaio de inibição da hemaglutinação, ensaio HI).
Como um exemplo aplicado, mostramos a resposta imunitária de uma coorte saudável, que recebeu uma vacina trivalente inativada. Além disso, é mostrada a reactividade cruzada entre os vírus da gripe de diferentes e métodos para minimizar a reactividade cruzada usando diferentes tipos de animais células vermelhas do sangue (hemácias) são explicados. A discussão destaca vantagens e desvantagens dos ensaios apresentados e como a determinação de anticorpos específicos de gripe pode melhorar a compreensão da imunidade vacina-relacionados.
Introdução
Infecção com vírus da gripe está associada com altos custos de saúde1,2,3,4, mortalidade e morbidade considerável. Em particular, idosos, recém-nascidos, gestantes e pacientes com doença crônica são em risco para desfechos clínicos mais graves. Portanto, a vacinação contra estirpes de vírus da gripe de circulação é a principal medida para diminuir o fardo da doença nessas populações de alto risco. O aumento da resposta imune individual após a vacinação, por exemplo, anticorpos específicos gripe acima de um limite de proteção, reduz o risco individual de infecção e, em geral, a probabilidade de transmissão viral dentro de uma população de 5. um entendimento detalhado de induzida pela vacina resposta imune humoral em diferentes populações e em vários grupos de idade é um elemento-chave para responder a questões clínicas importantes6,7,8 , 9, tais como: por que alguns pacientes idosos têm infecções apesar da vacinação anterior? O que é uma "bom" e "suficiente" proteção induzida pela vacina? Quantas vezes uma vacina deve ser aplicada a um paciente imunodeprimidos para alcançar títulos protetoras? Qual é a dosagem mais eficaz? Qual é o impacto de um romance adjuvante na pós-vacinação anticorpos? A medição da produção de anticorpos específicos de vacina pode ajudar a responder a estas importantes questões e melhorar os resultados da vacinação.
A quantificação de anticorpos específicos do vírus pode ser executada com vários métodos imunológicos. Isso inclui a fase sólida10 ou ensaios de11 ELISA grânulo-based, o HI ensaio12e neutralizante ensaios13. Métodos baseados em ELISA permitam o rastreio de relativamente grandes quantidades de amostras de soro contra vários antígenos. Além disso, imunoglobulinas (Ig) M e IgG patógeno-específicos podem ser separadamente explorados. Embora as características de um antígeno, por exemplo, a sequência linear de aminoácidos ou vírus-como partículas podem influenciar a ligação de anticorpos, o espectro de epítopos potenciais é muito amplo e não fornece informações sobre se um anticorpo resposta tem relevância funcional.
Em contraste, o ensaio de neutralização determina o potencial de anticorpos de funcionalmente inibir a infecção das células e, portanto, reflete a potencial de neutralização. No entanto, esse método é muito trabalhoso, exige o cultivo de específicos de linhas de células e viver o vírus, e portanto, é demorado, caro e requer equipamentos especiais.
Este artigo descreve um passo a passo o protocolo baseado na organização mundial de saúde OMS HI12 para quantificar os anticorpos específicos de gripe. Hemaglutinação é um efeito característico de alguns vírus, levando à aglutinação dos eritrócitos. A inibição deste efeito com soros de doentes permite a medição das concentrações de anticorpos inibitório, que reflete um efeito neutralizante.
Modificamos o fluxo de trabalho do WHO-protocolo para permitir uma manipulação mais eficiente de várias amostras ao mesmo tempo e reduzindo o tempo necessário. O primeiro protocolo descreve a determinação do potencial de aglutinação de um antigénio específico da gripe. Ao fazer isso, a concentração do antígeno de gripe correto é determinada para o segundo protocolo. Esta parte deve ser repetida com cada novo antígeno viral, bem como cada lote de sangue.
O segundo protocolo descreve a determinação de anticorpos específicos de gripe. Os protocolos apresentados são otimizados para a investigação de vírus da gripe e amostras de soro humano, no entanto, também pode ser aplicado para as amostras de soro de rato ou sobrenadantes de cultura de células de estimulada células imunes, por exemplo, as células específicas do vírus B. Resultados podem ser determinados como títulos de medida absolutos. Em muitos estudos de vacina, os média geométrica de títulos e o intervalo de confiança de 95% são mostradas para cada população específica. Para interpretação, soroproteção ou seroconversão são frequentemente usados para descrever a susceptibilidade de uma população a um determinado vírus. Soroproteção é definida como um título de ≥1:40 e a seroconversão como um título mais do que 4-fold aumentar com a conquista de títulos seroprotective entre dois pontos de tempo (normalmente mais vacinação pré e pós-vacinação 30 dias são utilizados).
Ambos os protocolos são fáceis de usar e podem ser adaptadas para uma ampla gama de questões de investigação. Em particular, podem ser usados para determinar de forma confiável e rapidamente os anticorpos contra vários outros vírus com capacidade para hemaglutinação, tais como polyomaviruses, sarampo, caxumba ou rubéola14,15,16 .
Protocolo
Os protocolos de estudo foram aprovados pelo Comitê de revisão ética local (www.EKNZ.ch) e foi obtido consentimento escrito de todos os participantes.
1. soro coleção
- Colete amostras de soro de humanos em pontos de tempo de interesse. Para este estudo, foram coletados sera dias 0 (tempo de vacinação da gripe), + 7, + 30, 60 e 180 após a vacinação.
- Para obter o soro, centrifuga os tubos de amostra em 1.200 x g durante 10 minutos à temperatura ambiente (20-25 ° C).
Nota: Amostras de sangue não-centrifugada devem ser armazenadas a 4 ° C e para não mais de 24 h. - O soro em tubos diferentes (cryo-frascos) e congelar a-80 ° C até o uso de alíquota.
- Realize os ensaios subsequentes batch-wise, incluindo todos os pontos de tempo de uma pessoa para reduzir a variabilidade dentro de um paciente.
2. preparação de antígenos
Cuidado: Cinco antígenos diferentes são usados (ver Tabela de materiais). Prepare antígenos em um laboratório de biossegurança nível 2 (BSL-2).
- De acordo com as instruções do fabricante, reconstituir o conteúdo total de uma ampola de antígeno liofilizado gripe com 1,0 mL de água destilada e permitir que o antígeno dissolvido repousar por um mínimo de 5 min à temperatura ambiente antes de prosseguir.
- Alíquota a solução do antígeno para 1,5 mL tubos e congelar a-80 ° C até utilização posterior.
3. preparação do filtrado de cólera
Nota: Filtrado de cólera é usado como um receptor de destruir a enzima (RDE), de acordo com o WHO protocolo12. Isso remove inatos inibidores do soro que iria interferir com o ensaio17.
- Reconstitua o liofilizado RDE de acordo com as instruções do fabricante.
- Armazene a solução RDE em um tubo de 15 mL a 4 ° C até utilização posterior.
4. HA ensaio
Nota: Para garantir que os ensaios de HI são comparáveis entre várias placas, a mesma quantidade de partículas de vírus deve ser usada por cada placa. O ensaio HA (também chamado de titulação HA) é realizado para quantificar as partículas de vírus necessárias para hemaglutinação e é gravado em unidades HA. Uma "unidade" de hemaglutinação é uma unidade operacional dependente do método utilizado para a titulação de HA e não é uma medição de uma quantidade absoluta de vírus. Assim, uma unidade HA é definida como a quantidade de vírus necessários para aglutinar um volume igual de uma suspensão padronizada do RBC. De acordo com a OMS, a quantidade padrão usada para o ensaio de HI é 4 unidades HA por 25 µ l. Para obter uma ilustração do princípio do ensaio HA ver Figura 1.

Figura 1 : Princípio de hemaglutinação e inibição da hemaglutinação. Não hemaglutinação ocorre em uma situação de controlo negativo sem vírus e anticorpos (coluna esquerda) e hemácias hemagglutinate apenas na presença de vírus da gripe (coluna do meio). No entanto, quando a hemaglutinina do vírus da gripe é bloqueada por anticorpos específicos do vírus, em seguida, sem hemaglutinação pode ocorrer (coluna direita). Clique aqui para ver uma versão maior desta figura.
Nota: As hemácias utilizadas são dependentes do tipo de vírus da gripe no ensaio (tabela 1). Além disso, vários tipos de placas de 96 poços micro de título, o tempo de incubação, bem como a aparência das células não aglutinadas diferentes (tabela 2).
| Antígeno da gripe | A/California/7/09 (H1N1) | A/Suíça/9715293/2013 (H3N2) | A/Texas/50/2012 (H3N2) | B/Brisbane/60/08 | B/Massachusetts/02/2012 | ||
| Espécie de RBC | Frango | Porquinho da Índia | Porquinho da Índia | Turquia | Turquia | ||
Tabela 1: antígenos da Influenza e correspondentes espécies de hemácias. De acordo com as instruções do fabricante (NIBSC).
| Espécie de RBC | Frango | Turquia | Porquinho da Índia | Tipo humano O |
| Concentração de glóbulos vermelhos (v/v) | 0,75% | 0,75% | 1% | 1% |
| Tipo de placa de microtitulação | Fundo de V | Fundo de V | Fundo de U | Fundo de U |
| Tempo de incubação, RT | 30 min | 30 min | 1 hora | 1 hora |
| Aparecimento de células não-aglutinadas | Botão * | Botão * | auréola | auréola |
Tabela 2: ensaio condições com diferentes espécies de glóbulos vermelhos. De acordo com o protocolo do WHO. (* flui quando inclinado).
-
Preparação da suspensão de RBC
- Diluir a suspensão das ações da RBC (10%, v/v; exceto humano tipo O) (ver Tabela de materiais) com fosfato, tampão salino (PBS) para fazer as concentrações adequadas para hemácias de mamíferos e aviária de 0,75% e 1%, respectivamente.

Figura 2 : Placa de concepção do ensaio HA. A titulação de HA é executada em duplicatas. Nenhum antígeno foi adicionado para as linhas de controle. Também consulte a Figura 4 para a determinação da melhor concentração do antígeno. Clique aqui para ver uma versão maior desta figura.
-
Preparação da placa de 96 poços Micro Titer
Nota: Consulte a Figura 2 para uma visão geral sobre o design da placa.- Adicione 25 µ l de PBS para poços 1 a 12 de cada linha usado de uma placa de 96 poços micro título usando uma pipeta multicanal (Figura 2). Utilize a placa de título micro em forma de V, quando se trabalha com hemácias aviária, como frango e Peru. Utilize a placa de título micro em forma de U quando trabalhando com hemácias dos mamíferos, como cobaia e humano tipo O (tabela 2).
- Adicione 25 µ l de antígeno de gripe para o primeiro poço de antígeno-linhas, que são arranjados em duplicatas. Nenhum antígeno é adicionado para as linhas de controle. As linhas de controle não devem mostrar um efeito de hemaglutinação e servir como controles negativos (Figura 2).
- Realizar uma diluição serial 2 vezes Transferindo 25 µ l do primeiro poço de antígeno-linhas sucessivas aos poços, usando uma pipeta multicanal. Misture a cada etapa de diluição pipetando subindo e descendo suavemente 10 vezes.
- Descarte o final 25 µ l de poços do passado.
- Adicione 25 µ l de PBS para poços de 1 a 12 de cada linha usado usando uma pipeta multicanal, a fim de atingir um volume total de 50 µ l por bem.
- Adicione 50 µ l de suspensão de RBC para cada um usado bem, usando uma pipeta multicanal.
- Bata a placa cuidadosamente 10 vezes em todos os quatro lados para misturar.
- Cubra o prato com uma tampa e incubar a temperatura para a quantidade adequada de tempo dependendo do RBC espécie utilizado (ver tabela 2). Não mova a placa durante a incubação.
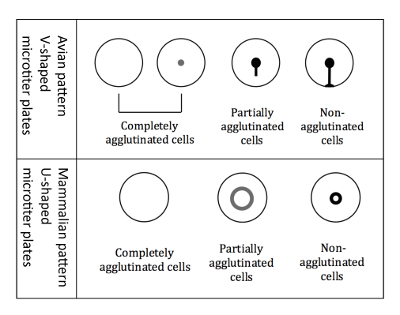
Figura 3 : Padrões de aglutinação de hemácias de mamíferos e aviária. Placas em forma de V título micro são utilizadas quando se trabalha com hemácias aviária. A leitura é realizada em uma posição inclinada da placa, e hemácias aglutinadas não começarem a correr para baixo formando um formato de lágrima. Placas de microtitulação em forma de U são utilizadas quando se trabalha com hemácias de mamíferos. A leitura, em seguida, é executada em uma posição não-inclinado, e hemácias não aglutinadas formam uma pequena auréola. Clique aqui para ver uma versão maior desta figura.
-
Lendo a placa
Nota: A leitura é um pouco diferente quando usando aviária hemácias em comparação com hemácias de mamíferos, por causa dos poços de diferentes em forma de micro titulação (Figura 3).- Leitura de hemácias aviária
- Incline o prato de 90° para 25 s.
Nota: Inclinação da placa é crucial para a diferenciação dos padrões aviária, porque todos os três tipos diferentes de padrões de aglutinação (completamente aglutinados, parcialmente aglutinados e não aglutinadas) aparecem como um botão quando não está inclinado. - Marca os resultados imediatamente, enquanto a placa ainda está em uma posição inclinada, em um esquema impresso da placa de 96 poços. Os padrões de aglutinação da RBCs aviária são mostrados na Figura 3.
- Incline o prato de 90° para 25 s.
- Leitura de hemácias de mamíferos
- Marca os resultados em um esquema impresso da placa de 96 poços, sem inclinação da placa (posição horizontal no banco).
Nota: Quando hemaglutinação ocorre, as células aglutinadas não resolver ao fundo, Considerando que as células aglutinadas não aparecem como um halo no fundo do poço. O halo das células parcialmente aglutinadas é menos intenso e tem um diâmetro maior (Figura 3).
- Marca os resultados em um esquema impresso da placa de 96 poços, sem inclinação da placa (posição horizontal no banco).
- Determinação de 4 unidades HA.
Nota: O ponto de extremidade de titulação de HA é o último poço onde ocorre a hemaglutinação completa. Isto bem contém 1 unidade HA de vírus. Por causa de 2 vezes diluições do antígeno, dois poços antes do ponto de extremidade de titulação de HA é o poço que contém 4 unidades HA de vírus (Figura 4).
- Leitura de hemácias aviária

Figura 4 : Leitura da titulação HA com hemácias aviária para determinar o título de 4 unidades HA. A quantidade de antígeno ideal necessária para hemaglutinação é medida pelo ensaio de hemaglutinação (ensaio de titulação de antígeno). O último poço onde ocorre a hemaglutinação completa é o ponto de extremidade de titulação de HA e contém 1 unidade HA. Devido as 2 vezes diluições do antígeno, dois poços antes do ponto final da titulação de HA, o título corresponde a 4 unidades HA. Clique aqui para ver uma versão maior desta figura.
5. HI ensaio
Nota: O fluxo de trabalho do protocolo foi otimizado para permitir uma manipulação mais eficiente de várias amostras ao mesmo tempo, usando PCR tubo de listras e um cycler térmico (veja abaixo).
-
Preparação das amostras de soro
Nota: Prepare amostras de soro em um laboratório BSL-2.- Descongelar as amostras de soro congelado de cada ponto de tempo de cada pessoa (consulte a etapa 1.2) à temperatura ambiente.
- Adicione uma alíquota de 10 µ l de cada amostra de soro descongelado para um tubo de uma tira de tubo PCR (10-tubos em uma tira).
Nota: A grande vantagem de usar tiras de tubo do PCR é que uma pipeta multicanal pode ser usada para as seguintes etapas no ensaio de HI; Isso economiza muito tempo ao testar uma grande quantidade de amostras de soro e quando executar repetidas medidas das mesmas amostras para anticorpos contra estirpes de vírus diferentes. - Armazene as amostras de soro aliquotadas nas tiras do tubo do PCR a-80 ° C até o uso.
- Um dia antes do ensaio de HI é executado, descongele as alíquotas de amostra de soro de interesse à temperatura ambiente.
- Adicione 10 µ l do antiapropriado soro para um tubo vazio de PCR.
Nota: Para servir como um controle positivo, o anticontra soro um vírus específico deve coincidir com o vírus usado. Controlo positivo permite a padronização do desempenho da placa sobre vários pratos. - Adicione 30 µ l de solução de filtrado de cólera para cada alíquota de soro e o anti-soro (3 volumes de cólera filtrado para 1 volume de soro) usando uma pipeta multicanal.
- Manter os tubos PCR em um rack de PCR de 96 poços ou uma dica-caixa vazia e o vórtice para 5 s.
- Incube as amostras durante a noite a 37 ° C, que usando um cycler térmico.
- Incube as amostras a 56 ° C durante 30 min inactivar o filtrado de cólera usando um cycler térmico.
Nota: Dependendo do cycler térmico, esta etapa pode ser programada para automatizar ainda mais o processo. - Manter os tubos PCR em um rack de PCR de 96 poços ou uma dica-caixa vazia e o vórtice para 5 s.
- Armazene as amostras em 4 ° C na geladeira até o uso para o ensaio de HI.

Figura 5 : Placa de design e fluxo de trabalho do ensaio HI. Cinco pontos de tempo de duas pessoas podem ser medidos em um prato. O título de HI varia de 8 a 1.024. Um antido soro antígeno utilizado serviu como um controle positivo e uma titulação de volta foi realizada para verificar se a diluição de antígeno é igual a 4 unidades HA. A série diluição da amostra soro é mostrada para 2 receptores de vacina individual. Clique aqui para ver uma versão maior desta figura.
-
Oi ensaio
Nota: Para obter uma ilustração do princípio do ensaio HI ver Figura 1. Dependendo do vírus, espécies diferentes de hemácias são utilizados para o ensaio (tabela 1). As diferentes espécies de glóbulos vermelhos são usadas em vários tipos de placas de 96 poços e o tempo de incubação, bem como a aparência das células aglutinadas não difere (tabela 2). Para o ensaio de HI, 4 unidades HA de vírus ou antígeno são adicionadas à série 2 vezes diluição das amostras.-
Preparação da solução do antígeno
- Calcular o volume da solução do antígeno necessário de acordo com o número de placas de 96 poços usada (antigénio de 25 µ l por bem × 96 = 2.400 µ l do antígeno por placa de 96 poços; adicionar 100 µ l por placa extra devido ao uso de um reservatório para a pipeta multicanal; um total de 2,5 mL de antige n por placa).
Nota: por exemplo, se 100 amostras de soro de medição então 10 placas são necessárias (10 amostras por placa): 2,5 mL x 10 = 25 mL da solução do antígeno necessária no total. - Prepare a diluição adequada de 4 HA de unidades para o volume calculado usando PBS.
Nota: 4 unidades HA são determinadas para o ensaio HA. Para a quantidade adequada de antígeno, divida o volume calculado pelo título correspondente a 4 unidades HA. Por exemplo, 4 unidades HA correspondem a uma diluição de 1/64, e precisávamos de 15.000 µ l da solução do antígeno são necessários: 15.000/64 = 234.4 µ l do antígeno gripe liofilizado dissolvidos são adicionados.
- Calcular o volume da solução do antígeno necessário de acordo com o número de placas de 96 poços usada (antigénio de 25 µ l por bem × 96 = 2.400 µ l do antígeno por placa de 96 poços; adicionar 100 µ l por placa extra devido ao uso de um reservatório para a pipeta multicanal; um total de 2,5 mL de antige n por placa).
-
Preparação da suspensão de RBC
- Calcular o volume de suspensão RBC necessário de acordo com o número de placas de 96 poços micro título usado (suspensão de RBC 50 µ l por bem × 96 = 4.800 µ l RBC suspensão por placa de 96 poços; adicionar 200 µ l por placa extra devido ao uso de um reservatório para a pipeta multicanal) .
- Diluir a suspensão das ações da RBC (normalmente 10%, v/v; exceto humano tipo O) com PBS tornar as concentrações adequadas para hemácias de mamíferos e aviária de 0,75% e 1%, respectivamente.
-
Preparação da placa de 96 poços micro título
- Rotule as placas de 96 poços micro título (ID de amostra, controle positivo e titulação de trás). Por favor, verifique a orientação da placa na Figura 5 cuidadosamente.
- Adicione 25 µ l de PBS a cada poço exceto para o primeiro poço da linha "titulação de volta" (Figura 5, 12ª linha) usando a pipeta multicanal.
Nota: Uma titulação de volta foi realizada para verificar se a diluição de antígeno usado é igual a 4 unidades HA. Um título de antígeno de 4 unidades HA é indicado se hemaglutinação ocorre nos três primeiros poços da linha "titulação de volta", mas não na quarta bem. - Adicione 50 µ l da solução do antígeno preparado (descrita em 5.2.1) para o primeiro poço da linha "titulação de volta" (12ª linha).
- Adicione 25 µ l das amostras de soro RDE-tratados aos primeiros poços de linhas de 1 a 10 em cada prato, usando a pipeta multicanal.
- Adicione 25 µ l do antiapropriado soro para o primeiro poço da linha 11th como controle positivo.
- Execute 2 vezes diluições em série pela transferência de 25 µ l do primeiro poço de cada linha (1-12) para poços sucessivos usando uma pipeta multicanal. Misture por pipetagem para cima e para baixo 10 - 15 vezes para cada etapa de diluição. As mesmas dicas podem ser usadas para cada etapa de diluição por amostra.
- Descarte o final 25 µ l de poços do passado.
- Adicione 25 µ l da solução do antígeno, usando uma pipeta multicanal para cada poço de linhas 1 a 11 (amostras de soro e anti-soro). As mesmas dicas podem ser usadas se não tocam os poços.
- Adicione 25 µ l de PBS em vez de antígeno para cada poço da linha "titulação de volta" (12ª linha).
- Bata a placa cuidadosamente 10 vezes em todos os quatro lados para misturar.
- Cubra o prato com uma tampa e incubar a temperatura ambiente por 30 min. Não mova a placa durante a incubação.
- Adicione 50 µ l de suspensão de RBC para cada poço.
- Bata a placa cuidadosamente 10 vezes em todos os 4 lados para misturar.
- Cubra o prato com uma tampa e incubar a temperatura para a quantidade adequada de tempo dependendo do RBC espécie utilizado (ver tabela 2). Não mova a placa durante a incubação.
-
Lendo a placa
Nota: O título de HI é a recíproca da última diluição do soro (anti-), o que inibe completamente a hemaglutinação. É importante considerar que o sera RDE-tratados já foram diluído 1:4 e após a etapa de diluição serial, o sera nos primeiros poços é diluídos 1:8, o que corresponde a um título de HI de 8.- Leitura de hemácias aviária
- Incline o prato de 90° para 25 s.
Nota: Inclinação da placa é crucial para a diferenciação dos padrões aviária, porque todos os três tipos diferentes de padrões de aglutinação (completamente aglutinados, parcialmente aglutinados e não aglutinadas) aparecem como um botão quando não está inclinado. - Marca os resultados imediatamente, enquanto a placa ainda está em uma posição inclinada, em um esquema impresso da placa de 96 poços. Os padrões de aglutinação de hemácias aviária são mostrados na Figura 3.
- Incline o prato de 90° para 25 s.
- Leitura de hemácias de mamíferos
- Marca os resultados em um esquema impresso da placa de 96 poços, sem inclinar o prato.
Nota: Quando hemaglutinação ocorre, as células aglutinadas não sossegar enquanto não aglutinadas células aparecem como um halo no fundo do poço. O halo das células parcialmente aglutinadas é menos intenso e tem um diâmetro maior (Figura 3). - Determinar o HI de cada amostra e transferi-lo para uma tabela baseada em computador (Figura 6)
- Nota: Parcialmente aglutinados poços foram determinados como um título inferior. Por exemplo, se uma amostra de soro completamente inibe a hemaglutinação até o 4º bem (diluição 1: 64) e o 5th bem (diluição de 1:128) é parcialmente aglutinada, então o título de HI é definido como o menor título 64 para a análise final (Figura 6, 4ª linha).
- Marca os resultados em um esquema impresso da placa de 96 poços, sem inclinar o prato.
- Leitura de hemácias aviária
-
Preparação da solução do antígeno

Figura 6 : Leitura do ensaio HI com hemácias aviária. A gripe pré e pós-vacinação induzida, resposta imunitária específica é determinada pelo ensaio de HI. Neste exemplo, a pessoa um tem maior concentração de HI que pessoa dois. Ambas as pessoas mostram uma resposta de anticorpos após a vacinação; 180 dias após a vacinação, que os anticorpos de ambas as pessoas são diminuídos novamente. Clique aqui para ver uma versão maior desta figura.
Resultados
Resposta de anticorpos induzidos pré e pós-vacinação contra Influenza A H3N2
A resposta de anticorpo induzida pela vacina foi avaliada em 26 voluntários saudáveis que receberam a vacina contra a gripe uma subunidade trivalente inativada contendo Influenza A/H1N1/Califórnia/2009, A/H3N2/Texas/2012 e B/Massachusetts/02/2012 antes de 2014 / temporada de gripe de 2015. A Figura 6 mostra um exemplo representativo de 2 receptores de vacin...
Discussão
Quantificação de anticorpos específicos vírus influenza pré- e pós-vacinação é uma importante ferramenta necessária para estudos de vacina. Com base nas medidas de proteção contra a infecção pelo vírus, tais como soroproteção substituto (> 01:40) ou seroconversão (aumento de 4-fold título), vacinação, estratégias podem ser otimizados9. Usando os protocolos fornecidos pode determinar: (i) o potencial de hemaglutinação, de um vírus específico e (ii) os anticorpos para o ví...
Divulgações
A.E. foi apoiado por uma pesquisa concede a partir do programa "SNSF Ambizione Score" (PZ00P3_154709), "Forschungsfond, strategischer Förderung Projekte" Universidade de Basel, Basel de Stiftungsinfektionskrankheiten e Bangeter Naraa Stiftung. L.K. foi apoiado por uma bolsa de técnico Universidade de Graz, Áustria. J.L. confirma apoio por uma comunhão IDoutora da iniciativa SystemsX.ch no programa de biologia de sistemas (9th chamada).
Agradecimentos
nenhum.
Materiais
| Name | Company | Catalog Number | Comments |
| 25 ml Disposable Multichannel Pipette Reservoirs | Integra | 4312 | |
| 8-well PCR tubes | Brand GMBH | 781332 | For serum aliquots |
| 96-well microtiter plate, U-shaped | TPP | 92097 | For HI assay when using mammalian RBCs |
| 96-well microtiter plate, V-shaped | Corning Costar | 3897 | For HI assay when using avian RBCs |
| Aqua ad iniect. Steril | Bichsel AG | 1000004 | For preparing influenza antigen and cholera filtrate solutions |
| Chicken RBC (10%) | Cedarlane | CLC8800 | 10% suspension of chicken red blood cells in Alsever's solution |
| Cholera filtrate | Sigma-Aldrich | C8772 | Used as receptor destroying enzyme (RDE) |
| Dulbecco's PBS | Sigma-Aldrich | D8537 | For diluting the serum samples, RBCs and antigens |
| Eppendorf Multichannel pipette, 12-channel, 10-100 µl | Sigma-Aldrich | Z683949 | |
| Eppendorf Multichannel pipette, 8-channel, 10-100 µl | Sigma-Aldrich | Z683930 | |
| Guinea Pig RBC (10%) | Cedarlane | CLC1800 | 10% suspension of guinea pig red blood cells in Alsever's solution |
| Influenza Anti-A/California/7/09 HA serum | NIBSC | 14/134 | Used as positive control at the HI assay |
| Influenza Anti-A/Switzerland/9715293/2013-like HA serum | NIBSC | 14/272 | Used as positive control at the HI assay |
| Influenza Anti-A/Texas/50/2012-Like HA Serum | NIBSC | 13/178 | Used as positive control at the HI assay |
| Influenza Anti-B/Brisbane/60/2008-HA serum | NIBSC | 13/254 | Used as positive control at the HI assay |
| Influenza Anti-B/Massachusetts/02/2012 HA serum | NIBSC | 13/182 | Used as positive control at the HI assay |
| Influenza antigen A/California/7/09 (H1N1)(NYMC-X181) | NIBSC | 12/168 | Inactivated, partially purified A/California/7/09 (H1N1)(NYMC-X181) virus (ca. 46µgHA/ml) |
| Influenza antigen A/Switzerland/9715293/2013 (NIB88) | NIBSC | 14/254 | Inactivated, partially purified A/Switzerland/9715293/2013 (NIB88) virus (ca. 55µgHA/ml) |
| Influenza antigen A/Texas/50/2012 (H3N2)(NYMCX-223) | NIBSC | 13/112 | Inactivated, partially purified A/Texas/50/2012 (H3N2)(NYMCX-223) virus (ca. 74µgHA/ml) |
| Influenza antigen B/Brisbane/60/2008 | NIBSC | 13/234 | Inactivated, partially purified B/Brisbane/60/2008 virus (ca. 42µgHA/ml) |
| Influenza antigen B/Massachusetts/02/2012 | NIBSC | 13/134 | Inactivated, partially purified B/Massachusetts/02/2012 virus (ca. 35µgHA/ml) |
| Serum-Tubes | S-Monovette, Sardstedt | 01.1601.100 | For serum extraction with clotting activator |
| Single Donor Human RBC, Type 0 | Innovative Research | IPLA-WB3 | Suspension of single donor human red blood cells in Alsever's solution (ca. 26%) |
| Turkey RBC (10%) | Cedarlane | CLC1180 | 10% suspension of turkey red blood cells in Alsever's solution |
| Phosphate Buffered Saline (PBS) | Gibco |
Referências
- . Prevention and control of seasonal influenza with vaccines. Recommendations of the Advisory Committee on Immunization Practices--United States, 2013-2014. MMWR Recomm Rep. 62, 1-43 (2013).
- Dominguez-Cherit, G., et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA. 302 (17), 1880-1887 (2009).
- Fox, B. D., et al. Pandemic influenza (H1N1): impact on lung transplant recipients and candidates. J Heart Lung Transplant. 29 (9), 1034-1038 (2010).
- Piercy, J., Miles, A., Krankheiten, S. B. f. G. S. V., Values, M. . The Economic Impact of Influenza in Switzerland: Interpandemic Situation. , (2003).
- Barclay, V. C., et al. Positive network assortativity of influenza vaccination at a high school: implications for outbreak risk and herd immunity. PLoS One. 9 (2), 87042 (2014).
- Baluch, A., et al. Randomized controlled trial of high-dose intradermal versus standard-dose intramuscular influenza vaccine in organ transplant recipients. Am J Transplant. 13 (4), 1026-1033 (2013).
- Haralambieva, I. H., et al. The Impact of Immunosenescence on Humoral Immune Response Variation after Influenza A/H1N1 Vaccination in Older Subjects. PLoS One. 10 (3), 0122282 (2015).
- Egli, A., et al. Vaccine adjuvants--understanding molecular mechanisms to improve vaccines. Swiss Med Wkly. 144, 13940 (2014).
- O'Shea, D., Widmer, L. A., Stelling, J., Egli, A. Changing face of vaccination in immunocompromised hosts. Curr Infect Dis Rep. 16 (9), 420 (2014).
- Meulemans, G., Carlier, M. C., Gonze, M., Petit, P. Comparison of hemagglutination-inhibition, agar gel precipitin, and enzyme-linked immunosorbent assay for measuring antibodies against influenza viruses in chickens. Avian Dis. 31 (3), 560-563 (1987).
- Martins, T. B. Development of internal controls for the Luminex instrument as part of a multiplex seven-analyte viral respiratory antibody profile. Clin Diagn Lab Immunol. 9 (1), 41-45 (2002).
- Webster, R., Cox, N., Stöhr, K. WHO Animal Influenza Manual. WHO/CDS/CSR/NCS. 2002.5, 1-99 (2002).
- Mittelholzer, C. M., et al. Human cell lines used in a micro neutralization test for measuring influenza-neutralizing antibodies. Scand J Immunol. 63 (4), 257-263 (2006).
- Hamilton, R. S., Gravell, M., Major, E. O. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol. 38 (1), 105-109 (2000).
- Kumakura, S., et al. Comparison of hemagglutination inhibition assay and enzyme immunoassay for determination of mumps and rubella immune status in health care personnel. J Clin Lab Anal. 27 (5), 418-421 (2013).
- Ogundiji, O. T., Okonko, I. O., Adu, F. D. Determination of measles hemagglutination inhibiting antibody levels among school children in Ibadan, Nigeria. J Immunoassay Immunochem. 34 (2), 208-217 (2013).
- Cwach, K. T., Sandbulte, H. R., Klonoski, J. M., Huber, V. C. Contribution of murine innate serum inhibitors toward interference within influenza virus immune assay. Influenza Other Respir Viruses. 6 (2), 127-135 (2012).
- Lee, P. S., et al. Receptor mimicry by antibody F045-092 facilitates universal binding to the H3 subtype of influenza virus. Nat Commun. 5, 3614 (2014).
- Blumel, B., et al. Age-related prevalence of cross-reactive antibodies against influenza A(H3N2) variant virus, Germany, 2003 to 2010. Euro Surveill. 20 (32), 16-24 (2015).
- Reber, A. J., et al. Seasonal Influenza Vaccination of Children Induces Humoral and Cell-Mediated Immunity Beyond the Current Season: Cross-reactivity with Past and Future Strains. J Infect Dis. , (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados