Method Article
Un método para la determinación y simulación de permeabilidad y difusión en un modelo de tejido 3D en una membrana Introduzca el sistema de placas de varios pocillos
En este artículo
Resumen
Un método para la determinación de la permeabilidad de una membrana de insertar el sistema de placas de varios pocillos y se presentan en silico optimización de parámetro para el cálculo de coeficientes de difusión mediante simulación.
Resumen
Modelos de piel in vitro cultivados se han convertido en cada vez más relevantes para los usos farmacéuticos y cosméticos y también se utilizan en el desarrollo de fármacos, así como la sustancia de prueba. Estos modelos se cultivan principalmente en sistemas de inserción de la membrana, su permeabilidad a diferentes sustancias es un factor esencial. Por lo general, los métodos aplicados para la determinación de estos parámetros requieren generalmente tamaños de muestra grandes (por ejemplo, celda de difusión de Franz) o laborioso equipo (p. ej., recuperación de fluorescencia Tras Fotoblanqueo (FRAP)). Este estudio presenta un método para la determinación de coeficientes de permeabilidad directamente en sistemas de membrana-inserción con tamaños de diámetro de 4,26 y 12,2 mm (área de la cultivación). El método se validó con agarosa y los geles de colágeno así como un modelo de células de colágeno que representan modelos de piel. Los procesos de impregnación de sustancias con diferentes tamaños moleculares y de la impregnación a través de modelos de celulares diferentes (que consiste en el gel de colágeno, fibroblastos y HaCaT) fueron descritos con precisión.
Por otra parte, para apoyar el método experimental anterior, se estableció una simulación. La simulación ajusta a los datos experimentales para las sustancias con tamaño molecular pequeño, hasta de 14 x 10-10 m de radio de Stokes (4.000 MW), y por lo tanto es una herramienta prometedora para describir el sistema. Además, la simulación puede reducir considerablemente el esfuerzo experimental y es suficientemente robusta como para ser ampliado o adaptado a configuraciones más complejas.
Introducción
Organo-típico culturas 3D se han convertido en poderosas herramientas para desarrollo de fármacos y sustancias prueba1. En este sentido, los modelos de piel humana son de especial interés debido a requisitos regulatorios, tales como ésos en la industria cosmética. Posteriormente han llevado al desarrollo de modelos 3D de la piel, para el uso en sus propias como único órgano culturas en placas de varios pocillos, o en chips multi multi-órgano en combinación con modelos de órganos adicionales, por ejemplo, el hígado2.
Con respecto a la cultivación de un equivalente de la piel, la interfaz de aire líquido (ALI) es un elemento esencial de diferenciación epidérmica adecuada3. Insertos de cultura de célula compuestas de un recipiente con una membrana permeable al líquido en la parte inferior se utilizan típicamente para establecer a un ALI. ALIs son ampliamente utilizados en modelos de piel disponibles en el mercado como la EpiDerm4, Phenion5y Episkin6, de la cultura de modelos de piel con tamaños de 96 pocillos (4,26 mm de diámetro) hasta placas de 12 pocillos (12,2 mm de diámetro). El método aquí descrito determina la penetración de sustancias en un sistema de inserción de la membrana.
El coeficiente de permeabilidad es un parámetro importante para evaluar la calidad de cualquier modelo de piel cultivada en comparación con la piel nativa5y se utiliza para evaluar la rapidez sustancias activas migran a través de la piel. Especialmente si productos medicamentos o cosméticos se deben aplicar a la piel, este parámetro es fundamental para comprender cuando precisamente los agentes activos pasan a través de él. Una simulación más puede ayudar a predecir el comportamiento del sistema y posteriormente reducir el necesario esfuerzo experimental requiere mucho tiempo, especialmente cuando un amplio conjunto de sustancias se trata.
La célula de difusión de Franz es de vanguardia para impregnación experimenta con piel y piel modelos5,6,7,8,9. Este dispositivo consiste en dos compartimientos con una muestra fija (barrera de difusión) en el medio. La sustancia a ensayar se aplica directamente sobre la parte superior de la muestra (compartimiento del donante) y la concentración del compuesto impregnante puede detectarse en el compartimiento opuesto de (aceptador). En el lado del aceptador, temperatura constante y la concentración de la sustancia homogénea se aseguran a través de una cámara de temperatura y un agitador magnético. Las muestras pueden tomarse de un brazo de muestreo en el lado del aceptador de la celda de Franz. Con un rango entre 19 y 179 cm de altura, este sistema es relativamente grande10,11. Otro método para la determinación de coeficientes de difusión en los tejidos y sustancias gelatinosa es FRAP. Esta técnica utiliza el principio de blanqueo fluorescente etiquetado partículas en el gel y luego determinar el tiempo de recuperación de la zona blanqueada para calcular el coeficiente de difusión12,13,14.
Además, espectroscopia de infrarrojo de transformación de Fourier (FTIR) se puede utilizar para detectar el movimiento de la partícula con absorción de luz infrarroja para determinar el proceso de impregnación de sustancias en la piel15,16. Sin embargo, estos u otros métodos por imágenes (por ejemplo, de espectroscopia de correlación de fluorescencia de dos fotones17) necesitan costo intensivo instrumentos.
En este artículo, un método se presenta a medir directamente la permeabilidad de una barrera dentro de un sistema de inserción de la membrana, donde se pueden cultivar un modelo de piel. Este método permite experimentos de permeabilidad para ejecutarse en un sistema compacto con un gran número de pequeñas muestras (bien tamaño hasta 4,26 mm). Esto está en contraste con la célula de difusión de Franz, donde un dispositivo separado es necesaria para cada sondeo, que tiene que ser montado en el dispositivo y es difícil de realizar para muestras pequeñas (tamaño de 4,26 mm). Además, puesto que el método no requiere instrumentación más importante (por ejemplo, un microscopio confocal o multifotón), se consigue una reducción en el tiempo y costo.
Todos los experimentos se realizaron en membrana microporosa insertar sistemas con una muestra (barrera) que consiste en gel de agarosa o un modelo de celular de colágeno en la membrana. Sustancias fluorescentes (donante) con diferentes tamaños moleculares fueron aplicadas a la parte superior de la muestra, y la concentración de sustancia permeado se detectó en la parte inferior (aceptador) con un lector de fluorescencia (ver figura 1). Para validar el método y comprobar la exactitud de esta simulación, geles de agarosa fueron producidos y utilizados como barrera. Los hidrogeles se utilizan generalmente para la investigación de los procesos de difusión y permeación en medio poroso en la ciencias biológicas13. El método entonces fue probado en un sistema de sembrado células consisten en una matriz de colágeno de fibroblastos primarios y adultos bajo calcio alta temperatura queratinocitos (HaCaT) las células humanas (modelo de célula-matriz), que es una piel simplificada modelo18,19 .
Además, el proceso de impregnación se simuló mediante simulaciones con dinámica de fluidos computacional del flujo. Se encontró que, mediante la optimización de parámetros, podría calcularse el coeficiente de difusión de los datos experimentales. En general, esta simulación ofrece diferentes aplicaciones; por ejemplo, es posible predecir un proceso de impregnación basado en experimentos cortos y la simulación puede reducir significativamente el número de experimentos.
Método experimental y simulación fueron diseñados para su aplicación a un sistema de órganos-en-un-chip1,20,21, específicamente el 2-órgano-chip (2 OC) desarrollado comercialmente1,22, 23,24,25. En principio, el proceso de impregnación de cualquier modelo de órgano basado en sistemas de inserción de la membrana puede describirse de esta manera.
Protocolo
1. preparación de la muestra para los estudios de permeabilidad
Nota: Para verificar las mediciones de permeabilidad y simulaciones, se utilizó una muestra formada por gel de agarosa o un modelo de matriz celular basado en el cultivo del modelo de piel.
- Gel de agarosa
- Disolver 0,2 g de agarosa en polvo de alta resolución en 10 mL de H2O (agua destilada doble).
- Mezclar la solución y calentar hasta 80 ° C. Mantener la temperatura durante 8 minutos.
- Aplicar gel de agarosa de 28,6 μl sobre la membrana 96 pozos sistema de membrana Insertar (4,26 mm de diámetro) o uso 226 μL para la membrana bien 12 insertar sistema (12 mm de diámetro) (p. ej., sistema Transwell).
- Espere 10 minutos hasta que el gel se solidifica.
- Gel de colágeno
Nota: Todas las medidas se realizan bajo condiciones estériles y las soluciones se mantienen en hielo para retrasar la polimerización del gel del colágeno.- Mezcla 125 μl de Hanks equilibrada solución de sal (HBSS) con 1 mL de solución de colágeno R 0,4% (colágeno de cola de rata).
- Valorar la solución con 1 M NaOH (hidróxido de sodio) (~ 6 μl) hasta que el color del rojo de fenol pasa de amarillo a rojo.
- Añadir 125 μl de Dulbecco modificado Eagle Medium (DMEM) + 10% de suero fetal de ternero (FCS) el gel de colágeno y mezclar cuidadosamente con una pipeta.
- Aplique 28,6 μl de gel de colágeno en la membrana del sistema de inserción de membrana de 96 pocillos o 226 μL para el sistema de inserción de membrana 12-bien.
- Deje el gel en una incubadora (37 ° C, 5% CO2) por 30 minutos.
- Modelo de células de colágeno con fibroblastos
Nota: Todos los pasos se ejecutan bajo condiciones estériles.- Preparar los fibroblastos primarios 5-7 días antes del experimento. Cultivar los fibroblastos con DMEM + 10% FCS en frascos de cultivo celular (75 cm2) y cambiar el medio cada 2-3 días.
Nota: Dependiendo de la configuración experimental, puede utilizarse un mayor número de células. - Retire el medio del frasco de cultivo celular (80% confluente) y lavar dos veces con 10 mL (matraz de cultivo 75 cm2) de tampón fosfato salino (PBS). Añadir 3 mL de 0.05% tripsina / ácido etilendiaminotetracético (EDTA) e incubar 3 min a 37 ° C.
- Golpear suavemente el frasco de cultura para separar las células de la superficie. Detener la reacción agregando 3 mL de DMEM + 10% FCS. Transferir la solución a un tubo de centrífuga.
- Centrifugue la suspensión de células en g x 120, eliminar el sobrenadante y resuspender las células con 0,5 mL de DMEM + 10% FCS.
- Contar las células y ajustar a una concentración de 0,5 x 106 células/mL.
Nota: Los pasos siguientes se ejecutan en el hielo para retrasar la polimerización del gel del colágeno. - Mezcla 125 μl de HBSS con 1 mL de solución de colágeno R 0,4%.
- Valorar la solución con 1 M NaOH (~ 6 μl) hasta que el color del rojo de fenol cambia de amarillo a rojo.
- Añadir 125 μl de suspensión celular (DMEM 10% FCS + 0,5 x 106 células/mL) en el colágeno gel y mezclar cuidadosamente con una pipeta.
- Aplicar 28,6 μl de gel de colágeno en la membrana del sistema de inserción de membrana de 96 pocillos o 226 μL para el sistema de inserción de membrana 12-bien.
- Deje el gel en una incubadora (37 ° C, 5% CO2) por 30 minutos.
- 75 μl de DMEM + 10% FCS se aplican en la superficie del gel y 300 μl a la placa del receptor de la membrana de 96 pocillos insertar sistema. De la membrana 12-bien Inserte el sistema, utilice un volumen de 590 μL para la superficie y 1.846 μL para la placa del receptor.
- Eliminar el medio de la superficie del modelo de la matriz de la célula (transporte aéreo) e Incube más el modelo de matriz de la célula durante 7 días. Utilizar 100 μl de medio en la parte inferior y cambiar el medio cada día.
- Preparar los fibroblastos primarios 5-7 días antes del experimento. Cultivar los fibroblastos con DMEM + 10% FCS en frascos de cultivo celular (75 cm2) y cambiar el medio cada 2-3 días.
- Modelo de células de colágeno con HaCaT
Nota: Todos los pasos se ejecutan bajo condiciones estériles.- Preparar el HaCaT 5-7 días antes de los siguientes pasos. Cultivar la HaCaT con DMEM + 5% FCS en un frasco de cultivo celular (75 m2) y cambiar el medio cada 2-3 días.
Nota: Dependiendo de la configuración experimental, puede utilizarse un mayor número de células. - Retire el medio del frasco y lavar dos veces con 10 mL (matraz de cultivo 75 cm2) de PBS. Añadir 3 mL de 0.05% tripsina/EDTA e incubar 10 min a 37 ° C. Detener la reacción con 3 mL de DMEM + 10% FCS. Transferir la solución a un tubo de centrífuga.
- Centrifugue la suspensión de células en g x 120, eliminar el sobrenadante y resuspender las células con 0,5 mL de DMEM + 10% FCS.
- Contar las células y ajustar a una concentración de 0,5 x 106 células/mL.
Nota: Los pasos siguientes se ejecutan en el hielo para retrasar la polimerización del gel del colágeno. - Mezcla 125 μl de HBSS con 1 mL de solución de colágeno R 0,4%.
- Valorar la solución con 1 M NaOH (~ 6 μl) hasta que el color del rojo de fenol cambia de amarillo a rojo.
- Añadir 125 μl de DMEM + 10% FCS el gel de colágeno y mezclar cuidadosamente con una pipeta.
- Aplicar 28,6 μl de suspensión celular sobre la membrana del sistema de inserción de membrana de 96 pocillos o 226 μL para el sistema de inserción de membrana 12-bien.
- Deje el gel en una incubadora (37 ° C, 5% CO2) por 30 minutos.
- 75 μl de la suspensión celular se aplican a la superficie del gel y añadir 300 μL de DMEM + 10% FCS a la placa del receptor de la membrana de 96 pocillos insertar sistema. De la membrana 12-bien Inserte el sistema, utilice un volumen de suspensión de células μl 590 para la superficie y 1.846 μl de DMEM + 10% FCS para la placa del receptor.
- Incubar el modelo de matriz de celdas durante 3 días; el medio de intercambio después de 2 días.
- Eliminar el medio de la superficie del modelo de matriz celular e incubar el modelo de matriz celular por más de 7 días. Utilizar 100 μl de medio en la parte inferior y cambiar el medio cada día.
- Preparar el HaCaT 5-7 días antes de los siguientes pasos. Cultivar la HaCaT con DMEM + 5% FCS en un frasco de cultivo celular (75 m2) y cambiar el medio cada 2-3 días.
- Modelo de células de colágeno con fibroblastos y HaCaT
Nota: Todos los pasos se ejecutan bajo condiciones estériles en el hielo para retrasar la polimerización del gel del colágeno. Preparar los fibroblastos como se describe en el paso 1.3 hasta el paso 1.3.5 y preparar un día HaCaT más adelante como se describe en el paso 1.4 hasta el paso 1.4.4.- Mezcla 125 μl de HBSS por 1 mL de solución de colágeno R 0,4%.
- Neutralizar la solución con 1 M NaOH (~ 6 μl) hasta que el color del rojo de fenol cambia de amarillo a un rojo violeta.
- Añadir 125 μl de suspensión de células de fibroblastos primarios consisten en DMEM + 10% FCS + 0,5 x 106 células/mL y colágeno gel y mezclar cuidadosamente.
- Aplicar 28,6 μl de suspensión de células a la membrana del sistema de inserción de membrana de 96 pocillos o 226 μL para el sistema de inserción de membrana 12-bien.
- Deje el gel en una incubadora (37 ° C, 5% CO2) por 30 minutos.
- A continuación, se aplican 75 μl de DMEM + 10% FCS en la superficie del gel y 300 μL en la placa del receptor de la membrana de 96 pozos sistema de inserción. De la membrana 12-bien Inserte el sistema, un volumen de 590 μl se utiliza para la superficie y 1.846 μL para la placa del receptor.
- Incubar durante 1 día a 37 ° C y 5% CO2.
- Eliminar el medio de la superficie y agregar una suspensión de células HaCaT con 0,5 x 106 células/mL. El volumen es el mismo descrito antes en paso 1.5.6.
- Incubar el modelo de matriz de celdas durante 3 días; el medio de intercambio después de 2 días.
- Eliminar el medio de la superficie del modelo de matriz celular e incubar el modelo de matriz celular por más de 7 días. Utilizar 100 μl de medio en la parte inferior y cambiar el medio cada día.
Nota: Para esta investigación, se prepararon 3 muestras de gel/celular-modelo para el sistema de inserción de membrana 12-bien. De la membrana de 96 pocillos insertar sistema, utilizamos 6 muestras para el modelo de célula de gel. Por medios estadísticos, 3 muestras son comunes. Pero para los experimentos en el sistema de inserción de membrana de 96 pocillos con modelo de matriz de colágeno fallas y desviaciones de la cultura de célula. Por lo tanto, elegimos un número mayor de muestras.
2. estudios permeabilidad de la membrana Introduzca el sistema de
-
Sustancia de donantes
Nota: Se producen dos sales de sodio de fluoresceína (NaFl).- Disolver NaFl en H2O en una concentración de 0.1 mg/mL y 0.01 mg/mL. El isotiocianato de fluoresceína diferentes-dextranes (FD) con un peso molecular de 4.000, 10.000, 20.000 y 40.000 g/mol se disuelve en H2O en una concentración de 2 mg/mL. Utilice estas soluciones como sustancia de donantes para los experimentos de permeabilidad (ver figura 1) con gel de agarosa.
- Para la configuración con el modelo de células de colágeno, preparar todas las soluciones con DMEM + 10% FCS, en lugar de agua.
Nota: Preparar las soluciones madre (10 x mayor concentración) de la sustancia de la donante. Pequeñas variaciones de la concentración de donantes pueden influir en los resultados del experimento de permeabilidad.
-
Método experimental
Nota: El experimento de permeabilidad es ejecutado a 37 ° C y una humedad de > 90%. Este parámetro garantiza la viabilidad de las células. Temperatura influye en el proceso de difusión para que los mismos parámetros se utilizan para los experimentos con el modelo de celular de colágeno, gel de colágeno y gel de agarosa. El volumen de información en el soporte se refiere al sistema de inserción de membrana 12-bien.- Preparar una membrana bien 96 (o 12) sistema de insertar con una barrera de agarosa gel (ver protocolo 1.1) o modelo de la célula (ver protocolo de 1.2-1.5) y la sustancia de la donante de fluorescencia.
- Preparar diluciones de 1:10, 1:20, 1:40, 1: 80, 1: 160 y 1:320 de la sustancia de donantes para establecer una curva estándar. Pipetear 300 μL (1.846 μL) de cada dilución en tres pozos de la placa del receptor. De la membrana 12-bien insertar una placa receptor separado el uso del sistema. Las diluciones en serie se utilizan para convertir la medida de la fluorescencia [RFU] la concentración equivalente [mg/mL].
- Agregar 75 μl (μL 590) de sustancia donante encima de la muestra (modelo de gel o células de agarosa) y 300 μL (μL 1.846) de sustancia aceptor (H2O o DMEM + 10% FCS) en la placa del receptor (ver figura 1).
Nota: Asegúrese que la superficie del líquido en la membrana sistema de insertar y en la placa del receptor tiene el mismo nivel para evitar la presión hidrostática. - Transferencia de todo el sistema en una coctelera en la incubadora. Ajustar el movimiento para lograr una mezcla homogénea (órbita de movimiento total es 1,5 mm, velocidad se ajusta a nivel 3.5, que se relaciona con una rotación de ~ 480 1/min) para evitar un gradiente de concentración, que influye en el proceso de difusión.
- Determinar la fluorescencia periódicamente cada hora. Para medir la fluorescencia, transferir el sistema de inserción de la membrana en un plato vacío y medir la fluorescencia en el receptor usando un lector de placas. Utilizar una longitud de onda de excitación de 485 nm y emisión de 535 nm para la fluoresceína.
- Ejecutar el experimento para 5 h.
Nota: Durante los experimentos, el líquido se evapora del todo el sistema. La evaporación cambia la concentración en el donador y aceptor e influye en los resultados. Este efecto es descuidado en el caso de una duración de 5 h, pero por más tiempo de funcionamiento que debe ser considerado.
-
Calcular el coeficiente de permeabilidad
- Para establecer la curva estándar, trazar la fluorescencia de las diluciones seriadas versus concentración y realizar una regresión lineal sobre los datos.
- Utilizar la pendiente de la regresión lineal para convertir los datos de fluorescencia de lo experimento de permeación en concentración. Con el fin de la simulación, convertir unidades de mol/m3.
- Parcela la concentración en función con el tiempo y establecer el segmento lineal de los datos (ver figura 2).
- Determinar la pendiente de esta parte lineal y calcular el coeficiente de permeabilidad según la siguiente ecuación (ver el ejemplo en la figura 2):
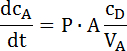
donde dcA/ dt es el cambio de la concentración de la sustancia en el lado del aceptador en el tiempo (la cuesta); CD es la concentración en el lado del donante; P es el coeficiente de permeabilidad; A es la superficie de infiltración, y VA es el volumen del aceptador. Esta ecuación se deriva de la primera ley de Fick y sólo se puede aplicar cuando CD » CA6,22. - Nota: Las concentraciones en el donante tienen que ser mucho más alto que la concentración detectada en el aceptador. Esto fue verificado en la configuración experimental.
3. simulación
Nota: La simulación se realizó con COMSOL Multiphysics 5.1. Se asume un conocimiento básico de este. Para la simulación de la difusión, se hacen los siguientes supuestos: (a) el coeficiente de difusión de las sustancias en H2O es mucho mayor en comparación con el gel. Para compensar esta diferencia, la simulación utiliza un valor de 1 x 10-9 m2/s que es mayor por un factor de 10 a 100 en comparación con el coeficiente de difusión de NaFl mediante gel de agarosa al 2%. (b) en el experimento, la sustancia se difunde a través de la barrera y luego a través de la membrana de la membrana insertar sistema. En contraste con la configuración experimental, la matriz de agarosa virtual gel o celular y la membrana se consideran una fase homogénea. (c) efectos de límite en las paredes se fijan "no deslizarse", todo el efecto deslizante en las paredes (no entre líquido y gel o líquido y celular modelo) del sistema de inserción de membrana son ignoradas y no son significativas para el proceso de difusión.
- Configuración de la simulación de la difusión
Nota: Estos pasos demuestran la configuración de la simulación del experimento de permeabilidad. Las simulaciones para los sistemas de inserción de membrana 96 y 12 bien se establecieron por separado. El módulo de "Transporte de especies químicas" utiliza una ecuación basada en la segunda ley de Fick de la difusión: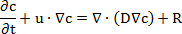
donde c es la concentración de la sustancia, t es el tiempo, u es la velocidad, D es el coeficiente de difusión, y R es la velocidad de reacción. La velocidad de reacción se descuidó porque ninguna reacción química ocurrió en el proceso de difusión.- Abrir el programa y comenzar un nuevo modelo. Eligió el "Asistente de modelo", modelo seleccione el 3D, añadir "Transporte de diluido especies" interfaz física en el menú desplegable, haga clic en "Estudio", seleccione el estudio "Tiempo dependiente" y haga clic en "Hecho".
- Ir a las "definiciones globales" y añadir "Parámetros" con click derecho. Ingrese los parámetros geométricos y físicos en la red (ver tabla 1, tabla 2y figura 3e).
Nota: La superficie cóncava del gel de agarosa en un sistema de inserción de membrana de 96 pozos se aproximó con una bola de inmersión. - Establecer la geometría del sistema de inserción de membrana de los experimentos. En el paso 3.2, se muestra un ejemplo de cómo construir la geometría del sistema de inserción de membrana de 96 pocillos. Se establece la unidad de longitud metro.
Nota: No construir la geometría todo para ahorrar tiempo de cálculo. Por el contrario, la geometría puede reducirse mediante el uso de líneas de centro de un cuarto de la geometría (ver figura 3a y 3b de la figura). - Añadir dos sondas de"dominio" en las "definiciones" (derecho haga clic en "Definiciones" y localice "Sonda") y seleccione una punta de prueba como el dominio aceptor y el otro como el dominio de los donantes. Elegir para ambos tipo "Media" y la expresión "c" con la unidad "mol/m3".
Nota: Este paso es opcional y muestra la concentración del aceptor y donante durante la simulación. - Establecer el coeficiente de difusión (Dc) en "Propiedades de transporte 1" en el "transporte de especies diluido"como "Dif_w".
Nota: "Propiedades de transporte 1" se utilizan para el dominio aceptor y donante. En el siguiente paso, se sobrescribirá el dominio de la barrera. - Añadir un segundo click "Propiedades de transporte 2" con la derecha en "Transporte de especies diluido" y seleccione la barrera (2) en la "selección de dominio". Según el objetivo de la simulación el coeficiente de difusión se puede establecer como valor de la barrera o como una variable dummy "D". Para el primer funcionamiento de prueba, establecer un valor de 2E-10 m2/s.
Nota: "D" se declarará más adelante en el paso 3.3. - En "Transporte de diluido especies" para "valores de inicial 1" definen la concentración como cero.
Nota: "Valores de inicial 1" se utilizan para barrera y aceptador de dominio. En el siguiente paso, se sobrescribirá el dominio de los donantes. - Añadir un segundo clic "Valores de inicial 2" con la derecha en "Transporte de especies diluido" y seleccione al donante (3) como el dominio. Establecer la concentración como la concentración inicial de la sustancia de la donante (p. ej., C_fl de la tabla 2).
- Añadir "Simetría 1" con click derecho sobre "Transporte de especies diluido", agregar y elegir todas las superficies de la "selección de límite", que reflejan la geometría todo (en el ejemplo de la geometría en el paso 3.2, es el límite de número 1, 2, 4, 5, 7, 8).
Nota: Se puede descuidar este punto si la geometría todo se creó. - Con un clic derecho en "Malla" agregar dos "libre tetraédrica". Seleccione la barrera (2) como dominio (cambio de nivel de entidad geométrica "Dominio"). Añadir "Tamaño" con click derecho en "Tetrahedral gratis 1" y para la malla predefinida "Más fino" de la membrana 12-bien inserta sistema o "extra fino" para una membrana de 96 pocillos inserta sistema.
- En el segundo "libre tetraédrica" Seleccione el aceptor y donante como dominio y predefinido del acoplamiento "Normal" una membrana 12-bien inserción sistema o "Más fino" para una membrana de 96 pocillos inserta sistema (ver figura 3 c y Figura 3d).
Nota: También es posible elegir una malla más gruesa para ahorrar tiempo de cálculo. Esto puede reducir la exactitud de los resultados. Haga clic en "Crear todos los" en"acoplamiento" a la geometría de la malla. - Iniciar la simulación con "calcular" en el "Estudio 1".
- Configuración de ejemplo para una geometría
Nota: Aquí se da un ejemplo de cómo configurar la geometría del sistema insertar membrana de 96 pocillos (con barrera cóncava). Todos los pasos se ejecutan en el módulo de geometría del programa. Se establece la unidad de longitud metro.- Generar un cilindro 1 (click derecho sobre "Geometría 1") con un radio de d_w/2 y altura de h_sp + h_b h_a.
- Generar un cilindro 2 con radio de d_tran/2, altura de h_b + h_a y z la posición de h_sp.
- Utilice la opción de "Diferencia" (clic derecho sobre "geometría 1", localizar "Booleanos y partición") para restar cilindro 2 cilindro 1. Eligió "cyl1" en los "objetos para agregar," activar "Objeto restar" y eligió "cyl2". El nuevo volumen es la geometría de la aceptante.
- Generar un cilindro 3 con radio de d_a/2, altura de h_b y la posición de z del h_sp.
- Generar una esfera de radio r y z r_z de la posición 1.
- Utilice la opción de "Diferencia" para sustraer de la esfera 1 (sph1) del cilindro 3 (cyl3). El nuevo volumen se llama 2 de diferencia.
- Generar un cilindro 4 con radio de d_a/2, altura de h_b + h_a y posición z de h_sp.
- Utilice la opción de "Diferencia" para restar el cilindro 4 (cyl4) de diferencia 2. El nuevo volumen es la geometría de la aceptante.
- Repita los pasos 3.2.4-3.2.6 para construir la barrera (el agarose gel o celular modelo en el experimento).
- Hacer una Unión 1 de todos los elementos de geometría (a la derecha haga clic en "Geometría 1", localizar "Booleanos y partición").
- Generar un bloque 1 con todos los bordes a una longitud de d_tran * 2, la posición x del - d_tran y de d_tran * 2.
- Generar un bloque de 2 con longitud del borde todos de d_tran * 2, la posición x del - d_tran * 2 y y de - d_tran.
- Utilice la opción de "Diferencia" para restar Unión 1 del bloque 1 y bloque 2.
- Adición de la optimización de parámetros para la simulación
Nota: Con la ayuda de optimización de parámetro puede montarse el coeficiente de difusión a los datos experimentales generados previamente. Las instrucciones siguientes muestran cómo integrar la parte de optimización en la simulación de la difusión. Asegúrese de que la simulación de la difusión está trabajando antes de iniciar estos pasos.- Añadir el módulo de física "Optimización" utilizando "Agregar físico" (optimización puede encontrarse en "Matemáticas" en la categoría "Optimización y sensibilidad") a la simulación. Haga clic en "Añadir al componente".
- Añadir "Variables" con click derecho en "Definiciones" (local en componente) y tipeen de las variables del cuadro 3.
Nota: La optimización del parámetro utiliza los números reales, es decir, el factor de 1-10 del coeficiente de difusión deben definirse por separado. - Añadir un "medio de 1" con click derecho sobre "Definiciones" en la sección "Componente de acoplamiento" y tipo en el nombre del operador "Aceptor".
- Generar un documento de texto independiente que contiene los datos experimentales.
Nota: Un punto y coma separa las columnas; un salto de línea separa filas. Declaración de tiempo se mide en segundos, la concentración en mol/m3. Eliminar el primer y segundo punto en la fase lag (ver figura 2) de los experimentos para evitar errores de montaje posible. Este es un ejemplo de cómo podría ser el documento de texto:
3540; 0.00216
7140; 0.00724
12240; 0.01707
15180; 0.02230
18660; 0.02697
21540; 0.02931
Este ejemplo puede utilizarse para probar la simulación. - Añadir "Objetivo Global Least-Squares" con click derecho en "Optimización", adjuntar el documento de texto del paso 3.3.4 a los "datos experimentales" y definir la primera columna como "columna de tiempo 1" con la derecha haga clic en "Objetivo Global de mínimos cuadrados" y la segunda columna como "Valor de columna 1" con click derecho en "Objetivo Global de mínimos cuadrados". En la "expresión" de "Valor de columna" tipo de la variable "C".
- Añadir "Control Variables globales 1" con click derecho sobre "Optimización" y declaran "D_search" como una variable con el valor inicial "1" límite inferior "0" y límite superior "1000".
- Añadir "Optimización" con click derecho en "Estudio 1" y eligió "SNOPT" como un método de optimización solver. Establecer la tolerancia de optimalidad a 1E-9.
Nota: Si la simulación no converger, aumentar la tolerancia de optimalidad. Tenga en cuenta que la simulación sea inexacta si la tolerancia de optimalidad es demasiado grande. - Iniciar la optimización de parámetro con "calcular" en "estudio". No se olvide de establecer el coeficiente de difusión en la barrera como "D".
Resultados
Experimentos de permeabilidad de una membrana de 96 pocillos Inserte sistema con gel de agarosa al 2% como una barrera se llevaron a cabo con el fin de evaluar la exactitud de una simulación. Sal de sodio de la fluoresceína (NaFl) y fluoresceína isotiocianato-dextranes (FD) fueron utilizados para verificar el impacto del tamaño molecular de la sustancia difusora de 5 x 10-10 m para arriba a 45 x 10-10 m radio de Stokes (40.000 376.27 mol wt). Optimización de parámetros nativos de la simulación se utilizó para ajustar la simulación a datos experimentales.
Para ello, laderas de sólo las partes lineales de la permeabilidad simulada se compararon con los resultados experimentales. Para pequeños tamaños moleculares, datos experimentales y simulación fueron en buen acuerdo con 99.2% NaFl y 80.2% para FD 4.000 (ver figura 4a y Figura 4b). Mayor tamaño molecular había generado desviaciones mayores mostrando correlaciones del 50,5% para FD 10.000, 79.7% de 20.000 FD y el 53,6% de 40.000 FD. Progresión de la curva en las simulaciones mostraron un retraso en el inicio y un aumento más fuerte en el curso posterior de las gráficas (ver figura 4 c–4e).
Coeficientes de permeabilidad y coeficientes de difusión simulada se muestran en cuadro 4. El coeficiente de penetración disminuye con el aumento de tamaño molecular. Desviación estándar fue entre 0.08 x 10-8 m/s y 0.47 x 10-8 m/s (N = 7), que correspondió a un error absoluto de entre 4.18% y 46.15%. Los experimentos con moléculas más grandes demostraron un mayor error absoluto. Los coeficientes de difusión simulada se comportaban de manera muy similar a coeficientes de permeabilidad experimental. Sustancias con mayor radio de Stokes demostraron disminuir los coeficientes de difusión y el error absoluto osciló entre el 9.09% y 18.46% (N = 3).
En experimentos de impregnación adicional, cuatro tipos de modelo de células de colágeno diferentes fueron utilizados como barreras en una membrana 12-bien insertar sistema. Estos modelos constituyen un modelo libre de la célula y un modelo de celular con diferentes combinaciones de los fibroblastos primarios en el gel de colágeno y HaCaT en la superficie. Se utilizaron las siguientes combinaciones: colágeno (col) como un modelo sin células, colágeno + fibroblastos (Col. + F.), colágeno HaCaT (Col. + H.) y colágeno fibroblastos + HaCaT (Col. + f + H.). Sal de sodio de la fluoresceína con DMEM + 10% FCS se utilizó como sustancia de donantes. Para la imagen se utilizan el análisis del modelo de células de colágeno, coloración con hematoxilina y eosina (HE). Esta coloración fue realizada utilizando el protocolo del fabricante. En la figura 5, se muestra tal una mancha con un modelo Col. + F. + H.. Tiñe ligeramente la estructura del tejido de la matriz de colágeno. Los fibroblastos se encuentran en la matriz y los núcleos de los fibroblastos y las células HaCaT se tiñen en color violeta. Encima de la matriz de colágeno, hay una capa que contiene muchos núcleos, que deben ser los núcleos de la HaCaTs, una capa envolvente en la parte superior el modelo del edificio.
En el cuadro 5, aparecen coeficientes de permeabilidad experimental y coeficientes de difusión simulada. Se aprecia una tendencia para la mayoría de los modelos con HaCaT, que tienen coeficientes de permeabilidad, difusión inferiores en comparación con los modelos sin HaCaT. El error absoluto de los coeficientes de permeabilidad es 10.9-24.4% y para la difusión coeficientes 5,2% - 12.9%.
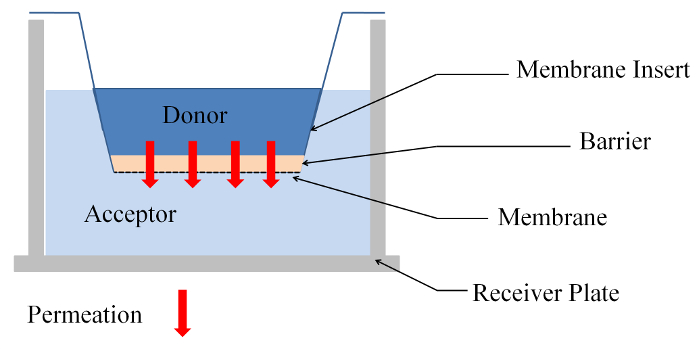
Figura 1: vista lateral del experimento de permeabilidad de una membrana insertar sistema. Haga clic aquí para ver una versión más grande de esta figura.
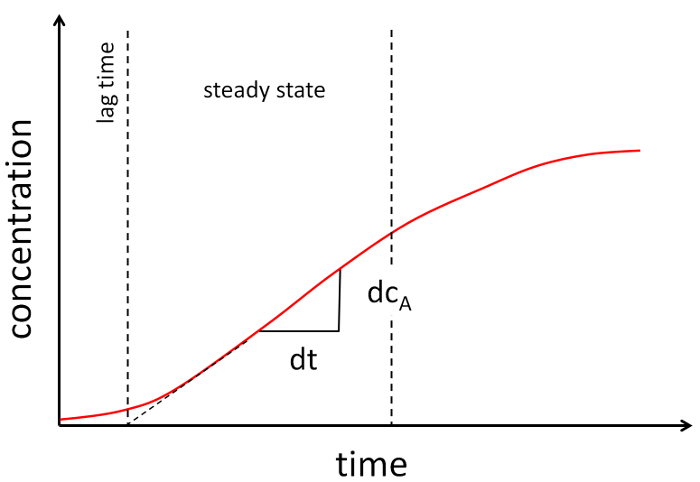
Figura 2: gráfico de ejemplar de un experimento de permeabilidad. La concentración del aceptador se grafica en el tiempo. Dos líneas punteadas del soporte de la parte casi lineal de la gráfica. La pendiente de la parte lineal se utiliza para determinar el coeficiente de permeabilidad. Haga clic aquí para ver una versión más grande de esta figura.
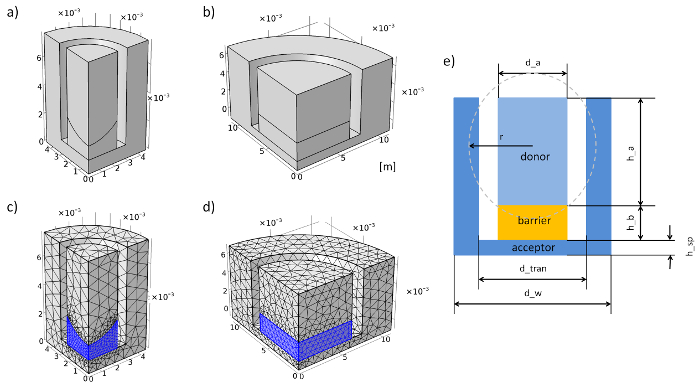
Figura 3: geometría y acoplamiento de la membranas inserción el sistema en la simulación. (a) geometría de la membrana de 96 pozos sistema de inserción. sistema de inserción (b) geometría de la membrana 12-bien. sistema de inserción de (c) acoplamiento de la membrana de 96 pocillos. (d) acoplamiento de la membrana 12-bien insertar sistema. (e) corte transversal y los parámetros de la membrana inserción sistema. Haga clic aquí para ver una versión más grande de esta figura.
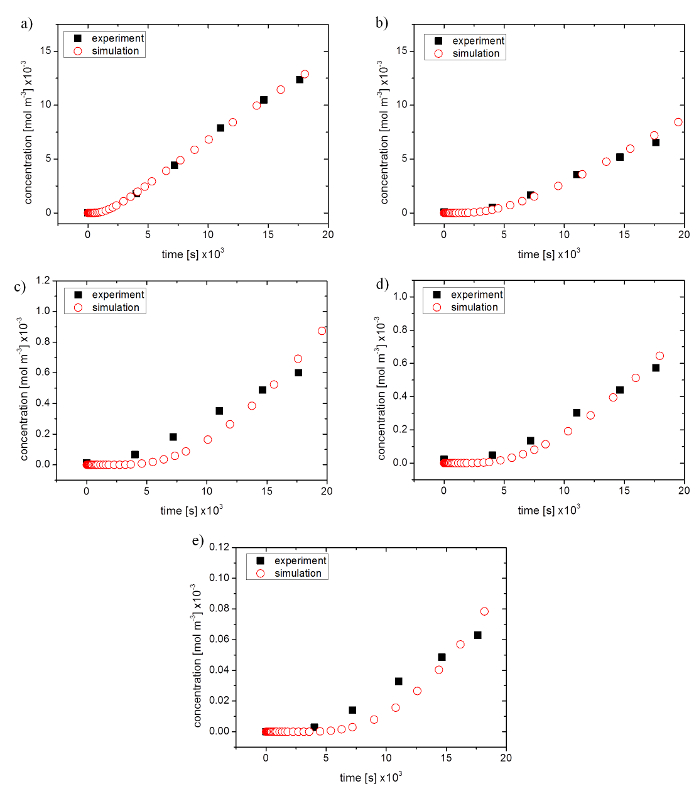
Figura 4: comparación de los datos experimentales de un experimento de permeación a la simulación optimizado. (un) sal de sodio de la fluoresceína, (b) fluoresceína isotiocianato-dextran 4.000 mol peso, (c) 10.000 pesos de mol, mol de (d) 20.000 pesos y (e) 40.000 mol peso haga clic aquí para ver una versión más grande de esta figura.
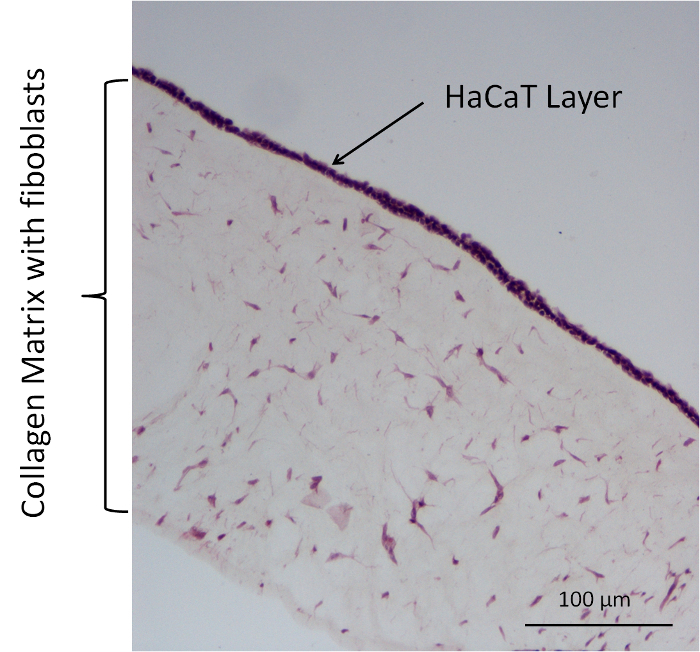
Figura 5: Representante HE teñido de un modelo de celular de colágeno (fibroblastos, colágeno + HaCaT). Haga clic aquí para ver una versión más grande de esta figura.
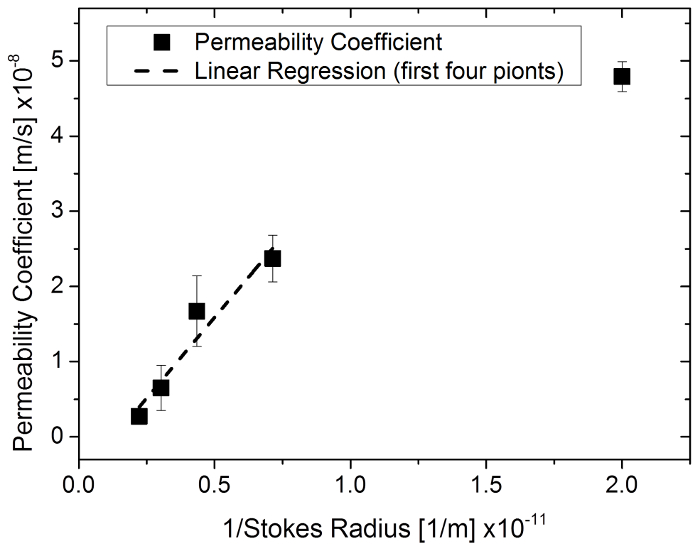
Figura 6: coeficiente de permeabilidad en función del radio 1/Stokes usando sal de sodio de la fluoresceína y fluoresceína isotiocianato-dextrán en una membrana de 96 pocillos insertar sistema. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre | Experession para 96 sistema bien en mm | Expresión para el sistema de 12 pozos en mm | Descripción |
| d_tran | 5.65 [mm] | 14.7 [mm] | Diámetro del pozo |
| d_a | 4.26 [mm] | 12.1 [mm] | Diámetro de la membrana |
| d_w | 8.79 [mm] | 21.97 [mm] | Diámetro del aceptador |
| h_b | 2 [mm] | 2 [mm] | Altura de la barrera |
| h_sp | 1 [mm] | 1 [mm] | Distancia entre el bien y la parte inferior |
| h_a | 4.73 [mm] | 5.24 [mm] | Alto del aceptador |
| b | h_b/2 | - | Profundidad de inmersión |
| r | ((d_a)^2+4*b^2)/(8*b) | - | Radio de inmersión bola+ |
| r_z | r + h_b | - | z-posición de la bola de inmersión+ |
Tabla 1: parámetros de la geometría para la simulación de "Transporte de especies químicas". + Sólo para ser utilizado para la simulación de agarosa gel en membrana bien 96 Inserte el sistema.
| Nombre | Expresión | Valor | Descripción |
| C_fl | 0.1 [mg/ml]/376.28 [g/mol] | 0.26576 mol/m2 | Concentración de Fl.So. |
| C_4 | 2 [mg/ml] / 4000 [g/mol] | 0,5 mol/m2 | Concentración de FD 4.000 |
| C_10 | 2 [mg/ml] / 10000 [g/mol] | 0,2 mol/m2 | Concentración de FD 10.000 |
| C_20 | 2 [mg/ml] / 20000 [g/mol] | 0,1 mol/m2 | Concentración de FD 20.000 |
| C_40 | 2 [mg/ml] / 40000 [g/mol] | 0,05 mol/m2 | Concentración de FD 40.000 |
| Dif_w | 1E-9 [m ^ 2/s] | 1E - 9m2/s | Coeficiente de difusión de agua de mezcla |
Tabla 2: Parámetros físicos para la simulación de "Transporte de especies químicas".
| Nombre | Expresión | Descripción |
| C | Acceptor(c) | Determinación de la concentración del receptor |
| D | D_search * 1e-10 | Cambio de factor d |
Tabla 3: Parámetros para la simulación de "Optimización".
| Impregnar | Coeficiente de permeabilidad (m/s) x 10-8 | Coeficiente de difusión (m/s2) x 10-10 | Radio de Stokes de permeado (m) x 10-10 |
| Fl.So. | 4.79 ± 0.20 | 1.94 ± 0.34 | 5 |
| FD 4.000 | 2,37 ± 0.31 | 0.65 ± 0,12 | 14 |
| FD10, 000 | 1.67 ± 0.47 | 0.22 ± 0.02 | 23 |
| FD 20.000 | ± 0.65 0.30 | 0,29 ± 0.04 | 33 |
| FD 40.000 | ± 0.27 0.08 | ± 0.14 0.02 | 45 |
Tabla 4: coeficiente de permeabilidad y difusión de sustancias con diferente radio de Stokes mediante gel de agarosa al 2% + de la membrana en una membrana de 96 pocillos insertar sistema. (sal de sodio de la fluoresceína = FL. So., dextrano fitc = FD).
| Modelo | Coeficiente de permeabilidad (m/s) x 10-8 | Coeficiente de difusión (m/s2) x 10-10 |
| Col. | 2.18 ± 0.29 | 1.22 ± 0.06 |
| Col. + F. | 1,77 ± 0,38 | 0.93 ± 0,12 |
| Col. + H. | 1.64 ± 0.40 | 0,96 ± 0.05 |
| Col. + f + H. | 1.65 ± 0.18 | 0.88 ± 0.11 |
Tabla 5: coeficiente de permeabilidad y difusión de la sal de sodio de la fluoresceína a través de un modelo de celular de colágeno en un 12-membrana bien insertar sistema (Col. = colágeno, f el. = fibroblastos, H. = HaCaT).
Discusión
Este estudio documenta un método desarrollado para cuantificar la permeabilidad a través de una construcción de tejido diseñada sobre una membrana. Impregnación de sustancias con diferentes tamaños moleculares mediante gel de agarosa fue examinado primero para probar y validar el método y la simulación correspondiente. Es bien sabido que moléculas más pequeñas se impregnan más rápido a través de una malla de matriz (con la excepción del efecto en la filtración de gel por cromatografía de permeabilidad). Observaciones similares fueron hechas con experimentos de exclusión de tamaño de las sustancias a través de la esclera26, membrana epidérmica humana27, piel humana17rata piel28. Una correlación inversa entre los coeficientes de permeabilidad y el correspondiente radio de Stokes (el radio de una esfera dura que se mueve con la misma velocidad de difusión que las moléculas se describe, generalmente más pequeñas que el radio eficaz de la molécula) se ha demostrado 26 , 28y una relación similar se observó en experimentos con sustancias de diferentes tamaños moleculares. Mediante la representación de los coeficientes de permeabilidad sobre radio 1/Stokes, se encontró una correlación lineal sobre los cuatro grupos con el menor tamaño molecular (R2 = 0,93) (figura 6). Esto indica que los coeficientes de permeabilidad simulado con el método propuesto en una gama realista.
El error del 46.15% de los experimentos es ligeramente más grande que divulga para los experimentos de permeabilidad con el Franz difusión celular sistema10. Una posible explicación podría ser la distribución de tamaño de fluoresceína isotiocianato de dextrano, que se discute más adelante.
El método descrito tiene importantes ventajas en comparación con los métodos usando el sistema de célula de difusión de Franz. En primer lugar, la configuración es más compacta; los experimentos se ejecutan directamente en un sistema de inserción de membrana, que tiene la escala de una placa bien comercial (∼ 13 x 8,5 cm). Esto permite varias muestras simultáneamente, mientras que una célula de difusión de Franz separada es necesaria para cada muestra. En segundo lugar, la permeabilidad de un modelo de piel puede medirse directamente en la inserción de la membrana, donde realiza el cultivo. Usando células de difusión de Franz, las muestras tienen que ser tomado hacia fuera y montada en el sistema, que es más engorroso para pequeñas muestras y es también más lento.
Experimentos de impregnación con matrices de células de colágeno demostraron que este método puede ser aplicado con éxito a los sistemas de semillas de células. El modelo presentado aquí se verificó para los modelos de piel; sin embargo, el método puede aplicarse a otros tipos de cultivos de células orgánicas, por ejemplo, del riñón o del hígado.
En este estudio, se utilizó un modelo de células de colágeno en la cual las células HaCaT cubrían totalmente la superficie del modelo (ver figura 5). Esto condujo a una reducción del coeficiente de permeabilidad, demostrando que el método es lo suficientemente sensible para distinguir el coeficiente de permeabilidad entre un modelo de células de colágeno con y sin una capa de HaCaT. Idealmente, un modelo de piel debe construir una barrera, que se acerca a la epidermis de una piel real29, y por lo tanto es importante verificar la calidad (p. ej., edificio de dermis, epidermis) de la modelo de piel antes de su uso real. El desarrollo de un modelo de piel se puede visualizar con técnicas de tinción y cuantificado de la detección de piel colágeno y proteína30,31,32. El coeficiente de permeabilidad también puede ser un factor importante para evaluar el desarrollo del modelo de piel, pero se requieren experimentos adicionales para confirmarlo. Como se mencionó anteriormente, este método permite ejecutar múltiples muestras en paralelo. También es posible tomar muestras durante el cultivo para medir la permeabilidad y así observar el desarrollo de este parámetro del modelo de piel.
Cabe señalar que la permeabilidad se mide a través de un gel/colágeno--modelo celular y una membrana simultáneamente. El coeficiente de permeabilidad detectado es específicos del sistema, por el que los resultados de los modelos de piel diferentes sólo se pueden comparar cuando se utiliza la inserción de la membrana misma. Además, el modelo de la piel necesita cubrir el área de cultivo todo para asegurar que la sustancia de ensayo se impregnan sólo a través del modelo y no adyacente a él, que induciría a errores en la permeabilidad medida. Otro aspecto que debe considerarse en el futuro los experimentos es el entorno natural que rodea la piel. Normalmente, la temperatura de la superficie de la piel es menor en comparación con la región interna, que puede influir en las condiciones de permeabilidad.
Con el fin de alinear los experimentos de laboratorio con simulaciones de computadora, se presentó un método que permite la optimización de parámetros para la simulación aplicada. Simulaciones fueron encontradas que coinciden con los datos experimentales para las sustancias con tamaño molecular pequeño. Sin embargo, se observaron desviaciones entre los datos experimentales y simulación para las sustancias con mayor tamaño molecular. Las moléculas grandes de polisacáridos pueden aumentan la fricción y ralentizar el proceso de difusión en gel. Este efecto causa difusión anormal, que es una razón posible de la desviación entre experimental y simulación valores33,34. Otra explicación podría ser la presencia de partículas más pequeñas o más grandes en dextrano de isotiocianato de fluoresceína. El fabricante especifica el peso molecular de la sustancia como la talla media con un rango determinado, que permite que las partículas más pequeñas y más grandes estar presente. Tampoco está claro cómo de dispersos están estas sustancias, como las partículas más pequeñas se impregnan más rápido por el gel y el canal fluido. Es posible extender la simulación para considerar estos efectos de fricción y difusión.
El experimento de permeabilidad y simulación fueron desarrollados para su uso en un OC de 2. Con la ayuda de la simulación, este método experimental puede ser transferido directamente a configuraciones experimentales más sofisticadas. Por ejemplo, la simulación de sistemas de inserción de membrana puede ser fácilmente transferida a la geometría de una 2-OC o a otros sistemas con configuraciones similares. Esta opción de la modulación de la simulación puede utilizarse para apoyar el diseño de experimentos futuros. Además, efectos secundarios tales como evaporación, difusión anormal y los efectos de la membrana puede ser integrados para mejorar la simulación, mejorando exactitud. El programa de simulación da la oportunidad de cambiar o mejorar la ecuación de la simulación, así como para integrar otros módulos físicos con el fin de investigar otros aspectos del desarrollo del modelo de la piel. Un ejemplo es la simulación de producción consumo y lactato de la glucosa en un modelo de celular de colágeno.
Un aspecto particularmente interesante en las pruebas de sustancias médicas es cómo se distribuyen las sustancias en un sistema de órganos-en-un-chip. El parámetro de simulación y permeabilidad mi ayuda para responder a preguntas como qué tan rápido una sustancia penetra en el sistema y que la concentración estará disponible para otros tejidos en un multi multi-órgano chip. Este método puede apoyar y mejorar el desarrollo y prueba de tales sistemas de órgano en el chip.
Divulgaciones
Uwe Marx es el CEO y accionista y Gerd Lindner es accionista de TissUse GmbH, una empresa de fabricación y comercialización de la tecnología MOC. Otros autores no declaran ningún conflicto de intereses con respecto a la publicación de este documento.
Agradecimientos
Esta obra fue creada con el apoyo financiero de la Deutsche Forschungsgemeinschaft (DFG) bajo concesión. PO413/12-1 y LA 1028/7-1.
Materiales
| Name | Company | Catalog Number | Comments |
| Agarose | Carl Roth | K297.2 | High Resolution Powder |
| Collagen | Serva | 47256.01 | Collagen R solution 0.4 % |
| DMEM | Lonza (Biozym Scientific GmbH) | 880010-12 | High Glucose with L-Glutamine |
| FCS | Biochrom GmbH | S0615 0114F | Fetal Calf Serum |
| Fluorescein Sodium Salt | Sigma-Aldrich | 46960-25G-F | |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | 46944-500MG | 4000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD10S-250MG | 10 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD20S-250MG | 20 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD40S-250MG | 40 000 g/mol |
| HBSS | ThermoFisher Scientific | 14170120 | no calcium, no magnesium , with phenol red |
| NaOH | Merck | 1.06467.9010 | granulated |
| PBS | Gibco | 18912-014 | tablets |
| Transwell Cell Culture Inserts | Corning | 3391 | 96 well, 0.4 µm pore size |
| Transwell Cell Culture Inserts | Corning (VWR) | 734-1563 | 12 well, 0.4 µm pore size |
| Trypsin | Biochrom GmbH | L2143 | with EDTA |
Referencias
- Marx, U., et al. Human-on-a-chip developments: a translational cutting-edge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man?. ATLA. 40 (5), 235-257 (2012).
- Maschmeyer, I., et al. Chip-based human liver-intestine and liver-skin co-cultures - A first step toward systemic repeated dose substance testing in vitro. Eur J Pharm Biopharm. 95, 77-87 (2015).
- Prunieras, M., Regnier, M., Woodley, D. Methods for Cultivation of Keratinocytes with an Air-Liquid Interface. J Invest Dermatol. 81 (1), 28-33 (1983).
- Cannon, C. L., et al. New epidermal model for dermal irritancy testing. Toxicol In Vitro. 8 (4), 889-891 (1994).
- Ackermann, K., et al. The Phenion Full-Thickness Skin Model for Percutaneous Absorption Testing. Skin Pharmacol Physiol. 23 (2), 105-112 (2010).
- Netzlaff, F., et al. Permeability of the reconstructed human epidermis model Episkin in comparison to various human skin preparations. Eur J Pharm Biopharm. 66 (1), 127-134 (2007).
- Bran, B., et al. A New Discriminative Criterion for the Development of Franz Diffusion Tests for Transdermal Pharmaceuticals. J Pharm Sci. 13 (2), 218-230 (2010).
- Pineau, A., et al. In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz diffusion cell. J Inorg Biochem. 110, 21-26 (2012).
- Filon, F. L., et al. In vitro percutaneous absorption of cobalt. Int Arch Occup Environ Health. 77 (2), 85-89 (2004).
- Ng, S. -. F., et al. Validation of a Static Franz Diffusion Cell System for In Vitro Permeation Studies. AAPS PharmSciTech. 11 (3), 1432-1441 (2010).
- Bonferoni, M. C., et al. A Modified Franz Diffusion Cell for Simultaneous Assessment of Drug Release and Washability of Mucoadhesive Gels. Pharm Dev Tecnol. 4 (1), 45-53 (1999).
- Seiffer, S., Oppermann, W. Systematic evaluation of FRAP experiments performed in a confocal laser scanning microscope. J Microsc. 220 (1), 20-30 (2005).
- Pluen, A., et al. Diffusion of Macromolecules in Agarose Gels: Comparison of Linear and Globular Configurations. Biophys J. 77, 542-552 (1999).
- Cornelissen, L. H., et al. Diffusion measurements in epidermal tissues with fluorescent recovery after photobleaching. Skin Res Technol. 14 (4), 462-467 (2008).
- Pirot, F., et al. Characterization of the permeability barrier of human skin in vivo. PNAS. 94 (4), 1562-1567 (1997).
- Tetteh, J., et al. Local examination of skin diffusion using FTIR spectroscopic imaging and multivariate target factor analysis. Anal Chim Acta. 642 (1-2), 246-256 (2009).
- Guldbrand, S., et al. Two-photon fluorescence correlation spectroscopy as a tool for measuring molecular diffusion within human skin. Eur J Pharm Biopharm. 84 (2), 430-436 (2013).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Rech. 291 (11), 600-605 (1999).
- Veronike, M., et al. Epidermal Organization and Differentiation of HaCaT Keratinocytes in Organotypic Coculture with Human Dermal Fibroblasts. J Invest Dermatol. 112 (3), 343-353 (1999).
- Moraes, C., et al. Organs-on-a-chip: a focus on compartmentalized microdevices. Ann Biomed Eng. 40 (6), 1211-1227 (2012).
- Huh, D., et al. From Three-Dimensional Cell Culture to Organs-on-Chips. Trends Cell Biol. 21 (12), 745-754 (2011).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab Chip. 13 (18), 3588 (2013).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), (2015).
- Materne, E. -. M., et al. A multi-organ chip co-culture of neurospheres and liver equivalents for long-term substance testing. J Biotechnology. 205, 36-46 (2015).
- Materne, E. -. M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing - organotypicalness versus cost-efficient high throughput. Lab Chip. 13 (18), 3481 (2013).
- Jayakrishna, A., et al. Diffusion of High Molecular Weight Compounds through Sclera. IOVS. 41 (5), 1181-1185 (2000).
- Peck, K., et al. Hindered Diffusion of Polar Molecules Through and Effective Pore Radii Estimate of Intact and Ethanol. Pharm Res. 11 (9), 1309-1314 (1994).
- Ogiso, T., et al. Mechanism of the Enhancement Effect of n-Octyl-β-D-thioglucoside on the Transdermal Penetration of Fluorescein Isothiocyanate-Labeled Dextrans and the Molecular Weight Dependence of Water-Soluble Penetrants through Stripped Skin. J Pharm Sci. 83 (12), 1676-1681 (1994).
- Hadgraft, J. Skin, the final frontier. Int J Pharm. 224 (1-2), 1-18 (2001).
- Asselineau, D., et al. Human Epidermis Reconstructed by Culture: Is It "Normal"?. J Invest Dermatol. 86 (2), 181-186 (1986).
- Casasco, A., et al. Cell proliferation and differentiation in a model of human skin equivalent. Anat Rec. 264 (3), 261-272 (2001).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Res. 291 (11), 600-605 (1999).
- Laurent, T. C., et al. Diffusion of Dextran in Concentrated Solutions. Eur J Biochem. 68, 95-102 (1976).
- Metzler, R., Klafter, J. The random walk's guide to anomalous diffusion: A fractional dynamics approach. Phys Rep. 339 (1), 1-77 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados